Микробиология, 2021, T. 90, № 6, стр. 627-659
Микробная деградация пластика и пути ее интенсификации
И. Б. Котова a, Ю. В. Тактарова a, Е. А. Цавкелова a, М. А. Егорова a, И. А. Бубнов a, Д. В. Малахова a, Л. И. Ширинкина a, Т. Г. Соколова b, Е. А. Бонч-Осмоловская a, b, *
a Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
117312 Москва, Россия
* E-mail: elizaveta.bo@gmail.com
Поступила в редакцию 01.08.2021
После доработки 02.08.2021
Принята к публикации 02.08.2021
Аннотация
Синтетические пластмассы, или пластики, во всем мире производятся в возрастающих количествах, и одновременно растет количество пластиковых отходов, которые неизбежно загрязняют окружающую среду. Процесс микробного разложения пластиков идет очень медленно, однако способность к нему найдена у многих бактерий, в том числе у симбионтов беспозвоночных, и микроскопических грибов. Наибольшее количество исследований посвящено микробному разложению полиэтилена, полистирола и полиэтилентерефталата (ПЭТ). Имеется арсенал разнообразных методов детекции процессов деградации пластиков и определения их скорости. Тем не менее, из-за отсутствия единых протоколов сравнение результатов различных авторов затруднено. Наиболее эффективным из известных в настоящее время процессов деградации пластиков является разложение ПЭТ с помощью рекомбинантных гидролаз из термофильных актинобактерий. В обзоре рассматриваются также различные способы ускорения процессов разложения пластиков.
Синтетические пластмассы, или пластики, используются в самых различных областях человеческой деятельности, и представить себе современный мир, лишенный пластиков, трудно или даже невозможно. Одним из важнейших свойств пластиков является их высокая устойчивость к воздействиям окружающей среды, в том числе к биоразложению. Но это же их свойство породило одну из центральных проблем современности: на планете скапливаются огромные количества пластиковых отходов.
В связи с простотой производства и повсеместностью применения глобальное производство пластиков неуклонно растет, что, соответственно, ведет к росту пластикового загрязнения Земли (Geyer et al., 2017; Плакунов и соавт., 2020; Lau et al., 2020). Весомый вклад в этот процесс вносит растущее применение предметов одноразового использования. В 2015 г. годовое производство пластиков возросло до 350 млн тонн по сравнению с 2 млн тонн в 1950 г. (Geyer et al., 2017); в 2019 г. оно составило уже 368 млн тонн (Plastics Europe, 2021). Суммарно за период с 1950 по 2015 годы продукция пластиков и используемых при их производстве добавок составила 8300 млн тонн.
При сохранении существующих тенденций увеличения производства пластиков ожидается образование 33 млрд тонн пластиковых отходов к 2050 г., большая часть которых попадет на полигоны твердых бытовых отходов или просто в окружающую среду, в почву, атмосферу, водные системы, загрязняя озера, реки, моря и океаны (Rochman et al., 2013). По некоторым оценкам около 8 млн тонн макропластика и 1.5 млн тонн первичного микропластика ежегодно поступают в океан (Jambeck et al., 2015; Boucher, Friot, 2017). При сохранении существующих тенденций совокупная масса пластика океана может к 2025 г. увеличиться на порядок по сравнению с уровнем 2010 г. (Jambeck et al., 2015). Доля микропластика, поступавшего в наземные места обитания с 2012 по 2017 гг., многократно превышала его поступление в океан (Horton et al., 2017).
В глобальной продукции пластиков, за исключением синтетических нитей, производимых из полиэстера, полиамида и акрила, наибольшую долю составляют полиэтилены (36%), чуть меньшую – полипропилен (21%) и поливинилхлорид (12%), равные доли составляют полиэтилентерефталат, полиуретан и полистирол (10% каждый) (Geyer et al., 2017). При этом в отходах доля пластиков, из которых изготавливают упаковочные материалы, возрастает (Geyer et al., 2017).
Пластмассы оказывают вредное воздействие на окружающую среду, прежде всего физически разрушая среду обитания (Sheavly, Register, 2007). Пластиковое загрязнение губительно влияет на животных и человека (Schmaltz et al., 2020). Присутствие пластиковых материалов в морях приводит к запутыванию в них морских животных (Gall, Thompson, 2015; Kühn et al., 2015; Lusher et al., 2018), переносу инвазивных видов (Kiessling et al., 2015), которые внедряются в пищевые цепи и нарушают питание морских животных (Laist, 1987; de Stephanis et al., 2013; Gall, Thompson, 2015; Brandon et al., 2019). Пластики могут служить эффективными системами доставки токсичных загрязнителей, которые являются известными репродуктивными токсинами, канцерогенами и мутагенами (Wright, Kelly, 2017; Schmaltz et al., 2020), содержащихся в них или адсорбированных из окружающей среды (Gallo et al., 2018). Это представляет потенциальную опасность и для здоровья человека, потому что люди потребляют с пищей и напитками, по разным оценкам, от 39 000 до 52 000 частиц микропластика в год (Schmaltz et al., 2020).
Существующие в настоящее время уровень поступления пластиков в отходы и их распределение вносят значительный вклад в усиление парникового эффекта. При сохранении существующих трендов к 2050 г. эмиссия парниковых газов из пластиков составит 15% по углероду от глобального количества парниковых газов (Zheng, Suh, 2019).
В настоящее время пластиковые отходы могут быть термически разрушены, отправлены на полигоны для отходов, оставлены в естественной среде или переработаны с получением вторичного пластика (Peng et al., 2018; Ru et al., 2020). Вторичная переработка задерживает окончательную утилизацию пластиков, но, в конечном итоге, не позволяет ее избежать. Несмотря на появление новых технологий, таких как пиролиз, преобразующий пластиковые отходы в топливо, на сегодняшний день практически все тепловые разрушения пластиков происходят путем сжигания, с получением энергии или без него (Lau et al., 2020; Ru et al., 2020).
Микроорганизмы, проявляя значительную пластичность метаболизма, обладают способностью разлагать многие химические соединения, в том числе некоторые пластики. Исследование таких микроорганизмов, их метаболизма и ферментного аппарата, а также интенсификация целевых процессов с помощью различных методов и подходов могут послужить основой для создания биотехнологии переработки пластиковых отходов, которая позволит решить комплекс экологических проблем, связанных с пластиковым загрязнением.
Настоящий обзор посвящен разнообразию микроорганизмов, разлагающих наиболее широко применяемые пластики, имеющихся у них ферментативных механизмах, и возможности интенсификации столь важного для нашей планеты процесса разложения пластиковых отходов.
ОБЩИЕ СВЕДЕНИЯ О ПЛАСТИКАХ
В настоящее время 80% применяемых пластмасс ‒ материалы на основе термопластичных полимеров, так называемых термопластов или термопластиков, состояние которых обратимо меняется с твердого на вязкое с повышением температуры. На основе примерно 10–15 разновидностей промышленных полимеров производится более 4000 марок конструкционных термопластиков (Мельникова, 2013). В рамках этого обзора мы собираемся рассмотреть характеристики пяти видов термопластиков, на которые приходится основная часть производства: полиэтилена, полипропилена, поливинилхлорида, полиэтилентерефталата и полистирола. Их основные свойства представлены в табл. 1.
Таблица 1.
Характеристики основных видов пластиков
| Пластик | Структурная формула | Способ изготовления | Молекулярная масса, Да | Т плавления, °C | Т стеклования, °C | Степень кристалличности, % | Область применения |
|---|---|---|---|---|---|---|---|
| Полиэтилен
низкой
плотности (ПЭНП) |
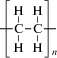 |
Полимеризация этилена при давлении 100‒288 МПа | 80 000‒500 000 | 103‒110 | ‒50‒120 | 50‒60 | Упаковочные материалы, пленка, тара; трубы для канализации, дренажа, водо- и газоснабжения; электроизоляционный материал; термоклей; корпуса для лодок, вездеходов, деталей технической аппаратуры, предметов домашнего обихода; термоизоляция; полигоны переработки отходов, накопители жидких и твердых веществ, способных загрязнять почву и грунтовые воды (ПЭВП) |
| Полиэтилен высокой плотности (ПЭВП) | 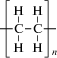 |
Полимеризация этилена при давлении 0.1‒0.495 МПа | 80 000‒300 000 | 130‒137 | ‒50‒120 | 75‒85 | |
| Полипропилен (ПП) изотактический | 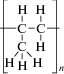 |
Полимеризация пропилена | 300 000‒700 000 | 172 | ‒10 | 73‒75 | Упаковочные материалы, пленки, волокна, тара, трубы, детали технической аппаратуры, пластиковая посуда, предметы домашнего обихода, нетканые материалы электро-, вибро- и шумоизоляция, строительный клей, замазки, уплотняющие мастики, дорожные покрытия, липкие ленты, лабораторное оборудование (наконечники для пипеток и центрифужные пробирки) |
| Поливинил- хлорид | 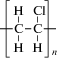 |
Полимеризация винилхлорида | 9000‒170 000 | 150‒220 | 75‒80 | <10 | Электроизоляция проводов и кабелей, строительные материалы (листы, трубы, оконные рамы, плeнки для натяжных потолков, линолеум), искусственная кожа, обувные пластикаты, мебельная кромка, моющеся обои, “виниловые” грампластинки |
| Полиэтилен-
терефталат (ПЭТ) |
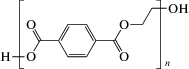 |
Поликонденсация этиленгликоля с терефталевой кислотой или переэтерификация диметилтерефталата и этиленгликоля | 15 000‒20 000 | 260 | 69‒70 | 2.1‒65 | Волокно, в том числе для одежных тканей, материал для армирования автомобильных шин и других резинотехнических изделий, тара для напитков и пищевых продуктов, прозрачный строительный материал |
| Полистирол (ПС) |
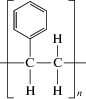 |
Полимеризация стирола (винилбензола) в среде бензола | 50 000‒300 000 | 240 | 100 | 30‒35 | Одноразовая посуда, детские игрушки, строительные материалы, медицинcкие инструменты, чашки Петри |
Около 90% объема производства термопластов составляют материалы на основе полиолефинов (полиэтилены, полипропилен), полистиролы, поливинилхлориды; они выдерживают постоянные внешние напряжения до 10–15 МПа и температуры до 80 ± 20°С. Около 9% объема производства составляют материалы на основе полиэтилентерефталата, полиамидов, поликарбоната, полиформальдегида и др. Более прочные и термостойкие, они выдерживают разрушающее напряжение до 140 ± 20 МПа и температуры до 150°С (Мельникова, 2013).
Мономером полиэтилена (ПЭ) является этилен. В зависимости от метода получения производят несколько типов полиэтилена: полиэтилен низкой плотности (ПЭНП), полиэтилен высокой плотности (ПЭВП), сверхвысокомолекулярный полиэтилен (СВМПЭ). ПЭНП отличается сильно разветвленными цепями со степенью полимеризации ~50 000, плотностью 910‒935 кг/м3 и степенью кристалличности 50‒60%. ПЭВП представляет собой плотный полимер, молекулы которого линейны и степень полимеризации составляет до 300 000, с плотностью 930‒970 кг/м3 и степенью кристалличности 70‒85% (Галыгин и соавт., 2012). Основной причиной, вызывающей различия в свойствах ПЭНП и ПЭВП, является разветвленность макромолекул: чем больше разветвлений в цепи, тем выше эластичность и меньше кристалличность полимера. Полиэтилены как низкой (ПЭНП), так и высокой плотности (ПЭВП) широко используются и востребованы практически на всех промышленных, сельскохозяйственных или бытовых рынках, главным образом, для упаковки товаров. Доля СВМПЭ в общей продукции чрезвычайно мала, но он заслуживает упоминания как весьма интересный материал, находящий все большее применение. СВМПЭ получают на металлоорганических катализаторах, его молекулярная масса более от 1.5 до 8 млн Да. Он обладает исключительной прочностью, морозостойкостью, физиологически инертен: применяется для изготовления высокопрочных технических изделий, таких как броня. СВМПЭ применяется в эндопротезировании; он также обладает исключительно низким коэффициентом трения и используется для производства искусственных “ледовых” покрытий (Захаров и соавт., 2009; Кудряшовa, 2020) .
Полипропилен (ПП) также относится к полиолефинам, то есть линейным углеводородам c общей формулой CnH2n. Это высокомолекулярный продукт полимеризации пропилена при низком и среднем давлении 0.3–10 МПа и температуре 80°С на стереоспецифических катализаторах Циглера‒Натта. В промышленности для производства пропилена используют продукты переработки нефти, а также природные углеводородные газы. В зависимости от способа полимеризации образуются полимеры разного стереоизомерного состава. Изотактический и синдиотактический полимеры имеют регулярно построенные цепи, располагающиеся вдоль спирали, а для атактического пластика характерна структура со стерически нерегулярной последовательностью метильных групп (Arutchelvi et al., 2008). Полипропилен – менее плотный и более твердый, чем полиэтилен, пластик, широко использующийся для производства упаковочных материалов, разнообразных товаров широкого потребления, нетканых материалов (в том числе медицинских масок), лабораторного оборудования (наконечников для пипеток и микроцентрифужных пробирок).
Поливинилхлорид (ПВХ) получают путем полимеризации винилхлорида; ему свойственна высокая химическая стойкость (устойчивость при воздействии щелочей, многих кислот и органических растворителей). Этот полимер состоит из линейных или малоразветвленных макромолекул. При низкой морозостойкости (‒15°С) ПВХ является хорошим диэлектриком и находит широкое применение при изготовлении кабелей и изоляционных материалов; его используют также в производстве труб, линолеума, оконных рам, натяжных потолков и многого другого. ПВХ непосредственно для изготовления изделий не используется. Изделия изготавливают из композиционных материалов на его основе: винипласта и пластиката. Они содержат термостабилизаторы, смазки, пигменты или красители, минеральные наполнители, эластомер; пластикат к тому же содержит 30–90 массовых частей пластификатора (например, эфиров фталевой, фосфорной, себациновой или адипиновой кислот). Эти материалы используются для изготовления химической аппаратуры и коммуникаций, вентиляционных воздуховодов, труб, строительных деталей. Из прозрачного винипласта изготовляют объемную тару для пищевых продуктов, бутылки и др. Пластикат используют для изготовления изоляции и оболочек для электропроводов и кабелей, для производства шлангов, линолеума и плиток для полов, материалов для облицовки стен и обивки мебели, искусственной кожи. Прозрачные гибкие трубки из пластиката применяют в системах переливания крови и жизнеобеспечения в медицинской технике (Мельникова, 2013).
Полиэтилентерефталат (ПЭТ) представляет собой cложный эфир – продукт поликонденсации этиленгликоля с терефталевой кислотой или переэтерификации диметилтерефталата и этиленгликоля. Структура ПЭТ состоит из линейных алифатических и ароматических фрагментов. Такое чередование кристаллических и аморфных участков обеспечивает основные свойства ПЭТ: твердость и ударопрочность, прозрачность, крайне низкую газопроницаемость, водопоглощение и пластичность в холодном и нагретом состояниях (Шевлик и соавт., 2016). ПЭТ устойчив в диапазоне температур от ‒40 до 60°С, отличается низким коэффициентом трения и низкой гигроскопичностью. Разлагается под действием УФ-излучения (Мельникова, 2013). Основным промышленным способом получения ПЭТ является использование нефтехимических продуктов. Высокая прочность и износостойкость ПЭТ объясняются высоким содержанием ароматических терефталатных звеньев, которые ограничивают подвижность полимерных цепей (Marten et al., 2005). ПЭТ широко используется для производства тары для жидкостей и других продуктов широкого пользования, волокон и тканей (одежда).
Полистирол (ПС) – это синтетический полимер, состоящий из молекул ароматического углеводорода стирола. Химическая формула полистирола (C8H8)n; из химических элементов он включает только углерод и водород. Степень полимеризации промышленно выпускаемых полистиролов n = 600‒2500. Фенильные группы препятствуют упорядоченному расположению макромолекул и формированию кристаллических образований. Полистирол является гомополимером с молекулярной массой 100 000–400 000 г/моль. Его трудно деполимеризовать, так как вновь образованная σ‑связь “углерод‒углерод” прочнее, чем π-связь винильной группы. На свойства пластика влияет характер расположения фенильных групп относительно зигзагообразной углеродной цепи. Полистирол ‒ жесткий хрупкий аморфный полимер с высокой степенью оптического светопропускания и невысокой механической прочностью. Полистирол имеет низкую плотность (1060 кг/м3), отличные диэлектрические свойства и хорошую морозостойкость (до −40°C). Стандартный коммерческий полистирол является атактическим, в котором фенильные группы случайным образом расположены по обеим сторонам полимерной цепи. Такое случайное расположение предотвращает образование кристаллических участков, и полимер является аморфным с температурой стеклования Tg около 90°C. Из полистирола изготавливают одноразовую посуду, упаковки, одноразовое лабораторное оборудование (чашки Петри), медицинские инструменты и стройматериалы.
Таким образом, все перечисленные пластики широко используются в самых различных областях деятельности человека. Несмотря на разные строение и структуру, их объединяет общее свойство: устойчивость к внешним воздействиям, в том числе и к биологическим факторам. Тем не менее, сейчас достоверно известно, что достаточно большое количество микроорганизмов способно разрушать пластики, используя их компоненты в качестве энергетических субстратов и источника углерода. Однако нерастворимость субстратов, крайне низкая скорость процессов, нестандартизированный состав пластиков, различная форма образцов заставляет исследователей использовать разнообразные методы детекции и количественной оценки процесса микробной деструкции пластиков.
МЕТОДЫ ИССЛЕДОВАНИЯ МИКРОБНОГО РАЗЛОЖЕНИЯ ПЛАСТИКОВ
Все рассматриваемые в этом обзоре наиболее широко используемые пластики нерастворимы в воде. Взаимодействие микроорганизмов с субстратом происходит на границе раздела фаз, и поэтому их биодеградации предшествует образование биопленок. Роль биопленок в разложении биопластиков подробно рассмотрена в недавнем обзоре В.К. Плакунова и соавт. (2020). Также ряд работ посвящен анализу микробного состава биопленок, образующихся на поверхности образцов различных видов пластика при инкубации их в природных местообитаниях. Так, например, был проанализирован состав биопленок, развивавшихся на образцах ПС во время их инкубации в воде Черного моря и оборотной воде нефтехимического производства в течение 60 сут, и выявлена его специфичность к материалу образцов (Турова и соавт., 2020). Одновременно было отмечено изменение состояния ПС (Лаптев и др., 2019).
Существует два принципиально разных подхода к исследованию процесса разложения пластика микроорганизмами: 1) тестирование чистых культур на способность к разложению пластика; 2) инкубация образцов пластика в присутствии природных проб или непосредственно в природных местообитаниях – почве, компосте, мусорных полигонах, воде или осадках водоемов. В последнем случае упор делается на естественный отбор штаммов, обладающих искомыми активностями.
Собственно процесс биодеградации пластиков предлагается разделить на четыре этапа (Sharma, 2018; Montazer et al., 2019):
1) биодетериорацию, состоящую в изменении свойств полимера и облегчающую его дальнейшее разложение;
2) биофрагментацию, которая приводит к гидролизу и фрагментации углеродных цепей полимера, а также к выделению промежуточных продуктов разложения;
3) биоассимиляцию, при которой мелкие углеводородные фрагменты-метаболиты метаболизируются клетками и включаются в биомассу микроорганизмов;
4) минерализацию, которая сопровождает полное разрушение пластика до СО2 и воды.
Для каждого из этапов существует набор методов, позволяющих достоверно зарегистрировать происходящие с пластиком изменения. Основные методы детекции микробной биодеградации пластиков представлены в табл. 2.
Таблица 2.
Основные методы детекции микробной биодеградации пластиков
| Анализируемый параметр | Метод | Признаки биодеградации пластика | Ссылки |
|---|---|---|---|
| Характер поверхности пластика | Сканирующая электронная микроскопия (СЭМ), атомно-силовая микроскопия (АСМ) | Изменение структуры поверхности – образование микротрещин, отверстий, перепадов высоты рельефа | Muhonja et al., 2018; Skariyachan et al., 2018; Sarmah, Rout, 2018; Delacuvellerie et al., 2019; Park, Kim, 2019; etc. |
| Предел прочности при растяжении (Tensile strength, TS) и удлинение при разрыве (EAB, extension at break) | Тензиометрия | Снижение TS и EAB (при деградации ПЭНП) | Skariyachan et al., 2016 |
| Температура стеклования (перехода в “стекловидное” состояние) | Дифференциальная сканирующая калориметрия (DSC) | Снижение температуры стеклования | Lucas et al., 2008; Park, Kim, 2019 |
| Измерение степени кристалличности | Инфракрасная спектроскопия с преобразованием Фурье (FTIR) | Степень кристалличности повышается при биодеградации за счет “выедания” аморфной части ПЭ | Sen, Raut, 2015; Das, Kumar, 2015 |
| Гидрофобность | Измерение контактного угла, BATH-тест | Уменьшение угла (увеличение гидрофильности) | Koutny et al., 2006; Das, Kumar, 2015 |
| Остаточная масса полимера | Гравиметрия (взвешивание) | Снижение массы пластика | Sarmah, Rout, 2018; ; Mohan Rasu et al., 2018; Skariyachan et al., 2018; Park, Delacuvellerie et al., 2019; Kim, 2019 |
| Химический состав | Инфракрасная спектроскопия с преобразованием Фурье (FTIR) | Увеличение карбонильного индекса, образование интермедиатов с дополнительными функциональными группами (карбонильными/карбоксильными), алканов; появление новых пиков, соответствующих карбонильным и простым эфирным связям | Muhonja et al., 2018; Skariyachan et al., 2018; Park, Kim, 2019; Sarmah, Rout, 2018; Delacuvellerie et al., 2019 |
| Молекулярный вес | Ядерный магнитный резонанс (NMR, ЯМР), газовая хроматография/ масс-спектрометрия (GC-MS, ГХ-МС), гель-проникающая хроматография (GPC, ГПХ) | Снижение средней молекулярной массы | Sarmah, Rout, 2018; Muhonja et al., 2018; Skariyachan et al., 2018; Park, Kim, 2019; Yamada-Onodera et al., 2001 |
| Увеличение микробной биомассы | Анализ содержания белка (биомассы) | Увеличение количества микробного белка в присутствии полимера | Sarmah, Rout, 2018 |
Первичную информацию об изменениях, происходящих на поверхности пластика, можно получить с помощью различных видов микроскопии. Наиболее часто используется сканирующая электронная микроскопия (СЭМ) отмытых от клеток образцов, в сравнении с контрольными образцами, инкубировавшимися в отсутствие микроорганизмов. Может быть использована атомно-силовая микроскопия и другие подходы, позволяющие изучить поверхность полимера. Используются и другие методы, позволяющие определить изменения в структуре пластика, например, проверка образцов пластика, инкубированных в присутствии микробных культур, на изменение его механических свойств (прочность на разрыв, удлинение при разрыве, модуль упругости и предел текучести).
Биофрагментация регистрируется по уменьшению средней молекулярной массы углеродных цепей полимера (Mn) и расширению молекулярно-массового распределения, определяемых с помощью гель-проникающей хроматографии, а также путем регистрации промежуточных продуктов разложения пластика, для чего используются спектрофотометрия, ГХ-МС, ВЭЖХ, ИК-спектроскопия с преобразованием Фурье и ядерный магнитный резонанс. В частности, ИК-спектроскопия (FTIR, Fourier-transform infrared spectroscopy) позволяет получить данные о содержании в образце различных связей между атомами, таких как С‒С, С‒Cl, С‒О, С=О и т.д. Изменение спектра может свидетельствовать о процессах окисления, дехлорирования (в случае ПВХ), разрушения цепей полимера. Термогравиметрический анализ позволяет оценить термостабильность пластика, которая теоретически будет снижаться при уменьшении и разрыве цепей полимера, но увеличиваться при разрушении или вымывании пластификаторов.
На этом и последующих этапах используется также наиболее прямой метод определения разложения пластика микроорганизмами – гравиметрический, для чего образцы пластика должны быть тщательно отмыты от ассоциированных с ними клеток.
Для некоторых пластиков, например, для ПЭТ, может быть использован ряд спектрофотометрических методов, основанных на обнаружении изменения оптической плотности культуральной жидкости, как напрямую, вследствие образования соединений, поглощающих свет, так и с применением индикатора, реагирующего на изменения pH (Pirillo et al., 2021).
Биоассимиляция пластика определяется по увеличению выхода биомассы клеток в культуре, растущей в присутствии пластика, например, по определению количества образовавшегося клеточного белка в сравнении с контролем.
Наконец, минерализация пластика определяется по количеству образовавшегося СО2 или, в случае анаэробного процесса, продуктов терминальных восстановительных реакций ‒ СН4, H2S, восстановленных соединений азота и пр.
В качестве вспомогательного метода, позволяющего провести скрининг изолятов, можно использовать тест на чашке с агаром, в котором полимер диспергируется в виде взвеси очень мелких частиц (порошка). Вокруг колонии микроорганизма, разрушающего пластик, образуется зона просветления.
Наконец, высокоточным методом является использование пластиков, меченых 14С-радиоактивными изотопами (Silelicki et al., 1978), и определение метки в образовавшихся продуктах ‒ 14CO2 или 14CH4. На этот метод не влияет присутствие биоразлагаемых примесей или добавок в полимере, однако его применение ограничивается сложностью проведения и стоимостью синтеза радиоактивно меченых полимеров.
Как правило, исследователи используют комплекс методов (Müller, 2005; Lucas et al., 2008; Ru et al., 2020), позволяющих зафиксировать изменения полимера, состояние микробной культуры, образование промежуточных или конечных продуктов разложения пластика.
ПРИМЕРЫ БИОДЕГРАДАЦИИ ПЛАСТИКОВ МИКРООРГАНИЗМАМИ
Несмотря на трудоемкость исследований и сложность получения достоверных результатов, в последние два десятилетия появилось большое количество экспериментальных работ, демонстрирующих микробную деградацию пластиков с помощью перечисленных в предыдущем разделе методов. Здесь мы приведем лишь некоторые из них.
Так, биодеградация полиэтилена микроорганизмами была описана в ряде работ, опубликованных за последние 30 лет, и сейчас является одной из основных тем исследований в области разложения пластиков (Shah et al., 2008; Ammala et al., 2011; Sen, Raut 2015; Harrison et al., 2018); общепризнанным является тот факт, что процесс биодеградации в нормальных условиях протекает чрезвычайно медленно. Известно, что ПЭ, имеющий простую линейную структуру, чрезвычайно устойчив к биоразложению. Низкая скорость биоразложения ПЭ связана также с его высокой гидрофобностью (в состав молекул входят только ‒CH2 группы) и высокой молекулярной массой (более 30 кДа), что препятствует его транспорту непосредственно в клетки (Orr et al., 2004; Sivan et al., 2006). Было показано, что в случае, когда ПЭ был единственным источником энергии для микроорганизмов, фрагменты меньшего размера использовались быстрее, чем более крупные (Kawai et al., 2004). Также сообщалось, что для достижения значимой степени биоразложения за разумный период времени средняя молекулярная масса полиэтилена должна быть ниже 5000 Да (Reddy et al., 2009). Разветвленная структура делает цепи ПЭНП более доступными, а третичные атомы углерода в местах разветвления ‒ более уязвимыми для атаки. Молярная масса ПЭВП намного выше, что, возможно, затрудняет доступ микроорганизмов и их ферментов к полимерным цепям (Sudhakar et al., 2008; Fontanella et al., 2010). Показано, что структурные вариации полиэтиленовых полимеров, образующиеся во время полимеризации и последующей обработки, такие как ненасыщенные двойные углерод-углеродные связи, карбонильные группы и гидропероксидные группы (Ojeda et al., 2011), первыми потребляются бактериями, что приводит к быстрому росту микроорганизмов. Если для первых двух этапов, биоразрушения (биодетериорации) и биофрагментации ПЭ, было приведено достаточно фактов и доказательств их именно микробного происхождения (Albertsson, Karlsson, 1990; Ammala et al., 2011), то доказательства биоассимиляции и полной минерализации ПЭ весьма немногочисленны (Yang et al., 2014; Sen, Raut, 2016; Montazer et al., 2019).
В табл. 3 приведены примеры исследования разложения ПЭ, представленные в различных публикациях. Из-за большого разнообразия используемых полиэтиленовых материалов и широкого диапазона условий культивирования сравнение различных результатов биодеградации зачастую весьма затруднено. Это подчеркивает необходимость стандартизированных методов и протоколов для систематического изучения биоразложения синтетических пластмасс, как это было предложено Montazer и соавт. (Montazer et al., 2020).
Таблица 3.
Разложение ПЭ бактериями
| Род и вид | Источник | Время инкубации | Условия эксперимента | Результат биодеградации | Ссылка |
|---|---|---|---|---|---|
| Phormidium lucidum, Oscillatoria subbrevis | Бытовые сточные воды | 42 сут | Пленка ПЭНП без обработки | Потеря веса 30% | Sarmah, Rout, 2018 |
| Acinetobacter baumannii | Городская свалка | 30 сут | 37°C, ПЭ без обработки | Образование биомассы | Pramila, Ramesh, 2015 |
| Achromobacter xylosoxidans | Почва с мусорных полигонов | 50 сут | 27°C, пленка ПЭВП | Потеря веса 9% | Kowalczyk et al., 2016 |
| Alcanivorax borkumensis | Средиземное море | 80 сут | Пленка ПЭВП | Потеря веса 3.5% | Delacuvellerie et al., 2019 |
| Aneurinibacillus sp., Brevibacillus spp. |
Мусорные полигоны и очистные сооружения | 140 сут | 50°C, полоски и гранулы ПЭВП H | ПЭНП, ПЭВП полоски: 58.21 и 46.6% ПЭНП, ПЭВП гранулы: 45.7 и 37.2% |
Skariyachan et al., 2018 |
| Bacillus cereus | Мусорная свалка (Африка) | 16 нед. | 37°C, пленки из ПЭНП | Потеря веса 35.72% | Muhonja et al., 2018 |
| Bacillus pumilus Bacillus subtillis | Пелагические воды | 30 сут | Пластиковые пакеты из ПЭ | Потеря веса 1.5‒1.75% | Harshvardhan, Jha, 2013 |
| Brevibacillus borstelensis | DSMZ | 90 сут | 50°C, УФ-облученный ПЭНП | Потеря веса 11% | Hadad et al., 2005 |
| Cupriavidus necator | Почва мусорного полигона | 21 сут | Порошок ПЭНП | Потеря веса 33.7% | Montazer et al., 2019 |
| Delftia sp. | Пластиковый мусор в почве | 90 сут | ПЭНП без обработки | Изменения химических свойств | Peixoto et al., 2017 |
| Kocuria palustris M16 | Пелагические воды | 30 сут | Пластиковые пакеты из ПЭ | Потеря веса 1% | Harshvardhan, Jha, 2013 |
| Klebsiella pneumoniae | Лабораторный изолят | 60 сут | Пленка ПЭНП, предобработка сухим горячим воздухом (70°C, 10 сут) | Потеря веса 18.4% | Awasthi et al., 2017 |
| Lysinibacillus xylanilyticus, Aspergillus niger | Почва свалки, Тегеран | 126 сут | Пленки ПЭ облученные и без облучения | Потеря веса 29.5 и 15.8%, для облученного и необлученного ПЭНП соответственно | Esmaeili et al., 2013 |
| Microbacterium paraoxydans | GenBank ID | 2 мес. | Обработанный ПЭНП | Потеря веса 61% | Rajandas et al., 2012 |
| Micrococcus luteus | Почва мусорного полигона | 21 сут | Порошок ПЭНП | Потеря веса 18.9% | Montazer et al., 2019 |
| Pseudomonas aeruginosa | Почва пляжа, загрязненная нефтью | 80 сут | Низкомолекулярный ПЭ (LMWPE) | Потеря веса 40.8% | Jeon, Kim, 2015 |
| Pseudomonas citronellolis | Городская свалка | 4 сут | Пленки ПЭНП | Потеря веса 17.8% | Bhatia et al., 2014 |
| Rhodococcus ruber | Почва, загрязненная РЕ мусором | 4 нед. | Обработанный УФ ПЭНП | Потеря веса до 8% | Gilan et al., 2004 |
| Rhodococcus sp. | Свалка отходов | 3 нед. | Обработанный ПЭНР | Потеря веса 33% | Nanda, Sahu, 2010 |
| Stentrophomonas sp. | Пластиковый мусор в почве | 90 сут | ПЭНП без обработки | Изменения химических свойств | Peixoto et al., 2017 |
О процессе деградации полипропилена известно очень мало. Очевидно, однако, что длинные молекулы, высокоупорядоченная структура, отсутствие групп, доступных для окисления, а также наличие боковой метильной группы затрудняют деградацию ПП (Jeon, Kim, 2016). Как правило, при инкубации образцов ПП с микроорганизмами отмечают уменьшение массы пластика, однако значения могут варьировать от 0.43% за 12 мес. (Arkatkar et al., 2009) до 6.4% за 40 сут (Auta et al., 2018) для чистого ПП и бактериальных культур, и от 1.4% за 3 мес. (Sheik et al., 2015) до 18% за 12 мес. для ПП, содержащего катализатор, и культур различных микромицетов ‒ Phanerochaete chrysosporium, Engyodontium album (Jeyakumar et al., 2013). Биоразложение ПП оценивают по образованию биопленок, увеличению содержания белка или АТФ в культуре по сравнению с контролем без пластика, по уменьшению молекулярной массы полимера, увеличению степени гидрофильности поверхности, изменению ИК-спектров.
Проблема изучения биодеградации отходов поливинилхлорида (ПВХ) связана с высоким содержанием в типичных бытовых изделиях из этого материала различных добавок: пластификаторов, термостабилизаторов, антипиренов, биоцидов, доля которых может доходить до 50‒75%. Хорошо известна способность многих микроорганизмов расти на питательных средах с пластификаторами в качестве единственного источника углерода и энергии (Berk et al., 1957; Booth et al., 1968; Webb et al., 2000; Nakamiya et al., 2005; Sabev et al., 2006; Das et al., 2012). Поэтому снижение веса пластика под воздействием микроорганизмов, или изменение таких физических свойств как гибкость и прочность на разрыв может быть связано не столько с разрушением цепей ПВХ, сколько с уменьшением доли добавок (Luzia et al., 2020; Ru et al., 2020). Решить эту проблему можно либо используя чистый порошок ПВХ (Wu et al., 2017) или пластинки чистого ПВХ, получаемые исследователями в лаборатории растворением коммерческого препарата в тетрагидрофуране (Kirbas et al., 1999; Ali et al., 2014; Khatoon et al., 2019), либо прибегая к дополнительным методам анализа. Среди них наиболее часто применяют ИК-спектроскопию, термогравиметрический анализ и гель-проникающую хроматографию (Raddadi, Fava, 2019).
Высокая прочность и износостойкость ПЭТ объясняются высоким содержанием ароматических терефталатных звеньев, которые ограничивают подвижность полимерных цепей (Marten et al., 2005) и делают ПЭТ чрезвычайно устойчивым к микробной деградации (Andredy, 1994; Zheng et al., 2005; Müller, 2006; Tokiwa et al., 2009). Степень кристалличности таких синтетических полимеров, которая обычно превышает 30‒40% (Liu et al., 2004; Lee et al., 2013), а также гидрофобность поверхности в значительной степени влияют на их биоразлагаемость, так как воздействие ферментов микроорганизмов происходит, прежде всего, на аморфные участки пластика и имеет наиболее важное значение при первичной адгезии потенциальных деструкторов (Urgun-Demirtas et al., 2007; Wang et al., 2016).
Несмотря на аморфность полистирола, действие ферментов на полимер крайне затруднено, поскольку его молекулы имеют высокую молекулярную массу и неполярны, а сам полимер нерастворим в воде (Motta et al., 2009). Кроме того, боковые фенильные группы, неупорядоченно распределенные в пространстве, очень устойчивы к биоразложению (Atlas, Barta, 1987). Сведения о микробном разрушении ПС противоречивы. Так, ряд исследователей считает, что полистирол устойчив к действию микроорганизмов. Например, выделенные из почвы чистые культуры Microbacterium sp. NA23, Paenibacillus urinalis NA26, Bacillus sp. NB6, Pseudomonas aeruginosa NB26 не показали активности по отношению к пленке ПС в течение 8 мес. (Atiq et al., 2010), а лист ПС, закопанный в почву на 32 года, не имел признаков деградации (Otake et al., 1995). Другие исследователи отмечают, что полистирол разрушается микроорганизмами очень медленно, так как на 75% состоит из ароматических соединений и имеет высокую молекулярную массу. Гидрофобный характер ПС способствует его устойчивости к гидролизу, а также влияет на способность микроорганизмов прикрепиться к его поверхности. Высокая молекулярная масса и плохая растворимость в воде не позволяют микробным клеткам транспортировать ПС через клеточную стенку и цитоплазматическую мембрану для метаболизма. Образуемые микроорганизмами экзоферменты не могут проникнуть внутрь полимера и действуют на поверхности. В исследованиях по биодеградации ПС чаще всего применяются визуальные наблюдения за изменениями поверхности образца и его цвета, а также за появлением и развитием микробных биообрастаний с использованием флуоресцентной (для оценки жизнеспособности микробных клеток) и сканирующей электронной микроскопии; гравиметрия; детекция образовавшихся интермедиатов путем спектрофотометрии (для ароматических соединений), газовой хроматографии, высокоэффективной жидкостной хроматографии и инфракрасной спектроскопии Фурье; оценка потребления и выделения газов.
Таким образом, несмотря на большие методические сложности, ряд разработанных специально для решения задачи разложения пластика методов позволяет достоверно продемонстрировать процесс деструкции основных видов пластиков, осуществляемых бактериями и грибами. Аналогичная информация об участии в этих процессах архей пока отсутствует. К сожалению, из-за различий между используемыми субстратами, а также формы образцов (пленки, порошок, гранулы и пр.) результаты невозможно сравнивать между собой. Очередной задачей исследователей является создание единого протокола исследования разложения пластиков, который должен будет решить эту задачу.
РАЗНООБРАЗИЕ СВОБОДНОЖИВУЩИХ МИКРООРГАНИЗМОВ, ОСУЩЕСТВЛЯЮЩИХ ПРОЦЕСС БИОДЕГРАДАЦИИ ПЛАСТИКОВ
Несмотря на то, что процесс разложения пластиков идет очень медленно, способность осуществлять его была найдена у многих бактерий и микромицетов.
Микроорганизмы, разлагающие ПЭ и другие виды пластика, чаще всего выделяли из почвы, мусорных полигонов, компоста, морской воды и активного ила (Montazer et al., 2020). Так, описана биофрагментация и использование в качестве источника углерода и энергии ПЭНП, не подвергавшегося предварительной обработке, штаммами Pseudomonas putida, Acinetobacter pittii и Micrococcus luteus (Montazer et al., 2019). Процесс сопровождался образованием алканов и накоплением в клетках биоразлагаемых полимеров – полигидроксиалканоатов. Известно более чем 20 родов бактерий, для которых показана возможность биодеградации различных типов ПЭ (Ghatge et al., 2020). Бактерии, способные к разложению ПЭ, и скорости осуществляемого процесса представлены в табл. 2. Способность разлагать ПЭ была обнаружена также у грибов родов Aspergillus, Cladosporium, Fusarium, Gliocladium, Mortierella, Mucor, Penicillium, Zalerion (El-Shafei et al., 1998; Yamada-Onodera et al., 2001; Volke-Sepúlveda et al., 2002; Bonhomme et al., 2003; Manzur et al., 2004; Koutny et al., 2006; Hasan et al., 2007; Ahebnazar et al., 2010; Nowak et al., 2011; Pramila, Ramesh, 2011; Sheik et al., 2015; Paco et al., 2017). Грибы обладают мощной ферментативной системой и способностью выживать в жестких условиях окружающей среды при низком содержании питательных веществ и влаги. Помимо этого, они обладают способностью широко распространять гифы, которые могут проникать в трещины и углубления в пластике (Jeyakumar et al., 2013).
Для бактерий родов Bacillus spp. (Sudhakar et al., 2008; Abrusci et al., 2013), Rhodococcus spp. (Bonhomme et al., 2003; Gilan et al., 2004; Fontanella et al., 2010) и Pseudomonas spp. (Rajandas et al., 2012), а также для грибов родов Aspergillus и Fusarium (Hasan et al., 2007; Sahebnazar et al., 2010), была показана деполимеризация ПЭ после различных видов предварительной обработки, такой как ультрафиолетовое облучение (УФ) и/или термическая обработка, которая делает углеродные цепи полимера чувствительными к биоразложению (Ammala et al., 2011).
Сообщения об успешной микробной деградации полипропилена весьма немногочислены. Так, было показано, что консорциум бактерий (Aneurinibacillus aneurinilyticus, Brevibacillus sp., B. agri, and B. brevi), выделенных из водоочистных сооружений и мусорных полигонов, за 140 сут инкубации при 50°С уменьшил массу ПП-гранул на 44%, а пленок ‒ на 56% (Skariyachan et al., 2008). Гравиметрические показатели были подтверждены данными ИК-спектроскопии Фурье, СЭМ и рядом других методов. Рост на минеральной среде с ПП как единственным источником углерода и энергии, сопровождавшийся уменьшением массы ПП, был показан для Bacillus cereus и Sporosarcina globispora (Auta et al., 2017). Однако основная часть положительных результатов по микробной деградации ПП была получена в результате предобработки пластика и будет освещена ниже.
Исследование способности грибов и бактерий к разложению ПВХ оказалась затруднена присутствием в этом пластике пластификаторов, которые могут являться истинными субстратами растущих на ПВХ микроорганизмов (Kirbas et al., 1999; Webb et al., 2000; Peciulyte, 2002; Sabev et al., 2006). В опытах с чистым ПВХ была продемонстрирована активность Phanerocheate chrysosporium, Lentinus tigrinus, Aspergillus niger и A. sydowii, подтвержденная увеличением биомассы грибов, выделением СО2 и сканирующей электронной микроскопией образца (Ali et al., 2014). Авторы продемонстрировали рост гриба на среде с пластиком, снижение массы лишенного пластификаторов и примесей полимера на 31% за 2 мес., минерализацию (к четвертой неделе выделение СО2 составило 13.74 мг/л), а также сопутствующее росту биомассы усиление активности пероксидазы. Источником грибов, способных разлагать ПВХ, может быть загрязненная этим пластиком почва. Недавно было показано, что подобные условия привели к селекции штаммов Mucor sp. и Penicillium sp., способных расти на среде с ПВХ и, основываясь на результатах ИК-спектрометрии, вызвать частичное разрушение пластика (Pardo-Rodríguez, Zorro-Mateus, 2021).
Бактерий, участвующих в повреждении изделий из ПВХ, начали изучать одновременно с грибами. В одной из первых работ выделенные с поверхности пластиковых изделий представители родов Pseudomonas, Brevibacterium и Achromobacter в лабораторных условиях снижали на 20% вес и уменьшали гибкость ПВХ с пластификатором ди-изо-октилсебацинатом (Booth et al., 1968). Тем не менее, работ о воздействии бактерий на ПВХ значительно меньше, чем о воздействии грибов, и многие из имеющихся связаны с утилизацией пластификаторов. Наибольший интерес представляет исследование биодеградации пленок ПВХ культурами Bacillus flexus и Pseudomonas citronellolis. Обе культуры за 45 сут инкубации вызвали фрагментацию пленок ПВХ, изменение данных ИК-спектроскопии, уменьшение термостабильности и снижение Mn примерно на 10%, а P. citronellosis вызывал уменьшение гравиметрического веса образцов ПВХ нa 19% в течение 30 сут (Giacomucci et al., 2019). Авторы отмечают, что используемые ими пленки содержали до 30% различных добавок (цитраты, адипаты и полиадипаты, эпоксидированное соевое масло, Zn), и полученные результаты позволяют предполагать разрушение как цепей полимера, так и добавок. Искусственный консорциум из Pseudomonas otitidis, Bacillus aerius, B. cereus и Acanthopleurobacter pedis вносили в экспериментальные образцы почвы с погруженными в нее пластиковыми пленками (Anwar et al., 2016). По сравнению с контрольными почвенными образцами добавление консорциума не только привело к значительному повреждению поверхности пластика (данные СЭМ) и изменению профилей ИК- и УФ-спектроскопии, но также к снижению Mn на 78.5% (с 72.65 до 15.63 кДа за 9 мес.; до 66.61 кДа в контроле), что указывает на разрушение цепей полимера. Этот исключительный результат сильно выбивается из результатов аналогичных работ и требует дополнительного подтверждения.
Разложением ПЭТ занимаются много и активно, и наиболее выдающиеся результаты, достигнутые с помощью использования ПЭТ-разлагающих ферментов, будут изложены в соответствующем разделе обзора. Нельзя не упомянуть, однако, наиболее известный микроорганизм, эффективно разлагающий ПЭТ – Ideonella sakaiensis (Yoshida et al., 2016). I. sakaiensis вызывает практически полную дегредацию пленок PЭТ за 6 нед. инкубации при 30°С. Однако основными источниками ферментов, разлагающих ПЭТ, в настоящее время являются термофильные актинобактерии, выделяемые из компоста и развивающиеся при температуре 50‒60°С, способствующей деградации полимерного субстрата, – Thermomonospora fusca (Kleeberg et al., 1998), Thermobifida alba (Hu et al., 2010), Saccharomonospora viridis (Kawai et al., 2014), Thermomonospora kurvata (Wei et al., 2014).
Данных по разложению полистирола микроорганизмами довольно много, но они противоречивы и трудно поддаются сравнению из-за различий в структуре полимера и разных методов детекции его разложения. Так, при том, что большинство клеток Rhodococcus ruber прикрепилось к субстрату (ПС) в течение нескольких часов, 0.8% снижение массы полимера было отмечено лишь после 8 нед. культивирования (Mor, Sivan, 2008). Из проб, полученных с полей орошения в Индии, были выделены два штамма бактерий Exiguobacterium sibiricum и Exiguobacterium undae, способных использовать твердый прозрачный ПС и гранулы ПС как источник углерода и энергии (Chauhan et al., 2018). С помощью атомно-силовой микроскопии было показано, что поверхность становится более шероховатой, что приводит к снижению ее гидрофобности. ИК-спектроскопия Фурье показала, что образуются окисленные группировки в молекулах, а гравиметрия подтвердила убыль массы ПС на 0.4% за 30 сут. Однако штамм Bacillus paralicheniformis, выделенный из Аравийского моря, был способен разрушать 34% по массе пленки ПС за 60 сут (Kumar et al., 2021). Для грибов рода Curvularia было показано, что гифы “прилипают” к поверхности атактического полистирола и проникают в нее; при этом потеря массы составила 2‒5% за 2‒3 мес. (Motta et al., 2009). При инкубации Enterobacter sp., Citrobacter sedlakii, Alcaligenes sp., Brevundimonas diminuta с ПС как единственным источником углерода и энергии показали до 12% убыли субстрата за месяц. Установлено, что грибы бурой гнили Gloeophyllum striatum и Gloeophyllum trabeum способны атаковать ПС с помощью реакций Фентона при участии гидрохинона, при этом после 20 сут инкубации происходит существенная деполимеризация ПС и снижение молекулярной массы почти на 50% (Krueger et al., 2015). Факт биодеградации лигнополистирола грибами белой гнили Pleurotus ostreatus, Phanerochaete chrysosporium и Trametes versicolor был отмечен еще в 1992 г. (Milstein et al., 1992). Восьминедельная инкубация Cephalosporium sp. с ПС привела к потере массы пластика на 2.17 ± 0.16%, а с Mucor sp. ‒ на 1.81 ± 0.13%, что было дополнительно подтверждено регистрацией изменений поверхности ПС от гладкой к шероховатой, снижением рН среды, появлением интермедиатов и снижением молекулярной массы (Chaudhary et al., 2019).
Наряду с исследованием чистых культур, микробное разложение ПС исследовалось и для природных ассоциаций микроорганизмов. Присутствие ПС вызывало сукцессию микробного сообщества активного ила в аэробных и анаэробных условиях (Wei et al., 2020). Микроорганизмы активного ила образовывали на кубиках ПС биопленки, увеличивающиеся с первой по девятую недели инкубации. Сканирующая электронная микроскопия и рентгеноспектроскопия выявили изменения в структуре ПС, а ИК-спектроскопия с преобразованием Фурье показала появление в среде интермедиатов неизвестного состава. При добавлении двух типов меченого изотопом 14C полистирола (α- и β-14C) к почве и активному илу сточных вод оказалось, что через 8 нед. только 0.01% ПС окислился до 14CO2, а через 75 сут общий уровень конверсии составил 0.7% (Giullet et al., 1974). Невысокие активности зафиксированы при деградации 14C-ПС смешанными культурами 17 штаммов лигнинразрушающих грибов, а также микробными сообществами ила, различных почв, навоза и мусорной свалки (от 0.04 до 3.0% за 16 нед.) (Sielicki et al., 1978; Kaplan et al., 1979). Существенно более высокие скорости деградации пенополистирола выявили в образцах с мусорной свалки Саримукти, Индонезия, где убыль массы пеноПС за 7 нед. инкубации составила 18.23% (Hidayat et al., 2020). СЭМ показала образование пор на поверхности пластика, а ИК-спектроскопия Фурье подтвердила образование более простых функциональных групп в молекулах и появление C‒O-групп. Предполагается, что в разложении пенополистирола участвовали бактерии родов Pseudomonas и Bacillus.
МИКРООРГАНИЗМЫ-СИМБИОНТЫ БЕСПОЗВОНОЧНЫХ, РАЗЛАГАЮЩИЕ ПЛАСТИК
Известно, что ряд беспозвоночных животных может потреблять пластики, и в последние годы интерес к этому явлению, а также к микробиомам кишечника этих организмов резко возрос. Первое упоминание о том, что некоторые насекомые могут оставлять отверстия в полиэтиленовой упаковке относится к 2007 г. (Riudavets et al., 2007). Позднее из кишечника Plodia interpunctella (южной амбарной огнeвки) были выделены штаммы Enterobacter asburiae и Bacillus sp., способные разрушать ПЭ в виде пленки за 60 сут на 6 и 10% соответственно, с уменьшением молекулярного веса остаточного ПЭ.
Описана способность личинок большой восковой моли Galleria mellonella быстро разлагать полиэтилен (убыль массы составила 13% за 14 ч) с образованием этиленгликоля (по данным Фурье-инфракрасной спектроскопии). Из кишечника личинок G. mellonella был выделен штамм Enterobacter sp., вызывающий изменения физических и химических свойств пленки ПЭ, зарегистрированные методами Фурье-инфракрасной спектроскопии, ЖХ-MС, СЭM и AСM после 31 сут инкубации (Ren et al., 2019). Личинки G. mellonella проявили также способность к деградации ПС (Lou et al., 2020): происходила значительная потеря массы пластика, появление C=O и C‒O-групп в молекулах и образование длинноцепочечных жирных кислот. Изучение состава микробиоты кишечника личинок G. mellonella показало, что при употреблении пластика в кишечнике начинают доминировать представители родов Bacillus и Serratia. При этом разрушение ПС отдельными выделенными штаммами шло менее эффективно, чем кишечным сообществом в целом.
Позднее была описана биодеградация ПЭ и других пластиков личинками различных насекомых, таких как мучной хрущак Tenebrio molitor (Billen et al., 2020), тeмный хрущак Tenebrio obscurus (Brandon et al., 2018; Peng et al., 2019), супер хрущак Zophobas atratus (Peng et al., 2020), малая пчелиная огневка Achroia grisella (Kundungal et al., 2019), а также улитками Achatina fulita (Song et al., 2020). Из кишечника личинок T. molitor были выделены штаммы Acinetobacter sp. и Bacillus sp., способные к росту на ПЭНП только в кокультуре; при этом масса ПЭНП за 30 сут снижалась на 18% (Yin et al., 2020).
Интересные результаты показаны для личинок мучного хрущака T. molitor, способных расти, используя в качестве корма порошок ПВХ (Peng et al., 2020). Происходила частичная деградация цепей полимера до небольших хлорорганических соединений, и снижение Mn на 33.4‒36.4%. Однако полная минерализации пластика шла очень медленно. Подобная активность Tenebrio molitor была продемонстрирована также для полиэтилена и полистирола (Wu et al., 2019). Важно отметить, что добавление в корм антибиотика значительно снижало эффективность биодеградации, что свидетельствует о роли микробиома кишечника личинок в этом процессе. Анализ вариабельных фрагментов генов 16S рРНК кишечного сообщества личинок показало преимущественное развитие на корме из ПВХ представителей семейств Streptococcaceae (в основном род Lactococcus), Spiroplasmataceae, Enterobacteriaceae и Clostridiaceae, не доминировавших на стандартном корме из отрубей.
Способность разрушать ПС была изучена для личинок двух разновидностей мучного хрущака (T. molitor и T. obscurus) и их микробиоты (Yang et al., 2015a, 2015b; Peng et al., 2019). По данным радиоизотопного анализа за 24 ч 47.7% меченого 13С пеноПС минерализовалось до CO2, 49.2% выделялось с фекалиями, и небольшая часть встраивалась в липиды. С помощью ГХ-МС были зарегистрированы следующие интермедиаты разложения полистирола: пентанон, 4-гидрокси-4-метилбензен, 2,2-диметил-1,3-диоксолан-4-метанол, оксалат, бутил-6-этилокт-3-ил-эфир, фенол, 2,4-бис(1,1-диметилэтил), 1,2-бензендикарбоксилат, бутил-2-метилпропиловый эфир. Микробное сообщество кишечника личинок при употреблении в пищу пеноПС претерпевало значительную сукцессию: от преобладания молочнокислых и энтеробактерий к доминированию стрептококков, а затем спироплазм и энтерококков. Важная роль кишечной микробиоты в процессе деградации пеноПС была доказана подавлением ее активности с помощью антибиотиков, что практически прекращало разложение пластика. Из кишечника личинок были выделены и идентифицированы 30 изолятов, которые затем инкубировали как чистые культуры в течение 28 сут в присутствии ПС. Значимый прирост числа клеток показали штаммы Bacillus cereus, Enterobacter hormaechei, Enterococcus gallinarum, Enterococcus faecalis, Chryseobacterium sp., Exiguobacterium sp.; при росте последнего организма на ПС в течение 60 сут в культуральной жидкости с помощью ГХ были выявлены многочисленные пики интермедиатов, а пластик потерял около 7.5% массы.
Таблица 4.
Микроорганизмы и микробные сообщества, активные по отношению к полистиролу (ПС)
| Источник пробы | Условия культивирования | Микроорганизм(ы) | Изменения в культуре с ПС | Проявление активности деструкции ПС | Методы детекции | Ссылки |
|---|---|---|---|---|---|---|
| Чистая культура | Минимальная среда, рН 7, 20°С, ПС модифицирован полилактатом, 28 сут | Pseudomonas aeruginosa | Прирост клеток и внеклеточного белка | Потеря массы ПС 10%, изменение поверхности сополимера | Спектроскопия, рН-метрия, гравиметрия, СЭМ | Shimpi et al., 2012 |
| Почва, загрязненная полиэтиленом | Минеральная среда SM, 35°С, 4 и 8 нед. | Rhodococcus ruber C208 | Образование биопленки на поверхности ПС | Снижение массы хлопьев ПС на 0.5 и 0.8% | Гравиметрия, прирост биомассы биопленки, оценка содержания белка, СЭМ | Mor, Sivan, 2008 |
| Чистые культуры | 2‒3 мес. | Curvularia sp. | Гифы гриба проникают в субстрат | Потеря массы атактического ПС 2‒5% | Гравиметрия, СЭМ | Motta et al., 2009 |
| Мусорная куча | 4 мес. | Bacillus subtilis | Потеря массы ПС | Гравиметрия | Asmita et al., 2015 | |
| Чистые культуры | Минеральная среда с ПС, в некоторых случаях с желатином, 30 сут | Enterobacter sp., Citrobacter sedlakii, Alcaligenes sp., Brevundimonas diminuta | Изменение структуры ПС, потеря массы до 12.4%, интермедиаты деструкции ПС (Enterobacter) | СЭМ, гравиметрия, ВЭЖХ, ЯМР- и ИК-спектроскопия Фурье, анализ генов16S рРНК | Sekhar et al., 2016 | |
| Почва | Питательный бульон с ПС, 30 сут | Bacillus sp., Pseudomonas sp. | Потеря массы ПС 23% | Гравиметрия | Mohan et al., 2016 | |
| Почва | Питательный бульон, 8 сут | Bacillus sp. | Потеря массы ПС 56%; убыль стирола 40% | Гравиметрия | Mohan et al., 2016 | |
| Почва | Питательный бульон, 30 сут | P. aeruginosa, B. subtilis, Staphylococcus aureus, Streptococcus pyogenes | Потеря массы ПС 5, 20‒59, 5, 38, 8‒11% |
Гравиметрия | Mohan et al., 2016 | |
| Чистые культуры | Богатая питательная среда, 28°С, 20 сут | Gloeophyllum striatum, Gloeophyllum trabeum | Деполимеризация ПС, потеря массы ПС 50% | ВЭЖХ, ГХ-МС, спектроскопия, гравиметрия | Krueger et al., 2015 | |
| Чистые культуры | Богатая питательная среда, 28°С, 21 сут | Pleurotus ostreatus, Phanerochaete chrysosporium, Trametes versicolor | Обрастание сополимера мицелием | Повреждение поверхности, потеря массы лигноПС от 10 до 50%; увеличение продукции лакказ и пероксидаз | Гравиметрия, СЭМ, УФ-спектроскопия, ферментный анализ | Milstein et al., 1992 |
| Чистые культуры | Питательный бульон, пеноПС, растворен в диметилформамиде и твине 80, или дихлорметане, 30 сут | Pestalotiopsis sp. Ceriporia sp. Cymatoderma dendriticumP. aeruginosa B. subtilis (Serratia marcescens) | Появление
микропор,
образование поверхностных (карбонильных) групп. Разложение 15.7‒74.4%, пеноПС (грибы) и 38.3‒63.4%, (бактерии) |
Гравиметрия, СЭМ, ИК-спектроскопия Фурье | Yanto et al., 2019 | |
| Поля орошения, Индия | Минеральная среда LCFBM, 30°С, ПС гранулы ПС, 30 сут | Exiguobacterium sibiricum, Exiguobacterium undae | Образование биопленки на поверхности ПС | Изменение структуры поверхности ПС, формирование окисленных групп, убыль массы ПС на 0.4% | Анализ изменений гидрофобности поверхности, атомная силовая микроскопия, ИК-Фурье спектроскопия, гравиметрия | Chauhan et al., 2018 |
| Донные отложения Аравийского моря на глубине 3538 м | 30°С, соленость 4%, пленка ПС | Bacillus paralicheniformis | Убыль массы пленки ПС 34% идентифици-рованы гены монооксигеназы, диоксигеназы, пероксидазы | Термический анализ, сканирующая калориметрия, СЭМ, ИК-Фурье-спектроскопия, ЯМР-спектроскопия | Kumar et al., 2021 | |
| Чистые культуры | Инкубация 8 недель | Cephalosporium, Mucor | Нет данных | Потеря массы ПС на 2.7 и 1.81%; изменения поверхности ПС, появление интермедиатов | СЭМ, ИК-Фурье-спектроскопия, ГХ-МС | Chaudhary, Vijayakuma, 2019 |
| Активный ил очистных сооружений | In situ, аэробно и анаэробно c кубиками ПС, 9 нед. | Нет данных | Образование биопленки кубиках ПС | Изменения в структуре ПС, появление окисленных групп в молекулах | СЭМ, рентгеноспектроскопия, ИК-спектроскопия с преобразованием Фурье | Naz et al., 2013 |
| Почва и активный ил сточных вод | In situ аэробно и анаэробно с α- и β-14C-ПС | Нет данных | Нет данных | 0.01% ПС окислился до 14CO2 через 8 нед. и 0.7% ‒ через 75 сут | Радиоизотопный метод | Guillet et al., 1974 |
| Лигнинразрушающие грибы, образцы ила, почвы, навоза, свалки | In situ аэробно и анаэробно с 14C-ПС | Нет данных | Нет данных | Убыль массы ПС от 0.04 до 3.0% | Радиоизотопный метод | Sielicki et al., 1978; Kaplan et al., 1979 |
| Морская вода, оборотная вода нефтехимического производства | In situ аэробно | Нет данных | Образование пленки бактерий и водорослей | Пластификация ПС и снижение величины максимального напряжения при растяжении | СЭМ, ИК-спектроскопия с преобразованием Фурье, ГХ-МС | Лаптев и соавт., 2019 |
| Образцы почвы | In situ аэробно
и анаэробно, ПС, крахмал |
Нет данных | Нет данных | Потеря массы ПС 81.3% | Гравиметрия | Nikolic et al., 2014 |
| Речная вода | In situ аэробно, ПС, крахмал | Нет данных | Нет данных | Потеря массы 45.8‒93.1% в течение 27 сут | Гравиметрия | Nikolic et al., 2013 |
Личинка Zophobas atratus потребляла в сутки 0.58 г ‒ в 4 раза больше, чем личинки мучного хрущака. С помощью различных методов анализа было доказано, что в ee кишечнике происходит деполимеризация ПС и образование низкомолекулярных интермедиатов, при этом 36.7% углерода пеноПС минерализуется до CO2 в течение 16 сут (Yang et al., 2020). Из кишечника личинки Zophobas atratus был выделен штамм Pseudomonas aeruginosa, способный к деградации ПС, и показано, что в процессе разрушения ПС повышается экспрессия сериновой гидролазы (Kim et al., 2020). Личинки жука Plesiophthalmus davidis за 14 сут потребили 34.27 ± 4.04 мг пеноПС на личинку и выжили, питаясь только этим пластиком. После 20 сут инкубации накопительных культур кишечной микробиоты этого насекомого с ПС наблюдали образование биопленок на поверхности пластика и ее морфологические изменения (образование полостей). ИК-спектроскопия Фурье показала появление C‒O-связей в молекулах. Анализ микробного сообщества показал, что в кишечнике в значительных количествах присутствовала Serratia marcescens; при кормлении личинок ПС в течение 2-х нед. ее количество увеличивалось в 6 раз (Woo et al., 2020).
Недавно была исследована способность широко распространенного вида улитки Achatina fulica перерабатывать пеноПС (Song et al., 2020). Улитка потребляла18.5 ± 2.9 мг ПС в течение 4 нед., выделяла микропластик с суммарной потерей массы в среднем на 30.7%. Аналитические методы подтвердили изменение молекулярной массы остаточного ПС и образование окисленных групп в молекулах. Анализ микробного сообщества с помощью высокопроизводительного секвенирования генов 16S рРНК выявил существенные сдвиги в сторону увеличения представителей семейств Enterobacteriaceae, Sphingobacteriaceae и Aeromonadaceae, что указывает на их возможное участие в процессе биодеградации.
МЕХАНИЗМЫ МИКРОБНОЙ ДЕГРАДАЦИИ ПЛАСТИКОВ
Полиэтилен и другие пластики, содержащие только углерод-углеродные связи в основной цепи, очень устойчивы к внешним воздействиям, в том числе и к микробному разложению (Wei, Zimmermann, 2017); тем не менее, у микроорганизмов существует целый ряд механизмов, приводящих к их деградации (Sheel, Pant, 2018). В процессе микробной биодеградации ПЭ, как правило, происходит биофрагментация полимера микробными ферментами с последующей биоассимиляцией получившихся мелких (с молярной массой меньше 500 г/моль) фрагментов (Bonhomme et al., 2003; Montazer et al., 2019).
В настоящее время известны две группы ферментов, участвующих в разложении ПЭ, и обе они задействованы в разложении других трудноразлагаемых полимеров – углеводородов и лигнина. В первом случае это алкангидроксилазы (Yoon et al., 2012; Jeon, Kim, 2015; Gravouil et al., 2017) и монооксигеназы (Jeon, Kim, 2015; Moreno, Rojo, 2019), во втором ‒ лакказы (Santo et al., 2013; Sheel, Pant, 2018) и марганецпероксидаза (Iiyoshi et al., 1998; Mukherjee, Kundu, 2014).
Алкангидроксилазы (EC 1.14.15.3) являются ключевыми ферментами, участвующими в аэробном разложении алканов бактериями (Monahan et al., 2020). Начальная стадия включает гидроксилирование связей C‒C с образованием первичных или вторичных спиртов, которые затем окисляются до альдегидов или кетонов, а затем до карбоновых кислот. Карбоксилированные н-алканы аналогичны жирным кислотам, которые могут катаболизироваться бактериями через систему β-окисления. C помощью транскриптомного анализа было показано, что у Rhodococcus ruber в присутствии ПЭ экспрессируются ферменты деградации алканов и пути β-окисления жирных кислот (Gravouil et al., 2017). Полная система алкангидроксилаз из Pseudomonas aeruginosa, выделенного с загрязненного нефтью пляжа, была экспрессирована в E. coli, в результате чего 19.3% низкомолекулярного ПЭ (low-molecular weight polyethylene, LMWPE) за 80 сут было минерализовано до СО2 (Yoon et al., 2012). Для многих микроорганизмов, разлагающих ПЭ, также была показана их способность использовать линейные н-алканы, такие как парафин (C44H90, Mw = 618). Было обнаружено, что линейные молекулы парафина потребляются несколькими микроорганизмами в течение 20 сут (Haines and Alexander, 1975). Однако ни о разрыве связей C‒C в основной цепи полиэтиленовых полимеров, ни об образовании продуктов гидролиза карбоновых кислот с длинной углеродной цепью не сообщалось (Eubeler et al., 2010; Yoon et al., 2012; Jeon, Kim, 2015; Gewert, 2015).
К ферментам, участвующим в разложении лигнина, относятся марганецпероксидаза (ЕС 1.11.1.13), лигнинпероксидазы (EC 1.11.1.14) и лакказы (EC 1.10.3.2), и для них также установлено участие в разложении ПЭ (Restrepo-Florez et al., 2014; Krueger et al., 2015). Внеклеточная медь-зависимая лакказа из Rhodococcus ruber вызывала снижение среднего молекулярного веса и Mn облученного УФ полиэтилена, увеличивая содержание карбонильных групп в полимере (Santo et al., 2013). Еще одним ферментом, участвующим в биодеградации синтетических пластиков, в том числе ПЭ, является марганецпероксидаза (ЕС 1.11.1.13). Показано, что лигнин-разлагающие грибы Phanerochaete chrysosporium и Trametes versicolor и штамм IZU-154, а также частично очищенная марганецпероксидаза из P. chrysosporium вызывали деградацию ПЭ, причем процесс стимулировался ионами Mn (Iiyoshi et al., 1998). Также была продемонстрирована способность этого фермента осуществлять биодеградацию предварительно облученного ультрафиолетом ПЭ (Mukherjee, Kundu, 2014). Есть указания на существование подобных механизмов и у бактерий. Так, у Bacillus cereus была показана стимуляция синтеза лакказы и марганецпероксидазы при инкубации с ПЭ, предварительно подвергнутым УФ-облучению (Sowmya et al., 2014). Показано, что лигнинпероксидаза Streptomyces sp. вызывала деградацию ПЭ после термообработки (Pometto et al., 1992).
Таким образом, эти и некоторые другие экспериментальные данные указывают на участие перечисленных ферментов в разложении полиэтилена. Следует отметить, однако, что в большинстве случаев пластик предварительно подвергался УФ или термообработке, что делало его более доступным для действия ферментов.
Сведения о механизмах деградации ПП отсутствуют. Информации о механизмах разложения ПВХ также практически нет; однако было показано, что разложение ПВХ P. chrysosporium основывается на действии пероксидазы (Khatoon et al., 2019). При этом видимые повреждения поверхности пластика (данные СЭМ) и изменение профиля ИК-спектроскопии были значительно более выражены при обработке ПВХ раствором очищенной пероксидазы из P. chrysosporium, чем при инкубации пластика в присутствии культуры.
Механизмы деструкции ПЭТ активно изучаются; его биодеградация осуществляется путем ограниченного ферментативного гидролиза сложноэфирной связи полимерной основы. Ферменты бактерий и грибов вызывают гидролиз сложноэфирных связей в составе ПЭТ до образования терефталата и этиленгликоля. Промежуточными продуктами ферментативного гидролиза также являются моно-(2-гидроксиэтил) терефталат и бис-(2-гидроксиэтил) терефталат (Vertommen et al., 2005; Ronkvist et al., 2009), которые также могут разрушаться до терефталата и этиленгликоля под действием эстераз (Austin et al., 2018; Мaurya et al., 2020). При этом активность ПЭТ-гидролаз подвергается ингибированию промежуточными продуктами MHET и BHET, что показано на примере полиэфиргидролазы TfCut2 из Thermobifida fusca (Barth et al., 2015a).
Среди основных ПЭТ-гидролизующих ферментов выделяют гидролазы, кутиназы, ПЭТазу, выделенную из Ideonella sakaiensis, сходную по своей природе с кутиназами, а также липазы и эстеразы, образуемые различными грибами и бактериями (табл. 5).
Таблица 5.
Ферменты, участвующие в разложении ПЭТ
| Фермент | Номер в базе данных NCBI или EC-номер (код фермента; шифр КФ) | Микроорганизм- деструктор ПЭТ | Субстрат | Диапазон температур (оптимальная температура, °С) | Ссылка на источник |
|---|---|---|---|---|---|
| Поли(этилен терефталат)гидролазы/ПЭТ-гидролазы/ПЭТазы 3.1.1.101 | |||||
| Термостабильная ПЭТ-гидролаза PET2 | C3RYL0 | Bacteroidetes | Агаровые пластины, содержащие наночастицы ПЭТ | 50 | Danso et al., 2018 |
| ПЭТ-гидролаза PET5 | R4YKL9 | Oleispira antarctica RB-8 | Агаровые пластины, содержащие наночастицы ПЭТ | 50 | Danso et al., 2018 |
| Термостабильная ПЭТ-гидролаза PET6 | UPI0003945E1F | Vibrio gazogenes | Агаровые пластины, содержащие наночастиц ПЭТ | 50 | Danso et al., 2018 |
| ПЭТ-гидролаза PET12 | A0A0G3BI90 | Polyangium brachysporum | Агаровые пластины, содержащие наночастицы ПЭТ | 50 | Danso et al., 2018 |
| ПЭТ-гидролаза TfH | WP_011291330.1 | Thermobifida fusca (Thermomonospora fusca) SM43793 | ПЭТ | 30−60 (60) | Silva et al., 2011 |
| ПЭТ-гидролаза Tha_Cut1 | ADV92525.1 | Thermobifida alba DSM43185 | ПЭТ | 50 | Ribitsch et al., 2012 |
| ПЭТ-гидролаза Cut1 | E9LVI0 | T. fusca | ПЭТ | 65−70 | Dresler et al., 2006 |
| ПЭТ-гидролаза Cut2 | E5BBQ3 | T. fusca | ПЭТ | 50 | Chen et al., 2008 |
| ПЭТ-гидролаза Сut2 | E9LVH9 | Thermobifida cellulosilytica | ПЭТ | 50 | Acero et al., 2011 |
| ПЭТ-гидролаза Cut190 | W0TJ64 | Saccharomonospora viridis | ПЭТ | 65‒75 | Kawai et al., 2014 |
| ПЭТ-гидролаза Tcur0390 | CDN67546.1 | Thermomonospora curvata DSM 43183 | Наночастицы ПЭТ бис(бензоилоксиэтил) терефталат (3ПЭТ) |
50 25−70 (55) |
Wei et al., 2014 |
| ПЭТ-гидролаза Tcur1278 | CDN67545.1 | Th. curvata DSM 43183 | Наночастицы ПЭТ | 50−60 (60) | Wei et al., 2014 |
| ПЭТ-гидролаза PE-H | 6SBN | Pseudomonas aestusnigri VGXO14 | Aморфная пленка ПЭТ | 30 | Bollinger et al., 2020 |
| Сериновая ПЭТ-гидролаза Thh_Est | AFA45122.1 | Thermobifida halotolerans DSM44931 |
ПЭТ | 50 25 |
Ribitsch et al., 2012 |
| ПЭТаза | GAP38373.1 | Ideonella sakaiensis 201-F6 | ПЭТ | 15‒42 (30‒37) | Tanasupawat et al., 2016 |
| ПЭТ-гидролаза ISF6_4831 |
A0A0K8P6T7 | Ideonella sakaiensis | ПЭТ | 15‒42 (30‒37) | Yoshida et al., 2016 |
| ПЭТаза | ЕС 3.1.1.101 | Ideonella sakaiensis 201. F6.48 | ПЭТ | 15‒42 (30‒37) | Yoshida et al., 2016 |
| МГЕТаза (моно(этилентерефталат)гидролаза) | EC 3.1.1.102 | Ideonella sakaiensis 201. F6.48 | Моно(2-гидроксиэтил) терефталевая кислота | 15‒42 (30‒37) | Yoshida et al., 2016 |
| 1,2-Диоксигеназа терефталевой кислоты | EC 1.14.12.15 | Ideonella sakaiensis 201. F6.48 | Терефталевая кислота | 15‒42 (30‒37) | Yoshida et al., 2016 |
| 1,2-Дигидрокси-3,5- циклогексадиен-1,4-дикарбоксилат дегидрогеназа | ЕС 1.11.13 | Ideonella sakaiensis 201. F6.48 | Протокатеховая кислота | 15‒42 (30‒37) | Yoshida et al., 2016 |
| 3,4-Диоксигеназа | EC 1.3.1.53 | Ideonella sakaiensis 201. F6.48 | Протокатеховая кислота | 15‒42 (30‒37) | Yoshida et al., 2016 |
| Эстеразы 3.1 | |||||
| Эстераза del71Cbotu_EstA | 5AH1 | Clostridium botulinum | ПЭТ | 25 | Biundo et al., 2016 |
| Рекомбинантная эстераза Thh_Est | Thermobifida halotolerans | ПЭТ пленки | 50 | Ribitsch et al., 2012 | |
| п-Нитробензилэстераза BsEstB |
ADH43200.1 | Bacillus subtilis 4P3-11 | ПЭТ 3ПЭТ |
40−45 (40) | Ribitsch et al., 2012 |
| Полиэстераза | |||||
| Термостабильная
полиэстераза Cut190 S226P/R228S |
BAO42836.1 | Saccharomonospora viridis AHK190 | ПЭТ | 60−65 | Kawai et al., 2014 |
| Полиэстераза | Penicillium citrinum | ПЭТ, 3ПЭТ | 30‒50 | Liebminger et al., 2007 | |
| Кутиназы ЕС 3.1.1.74 | |||||
| Кутиназа LC | AEV21261.1 | Thermobifida fusca | ПЭТ пленки | 30−80 (50) | Sulaiman et al., 2012 |
| Кутиназа PmC | Pseudomonas mendocina | Низкокристаллический ПЭТ, ПЭТ пленки | 50 | Ronkvist et al., 2009 | |
| Грибная кутиназа FsC | 1CEX | Fusarium solani pisi | ПЭТ | 30−60 (50) | Ronkvist et al., 2009 |
| Грибная кутиназа HiC | 4OYY | Humicola insolens Thermomyces insolens | ПЭТ Низкокристаллический ПЭТ |
30−85 (80) 70 |
Ribitsch et al., 2012; Ronkvist et al., 2009 |
| Кутиназа Thc_Cut1 | ADV92526.1 | Thermobifida cellulosilytica DSM44535 | ПЭТ | 50 | Acero et al., 2011 |
| Кутиназа Thc_Cut2 | ADV92527.1 | Thermobifida cellulosilytica DSM44535 | ПЭТ | 50 | Acero et al., 2011 |
| Кутиназа Tha_Cut1 | ADV92525.1 | Thermobifida alba DSM43185 | ПЭТ | 50 | Ribitsch et al., 2012 |
| Кутиназа Thf42_Cut1 | ADV92528.1 | Thermobifida fusca DSM44342 | ПЭТ | 50 | Acero et al., 2011 |
| Термостабильная кутиназа TfCut2 | G62A/F209A | Thermobifida fusca | Низкокристаллический ПЭТ | 40‒70 (65) | Furukawa et al., 2019 |
| Липазы ЕС 3.1.1.3 | |||||
| Грибная липаза | EC 3.1.1.3 | Thermomyces insolens | ПЭТ-пленка с низкой кристаличностью | 50‒80 (60) | Ronkvist et al., 2009 |
| Термофильная грибная липаза TLL | Thermomyces lanuginosus | ПЭТ | 55‒60 | Fernandez-Lafuente, 2010 | |
| Липаза | CCUG 33812 | Aspergillus oryzae | ПЭТ, ПЭТ упаковочный | 40 | Wang et al., 2008 |
| Липаза ETE Lipase | L 4777 | Candida antarctica | ПЭТ упаковочный | 30‒90 (40) | Andersen, 1999 |
| Липаза | Triticum aestivum | ПЭТ-олигомеры | 25 | Nechwatal et al., 2006 | |
| Лакказа ScL | Streptomyces coelicolor | ПЭТ упаковочный | 55 | Liu et al., 2008 | |
Кутиназы (E.C. 3.1.1.74) имеют широкую субстратную специфичность и проявляют гидролитическую активность как в отношении нерастворимых триглицеридов (типичные субстраты липаз), так и растворимых сложных эфиров (субстраты эстераз) (Taniguchi, 2019). Среди продуцентов кутиназ, которые гидролизуют ПЭТ, описаны представители Fusarium solani, Thermobifida fusca, Thermobifida cellulolysilitica, Humicola insolens и Pseudomonas mendocina. Ферментативный гидролиз ПЭТ при участии кутиназ относят к так называемой поверхностной эрозии синтетических полимеров (Zhang et al., 2004; Wei et al., 2014). В отличие от других ферментов, разлагающих биополимеры, (например, целлюлозу или полигидроксиалканоаты), специфические связывающие домены, ответственные за адсорбцию клеток к субстрату, в кутиназах отсутствуют (Chen et al., 2013; Wei et al., 2014). Их адсорбция на поверхности ПЭТ определяется гидрофобными участками, находящимися в непосредственной близости от каталитического центра фермента, что было показано на примере нескольких кутиназ Thermobifida (Herrero Acero et al., 2011). Авторы показали, что именно различия в электростатических и гидрофобных свойствах поверхности кутиназ из T. cellulolysilitica и T. fusca определяют различия в их гидролитической активности, что приводит к высоким выходам продуктов гидролиза у T. fusca. Кутиназы более активны в отношении биоразложения ПЭТ, среди них много термостабильных ферментов, которые способны вызывать значительную потерю веса аморфных ПЭТ-пленок (Wei et al., 2016). Кутиназы из гриба Fusarium solani и бактерии Pseudomonas mendocina действуют при 50°C, а кутиназа, выделенная из гриба Humilica insolens, проявляет термостабильность в диапазоне 70‒80°C, однако их активность в 10 раз выше при использовании ПЭТ с 7% кристалличности, чем при использовании пластика с 35% кристалличности (Ronkvist et al., 2009).
Фермент ПЭТаза (ПЭТ-гидролаза; ЕС 3.1.1.101) из Ideonella sakaiensis 201-F6 (Yoshida et al., 2016), сходен по данным секвенирования с кутиназами, но имеет более широкий активный центр с дополнительными дисульфидными мостиками (Kawai et al., 2020). Этот фермент проявляет наивысшую гидролитическую активность в отношении ПЭТ с низкой кристалличностью при температуре окружающей среды, но он не термоустойчив, что отличает его от других кутиназ, которые проявляют высокую термостабильность.
Ферменты эстеразы (3.1) действуют на границе раздела между водной средой и нерастворимыми в воде субстратами. На примере эстеразы Clostridium botulinum обнаружена важная роль цинк-связывающего домена в ПЭТ-гидролитической активности этих анаэробных бактерий, отличающая эти ферменты от кутиназ аэробных микроорганизмов (Biundo et al., 2018; Kawai et al., 2019). Генная инженерия и введение определенных мутаций по этому участку эстераз облегчали адсорбцию Clostridium botulinum на ПЭТ и повышали гидролитическую активность (Biundo et al., 2016). Эстеразы гидролизуют сложные эфиры с алифатической областью с преимущественно более короткой цепью по сравнению с теми, которые подвергаются действию липаз (Freddi et al., 2011). Поэтому лишь незначительное число эстераз, таких как п-нитробензилэстераза, выделенная из Bacillus subtilis (BsEstB), способны участвовать в гидролизе ПЭТ (Ribitsch et al., 2011). Эстеразы обладают меньшим потенциалом для поверхностного гидролиза сложных полиэфиров, чем кутиназы или липазы, однако эстераза Thermobifida Thh_Est обладает активностью для поверхностного гидролиза ПЭТ, сравнимой с кутиназами из того же рода (Ribitsch et al., 2012).
Липазы (ЕС 3.1.1.3) проявляют низкую активность в отношении биодеградации ПЭТ из-за ограниченной доступности к субстрату (Zimmermann, Billig, 2011). Имеются данные о деградации ПЭТ липазами из дрожжей Candida cylindracea, мицелиального гриба Aspergillus oryzae и бактерии Pseudomonas sp. (Wang et al., 2008; Ma et al., 2012; Maurya et al., 2020).
Для полиэстеразы, выявленной у Penicillium citrinum, была показана частичная биодеградация ПЭТ и модельного субстрата бис-(бензоилоксиэтил) терефталата (3ПЭТ) с высвобождением продуктов разложения моно-(2-гидроксиэтил) терефталата и бис-(2-гидроксиэтил) терефталата, однако количество терефталиевой кислоты было незначительным (Liebminger et al., 2007). Среди известных своей ПЭТ-гидролазной активностью отмечают рекомбинантную термостабильную полиэстеразу из дрожжей Saccharomonospora viridis AHK190 (Kawai et al., 2014), рекомбинантную эстеразу, выделенную исходно из Thermobifida halotolerans и способную деполимеризовать ПЭТ с образованием TA и MHEТ (Ribitsch et al., 2012), а также нитробензилэстеразу из Bacillus subtilis (Ribitsch et al., 2011).
Имеется некоторое количество работ, посвященное механизмам разложения ПС. Слабыми участками полимерной цепи полистирола являются третичные атомы углерода, присоединенные к фенильным группам. Именно они уязвимы для атаки свободных радикалов, и ряд химических реакций может здесь привести к разрыву цепи и инициировать образование карбонильных групп (Niessner, Gausepohl, 2003). Образование карбонильных групп, а также пероксидных групп ускоряет деградацию полимера (Meekum, Kenharaj, 2002; Botelho et al., 2004).
Первыми этапами процесса могут быть ферментативная деполимеризация, воздействие агрессивных метаболитов микроорганизмов и химическая реакция полимера с имеющимися в нем добавками (Milstein et al., 1992; Mooney et al., 2006; Krueger et al., 2015; Tischler et al., 2015; Ho et al., 2018; Chauhun et al., 2018). Предполагается, что растущие на поверхности полистирола микроорганизмы должны образовывать ферменты или выделять агрессивные метаболиты, способствующие разложению полимера на олигомеры и мономеры, однако пока неизвестно ни одного микробного фермента, который мог бы разлагать ПС. Предполагают, что это могут быть грибные лигнинпероксидазы. Сильное деградирующее действие на полимерные материалы оказывают выделяемые плесневыми грибами органические кислоты (лимонная, щавелевая, янтарная, уксусная, глюконовая, молочная, фумаровая). При совместном развитии нескольких видов плесневых грибов они могут обмениваться производимыми органическими кислотами, тем самым обеспечиваются подходящие жизненные условия на ПС даже для таких грибов, для которых этот полимер непригоден при развитии в виде чистой культуры.
На втором этапе происходит биодеградация олиго- и мономеров, в частности стирола. Преобладающим путем окисления является путь боковой цепи стирола (так называемый “верхний” путь) (Oelschlaegel et al., 2018). Стирол в аэробных условиях непосредственно окисляется монооксигеназой стирола с образованием эпоксида стирола, который затем окисляется до фенилацетальдегида изомеразой оксида стирола. Далее эта молекула катаболизируется в фенилуксусную кислоту дегидрогеназой. Фенилуксусная кислота преобразуется в фенилацетил-КоА с помощью лигазы и затем подвергается деароматизации в нескольких ферментативных реакциях, чтобы окончательно войти в ЦТК через образование ацетил-КoA и сукцинил-КoA (изучено у представителей родов Pseudomonas, Xanthobacter, Rhodococcus, Corynebacterium).
Pseudomonas putida CA-3 может накапливать полигидроксиалканоаты при выращивании на стироле (O’Leary et al., 2005), используя оригинальный путь биодеградации (“нижний” путь). Он включает окисление ароматического кольца с последующим вступлением в цикл β-окисления и превращением в ацетил-КоА. Ацетил-КоА может затем либо входить в ЦТК, либо в путь биосинтеза жирных кислот de novo, который даст в качестве конечного продукта полигидроксиалканоаты средней длины. У уже упоминавшегося штамма Bacillus paralicheniformis, выделенного из донных отложений Аравийского моря и способного разрушать 34% от общей массы пленки ПС за 60 сут, были идентифицированы гены, кодирующие ферменты монооксигеназу, диоксигеназу, пероксидазу, эстеразу и гидролазу, участвующие в деградации ПС.
Гены, отвечающие за окисление боковой цепи, часто располагаются в одном консервативном генном кластере, обозначаемом styABC (D). Гены styA и styB кодируют монооксигеназный комплекс, обуслoвливающий деградацию стирола. Монооксигеназа стирола представляет собой двухкомпонентный флавопротеин, который катализирует НАДН-и ФАД-зависимое эпоксидирование стирола до оксида стирола. StyA является монооксигеназой, а StyB функционирует как флавин-адениндинуклеотидредуктаза для снабжения StyA необходимыми электронами. Ген styC кодирует изомеразу стирола, а styD – фенилацетальдегиддегидрогеназу (Oelschlaegel et al., 2012; Morrison et al., 2013; Crabo et al., 2017; Oeleschlaegel et al., 2018).
ПУТИ ИНТЕНСИФИКАЦИИ ПРОЦЕССА БИОДЕГРАДАЦИИ ПЛАСТИКОВ
Исследование процесса разложения пластиков неизменно сопровождается поисками путей его ускорения. Скорость разложения полимера микроорганизмами в первую очередь зависит от площади контактной поверхности, поэтому для ускорения процесса деградации используются тонкие полимерные пленки или порошок (Montazer et al., 2020).
Для ускорения процесса деградации часто используют различные физические воздействия на пластик, меняющие его структуру и делающие ее более доступной для биодеградации. Наиболее часто используют ультрафиолетовое излучение (УФ) и термическую обработку. Так, было показано, что скорость биодеградации ПЭНП может быть увеличена путем его предварительной фото- или термической обработки (Volke-Sepúlveda et al., 2002; Chatterjee et al., 2010). Под влиянием этих воздействий меняется степень кристалличности ПЭ и его морфологические особенности, снижается размер полимерной цепи, образуются окисленные группы, такие как карбоксил, карбонил и гидроксил, что ускоряет процесс разложения полимера микроорганизмами (Albertsson, 1980; Hadad et al., 2005, Esmaeili et al., 2013). Продолжительность УФ обработки должна составлять не менее 250 ч, а температуры (70‒80°С) ‒ не менее суток (Yamada-Onodera et al. 2001; Abrusci et al., 2011, Montazer et al., 2019).
Аналогичные эффекты УФ облучения и термической обработки наблюдаются и при разложении ПЭТ. Его сложноэфирные связи, более подверженные биоразложению, например, микробными эстеразами или липазами, оказываются экранированы ароматическими группами, вследствие чего вся структура пластика остается устойчивой к биоразложению (Webb et al., 2013). Дополнительные воздействия, такие как УФ облучение, а также термическая обработка, значительно усиливают действие микробных гидролитических ферментов (Wei, Zimmermann, 2017).
Образованию карбонильных групп в ПЭ способствует предобработка кислотой, что повышает степень биодеградации полимера. При исследовании микробного разложения ПЭНП использовалась предобработка его порошка 65%-ым раствором азотной кислоты в течение 10 сут (Rajandas et al., 2012) или 99% раствором азотной кислоты в течение 6 сут (Hasan et al., 2007). В обоих случаях, согласно данным Фурье-инфракрасной спектроскопии, было показано увеличение биодеградации ПЭ. Было также показано, что при сочетании фотоокисления и химической предобработки под действием азотной кислоты наблюдали синергетический эффект повышения скорости биодеградации (Hasan et al., 2007).
Активно исследуется влияние температуры культивирования на процесс разложения полимеров. Так, сообщается о высокой способности к деградации пластика термофильными бактериальными консорциумами Brevibacillus spp. и Aneurinibacillus sp. (Skariyachan et al., 2008). При сравнении процесса деградации ПЭ Pseudomonas aeruginosa при 7, 23, 37 и 44°C было показано, что наибольшая убыль субстрата (6.25% за 30 сут) происходила при 44°C (Tamnou et al., 2021).
В решении проблемы разложения ПЭТ одной из основных задач является поиск микроорганизмов с термостабильными и высокоактивными при повышенных температурах ферментами, поскольку при температуре, выше температуры стеклования (65°C) аморфные части полимера становятся более гибкими и доступными для воздействия гидролитических ферментов (Ronkvist et al., 2009).
Одним из важных препятствий к микробной деградации пластиков является их гидрофобность, затрудняющая контакт клеток с поверхностью пластика. Образование поверхностно-активных веществ бактериями является ключевым фактором при бактериальном разложении ПЭ, поскольку секреция молекул биосурфактанта снижает поверхностное натяжение и облегчает прикрепление бактерий к поверхности ПЭ (Vimala, Mathew, 2016; Журина и соавт., 2020). Также было показано, что добавление 0.05% минерального масла способствует образованию биопленки и повышает биодеградацию ПЭ (Hadad et al., 2005). Установлено, что при разложении ПЭТ гидролитическая активность ПЭТаз может быть увеличена благодаря использованию анионных поверхностно-активных сурфактантов, что позволит анионизированным поверхностям ПЭТ привлекать больше катионных ПЭТаз (Furukawa et al., 2019).
Процесс разложения пластиков ускоряется при использовании смеси субстратов, когда, помимо пластика, в среде присутствует более доступный источник углерода и энергии. Установлено, что смешивание ПЭ с полимерами природного происхождения, такими как крахмал, может повысить его биоразлагаемость. Было показано, что фермент α-амилаза способен разлагать образцы смеси ПЭНП‒крахмал в водном растворе; при этом вес и предел прочности на разрыв образцов полимера после обработки ферментом уменьшаются на 48 и 87% соответственно (Karimi, Biria, 2019). По данным гель-проникающей хроматографии (ГПХ) было выявлено значительное снижение как молярной массы, так и вязкости ПЭНП более чем на 70 и 60% соответственно. Данные этих экспериментов показали, что основная цепь полимера, а также боковые ответвления были расщеплены ферментом, что позволяет предположить, что α-амилаза оказывает смешанный ко-метаболический эффект на биодеградацию ПЭНП в смесях полимер‒крахмал.
Также было замечено, что в бинарных биопленках процессы биоразрушения протекают интенсивнее, когда партнеры составляют трофическую цепь, в которой один штамм может осуществлять первичную модификацию полимерной цепи, а другой ‒ потреблять образующиеся промежуточные продукты. Важной дополнительной функцией одного из компонентов микробной ассоциации может быть способность к образованию биосурфактантов, которые помогают метаболизировать нерастворимые в воде соединения (Плакунов и соавт., 2020). При разложении ПС смешанными культурами (как правило, на первых стадиях разрушения пластика) возможно воздействие на полимер агрессивных продуктов метаболизма (например, кислот), продуцируемых компонентами сообщества, растущими на доступных источниках углерода и энергии и не образующих ферментов прямого воздействия на полимер (Naz et al., 2013; Ho et al., 2018; Chauhan et al., 2018).
ЗАКЛЮЧЕНИЕ
Накопление пластиковых отходов в окружающей среде однозначно свидетельствует о том, что природные микробные сообщества не справляются с их разложением. Действительно, все экспериментальные данные свидетельствуют о том, что достоверно регистрируемый процесс разложения пластиков идет очень медленно. Тем не менее, результаты активных и многогранных исследований последних лет свидетельствуют о том, что микроорганизмы и в этой, казалось бы, безнадежной борьбе демонстрируют свое могущество. Прежде всего, поражает разнообразие грибов и бактерий, для которых была доказана способность разлагать различные виды пластиков: это представители разных филумов, при этом имеющих большое количество культивируемых представителей – Proteobacteria, Firmicutes, Actinobacteria и др. Можно предположить, что в действительности разнообразие прокариот, разлагающих пластики, гораздо больше. Следует отметить также, что далеко не все экологические ниши были исследованы на предмет присутствия в них микроорганизмов, способных к разложению пластиков, и, возможно, расширение спектра исследуемых местообитаний приведет к выделению новых целевых микроорганизмов. Лишь очень небольшое количество работ посвящено анаэробному разложению пластиков; между тем, эти процессы, безусловно, заслуживают внимания исследователей, так как анаэробные местообитания широко распространены на нашей планете, в том числе и в глубинных, лишенных кислорода слоях мусорных полигонов. Необыкновенно интересные результаты были получены при исследовании беспозвоночных животных, которые с помощью микробных симбионтов усваивают труднодоступные субстраты, например, воска. Можно предположить, что таких симбиотических сообществ существует гораздо больше, причем в местообитаниях самого разного типа. Среди биотопов, перспективных для поиска новых микроорганизмов, способных к разложению пластиков, можно назвать экстремальные местообитания, где на пластики будут воздействовать и физико-химические факторы, и устойчивые к этим факторам микроорганизмы.
Примером успешного исследования механизмов разложения пластиков можно считать быстро продвигающиеся исследования ферментов, вызывающих разложение ПЭТ. Рекомбинантные ПЭТазы демонстрируют высокую скорость разложения полимерного субстрата, причем важным фактором является их термостабильность, позволяющая вести процесс при высоких температурах. Этот несомненный успех дает возможность надеяться на создание в недалеком будущем технологии ферментативной переработки ПЭТ.
Можно предположить, что в ближайшие годы количество работ, посвященных микробному разложению пластиков, будет только увеличиваться. Это обусловливает необходимость разработки единых протоколов исследования процессов биодеградации пластиков, что позволит ученым из разных стран действовать единым образом при решении этой очень трудной и важной задачи.
Список литературы
Бартнев Г.М., Френкель С.Я. Физика полимеров / Под ред. Ельяшевич А.М. Л.: Химия, 1990.
Брацыхин Е.А., Шульгина Э.С. Технология пластических масс. Учебное пособие для техникумов. 3-е изд. перераб. и дополн. Л.: Химия, 1982.
Галыгин В.Е., Баронин Г.С., Таров В.П., Завражин Д.О. Современные технологии получения и переработки полимерных и композиционных материалов. Тамбов: Изд-во ФГБОУ ВПО “ТГТУ”, 2012. 180 с.
Журина М.В., Ганнесен А.В., Мартьянов С.В., Плакунов В.К. Экспресс-метод определения взаимосвязи биокоррозии полиэтилена биопленками Chromobacterium violaceum с их способностью формировать внеклеточный полимерный матрикс // Микробиология. 2020. Т. 89. С. 52–58.
Zhurina M.V., Gannesen A.V., Martyanov S.V., Plakunov V.K. Express method for determining the relation between polyethylene biocorrosion by Chromobacterium violaceum biofilms and their ability to form extracellular matrix // Microbiology (Moscow). 2020. V. 89. P. 44‒.
Захаров В.А., Микенас Т.Б., Никитин В.Е., Мозгунова Н.В. Патент РФ № 2346006. Катализатор и способ получения сверхвысокомолекулярного полиэтилена с использованием этого катализатора. Опубл. 10.02.2009. Бюл. № 4.
Кудряшова Д.П. Тенденции мирового рынка сверхвысокомолекулярного полиэтилена // Вестник химической промышленности. 2020. http://vestkhimprom.ru/posts/tendentsii-mirovogo-rynka-sverkhvysokomolekulyarnogo-polietilena
Лаптев А.Б., Николаев Е.В., Куршев Е.В., Горяшник Ю.С. Особенности биодеструкции термопластов на основе полиэфиров в различных климатических зонах. 2019. http://viam-works.ru
Мельникова М.А. Полимерные материалы: свойства, практическое применение. Благовещенск: Амурский гос. ун-т, 2013. 86 с.
Описание и марки полимеров // Полимерные материалы. Изделия Оборудование Технологии. http://www.polymerbranch.com/catalogp/view/3.html
Плакунов В.К., Ганнесен А.В., Мартьянов С.В., Журина М.В. Биокоррозия синтетических пластмасс: механизмы деградации и способы защиты // Микробиология. 2020. Т. 89. С. 631.
Plakunov V.K., Gannesen A.V., Mart’yanov S.V., Zhurina M.V. Biocorrosion of synthetic plastics: degradation mechanisms and methods of protection // Microbiology (Moscow). 2020. V. 89. P. 647.
Сажин Б.И., Лобанов А.М., Романовская О.С., Эйдельнант М.П., Койков С.Н., Шуваев В.П., Борисова М.Э. Электрические свойства полимеров / Под ред. Сажина Б.И. Л.: Химия, 1986. 224 с.
Справочник химика 21. Химия и химическая технология. https://www.chem21.info/
Турова Т.П., Соколова Д.Ш., Назина Т.Н., Груздев Д.С., Лаптев А.Б. Филогенетическое разнообразие микробных сообществ с поверхности полиэтилентерефталатных материалов при экспозиции в водных срелах // Микробиология. 2020. Т. 89. № 1. С. 99–110.
Tourova T.P., Sokolova D.S., Nazina T.N., Gruzdev D.S., Laptev A.B. Phylogenetic diversity of microbial communities from the surface of polyethylene terephthalate materials exposed to different water environments // Microbiology (Moscow). 2020. V. 89. P. 96–106.
Химия и технология синтетических высокомолекулярных соединений. Карбоцепные полимеры / Под ред. Школиной М.А. М.: “Наука”, 1967. 852 с.
Шевлик Н.В., Строганова С.С., Тычинская Л.Ю., Коваль В.Н., Щербина Л.А. Синтез и свойства аморфного светопрозрачного С-ПЭТ // Полимерные материалы и технологии. 2016. Т. 2. С. 35.
Abrusci C., Pablos J.L., Corrales T., López-Marín J., Marín I., Catalina F. Biodegradation of photo-degraded mulching films based on polyethylenes and stearates of calcium and iron as pro-oxidant additives // Int. Biodeterior. Biodegrad. 2011. V. 65. P. 451.
Abrusci C., Pablos J.L., Marín I., Espí E., Corrales T., Catalina F. Comparative effect of metal stearates as pro-oxidant additives on bacterial biodegradation of thermal- and photo-degraded low density polyethylene mulching films. // Int. Biodeterior. Biodegrad. 2013. V. 83. P. 25–32. doi: 10.1016/j.ibiod.2013.04.002.
Acero E.H., Ribitsch D., Steinkellner G., et al. Enzymaticsurface hydrolysis of PET: Effect of structural diversityon kinetic properties of cutinases from Thermobifida //Macromolecules. 2011. V. 44. P. 4632–4640. Ahebnazar Z., Shojaosadati S.A., Mohammad-Taheri M., Nosrati M. Biodegradation of low-density polyethylene (LDPE) by isolated fungi in solid waste medium // Waste Manag. 2010. V. 30. P. 396.
Albertsson A.C., Karlsson S. The influence of biotic and abiotic environments on the degradation of polyethylene // Prog. Polym. Sci. 1990. V. 15. P. 177. https://doi.org/10.1016/0079-6700(90)90027-X
Ali M.I., Ahmed S., Robson G., Javed I., Ali N., Atiq N., Hameed A. Isolation and molecular characterization of polyvinyl chloride (PVC) plastic degrading fungal isolates // J. Basic Microbiol. 2014. V. 54. P. 18.
Ammala A., Bateman S., Dean K., Petinakis E., Sangwan P., Wong S. An overview of degradable and biodegradable polyolefins // Prog. Polym. Sci. 2011. V. 36. P. 1015–1049. https://doi.org/10.1016/j.progpolymsci.2010.12.002
Andersen B.K., Borch K., Abo M., Damgaard B. Method of treating polyester fabrics. US 5997584. 1999. Andredy A. Assessment of environmental biodegradation of synthetic polymers // J. Macromol. Sci. Part C. Polymer Reviews. 1994. V. 34. P. 25.
Anwar M.S., Kapri A., Chaudhry V., Mishra A., Ansari M.W., Souche Y., Nautiyal C.S., Zaidi M.G.H., Goel R. Response of indigenously developed bacterial consortia in progressive degradation of polyvinyl chloride // Protoplasma. 2016. V. 253. P. 1023.
Arkatkar A., Arutchelvi J., Bhaduri S., Uppara P.V., Doble M. Degradation of unpretreated and thermally pretreated polypropylene by soil consortia. // Int. Biodeterior. Biodegrad. 2009. V. 63. P. 106.
Arutchelvi J., Sudhakar M., Arkatkar A., Doble M., Bhadur S., Uppara P.V. Biodegradation of polyethylene and polypropylene // Indian J. Biotechnol. 2008. V. 7. P. 9.
Asmita A., Shubhamsingh T., Tejashree S. Isolation of plastic degrading micro-organisms from soil samples collected at various locations in Mumbai, India // Int. Res. J. Environ. Sci. 2015. V. 4. P. 77.
Atiq N., Safia A., Ali M.I., Andleeb S. Isolation and identification of polystyrene biodegrading bacteria from soil // Afr. J. Microbiol. Res. 2010. V. 4. P. 1537.
Atlas R.M., Bartha R. Biogeochemical cycling: Nitrogen, sulfur, phosphorus, iron, and other elements // Microbial Ecology: Fundamentals and Applications. Menlo Park, CA: The Benjamin/Cummings Publishing Company, Inc., 1987. P. 333.
Austin H.P., Allen M.D., Donohoe B.S., Rorrer N.A., Kearns F.L., Silveira R.L. Characterization and engineering of a plastic degrading aromatic polyesterase. // Proc. Natl. Acad. Sci. U.S.A. 2018. V. 115. E4350–E4357.
Auta H.S., Emenike C., Fauziah S.H. Distribution and importance of microplastics in the marine environment: A review of the sources, fate, effects, and potential solutions. // Environ. Intern. 2017b. V. 102. DOI: 10.1016/j.envint.2017.02.013.
Auta H.S., Emenike C.U., Jayanthi B., Fauziah S.H. Growth kinetics and biodeterioration of polypropylene microplastics by Bacillus sp. and Rhodococcus sp. isolated from mangrove sediment // Marine Pollut. Bull. 2018. V. 127. P. 15.
Barth M., Oeser T., Wei R., Then J., Schmidt J., Zimmermann W. Effect of hydrolysis products on the enzymatic degradation of polyethylene terephthalate nanoparticles by a polyester hydrolase from Thermobifida fusca // Biochem. Eng. J. 2015. V. 93. P. 222. https://doi.org/10.1016/J.BEJ.2014.10.012
Berk S., Ebert H., Teitell L. Utilization of plasticizers and related organic compounds by fungi // Ind. Eng. Chem. 1957. V. 49. P. 1115.
Bhatia M., Girdhar A., Tiwari A., Nayarisseri A. Implications of a novel Pseudomonas species on low density polyethylene biodegradation: an in vitro to in silico approach // SpringerPlus. 2014. V. 3. Art. 497. P. 1. https://doi.org/10.1186/2193-1801-3-497
Billen P., Khalifa, L., Van Gerven F., Tavernier S., Spatari S. Technological application potential of polyethylene and polystyrene biodegradation by macro-organisms such as mealworms and wax moth larvae // Sci. Total Environ. 2020. V. 735. Art. 139521. https://doi.org/10.1016/j.scitotenv.2020.139521
Biundo A., Ribitsch D., Steinkellner G., Gruber K., Guebitz G.M. Polyester hydrolysis is enhanced by a truncated esterase: less is more // Biotechnol. J. 2016. V. 12. https://doi.org/10.1002/biot.201600450
Biundo A., Reich J., Ribitsch D., Guebitz G.M. Synergistic effect of mutagenesis and truncation to improve a polyesterase from Clostridium botulinum for polyester hydrolysis // Sci. Rep. 2018. V. 8. P. 3745.
Bollinger A., Thies S., Knieps-Grünhagen E., Gertzen C., Kobus S., Höppner A., Ferrer M., Gohlke H., Smits S.H.J., Ja-eger K. A novel polyester hydrolase from the marine bacterium Pseudomonas aestusnigri – structural and functional insights // Front. Microbiol. 2020. V. 11. Art. 114. https://doi.org/10.3389/fmicb.2020.00114
Bonhomme S., Cuer A., Delort A.M., Lemaire J., Sancelme M., Scott C. Environmental biodegradation of polyethylene // Polym. Degrad. Stab. 2003. V. 81. P. 441.
Booth G.H., Cooper A.W., Robb J.A. Bacterial degradation of plasticized PVC // J. Appl. Bacteriol. 1968. V. 31. P. 305.
Botelho G., Queiros A., Machado A., Frangiosa P., Ferreira J. Enhancement of the thermooxidative degradability of polystyrene by chemical modification // Polym. Degrad. Stab. 2004. V. 86. P. 493.
Boucher J., Friot D. Primary Microplastics in the Oceans: A Global Evaluation of Sources. Gland, Switzerland: IUCN, 2017. P. 43.
Brandon A.M., Gao S.H., Tian R., Ning D., Yang S.S., Zhou J., Wu W.-M., Criddle C.S. Biodegradation of polyethylene and plastic mixtures in mealworms (larvae of Tenebrio molitor) and effects on the gut microbiome // Environ. Sci. Technol. 2018. V. 52. P. 6526. https://doi.org/10.1021/acs.est.8b02301
Brandon J.A., Jones W., Ohman M.D. Multidecadal increase in plastic particles in coastal ocean sediments // Sci. Adv. 2019. V. 5. Art. eaax0587. https://doi.org/10.1126/sciadv.aax0587
Chatterjee S., Roy B., Roy D., Banerjee R. Enzyme-mediated biodegradation of heat treated commercial polyethylene by Staphylococcal species // Polym. Degrad. Stab. 2010. V. 95. P. 195. https://doi.org/10.1016/j.polymdegradstab.2009.11.025
Chaudhary A.K., Vijayakumar R. Studies on biological degradation of polystyrene by pure fungal cultures // Environ. Dev. Sustain. 2019. V. 22. P. 4495.
Chauhan D., Agrawal G., Deshmukh S., Roy S.S., Priyadarshini R. Biofilm formation by Exiguobacterium sp. DR11 and DR14 alter polystyrene surface properties and initiate biodegradation // RSC Adv. 2018. V. 8. P. 37590–37599.
Chen S., Tong X., Woodard R.W., Du G.C., Wu J., Chen J. Identification and characterization of bacterial cutinase // J. Biol. Chem. 2008. V. 283. P. 25854.
Chen S., Su L., Chen J., Wu J. Cutinase: characteristics, preparation and application // Biotechnol. Adv. 2013. V. 31. P. 1754. https://doi.org/10.1016/j.biotechadv.2013.09.005
Crabo A.G., Singh B., Nguyen T., Emami S., Gassner G.T., Sazinsky M.H. Structure and biochemistry of phenylacetaldehyde dehydrogenase from the Pseudomonas putida S12 styrene catabolic pathway // Arch. Biochem. Biophys. 2017. V. 616. P. 47.
Danso D., Schmeisser C., Chow J. Zimmermann W., Wei R., Leggewie C., Li X., Hazen T., Streit W. R. New insights into the function and global distribution of polyethylene terephthalate (PET)-degrading bacteria and enzymes in marine and terrestrial metagenomes // Appl. Environ. Microbiol. 2018. V. 84. e02773-17.
Das G., Bordoloi N.K., Rai S.K., Mukherjee A.K., Karak N. Biodegradable and biocompatible epoxidized vegetable oil modified thermostable poly(vinyl chloride): Thermal and performance characteristics post biodegradation with Pseudomonas aeruginosa and Achromobacter sp. // J. Hazard. Mat. 2012. V. 209–210. P. 434–442.
Das M.P., Kumar S. An approach to low-density polyethylene biodegradation by Bacillus amyloliquefaciens // 3 Biotech. 2015. V. 5. P. 81–86.
Delacuvellerie A., Cyriaque V., Gobert S., Benali S., Wattiez R. The plastisphere in marine ecosystem hosts potential specific microbial degraders including Alcanivorax borkumensis as a key player for the low-density polyethylene degradation // J. Hazard. Mater. 2019. V. 380. e120899. https://doi.org/10.1016/j.jhazmat
de Stephanis R., Giménez J., Carpinelli E., Gutierrez-Exposito C., Cañadas A. As main meal for sperm whales: plastics debris // Mar. Pollut. Bull. 2013. V. 69. P. 206‒214.
Devi R.S., Kannan V.R., Natarajan K., Nivas D., Kannan K., Chandru S., Antony A.R. The role of microbes in plastic degradation // Environmental Waste Management / Ed. Ram Chandra. Taylor & Francis Group, LLC, 2016. P. 341‒370.
Dresler K., van den Heuvel J., Muller R.J., Deckwer W.D. Production of a recombinant polyester-cleaving hydrolase from Thermobifida fusca in Escherichia coli // Bioproc. Biosyst. Eng. 2006. V. 29. P. 169–183.
El-Shafei H., EI-Nasser N.H.A., Kansoh A.L., Ali A.M. Biodegradation of disposable polyethylene by fungi and Streptomyces species // Polym. Degrad. Stab. 1998. V. 62. P. 361–365.
Esmaeili A., Pourbabaee A.A., Alikhani H.A., Shabani F., Esmaeili E. Biodegradation of low-density polyethylene (LDPE) by mixed culture of Lysinibacillus xylanilyticus and Aspergillus niger in soil // PLoS One. 2013. V. 8. e71720.
Eubeler J.P., Bernhard M., Knepper T.P. Environmental biodegradation of synthetic polymers: Biodegradation of different polymer groups // Trends Analyt. Chem. 2010. V. 29. P. 84–100.
Fernandez-Lafuente R. Lipase from Thermomyces lanuginosus: Uses and prospects as an industrial biocatalyst // J. Mol. Catal. B: Enzymatic. 2010. V. 62. P. 197–212.
Fontanella S., Bonhomme S., Koutny M., Husarova L., Brusso J.M., Courdavault J.P., Pitteri S., Samuel G., Pichon G., Lemaire J., Delort A.-M. Comparison of the biodegradability of various polyethylene films containing pro-oxidant additives // Polym. Degrad. Stab. 2010. V. 95. P. 1011–1021. https://doi.org/10.1016/j.polymdegradstab.2010.03.009
Freddi G., Schwab H., Guebitz G.M. Hydrolysis of polyethyleneterephthalate by p-nitrobenzylesterase from Bacillus subtilis // Biotechnol. Prog. 2011. V. 27. P. 951−960.
Furukawa M., Kawakami N., Tomizawa A., Miyamoto K. Efficient degradation of poly(ethylene terephthalate) with Thermobifda fusca cutinase exhibiting improved catalytic activity generated using mutagenesis and additive-based approaches // Sci. Rep. 2019. V. 9. Art. 16038.
Gall S.C., Thompson R.C. The impact of debris on marine life // Marine Pollut. Bull. 2015. V. 92. P. 170‒179.
Gallo F., Fossi C., Weber R., Santillo D., Sousa J., Ingram I., Nadal A., Romano D. Marine litter plastics and microplastics and their toxic chemicals components: the need for urgent preventive measures // Environ. Sci. Eur. 2018. V. 30. P. 13.
Geyer R., Jambeck, J., Law K.L. Production, use, and fate of all plastics ever made. // Sci. Adv. 2017. 3:e1700782. doi: 10.1126/sciadv.1700782.
Ghatge S., Yang Y., Ahn J.-A., Hur H.-G. Biodegradation of polyethylene: a brief review // Appl. Biol. Chem. 2020. V. 63. Art. 27. https://doi.org/10.1186/s13765-020-00511-3
Giacomucci L., Raddadi N., Soccio M., Lotti N., Fava F. Polyvinyl chloride biodegradation by Pseudomonas citronellolis and Bacillus flexus // New Biotechnol. 2019. V. 52. P. 35–41.
Gilan I., Hadar Y., Sivan A. Colonization, biofilm formation and biodegradation of polyethylene by a strain of Rhodococcus ruber // Appl. Microbiol. Biotechnol. 2004. V. 65. P. 97–104.
Gravouil K., Ferru-Clément R., Colas S., Helye R., Kadri L., Bourdeau L., Moumen B., Mercier A., Ferreira T. Transcriptomics and lipidomics of the environmental strain Rhodococcus ruber point out consumption pathways and potential metabolic bottlenecks for polyethylene degradation // Environ. Sci. Technol. 2017. V. 51. P. 5172–5181.
Guillet J.E., Regulski T.W., McAneney T.B. Biodegradability of photodegraded polymers. II. Tracer studies of biooxidation of Ecolyte PS polystyrene // Environ. Sci. Technol. 1974. V. 8. P. 923–925. https://doi.org/10.1016/j.chemosphere.2008.07.035
Hadad D., Geresh S., Sivan A. Biodegradation of polyethylene by the thermophilic bacterium Brevibacillus borstelensis // J. Appl. Microbiol. 2005. V. 98. P. 1093–1100.
Haines J.R. Microbial degradation of high-molecular-weight alkanes // Appl. Microbiol. 1975. V. 28. P. 1084–1085.
Harrison J.P., Boardman C., O’Callaghan K., Delort A.M., Song J. Biodegradability standards for carrier bags and plastic films in aquatic environments: A critical review // R. Soc. Open Sci. 2018. V. 5. Art. 171792. https://doi.org/10.1098/rsos.171792
Harshvardhan K., Jha B. Biodegradation of low-density polyethylene by marine bacteria from pelagic waters, Arabian Sea, India // Marine Pollut. Bull. 2013. V. 77. P. 100‒106.
Hasan F., Shah A.A., Hameed A., Ahmed S. Synergistic effect of photo and chemical treatment on the rate of biodegradation of low density polyethylene by Fusarium sp. AF4 // J. Appl. Polym. Sci. 2007. V. 105. P. 1466–1470. https://doi.org/10.1002/app.26328
Herrero Acero E., Ribitsch D., Steinkellner G., Gruber K., Greimel K., Eiteljoerg I., Trotscha E., Wei R., Zimmermann W., Zinn M., Cavaco-Paulo A., Freddi G., Schwab H., Guebitz G. Enzymatic surface hydrolysis of PET: Effect of structural diversity on kinetic properties of cutinases from Thermobifida // Macromolecules. 2011. V. 44. P. 4632–4640.
Hidayat T.R., Indrawati I., Herlina T. Biodegradation styrofoam by soil bacteria from Sarimukti Cipatat Bandung final disposal site // AL-Kaunivah J. Biol. 2020. V. 13. P. 218‒227.
Ho B.T., Roberts T.K., Lucas S. An overview on biodegradation of polystyrene and modified polystyrene: the microbial approach // Crit. Rev. Biotechnol. 2018. V. 38. P. 308–320.
Horton A.A., Walton A., Spurgeon D.J., Lahive E., Svendsen C. Microplastics in freshwater and terrestrial environments: Evaluating the current understanding to identify the knowledge gaps and future research priorities // Sci. Total Environ. 2017. V. 586. P. 127‒141.
Hu X., Thumarat U., Zhang X., Tang M., Kawai F. Diversity of polyester-degrading bacteria in compost and molecular analysis of a thermoactive esterase from Thermobifida alba AHK119 // Appl. Microbiol. Biotechnol. 2010. V. 87. P. 771–779. https://doi.org/10.1007/s00253-010-2555-x
Iiyoshi Y., Tsutsumi Y., Nishida T. Polyethylene degradation by lignin-degrading fungi and manganese peroxidase // J. Wood Sci. 1998. V. 44. P. 222–229.
Jambeck J.R., Geyer R., Wilcox C., Siegler T.R., Perryman M., Andrady A., Narayan R., Law K.L. Marine pollution. Plastic waste inputs from land into the ocean // Science. 2015. V. 347. P. 768‒771.
Jeon H.J., Kim M.N. Functional analysis of alkane hydroxylase system derived from Pseudomonas aeruginosa E7 for low molecular weight polyethylene biodegradation // Int. Biodeterior. Biodegrad. 2015. V. 103. P. 141–146.
Jeon H.J., Kim M.N. Isolation of mesophilic bacterium for biodegradation of polypropylene // Int. Biodeter. Biodegr. 2016. V. 115. P. 244–249. doi:10.1016/j.ibiod.2016.08.025 Jeyakumar D., Chirsteen J., Doble M. Synergistic effects of pretreatment and blending on fungi mediated biodegradation of polypropylenes // Bioresour. Technol. 2013. V. 148. P. 78–85.
Kaplan D.L., Roy H., Jim S. Biodegradation of polystyrene, poly(metnyl methacrylate), and phenol formaldehyde // Appl. Environ. Microbiol. 1979. V. 38. P. 551–553.
Karimi M., Biria D. The promiscuous activity of alpha-amylase in biodegradation of low density polyethylene in a polymer-starch blend // Nat. Sci. Rep. 2019. V. 9. Art. 2612.
Kawai F., Watanabe M., Shibata M., Yokoyama S., Sudate Y., Hayashi S. Comparative study on biodegradability of polyethylene wax by bacteria and fungi // Polym. Degrad. Stab. 2004. V. 86. P. 105–114. https://doi.org/10.1016/j.polymdegradstab.2004.03.015
Kawai F., Oda M., Tamashiro T., Waku T., Tanaka N., Ya-mamoto M., Mizushima H., Miyakaw T., Tanokura M. A novel Ca2+-activated, thermostabilized polyesterase capable of hydrolyzing polyethylene terephthalate from Saccharomonospora viridis AHK190 // Appl. Microbiol. Biotechnol. 2014. V. 98. P. 10053−10064.
Kawai F., Kawabata T., Oda M. Current knowledge on enzymatic PET degradation and its possible application to waste stream management and other fields // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 4253‒4268.
Kawai F., Kawabata T., Oda M. Current state and perspectives related to the polyethylene terephthalate hydrolases available for biorecycling // ACS Sustainable Chem. Eng. 2020. V. 8. P. 8894‒8908.
Khatoon N., Jamal A., Ali M.I. Lignin peroxidase isoenzyme: a novel approach to biodegrade the toxic synthetic polymer waste // Environ. Technol. 2019. V. 40. P. 1366–1375.
Kiessling T., Gutow L., Thiel M. Marine litter as habitat and dispersal vector // Marine Anthropogenic Litter / Eds. Bergmann M., Gutow L., Klages M. Springer, Cham. 2015.
Kim H.R., Lee H.M., Yu H.C., Jeon E., Lee S., Li J.J. et al. Biodegradation of polystyrene by Pseudomonas sp. isolated from the gut of superworms (Larvae of Zophobas atratus). Environ. Sci. Technol. 2020. V. 54. P. 6987–6996. doi: 10.1021/acs.est.0c01495 Kimura Y., Oda K. A bacterium that degrades and assimilates poly(ethylene terephthalate) // Science. 2016. V. 351. P. 1196–1199.
Kleeberg I., Hetz C., Kroppenstedt R.M., Müller R.J., Deckwer W.-D. Biodegradation of aliphatic-aromatic copolyesters by Thermomonospora fusca and other thermophilic compost isolates // Appl. Environ. Microbiol. 1998. V. 64. P. 1731–1735. https://doi.org/10.1128/AEM.64.5.1731-1735.1998
Kirbaş Z., Keskin N., Güner A. Biodegradation of polyvinylchloride (PVC) by white rot Fungi // Bull. Environm. Contamin. Toxicol. 1999. V. 63. P. 335–342.
Koutny M., Sancelme M., Dabin C., Pichon N., Delort A., Lemaire J. Acquired biodegradability of polyethylenes containing pro-oxidant additives // Polym. Degrad. Stab. 2006. V. 91. P. 1495–1503. https://doi.org/10.1016/j.polymdegradstab.2005.10.007
Kowalczyk A., Chyc M., Ryszka P., Latowski D. Achromobacter xylosoxidans as a new microorganism strain colonizing high-density polyethylene as a key step to its biodegradation // Environ. Sci. Pollut. Res. 2016. V. 23. P. 11349–11356.
Krueger M.C., Hofmann U., Moeder M., Schlosser D. Potential of wood-rotting fungi to attack polystyrene sulfonate and its depolymerisation by Gloeophyllum trabeum via hydroquinone-driven fenton chemistry // PLoS One. 2015. V. 10. e0131773.
Kühn S., Rebolledo E.L.B., van Franeker J.A. Deleterious effects of litter on marine life // Marine Anthropogenic Litter. 2015.P. 75‒116. KundungalH., Gangarapu M., Sarangapani S., Patchaiyappan A., Devipriya S.P. Efficient biodegradation of polyethylene (HDPE) waste by the plastic-eating lesser waxworm (Achroia grisella). // Environ. Sci. Pollut. Res. Int. 2019. V. 26. P. 18509–18519. doi: 10.1007/s11356-019-05038-9
Kumar G.A., Hinduja M., Sujitha K., Rajan N.N., Dharani G. Biodegradation of polystyrene by deep-sea Bacillus paralicheniformis G1 and genome analysis // Sci. Total Environ. 2021. V. 774. e145002. Kundungal H., Manjari B., Sarangapany S. et al. Efficient biodegradation of polyethylene (HDPE) wate by the plastic-eating lesser waxworm (Achoria grisella). // Environ. Sci. Pollut. Res. 2019. V. 26. P. 18509−18519.
Laist D. Overview of the biological effects of lost and discarded plastic debris in the marine environment. Marine Poll. Bull. 1987. V. 18. P. 319−326. Lau W.W.Y., Shiran Y., Bailey R.M. et al. Evaluating scenarios toward zero plastic pollution // Science. 2020. V. 369. P. 1455‒1461.
Lee J.H., Lim K.S., Hahm W.G., Kim S.H. Properties of recycled and virgin poly(ethylene terephthalate) blend fibers // J. Appl. Polym. Sci. 2013. V. 128. P. 1250–1256.
Liebminger S., Eberl A., Sousa F., Heumann S., Fischer-Colbrie G., Cavaco-Paulo A., Guebitz G.M. Hydrolysis of PET and bis-(benzoyloxyethyl) terephthalate with a new polyesterase from Penicillium citrinum // Biocatal. Biotransform. 2007. V. 25. P. 171–177.
Liu Y., Wu G., Gu L. Enzymatic treatment of PET fabrics for improved hydrophilicity // AATCC Rev. 2008. V. 8. P. 44–48.
Lohse D.J. Polyolefins // Applied Polymer Science: 21st Century / Eds. C.D. Craver, C.E. Carraher. Pergamon, 2000. P. 73‒91. ISBN 9780080434179. https://doi.org/10.1016/B978-008043417-9/50008-8
Lou Y., Pererva E., Yang S.-S., Lu B., Liu B., Ren N., Corvini P.F.-X., Xing D. Bio-degradation of polyethylene and polystyrene by greater wax moth larvae (Galleria mellonella L.) and the effect of co-diet supplementation on the core gut microbiome // Environ. Sci. Technol. 2020. V. 54. P. 2821‒2831. https://doi.org/10.1021/acs.est.9b07044
Lucas N., Bienaime C., Belloy C., Queneudec M., Silvestre F., Nava-Saucedo J.-E. Polymer biodegradation: mechanisms and estimation techniques: a review // Chemosphere. 2008. V. 73. P. 429–442.
Lusher A.L., Hernandez-Milian G., Berrow S., Rogan E., O’Connor I. Incidence of marine debris in cetaceans stranded and bycaught in Ireland: Recent findings and a review of historical knowledge // Environ. Pollut. 2018. V. 232. P. 467‒476.
Luzia M.R.F., Sarrouh B., Lofrano R.C.Z. Evaluation of the biodegradation of phthalic contaminants originated from polyvinyl chloride commercial films // Acta Sci. Technol. 2020. V. 42. e47010.
Macali A., Semenov A., Venuti V., Crupi V., D’Amico F., Rossi B., Corsi I., Bergami E. Episodic records of jellyfish ingestion of plastic items reveal a novel pathway for trophic transference of marine litter // Sci. Rep. 2018. V. 8. Art. 6105. https://doi.org/10.1038/s41598-018-24427-7
Manzur A., Limón-González M., Favela-Torres E. Biodegradation of physicochemically treated LDPE by a consortium of filamentous fungi // J. Appl. Polym. Sci. 2004. V. 92. P. 265–271. https://doi.org/10.1002/app.13644
Marten E., Müller R.J., Deckwer W.D. Studies on the enzymatic hydrolysis of polyesters. II. Aliphatic-aromatic copolyesters // Polym. Degrad. Stab. 2005. V. 88. P. 371−381.
Maurya A., Bhattacharya A., Khare S.K. Enzymatic remediation of polyethylene terephthalate (PET) – based polymers for effective management of plastic wastes: an overview // Front. Bioeng. Biotechnol. 2020. V. 8. Art. 602325.
Meekum U., Kenharaj R. Comparative study of polystyrene foam degradation in the open-air and artificial weathering // Arabian J. Sci. Eng. 2002. V. 27 1C. P. 25–32.
Milstein O., Gersonde R., Huttermann A., Chen M.J., Meister J.J. Fungal biodegradation of lignopolystyrene graft copolymers // Appl. Environ. Microbiol. 1992. V. 58. P. 3225–3232.
Modern Polyesters: Chemistry and Technology of Polyesters and Copolyesters / Eds. Scheirs J., Long T.E. Hoboken, John Wiley & Sons, Ltd. 2003. https://doi.org/10.1002/0470090685
Mohan A.J., Sekhar V.C., Bhaskar T., Nampoothiri K.M. 2016. Microbial assisted high impact polystyrene (HIP) degradation. // Bioresour. Technol. 2016. V. 213. P. 204–207. doi:10.1016https://doi.org/10.1139/cjm-2018-033521 Mohanan N., Sharma P.K., Levin D.B. Characterization of an intracellular poly(3-hydroxyalkanoate) depolymerase from the soil bacterium, Pseudomonas putida LS46. // Polym. Degrad. Stab. 2020. V. 175:109127. doi: 10.1016/j.polymdegradstab.2020.109127Montazer Z.,Habibi Najafi M.B., Levin D.B. Microbial degradation of low-density polyethylene and synthesis of polyhydroxyalkanoate polymers // Can. J. Microbiol. 2019. V. 65. P. 1–11. 10.1139/cjm-2018-0335
Montazer Z., Habibi Najafi M.B., Levin D.B. Challenges with verifying microbial degradation of polyethylene // Polymers. 2020. V. 12. Art. 123. https://doi.org/10.3390/polym12010123
Mooney A., Ward P.G., O’Connor K.E. Microbial degradation of styrene: biochemistry, molecular genetics, and perspectives for biotechnological applications // Appl. Microbiol. Biotechnol. 2006. V. 72. P. 1–10. https://doi.org/10.1007/s00253-006-0443-1
Mor R., Sivan A. Biofilm formation and partial biodegradation of polystyrene by the actinomycete Rhodococcus ruber: biodegradation of polystyrene // Biodegradation. 2008. V. 19. P. 851–858.
Moreno R., Rojo F. Enzymes for aerobic degradation of alkanes in bacteria // Aerobic Utilization of Hydrocarbons, Oils, and Lipids. Handbook of Hydrocarbon and Lipid Microbiology / Ed. Rojo F. Springer Nature Switzerland AG, 2019. P. 118–142.
Morrison E., Kantz A., Gassner G.T., Sazinsky M.H. Structure and mechanism of styrene monooxygenase reductase: new insight into the FAD-transfer reaction // Biochemistry. 2013. V. 52. P. 6063–6075.
Motta O., Proto A., De Carlo F., Santoro E. Brunetti L., Capunzo M. Utilization of chemically oxidized polystyrene as co-substrate by filamentous fungi // Int. J. Hyg. Environ. Health. 2009. V. 212. P. 61‒66. https://doi.org/10.1016/j.ijheh.2007.09.014
Muhonja C.N., Makonde H., Magoma G., Imbuga M. Biodegradability of polyethylene by bacteria and fungi from dandora dumpsite Nairobi-Kenya // PLoS One. 2018. V. 13. e0198446.
Mukherjee S., Kundu P.P. Alkaline fungal degradation of oxidized polyethylene in black liquor: studies on the effect of lignin peroxidases and manganese peroxidases // J. Appl. Polym. Sci. 2014. V. 131. P. 40738.
Müller R.-J. Biodegradability of polymers: regulations and methods for testing // Biopolymers Online. 2005. V. 12. P. 365–388.
Müller R.-J. Biological degradation of synthetic polyesters ‒ Enzymes as potential catalysts for polyester recycling // Proc. Biochem. 2006. V. 41. P. 2124–2128. https://doi.org/10.1016/j.procbio.2006.05.018
Nakamiya K., Hashimoto S., Ito H., Edmonds J.S., Yasuhara A., Morita M. Microbial treatment of bis(2-ethylhexyl) phthalate in polyvinyl chloride with isolated bacteria // J. Biosci. Bioeng. 2005. V. 99. P. 115–119.
Nanda S., Sahu S.S. Biodegradability of polyethylene by Brevibacillus, Pseudomonas, and Rhodococcus spp. // N.Y. Sci. J. 2010. V. 3. P. 95–98.
Naz I., Batool S.A., Naeem A., Khatoon N., Atiq N., Hameed A., Ahmed S. Monitoring of growth and physiological activities of biofilm during succession on polystyrene from activated sludge under aerobic and anaerobic conditions // Environ. Monit. Assess. 2013. V. 185. P. 6881–6892.
Nikolic V., Velickovic S., Popovic A. Biodegradation of polystyrene‒graft‒starch copolymers in three different types of soil // Environ. Sci. Pollut. Res. Int. 2014. V. 21. P. 9877–9886.
Nikolic V., Velickovic S., Antonovic D., Popovic A. Biodegradation of starch–graft–polystyrene and starch–graft–poly(methacrylic acid) copolymers in model river water // J. Serb. Chem. Soc. 2013. V. 78. P. 1425–1441.
Nechwatal A., Blokesch A., Nicolai M., Krieg A., Kolbe A., Wolf M., Gerhardt M. A contribution to the investigation of enzyme-catalysed hydrolysis of poly(ethylene terephthalate) oligomers // Macromol. Mater. Eng. 2006. V. 291. P. 1486–1494.
Niessner N., Gausepohl H. Polystyrene and styrene copolymers ‒ an overview // Modern Styrenic Polymers: Polystyrenes and Styrenic Copolymers / Eds. Scheirs J., Priddy D.B. Chichester, UK: John Wiley & Sons, 2003. Ch. 2. P. 25–41.
Nowak B., Pajak J., Drozd-Bratkowicz M., Rymarz G. Microorganisms participating in the biodegradation of modified polyethylene films in different soils under laboratory conditions // Int. Biodeteror. Biodegr. 2011. V. 65. P. 757–767.
Oelschlägel M., Zimmerling J., Tischler D. A review: the styrene metabolizing cascade of side-chain oxygenation as biotechnological basis to gain various valuable compounds // Front. Microbiol. 2018. V. 9. Art. 490.
Oelschlägel M., Gröning J.A.D., Tischler D., Kaschabek S.R., Schlömann M. Styrene oxide isomerase of Rhodococcus opacus 1CP, a highly stable and considerably active enzyme // Appl. Environ. Microbiol. 2012. V. 78. P. 4330–4337.
Ojeda T., Freitas A., Birck K., Dalmolin E., Jacques R., Bento F., Camargo F. Degradability of linear polyolefins under natural weathering // Polym. Degrad. Stab. 2011. V. 96. P. 703–707. https://doi.org/10.1016/j.polymdegradstab.2010.12.004
O’Leary N.D., O’Connor K.E., Ward P., Goff M., Dobson A.D. Genetic characterization of accumulation of polyhydroxyalkanoate from styrene in Pseudomonas putida CA-3 // A-ppl. Environ. Microbiol. 2005. V. 71. P. 4380–4387.
Orr I.G., Hadar Y., Sivan A. Colonization, biofilm formation and biodegradation of polyethylene by a strain of Rhodococcus ruber // Appl. Microbiol. Biotechnol. 2004. V. 65. P. 97–104. https://doi.org/10.1007/s00253-004-1584-8
Otake Y., Kobayashi T., Asabe H., Murakami N. Biodegradation of low density polyethylene, polystyrene, polyvinyl chloride, and urea formaldehyde resin buried under soil for over 32 years // Appl. Polym. Sci. 1995. V. 56. P. 1789–1796.
Paco A., Duarte K., da Costa J.P., Santos P.S.M., Pereira R., Pereira M.E., Freitas A.C., Duarte A.C., Rocha-Santos T.A.P. Biodegradation of polyethylene microplastics by the marine fungus Zalerion maritimum // Sci. Total Environ. 2017. V. 586. P. 10–15. Pardo-Rodríguez M.L., Zorro-Mateus, P.J.P. Biodegradation of polyvinyl chloride by Mucor sp. and Penicillium sp. isolated from soil. // Revista de Investigación Desarrollo e Innovación: RIDI, ISSN 2027-8306, ISSN-e 2389-9417. 2021. P. 387−400.
Park S.Y., Kim C.G. Biodegradation of micro-polyethylene particles by bacterial colonization of a mixed microbial consortium isolated from a land fill site // Chemosphere. 2019. V. 222. P. 527–533. Peciulyte D. Microbial colonization and biodeterioration of plasticized polyvinyl chloride plastics // Ekologija. 2002. V. 4. P. 7–15.
Peixoto J., Silva L.P., Krüger R.H. Brazilian Cerrado soil revealsan untapped microbial potential for unpretreated polyethylene biodegradation // J. Hazard. Mater. 2017. V. 324. P. 634–644. https://doi.org/10.1016/j.jhazmat.2016.11.037
Peng B.-Y., Su Y., Chen Z., Chen J., Zhou X., Benbow M.E., Criddle C.S., Wu W.-M., Zhang Y. Biodegradation of polystyrene by dark (Tenebrio obscurus) and yellow (Tenebrio molitor) mealworms (Coleoptera: Tenebrionidae) // Environ. Sci. Technol. 2019. V. 53. P. 5256–5265. https://doi.org/10.1021/acs.est.8b06963
Peng B.-Y., Chen Z., Chen J., Yu H., Zhou X., Criddle C.S., Wu W.-M., Zhang Y. Biodegradation of polyvinylchloride (PVC) in Tenebrio molitor (Coleoptera: Tenebrionidae) larvae // Environ. Int. 2020. V. 145. P. 106.
Peng X., Chen M. S., Chen S., Dasgupta H.X., Ta K., Du M., Li J., Guo Z., Bai S. Microplastics contaminate the deepest part of the world’s ocean // Geochem. Persp. Let. 2018. V. 9. P. 1‒5. https://doi.org/10.7185/geochemlet.1829
Pirillo V., Pollegioni L., Molla G. Analytical methods for the investigation of enzyme-catalyzed degradation of polyethylene terephthalate // FEBS J. 2021. Epub ahead of print. PMID: 33792200.https://doi.org/10.1111/febs.15850
Plastics Europe https://www.plasticseurope.org/en/newsroom/events/2021
Pometto A.L., Lee B.T., Johnson K.E. Production of an extracellular polyethylene-degrading enzyme(s) by Streptomyces species // Appl. Environ. Microbiol. 1992. V. 58. P. 731–733.
Pramila R., Ramesh K.V. Biodegradation of low density polyethylene (LDPE) by fungi isolated from municipal landfill area // J. Microbiol. Biotechnol. Res. 2011. V. 1. P. 131–136.
Pramila R., Ramesh K.V. Pontential degradation of low density polyethylene (LDPE) by Acinetobacter baumanii // Afr. J. Bacteriol. Res. 2015. V. 7. P. 24‒28.
Raddadi N., Fava F. Biodegradation of oil-based plastics in the environment: Existing knowledge and needs of research and innovation // Sci. Total Environ. 2019. V. 679. P. 148–158.
Rajandas H., Parimannan S., Sathasivam K., Ravichandran M., Yin L.S. A novel FTIR-ATR spectroscopy based technique for the estimation of low-density polyethylene biodegradation // Polym. Test. 2012. V. 31. P. 1094–1099. https://doi.org/10.1016/j.polymertesting
Reddy M.M., Deighton M., Gupta R.K., Bhattacharya S.N., Parthasarathy R. Biodegradation of oxo-biodegradable polyethylene // J. Appl. Polym. Sci. 2009. V. 111. P. 1426–1432.
Ren L., Men L., Zhang Z., Guan F., Tian J., Wang B., Wang J., Zhang Y., Zhang W. Biodegradation of polyethylene by Enterobacter sp. D1 from the guts of Wax Moth Galleria mellonella // Int. J. Environ. Res. Publ. Health. 2019. V. 16. Art. 1941. https://doi.org/10.3390/ ijerph16111941
Restrepo-Florez J.M., Bassi A., Thompson M.R. Microbial degradation and deterioration of polyethylene ‒ a review // Int. Biodeterior. Biodegr. 2014. V. 88. P. 83–90.
Ribitsch D., Heumann S., Trotscha E., Herrero Acero E., Greimel K., Leber, R., Birner-Gruenberger R., Deller S., E-iteljoerg I., Remler P., Weber T., Siegert P., Maurer K.H., Donelli I., Freddi G., Schwab H., Guebitz G.M. Hydrolysis of polyethylene-terephthalate by p-nitrobenzylesterase from Bacillus subtilis // Biotechnol. Prog. 2011. V. 27. P. 951−960.
Ribitsch D., Herrero Acero E., Greimel K., Dellacher A., Zitzenbacher S., Marold A., Rodriguez R.D., Steinkellner G., Gruber K., Schwab H., Guebitz G.M. A new esterase from Thermobifida halotolerans hydrolyses polyethylene terephthalate (PET) and polylactic acid (PLA) // Polymers. 2012. V. 4. P. 617−629.
Riudavets J., Salas I., Pons M.J. Damage characteristics produced by insect pests in packaging film // J. Stored Prod. Res. 2007. V. 43. P. 564–570. https://doi.org/10.1016/j.jspr.2007.03.006
Rochman C., Hoh E., Kurobe T. et al. Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. // Sci Rep. 2013. V. 3. 3263. https://doi.org/ 10.1038/srep03263. Ronkvist A.M., Xie W.C., Lu W.H., Gross R.A. Cutinase catalyzed hydrolysis of poly(ethylene terephthalate) // Macromolecules. 2009. V. 42. P. 5128−5138.
Ru J., Huo Y., Yang Y. Microbial degradation and valorization of plastic wastes // Front. Microbiol. 2020. V. 11. Art. 442. https://doi.org/10.3389/fmicb.2020.00442
Sabev H.A., Handley P.S., Robson G.D. Fungal colonization of soil-buried plasticized polyvinyl chloride (pPVC) and the impact of incorporated biocides // Microbiology (SGM). 2006. V. 152. P. 1731–1739.
Sahebnazar Z., Shojaosadati S.A., Mohammad-Taheri M., Nosrati M. Biodegradation of low-density polyethylene (LDPE) by isolated fungi in solid waste medium // Waste Manage. 2010. V. 30. P. 396–401. https://doi.org/10.1016/j.wasman.2009.09.027
Santo M., Weitsman R., Sivan A. The role of the copper-binding enzyme – laccase – in the biodegradation of polyethylene by the actinomycete Rhodococcus ruber // Int. Biodeterior. Biodegr. 2013. V. 84. P. 204–210. https://doi.org/10.1016/j.ibiod.2012.03.001
Sarmah P., Rout J. Efficient biodegradation of low-density polyethylene by cyanobacteria isolated from submerged polyethylene surface in domestic sewage water // Environ. Sci. Pollut. Res. 2018. https://doi.org/10.1007/s11356-018-3079-7
Schmaltz E., Melvin E.C., Diana Z., Gunady E.F., Rittschof D., Somarelli J.A., Virdin J., Dunphy-Daly M.M. Plastic pollution solutions: emerging technologies to prevent and collectmarineplastic pollution // Environ Int. 2020. V. 144. P. 106067.
Sen S., Raut S. Microbial degradation of low density polyethylene (LDPE): A review // J. Environ. Chem. Eng. 2015. V. 3. P. 462–473. Sekhar V.C., Nampoothiri K.M., Mohan A.J., Nair N.R., Bhaskar T., Pandey A. Microbial degradation of high impact polystyrene (HIPS), an e-plastic with decabromodiphenyl oxide and antimony trioxide. // J. Hazard. Mater. 2016. V. 318. P. 347–354. doi:10.1016/ j.jhazmat.2016.07.008
Shah A.A., Hasan F., Hameed A., Ahmed S. Biological degradation of plastics: a comprehensive review // Biotechnol. Adv. 2008. V. 26. P. 246–265. https://doi.org/10.1016/j.biotechadv.2007.12.005
Sharma S.R. Bioremediation of polythenes and plastics: a microbial approach // In: R. Prasad, E. Aranda (eds.), Approaches in bioremediation, Nanotechnology in the life.sciences. 2018. Springer Nature Switzerland AG. P. 97‒114. Sheavly S.B., Register K.M. Marine debris & plastics: environmental concerns, sources, impacts and solutions // J. Polym. Environ. 2007. V. 15. P. 301–305.
Sheel A., Pant D. Microbial depolymerization ( In: S. J. Varjani, E. Gnansounou G. Baskar, D. Pant, Z.A. Zakaria (eds.), Waste Bioremediation, Energy, Environment, and Sustainability. 2018. Springer Nature Singapore Pte Ltd. P. 61‒103. Sheik S., Chandrashekar K.R., Swaroop K., Somashekarappa H.M. Biodegradation of gamma irradiated low density polyethylene and polypropylene by endophytic fungi // Int. Biodeterior. Biodegr. 2015. V. 105. P. 21–29.
Shimpi N., Mishra S., Kadam M. Biodegradation of polystyrene (PS)-poly(lactic acid) (PLA) nanocomposites using Pseudomonas aeruginosa. // Macromol. Res. 2012. V. 20. P. 181–187. doi: 10.1007/s13233-012-0026-1 Sielicki M., Focht D.D., Martin J.P. Microbial degradation of [14C]polystyrene and 1,3-diphenylbutane // Can. J. Microbiol. 1978. V. 2. P. 798‒803.
Silva C., Da S., Silva N., Matama T., Araujo R., Martins M., Chen S., Chen J., Wu J., Casal M., Cavaco-Paulo A. Engineered Thermobifida fusca cutinase with increased activity on polyester substrates // Biotechnol. J. 2011. V. 6. P. 1230−1239.
Sivan A., Szanto M., Pavlov V. Biofilm development of the polyethylene-degrading bacterium Rhodococcus ruber // Appl. Microbiol. Biotechnol. 2006. V. 72. P. 346–352.
Skariyachan S., Patil A.A., Shankar A., Manjunath M., Bachappanavar N., Kiran S. Enhanced polymer degradation of polyethylene and polypropylene by novel thermophilic consortia of Brevibacillus sp. and Aneurinibacillus sp. screened from waste management landfills and sewage treatment plants // Polym. Degrad. Stab. 2018. V. 149. P. 52–68. https://doi.org/10.1016/j.polymdegradstab.2018.01.018
Son Y., Qui R., Hu J., Zhang X. et al. Biodegradation and desintegration of expanded polystyrene by land snails Achatine fulica. // Sci. Total. Environm. 2020. V. 746. 141289. Sowmya H.V., Ramalingappa Krishnappa M., Thippeswamy B. Biodegradation of polyethylene by Bacillus cereus // Adv. Polym. Sci. Technol. Int. J. 2014. V. 4. P. 28–32.
Sudhakar M., Doble M., Murthy P. S., Venkatesan R. Marine microbe-mediated biodegradation of low- and high-density polyethylenes // Int. Biodeterior. Biodegr. 2008. V. 61. P. 203–213. https://doi.org/10.1016/j.ibiod.2007.07.011
Sulaiman S., Yamato S., Kanaya E., Kim J.J., Koga Y., Takano K. et al. Isolation of a novel cutinase homolog with polyethylene terephthalatedegrading activity from leaf-branch compost by using a metagenomic approach. // Appl. Environ. Microbiol. 2012. V. 78. P. 1556–1562. doi: 10.1128/AEM.06725-11 Tamnou E.M.B., Arafo A.T., Nougang M.E. et al. Biodegradation of polyethylene by the bacterium Pseudomonas aeruginosa in acidic microcosm and effect of the environmental temperature // Environ. Challenges. 2021. V. 3. e10056. https://doi.org/10.1016/j.envc.2021.100056
Tanasupawat S., Takehana T., Yoshida S., Hiraga K., Oda K. Ideonella sakaiensis sp. nov., isolated from a microbial consortium that degrades poly(ethylene terephthalate) // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 2813‒2818.
Taniguchi I., Yoshida S., Hiraga K., Miyamoto K., Kimura Y., Oda K. Biodegradation of PET: current status and application aspects // ACS Catalysis. 2019. V. 9. P. 4089‒4105.
Tischler D. Microbial Styrene Degradation. Cham, Switzerland: Springer International Publishing, 2015. P. 7–22.
Tokiwa Y., Calabia B.P., Ugwu C.U., Aiba S. Biodegradability of plastics. // Int. J. Mol. Sci. 2009. V. 10. P. 3722–3742. doi: 10.3390/ijms10093722 Urgun-Demirtas M., Singh D., Pagilla K. Laboratory investigation of biodegradability of a polyurethane foam under anaerobic conditions // Polym. Degrad. Stabil. 2007. V. 92. P. 1599–1610.
Vertommen M.A.M.E., Nierstrasz V.A., van der Veer M., Warmoeskerken M.M.C.G. Enzymatic surface modification of poly(ethyleneterephthalate) // J. Biotechnol. 2005. V. 120. P. 376–386.
Vimala P.P., Mathew L. Biodegradation of polyethylene using Bacillus subtilis // Procedia Technol. 2016. V. 24. P. 232–239.
Volke-Sepúlveda T., Saucedo-Castañeda G., Gutiérrez-Rojas M., Manzur A., Favela-Torres E. Thermally treated low density polyethylene biodegradation by Penicillium pinophilum and Aspergillus niger // J. Appl. Polym. Sci. 2002. V. 83. P. 305–314. https://doi.org/10.1002/app.2245
Wang X., Lu D., Jönsson L.J., Hong F. Preparation of a PET-hydrolyzing lipase from Aspergillus oryzae by the addition of bis(2-hydroxyethyl)terephthalate to the culture medium and enzymatic modification of PET fabrics // Eng. Life Sci. 2008. V. 8. P. 268–276.
Wang Z., Ma Z., Li L. Flow-induced crystallization of polymers: molecular and thermodynamic considerations // Macromolecules. 2016. V. 49. P. 1505–1517.
Webb J.S., Nixon M., Eastwood I.M., Greenhalgh M., Robson G.D., Handley P.S. Fungal colonization and biodeterioration of plasticized polyvinyl chloride // Appl. Environ. Microbiol. 2000. V. 66. P. 3194–3200.
Webb H., Arnott J., Crawford R., Ivanova E. Plastic degradation and its environmental implications with special reference to poly(ethylene terephthalate) // Polymers. 2013. V. 5. P. 1.
Wei R., Oeser T., Then J., Kuhn N., Barth M., Schmidt J., Zimmermann W. Functional characterization and structural modeling of synthetic polyester-degrading hydrolases from Thermomonospora curvata // AMB Express. 2014. V. 4. P. 44.
Wei R., Oeser T., Schmidt J., Meier R., Barth M., Then J., Zimmermann W. Engineered bacterial polyester hydrolases efficiently degrade polyethylene terephthalate due to relieved product inhibition // Biotechnol. Bioeng. 2016. V. 113. P. 1658–1665. https://doi.org/10.1002/bit.25941
Wei R., Zimmermann W. Biocatalysis as a green route for recycling the recalcitrant plastic polyethylene terephthalate // Microb. Biotechnol. 2017a. V. 10. P. 1302–1307. https://doi.org/10.1111/1751-7915.12714
Wei R., Zimmermann W. Microbial enzymes for the recycling of recalcitrant petroleum-based plastics: how far are we? // Microb. Biotechnol. 2017. V. 10. P. 1308.
Wei W., Hao Q., Chen Zh., Bao T., Ni B.-J. Polystyrene nanoplastics reshape the anaerobic granular sludge for recovering methane from wastewater // Water Res. 2020. V. 182. P. 116041.
Woo S., Song I., Joon Cha H. Fast and facile biodegradation of polystyrene by the gut microbial flora of Plesiophthalmus davidis larvae // Appl. Environ. Microbiol. 2020. V. 86. e01361-20. https://doi.org/10.1128/AEM.01361-20
Wright S.L., Kelly F.J. Plastic and human health: a micro issue? // Environ. Sci. Technol. 2017. V. 51. P. 6634‒6647.
Wu Q., Tao H., Wong M.H. Feeding and metabolism effects of three common microplastics on Tenebrio molitor // Environ. Geochem. Health. 2019. V. 41. P. 17–26.
Yamada-Onodera K., Mukumoto H., Katsuyama Y., Saiganji A., Tani Y. Degradation of polyethylene by a fungus, Penicillium simplicissimum YK // Polym. Degrad. Stab. 2001. V. 72. P. 323–327.
Yang J., Yang Y., Wu W.M., Zhao J., Jiang L. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms. // Environ. Sci. Technol. 2014. V. 48. P. 13776–13784. doi: 10.1021/es504038a Yang Y., Yang J., Wu W.M., Zhao J., Song Y., Gao L., Yang R., Jiang L. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. Chemical and physical characterization and isotopic tests // Environ. Sci. Technol. 2015a. V. 49. P. 12080–12086.
Yang Y., Yang J., Wu W.M., Zhao J., Song Y., Gao L., Yang R., Jiang L. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 2. Role of gut microorganisms // Environ. Sci. Technol. 2015b. V. 49. P. 12087‒12093.
Yamada-Onodera K., Mukumoto H., Saiganji A., Tani Y. Degradation of polyethylene by a fungus, Penicillium simplicissimum. // Polymer Degr. Stab. 2001. V. 72. P. 323-327. Yang Y., Wang J., Xia M. Biodegradation and mineralization of polystyrene by plastic-eating superworms Zophobas atratus // Sci. Total Environ. 2020. V. 15. V. 708. Art. 135233. https://doi.org/10.1016/j.scitotenv.2019.135233
Yanto D.H.Y., Ni P.R.A.K., Fenny C.A. etc. Biodegradation of styrofoam waste by ligninolytic fungi and bacteria. // IOP Conf. Series Earth Environ. Sci. 2019. V. 308:012001 DOI:10.1088/1755-1315/308/1/012001 Yin C.-F., Xu Y., Zhou N.-Y. Biodegradation of polyethylene mulching films by a co-culture of Acinetobacter sp. strain NyZ450 and Bacillus sp. strain NyZ451 isolated from Tenebrio molitor larvae. // Int. Biodeterior. Biodegrad. 2020. V. 155:105089. doi: 10.1016/j.ibiod.2020.105089 Yoon M.G., Jeon J.H., Kim M.N. Biodegradation of polyethylene by a soil bacterium and AlkB cloned recombinant cell // J. Bioremed. Biodegrad. 2012. V. 3. Art. 145.
Yoshida S., Hiraga K., Takehana T., Taniguchi I., Yamaji H., Maeda Y., Toyohara K., Miyamoto K., Zheng Y., Yanful E.K., Bassi A.S. A review of plastic waste biodegradation // Crit. Rev. Biotechnol. 2005. V. 25. P. 243–250.
Yoshida S., Hiraga K., Takehana T., Taniguchi I., Yamagi H., Maeda Y., Toyohara K., Miamoto K., Kimura Y., Oda K. A bacterium that degrades and assimilates poly(ethylene terephthalate) // Science. 2016. V. 351. P. 1196‒1199.
Zhang J., Wan X., Gong J., Gu Z. A study on the biodegradability of polyethylene terephthalate fiber and diethylene glycol terephthalate // J. Appl. Polym. Sci. 2004. V. 93. P. 1089–1096. https://doi.org/10.1002/app.20556
Zheng Y., Yanful E.K., Bassi A.S. A review of plastic waste biodegradation. // Crit. Rev. Biotechnol. 2005. V. 25. P. 243–250. doi: 10.1080/07388550500346359 Zheng J., Suh S. Strategies to reduce the global carbon footprint of plastics // Nat. Clim. Chang. 2019. V. 9. P. 374–378.
Zimmermann W., Billig S. Enzymes for the biofunctionalization of poly(ethylene terephthalate) // Adv. Biochem. Engin. Biotechnol. V. 125. P. 97–120.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


