Микробиология, 2021, T. 90, № 6, стр. 660-680
Растительные ингибиторы плотностно-зависимой коммуникации у бактерий: разнообразие структур, механизмов действия и источников происхождения
Д. Г. Дерябин a, *, А. А. Галаджиева a, b, Д. Б. Косян a, Г. К. Дускаев a
a Федеральный научный центр биологических систем и агротехнологий
Российской академии наук
460000 Оренбург, Россия
b Институт клеточного и внутриклеточного симбиоза Уральского отделения
Российской академии наук
460000 Оренбург, Россия
* E-mail: dgderyabin@yandex.ru
Поступила в редакцию 03.07.2021
После доработки 20.07.2021
Принята к публикации 22.07.2021
Аннотация
В обзоре систематизированы современные данные о соединениях растительного происхождения, ингибирующих плотностно-зависимую коммуникацию (англ. ‒ quorum sensing; QS) у бактерий. Описаны основные типы QS и дано представление о них как перспективной мишени для нового направления антимикробной терапии, ориентированной на подавление продукции факторов вирулентности и образования биопленок. Представлена методология поиска и исследования растительных ингибиторов QS. Охарактеризовано разнообразие обнаруженных растительных ингибиторов плотностно-зависимой коммуникации, относящихся к терпенам и терпеноидам, фенолам и метоксифенолам, кумаринам, флавоноидам, сульфоксидам и изотиоцианатам. Проанализировано действие названных растительных соединений на бактерии с различным типом организации QS, а также молекулярные механизмы развития подобных эффектов. Рассмотрено классификационное положение растений-продуцентов ингибиторов QS и имеющихся у них путей биосинтеза вторичных метаболитов с обсуждаемой активностью. Сформулировано положение о способности растений к ингибированию плотностно-зависимой коммуникации у бактерий как новом механизме врожденного фитоиммунитета, а также возможном использовании растительных ингибиторов QS для защиты животных и человека.
СИСТЕМЫ ПЛОТНОСТНО-ЗАВИСИМОЙ КОММУНИКАЦИИ У БАКТЕРИЙ
Зависимость роста и функционирования популяций от плотности входящих в их состав организмов является общебиологическим феноменом (Hixon, 2009). Его частным случаем у прокариот является плотностно-зависимая химическая коммуникация, обеспечивающая бактериям возможность реализации сложных паттернов кооперативного поведения (Swift et al., 2001). Общим принципом организации таких систем является образование и высвобождение во внешнюю среду специализированных сигнальных молекул – автоиндукторов (АИ), концентрация которых отражает текущую плотность бактериальной популяции. При достижении критического “порога” АИ начинают рецептироваться бактериальными клетками, что изменяет в них профили генной экспрессии и запускает процессы функциональной и морфологической дифференцировки (Miller, Bassler, 2001). Поскольку процесс автоиндукции предполагает восприятие каждым из сочленов популяции плотности его окружения, за ним закрепился термин “чувство кворума” (англ. – quorum sensing; QS).
Описанное к настоящему времени разнообразие систем QS основывается на характеристиках АИ и вариантах их рецепции. Исторически первой из них является двухкомпонентная система LuxI/LuxR типа, названная так по результатам исследования природы биолюминесценции морской симбиотической бактерии Vibrio fischeri (в современной классификации – Aliivibrio fischeri). Образуемый синтазой LuxI автоиндуктор – ацилированный лактон гомосерина (АГЛ), диффундирует во внешнюю среду, где накапливается до критических значений, после чего совершает обратное движение и рецептируется находящимся в цитоплазме белком LuxR (рис. 1а). Последний, предсуществующий в виде гомодимера, взаимодействуя с двумя молекулами АГЛ, изменяет свою конформацию, в результате чего приобретает способность к связыванию со специфическими последовательностями на бактериальной ДНК и запускает транскрипцию ранее молчащих генов, в том числе кассеты генов биолюминесценции (lux-оперона) (Egland, Greenberg, 1999). В дальнейшем оказалось, что стереотипно устроенные системы QS 1-го типа, опосредуемые различными по структуре АГЛ, характерны для широкого круга грамотрицательных бактерий, в том числе многочисленных фито- и зоопатогенов (Papenfort, Bassler, 2016).
Рис. 1.
Варианты систем плотностно-зависимой коммуникации у бактерий: а – система LuxI/LuxR типа, опосредуемая АГЛ (на примере Vibrio fischeri); б – система QS, опосредованная АИ-2 (на примере Vibrio harveyi); в – система QS, опосредованная АИ-3 и горомонами эпинефрином (Э) и норэпинефрином (НЭ) (на примере энтерогеморрагических штаммов Escherichia coli); г – система QS, опосредованная AIP (на примере Staphylococcus aureus).
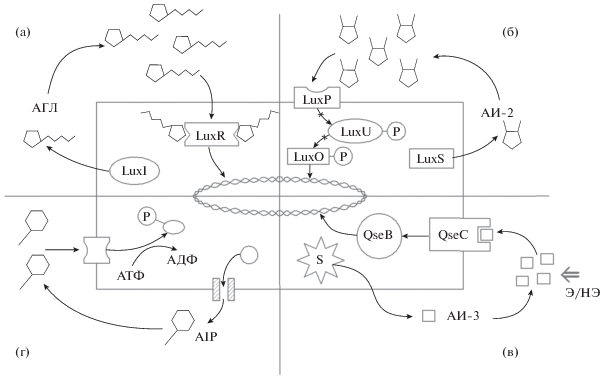
Другим широко распространенным вариантом QS являются системы, опосредованные т.н. “автоиндуктором 2-го типа” (АИ-2) и обнаруживаемые как у грамотрицательных, так и грамположительных бактерий. При этом имеющиеся у них синтазы семейства LuxS осуществляют образование предшественника 4,5-дигидрокси-2,3-пентандиона, который самопроизвольно подвергается реакциям циклизации и гидратации, ведущим к образованию “зрелого” АИ-2: тетрагидроксифурана (у Salmonella typhimurium) или фуранозилборатдиэфира (у морской бактерии V. harveyi). Структурные особенности данных молекул исключают возможность пассивной диффузии в цитоплазму бактериальных клеток, в связи с чем их рецепция осуществляется белками с мембранной локализацией (LsrB у S. typhimurium; LuxP у V. harveyi), а индукция QS-контролируемых генов происходит через запускаемые ими каскады дефосфорилирования внутриклеточных регуляторных белков (Pereira et al., 2013) (рис. 1б).
Третий тип QS первоначально связывался с системой автоиндукции у энтерогеморрагических штаммов E. coli (EHEC), имеющих комплекс QseВС (где qseB кодирует регулятор ответа, а qseC ‒ сенсорную киназу) и воспринимающих гормоны эпинефрин и норэпинефрин, а также собственные структурно сходные с ними АИ-3 (Kendall et al., 2007), по современным представлениям являющиеся метаболитами пиразинона (Kim et al., 2020) (рис. 1в).
При этом подобные системы оказались характерны для некоторых других грамотрицательных бактерий, у которых они интегрированы в иерархически устроенные регуляторные сети с участием QS 1-го и 2-го типов.
В свою очередь четвертый тип организации плотностно-зависимой коммуникации типичен для грамположительных бактерий (например, Staphylococcus aureus) (рис. 1г), где включает циклические автоиндуцирующие пептиды (англ. – autoinducing peptides; AIP) и рецептирующие их мембранные белки-киназы, запускающие процесс фосфорилирования внутриклеточных регуляторов транскрипции целевых генов (Le, Otto, 2015).
Результатом синхронной автоиндукции и координированной экспрессии генов в целостной бактериальной популяции является появление у нее совокупности свойств, реализация которых одиночными бактериальными клетками была бы неэффективной. При этом особое внимание привлекает к себе нахождение под контролем QS биосинтеза факторов вирулентности (Rutherford, Bassler, 2012), что определяется целесообразностью названного паттерна экспрессии только у значительной по численности бактериальной популяции, превышающей значение минимальной инфицирующей дозы. Кроме того, плотностно-зависимая коммуникация оказывается тесно связанной с процессами образования и функционирования бактериальных биопленок (Li, Tian, 2012), также рассматриваемых в качестве одного из важнейших факторов развития и поддержания инфекционного процесса.
Указанные обстоятельства определили интерес к поиску средств ингибирования QS болезнетворных бактерий как инструментов обнуления их патогенного потенциала в отсутствии развития бактерицидных или бактериостатических эффектов (Defoirdt, 2017). При этом ожидаемым преимуществом данного подхода должно стать отсутствие “селективного давления” на популяцию возбудителя, исключающее возможность образования новой генерации резистентных форм.
Среди предложенных стратегий поиска ингибиторов QS, включающих направленный синтез структурных антагонистов АИ, экспериментальный или виртуальный скрининг обширных библиотек химических соединений, уже нашедших свое применение в клинической практике или пищевой промышленности и т.д. (Lan et al., 2021), заметное место занимает поиск природных соединений с подобной активностью. В свою очередь высокая устойчивость растений в агрессивном бактериальном окружении, не полностью объясняемая известными механизмами их фитоиммунитета, определила перспективу поиска растительных ингибиторов QS, эволюционно направленных на бактериальные фитопатогены, снабженные механизмами плотностно-зависимой коммуникации (Koh et al., 2013).
МЕТОДОЛОГИЯ ОБНАРУЖЕНИЯ И ИССЛЕДОВАНИЯ РАСТИТЕЛЬНЫХ ИНГИБИТОРОВ ПЛОТНОСТНО-ЗАВИСИМОЙ КОММУНИКАЦИИ У БАКТЕРИЙ
Экспериментальному поиску анти-QS активности обычно предшествует предварительный отбор растительных субстратов с акцентом на их известное использование в традиционной (народной) медицине для лечения заболеваний бактериальной этиологии. Примерами подобного похода являются масштабные скрининги лекарственных растений, произрастающих в Северной Америке (Adonizio et al., 2006), Центральной и Восточной Европе (Tolmacheva et al., 2014), а также трав, используемых в традиционной китайской медицине (Koh, Tham, 2011). Непосредственным же материалом для исследования являются высушенные части отобранных растений, а также приготовленные на их основе экстракты, получаемые с использованием растворителей различной степени полярности (рис. 2).
Рис. 2.
Основные этапы обнаружения и исследования растительных ингибиторов плотностно-зависимой коммуникации у бактерий (обведены сплошной линией) и варианты их исполнения (обведены пунктирной линией).

Особенность выявляемого варианта биоактивности определила необходимость использования специальных тест-штаммов, позволяющих оценивать ингибирование QS на основе визуального или аппаратного учета определенных фенотипических характеристик. В наибольшей степени данный поход реализован для плотностно-зависимой коммуникации 1-го типа, что достигается использованием специально сконструированных биосенсоров, несущих АГЛ-рецептирующие белки, и при взаимодействии с соответствующим автоиндуктором запускающих в бактериальных клетках специфические биохимические реакции. Примерами являются рекомбинантные бактерии с клонированным геном LuxR-подобного белка и распознаваемым им промотором, под контролем которого находятся т.н. “репортерные” гены, в качестве которых используются lux-опероны (Winson et al., 1998), ген бета-галактозидазы (lacZ) или ген зеленого флуоресцирующего протеина (gfp) (Andersen, 2001). Другим известным примером является штамм Chromobacterium violaceum 026 (NCTC 13278), возможность использования которого для заявленной цели обеспечивается инсерцией Tn5-транспозона в ген синтазы автоиндуктора CviI с сохранением возможности его рецепции белком CviR, запускающим биосинтез сине-фиолетового пигмента виолацеина (McClean, 1997). В то же время для исследования большинства других систем плотностно-зависимой коммуникации специфичные тест-объекты до сих пор не разработаны, в связи с чем тестирование ведется на примере “диких” штаммов с полноценными системами QS и доказанной совокупностью кворум-регулируемых признаков. Аналогичный подход используется и при исследовании влияния растительных экстрактов на процесс образования бактериальных биопленок, что предусматривает проведение тестирования на релевантных грамотрицательных (Pseudomonas aeruginosa) (Rzhepishevska et al., 2018) или грамположительных (Staphylococcus spp., Enterococcus spp.) (Cruz et al., 2018) микроорганизмах.
На следующем этапе растительные экстракты с наиболее выраженной биоактивностью становятся объектом для фитохимического анализа, направленного на идентификацию в их составе химических соединений, определяющих развитие QS-ингибирующего эффекта и подавление образования бактериальных биопленок. В некоторых исследованиях эта задача решалась путем прямого фракционирования растительных экстрактов (например, с использованием высокоэффективной жидкостной хроматографии; ВЭЖХ), позволяющей выделить из сложной смеси растительных молекул целевой компонент с последующей идентификацией его структуры методом ЯМР (Adonizio et al., 2008). Однако в ряде случаев проведение ВЭЖХ сопровождалось диссипацией искомого эффекта (Deryabin, Tolmacheva, 2015), в связи с чем более широкое распространение получил метод предварительной идентификации компонентного состава растительных экстрактов методом газовой хроматографии с масс-спектрометрией (ГХ-МС), на основании которого формировались библиотеки обнаруженных химических соединений.
Для подтверждающего биотестирования привлекаются описанные выше тесты in vitro, а также разнообразные модели in vivo, призванные доказать защитный потенциал анализируемых соединений при экспериментальной инфекции у беспозвоночного Caenorhabditis elegans (Kong et al., 2016) или у мелких млекопитающих (van derWorp et al., 2010).
В свою очередь завершающим этапом современных экспериментальных исследований является определение молекулярного механизма действия химических соединений с подтвержденной анти-QS активностью, что может быть достигнуто на основе совокупности исследований in silico (при моделировании взаимодействия с синтазой автоиндуктора или рецепторным белком) (Byeon et al., 2017), а также путем проведения протеомного (Swatton et al., 2016) и транскриптомного (Asfahl, Schuster, 2017) анализа.
ОСНОВНЫЕ ГРУППЫ РАСТИТЕЛЬНЫХ ИНГИБИТОРОВ ПЛОТНОСТНО-ЗАВИСИМОЙ КОММУНИКАЦИИ У БАКТЕРИЙ
В настоящем обзоре мы предпринимаем попытку систематизации массива современных научных данных по обсуждаемому вопросу, в том числе путем описания основных групп идентифицированных соединений растительного происхождения (рис. 3), их эффектов на различные системы плотностно-зависимой коммуникации у бактерий (табл. 1), а также вероятных механизмов регистрируемой анти-QS активности.
Рис. 3.
Разнообразие структур химических соединений растительного происхождения, ингибирующих плотностно-зависимую коммуникацию у бактерий (пояснения в тексте).
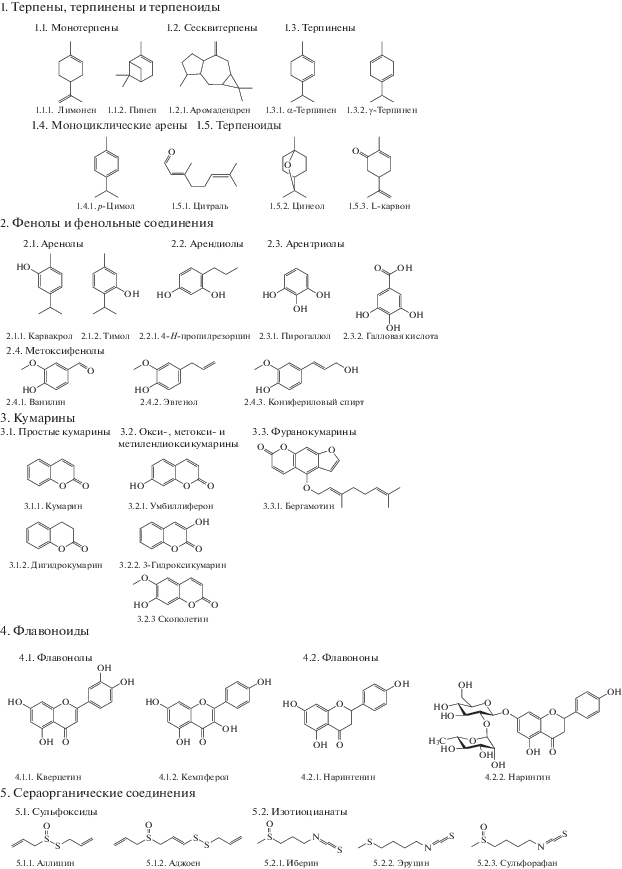
Таблица 1.
Эффекты растительных соединений на системы плотностно-зависимой коммуникации у бактерий
| № | Химическое соединение |
Растение-продуцент | Тест-объект | Тип QS | Регистрируемые эффекты | Литература | |
|---|---|---|---|---|---|---|---|
| ингибирование QS-регулируемых признаков* | подавление образования биопленок | ||||||
| 1. Терпены, терпинены и терпеноиды | |||||||
| 1.1.1 | Лимонен | Citrus reticulate (мандарин) | P. aeruginosa | I | + | + | Luciardi et al., 2016 |
| 1.1.2 | Пинен | Eucalyptusglobulus (эвкалипт шаровидный); Eucalyptusradiata (эвкалипт лучистый) | A. baumannii | I | + | Нд** | Luís et al., 2016 |
| 1.2.1 | Аромадендрен | ||||||
| 1.3 | Терпинен | Thymus daenensis (тимьян), Satureja hortensis (чабер садовый) |
S. aureus | IV | + | + | Sharifi et al., 2018 |
| 1.4.1 | p-Цимол | Eucalyptusglobulus (эвкалипт шаровидный) | C.violaceum | I | + | + | Cáceres et al., 2020 |
| E. coli O157:H7, E. coli O33 | III | ||||||
| S. epidermidis | IV | ||||||
| 1.5.1 | Цитраль | V. alginolyticus и S. pyogenes | II | + | + | Adil et al., 2019; Liua et al., 2020 | |
| 1.5.2 | Цинеол | S. aureus | IV | + | + | Merghni et al., 2018 | |
| 1.5.3 | L-карвон | Thymus vulgare (тимьян обыкновенный) | H. alvei | I | + | + | Li et al., 2019 |
| 2. Фенолы и фенольные соединения | |||||||
| 2.1.1 | Карвакрол | Thymus vulgare (тимьян обыкновенный) | C. violaceum и P. aeruginosa | I | + | + | Burt et al., 2014; Tapia-Rodriguez et al., 2019; Cáceres et al., 2020 |
| S. enterica | II | ||||||
| S. aureus | IV | ||||||
| 2.1.2 | Тимол | Carum copticum (ажгон) и Thymus vulgare (тимьян обыкновенный) | C. violaceum и P. fluorescens KM121 | I | + | + | Myszka et al., 2016; Snoussi et al., 2019; Cáceres et al., 2020 |
| 2.2.1 | 4-Н-Пропилрезорцин | Quercus robur (дуб обыкновенный) | C. violaceum | I | + | + | Дерябин соавт., 2014; Deryabin, Tolmacheva, 2015 |
| 2.3.1 | 1,2,3-Пирогаллол | C. violaceum | I | + | Нд | Ni et al., 2008; Deryabin, Tolmacheva, 2015 | |
| V. harveyi | II | ||||||
| 2.3.2 | Галловая кислота | C. violaceum и P. aeruginosa | I | + | + | Kim et al., 2019 | |
| 2.4.1 | Ванилин | Vanilla planifolia (ваниль плосколистная), Quercus robur (дуб обыкновенный) | C. violaceum и A. hydrophila | I | + | + | Choo et al., 2006; Ponnusamy et al., 2009 |
| 2.4.2 | Эвгенол | Cuminum cyminum (зира) | C. violaceum и P. aeruginosa | I | + | + | Sybiya Vasantha Packiavathy et al., 2012; Al-Shabib et al., 2017; Lou et al., 2019 |
| S. aureus | IV | ||||||
| 2.4.3 | Конифериловый спирт | Quercus robur (дуб обыкновенный) | C. violaceum | I | + | Нд | Deryabin, Tolmacheva, 2015 |
| 3. Кумарины | |||||||
| 3.1.1 | Кумарин | Dipteryx odorata, Melilotus suaveolens, Galium odoratum (диптерикс, донник, подмаренник душистые), Cinnamomum cassia (коричник китайский), Justicia pectoralis | C. violaceum, P. aeruginosa и A. fischeri | I | + | + | Schreier et al., 1991; Lino et al., 1997; Wang et al., 2013; Lee et al., 2014; Gutiérrez-Barranquer et al., 2015; Deryabin, Tolmacheva, 2015 |
| E. coli O157:H7 | II | ||||||
| 3.1.2 | Дигидрокумарин | Lavandula angustifolia (лаванда узколистная), Melilotus officinalis (донник) |
C. violaceum, H. alvei и P. aeruginosa | I | + | + | Kovaleva et al., 2009; Elharas et al., 2013; Hou et al., 2017; D’Almeida et al., 2017 |
| 3.2.1 | Умбеллиферон | Archangelica officinalis (дудник лекарственный), Ferula communis (ферула обыкновенная), Justicia pectoralis | E. coli | II | Нд | + | Härmälä et al., 1992; Wang et al., 2013; Lee et al., 2014, Yu et al., 2015; |
| 3.2.2 | 3-Гидроксикумарин | Ferula communis (ферула обыкновенная) | C. violaceum | I | + | − | Kovaleva et al., 2009; D’Almeida et al., 2017 |
| 3.2.3 | Скополетин | Scopolia carniolica (скополия), Cichorium intybus (цикорий обыкновенный), Solanum nigrum (паслен черный), Datura metel (дурман индийский), Trigonella foenum-graecum (пажитник) |
C. violaceum | I | + | − | Bais et al., 2001; Zhao et al., 2010; Deryabin, Tolmacheva, 2015; Han et al., 2015; Ouzir et al., 2016; Reen et al, 2018 |
| 3.3.1 | Бергамотин | Citrus bergamia, Citrus maxima и Citrus paradisi (цитрусовые) | P. aeruginosa | I | + | + | Girennavar et al., 2008; Reen et al., 2018 |
| V. harvey, S. typhimurium и E. coli | II | ||||||
| 4. Флавоноиды | |||||||
| 4.1.1 | Кверцетин | Psidium guajava (гуайява) | C. violaceum
и P. aeruginosa V. harveyi BB886 |
I | + | + | Vikram et al., 2010; Vasavi et al., 2014; Ouyang et al., 2016 |
| V. harveyi MM32, BB120, E. coli O157:H7 | II | ||||||
| 4.1.2 | Кемпферол | Centella asiatica (центелла азиатская) | C. violaceum
и P. aeruginosa V. harveyi BB886 |
I | + | + | Vikram et al., 2010; Vasavi et al., 2016 |
| V. harveyi MM32, BB120, E. coli O157:H7 | II | ||||||
| 4.2.1 | Нарингенин | Combretum albiflorum | P. aeruginosa V. harveyi BB886 |
I | + | + | Vikram et al., 2010; Vandeputte et al., 2011 |
| V. harveyi MM32, BB120, E. coli O157:H7 | II | ||||||
| 4.2.2 | Нарингин | Citrus sinensis (апельсин), Citrus maxima (помело) |
C. violaceum и Y. enterocolitica | I | + | + | Truchado et al., 2012; Zunying et al., 2017 |
| V. anguillarum | II | ||||||
| 5. Сераорганические соединения | |||||||
| 5.1.1 | Аллицин | Allium sativum (чеснок) | P. aeruginosa | I | + | + | Pérez-Giraldo et al., 2003; Lin et al., 2013 |
| S. epidermidis | IV | ||||||
| 5.1.2 | Аджоен | Allium sativum (чеснок) | P. aeruginosa lasB-gfp, P. aeruginosa rhlA-gfp и E. coli luxI-gfp | I | + | + | Jakobsen et al., 2012 |
| 5.2.1 | Иберин | Armoracia rusticana (хрен) | P. aeruginosa | I | + | + | Jakobsen et al., 2012 |
| 5.2.2 | Эруцин | Brassica oleracea (брокколи) | E. coli DH5-lacZ и P. aeruginosa | I | + | + | Ganin et al., 2013 |
| 5.2.3 | Сульфорафан | Brassica oleracea (брокколи) | + | + | Ganin et al., 2013 | ||
Терпены, терпинены и терпеноиды. Терпены ‒ соединения, состоящие из одного или нескольких изопреновых звеньев и описываемые общей формулой (C5H8)n. В зависимости от числа изопреновых звеньев, образующих углеродный скелет молекулы, они разделяются на монотерпены (C10H16) с одной (лимонен; 1.1.1) или двумя (пинен; 1.1.2) циклическими группами; сесквитерпены (C15H24), например, аромадендрен (1.2.1), а также ди-, три-, тетра- и политерпены. Структурно близкими к монотерпенам являются терпинены, соответствующие общей формуле (C10H16). Их особенностью является существование четырех различных изомеров (α, β, γ, δ), различающихся положением двойной связи между соседними атомами углерода. Наиболее часто встречающимися в природе являются α- и γ-терпинены (1.3.1 и 1.3.2). Цимол (C10H14; 1.4.1) имеет дополнительную двойную связь в углеводородном кольце и в этой связи часто классифицируется как “моноциклический арен” или “алкилбензен”. В то же время совокупность физико-химических свойств определяют целесообразность его рассмотрения в составе обсуждаемой группы растительных соединений. В свою очередь терпеноиды также являются производными изопрена, но имеют дополнительные кислородсодержащие группы. Указанная особенность определяет их повышенную лабильность, склонность к изомеризации, циклизации и полимеризации. Как и терпены, терпеноиды классифицируются на основе количества входящих в их структуру изопреновых звеньев, а их известными примерами являются монотерпеновый ациклический альдегид цитраль (C10H16O; 1.5.1); моноциклический эфир цинеол (C10H18O; 1.5.2), а также циклический тепеноид карвон (C10H14O; 1.5.3).
Первые наблюдения о наличии анти-QS активности у терпенов и близких к ним растительных соединений связаны с ее обнаружением у эфирных масел – растительных экстрактов, получаемых из разных частей растений дистилляционным методом (табл. 1). В частности, исследование биоактивности мандаринового масла, показавшего подавление кворум-индуцируемой продукции эластазы и образования биопленки P. aeruginosa, позволило связать регистрируемые эффекты с присутствием лимонена (Luciardi et al., 2016). Активность данного соединения, дополняемого действием пинена, аромадендрена и других терпеноидов, подтверждена и при исследовании эвкалиптовых эфирных масел, подавляющих кворум-индуцируемые проявления у Acinetobacter baumannii (Luís et al., 2016).
Активность терпиненов продемонстрирована в отношении биопленкообразования у грамположительного микроорганизма S. aureus (Sharifi et al., 2018). В свою очередь эфирные масла с высоким содержанием p-цимола и его гидроксипроизводных тимола, и карвакрола подавляли биопленкообразование E. coli и S. epidermidis (Cáceres et al., 2020), что дополнялось их ингибирующим эффектом на систему “кворум сенсинга” 1-го типа у C. violaceum.
Для очищенного монотерпенового ациклического альдегида цитраля способность к подавлению экспрессии генов вирулентности, регулируемых системой “кворум сенсинга” 2-го типа, показана как в отношении грамотрицательного патогена Vibrio alginolyticus (Liua et al., 2020), так и грамположительного патогена Streptococcus pyogenes (Adil et al., 2019), что в последнем случае дополнялось развитием антибиопленочного эффекта и могло быть усилено в присутствии флавоноидов (см. ниже). Сходные эффекты 1,8-цинеола в отношении S. aureus с системой “кворум-сенсинга” 4-го типа были продемонстрированы при тестировании эвкалиптового масла, в котором данный терпеноид является превалирующим компонентом (Merghni et al., 2018). Наконец, еще один терпеноид – карвон развивал активность в отношении Hafnia alvei с системой QS 1-го типа, что проявлялось в ингибировании биосинтеза автоиндук-тора, нарушении подвижности и подавлении образования биопленки (Li et al., 2019).
Разнообразие терпеновых соединений, а также их биологические эффекты на системы “кворум сенсинга” и биопленкоообразование патогенных бактерий представлены в недавнем обзоре Camele и соавт. (Camele et al., 2019). При этом отмечается синергизм между отдельными компонентами эфирных масел, что показано для композиций “лимонен; пинен; линалоол” и “γ-терпинен; цимол; карвакрол”.
В свою очередь наиболее общим механизмом активности терпеновых соединений, показанном in silico при моделировании молекулярного докинга карвона с функциональными беками H. alvei, в настоящее время считается подавление активности LuxI-подобных синтаз (на примере HalI), а также взаимодействие с LuxR-подобными белками (на примере HalR), дополнительно нарушающее рецепцию АГЛ (Li et al., 2019), что хорошо объясняет ингибирующий эффект в отношении QS 1-го типа, но не позволяет распространить его на иные варианты систем плотностно-зависимой коммуникации.
Фенолы. Фенолы – это обширная группа органических соединений, в молекулах которых гидроксильные (OH−) группы ковалентно присоединены к одному или нескольким атомам углерода ароматического кольца. При этом в зависимости от числа ОН-групп данные соединения классифицируются на одноатомные (аренолы), двухатомные (арендиолы) и трехатомные фенолы (арентриолы). Примером первой группы являются изомерные друг другу карвакрол (2.1.1) и тимол (2.1.2) общей формулы C6H3CH3(OH)(C3H7), относимые к классу монотерпенидов фенола, и вместе с другими терпеновыми соединениями (см. выше) присутствующие в составе ряда растительных эфирных масел. Двухатомные фенолы, в зависимости от взаимного (орто-, пара- или мета-) расположения гидроксильных групп, делятся на пирокатехины, гидрохиноны и резорцины, примером последних из которых является 4-Н-пропилрезорцин (2.2.1). В свою очередь наиболее известным трехатомным фенолом является пирогаллол (2.3.1) и его производное галловая (3,4,5-триоксибензойная) кислота (2.3.2). К фенольным соединениям (метоксифенолам) относятся и такие растительные соединения как ванилин (2.4.1), эвгенол (2.4.2) и конифериловый спирт (2.4.3), общими элементами структуры которых является наличие эфирной и фенольной функциональных групп.
Кворум-ингибирующая активнось карвакрола впервые была показана в отношении C. violaceum с системой плотностно-зависимой коммуникации 1‑го типа, в то время как подавление биопленкообразования было продемонстрировано в отношении более широкого круга модельных микроорганизмов, помимо C. violaceum включающего Salmonella enterica (2-ой тип QS) и S. aureus (4‑ый тип QS) (Burt et al., 2014). В дальнейшем анти-QS активность карвакрола была распространена и на P. aeruginosa, что заключалось в сочетанном подавлении кворум-зависимого биопленкообразования, подвижности и биосинтеза пиоцианина (Tapia-Rodriguez et al., 2019). Аналогичные эффекты демонстрировал и изомерный карвакролу тимол, а также богатые данным одноатомным фенолом масла ажгона (Carum copticum) (Snoussi et al., 2018) и тимьяна (Thymus vulgare) (Myszka et al., 2016), что в первом случае регистрировалось как подавление кворум-зависимого биосинтеза виолацеина у C. violaceum, а во втором – как нарушение биопленкообразования у Pseudomonas fluorescens. Двухатомный фенол 4-Н-пропилрезорцин первично был идентифицирован в качестве одного из кворум-ингибирующих компонентов коры дуба (Quercus cortex) (Deryabin, Tolmacheva, 2015) и в дальнейшем, совместно с другими представителями группы арендиолов, детально охарактеризован в тестах подавления кворум-зависимого биосинтеза виолацеина и биопленкообразования у C. violaceum (Дерябин и соавт., 2014). Активность микромолярных концентраций трехатомного фенола пирогаллола последовательно была показана в отношении V. harveyi с системой QS 2-го типа (Ni et al., 2008), а в цитируемом выше исследовании (Deryabin, Tolmacheva, 2015) и в отношении C. violaceum с системой “кворум сенсинга” 1-го типа. В свою очередь сравнительный анализ названных и некоторых других фенольных соединений в качестве наиболее эффективного ингибитора систем плотностно-зависимой коммуникации C. violaceum и P. aeruginosa позволил назвать другой трехатомный фенол – галловую кислоту, а также метилгалат (Hossain et al., 2017) и ее алкилированные производные (Kim et al., 2019).
Среди представителей метоксифенолов хорошо документированной является анти-QS активность ванилина, впервые обнаруженная при оценке эффектов экстракта семян ванили плосколистной (Vanilla planifolia) на кворум-зависимые проявления у C. violaceum (Choo et al., 2006). В дальнейшем активность собственно ванилина была подтверждена в отношении еще одной бактерии с системой “кворум сенсинга” 1-го типа ‒ Aeromonas hydrophila, что включало выраженное подавление ее биопленкообразования (Ponnusamy et al., 2009). Аналогичная активность эвгенола первоначально также была показана на примере цельного растительного экстракта – спиртовой вытяжки зиры (Cuminum cyminum) (Sybiya et al., 2012). При этом химически чистый эвгенол в форме наноэмульсии эффективно ингибировал кворум-зависимый биосинтез виолацеина у C. violaceum, образование пиоцианина и подвижность у P. aeruginosa (Lou et al., 2019), а также эффективно уменьшал биомассу биопленок у антибиотикорезистентных штаммов S. aureus (Al-Shabib et al., 2017). В свою очередь анти-QS активность кониферилового спирта, являющегося важным интермедиатом на биосинтетических путях образования эвгенола (см. выше), кумарина (см. ниже) и других продуктов растительного происхождения, показана при исследовании воздействия экстрактов коры дуба и отдельных присутствующих в его составе малых молекул на систему “кворум сенсинга” 1-го типа у C. violaceum (Deryabin, Tolmacheva, 2015).
Среди представителей рассматриваемой группы соединений наиболее детально охарактеризованным является механизм действия эвгенола, оцененный по результатам транскриптомного анализа Klebsiella pneumoniae с системой плотностно-зависимой коммуникации 2-го типа (Wang et al., 2019). Действие данного соединения было охарактеризовано как плейотропное, затрагивающее в общей сложности 5779 дифференциально экспрессируемых генов, связанных с множеством биосинтетических путей и биологических функций. При этом его анти-QS активность могла быть объяснена нарушением транскрипции ряда генов (luxS, pfs и lsrK), вовлеченных в синтез АИ-2, что подтверждается экспериментальными данными о подавлении образования названного автоиндуктора в присутствии эвгенола.
Кумарины. Кумарины – это класс природных соединений, в основе которых лежит 5,6-бензо-α-пирон (лактон цис-орто-оксикоричной кислоты). При этом в зависимости от особенностей строения их ядра и наличия заместителей данные соединения могут быть классифицированы на простые кумарины (кумарин, 3.1.1; дигидрокумарин, 3.1.2); окси-, метокси- и метилендиоксикумарины с различными замещениями в бензольном или пироновом кольцах (например, умбиллиферон, 3.2.1; 3-гидроксикумарин, 3.2.2 и скополетин, 3.2.3); франокумарины, содержащие дополнительное конденсированное фурановое ядро (бергамотин, 3.3.1), а также иные структурно более сложные соединения, представляющие собой результаты конденсации кумарина с пирановым, бензольным и бензофурановым кольцами. При этом большинство растительных соединений этого класса обнаруживаются в свободном состоянии, и лишь незначительное число – в виде гликозидов с D‑глюкозой, присоединенной к С6, С7 или С8 атомам кумаринового ядра.
Экспериментальные наблюдения об анти-QS активности кумарина преимущественно связаны с его воздействием на ряд грамотрицательных бактерий, использующих систему плотностно-зависимой коммуникации 1-го типа: P. aeruginosa (подавление образования биопленки, биосинтеза феназина, подвижности); A. fischeri (ингибирование биолюминесценции) и др. (Gutiérrez-Barranquero et al., 2015). Другой простой кумарин – дигидрокумарин демонстрировал сходную активность: эффективно ингибировал кворум-зависимый биосинтез виолацеина у C. violaceum и биопленкообразование у H. alvei (Hou et al., 2017). При исследовании воздействия восьми представителей рассматриваемого класса соединений на образование биопленки у E. coli O157:H7 со 2-ым типом QS искомый эффект был подтвержден для кумарина и впервые показан для его производного – умбиллиферона (7-гидроксикумарина) (Lee et al., 2014). Дальнейший сравнительный анализ семи гидроксипроизводных кумарина в отношении кворум-зависимого биосинтеза виолацеина у C. violaceum и биопленкообразования у P. aeruginosa позволил частично разделить эти эффекты: первые из них были характерны для 3-гидроксикумарина, а вторые показаны при использовании 6-, 7- и 6,7-дигидроксикумарина (D’Almeida et al., 2017). Возможность выделения двух функциональных групп кумаринов, преимущественно нарушающих образование бактериальных биопленок и, наряду с этим, ингибирующих проявления QS, подтверждена и в работе Reen et al. (2018). Так первый вариант биоактивности был характерен для 7-гидрокси-5-метоксикумарина (скополетина), а второй – для более обширной группы соединений, в том числе включающей фуранокумарины: бергамотин и 6,7-дигидробергамотин. При этом два последних соединения, стабильно обнаруживаемые в плодах цитрусовых (Citrus bergamia, C. maxima и C. paradisi), развивали свою активность в отношении бактерий, использующих как I, так и II тип плотностно-зависимой коммуникации (Girennavar et al., 2008).
Объяснением подобного эффекта, неспецифичного по отношению к бактериальному виду, и используемой им системе плотностно-зависимой коммуникации, явился особенный механизм биоактивности кумаринов, заключающийся в подавлении метаболизма циклического дигуанозиномонофосфата (c-di-GMP) (Zhang et al., 2018).
Поскольку c-di-GMP в настоящее время оценивается как внутриклеточный вторичный мессенджер, дефицит которого в клетках P. aeruginosa активирует 535 и репрессирует 432 гена, включая гены трех регуляторных систем (las, rhl и PQS), результатом действия кумаринов закономерно становятся системное ингибирование факторов вирулентности и подавление образования биопленок, как названным модельным микроорганизмом, так и множеством других бактериальных видов, также осуществляющих внутриклеточную регуляцию с участием c-di-GMP.
Флавоноиды. Флавоноиды – еще одна обширная группа растительных соединений, в зависимости от особенностей химического строения (количества и расположения различных заместителей вокруг в т.н. “базового скелета” C6‒C3‒C6 из 15 атомов углерода), разделяемая на шесть классов: флавонолы, флавоны, изофлавоны, флаваноны, халконы и антоцианины (Panche et al., 2016). При этом наиболее хорошо документированные доказательства наличия кворум-ингибирующей активности к настоящему времени получены в отношении флавонолов: кверцетина (4.1.1) и кемпферола (4.1.2), а также флаванонов: нарингенина (4.2.1) и его гликозидированного производного – нарингина (4.2.2).
В работе Vasavi et al. (2014) в биотестах на C. violaceum ATCC 12472 и P. aeruginosa PAO1 впервые описана кворум-ингибирующая активность богатого флавоноидами экстракта листьев гуайявы (Psidium guajava) из семейства миртовых. Исследование природы подобной активности позволило связать ее с присутствием в исследуемых экстрактах флавонола кверцетина и его производного кверцетин-3-О-арабинозида, первоначально идентифицированных при проведении жидкостной хроматографии с масс-спектрометрией, а в дальнейшем подтвердивших наличие искомой активности в виде химически чистых соединений. Дальнейшее тестирование кверцетина в отношении P. aeruginosa PAO1 показало его способность к ингибированию продукции пиоцианина, протеазы и эластазы, а также образованию биопленок, причиной чего было названо подавление транскрипции регуляторных генов “кворум сенсинга” lasI, lasR, rhlI и rhlR (на 34, 68, 57 и 50% соответственно) (Ouyang et al., 2016). В настоящее время представления о механизмах биоактивности кверцетина дополнены и его способностью к аллостерической ингибиции LuxR-подобных рецепторов LasR и RhlR (Paczkowski et al., 2017), следствием чего является нарушение связывания названных белков с ДНК в области кворум-регулируемых промоторов, а итоговым результатом ‒ подавление транскрипции соответствующих генов.
При исследовании богатого флавоноидами этанольного экстракта многолетнего цветкового растения Centella asiatica из семейства зонтичных совокупность его кворум-ингибирующих эффектов продемонстрирована как при проведении тестирования на C. violaceum ATCC12472 (подавление биосинтеза виолацеина), так и в отношении P. aeruginosa PAO1 (подавление продукции пиоцианина, эластолитической и протеолитической активностей, подвижности и образования биопленок). В свою очередь проведение тонкослойной хроматографии позволило выделить из тестируемого экстракта наиболее активное соединение, каковым оказался флавонол кемпферол (Vasavi et al., 2016).
В коре тропического растения Combretum albiflorum из порядка миртоцветных были идентифицированы несколько флавонов, флавононов, флавонолов и халконов, в дальнейшем тестированных на способность подавлять кворум-регулируемые проявления у P. aeruginosa PAO1 (Vandeputte et al., 2011). При этом наибольшую активность демонстрировали флаваноны (нарингенин, эриодиктиол и таксифолин), существенно снижающие продукцию пиоцианина и образование эластазы без существенного воздействия на интенсивность бактериального роста. Кроме того, нарингенин и таксифолин ингибировали экспрессию ряда генов, формирующих многокомпонентную систему плотностно-зависимой коммуникациии у P. aeruginosa PAO1 (lasI, lasR, rhlI, rhlR, lasA, lasB и др.), а наиболее биоактивный нарингенин выраженно блокировал образование опосредующих ее автоиндукторов: С4-АГЛ и 3-оксо-С12-АГЛ (продуктов генов lasI и rhll соответственно), а также нарушал взаимодействие первого из них с рецепторным белком RlhR.
Согласующийся результат получен в работе Truchado et al. (2012), где продемонстрировано наличие кворум-ингибирующей активности в экстракте апельсина, в значительных количествах содержащем О-гликозилированные флаваноны (нарингин, неогесперидин и гесперидин). Спектр обнаруженных эффектов, помимо воздействия на систему “кворум сенисинга” C. violaceum, включал подавление биосинтеза АГЛ и формирование биопленки у Yersinia enterocolitica, что при использовании нарингина дополнялось угнетением его подвижности. При этом, как в присутствии цельного экстракта, так и при использовании нарингина, в клетках Y. enterocolitica детектировано выраженное изменение уровня транскрипции гена yenR (кодирует рецептор для АГЛ), а также генов flhDC и fliA (кодируют белки флагелл). Другое доказательство биоактивности нарингина получено в работе Zunying et al. (2017), исследующей экстракт кожуры Citrus maxima (помело), в которой названный гликозилированный флаванон является доминирующим компонентом (91.62% сухого остатка). При этом спектр регистрируемых эффектов включал как подавление АИ-1-регулируемого биосинтеза виолацеина у C. violaceum CV026, так и АИ-2-контролируемых биопленкообразования и подвижности у Vibrio anguillarum. В свою очередь механизм подобной активности был связан с ингибированием процесса взаимодействия автоиндуктора и соответствующего рецепторного белка (в частности, 3-оксо-С12-АГЛ и LasR у P. aeruginosa) (Hernando-Amado et al., 2020), что уподобляло его аналогичному механизму действия кверцетина (см. выше).
Первое систематизированное сравнительное исследование кворум-ингибирующей активности флавоноидов проведено в работе Vikram et al. (2010), где сопоставлено воздействие 10 соединений (флавонолов – кверцетина, кемпферола, рутина; флавонов – нариненина, нарингина, неоэриоцитрина, неогесперидина, гесперидина; а также полиметоксифлавона – синенсетина) в биотестах на V. harvey и E. coli O157:H7. Среди них наиболее эффективными антагонистами АИ-2-опосредованной межклеточной коммуникации и ингибиторами образования биопленок оказались нарингенин, кемпферол, кверцетин и апигенин. Другое известное сравнительное исследование проведено Skogman et al. (2016), которые осуществили скрининг библиотеки из 465 природных и химически синтезированных флавоноидов при параллельном тестировании на генетически связанной паре дикого (ATCC 31532) и мутантного (CV026) штаммов C. violaceum. По его результатам искомая активность, оцененная по способности вызывать 85% ингибирование кворум-регулируемого биосинтеза виолацеина в одном или обеих биотестах, показана у 70 соединений. В свою очередь среди них наивысшая активность зафиксирована у 5 химически синтезированных соединений из группы флавонов, обуславливающих развитие подобного эффекта в микромолярном диапазоне концентраций, что иллюстрирует возможность дальнейшей целенаправленной селекции флавоноидов с искомой активностью.
Сераорганические соединения. Среди обширного класса сераорганических молекул растительного происхождения, имеющих в структуре одну или несколько ковалентных связей “углерод–сера”, кворум-ингибирующая активность к настоящему моменту продемонстрирована у двух групп соединений: сульфоксидов (5.1) и тиоцианатов (5.2). При этом общим элементом структуры сульфоксидов общей формулы R1‒SO‒R2 является присутствие двух органических радикалов, связанных с атомом серы, а отличительным моментом тиоцианатов является присутствие терминально расположенной функциональной группы N=C=S.
Известным сульфоксидом с доказанной кворум-ингибирующей активностью является аллицин (S‑проп-2-ен-1-ил проп-2-ен-1-сульфинотиолат, образующийся из предшественника аллиина при повреждении клеток луковицы чеснока (Allium sativum)) (5.1.1) в результате каскада ферментативных реакций (см. ниже). При этом спектр биоактивности данного сераорганического соединения распространяется на грамотрицательные (P. aeruginosa) и грамположительные (S. epidermidis) микроорганизмы и включает как подавление экспрессии образуемых ими кворум-регулируемых факторов вирулентности, так и образование биопленок (Pérez-Giraldo et al., 2003; Lin et al., 2013). В частности, использование аллицина в концентрации 128 мкг/мл приводило к 50% уменьшению толщины биопленки и 70% снижению продукции экзополисахарида GFP-трансформированной культурой P. aeruginosa PAO1 (Lin et al., 2013), а аналогичный эффект, заключающийся в подавлении образования биопленки культурой S. epidermidis, формировался уже при концентрации 4 мкг/мл (Pérez-Giraldo et al., 2003).
Хорошо корреспондирующие с этим наблюдения сделаны в отношении аджоена ((E)-1-(проп-2-енилдисульфанил)-3-проп-2-енилсульфинилпроп-1-ена) (5.1.2), образующегося в процессе дальнейшей трансформации аллицина и содержащего как сульфоксидную, так и дисульфидную группы. Тестирование аджоена на репортерных штаммах P. aeruginosa lasB-gfp, P. aeruginosa rhlA-gfp и E. coli luxI-gfp, оценивающих эффекты в отношении отдельных систем плотностно-зависимой коммуникации 1-го типа, показало их 50% подавление в диапазоне концентраций от 15 до 100 мкМ (Jakobsen et al., 2012). В том же исследовании аджоен в дозе 80 мкг/мл выраженно ингибировал экспрессию факторов вирулентности P. aeruginosa (эластаза, энтеротоксины), а также не менее чем в пять раз снижал продукцию рамнолипидов. В свою очередь поиск путей повышения искомой активности, проведенный на примере библиотеки из 25 синтетических аналогов аджоена, позволил идентифицировать два наиболее активных соединения с заменой аллильного радикала на бензотиазольную группу, развивающих 50%-ное ингибирование кворум-регулируемых факторов вирулентности P. aeruginosa (элестаза, рамнолипид, пиоцианин) уже при концентрации 0.56 мкМ (Fong et al., 2017).
В работе Jakobsen et al. (2012) сравнительный анализ ряда растительных экстрактов показал наиболее выраженную кворум-ингибирующую активность в экстракте хрена (Armoracia rusticana), а хроматографическое разделение последнего с последующим использованием масс-спектрометрии и спектроскопии ядерного магнитного резонанса позволило связать регистрируемую биоактивность с присутствием еще одного сероорганического соединения ‒ изотиоцианата иберина (5.2.1). При этом дальнейший анализ с использованием технологий ОТ-ПЦР и ДНК-микрочипов подтвердил собственный эффект иберина, заключающийся в блокаде экспрессии широкого спектра кворум-индуцируемых генов у P. aeruginosa.
Исследование природы кворум-ингибирующей активности экстракта брокколи (Brassica oleracea) связало ее с присутствием еще двух изотиоцианатов: эруцина (5.2.2) и его производного – сульфорафана (5.2.3) (Ganin et al., 2013). При этом более активный сульфорафан в концентрации 100 мкМ обусловливал полное подавление 3-оксо-С12-АГЛ индуцируемого LasR-контролируемого QS у репортерного штамма E. coli DH5-lacZ, а использование данного соединения в концентрациях 37 и 100 мкМ позволило достичь 60% ингибирования образования биопленки и 70% ингибирования биосинтеза пиоцианина у P. aeruginosa PAO1.
Углубленный анализ механизма биоактивности сераорганических соединений с использованием протеомного и транскриптомного анализа позволил связать его с воздействием нa систему малых некодирующих РНК, реализующих свою регуляторную функцию в процессе РНК-интерференции. При этом эффект иберина заключался в нарушении функционирования внутриклеточной регуляторной сети Gac/Rsm (Tan et al., 2014), а аналогичный эффект аджоена проявлялся в нарушении экспрессии GacA-зависимых малых регуляторных РНК RsmY и RsmZ (Jakobsen et al., 2017), что приводило к ингибированию QS-зависимых проявлений безотносительно типа системы плотностно-зависимой коммуникации и природы автоиндуктора.
КЛАССИФИКАЦИОННОЕ ПОЛОЖЕНИЕ РАСТЕНИЙ – ПРОДУЦЕНТОВ ИНГИБИТОРОВ ПЛОТНОСТНО-ЗАВИСИМОЙ КОММУНИКАЦИИ У БАКТЕРИЙ
Присутствие определенных химических соединений в растительных тканях определяется наличием соответствующих метаболических путей, в которых малые молекулы – ингибиторы QS являются значимыми интермедиатами или конечными продуктами биосинтеза. В свою очередь эволюционная обусловленность подобных метаболических путей указывает на возможную приуроченность анализируемых соединений к отдельным растительным кладам, учитываемым в системе классификации APG IV (2016) и отражающих процесс их филогении.
Так присутствие терпенов обеспечивается активностью двух метаболических путей: MVA и MEP, ведущих к образованию сходных “изопреновых звеньев”, в дальнейшем используемых в качестве прекурсоров для биосинтеза широкого круга молекул различного функционального назначения. При этом для большинства растений характерным является мевалонатный путь, названный так по основному интермедиату (англ. – mevalonic acid pathway; MVA) и стартующий от ацетил-КоА (Miziorko, 2011). Альтернативный путь синтеза изопреноидов ‒ MEP (от англ. – methylerythritol phosphate pathway) начинается с пирувата и завершается образованием изопентенилпирофосфата (IPP) и диметилаллилпирофосфата (DMAPP), являющимися универсальными предшественниками изопрена, моно- и дитерпенов, каротиноидов и хлорофиллов (Banerjee, Sharkey, 2014). В свою очередь в геномах как минимум 17 растительных таксонов обнаруживается ген терпеноид-синтазы, с участием цитохрома P450 осуществляющей дальнейшую каталитическую модификацию основной структуры терпенов до терпеноидов (Boutanaev et al., 2014). Разнообразие возникающих в результате этих процессов соединений насчитывает от двадцати до тридцати тысяч малых молекул, типичных для многих хвойных растений, а у представителей клада core eudicots (настоящие двудольные) стабильно присутствующих в порядках Myrtales и Apiales (рис. 4).
Рис. 4.
Кладограмма, отображающая классификационное (филогенетическое) положение растений – продуцентов ингибиторов плотностно-зависимой коммуникации у бактерий (слева) и идентифицированные в их составе химические соединения с подобной активностью (справа).
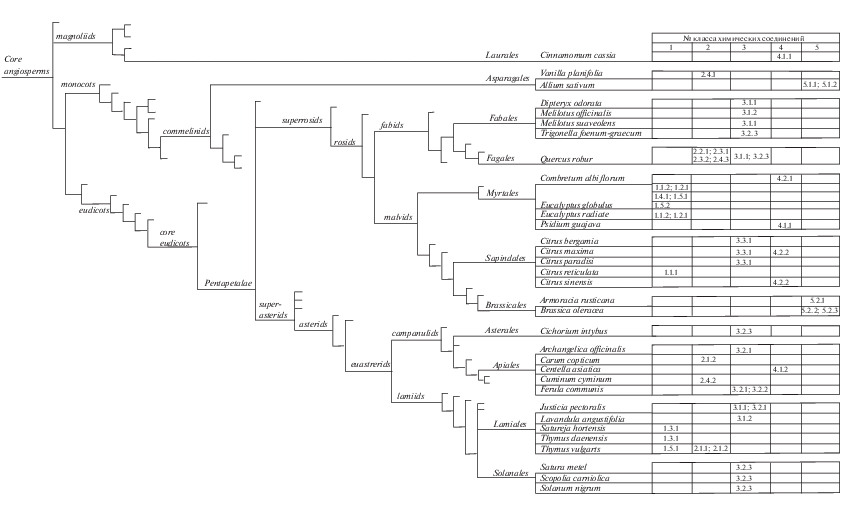
Фенольные соединения синтезируются несколькими способами, среди которых у высших растений основным является шикиматный путь, названный так по основному интермедиату – шикимовой кислоте и дающий начало пути биосинтеза фенольных кислот (например, галловой кислоты), а также фенилпропаноидному пути, ведущему к образованию широкого спектра фенольных соединений (например, ванилина) (Babenko et al., 2019). В то же время в образовании ряда фенольных соединений, например, тимола и корвакрола, вовлекаются метаболические пути синтеза монотерпенов (Majdi et al., 2017), а биосинтез эвгенола и кониферилового спирта происходит на основе многоступенчатых превращений аминокислоты тирозина (Harakava, 2005). Указанные обстоятельства определяют широту распространения фенолов, оцениваемых как третья по численности группа вторичных растительных метаболитов (около девяти тысяч соединений) (Crozier et al., 2008), присутствующих как среди представителей кладов core monocots (настоящие однодольные), так и core eudicots – в порядках Fagales, Apiales и Lamiales (в последнем случае совместно с близкими по путям биосинтеза терпенами) (рис. 4).
Соединения группы кумаринов также являются достаточно распространенной группой малых молекул растительного происхождения, обнаруживаемых среди многочисленных представителей core eudicots, в том числе у большинства цветковых растений, принадлежащих к порядкам Fabales, Sapindales, Asterales, Apiales, Lamiales и Solonales. При этом широта представительства кумаринов определяется универсальностью путей их биосинтеза, начинающихся от ароматических аминокислот (фенилаланина, тирозина) и идущих через ряд фенолокислот (коричную, кумаровую, кофейную, феруловую) с вовлечением реакций гидроксилирования, гликолиза и циклизации (Sarker, Nahar, 2017). Образующиеся в результате этого простые кумарины и их производные преимущественно обнаруживаются в корнях, коре и плодах (в меньшей степени в стеблях и листьях), где одной из их важных функций является защита от фитопатогенов, что традиционно связывается с прямой антимикробной активностью кумаринов (Ververidis et al., 2007), а в настоящее время органично дополняется доказанной кворум-ингибирующей активностью и способностью к подавлению образования бактериальных биопленок.
В свою очередь широта распространения флавоноидов определяется высокой представленностью т.н. “фенилпропаноидного” биосинтетического пути, в том числе обеспечивающего образование многих растительных полифенолов (см. выше). Названный метаболический путь начинается с использования аминокислоты фенилаланина для образования 4-кумароил-КоА, комбинирование которого с малонил-КоА ведет к образованию халконов, а конъюгированное замыкание последних как раз и приводит к типичной трехкольцевой структуре флавона (Mathesius et al., 2003). В дальнейшем этот путь может быть продолжен через серию ферментативных модификаций с образованием флаванонов → дигидрофлавонолов → → антоцианов. При этом присутствие флавонолов может быть обнаружено у классификационно и филогенетически достаточно удаленных представителей порядков Laurales, Myrtales и Apiales, а флавононы присутствуют в порядке Myrtales и особенно широко распространены среди цитрусовых из порядка Sapindales. В рассматриваемом контексте особенно интересно, что образование флавоноидов может стимулироваться при контакте растений-продуцентов с АГЛ, опосредующими системы плотностно-зависимой коммуникации у бактерий (Cowan, 1999). Так обработка корней люцерны усеченной (Medicago truncatula) автоиндукторами 3-оксо-C12-АГЛ и 3-оксо-C16-АГЛ приводила к значительным изменениям в уровне экспрессии 154 белков, связанных с окислительным стрессом, метаболизмом фитогормонов и биосинтезом флавоноидов, что подтверждает мнение о роли последних в антибактериальном фитоиммунитете (Delves-Broughton, 2012).
Финальная рассматриваемая группа – сераорганические соединения ‒ к настоящему моменту обнаруживается как у однодольных, так и двудольных растений. При этом среди представителей core monocots присутствие сульфоксидов показано для представителей порядка Asparagales, род Allium, где они возникают в результате серий ферментативных реакций, индуцируемых при повреждении растительных клеток (последнее косвенно подтверждает специализированную защитную функцию данной группы соединений) (Vincente, 2014). В частности, при повреждении клеток чеснока неактивный предшественник аллинин (S-2-пропенилцистеин) гидролизуется ферментом аллииназой до нестабильного тиосульфината аллицина (2-пропенил-2-пропентиолсульфината), в результате дальнейшей реарранжировки превращающегося в наиболее активный ингибитор “кворум сенсинга” ‒ аджоен. При этом для обсуждаемой группы малых молекул также характерными являются прямые антибактериальные и антиоксидантные эффекты (Burow et al., 2007). В свою очередь внутри core eudicots обнаруживается другая группа сераорганических соединений – изотиоционатов, характерных для представителей порядка Brassicales (капуста, хрен). Как и для обсуждаемой выше группы сераорганических соединений, их образование также происходит по механизму ферментативного гидролиза с участием ферментов мирозиназ, в присутствии воды отщепляющих глюкозную группу от предшественников ‒ глюкозинолатов с быстрым превращением продукта реакции в биологически активные тиоционат или изотиоцианат с широким спектром анти-QS активности.
ЗАКЛЮЧЕНИЕ
Плотностно-зависимая коммуникация у бактерий, часто обозначаемая термином “quorum sensing” и контролирующая их переход к вирулентному фенотипу с образованием биопленок, является одной из привлекательных мишеней для разработки нового поколения антибактериальных препаратов.
Перспективным источником для выделения и получения ингибиторов QS являются растительные субстраты, в том числе используемые традиционной (народной) медициной для терапии бактериальных инфекций. При этом проведенные скрининнговые исследования демонстрируют типичность обнаружения подобной активности у широкого круга растений различного классификационного положения, что характеризует анти-QS активность как новый механизм их защиты от бактериальных патогенов, дополняющей ранее известные механизмы врожденного фитоиммунитета.
Идентификация растительных соединений, являющихся носителями анти-QS активности, демонстрирует существенное разнообразие их структур, относящихся к терпенам и терпеноидам, фенолам и метоксифенолам, кумаринам, флавоноидам, сульфоксидам и изотиоцианатам. В свою очередь наиболее вероятной причиной подобного разнообразия является вариативность путей биосинтеза названных вторичных метаболитов у растений различного классификационного происхождения. С этой точки зрения растительные соединения с анти-QS активностью могут рассматриваться как продукты естественной эволюции растений, важным элементом которой является их коэволюция с агрессивным бактериальным окружением.
Отражением разнообразия химических структур идентифицированных соединений является и многообразие реализуемых ими механизмов подавления плотностно-зависимой коммуникации, включающих не только воздействие на синтазы автоиндукторов или воспринимающие их рецепторные белки (терпеноиды, флавоноиды), но и достаточно часто ‒ на внутриклеточные регуляторные пути, контролирующие “глобальные” изменения профилей генной экспрессии (кумарины, сераорганические соединения). В результате для растительных соединений характерен эффект, неспецифичный в отношении определенного вида микроорганизмов, типа QS и опосредующего его АИ, что должно обеспечивать растению-продуценту защиту от максимально широкого спектра бактериальных патогенов.
Обнаружение способности к подавлению плотностно-зависимой коммуникации у бактерий с использованием растительных субстратов и входящих в их состав химических соединений создает возможность их использования для замещения кормовых антибиотиков в системах кормления сельскохозяйственных животных, а при успехе этой стратегии формирует перспективу для тестирования наиболее эффективных молекул и их композиций в качестве кандидатных фармацевтических препаратов.
Список литературы
Дерябин Д.Г., Камаева А.А., Толмачева А.А., Эль-Регистан Г.И. Влияние алкилоксибензолов на индуцируемые гомосеринлактонами проявления кворум сенсинга у бактерий // Прикл. биохимия и микробиология. 2014. Т. 50. № 4. С. 391–397.
Deryabin D.G., Kamayeva A.A., Tolmacheva A.A., El-Registan G.I. The effects of alkylhydroxybenzenes on homoserine lactone-induced manifestations of quorum sensing in bacteria // Appl. Biochem. Microbiol. 2014. V. 50. P. 353‒358.
Adil M., Baig M.H., Rupasinghe H.P.V. Impact of citral and phloretin, alone and in combination, on major virulence traits of Streptococcus pyogenes // Molecules. 2019. V. 24. Art. 4237.
Adonizio A., Dawlaty J., Ausubel F., Clardy J., Mathee K. Ellagitannins from Conocarpus erectus exhibit anti-quorum sensing activity against Pseudomonas aeruginosa // Planta Medica. 2008. V. 74. https://doi.org/10.1055/s-0028-1084373
Adonizio A.L., Downum K., Bennett B.C., Mathee K. Antiquorum sensing activity of medicinal plants in southern Florida // J. Ethnopharmacol. 2006. V. 105. P. 427–435.
Al-Shabib N.A., Husain F.M., Ahmad I., Baig M.H. Eugenol inhibits quorum sensing and biofilm of toxigenic MRSA strains isolated from food handlers employed in Saudi Arabia // Biotechnol. Biotechnologic. Equipm. 2017. V. 31. P. 387–396.
Andersen J.B., Heydorn A., Hentzer M., Eberl L., Geisenberger O., Christensen B.B., Molin S., Givskov M. gfp-Based N-acyl homoserine-lactone sensor systems for detection of bacterial communication // Appl. Environ. Microbiol. 2001. V. 67. P. 575‒585.
Asfahl K.L., Schuster M. Additive effects of quorum sensing anti-activators on Pseudomonas aeruginosa virulence traits and transcriptome // Front. Microbiol. 2017. V. 8. Art. 2654.
Babenko L.M., Smirnov O.E., Romanenko K.O., Trunova O.K., Kosakivska I.V. Phenolic compounds in plants: biogenesis and functions // Ukr. Biochem. J. 2019. V. 91. № 3. P. 5‒18.
Bais H.P., Ravishankar G.A. Cichorium intybus L. – cultivation, processing, utility, value addition and biotechnology, with an emphasis on current status and future prospects // J. Sci. Food Agric. 2001. V. 81. P. 467‒484.
Banerjee A., Sharkey T.D. Methylerythritol 4-phosphate (MEP) pathway metabolic regulation // Nat. Prod. Rep. 2014. V. 31. P. 1043‒1055.
Boutanaev A.M., Moses T., Zi J., Nelson D.R., Mugford S.T., Peters R.J., Osbourn A. Investigation of terpene diversification across multiple sequenced plant genomes // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. E81‒E88. https://doi.org/10.1073/pnas.1419547112
Burow M., Bergner A., Gershenzon J., Wittstock U. Glucosinolate hydrolysis in Lepidium sativum – identification of the thiocyanate-forming protein // Plant Mol. Biol. 2007. V. 63. P. 49–61.
Burt S.A., Ojo-Fakunle V.T., Woertman J., Veldhuizen E.J. The natural antimicrobial carvacrol inhibits quorum sensing in Chromobacterium violaceum and reduces bacterial biofilm formation at sub-lethal concentrations // PLoS One. 2014. V. 9. e93414.
Byeon J.-Y., Sim J., Ryu E.-J., Sim J., Lee H., Cho K.-H., Choi B.-K., Lee J. In silico development of quorum-sensing inhibitors // Bull. Korean Chem. Soc. 2017. V. 38. P. 728–734.
Cáceres M., Hidalgo W., Stashenko E., Torres R., Ortiz C. Essential oils of aromatic plants with antibacterial, anti-biofilm and anti-quorum sensing activities against pathogenic bacteria // Antibiotics (Basel). 2020. V. 9. Art. 147.
Camele I., Elshafie H.S., Caputo L., De Feo V. Anti-quorum sensing and antimicrobial effect of mediterranean plant essential oils against phytopathogenic bacteria // Front. Microbiol. 2019. V. 10. Art. 2619.
Choo J.H., Rukayadi Y., Hwang J.K. Inhibition of bacterial quorum sensing by vanilla extract // Lett. Appl. Microbiol. 2006. V. 42. P. 637–641.
Cowan M.M. Plant products as antimicrobial agents // Clin. Microbiol. Rev. 1999. V. 12. P. 564‒582.
Crozier A., Jaganath I.B., Clifford M.N. Phenols, polyphenols and tannins // Plant Secondary Metabolites: Occurrence, Structure and Role in the Human Diet / Eds. Crozier A., Clifford M., Ashihara H. Oxford, UK: Blackwell, 2008. P. 1‒24.
Cruz C.D., Shah S., Tammela P. Defining conditions for biofilm inhibition and eradication assays for Gram-positive clinical reference strains // BMC Microbiol. 2018. V. 18. P. 173.
D’Almeida R.E., Molina R.D.I., Viola C.M., Luciardi M.C., Nieto Peñalver C., Bardón A., Arena M.E. Comparison of seven structurally related coumarins on the inhibition of Quorum sensing of Pseudomonas aeruginosa and Chromobacterium violaceum // Bioorg. Chem. 2017. V. 73. P. 37–42.
Defoirdt T. Quorum-sensing systems as targets for antivirulence therapy // Trends Microbiol. 2018. V. 26. P. 313‒328.
Delves-Broughton J. Natural Antimicrobials as Additives and Ingredients for the Preservation of Foods and Beverages. Natural Food Additives, Ingredients and Flavourings. CRC Press, 2012. 26 p.
Deryabin D.G., Tolmacheva A.A. Antibacterial and anti-quorum sensing molecular composition derived from Quercus cortex (Oak bark) extract // Molecules. 2015. V. 20. P. 17093‒17108.
Egland K.A., Greenberg E.P. Quorum sensing in Vibrio fischeri: elements of the luxl promoter // Mol. Microbiol. 1999. V. 31. P. 1197‒1204.
Elharas K., Daagare A., Mesfioui A., Ouhssine M. Activité antibactérienne de l’huile essentielle des inflorescences de Laurus nobilis et Lavandula angustifolia // Afrique Sci. 2013. V. 9. P. 134‒141.
Fong J., Yuan M., Jakobsen T.H., Mortensen K.T., DelosSantos M.M., Chua S.L., Yang L., Tan C.H., Nielsen T.E., Givskov M. Disulfide bond-containing ajoene analogues as novel quorum sensing inhibitors of Pseudomonas aeruginosa // J. Med. Chem. 2017. V. 60. P. 215‒227.
Ganin H., Rayo J., Amara N., Levy N., Krief P., Meijler M. Sulforaphane and erucin, natural isothiocyanates from broccoli, inhibit, bacterial quorum sensing // Med. Chem. Commun. 2013. V. 4. P. 175‒179.
Girennavar B., Cepeda M.L., Soni K.A., Vikram A., Jesudhasan P., Jayaprakasha G.K., Pillai S.D., Patil B.S. Grapefruit juice and its furocoumarins inhibits autoinducer signaling and biofilm formation in bacteria // Int. J. Food Microbiol. 2008. V. 125. P. 204–208.
Gutiérrez-Barranquero J.A., Reen F.J., McCarthy R.R., O’Gara F. Deciphering the role of coumarin as a novel quorum sensing inhibitor suppressing virulence phenotypes in bacterial pathogens // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 3303–3316.
Han X.L., Wang H., Zhang Z.H., Tan Y., Wang J.H. Study on chemical constituents in seeds of Datura metel from Xinjiang // J. Chin. Med. Mater. 2015. V. 38. P. 1646–1648.
Harakava R. Genes encoding enzymes of the lignin biosynthesis pathway in Eucalyptus // Genet. Mol. Biol. 2005. V. 28. P. 601–607.
Härmälä P., Vuorela H., Hiltunen R., Nyiredy Sz., Sticher O., Törnquist K., Kaltia S. Strategy for the isolation and identification of coumarins with calcium antagonistic properties from the roots of Angelica archangelica // Phytochem. Anal. 1992. V. 3. P. 42–48.
Hernando-Amado S., Alcalde-Rico M., Gil-Gil T., Valverde J.R., Martinez J.L. Naringenin inhibition of the Pseudomonas aeruginosa quorum sensing response is based on its time-dependent competition with N-(3-oxo-dodecanoyl)-L-homoserine lactone for LasR binding // Front. Mol. Biosci. 2020. V. 7. Art. 25. https://doi.org/10.3389/fmolb.2020.00025
Hixon M., Johnson D. Density dependence and independence // Encyclopedia of Life Sciences. Chichester: John Wiley & Sons Ltd., 2009. P. 1‒6. https://doi.org/10.1002/9780470015902.a0021219
Hossain M.A., Lee S., Park N.-H., Mechesso A.F., Birhanu B.T., Kang J., Reza M.A., Suh J.-W., Park S.-C. Impact of phenolic compounds in the acyl homoserine lactone-mediated quorum sensing regulatory pathways // Sci. Rep. 2017. V. 7. Art. 10618.
Hou H.M., Jiang F., Zhang G.L., Wang J.Y., Zhu Y.H., Liu X.Y. Inhibition of Hafnia alvei H4 biofilm formation by the food additive dihydrocoumarin // J. Food Prot. 2017. V. 12. P. 842–847.
Jakobsen T.H., Bragason S.K., Phipps R.K., Christensen L.D., Gennip M.V., Alhede M., Skindersoe M., Larsen T.O., Høiby N., Barnsholt T. Food as a source for quorum sensing inhibitors: iberin from horseradish revealed as a quorum sensing inhibitor of Pseudomonas aeruginosa // Appl. Environ. Microbiol. 2012. V. 78. P. 2410‒2421.
Jakobsen T.H., vanGennip M., Phipps R.K., Shanmugham M.S., Christensen L.D., Alhede M., Skindersoe M.E., Rasmussen T.B., Friedrich K., Uthe F., Jensen P.Ø., Moser C., Nielsen K.F., Eberl L., Larsen T.O., Tanner D., Høiby N., Bjarnsholt T., Givskov M. Ajoene, a sulfur-rich molecule from garlic, inhibits genes controlled by quorum sensing // Antimicrob. Agents Chemother. 2012. V. 56. P. 2314–2325.
Jakobsen T.H., Warming A.N., Vejborg R.M., Moscoso J.A., Stegger M., Lorenzen F., Rybtke M., Andersen J.B., Petersen R., Andersen P.S., Nielsen T.E., Tolker-Nielsen T., Filloux A., Ingmer H., Givskov M. A broad range quorum sensing inhibitor working through sRNA inhibition // Sci. Rep. 2017. V. 7. Art. 9857.
Kendall M.M., Rasko D.A., Sperandio V. Global effects of the cell-to-cell signaling molecules autoinducer-2, autoinducer-3, and epinephrine in a luxS mutant of enterohemorrhagic Escherichia coli // Infect. Immun. 2007. V. 75. P. 4875‒4884.
Kim B., Park J.-S., Choi H.-Y., Kwak J.-H., Kim W.-G. Differential effects of alkyl gallates on quorum sensing in Pseudomonas aeruginosa // Sci. Rep. 2019. V. 9. Art. 7741.
Kim C.S., Gatsios A., Cuesta S., Lam Y.C., Wei Z., Chen H., Russell R.M., Shine E.E., Wang R., Wyche T.P., Piizzi G., Flavell R.A., Palm N.W., Sperandio V., Crawford J.M. Characterization of autoinducer-3 structure and biosynthesis in E. coli // ACS Cent. Sci. 2020. V. 6. P. 197‒206.
Koh C.L., Sam C.K., Yin W.F., Tan L.Y., Krishnan T., Chong Y.M., Chan K.G. Plant-derived natural products as sources of anti-quorum sensing compounds // Sensors (Basel). 2013. V. 13. P. 6217‒6228.
Koh K.H., Tham F.Y. Screening of traditional Chinese medicinal plants for quorum-sensing inhibitors activity // J. Microbiol. Immunol. Infect. 2011. V. 44. P. 144‒148.
Kong C., Eng S.A., Lim M.P., Nathan S. Beyond traditional antimicrobials: a Caenorhabditis elegans model for discovery of novel antiinfectives // Front. Microbiol. 2016. V. 7. Art. 1956. https://doi.org/10.3389/fmicb.2016.01956
Kovaleva A.M., Grud’Ko I.V., Aleksandrov, A.N., Komissarenko A.N. GC/MS study of the chloroform fraction of Melilotus officinalis // Chem. Nat. Compd. 2009. V. 45. P. 585–586.
Le K.Y., Otto M. Quorum-sensing regulation in staphylococci-an overview // Front. Microbiol. 2015. V. 6. Art. 1174.
Lee J.H., Kim Y.G., Cho H.S., Ryu S.Y., Cho M.H., Lee J. Coumarins reduce biofilm formation and the virulence of Escherichia coli O157:H7 // Phytomedicine. 2014. V. 21. P. 1037–1042.
Li T., Mei Y., He B., Sun X., Li J. Reducing quorum sensing-mediated virulence factor expression and biofilm formation in Hafnia alvei by using the potential quorum sensing inhibitor L-carvone // Front. Microbiol. 2019. V. 9. Art. 3324. https://doi.org/10.3389/fmicb.2018.03324
Li Y.H., Tian X. Quorum sensing and bacterial social interactions in biofilms // Sensors (Basel). 2012. V. 12. P. 2519‒2538.
Lin L., Wang J., Yu J., Li Y., Liu, G. Effects of alicinon the formation of Pseudomonas aeruginosa biofilm and the production of quorum-sensing controlled virulence factors // Pol. J. Microbiol. 2013. V. 62. P. 243–251.
Lino C.S., Taveira M.L., Viana G.S. B., Matos F.J.A. Analgesic and antiinflammatory activities of Justicia pectoralis Jacq. and its main constituents: coumarin and umbelliferone // Phytother. Res. 1997. V. 11. P. 211–215.
Liua H., Wang Y., Cao J., Jiang H., Yao J., Gong G., Chen X., Xu W., He X. Antimicrobial activity and virulence attenuation of citral against the fish pathogen Vibrio alginolyticus // Aquaculture. 2020. V. 515. Art. 734578.
Lou Z., Letsididi K.S., Yu F., Pei Z., Wang H., Letsididi R. Inhibitive effect of eugenol and its nanoemulsion on quorum sensing-mediated virulence factors and biofilm formation by Pseudomonas aeruginosa // J. Food Prot. 2019. V. 82. P. 379–389.
Lu L., Li M., Yi G., Liao L., Cheng Q., Zhu J., Zhang B., Wang Y., Chen Y., Zeng M. Screening strategies for quorum sensing inhibitors in combating bacterial infection // J. Pharm. Anal. 2021. In press. https://doi.org/10.1016/j.jpha.2021.03.009
Luciardi M.C., Blàzquez M.A., Cartagena E., Bardon A., Arena M.E. Mandarin essential oils inhibit quorum sensing and virulence factors of Pseudomonas aeruginosa // LWT Food Sci. Technol. 2016. V. 68. P. 373–380.
Luís A., Duarte A., Gominho J., Domingues F., Duarte A.P. Chemical composition, antioxidant, antibacterial and anti-quorum sensing activities of Eucalyptus globulus and Eucalyptus radiata essential oils // Ind. Crops Prod. 2016. V. 79. P. 274–282.
Majdi M., Malekzadeh-Mashhady A., Maroufi A., Crocoll C. Tissue-specific gene-expression patterns of genes associated with thymol/carvacrol biosynthesis in thyme (Thymus vulgaris L.) and their differential changes upon treatment with abiotic elicitors // Plant Physiol. Biochem. 2017. V. 115. P. 152‒162.
Mathesius U., Mulders S., Gao M., Teplitski M., Caetano-Anolles G., Rolfe B.G., Bauer W.D. Extensive and specific responses of a eukaryote to bacterial quorum-sensing signals // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 1444–1449.
McClean K.H., Winson M.K., Fish L., Taylor A., Chhabra S.R., Camara M., Daykin M., Lamb J.H., Swift S., Bycroft B.W., Stewart G.S., Williams P. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones // Microbiology (SGM). 1997. V. 143. P. 3703‒3711.
Merghni A., Noumi E., Hadded O., Dridi N., Panwar H., Ceylan O., Mastouri M., Snoussi M. Assessment of the antibiofilm and antiquorum sensing activities of Eucalyptus globulus essential oil and its main component 1,8-cineole against methicillin-resistant Staphylococcus aureus strains // Microb. Pathog. 2018. V. 118. P. 74–80.
Miller M.B., Bassler B.L. Quorum sensing in bacteria // Annu. Rev. Microbiol. 2001. V. 55. P. 165‒199.
Miziorko H. Enzymes of the mevalonate pathway of isoprenoid biosynthesis // Arch. Biochem. Biophys. 2011. V. 505. P. 131‒143.
Myszka K., Schmidt M.T., Majcher M., Juzwa W., Olkowicz M., Czaczyk K. Inhibition of quorum sensing-related biofilm of Pseudomonas fluorescens KM121 by Thymus vulgare essential oil and its major bioactive compounds // Int. Biodeter. Biodegr. 2016. V. 114. P. 252–259.
Ni N., Choudhary G., Li M., Wang B. Pyrogallol and its analogs can antagonize bacterial quorum sensing in Vibrio harveyi // Bioorg. Med. Chem. Lett. 2008. V. 18. P. 1567–1572.
Ouyang J., Sun F., Feng W., Sun Y., Qiu X., Xiong L., Liu Y., Chen Y. Quercetin is an effective inhibitor of quorum sensing, biofilm formation and virulence factors in Pseudomonas aeruginosa // J. Appl. Microbiol. 2016. V. 120. P. 966–974.
Ouzir M., El Bairi K., Amzazi S. Toxicological properties of fenugreek (Trigonella foenum graecum) // Food Chem. Toxicol. 2016. V. 96. P. 145–154.
Packiavathy I.A., Agilandeswari P., Musthafa K.S., Pandian S., Ravi A. Antibiofilm and quorum sensing inhibitory potential of Cuminum cyminum and its secondary metabolite methyl eugenol against Gram negative bacterial pathogens // Food Res. Int. 2012. V. 45. P. 85–92.
Paczkowski J.E., Mukherjee S., McCready A.R., Cong J.-P., Aquino C.J., Kim H., Henke B.R., Smith C.D., Bassler B.L. Flavonoids suppress Pseudomonas aeruginosa virulence through allosteric inhibition of quorum-sensing receptors // J. Biol. Chem. 2017. V. 292. P. 4064–4076.
Panche A.N., Diwan A.D., Chandra S.R. Flavonoids: an overview // J. Nutr. Sci. 2016. V. 5. e47.
Papenfort K., Bassler B.L. Quorum sensing signal-response systems in Gram-negative bacteria // Nat. Rev. Microbiol. 2016. V. 14. P. 576–588.
Pereira C.S., Thompson J.A, Xavier K.B. AI-2-mediated signalling in bacteria // FEMS Microbiol. Rev. 2013. V. 37. P. 156–181.
Pérez-Giraldo C., Cruz-Villalón G., Sánchez-Silos R., Martínez-Rubio R., Blanco M., Gómez-García A. In vitro activity of allicin against Staphylococcus epidermidis and influence of subinhibitory concentrations on biofilm formation // J. Appl. Microbiol. 2003. V. 95. P. 709–711.
Ponnusamy K., Paul D., Kweon J.H. Inhibition of quorum sensing mechanism and Aeromonas hydrophila biofilm formation by vanillin // Environ. Engin. Sci. 2009. V. 26. P. 1359–1363.
Reen F.J., Gutiérrez-Barranquero J.A., Parages M.L., O’Gara F. Coumarin: a novel player in microbial quorum sensing and biofilm formation inhibition // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 2063–2073.
Rutherford S.T., Bassler B.L. Bacterial quorum sensing: its role in virulence and possibilities for its control // Cold Spring Harb. Perspect. Med. 2012. V. 2. P. a012427.
Rzhepishevska O., Limanska N., Galkin M., Lacoma A., Lundquist M., Sokol D., Hakobyan S., Sjöstedt A., Prat C., Ramstedt M. Characterization of clinically relevant model bacterial strains of Pseudomonas aeruginosa for anti-biofilm testing of materials // Acta Biomater. 2018. V. 76. P. 99‒107.
Sarker S.D., Nahar L. Progress in the chemistry of naturally occurring coumarins // Progress in the Chemistry of Organic Natural Products / Eds. Kinghorn A., Falk H., Gibbons S., Kobayashi J. Springer, 2017. V. 106. P. 241‒304.
Schreier P., Wörner M. Flüchtige inhaltsstoffe aus tonkabohnen (Dipteryx odorata Willd.) // Eur. Food Res. Technol. 1991. V. 193. P. 21–25.
Sharifi A., Mohammadzadeh A., Zahraei Salehi T., Mahmoodi P. Antibacterial, antibiofilm and antiquorum sensing effects of Thymus daenensis and Saturejahortensis essential oils against Staphylococcus aureus isolates // J. Appl. Microbiol. 2018. V. 124. P. 379–388.
Skogman M.E., Kanerva S., Manner S., Vuorela P.M., Fallarero A. Flavones as quorum sensing inhibitors identified by a newly optimized screening platform using Chromobacterium violaceum as reporter bacteria // Molecules. 2016. V. 21. P. 1211.
Snoussi M., Noumi E., Punchappady-Devasya R., Trabelsi N., Kanekar S., Nazzaro F., Fratianni F., Flamini G., De Feo V., Al-Sieni A. Antioxidant properties and anti-quorum sensing potential of Carum copticum essential oil and phenolics against Chromobacterium violaceum // J. Food Sci. Technol. 2018. V. 55. P. 2824–2832.
Swatton J.E., Davenport P.W., Maunders E.A., Griffin J.L., Lilley K.S., Welch M. Impact of azithromycin on the quorum sensing-controlled proteome of Pseudomonas aeruginosa // PLoS One. 2016. V. 11. e0147698.
Swift S., Downie J.A., Whitehead N.A., Barnard A.M., Salmond G.P., Williams P. Quorum sensing as a population-density-dependent determinant of bacterial physiology // Adv. Microb. Physiol. 2001. V. 45. P. 199‒270.
Tan S.Y., Liu Y., Chua S.L., Vejborg R.M., Jakobsen T.H., Chew S.C., Li Y., Nielsen T.E., Tolker-Nielsen T., Yang L., Givskov M. Comparative systems biology analysis to study the mode of action of the isothiocyanate compound Iberin on Pseudomonas aeruginosa // Antimicrob. Agents Chemother. 2014. V. 58. P. 6648‒6659.
Tapia-Rodriguez M.R., Bernal-Mercado A.T., Gutierrez-Pacheco M.M., Vazquez-Armenta F.J., Hernandez-Mendoza A., Gonzalez-Aguilar G.A., Martinez M.A., Nazzaro F., Ayala-Zavala J. F. Virulence of Pseudomonas aeruginosa exposed to carvacrol: alterations of the Quorum sensing at enzymatic and gene levels // J. Cell Commun. Signal. 2019. V. 13. P. 531–537.
The Angiosperm Phylogeny Group. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV // Botan. J. Linnean Soc. 2016. V. 181. P. 1–20.
Tolmacheva A.A., Rogozhin E.A., Deryabin D.G. Antibacterial and quorum sensing regulatory activities of some traditional Eastern-European medicinal plants // Acta Pharm. 2014. V. 64. P. 173‒186.
Truchado P., Giménez-Bastida J.A., Larrosa M., Castro-Ibáñez I., Espín J.C., Tomás-Barberán F.A., García-Conesa M.T., Allende A. Inhibition of quorum sensing (QS) in Yersinia enterocolitica by an orange extract rich in glycosylated flavanones // J. Agric. Food Chem. 2012. V. 60. P. 8885–8894.
van derWorp H.B., Howells D.W., Sena E.S., Porritt M.J., Rewell S., O’Collins V., Macleod M.R. Can animal models of disease reliably inform human studies? // PLoS Med. 2010. V. 7. P. e1000245.
Vandeputte O.M., Kiendrebeogo M., Rasamiravaka T., Stévigny C., Duez P., Rajaonson S., Diallo B., Mol A., Baucher M., El Jaziri M. The flavanone naringenin reduces the production of quorum sensing-controlled virulence factors in Pseudomonas aeruginosa PAO1 // Microbiology (SGM). 2011. V. 157. P. 2120–2132.
Vasavi H.S., Arun A.B., Rekha P.D. Anti-quorum sensing activity of Psidium guajava L. flavonoids against Chromobacterium violaceum and Pseudomonas aeruginosa PAO1 // Microbiol. Immunol. 2014. V. 58. P. 286–293.
Vasavi H.S., Arun A.B., Rekha P.D. Anti-quorum sensing activity of flavonoid-rich fraction from Centella asiatica L. against Pseudomonas aeruginosa PAO1 // J. Microbiol. Immunol. Infect. 2016. V. 49. P. 8–15.
Ververidis F., Trantas E., Douglas C., Vollmer G., Kretzschmar G., Panopoulos N. Biotechnology of flavonoids and other phenylpropanoid-derived natural products. Part I: Chemical diversity, impacts on plant biology and human health // Biotechnol. J. 2007. V. 2. P. 1214‒1234.
Vikram A., Jayaprakasha G.K., Jesudhasan P.R., Pillai S.D., Patil B.S. Suppression of bacterial cell-cell signalling, biofilm formation and type III secretion system by citrus flavonoids // J. Appl. Microbiol. 2010. V. 109. P. 515–527.
Vincente A.R., Manganaris G.A., Ortiz C.M., Sozzi G.O., Crisosto C.H. Nutritional Quality of Fruits and Vegetables. Postharvest Handling. Academic Press, 2014. 192 p.
Wang Y., Dong W., Odah K.A., Kong L., Ma H. Transcriptome analysis reveals AI-2 relevant genes of multi-drug resistant Klebsiella pneumoniae in response to eugenol at sub-MIC // Front. Microbiol. 2019. V. 10. Art. 1159.
Wang Y.-H., Avula B., Nanayakkara N. P. D., Zhao J., Khan I.A. Cassia cinnamon as a source of coumarin in cinnamon-favored food and food supplements in the united states // J. Agric. Food Chem. 2013. V. 61. P. 4470–4476.
Winson M.K., Swift S., Fish L., Throup J.P., Jørgensen F., Chhabra S.R., Bycroft B.W., Williams P., Stewart G.S. Construction and analysis of luxCDABE-based plasmid sensors for investigating N-acyl homoserine lactone-mediated quorum sensing // FEMS Microbiol. Lett. 1998. V. 163. P. 185‒192.
Yu S.M., Hu D.H., Zhang J.J. Umbelliferone exhibits anticancer activity via the induction of apoptosis and cell cycle arrest in HepG2 hepatocellular carcinoma cells // Mol. Med. Rep. 2015. V. 12. P. 3869‒3873.
Zhang Y., Sass A., Acker H.V., Wille J., Verhasselt B., Nieuwerburgh F.V., Kaever V., Crabbé A., Coenye T. Coumarin reduces virulence and biofilm formation in Pseudomonas aeruginosa by affecting quorum sensing, type iii secretion and C-di-GMP levels // Front. Microbiol. 2018. V. 9. Art. 1952.
Zhao Y., Liu F., Lou H.X. Studies on the chemical constituents of Solanum nigrum // Zhong Yao Cai (in Chinese). 2010. V. 33. P. 555–556.
Zunying L., Yurong P., Xiaoshuang L., Jinxin J., Mingyong Z. Chemical composition, antimicrobial and anti-quorum sensing activities of pummelo peel flavonoid extract // Ind. Crops and Products. 2017. V. 109. P. 862–868.
Дополнительные материалы отсутствуют.


