Микробиология, 2021, T. 90, № 6, стр. 763-768
Высокоперсистерные штаммы углеводородокисляющих бактерий как основа для повышения количества жизнеспособных клеток при длительном хранении
Ю. А. Николаев a, *, Н. Г. Лойко a, Е. В. Дёмкина a, И. А. Борзенков a, Т. А. Канапацкий a, Г. И. Эль-Регистан a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: NikolaevYA@mail.ru
Поступила в редакцию 14.07.2021
После доработки 18.07.2021
Принята к публикации 18.07.2021
Аннотация
Повышение стабильности биопрепаратов на основе углеводородокисляющих бактерий (УОБ), используемых для биоремедиации нефтезагрязненных объектов окружающей среды, является актуальной задачей вследствие частых и массовых разливов нефти. В настоящем исследовании с целью повышения титра жизнеспособных клеток при хранении жидких культур УОБ в неблагоприятных для длительного выживания условиях (температура 18–24°С, доступ кислорода) разработан новый подход, предполагающий создание штамма, образующего повышенное количество клеток-персистеров (высокоперсистерный штамм, ВПШ). ВПШ УОБ Acinetobacter seifertii WS1 получен методом антибиотической селекции с использованием ципрофлоксацина. После 13 последовательных циклов селекции доля клеток-персистеров в популяции выросла с исходного уровня 1.2 до 52%. При хранении полученного ВПШ A. seifertii в течение нескольких месяцев выживало в 2–4 раза больше клеток, чем в контрольной культуре. Новый штамм сохранял способность к образованию высокого уровня клеток-персистеров при множественных пассажах без антибиотической селекции. После хранения в течение 4 мес. культура ВПШ окисляла нефть со скоростью в 2–4 раза более высокой, чем контрольная культура. Разработанный подход повышения титра жизнеспособных клеток при их длительном хранении применен впервые и может быть использован для нужд экобиотехнологии.
Фенотипическая гетерогенность микробных популяций является их конститутивным свойством, обеспечивающим адаптацию и выживание популяций в постоянно меняющихся условиях внешней среды. В литературе широко рассматривается внутрипопуляционная гетерогенность, приводящая к выживанию в стрессовых и неростовых условиях (например, при воздействии бактериоцидных антибиотиков) одной субпопуляции за счет гибели другой. Такая адаптационная стратегия основана на диверсификации изогенной (и даже моноклональной) бактериальной популяции и может рассматриваться в качестве одного из известных феноменов: (1) каннибализм у спорообразующих бактерий в голодающей культуре, когда одна субпопуляция, с низким уровнем белка SpoОA, лизируется и служит дополнительным источником питания для другой субпопуляции, с более высоким уровнем этого белка, “включающим” программу спорообразования (Veening et al., 2005; Lopez, Kolter, 2010); (2) автолиз одной субпопуляции Streptococcus pneumoniae приводит к появлению в среде свободной ДНК, которая захватывается компетентными клетками другой субпопуляции, вследствие чего осуществляется передача признаков вирулентности в популяции в целом (Dagkessamanskaia et al., 2004; Guiral et al., 2005); (3) персистенция – это способность одной из субпопуляций, ‒ клеток-персистеров, выживать при воздействии бактерицидных препаратов при одновременной гибели клеток другой субпопуляции (Balaban et al., 2019), продукты автолиза которой способствуют выживанию персистеров (Grant et al., 2012). Клетки-персистеры (П) всегда образуются в развивающейся культуре (П второго типа), но в большем количестве – в культуре стационарной фазы роста (П первого типа) (до 1.0% от общего числа клеток популяции); в новом цикле роста П воспроизводят родительскую популяцию, чувствительную к антибиотикам и другим стрессорам и образующую вновь П (Lewis, 2010; Van der Bergh et al., 2017; Balaban et al., 2019). Показано, что применение антибиотиков обусловливает приобретение к ним устойчивости за счет как появления антибиотикорезистентных штаммов, так и отбора высокоперсистерных клонов (Van der Bergh et al., 2016a; Bakkeren et al., 2020; Sulaiman, Lam, 2021). Для изучения П как основного фенотипа развития устойчивости к антибиотикам был предложен способ получения высокоперсистерных штаммов (Van der Bergh et al., 2016b). Нами в предыдущих исследованиях была выдвинута гипотеза о созревании П, в которых прошли процессы цитодифференцировки (Balaban et al., 2004, 2019), в цистоподобные покоящиеся формы (ПФ) (Лойко и соавт., 2015; Мулюкин и соавт., 2015), устойчивые к повреждающим воздействиям и сохраняющие жизнеспособность в течение длительного времени (месяцы–годы–миллионы лет) (Эль-Регистан и соавт., 2006). Применение таких ПФ для создания бактериальных препаратов как экологического, так и других назначений, представляется перспективным. В частности, стабилизация жидких биопрепаратов углеводородокисляющих бактерий является актуальной задачей, т.к. они широко используются для целей биоремедиации экотопов, загрязненных нефтепродуктами (Das, Chandran, 2011).
Целью настоящего исследования явилось получение высокоперсистерных штаммов углеводородокисляющих грамотрицательных бактерий и исследование сохранения ими жизнеспособности при длительном хранении.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. В работе использовали штамм Acinetobacter seifertii WS1 из коллекции культур лаборатории нефтяной микробиологии Института микробиологии ФИЦ Биотехнологии РАН, способный к окислению углеводородов.
Культивирование и определение углеводородокисляющей активности бактерий. Культуру бактерий A. seifertii WS1 для получения биопрепарата выращивали в богатой питательной среде LB (Miller, “Sigma-Аldrich”) в колбах объемом 250 мл с 50 мл среды при температуре 28–30°С на орбитальной качалке (100 об./мин) до стационарной фазы роста. Функциональную (углеводородокисляющую) активность культуры A. seifertii после хранения проверяли при росте в минеральной среде Раймонда (г/л): CaCl2 ⋅ 6H2O – 0.01; MnSO4 ⋅ 5H2O – 0.02; FeSO4 ⋅ 7H2O – 0.01; Na2HPO4 – 1.5; KH2PO4 – 1.0; MgSO4 ⋅ 7H2O – 0.2; NH4NO3 – 1.0; NaCl – 5.0; pH 6.8–7.2. В качестве единственного источника углерода и энергии в минеральную среду использовали сырую нефть (Черeмуховское месторождение, Республика Татарстан, РФ) в концентрации 2 об. %. Бактерии после 4 мес. хранения при 18–24°С и свободном доступе воздуха вносили в среду культивирования (200 мкл, что соответствует ≈6 × 108 кл.). Выращивание бактериальных клеток проводили в герметично закрытых флаконах объемом 120 мл с 10 мл среды при температуре 30°С на качалке (100 об./мин). О росте культур и, соответственно, потреблении нефти судили по эмиссии СО2 (накоплению газа в воздушной фазе) с помощью газового хроматографа Кристалл 5000 (“Хроматэк”, Россия).
Получение высокоперсистерных штаммов. Высокоперсистерные штаммы (ВПШ) A. seifertii получали по схеме, описанной в работе Van der Bergh и соавт. (2016а). В пробирки с 5 мл среды LB и антибиотиком ципрофлоксацином (2 мкг/мл, раствор для инфузий; “Курган-синтез”, РФ) вносили 100 мкл культуры стационарной фазы роста, выращенной на среде LB до конечной концентрации (5.9 ± 0.4) × 107 кл./мл. Через 3.5 ч (время инкубации с антибиотиком оптимизировано в предварительных экспериментах) определяли количество жизнеспособных клеток (титр колониеобразующих единиц, КОЕ при рассеве на плотные среды), отмывали клетки от антибиотика (при помощи центрифугирования при 5000 g в течение 10 мин) 4 раза фосфатным буфером (0.05 М, рН 7.0). Отмытые клетки разводили в 103, 104, 105 раз и использовали в качестве инокулята для выращивания A. seifertii в среде LB, как описано выше. Клеточную популяцию, выросшую в варианте опыта с наибольшим разведением инокулята, использовали для следующего цикла экспериментов, как описано выше. Стабильность ВПШ проверяли путем девятикратных пересевов в жидкие (LB) и на плотные (LА) среды без антибиотиков. Жизнеспособность бактериальных клеток в длительно хранящихся культурах определяли по числу КОЕ при высеве клеточных суспензий из десятичных разведений на агаризованную среду LА.
Статистическая обработка данных. Исследования проводили в двух–трехкратной повторности по два параллельных эксперимента в каждом. При расчете титра КОЕ определяли среднее арифметическое и экспериментальный разброс (ошибку) (функция Excell “среднее отклонений экспериментальных значений от среднего”) из 5–7 параллельных проб с использованием программы Microsoft Office Excell 2007. Различия между вариантами считали значимыми, если они превышали экспериментальную ошибку (для экспериментов по определению КОЕ не более 30%). На рисунках представлены результаты типичных экспериментов, каждая точка представляет среднее арифметическое и экспериментальный разброс.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
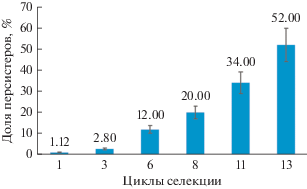
Исходное количество клеток-персистеров первого типа (П I) в культуре A. seifertii дикого типа (ДТ) составляло 1.12% (рис. 1). В качестве селектирующего агента применяли антибиотик ципрофлоксацин. Как видно из рис. 1, с каждым циклом селекции доля клеток-персистеров возрастала. Через 13 циклов селектирующей обработки антибиотиком был получен штамм, численность персистеров у которого составляла 52%. Это свойство стабильно сохранялось в течение последующих 9 пересевов в свежую жидкую (LB) или на плотную (LA) среды без антибиотиков.
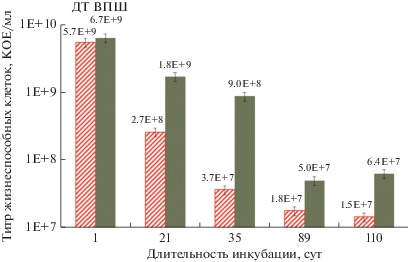
При хранении в течение 110 сут исходного (ДТ, дикий тип) штамма и ВПШ после 13 циклов обработки антибиотиком титр жизнеспособных клеток у штамма ДТ снижался более чем на два порядка. У ВПШ число жизнеспособных клеток было выше в 2–4 раза по сравнению с контролем (рис. 2). Несоответствие (~ в 50 раз) между возрастанием удельной доли клеток-персистеров в ВПШ относительно исходного штамма ДТ и превышением (в 2–4 раза) титра КОЕ ВПШ над ДТ, по-видимому, можно объяснить следующими соображениями. Теоретически стратегия “страховки” (bet-hеdging) описывает общую популяционную стратегию, обеспечивающую минимизацию рисков исчезновения популяции (вида) при смене условий окружающей среды (Browning et al., 2020). Популяция разделяется (молекулярно-генетическими механизмами) на субпопуляции, у каждой из которых реализуется собственная тактика поведения, что обеспечивает выживание (адаптацию) одной из субпопуляций за счет гибели другой. В нашем случае это: а) среднесрочное (час–сутки) сохранение клеток-персистеров при одновременном автолизе субпопуляции обычных клеток-неперсистеров; б) долгосрочное сохранение жизнеспособности покоящихся форм (ПФ), созревающих из П в образованном автолизате. Пока остается неизвестным, каково должно быть соотношение численности П, созревающих в ПФ, и автолизирующихся клеток, хотя для выживания П и созревания ПФ автолизат необходим (Бухарин и соавт., 2005). Если рассматривать эту ситуацию на уровне функционирования сообщества, то эволюционно должны были сформироваться пределы (min–max) доли в популяциях высокоустойчивых персистеров и образовавшихся из них ПФ, обеспечивающие стабильность состава и функционирования сообщества в целом. Можно предполагать, что более чем 50%-ное образование персистеров – это “завышенный” резерв для сохранения структуры сообщества, поэтому значительная часть персистеров в наших экспериментах не созревала в ПФ. Следует отметить, что отмирание клеток ВПШ протекало гораздо медленнее, чем клеток контрольного штамма: через 1 мес. хранения титр КОЕ в ВПШ был в 24 раза выше, чем в штамме ДТ. А через 3 мес. хранения титр КОЕ в культуре ВПШ был в 2–4 раза выше, чем в контрольном варианте (культура ДТ) (см. рис. 2). Эти данные не противоречат приведенному объяснению.
Рис. 2.
Титр жизнеспособных клеток (КОЕ/мл) исходного (ДТ) и высокоперсистерного (ВПШ) штаммов A. seifertii при хранении в течение 4 мес.
О сохранении углеводородокисляющей активности исходного и высокоперсистерного штаммов A. seifertii судили по образованию СО2 клетками, растущими на нефти как единственном источнике углерода, при использовании в качестве инокулята культур ДТ и ВПШ, хранившихся в течение 4 мес. (рис. 3).
Рис. 3.
Накопление СО2 высокоперсистерным (ВПШ) (2) и исходным (ДТ) (1) штаммами A. seifertii после хранения в течение 4 мес., при их росте в минеральной среде с нефтью.
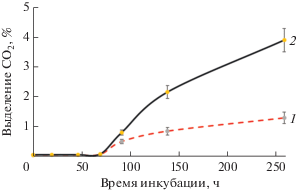
Как видно из рис. 3, культура A. seifertii ВПШ окисляла нефть со скоростью, в 2–3 раза превышающей таковую культуры ДТ, что соответствует большему содержанию жизнеспособных клеток (см. рис. 2). Следует также отметить, что при рассеве ПФ исходного и высокоперсистерного штаммов A. seifertii на плотные среды они формировали популяции фенотипически различающихся между собой вариантов-диссоциантов. При этом диссоцианты не отличались способностью окислять коротко- и длинноцепочечные или циклические углеводороды, зато существенно различались характеристиками устойчивости к стрессорам, например, к высоким концентрациям NaCl и ионов Cu2+ (данные не приводятся). Следует отметить, что прорастание ПФ в виде спектра различающихся диссоциантов типично для цистоподобных ПФ и многократно показано ранее для бактерий разных таксонов, в том числе биотехнологически значимых штаммов (Эль-Регистан, 2006; Solyanikova et al., 2011; Мулюкин и соавт., 2014; Ivshina et al., 2015).
Таким образом, в результате проведенных исследований впервые получен высокоперсистерный (более 50%) штамм A. seifertii – деструктора нефтепродуктов. При длительном (4 мес.) хранении ВПШ в провокационных условиях (при температуре 18–24°С и доступе кислорода) число сохранивших жизнеспособность клеток было в 2–4 раза больше, чем в исходном штамме. Полученный новый ВПШ сохранял способность к образованию персистеров в течение 9 и более пересевов без селекции. После хранения в течение 4 мес. культура ВПШ окисляла нефть с большей скоростью по сравнению с таковой контрольной культуры. По показателю повышения эффективности биодеструкции нефти относительно исходного штамма после длительного хранения, созданный штамм сопоставим с культурами, стабилизированными с применением новых биокомпозитных материалов (Николаев и соавт., 2021, в печати).
Разработанный прием получения высокоперсистерных штаммов, обеспечивающий сохранение высокого титра жизнеспособных клеток при длительном хранении и высокую функциональную активность, может быть рекомендован для нужд экобиотехнологии.
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.Н., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005. 367 с.
Лойко Н.Г., Козлова А.Н., Николаев Ю.А., Гапонов А.М., Тутельян А.В., Эль-Регистан Г.И. Влияние стресса на образование антибиотикотолерантных клеток Escherichia coli // Микробиология. 2015. Т. 84. С. 595‒609.
Loiko N.G., Kozlova A.N., Nikolaev Y.A., El’-Registan G.I., Gaponov A.M., Tutel’yan A.V. Effect of stress on emergence of antibiotic-tolerant Escherichia coli cells // Microbiology (Moscow). 2015. V. 84. P. 595‒609.
Мулюкин А.Л., Козлова А.Н., Сорокин В.В., Сузина Н.Е., Чердынцева Т.А., Котова И.Б., Гапонов А.М., Тутельян А.В., Эль-Регистан Г.И. Формы выживания Pseudomonas aeruginosa при антибиотической обработке // Микробиология. 2015. Т. 84. С. 645‒659.
Mulyukin A.L., Kozlova A.N., Sorokin V.V., El’-Registan G.I., Suzina N.E., Cherdyntseva T.A., Kotova I.B., Gaponov A.M., Tutel’yan A.V. Surviving forms in antibiotic-treated Pseudomonas aeruginosa // Microbiology (Moscow). 2015. V. 84. P. 751‒763.
Мулюкин А.Л., Сузина Н.Е., Мельников В.Г., Гальченко В.Ф., Эль-Регистан Г.И. Состояние покоя и фенотипическая вариабельность у Staphylococcus aureus и Corynebacterium pseudodiphtheriticum // Микробиология. 2014. Т. 83. С. 15‒27.
Mulyukin A.L., Suzina N.E., Mel’nikov V.G., Gal’chenko V.F., El’-Registan G.I. Dormant state and phenotypic variability of Staphylococcus aureus and Corynebacterium pseudodiphtheriticum // Microbiology (Moscow). 2014. V. 85. P. 149‒159.
Николаев Ю.А., Борзенков И.А., Дёмкина Е.В., Лойко Н.Г., Канапацкий Т.А., Перминова И.В., Хрептугова А.Н., Григорьева Н.В., Близнец И.В., Манучарова Н.А., Сорокин В.В., Коваленко М.А., Эль-Регистан Г.И. Новые биокомпозитные материалы на основе углеводородокисляющих бактерий и их потенциал для деградации нефтепродуктов // Микробиология. 2021. (B печати).
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. С. 446‒456.
Bakkeren E., Diard M., Hardt W.D. Evolutionary causes and consequences of bacterial antibiotic persistence // Nat. Rev. Microbiol. 2020. V. 18. P. 479–490.
Balaban N.Q., Merrin J., Chait R., Kowalik L., Leibler S. Bacterial persistence as a phenotypic switch // Science. 2004. V. 305. P. 1622–1625.
Balaban N.Q., Helaine S., Lewis K., Ackermann M., Aldridge B., Andersson D.I., Brynildsen M.P., Bumann D., Camilli A., Collins J.J., Dehio C., Fortune S., Ghigo J.M., Hardt W.D., Harms A., Heinemann M., Hung D.T., Jenal U., Levin B.R., Michiels J., Storz G., Tan M.W., Tenson T., Van Melderen L., Zinkernagel A. Definitions and guidelines for research on antibiotic persistence // Nat. Rev. Microbiol. 2019. V. 17. P. 441–448.
Browning A.P., Sharp J.A., Mapder T., Baker C.M., Burrage K., Simpson M.J. Persistence as an optimal hedging strategy // Biophys. J. 2020. V. 120. P. 133–142.
Dagkessamanskaia A., Moscoso M., Hénard V., Guiral S., Overweg K., Reuter M., Martin B., Wells J., Claverys J.-P. Interconnection of competence, stress and CiaR regulons in Streptococcus pneumoniae: competence triggers stationary phase autolysis of ciaR mutant cells // Mol. Microbiol. 2004. V. 51. P. 1071–1086.
Das N., Chandran P. Microbial degradation of petroleum hydrocarbon contaminants: An overview // Biotechnol. Res. Int. 2011. Art. 941810. https://doi.org/10.4061/2011/941810
Grant S.S., Kaufmann B.B., Chand N.S., Haseley N., Hung D.T. Eradication of bacterial persisters with antibiotic-generated hydroxyl radicals // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 12147–12152.
Guiral S., Mitchell T.J., Martin B., Claverys J.-P. Competence-programmed predation of noncompetent cells in the human pathogen Streptococcus pneumoniae: genetic requirements // Proc. Natl. Acad. Sci. USA. 2005. V. 102. P. 8710–8715.
Ivshina I.B., Mukhutdinova A.N., Tyumina H.A., Vikhareva H.V., Suzina N.E., El’-Registan G.I., Mulyukin A.L. Drotaverine hydrochloride degradation using cyst-like dormant cells of Rhodococcus ruber // Curr. Microbiol. 2015. V. 70. P. 307–314.
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. P. 357–372.
Lopez D., Kolter R. Extracellular signals that define distinct and coexisting cell fates in Bacillus subtilis // FEMS Microbiol. Rev. 2010. V. 34. P. 134–149.
Solyanikova I.P., Suzina N.E., Golovleva L.A., Mulyukin A.L., El-Registan G.I. Improved xenobiotic-degrading activity of Rhodococcus opacus strain 1cp after dormancy // J. Environ. Sci. Health B. 2011. V. 46. P. 638–647.
Sulaiman J.E., Lam H. Evolution of bacterial tolerance under antibiotic treatment and its implications on the development of resistance // Front. Microbiol. 2021. V. 12. Art. 617412. https://doi.org/10.3389/fmicb.2021.617412
Van den Bergh B., Fauvart M., Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters // FEMS Microbiol. Rev. 2017. V. 41. P. 219–251.
Van den Bergh B., Michiels J.E., Michiels J. Experimental evolution of Escherichia coli persister levels using cyclic antibiotic treatments // Methods Mol. Biol. 2016a. V. 1333. P. 131‒143. https://doi.org/10.1007/978-1-4939-2854-5_12
Van den Bergh B., Michiels J.E., Wenseleers T., Windels E.M., Boer P.V., Kestemont D., De Meester L., Verstrepen K.J., Verstraeten N., Fauvart M., Michiels J. Frequency of antibiotic application drives rapid evolutionary adaptation of Escherichia coli persistence // Nat. Microbiol. 2016b. V. 1. Art. 16020. https://doi.org/10.1038/nmicrobiol.2016.20
Veening J.-W., Hamoen L.W., Kuipers O.P. Phosphatases modulate the bistable sporulation gene expression pattern in Bacillus subtilis // Mol. Microbiol. 2005. V. 56. P. 1481–1494.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология