Микробиология, 2021, T. 90, № 6, стр. 753-762
Продукционные и структурные показатели фитопланктонного сообщества и бактериопланктона на двух станциях в открытой части устья Севастопольской бухты. Оценка влияния мидийной фермы
Е. С. Соломонова a, *, А. И. Акимов a
a Федеральный исследовательский центр “Институт биологии южных морей им. А.О. Ковалевского
Российской академии наук”
299011 Севастополь, Россия
* E-mail: solomonov83@mail.ru
Поступила в редакцию 04.06.2021
После доработки 30.06.2021
Принята к публикации 07.07.2021
Аннотация
Исследована сезонная динамика продукционных и структурных характеристик фитопланктона на двух близлежащих станциях открытой части Севастопольской бухты, одна из которых является мидийной плантацией. Величина валовой первичной продукции, содержание хлорофилла а, общая биомасса фитопланктона, количественное соотношение крупных и мелких клеток водорослей, а также их сезонная динамика не различались для двух станций. Между соответствующими показателями станций наблюдались линейные зависимости, угловые коэффициенты регрессии которых были близки к единице. Продукция и биомасса фитопланктона были максимальными в летний период и составили 350 ± 43 мг С/м3 сут и 450 ± 50 мг С/м3 соответственно. Содержание хлорофилла а изменялось от 0.5 до 3 мг/м3 при минимуме в январе‒феврале и максимуме в летний период. Ассимиляционное число хлорофилла а за световой период имело значения, соответствующие отмеченным для продуктивных вод, и коррелировало с ходом температур в течение года. Суммарная величина потребления кислорода бактерио- и фитопланктоном в летний период составляла 30–70% от валового фотосинтеза. Получены сведения о сезонной изменчивости биомассы трех групп водорослей (Synechococcus, пикоэукариотический фитопланктон, нанофитопланктон); процент биомассы пиководорослей в массе черноморского фитопланктона в среднем составил 30% с максимумом в зимне-весенний и летний периоды. С помощью проточной цитометрии и витального флуорохрома SYBR Green I рассчитана численность бактериопланктона в исследуемой акватории и показана достоверная положительная связь между обилием бактерий и температурой воды.
При создании морской фермы по выращиванию мидий и устриц важными являются вопросы экологического мониторинга с целью определения состояния экосистемы и тенденций ее изменчивости в результате процессов жизнедеятельности моллюсков, выделяемые продукты которых (органический азот, фосфор, аммонийные соединения), оказывают как позитивное, так и негативное влияние на альгоценозы. В частности, выделение мидиями и моллюсками органического вещества может усилить процесс эвтрофирования вод, создавая условия для развития заморных явлений, что проявляется в акваториях со слабым водообменом (Золотницкий, Крючков, 2006). Органические вещества метаболитов мидий стимулируют развитие фитопланктона, расширяя его видовое разнообразие (Галкина и соавт., 1982; Кулаковский, 2000). Следует отметить, что определяющее влияние на степень эвтрофикации и сопутствующих явлений имеют гидрологические условия данной акватории, а также размеры и мощность мидийной фермы (Officer et al., 1982; Trottet et al., 2008). Известно, что двустворчатые моллюски могут предпочтительно выбирать фитопланктон для употребления его в пищу, что в значительной степени зависит от размера, морфологии, формы частиц, подвижности, токсичности и пищевой ценности жертвы (Safi et al., 2007; Safi, Hayden, 2010), что, в свою очередь, может привести к изменению размерной структуры фитопланктона в районе мидийного марихозяйства. Пикопланктон имеет тенденцию процветать в районах аквакультуры моллюсков, потому что их хищники (например, инфузории и гетерофлагелляты) и конкуренты (например, более крупные диатомовые водоросли) за питательные вещества удаляются посредством фильтрации моллюсками (Cranford et al., 2011). Следовательно, разведение моллюсков контролирует не только размер популяций фитопланктона, но и рост определенных видов водорослей за счет их избирательной фильтрации (Wetz et al., 2002; Cranford et al., 2011). Однако оценить, достоверен ли данный тезис для мидийного марихозяйства Черного моря, не представлялось возможным, так как пикофитопланктон Черного моря почти не попадал в поле зрения исследователей из-за его размеров. Применение современной приборной базы, в частности проточной цитометрии, позволяет восполнить этот пробел. В связи с чем для оценки влияния мидийного марихозяйства на прилегающие акватории важно использовать как структурные, так и функциональные показатели фитопланктонного сообщества.
Актуальными остаются вопросы мониторинга качественных и количественных изменений продукционных процессов в условиях возрастающего антропогенного воздействия, особенно в шельфовых и прибрежных акваториях, где это влияние может быть особенно велико. Применение проточной цитометрии и флуоресцентных методов в ряде вопросов упрощают исследования и позволяют получать дополнительную информацию.
Цель данной работы заключалась в оценке влияния мидийной фермы на состояние альгоценоза двух станций в сравнительном аспекте, а также в исследовании сезонных изменений продукционных и структурных показателей фитопланктонного сообщества и бактериопланктона шельфа Севастопольской бухты.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
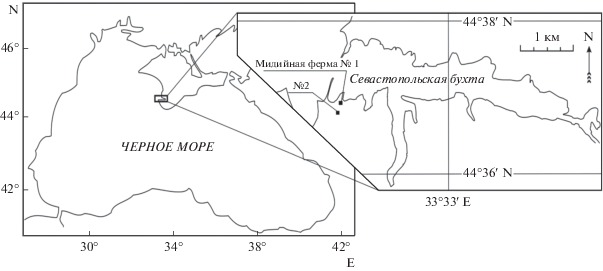
Пробы отбирали в поверхностном слое (0.1 м) ежемесячно с января по декабрь 2016 г. на двух станциях, расположенных на севастопольском взморье между бухтами Карантинная и Севастопольская (Черное море). Схема расположения станций показана на рис. 1. Собрано и обработано 200 проб.
Глубины под фермой составляют 16–18 м. Ферму относят к категории малых, с размерами 70 × 150 м и производительностью не более 100 тысяч моллюсков в год. Гидрологический режим шельфовой зоны характеризуется высокой интенсивностью водообмена и наличием сгонно-нагонных процессов (Попов, Ерохин, 2017).
Содержание хлорофилла и феофитина определяли стандартным спектрофотометрическим методом (Jeffrey, 1975) в ацетоновых экстрактах после фильтрации 1–2 л воды на стекловолокнистых фильтрах GFF. Пробы отбирали в 2-х повторностях.
Скорость фотосинтеза и дыхания определяли методом Винклера (Методика…, 2010) в лабораторных условиях при температуре, соответствующей естественным условиям. Продолжительность световой экспозиции при интенсивности света 120 мкЭ/м2 с составляла 24 ч. При расчете данные пересчитывали на реальную продолжительность светового периода, вычитая 2 ч.
Для проведения исследований использовали бокс с соответствующей терморегуляцией и светодиодным источником освещения. Производили усреднение по 6 измерениям (для хлорофилла а по 4) и определяли стандартное отклонение.
Валовую первичную продукцию рассчитывали в углеродных единицах, используя коэффициент пересчета 0.375 (Винберг, 1960).
Численность пико- (размер клеток 0.2–2 мкм) и нанофитопланктона (размер клеток 2–20 мкм) определяли с помощью проточного цитометра Cytomics FC 500 (“Beckman Coulter”, США), оборудованного 488-нм однофазным аргоновым лазером и программным обеспечением CXP в кластере на 2-х параметрических цитограммах по прямому светорассеиванию (FS) и флуоресценции отдельных клеток в красной (FL4, 675 нм) области спектра. Исследовали только указанные размерные группы водорослей из-за невозможности проточного цитометра пропускать клетки размером свыше 35 мкм (Муханов и соавт., 2016).
Идентификацию пикоцианобактерий осуществляли по оранжевой флуоресценции их фотосинтетического пигмента фикоэритрина (FL2, 575 нм) (Муханов и соавт., 2016). Эти группы образуют кластеры на цитограммах, характеризуются высоким содержанием фикоэритрина и его отсутствием у пикоэукариотического фитопланктона.
Биомассу исследуемых размерных групп в единицах углерода рассчитывали с использованием коэффициентов, определенных в работах Heldal et al. (2003) для Synechococcus, Worden et al. (2004) для пикоэукариотов и Verity et al. (1992) для нанофитопланктона.
Окраску бактериоплантона красителем SYBR Green I производили в соответствии с работой Рауэн и соавт. (2011). Рабочий раствор красителя готовили в разбавлении 10–2 и хранили в замороженном состоянии при –20°С. Конечное разбавление в пробе составляло 10–4. Окраску производили в течение 40 мин непосредственно перед цитометрическими измерениями.
Цитометрические данные обрабатывали с использованием программы flowing software 2 (www.flowingsoftware.com).
Пробы фитопланктона концентрировали с использованием фильтров Whatman (GF/C) с диаметром пор 2 мкм. Доминирующие виды определяли под микроскопом ZEISS Primo Star (“ZEISS”, Германия).
Статистическую обработку данных выполняли с помощью стандартных программных пакетов Microsoft Exel 7.0, Statistica-5, Grapher-9, Sigma Plot для персонального компьютера. Рассчитывали стандартные отклонения (SD) по трем повторностям. Достоверность различий выборочных средних оценивали c помощью парного t-критерия (α) и коэффициентов корреляции (R). Для получения уравнений регрессии использовали линейный регрессионный анализ (Р 95%).
РЕЗУЛЬТАТЫ
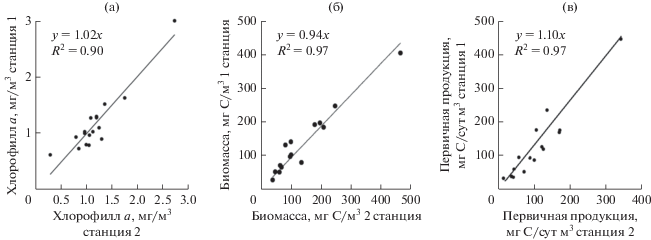
Полученные значения продукционных и размерно-структурных характеристик фитопланктона для двух станций показали отсутствие закономерных различий между исследуемыми параметрами в любой период наблюдений. Отмеченные в течение года изменения значений хлорофилла а, биомассы, скорости фотосинтеза, а также параметров размерной структуры имели высокую степень корреляции между собой для обеих станций, что показано на рис. 2.
Угловые коэффициенты линейных регрессий взаимосвязи исследуемых величин были близки к единице (при достаточно высоком коэффициенте детерминации). Полученные результаты позволяют сделать вывод об отсутствии заметного влияния мидийной фермы малой мощности на фитоценоз в конкретных гидрологических условиях открытой акватории, поэтому для дальнейшего анализа сезонных закономерностей данные по обеим станциям объединены в один массив.
Минимальные значения концентрации хлорофилла а, первичной продукции, суммарной биомассы исследуемых размерных групп водорослей наблюдали в зимний период (0.7 мг/м3, 80 мг C/м3, 25 мг С/м3 сут1) (рис. 3). С января по март наблюдалось увеличение содержание хлорофилла а. В весенне-летний период зарегистрированы значительные колебания содержания хлорофилла а, которые коррелировали с биомассой и валовой первичной продукцией фитопланктона.
Рис. 3.
Сезонные изменения концентрации хлорофилла а и биомассы водорослей (а) и валовой первичной продукции (б).
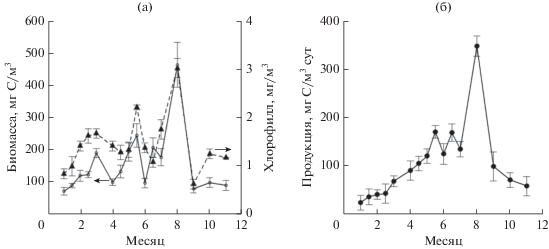
Общая тенденция изменения содержания биомассы и величины первичной продукции ‒ повышение от зимы к лету. Среднее значение биомассы фитопланктона в весенне-летний период составило 255 ± 35 мг C/м3. С мая по сентябрь зарегистрированы также наибольшие величины первичной продукции (в среднем 140 ± 25 мг С/м3 сут), превосходящие зимний минимум в 2.5–3 раза. Абсолютный максимум продукционных показателей зафиксирован в августе при интенсивном развитии Synechococcus. Осенью, с середины сентября, значения этих показателей снижаются, что связано, по-видимому, с уменьшением температуры и продолжительности светового дня.
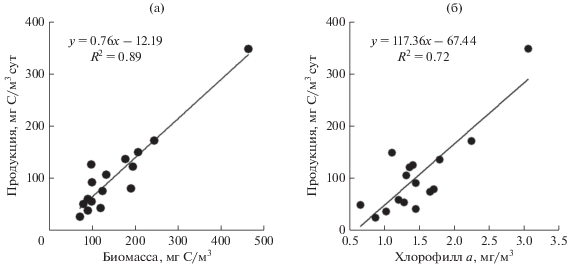
Между величиной первичной продукции и биомассой наблюдалась корреляционная зависимость с коэффициентом детерминации R2 = 0.89 (рис. 4а). Корреляция между продукцией и содержанием хлорофилла а была более слабой, R2 = 0.72 (рис. 4б). Это объясняется существенной сезонной изменчивостью удельного содержания хлорофилла а, которая в значительной степени зависит от величины инсоляции и имеет обратную направленность, в отличие от продукционных показателей.
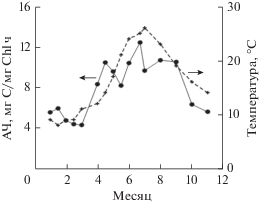
Ассимиляционное число (далее АЧ) хлорофилла а имело минимальные (4–6 мг С/мг Хл ч) значения в январе и начале апреля при температурах 9‒11°C. Последующее повышение этого параметра в течение года коррелировало с ходом температуры; максимум наблюдался с начала июня до середины сентября в диапазоне температур 21‒26°С, с колебаниями в пределах 8–12 мг С/мг Хл ч. Заметное снижение АЧ хлорофилла а наблюдалось после середины сентября и также было связано с уменьшением температуры воды и продолжительности светового периода (рис. 5).
Измерение скорости дыхания в зимне-весенний период при температурах 9‒11°С и относительно низком содержании хлорофилла а кислородным методом было весьма неточным, так как средние значения величины потребления кислорода по 6 измерениям не превосходили достоверно величину погрешности измерений. Интенсивность дыхания с середины мая по ноябрь (15‒26°С) была равна 68 ± 40 мг С/м3 сут, что составило примерно 30–70% от величин валового фотосинтеза. Между тем детализацию сезонной изменчивости потребления кислорода осуществить не удалось. Можно отметить, что максимальное потребление кислорода наблюдалось в августе‒сентябре и совпадало с максимумом биомассы бактерий в пробах.
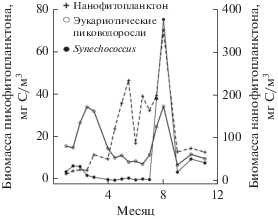
С помощью цитофлуориметра проведена оценка количественного содержания трех размерных групп водорослей в исследуемых пробах: Synechococcus (прокариотическая водоросль), эукариотических пиководорослей и нанофитопланктона (рис. 6). Вклад Synechococcus в суммарную биомассу фитопланктона составлял в среднем около 7%, за исключением августа, когда зарегистрирован летний пик его развития ‒ 32% от суммарной биомассы фитопланктона. Сообщество эукариотических пиководорослей характеризовалось двумя максимумами биомассы в течение годового цикла: зимне-весенним пиком при температуре воды <15°C, когда содержание этих видов составляло примерно 50% от общей биомассы, и летним, когда вклад эукариотических пиководорослей в суммарную биомассу был около 10%. Основной вклад в суммарную биомассу водорослей вносил нанофитопланктон, концентрация которого имела максимальные значения с мая по август.
В ранневесенний период в пробах преобладали диатомовые водоросли Skeletonema costatum Cleve, 1878, Psevdo-nitzschia delicatissima Cleve, 1928 и кокколитофорида Emiliania huxleyi (Lohmann) Hay, Mohler, 1967. Начиная с конца апреля, по мере прогревания вод и снижения концентрации биогенных элементов, наблюдали развитие водорослей Chaetoceros curvisetus Cleve, 1889, Chaetoceros affinis Lauder, 1864, а также Emiliania huxleyi. Лето характеризовалось развитием динофитовых водорослей Prorocentrum cordatum Ostenfeld, 1976, Prorocentrum micans Ehrenberg, 1834 с доминированием цианобактерий.
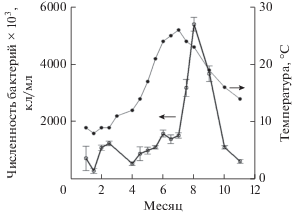
Методом проточной цитометрии с использованием витального красителя SYBR GREEN рассчитана численность бактериопланктона в исследуемой акватории (рис. 7). Отмечены значительные колебания значений данного показателя в течение периода измерений, при общей тенденции увеличения летом и при возрастании температуры.
ОБСУЖДЕНИЕ
Мидийное марихозяйство оказывает влияние на морскую среду, изменяя ее физические и химические характеристики: в воду поступают продукты метаболизма мидий (фекалии и псевдофекалии), что способствует увеличению в среде концентрации азота и фосфатов, а также растворенного органического вещества (Gilbert et al., 1997; Mirto et al., 2000; Куфтаркова и соавт., 2006). Это, в свою очередь, может привести к трансформации сложившейся экосистемы, к качественным и количественным изменениям бентосных и пелагических сообществ гидробионтов (Куфтаркова и соавт., 2011). Считается, что степень влияния мидийно-устричных хозяйств особенно велика в закрытых и полузакрытых акваториях и зависит от интенсивности водообмена в них (Officer et al., 1982).
Несмотря на то, что в литературе описаны различные воздействия мидийных плантаций на микроводоросли, на сегодняшний день работы, посвященные этому аспекту, показали неоднозначные результаты. Исследуемая нами ферма расположена между бухтами Карантинная и Севастопольская Черного моря и находится в зоне активного водообмена. Глубина на ферме 16–18 м, что позволяет беспрепятственно поступать в ее акваторию водам открытой части моря. В работах (Куфтаркова и соавт., 2011; Попов, Ерохин, 2017) детально рассмотрен данный район исследования и показано, что определяющими и формирующими динамику прибрежных вод являются особенности района, в частности, активность основного черноморского течения, а также интенсивность сгонно-нагонных процессов. Это способствует выносу продуктов метаболизма мидий за пределы марихозяйства (Мысленков, Самсонов, 2014).
Проведенные нами исследования продукционных и структурных характеристик двух станций в районе Черного моря показали отсутствие заметного влияния мидийно-устричного хозяйства небольшой производительности на фитопланктонное сообщество в условиях открытой акватории Черноморского шельфа. Аналогичные результаты получены в ряде других работ (Murdoch, Oliver, 1995; Prins et al., 1998; Dupuy et al., 2000; Zhang et al., 2013), в частности, при исследовании влияния мидийных плантаций в центре Залива Святого Лаврентия (Канада) (Grant et al., 2007; Trottet et al., 2008). Однако авторами (Jiang et al., 2016) показано, что средняя концентрация общего хлорофилла а (сумма фракционированного по размеру хлорофилла а) в пределах площади мидийного марихозяйства была примерно на 60% меньше, чем на контрольном участке. Авторы связывают это с уменьшением численности используемых в питании устриц крупных видов микроводорослей в зоне аквакультуры и увеличением численности пикофитопланктона, при этом концентрации питательных веществ не показали статистических различий между районами исследования. Наши результаты не подтверждают данный тезис. С помощью проточной цитометрии были идентифицированы три размерные группы водорослей ‒ Synechococcus (прокариотическая водоросль), эукариотические пиководоросли и нанофитопланктон, различий в биомассе которых между станциями в течение периода исследования не отмечено. Как и было сказано выше, скорее всего различия в получаемых данных, прежде всего, связаны с местными характеристиками, такими как расстояние между местом отбора проб, самой фермой по выращиванию мидий (различия в плотности мидий внутри ферм), а также с гидродинамическими особенностями в пределах участка культивирования мидий.
Представленные данные по распределению сезонных величин концентрации хлорофилла а, биомассы и продукции в целом соответствуют сложившимся ранее представлениям о продуктивности шельфовой части Черного моря, которая главным образом определяется гидрометеорологическими и гидродинамическими факторами. Минимальные зимне-весенние температуры воды 2016 г. были выше 8°С. Как правило, при таких теплых зимах и более слабой вертикальной конвекции не наблюдается массового развития таких видов, как Skeletonema costatum, Psevdo-nitzschia delicatissima и кокколитофориды Emiliania huxleyi, которые зачастую вызывают цветение при более холодных зимах (Сеничива, 2008). Наблюдаемое нами в феврале и марте повышение концентрации хлорофилла а и биомассы было вызвано развитием именно этих видов, общая биомасса составляла 100–200 мг С/м3, что более чем на порядок меньше, чем в холодные годы. По мере прогревания вод и снижения концентрации биогенных элементов, по данным Сеничевой (Сеничива, 2008), мелкоклеточные виды сменяются в апреле‒мае более теплолюбивыми видами Chaetoceros curvisetus, Chaetoceros affinis, а также кокколитофоридой Emiliania huxleyi. Это и привело к наблюдаемому нами майскому повышению концентрации хлорофилла а и биомассы нанофитопланктона.
В летний период основной вклад в биомассу вносили различные виды динофитовых, возрастала роль пикофитопланктона. Рассматривая отдельно вклад пикофитопланктона, который недостаточно изучен в Черном море, и сопоставляя наши результаты с полученными ранее, следует отметить, что диапазоны изменения его количественных показателей в целом соответствуют значениям, приведенным в литературе (Стельмах, 1988; Заика и соавт., 1989, 1991; Шалапёнок, Шалапёнок, 1997; Муханов и соавт., 2016). В работе Л.В. Стельмах (Стельмах, 1988) показано, что на долю пикофитопланктона в Севастопольской бухте приходилось от 18 до 44% первичной продукции и от 20 до 40% хлорофилла a в течение года; в работе (Муханов и соавт., 2016) отмечены максимальные значения биомассы цианобактерий в летний период.
В течение сезона наблюдали два максимума количества бактерий, один их которых совпал с августовским пиком развития фитопланктона, в частности Synechococcus. Максимальные значения численности бактериопланктона в исследуемой акватории получены в летний и раннеосенний периоды, минимальные ‒ в зимний и весенний, что в целом коррелирует с изменениями температуры. Как указывает ряд авторов (Рылькова, 2013; Серегин, 2013), обилие бактериопланктона, главным образом, связано именно с повышением температуры.
Первичная продукция Черного моря является одним из основных показателей ресурсного потенциала водной экосистемы. В ходе проведенного исследования показано, что в холодный период получены минимальные значения, а по мере прогрева воды и увеличения солнечной радиации в теплое время года отмечены максимальные значения валовой первичной продукции (среднее значение 350 ± 43 мг С/м3 сут), превосходя зимний минимум в 3 раза. А.Б. Демидов (Демидов, 2001), проведя детальный анализ сезонных изменений первичной продукции различных прибрежных районов Черного моря, показал, что во всех шельфовых районах, за исключением Придунайского, где прослеживается только один летний максимум первичной продукции, проявляются зимне-весенний и летний максимумы первичной продукции и биомассы фитопланктона. В ходе нашего мониторинга наблюдался одновершинный характер сезонного хода продукции и биомассы фито- и бактериопланктона. По нашему мнению, это связано с особенностями гидрологического режима акватории: небольшой глубиной, высокой скоростью водообмена, высокими зимними температурами и, как следствие, слабой вертикальной динамической активностью в зимне-весенний период. Августовский пик, возможно, связан со сгонно-нагонными явлениями, о чем косвенно можно судить по некоторому снижению температуры воды.
Параллельно с первичной продукцией фитопланктона считали АЧ хлорофилла а. Как указано выше, в летний период оно в среднем составило 10 ± 4 мг С/мг Хл ч при колебаниях от 8 до 12, а для холодного периода года отмечены более низкие значения, которые варьировали от 4 до 6 мг С/мгХл час. Величина и сезонная амплитуда изменений АЧ совпадают с данными, приводимыми Ведерниковым для высокопродуктивных прибрежных вод (Ведерников, 1978). В ряде работ для умеренных и высоких широт зарегистрирована положительная связь температуры и ассимиляционного числа хлорофилла а (Williams, 1966; Steven, 1971).
Таким образом, проведенные исследования показали, что основные продукционные и структурные характеристики фитоценоза мидийной фермы малой мощности, расположенной в открытой части шельфовой зоны, и реперной станции существенно не различались. Значительного снижения концентраций фитопланктона на мидийной плантации не произошло, ни с точки зрения общих концентраций хлорофилла а, ни с точки зрения биомассы конкретных групп фитопланктона, определенной с помощью проточной цитометрии. Можно сказать, что местное производство мидий, вероятно, недостаточно велико, чтобы оказывать существенное влияние на состав и биомассу планктона в пространственных и временных масштабах. Оценка сезонных изменений продукционных и структурных показателей фитопланктонного сообщества и бактериопланктона в течение годового цикла показала, что между биомассой фитопланктона, первичной валовой продукцией и содержанием хлорофилла а наблюдалась положительная корреляция. Ассимиляционное число хлорофилла а и концентрация бактерий повышались с увеличением температуры. Суммарная величина дыхания фито- и бактериопланктона в пробах составляла 30–70% от валового фотосинтеза. Одновершинный характер сезонных изменений исследуемых параметров, с летним максимумом, был обусловлен особенностями гидрологического режима шельфовой зоны и высокими зимними температурами 2016 г., что приводило к замедлению вертикальной циркуляции и исчезновению зимне-весеннего пика фитопланктона.
Список литературы
Ведерников В.И. Сезонные изменения ассимиляционного числа морского фитопланктона // Тр. ВГБО. 1978. Т. 22. С. 18–31.
Винберг Г.Г. Первичная продукция водоемов. Минск: РИСО АН БССР, 1960. 23 с.
Галкина В.Н., Кулаковский Э.Е., Кунин Б.Л. Влияние аквакультуры мидий в Белом море на окружающую среду // Океанология. 1982. Т. 22. № 2. С. 321–324.
Демидов А.Б. Сезонные изменения первичной продукции и хлорофилла “а” в открытых районах Чeрного моря. Автореферат дис. … канд. биол. наук. Москва: МГУ, 2001. 44 с.
Заика В.Е., Шалапёнок Л.С., Покотилов С.Л. Изменение частоты делящихся цианобактерий по глубине и времени суток // АН УССР, ИнБЮМ. Севастополь, 1991. 9е. Деп. в ВИНИТИ 21.02.91, № 870-В91.
Заика В.Е., Шевченко В.А., Булатов К.В. Экология морского фототрофного пикопланктона. М.: НЦБИ, 1989. 171 с.
Золотницкий А.П., Крючков В.Г. О возможных экологических последствиях крупномасштабного культивирования мидий в шельфовой зоне Черного моря // Современные проблемы экологии Азово-Черноморского бассейна / Материалы II межд. конф., 26‒27 июня 2006 г., Керчь, ЮгНИРО. Керчь: Изд-во ЮгНИРО, 2006. С. 30–35.
Куфтаркова Е.А., Губанов В.И., Ковригина Н.П., Еремин И.Ю., Сеничева М.И. Экологическая оценка современного состояния вод в районе взаимодействия Севастопольской бухты с прилегающей частью моря // Морской экологический журнал. 2006. Т. 5. № 1. С. 72–91.
Куфтаркова Е.А., Ерёмин И.Ю., Субботин А.А. Тонкая вертикальная химическая структура вод в районе мидийной фермы (предпроливная часть Севастопольской бухты) // Морской экологический журнал. 2011. Т. 10. № 1. С. 38–42.
Муханов В.С. Рылькова О.А., Чурилова Т.Я., Сахонь Е.Г., Пименов Н.В. Структура и сезонная трофодинамика пикофитопланктона в Севастопольской бухте и сопредельных водах Черного моря // Микробиология. 2016. Т. 85. № 5. С. 512‒521.
Mukhanov V.S., Rylkova O.A., Churilova T.Y., Sakhon E.G., Pimenov N.V. Structure and seasonal trophodynamics of picophytoplankton in Sevastopol Bay and adjacent waters (the Black Sea) // Microbiology (Moscow). 2016. V. 85. P. 553‒561.
Мысленков С.А., Самсонов Т.Е. Исследование течений на шельфе Черного моря с помощью ГНСС-мониторинга // Известия высших учебных заведений. Геодезия и аэрофотосъемка. 2014. Т. 3. С. 60–68.
Объемная концентрация растворенного кислорода в морских водах. Методика измерения йодометрическим методом. РД № 52.10.736-2010; утвержден: 15.11.2010; введен: 2011.07.01 / Росгидромет. М., 2010. URL: https://meganorm.ru/Data2/1/4293791/ 4293791177.htm
Попов М.А., Ерохин А.В. Течения в районе устрично-мидийной фермы как фактор оптимального функционирования марихозяйства (Севастополь, Чeрное море) // Морской биологический журнал. 2017. Т. 2. № 4. С. 58–66.https://doi.org/10.21072/mbj.2017.02.4.06
Рауэн Т.В., Ханайченко А.Н., Муханов В.С. Влияние микроводорослей и их фильтратов на численность бактерий в среде выращивания камбалы калкана // Морской экологический журнал. 2011. Т. 10. № 3. С. 48–56.
Рылькова О.А. Многолетние изменения численности бактериопланктона в прибрежье Севастополя (Чeрное море) // Морской экологический журн. 2013. Т. 12. № 1. С. 74–79.
Сеничива М.И. Видовое разнообразие, сезонная и межгодовая изменчивость микроводорослей в планктоне к берегов Крыма // Микроводоросли Чeрного моря: проблемы сохранения биоразнообразия и биотехнологического использования / Под. ред. Токарева Ю.Н. и др. Севастополь: ЭКОСИ-Гидрофизика, 2008. С. 18–23.
Серегин С.А. Сезонная и многолетняя динамика общей численности бактериопланктона в прибрежных водах Севастополя // Рыбное хозяйство Украины. 2013. Т. 2. С. 10–16.
Стельмах Л.В. Вклад пикопланктона в первичную продукцию и содержание хлорофилла “а” в эвтрофных водах на примере Севастопольской бухты // Океанология. 1988. Т. 28. № 1. С. 127–131.
Шалапёнок Л.С., Шалапёнок А.А. Гетерогенность пигментного состава пикоэритринсодержащих пикоцианобактерий Synechococcus sp. в Черном море // Микробиология. 1997. Т. 66. № 1. С. 95–100.
Shalapenok L.S., Shalapenok A.A. Heterogeneous pigment composition of phycoerythrin-containing picocyanobacteria Synechococcus spp. in the Black Sea // Microbiology (Moscow). 1997. V. 66. P. 80–85.
Cranford P.J., Ward J.E., Shumway S.E. Bivalve filter feeding: variability and limits of the aquaculture biofilter // Shellfish Aquaculture and the Environment / Ed. Shumway S. Wiley-Blackwell, 2011. P. 81‒124. https://doi.org/10.1002/9780470960967.ch4
Dupuy C., Le Gall S., Hartmann H.J., Bréret M. Retention of ciliates andflagellatesby the oyster Crassostrea gigas in French Atlantic coastal ponds, protists as a trophiclink between bacterioplankton and benthic suspension-feeders // Mar. Ecol. Prog. Ser. 1999. V. 177. P 165–175.
Gilbert F., Souchu P., Bianchi M., Bonin P. Influence of shellfish farming activities on nitrification, nitrate reduction to ammonium and denitrification at the water-sediment interface of the Thau lagoon, France // Mar. Ecol. Progr. Ser. 1997. V. 151. P. 143–153.https://doi.org/10.3354/meps151143
Grant J., Curran K.J., Guyondet T.L., Tita G., Bacher C., Koutitonsky V., Dowd M. A box model of carrying capacity for suspended mussel aquaculture in Lagune deGrande-Entrée, Îles-de-la-Madeleine // Québec. Ecol. Model. 2007. V. 200. P. 193–206.
Heldal M., Scanlan D.J., Norland S., Thingstad F., Mann N.H. Elemental composition of single cells of various strains of marine Prochlorococcus and Synechococcus using X-ray microanalysis // Limnol. Oceanogr. 2003. V. 48. P. 1732–1743.https://doi.org/10.4319/lo.2003.48.5.1732
Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c 1 and c 2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanzen. 1975. V. 167. P. 191–194.https://doi.org/10.1016/S0015-3796(17)30778-3
Jiang T., Chen F., Yu Z., Lu L., Wang Z. Size-dependent depletion and community disturbance of phytoplankton under intensive oyster mariculture based on HPLC pigment analysis in Daya Bay, South China Sea // Environ. Pollut. 2016. V. 219. P. 804‒814.
Mirto S., Danovaro R., Mazzola A. Microbial and meiofaunal response to intensive mussel-farm biodeposition in coastal sediments of the western Mediterranean // Mar. Poll. Bull. 2000. V. 40. P. 244–252.https://doi.org/10.1016/S0025-326X(99)00209-X
Murdoch R., Oliver M. Study of chlorophyll concentrations within and around mussel farms: Beatrix Bay, Pelorus Sound. 1995. 1995/6-WN. NIWA, Wellington.
Officer G.B., Smayda T.J., Mann R. Benthic filter feeding: a natural eutrophication control // Mar. Ecol. Progr. Ser. 1982. V. 9. P. 203–210.
Prins T.C., Smaal A.C., Dame R.F. A review of the feedbacks between bivalvegrazing and ecosystem processes // Aquat. Ecol. 1998. V. 31. P. 349–359.
Safi K.A., Hayden B. Differential grazing on natural planktonic populations by the mussel Perna canaliculus // Aquat. Biol. 2010. V. 11. P. 113‒125.
Safi K.A., Hewitt J.E., Talman S.G. The effect of high inorganic seston loads on prey selection by the suspension-feeding bivalve, Atrina zelandica // Exp. Mar. Biol. Ecol. 2007. V. 344. P. 136‒148.
Steven D.M. Primary productivity of the tropical western Atlantic Ocean near Barbados // Mar. Biol. 1971. V. 10. P. 261–264.https://doi.org/10.1007/BF00352816
Trottet A. Roy S., Tamigneaux E., Lovejoy C., Tremblay R. Impact of suspended mussels (Mytilus edulis L.) on plankton communities in a Magdalen Islands lagoon (Québec, Canada): A mesocosm approach // Exp. Mar. Biol. Ecol. 2008. V. 365. P. 103‒115.
Verity P.G., Robertson C.Y., Tronzo C.R., Andrews M.G., Nelson J.R., Sieracki M.E. Relationships between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton // Limnol. Oceanogr. 1992. V. 37. P. 1434–1446.https://doi.org/10.4319/lo.1992.37.7.1434
Wetz M.S., Lewitus A.J., Koepfler E.T., Hayes K.C. Impact of the eastern oyster Crassostrea virginica on microbial community structure in a salt marsh estuary // Aquat. Microbial Ecol. 2002. V. 28. P. 87‒97.
Williams R.B., Murdoch M.B. Phytoplankton production and chlorophyll concentration in the Beaufort channel, North Carolina // Limnol. Oceanogr. 1966. V. 11. P. 73–82. https://doi.org/10.4319/lo.1966.11.1.0073
Worden A.Z., Nolan J.K., Palenik B. Assessing the dynamics and ecology of marine picophytoplankton: the importance of the eukaryotic component // Limnol. Oceanogr. 2004. V. 49. P. 168–179.https://doi.org/10.4319/lo.2004.49.1.0168
Zhang X., Huang X., Huang L. Phytoplankton community structure shaped by key environmental factors in fish and shellfish farms in Daya Bay, South China // Aquatic Ecosystem Health and Management. 2013. V. 16. №. 3. P. 300‒310.https://doi.org/10.1080/14634988.2013.817935
Дополнительные материалы отсутствуют.