Микробиология, 2022, T. 91, № 1, стр. 116-124
Скрининг образования биосурфактантов штаммами Yarrowia lipolytica и оценка их антибиопленочной и антиадгезивной активности против биопленок Salmonella enterica ser. Enteritidis
Ф. Шатила a, Е. Уйар b, Х. Т. Ялсин a, *
a Университет Эге, факультет естественных наук, отделение биологи,
кафедра общей и промышленной микробиологии
Измир, Турция
b Университет Харран, факультет искусств и наук, отделение биологии
Санлиурфа, Турция
* E-mail: tanselozturk@hotmail.com
Поступила в редакцию 20.01.2021
После доработки 19.02.2021
Принята к публикации 19.02.2021
- EDN: HFLIKE
- DOI: 10.31857/S0026365622010128
Аннотация
Проведен скрининг способности образовывать биосурфактанты у дрожжевого штамма (TY24), выделенного из образца пищи, и штамма, идентифицированного ранее как Yarrowia lipolytica TEM OS12. Результаты, полученные для обоих штаммов на агаре CTAB-MB, с помощью методов уплощения капли, вытеснения масла и с использованием Parafilm M, были положительными. Кроме того, как изолят TY24, так и Y. lipolytica TEM OS12 продуцировали липазы, обладали β-гемолитической активностью и снижали поверхностное натяжение с 57.5 до 33.5 и 35.5 мН м−1 соответственно. Анализ последовательностей ITS1-5.8S рРНК-ITS2 и D1/D2 домена 26S рРНК позволил идентифицировать новый изолят как Y. lipolytica TY24. Совместная инкубация Salmonella enterica ser. Enteritidis с повышающимися объемами поверхностно-активных биосурфактантов из культур Y. lipolytica TEM OS12 и Y. lipolytica TY24 снижала образование биопленок на 89.42 и 88.09% соответственно. Бесклеточный супернатант исследованных дрожжевых культур эффективно тормозил развитие биопленок сальмонеллы.
Грамположительная патогенная бактерия Salmonella enterica способна образовывать устойчивые прикрепленные сообщества (биопленки). Биопленки представляют собой агрегаты микробных клеток, окруженные экзополисахаридным матриксом, действующим в качестве структурного компонента и защитного барьера. Они проявляют повышенную устойчивость к стрессовым факторам, в том числе, к антимикробным агентам. Биопленки являются серьезной проблемой в здравоохранении и причиной значительных экономических потерь в медицине и промышленности (Peng, 2016).
Устойчивость таких прикрепленных сообществ на поверхности растений способствует переносу патогенов с сельскохозяйственных растений к людям (Barak, Liang, 2008; Teplitski et al., 2009; Steenackers et al., 2012; Amrutha et al., 2017). Биопленки, формируемые некоторыми видами сальмонелл на поверхности эпителиальных клеток и камней в желчном пузыре человека, являются резервуаром бактерий, ответственных за хронические и острые инфекции (Steenackers et al., 2012; Gunn et al., 2014). Биопленки, образуемые сальмонеллами на поверхности материалов, используемых на фермах, бойнях, в пищевой промышленности и в домашнем хозяйстве, также представляют собой важную проблему для пищевой промышленности. Они могут вызывать вспышки пищевых инфекций и экономические потери вследствие контаминации продукции и порчи оборудования (Giaouris et al., 2012; De Oliveira et al., 2014; Borges et al., 2018). Проблемы с биопленками сальмонелл усугубляются их повышенной устойчивостью к антибиотикам, вследствие чего разработка новых подходов к борьбе с биопленками является актуальной.
Биосурфактанты ‒ это поверхностно-активные метаболиты, синтезируемые бактериями, дрожжами и грибами. Обладая амфифильной структурой, сурфактанты являются отличными эмульсифицирующими, диспергирующими и вспенивающими агентами. Их преимущества перед химически синтезируемыми сурфактантами включают малую токсичность, восприимчивость к биодеградации, разнообразие применений и эффективность в экстремальных условиях (Pacwa-Płociniczak et al., 2011). Благодаря этим привлекательным чертам, биосурфактанты широко применяются во многих областях, включая фармакологическую, биомедицинскую и пищевую промышленность. Кроме того, они обладают антибактериальными, противогрибковыми и противовирусными свойствами. Широкий спектр антибактериальной активности биосурфактантов связан с их способностью нарушать целостность клеточных мембран и клеточных стенок, а также ингибировать рост микроорганизмов (Plaza, Achal, 2020). Они также могут оказаться биодетергентами, полезными для целого ряда медицинских применений (Harshada, 2014). Кроме того, сообщалось об антиадгезивных и антибиопленочных свойствах сурфактантов (Naughton et al., 2019). Они могу влиять на характеристики поверхностей и уменьшать их адгезивные свойства. Поэтому они считаются подходящими для покрытия поверхностей пищевого и биомедицинского назначения, включая стекло, силиконовую резину, хирургические имплантаты и катетеры, а также голосовые протезы (Sadekuzzman et al., 2015).
Целью данной работы было выделить и идентифицировать штамм дрожжей, синтезирующий биосурфактанты. Полученный изолят, а также ранее выделенный штамм, исследовали на предмет способности синтезировать биосурфактанты; были изучены антиадгезивные и антибиопленочные свойства супернатантов, содержащих биосурфактанты.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Микроорганизмы и выделение биосурфактант-продуцирующего штамма. Образцы почвы, загрязненной сырой нефтью, были отобраны в промышленной зоне вблизи Измира, Турция. Навеску почвы (5 г) добавляли в колбу с 50 мл среды MSM следующего состава (г/л): KH2PO4 ‒ 1.2; K2HPO4 ‒ 1.8; MgSO4 · 7H2O ‒ 0.2; FeSO4 · 7H2O ‒ 0.01; NaCl ‒ 0.1; NH4Cl ‒ 4. В качестве источника углерода использовали соевое масло (1%, об.). Колбы инкубировали в течение 7 сут на качалке (150 об./мин) при 27°C.
В данной работе способность к синтезу биосурфактантов была изучена для двух штаммов: нового изолята TY24 и штамма Y. lipolytica TEM OS12, выделенного и идентифицированного нами ранее (Yalçın et al., 2018). На следующей стадии супернатанты этих культур использовали в экспериментах по подавлению биопленкообразования.
Штамм сальмонеллы, выделенный нами ранее в птицеводческом хозяйстве, был идентифицирован как Salmonella enterica ser. Enteritidis TM6. Этот изолят использовали в экспериментах по ингибированию биопленкообразования, поскольку ранее была показана его способность образовывать мощные биопленки (Shatila et al., 2020). Штамм был депонирован в Университете Эге, в лабораториях кафедры общей и промышленной микробиологии. Перед экспериментом культуру подращивали в течение ночи в среде Tryptic Soy Broth (TSB) при 37°С.
Приготовление бесклеточных супернатантов (БКС). Штаммы засевали в 250-мл колбы Эрленмейера с 50 мл среды MSM и соевым маслом (1%, об.). Колбы инкубировали, как описано выше. Затем клетки отделяли центрифугированием в течение 25 мин при 3600 g. Далее супернатанты стерилизовали фильтрацией через 0.22-мкм мембраны (“Sartorius Minisart”, Германия). Бесклеточные супернатанты исследовали на предмет наличия биосурфактантов.
Гемолитическая активность. Гемолитическую активность определяли на кровяном агаре с 5% (об.) свежей овечьей крови. БКС (100 мкл) вносили в лунки в агаре, сделанные стерильным пробочным сверлом. Чашки инкубировали 48 ч при 30°C. Прозрачные зоны вокруг лунок указывали на наличие гемолитической активности (Youssef et al., 2004).
Липолитическая активность. Продукцию липаз определяли на солодово-дрожжевом пептонном агаре (среда MYGPA) с 1% (об.) трибутирина. БКС (100 мкл) вносили в лунки в агаре, чашки инкубировали при 28°C в течение 48‒72 ч. Зоны гало вокруг лунок, возникшие в результате гидролиза трибутирина, указывали на наличие липолитической активности.
Метод со CTAB агаром. Метод с цетримониум бромидом-метиленовым синим (CTAB-MB) использовали для определения наличия внеклеточных анионных сурфактантов. В MSM агар добавляли 0.2 г/л CTAB и 0.005 г/л метиленового синего (Siegmund, Wagner, 1991). БКС (100 мкл) вносили в лунки в агаре. Чашки инкубировали 48‒72 ч при 30°C, а затем выдерживали 48 ч при 4°C для развития окрашивания. Образование темно-синего гало указывало на присутствие биосурфактантов гликолипидного типа.
Вытеснение масла. Тест проводили, как было описано ранее (Yalçın et al., 2018). Дистиллированную воду (40 мл) вносили в чашки Петри. Использованное моторное масло (3 мл) равномерно наносили поверх слоя воды. В центр масляного слоя вносили БКС исследуемых дрожжевых штаммов (0.5 мл) и измеряли диаметр образующейся прозрачной зоны. В качестве положительного и отрицательного стандартов использовали 1% СДС (в./об.) и стерильную среду. Приведены средние результаты трех экспериментов в виде среднее ± ± среднеквадратичное отклонение.
Тест с парафилмом М. БКС (25 мкл) наносили на гидрофобную поверхность парафилма М и через 60 с определяли размер и форму капель. Положительным считался результат, при котором капля была не сферической, а ее диаметр превышал 4 мм. В качестве положительного и отрицательного стандартов использовали 1% СДС (в./об.) и стерильную среду.
Метод уплощения капли. Тест проводили как описано ранее (Youssef et al., 2004), с небольшими модификациями. Использованное машинное масло (2 мкл) вносили в ячейки стерильного планшета. Планшет оставляли на 24 ч при комнатной температуре, после чего вносили БКС (20 мкл) в каждую ячейку. Если капля растекалась по покрытой маслом поверхности, результат считали положительным.
Поверхностное натяжение. Поверхностное натяжение (мН м−1) определяли для БКС штаммов Y. lipolytica OS12 и TY24. Измерения проводили на тенсиометре Krüss K6 (“KRÜSS GmbH”, Германия) по методу дю Нуи (отрыва кольца). Показаны средние результаты трех измерений при комнатной температуре. В качестве положительного и отрицательного стандартов использовали 1% СДС (в./об.) и стерильную среду (Gudiña et al., 2010).
Молекулярная идентификация штамма TY24. ДНК выделяли, как описано ранее (Liu et al., 2000). Для амплификации ITS1-5.8S рРНК-ITS2 и D1/D2 доменов 26S рРНК генов использовали праймеры ITS1-ITS4 и NL1-NL4 соответственно. Последовательности праймеров: ITS1 (5'-TCC GTA GGT GAA CCT GCG G-3'), ITS4 (5'-TCC TCC CC GCT TAT TGA TATG C-3'), NL1 (5'-GCA TAT CAA TAA GCG GAG GAA AAG-3') и NL4 (5'-GGT CCG TGT TTC AAG ACG G-3'). Амплификацию проводили на устройстве Gradient Palm-Cycler model CGI-96 (“Corbett Life Science”) в течение 40 циклов при следующих условиях: денатурация ‒ 1 мин при 95°C; отжиг ‒ 1 мин при 58°C; элонгация ‒ 2 мин при 72°C; и финальная элонгация ‒ 10 мин при 72°C. ПЦР-продукты сeквенировали на автоматическом сeквенаторе ABI 3130XL (“Applied Biosystems”, США). Эволюционную историю полученных последовательностей определяли с использованием метода Neighbor Joining (Saitou, Nei, 1987). Филогенетические деревья строили с использованием программы M-ega X (Kumar et al., 2018). Эволюционные расстояния вычисляли по методу Тамура‒Ней (Tamura, Nei, 1993). Анализировали 11 и 12 нуклеотидов для ITS1-5.8S рРНК-ITS2 и D1/D2 домена 26S рРНК генов соответственно. Финальный набор данных для ITS1-5.8S рРНК-ITS2 и D1/D2 домена 26S рРНК генов включал 655 и 3138 позиций соответственно. Значения bootstrap-поддержки для 1000 деревьев указаны в узлах ветвления (Felsenstein, 1985). Последовательности всех типовых штаммов, использованных для построения филогенетического древа, были получены из базы данных NCBI GenBank.
Образование биопленок Salmonella enterica ser. Enteritidis. Для штамма Salmonella Enteritidis, использованного в работе, было ранее показано активное образование биопленок. В ячейки 96-луночного планшета вносили по 100 мкл среды LB без NaCl, инокулировали их штаммом сальмонеллы и инкубировали 24 ч в статических условиях при 37°C. Затем вносили кристаллический фиолетовый (CV) и определяли образование био-пленок, как описано ранее (Shatila et al., 2020).
Антиадгезивная и антибиопленочная активность БКС. БКС из культур штаммов Y. lipolytica TY24 и TEM OS12 использовали для изучения ингибирования биопленок. Для исследования антиадгезивного эффекта БКС (200 мкл) вносили в каждую ячейку 96-луночного планшета. После 18-ч инкубации при 4°C, ячейки ополаскивали стерильным PBS. Ячейки инокулировали, и образование биопленок проходило в условиях, описанных выше. Через 24 ч вносили кристаллический фиолетовый для определения биопленкообразования, как описано выше.
Антибиопленочный эффект оценивали также по модифицированному методу, предложенному Khiralla et al. (2015). Различные объемы БКС (10, 20, 40, 60 и 80 мкл) инкубировали с 50 мкл суточной культурой сальмонеллы в ячейках, содержащих 100 мкл LB без NaCl. Объем в контрольных ячейках доводили до того же значения, что в эксперименте, добавляя стерильную среду вместо БКС. Контроль стерильности содержал неинокулированную среду. Через 24 ч вносили кристаллический фиолетовый для определения биопленкообразования, как описано выше. Значения оптической плотности в эксперименте сравнивали со значениями в контроле.
Процент ингибирования вычисляли согласно уравнению:
Статистический анализ. Данные анализировали, используя программный пакет GraphPad. Результаты представлены как среднее ± среднеквадратичное отклонение.
РЕЗУЛЬТАТЫ
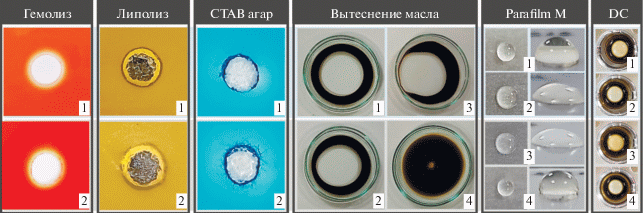
Продукция биосурфактантов дрожжевыми штаммами. Для определения способности изучаемых штаммов синтезировать биосурфактанты использовали несколько качественных и количественных методов. Оба штамма обладали β-гемолитической и липолитической активностью. На CTAB-MB агаре вокруг их колоний образовывались темно-синие зоны. Капли БКС, нанесенные на поверхность масла или парафилма М, имели больший диаметр, чем в контроле. БКС из культур штамма TY24 и Y. lipolytica TEM OS12 вытесняли масло на 6 и 5 см соответственно. Поверхностное натяжение снижалось с 57.5 до 33.5 и 35.5 мН м−1 соответственно. Таким образом, БКС изученных штаммов понижали поверхностное натяжение на 41.7 и 38.3%, что выше значения для положительного контроля (33.91%). Эти результаты указывают на продукцию сурфактантов (табл. 1, рис. 1).
Таблица 1.
Образование биосурфактантов исследуемыми штаммами
| Штамм/образец | HA | LA | CTAB | DC | PM | ODD(см)/ODA(см2) | ST (мН м–1) |
|---|---|---|---|---|---|---|---|
| TY24 | β-Гемолиз | + | + | + | + | 6.0 ± 0.5/28.27 | 33.5 ± 1 |
| TEM OS12 | β-Гемолиз | + | + | + | + | 5.0 ± 0.4/19.64 | 35.5 ± 1 |
| SDS | + | + | + | 7.0 ± 0.5/38.48 | 38 ± 1 | ||
| MSM | ‒ | ‒ | ‒ | 0.8 ± 0.2/0.50 | 57.5 ± 1 |
Примечание. HA ‒ гемолитическая активность; LA ‒ липолитическая активность; CTAB ‒ рост на CTAB-MB агаре; DC ‒ уплощение капли; PM ‒ тест с Parafilm; ODD ‒ вытеснение масла, см; ODA ‒ площадь вытеснения масла, см2; ST ‒ поверхностное натяжение, мН м–1; SDS ‒ положительный контроль, 1% додецилсульфат натрия; MSM ‒ отрицательный контроль, среда MSM.
Рис. 1.
Продукция биосурфактантов исследованными штаммами: Y. lipolytica OS12 (1); штамм TY24 (2); SDS (3); MSM (4); DC ‒ уплощение капли.
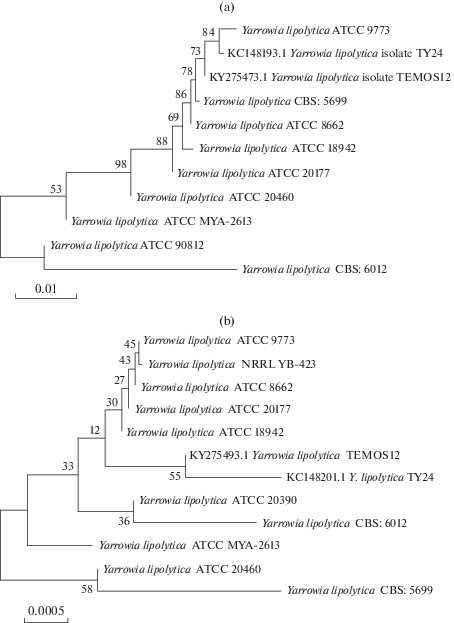
Молекулярный анализ штаммов-продуцентов биосурфактантов. В результате ПЦР амплификации ITS1-5.8S-ITS2 и 26S рРНК регионов штамма TY24 были получены ампликоны длиной 350 и 565 пн. После сравнения с последовательностями, доступными в базе данных GenBank с помощью BLASTN, они были депонированы в базу данных NCBI. Была показана принадлежность исследуемого изолята к виду Yarrowia lipolytica с гомологией свыше 99.50% (табл. 2). Филогенетический анализ ITS1-5.8S рРНК-ITS2 (рис. 2а) и домена D1/D2 26S рРНК (рис. 2б) показал также близкое родство двух исследуемых штаммов и других штаммов, доступных в базе данных NCBI.
Таблица 2.
Молекулярная идентификация исследованных дрожжевых штаммов
| Изолят | ITS1-5.8S-ITS2 rRNA регион | D1/D2 домен 26S рРНК регион | Вид | ||||
|---|---|---|---|---|---|---|---|
| размер ПЦР продукта, пн | гомология, % | № в GenBank | размер ПЦР продукта, пн | гомология, % | № в GenBank | ||
| TY24 | 350 | 99.64 | KC148193.1 | 565 | 99.60 | KC148201.1 | Y. lipolytica |
| TEM OS12 | 285 | 100 | KY275473.1 | 457 | 100 | KY275493.1 | Y. lipolytica |
Рис. 2.
Филогенетические деревья исследованных штаммов Yarrowia lipolytica, основанные на последовательностях ITS1-5.8S-ITS2 регионов (а) и домена D1/D2 26S рДНК (б).
Антибиопленочная и антиадгезивная активность штаммов Y. lipolytica. Было изучено ингибирование формирования биопленок Salmonella Enteritidis в присутствии супернатантов культур двух штаммов Y. lipolytica. Хотя антиадгезивный эффект не был отмечен, при инкубации бактерий с различными объемами БКС образование биопленок тормозилось. Антибиопленочный эффект проявлялся сильнее при большем объеме внесенного супернатанта. При увеличении объема супернатанта Y. lipolytica TEM OS12 с 10 до 80 мкл, ингибирование биопленкообразования возрастало с 86 до 89.42% (рис. 3а). В случае Y. lipolytica TY24, аналогичное увеличение объема БКС (с 10 до 80 мкл) приводило к увеличению антибиопленочной активности с 13.34 до 88.09% (рис. 3б).
ОБСУЖДЕНИЕ
Низкая эффективность существующих методов борьбы с биопленками, а также возрастающая устойчивость биопленкообразующих бактерий к антибиотикам вынуждают исследователей искать новые, более эффективные подходы. С другой стороны, различные группы биосурфактантов известны своими антибиопленочными свойствами, в частности, липопептиды, псевдофактин и гликолипиды. Интерес к биосурфактантам дрожжевого происхождения поддерживается отнесением ряда видов родов Candida, Yarrowia и Pseudozyma к группе GRAS (Generally Regarded As Safe, в общем полагаемые безопасными) (Amaral et al., 2010).
Способность дрожжей Yarrowia lipolytica (ранее Candida lipolytica) синтезировать ряд ценных метаболитов, включая липазы и биосурфактанты, хорошо известна (Janek et al., 2020; Radha et al., 2020). Целью данной работы была оценка продукции биосурфактантов новым изолятом (идентифицированным нами как Y. lipolytica TY24) и ранее описанным штаммом (Y. lipolytica TEM OS12) (Yalçın et al., 2018).
Для скрининга поверхностно-активных агентов было разработано несколько качественных и количественных методов. Тем не менее, ограничения каждого метода делают необходимым применение нескольких подходов для точного и успешного скрининга (Walter et al., 2010; Sidkey et al., 2016). Поэтому в данной работе был использован ряд качественных и количественных тестов для определения способности изучаемых штаммов производить биосурфактанты. Наши результаты аналогичны представленным ранее (Pendse, Aruna, 2018; Yalçın et al., 2018, Eldin et al., 2019).
В первую очередь была изучена гемолитическая активность штаммов. Это предварительный качественный тест, основанный на визуальном наблюдении гемолиза, возможно, указывающего на повреждение мембран в присутствии поверхностно-активных молекул (Youssef et al., 2004; Satpute et al., 2010; Eldin et al., 2019). В работе Sidkey et al. (2016) в качестве потенциальных продуцентов биосурфактантов отбирали только штаммы, вызывающие полный гемолиз на кровяном агаре (β-гемолитические штаммы). Поскольку штаммы, исследованные в данной работе, были способы вызывать тотальный гемолиз, они были классифицированы как потенциальные продуценты биосурфактантов.
Затем был исследован рост штаммов на CTAB-MB агаре. Положительный результат этого теста подтвердил наличие внеклеточных анионных биосурфактантов. Образование синей зоны было вызвано образованием нерастворимых соединений с CTAB (катион) и метиленовым синим (Walter et al., 2010; Sidkey et al., 2016; Pendse, Aruna, 2018; Eldin et al., 2019).
Капли БКС из культур обоих изученных штаммов уплощались и распространялись по поверхности гидрофобного масла или парафилма М. Оба эти теста являются качественными и зависят от способности сурфактанта дестабилизировать капли жидкости, которую связывают со способностью биосурфактантов понижать межфазовое натяжение между каплей и гидрофобной поверхностью (Youssef et al., 2004; Pendse, Aruna, 2018).
Для оценки продукции биосурфактантов был также использован метод вытеснения масла. Площадь, с которой вытесняется масло, зависит от количества биосурфактантов и их эффективности (Walter et al., 2010; Eldin et al., 2019). В данной работе было показано, что супернатанты из культур штаммов Y. lipolytica TY24 и TEM OS12 вытесняли масло на 6 и 5 см соответственно. На следующей стадии после этих предварительных тестов определяли поверхностную активность БКС. Поверхностное натяжение ‒ это мера межфазовой или поверхностной активности жидкостей. Культура считается перспективной, если при добавлении БКС поверхностное натяжение жидкости снижается до 40 или ниже либо более чем на 20 мН м–1 (Walter et al., 2010). В данной работе супернатанты изученных культур понижали поверхностное натяжение с 57.5 до 33.5 и 35.5 мН м–1 соответственно. В соответствии с требованиями, описанными выше, исследованные штаммы можно считать перспективными либо хорошими продуцентами биосурфактантов.
После того, как было показано наличие биосурфактантов в БКС исследованных штаммов Y. lipolytica, провели исследование ингибирования биопленкообразования штаммом Salmonella enterica ser. Enteritidis. Применение бесклеточных супернатантов привлекательно тем, что позволяет снизить стоимость производства (Pontes et al., 2016). Однако применение биосурфактантов дрожжевого происхождения в исследованиях биопленок ограничено. Rufino et al. (2011) вносили в ячейки планшета различные концентрации биосурфактанта Rufisan, полученного из Candida lipolytica UCP 0988. Подавление биопленок, сформированных различными штаммами Lactobacillus spp., Streptococcus spp., Staphylococcus spp., E. coli и Pseudomonas aeruginosa, зависело от концентрации неочищенного биосурфактанта. В некоторых случаях уровень ингибирования достигал 99%. Luna et al. (2011) сообщали о способности неочищенного биосурфактанта из культуры Candida sphaerica подавлять на 80‒92% образование биопленок Pseudomonas aeruginosa, Streptococcus agalactiae и Streptococcus sanguis 12. De Rienzo et al. (2015) сообщали о способности софоролипидов, выделенных из Candida bombicola ATCC 22214 (5%, об.), разрушать зрелые биопленки, образованные Staphylococcus a-ureus ATCC 9144 и B. subtilis BBK006. Очищенные софоролипиды, выделенные из Starmerella bombicola MTCC1910, также ингибировали формирование биопленок Candida albicans, снижали их жизнеспособность и влияли на их архитектуру и на морфологию включенных в биопленку клеток (Haque et al., 2015). Haque et al. (2017) также подтвердили роль софоролипидов как агентов доставки сочетания софоролипид-амфотерицин B против биопленок Candida. В данной работе также сообщается о подавлении биопленок, образуемых Salmonella Enteritidis, на 86‒89.42 и 13.34‒88.09% при совместной инкубации с возрастающими объемами содержащих биосурфактанты супернатантов из культур Y. lipolytica TEM OS12 и Y. lipolytica TY24. Ранее также сообщалось, что повышенный объем БКС вызывал более выраженное подавление бактериальных биопленок (Khiralla et al., 2015; Koohestani et al., 2018).
Одновременный синтез биосурфактантов и липазы позволяет микроорганизмам утилизировать водонерастворимые субстраты и улучшает ассимиляцию нефти (Hu et al., 2018; Singh et al., 2018). Кроме того, Pendse и Aruna (2018) сообщали, что продуценты липазы могут быть также продуцентами биосурфактантов, поэтому мы также исследовали наличие липазной активности на трибутириновом агаре. Этот тест был предложен как удобный метод обнаружения микроорганизмов ‒ продуцентов биосурфактантов (Balan et al., 2017). В данной работе мы также сообщаем о способности изученных штаммов Y. lipolytica синтезировать липазу, что, возможно, также влияло на способность подавлять биопленки Salmonella Enteritidis. Роль липаз как антибиопленочных агентов отмечалась ранее (Kiran et al., 2014; Aykin et al., 2019).
В данной работе в ячейках, покрытых содержащим биосурфактант БКС, не наблюдалась антиадгезивная активность. Это может объясняться низкой концентрацией биосурфактанта в супернатанте. Альтернативное объяснение ‒ неспособность активного ингредиента в супернатанте влиять на свойства поверхности таким образом, чтобы ингибировать образование биопленок (Abu Sayem et al., 2011).
Помимо этого, в настоящей работе была изучена способность двух штаммов Yarrowia lipolytica продуцировать биосурфактанты, а также их антибиопленочная и антиадгезивная активность против биопленок, образуемых штаммом Salmonella Enteritidis. Насколько нам известно, это первое сообщение об антибиопленочной и антиадгезивной активности супернатантов из культур штаммов Yarrowia против биопленок, сформированных Salmonella spp. Антибиопленочный эффект, наблюдавшийся нами, вероятно, связан с наличием биосурфактантов, поэтому дальнейшие исследования будут сконцентрированы на применении неочищенных и/или очищенных биосурфактантов. Кроме того, не исключен анализ различных компонентов бесклеточного супернатанта с целью выявления других антибиопленочных агентов.
Список литературы
Abu Sayem S.M., Manzo E., Ciavatta L., Ramice A., Cordone A., Zandardino A., De Felice M., Varcamonti M. Antibiofilm activity of an exopolysaccharide from a sponge-associated strain of Bacillus licheniformis // Microb. Cell. Fact. 2011. V. 10. Art. 74.
Amaral P.F.F., Coelho M.A.Z., Marrucho I.M.J., Coutinho J.A.P. Biosurfactants from yeasts: Characteristics, production and application // Biosurfactants: Advances in Experimental Medicine and Biology / Ed. Sen R. New York: Springer, 2010. P. 236‒249.
Amrutha B., Sundar K., Halady P.S. Study on E. coli and Salmonella biofilms from fresh fruits and vegetables // J. Food. Sci. Technol. 2017. V. 54. P. 1091‒1097.
Aykin E., Omuzbuken B., Kacar A. Microfouling bacteria and the use of enzymes in eco-friendly antifouling technology // J. Coat. Technol. Res. 2019. V. 16. P. 847‒856.
Balan S.S., Kumar C.G., Jayalakshmi S. Aneurinifactin, a new lipopeptide biosurfactant produced by a marine Aneurinibacillus aneurinilyticus SBP-11 isolated from Gulf of Mannar: Purification, characterization and its biological evaluation // Microbiol. Res. 2017. V. 194. P. 1‒9.
Barak J.D., Liang A.S. Role of soil, crop debris, and a plant pathogen in Salmonella enterica contamination of tomato plants // PLoS One. 2008. V. 3. Art. 1657.
Borges K.A., Furian T.Q., Souza S.N., Menezes R., Tondo E.C., Salle C.T.P., Morales H.L.S., Nascimento V.P. Biofilm formation capacity of Salmonella serotypes at different temperature conditions // Pesqui. Vet. Bras. 2018. V. 38. P. 71‒76.
De Rienzo M.A.D., Banat I.M., Dolman B., Winterburn J., Martin P.J. Sophorolipid biosurfactants: Possible uses as antibacterial and antibiofilm agents // N. Biotechnol. 2015. V. 32. P. 720‒726.
De Oliveira D.C., Fernandes J.A., Kaneno R., Silva M.G., Araujo J.J.P., Silva N.C., Rall V.L. Ability of Salmonella spp. to produce biofilm is dependent on temperature and surface material // Foodborne Pathog. Dis. 2014. V. 11. P. 478‒483.
Eldin A.M., Kamel Z., Hossam N. Isolation and genetic identification of yeast producing biosurfactants, evaluated by different screening methods // Microchem. J. 2019. V. 146. P. 309‒314.
Felsenstein J. Confidence limits on phylogenies: An approach using the bootstrap // Evolution. 1985. V. 39. P. 783‒791.
Giaouris E., Chorianopoulos N., Skandamis P., Nychas G.J. Attachment and biofilm formation by Salmonella in food processing environments // Salmonella ‒ a Dangerous Foodborne Pathogen / Ed. Barakat S.M.M. Croati: InTech, 2012. P. 157‒180.
Gudiña E.J., Rocha V., Teixeira J.A., Rodrigues L.R. Antimicrobial and antiadhesive properties of a biosurfactant isolated from Lactobacillus paracasei ssp. A20 // Lett. Appl. Microbiol. 2010. V. 50. P. 419‒424.
Gunn J.S., Marshall J.M., Baker S., Dongol S., Charles R.C., Ryan E.T. Salmonella chronic carriage: epidemiology, diagnosis and gallbladder persistence // Trends Microbiol, 2014. V. 22. P. 648‒655.
Haque F., Alfatah M.D., Ganesan K., Bhattacharyya M.S. Inhibitory effect of sophorolipid on Candida albicans biofilm formation and hyphal growth // Sci. Rep. 2015. V. 6. v23575.
Haque F., Sajid M., Singh S.C., Batacharyya S. Anti-biofilm activity of a sophorolipid- amphotericin B niosomal formulation against Candida albicans // Biofouling. 2017. V. 33. P. 768‒779.
Harshada K. Biosurfactant: A potent antimicrobial agent // J. Microbiol. Exp. 2014. V. 1. P. 173‒177.
Hu X., Cheng T., Liu J. A novel Serratia sp. ZS6 isolate derived from petroleum sludge secretes biosurfactant and lipase in medium with olive oil as sole carbon source // AMB Express. 2018. V. 8. 165.
Janek T., Mirończuk A., Rymowicz W., Dobrowolski A. High-yield expression of extracellular lipase from Yarrowia lipolytica and its interactions with lipopeptide biosurfactants: a biophysical approach // Arch. Biochem. Biophys. 2020. V. 689. Art. 108475.
Khiralla G.M., Mohamed E.A.H., Farag A.G., Elhariry H. Antibiofilm effect of Lactobacillus pentosus and Lactobacillus planatum cell-free supernatants against some bacterial pathogens // J. Biotech. Res. 2015. V. 6. P. 86‒95.
Kiran G.S., Lipton A.N., Kennedy J., Dobson A.D.W., Selvin J. A halotolerant thermostable lipase from the marine bacterium Oceanobacillus sp. PUMB02 with an ability to disrupt bacterial biofilms // Bioengineered. 2014. V. 5. P. 305‒318.
Koohestani M., Moradi M., Tajik J., Badali A. Effects of cell free supernatant of Lactobacillus acidohilus LA5 and Lactobacillus casei 431 against planktonic form and biofilm of Staphylococcus aureus // Vet. Res. Forum. 2018. V. 9. P. 301‒306.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547‒1549.
Liu D., Coloe S., Braid R., Pedersen J. Rapid mini preparation of fungal DNA for PCR // J. Clin. Microbiol. 2000. V. 38. P. 471.
Luna J.M., Rufino R.D., Sarubbo L.A., Rodrigues L.R.M., Teixeira J.A.C., De Campos-Takaki G.M. Evaluation antimicrobial and antiadhesive properties of the biosurfactant Lunasan produced by Candida sphaerica UCP0995 // Curr. Microbiol. 2011. V. 62. P. 1527‒1534.
Naughton P.J., Marchant R., Naughton V., Banat I.M. Microbial biosurfactants: current trends and applications in agricultural and biomedical industries // J. Appl. Microbiol. 2019. V. 127. P. 12‒28.
Pacwa-Płociniczak M., Płaza G.A., Piotrowska-Seget Z., Cameotra S.S. Environmental applications of biosurfactants: recent advances // Int. J. Mol. Sci. 2011. V. 12. P. 633‒654.
Pendse A., Aruna K. Use of various screening methods for isolation of potential biosurfactant producing microorganism from oil-contaminated soil samples // J. Pharm. Res. 2018. V. 12. P. 599‒605.
Peng D. Biofilm formation of Salmonella // Microbial Biofilms ‒ Importance and Applications / Eds. Dhanaseka-ran D., Thajuddin N. UK: Intech Open, 2016. P 21.
Plaza G., Achal V. Biosurfactants: eco-friendly and innovative biocides against biocorrosion // Int. J. Mol. Sci. 2020. V. 21. Art. 2152.
Pontes C., Alves M., Sanos C., Ribeiro M.H., Gonçalves L., Bettencourt A.F., Ribeiro I.A.C. Can sophorolipids prevent biofilm formation on silicone catheter tubes? // Int. J. Pharm. 2016. V. 513. P. 697‒708.
Radha P., Prabhu K., Jayakumar A., Abilash Karthik S., Ramani K. Biochemical and kinetic evaluation of lipase and biosurfactant assisted ex novo synthesis of microbial oil for biodiesel production by Yarrowia lipolytica utilizing chicken tallow // Process Biochem. 2020. V. 95. P. 17‒29.
Rufino R.D., Luna J.M., Sarubbo L.A., Rodrigues L.R.M., Teixeira J.A.C., Campos-Takak G.M. Antimicrobial and antiadhesive potential of a biosurfactant Rufisan produced by Candida lipolytica UCP 0988 // Colloids Sur. 2011. V. 84. P. 1‒5.
Sadekuzzaman M., Yang S., Mizan M.F.R., Ha S.D. Current and recent advanced strategies for combating biofilms // Compr. Rev. Food Sci. Food Saf. 2015. V. 14. P. 492‒509.
Saitou N., Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees // Mol. Biol. Evol. 1987. V. 4. P. 406‒425.
Satpute S.K., Banpurkar A.G., Dhakephalkar P.K., Banat I.M., Chopade B.A. Methods for investigating biosurfactants and bioemulsifiers: a review // Crit. Rev. Biotechnol. 2010. V. 30. P. 127‒144.
Shatila F., Yaşa I., Yalçın H.T. Inhibition of Salmonella enteritidis biofilms by Salmonella invasion protein-targeting aptamer // Biotechnol. Lett. 2020. V. 42. P. 1963‒1974.
Sidkey N.M., Mohamed H.F. Elkhouly H. Evaluation of different screening methods for biosurfactant producers isolated from contaminated Egyptian samples grown on industrial olive oil processing waste // Br. Microbiol. Res. J. 2016. V. 17. P. 1‒19.
Siegmund I., Wagner F. New method for detecting rhamnolipids excreted by Pseudomonas species during growth on mineral agar // Biotechnol. Tech. 1991. V. 5. P. 265‒268.
Singh P., Patil Y., Rale V. Biosurfactant production: emerging trends and promising strategies // J. Appl. Microbiol. 2018. V. 126. P. 2‒13.
Steenackers H., Hermans K., Vanderleyden J., De Keersmaecker S.C.J. Salmonella biofilms: an overview on occurrence, structure, regulation and eradication // Food. Res. Int. 2012. V. 45. P. 502‒531.
Tamura K., Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees // Mol. Biol. Evol. 1993. V. 10. P. 512‒526.
Teplitski M., Barak J.D., Schneider K.R. Human enteric pathogens in produce: un-answered ecological questions with direct implications for food safety // Curr. Opin. Biotechnol. 2009. V. 20. P. 166‒171.
Walter V., Syldatk C., Hausman R. Screening concepts for the isolation of biosurfactant producing microorganisms // Adv. Exp. Med. Biol. 2010. V. 672. P. 1‒13.
Yalçın H.T., Ergin-Tepebaşı G., Uyar E. Isolation and molecular characterization of biosurfactant producing yeasts from the soil samples contaminated with petroleum derivatives // J. Basic. Microbiol. 2018. V. 58. P. 782‒792.
Youssef N.H., Duncan K.E., Nagle D.P., Savage K.N. Comparison of methods to detect biosurfactant production by diverse microorganisms // J. Microbiol. Methods. 2004. V. 56. P. 339‒347.
Дополнительные материалы отсутствуют.



