Микробиология, 2022, T. 91, № 2, стр. 131-149
Микропластики – новая экологическая ниша в пластисфере для мультивидовых микробных биопленок
М. В. Журина a, *, К. И. Богданов a, А. В. Ганнесен a, С. В. Мартьянов a, В. К. Плакунов a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: mzhurik@mail.ru
Поступила в редакцию 16.11.2021
После доработки 25.11.2021
Принята к публикации 29.11.2021
- EDN: LOXEFL
- DOI: 10.31857/S0026365622020148
Аннотация
Проведен анализ распределения, колонизации, биодеградации и воздействия первичных и вторичных микропластиков на экологические системы пластисферы. Описаны пути загрязнения микропластиками атмосферы, гидросферы и литосферы. Рассмотрен состав мультивидовых сообществ, колонизирующих микропластики, и их особенности по сравнению с сообществами микроорганизмов окружающей среды. Обсуждаются процессы биодеструкции микропластиков и их векторная роль в переносе генетической информации, влияющей на структуру природных микробных сообществ, а также в распространении токсичных примесей.
ВВЕДЕНИЕ
Недавно в журнале “Микробиология” были опубликованы два обзора, значительная часть которых посвящена микробной колонизации и биодеградации пластмасс свободноживущими и объединенными в сообщества (мультивидовые биопленки) микроорганизмами (Плакунов и соавт., 2020; Котова и соавт., 2021). В данном обзоре мы остановимся только на результатах работ, касающихся распространения, колонизации, деградации и вредного воздействия на окружающую среду микропластиков, данные о которых не вошли в упомянутые публикации.
КЛАССИФИКАЦИЯ МИКРОПЛАСТИКОВ, ОСОБЕННОСТИ ИХ РАСПРОСТРАНЕНИЯ И МЕТОДЫ ОБНАРУЖЕНИЯ
Термин “микропластики” (МП) (microplastics, MP) впервые применен при обнаружении и исследовании распределения мелких фрагментов синтетических пластмасс в морских осадках (Thompson et al., 2004).
Классификация микропластиков. В настоящее время при классификации МП используют два основных критерия: размер МП и их происхождение. К собственно МП относят частицы, размеры которых лежат в пределах от 1 мкм до 5 мм (по всем измеряемым параметрам). Частицы меньшего (от 1 нм до 1 мкм) размера принято называть нанопластиками (НП) (Brander et al., 2020). Существуют и другие системы классификации, в которых пластики подразделяют, например, на макро- или мегапластики, размеры которых более 2.5 см, и мезопластики от 5 мм до 2.5 см (Akdogan, Guven, 2019; Ganesh et al., 2019). Но и в этих случаях к МП относят фрагменты длиной менее 5 мм (Hammer et al., 2012; National Ocean Service, 2018; Wu et al., 2019).
По источникам происхождения МП подразделяются на первичные и вторичные. Первичные МП производят в промышленных масштабах в виде частиц различной формы (размером, как правило, не более 5 мм). Их используют для изготовления бытовых и технических изделий: косметических средств, листовых и пленочных материалов, трубопроводов, композитных абразивов и красок, резиновых и пластиковых гранул, применяемых как наполнители и асфальтовые покрытия, и т.д. Ежегодное производство этих МП измеряется миллионами тонн. В окружающую среду они попадают, как правило, в составе сточных вод (Ziajahromi et al., 2017).
Вторичные МП (включая НП) возникают в результате деструкции изделий из первичных МП (именно их иногда называют “мегапластиками”). Их количество, поступающее в окружающую среду, значительно превосходит масштабы загрязнения экосистем первичными МП (Lassen et al., 2015; Rochman et al., 2019) в связи с широчайшим использованием пластмасс и накоплением огромных количеств отходов, формирующих даже целые “пластиковые озера”. Примером может служить озеро Уру-Уру в Боливии, которое превратилось в пластиковую свалку (рис. 1).
Распространение микропластиков. По современным данным, МП (и НП) распространены в природных средах по всей поверхности Земли, поскольку они легко переносятся с воздушными массами (Prata et al., 2020; Petersen, Hubbart, 2021). Изучению МП посвящено большое количество работ (согласно Palmas et al., 2021, свыше 1000 публикаций в 2020 г.), в которых основное внимание уделяется методам обнаружения МП в составе как неживой природы, так и в тканях и органах растений и животных, а также механизмам токсического воздействия МП на эти организмы, включая человека. Значительно меньше освещены процессы микробной деградации МП в природе и участие в них мультивидовых микробных сообществ. Именно этим вопросам мы постараемся уделить особое внимание в своем обзоре. В то же время коснемся других связанных с МП аспектов лишь в той степени, которая необходима для представления о глобальном характере данной проблемы. Стоит отметить, что некоторые авторы рассматривают проблему МП как “бомбу замедленного действия”, учитывая возможность отдаленных последствий влияния МП на природные экосистемы (Lassen et al., 2015).
Методы обнаружения микропластиков. Выявление и количественное определение МП в природных объектах вызывает значительные трудности. Первым этапом является сбор и обработка проб. Соответствующие методы наиболее разработаны для водных и воздушных сред. Исторически сложилось так, что в основном они были применены для анализа морской воды. Однако, несмотря на подавляющую численность исследований, посвященных обнаружению МП в этой природной среде, до сих пор не существует стандартизированных подходов к анализу МП в морских объектах. Для отбора проб поверхностных вод (обычно из слоя глубиной 15 см, где скапливается до 95% МП, а также связанный с ними планктон) чаще всего используют либо нейстонные сети, либо тралы-манты (manta trawls). Последние названы так из-за сходства их формы с гигантскими скатами. Подобный трал, состоящий из тонкой сетки, буксируется за судном и собирает фрагменты размером от 50 мкм до 3 мм (Crawford, Quinn, 2017). В дальнейшем МП отделяются от остального содержимого трала, например, посредством флотации. Особое значение имеют эстуарии – места впадения рек в моря, где скапливаются значительные количества МП. При сборе образцов в таких районах необходимо соблюдать стерильность и хранить материалы при низкой температуре, поскольку, как правило, сообщества, колонизирующие МП в эстуариях, сильно отличаются по составу от природного окружения и содержат много примесей (Wang et al., 2020).
Переносимые воздушными потоками атмосферные МП наименее изучены в отношении их количества и степени распространенности. Это неудивительно, поскольку атмосферное загрязнение состоит из очень мелких МП, что затрудняет их сбор и анализ. С этой целью используют специальные фильтровальные устройства, позволяющие обеспечивать проток больших объемов воздуха и собирать МП размером до 10 мкм (Prata et al., 2020).
Серьезные затруднения вызывают сбор и анализ образцов МП в почве. Для этого используют различные механические устройства с последующим фракционированием полученных образцов (Liu et al., 2020).
Не останавливаясь на деталях специальных методик, сошлемся на недавно опубликованный обзор (da Costa, Duarte, 2020), в котором подробно рассмотрены методические приемы сбора и анализа МП морской, атмосферной и почвенной пластисфер. Особым приемам анализа МП в пищевых продуктах посвящен отдельный обзор (Conesa, Iñiguez, 2020).
МИКРОПЛАСТИКИ В ОКРУЖАЮЩЕЙ СРЕДЕ
В течение 2019–2020 гг. в мире было произведено в среднем от 368 до 415 млн тонн пластика (с ожидаемым приростом 4% в ближайшие годы), что привело к возрастающим масштабам поступления пластиковых отходов в окружающую среду (Billard, Boucher, 2019; Plastics – the Facts, 2020). По оценке специалистов, в океан попадает 10–12 млн тонн в год первичных МП (около 3% от общего производства синтетических пластмасс), вызывая его беспрецедентное загрязнение и оказывая отрицательное воздействие на экосистему океана (Amaral-Zettler et al., 2020; Petersen, Hubbart, 2021) (рис. 2). МП и НП, возникающие при разрушении мегапластиков, распространяются через атмосферу, литосферу и гидросферу.
Рис. 2.
Микропластики: распределение в окружающей среде и направления исследования (по Sun et al., 2022).
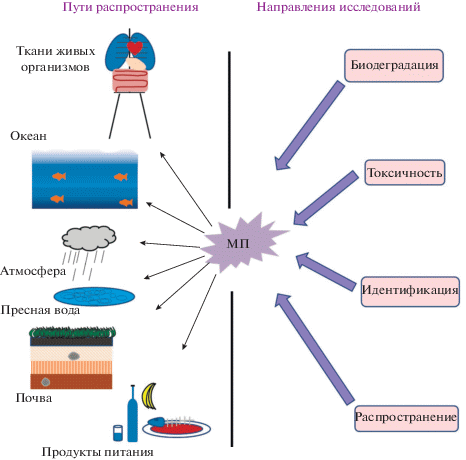
Микропластики в атмосфере. По подсчетам экспертов, в западных районах США преимущественным источником МП в атмосфере являются шоссейные дороги (84%), океан (11%) и пыль сельскохозяйственных земель (5%) (Brahney et al., 2021). В атмосфере, которая служит ключевым переносчиком МП на большие расстояния, обнаруживается значительное количество частиц МП (особенно в густонаселенных районах). В качестве типичных примеров можно упомянуть исследования, проведенные в разных районах Европы, в частности, в Гамбурге (Германия) и его окрестностях. В целом, количество (от 136.5 до 512.0 частиц), измеряемое путем сбора осевших частиц МП с 1 м2 в сут, пропорционально степени заселенности данной местности. Однако высокая плотность частиц МП неожиданно обнаружена и в сельских районах. Как правило, МП выявляли методом эпифлуоресцентной микроскопии после обработки красителем нильским красным. Химическую природу МП устанавливали методом Рамановской спектроскопии. Обнаружено, что в составе МП преобладают частицы, состоящие из сополимера полиэтилена (ПЭ) (48.8%) с этилвинилацетатом (22%), тогда как количество индивидуального ПЭ составляло около 15% (Klein, Fischer, 2019). Сходные результаты получены в другом районе Земли (на юге КНР в провинции Дунгуань), где обнаружено от 175 до 313 частиц МП на 1 м2 в сут. Химическую природу МП в этом случае устанавливали с помощью инфракрасной спектроскопии с Фурье-преобразованием (ИКФС или FTIR). Обнаружены четыре вида полимеров: ПЭ (14%), полипропилен (ПП) (9%), полистирол (ПС) (4%), и целлюлоза (73%). Несмотря на то, что целлюлоза является природным полимером, ее волокна могут содержать токсичные красители и другие вредные примеси. Подавляющее количество частиц МП было представлено именно волокнами (Cai et al., 2017). По-видимому, атмосфера является одним из путей попадания МП в такие экзотические и мало посещаемые человеком районы Земли как вершины гор. Недавно МП обнаружены на горе Эверест (в Гималаях) на высоте 8840 м. В этом случае наибольшая концентрация МП, представленных микроволокнами, происходит из альпинистского снаряжения и одежды, однако заметное количество МП поступает и с воздушными потоками (Napper et al., 2020). Замечено также попадание МП через атмосферу в ледниковую зону Тибетского плато (“Третий полюс мира”, “Азиатская водонапорная башня”) (Zhang et al., 2020).
Микропластики в литосфере. Содержание МП в литосфере относительно невелико. Например, в среднем оно составляет 25 частиц МП на литр фильтрата, полученного со свалки типичных твердых бытовых отходов. Однако следует учесть, что этот вопрос остается малоизученным, поскольку только 5% исследований посвящено выявлению МП в литосферных объектах. Одним из возможных объяснений малой изученности этого компонента окружающей среды являются трудности выделения и количественного определения МП в таких объектах, как почва, а также отсутствие стандартных приемов для осуществления этих анализов. Не исключается потеря или видоизменение МП в процессе мокрого сжигания сопутствующих органических веществ, препятствующих отделению МП (Ruimin et al., 2020). Сделаны попытки улучшить способы извлечения МП из почвенных образцов. Например, показано, что обработка 30% Н2О2 при 70°С вдвое увеличивает количество МП, извлекаемых из почвы и глинистых субстратов (Li et al., 2019).
Исключением из общего правила являются почвы, расположенные поблизости от предприятий, производящих первичные МП, а также сельскохозяйственные почвы, подвергающиеся специальным методам обработки, например, мульчированию, т.е. внесению компонентов (в том числе пластических масс), с целью улучшения структуры почвы. В этих объектах количество частиц МП и НП может резко возрастать. Подробнее эта проблема освещена в ряде обзорных публикаций (Li et al., 2020; Zhang et al., 2021).
Микропластики в гидросфере. Ранее уже было упомянуто, что сам термин МП возник при их обнаружении и изучении в морских осадках (Thompson et al., 2004). С тех пор поиск МП и НП, их количественное определение, анализ токсичности и оценка вредных последствий, вызываемых ими для объектов животного и растительного мира, как в пресноводных, так и в морских водоемах, являются ведущим направлением изучения МП. Как мы отмечали в предыдущем обзоре (Плакунов и соавт., 2020), для систем гидросферы, содержащих сообщества организмов, колонизирующих отходы синтетических пластмасс, предложен специальный термин “пластисфера” (plastisphere), в качестве новых экологических ниш для населяющих ее организмов (Zettler et al., 2013; Yang et al., 2020; Wright et al., 2021). МП обнаружены во всех водоемах, включая океаны, озера и реки. Не являются исключением и источники питьевой воды, в т.ч. озеро Байкал (Ильина и др, 2021). При этом реки и озера представляют собой своего рода “пластиковые коллекторы”, куда пластики смываются с водоразделов атмосферными осадками (Koelmans et al., 2019; Hale et al., 2020). Большое беспокойство вызывает накопление МП в антарктических районах, поскольку они представляют собой уникальные и высокочувствительные к загрязнению области мирового океана (Lo Giudice et al., 2019).
Как будет показано в следующих разделах обзора, многочисленные исследования доказали, что МП являются важными переносчиками и распространителями микроорганизмов (особенно в водных средах), формирующих на их поверхности мультивидовые биопленки. Состав таких биопленок может существенно отличаться от состава популяций окружающей микрофлоры, свободно живущей или связанной с природными поверхностями раздела. Эти свойства МП могут оказывать существенное воздействие на состояние окружающей среды и функционирование населяющих ее организмов (Yang et al., 2020).
Наличие МП в ряде используемых человеком продуктах (пище, косметике и др.) рассмотрено в разделе “Токсичность МП в природных средах, пищевых продуктах и косметике”.
КОЛОНИЗАЦИЯ МИКРОПЛАСТИКОВ МИКРООРГАНИЗМАМИ
Особенности формирования мультивидовых био-пленок на микропластиках. Загрязнение природных биомов (совокупности экосистем одной природно-климатической зоны), в первую очередь гидросферы, отходами производственной деятельности человека происходит в течение многих тысячелетий, однако только в последние десятки лет оно начинает приобретать катастрофический характер, в основном, из-за появления искусственной среды, пластисферы, содержащей в качестве нового субстрата синтетические пластмассы. Основными типами таких субстратов являются ПЭ (английская аббревиатура PE), ПП (PP), поливинилхлорид, ПВХ (PVC), ПС (PS), и полиэтилентерефталат, ПЭТ (PET), которые, по данным разных авторов, в среднем составляют 90% МП гидросферы. В случае пресноводных экотопов (реки, озера) ПЭ и ПП обнаружены примерно в 50% МП, причем, они преимущественно локализуются в водной фазе и осадках, тогда как ПЭТ и ПС наиболее широко представлены в водной биоте. Естественно, что количественные результаты этих измерений могут отличаться в зависимости от разных географических зон (Cera et al., 2020). МП служат поверхностью, колонизируемой, в основном, прокариотными микроорганизмами, а также некоторыми эукариотами (мицелиальными грибами, диатомовыми водорослями и мшанками) (Arias-Andres, 2020).
Возникновение пластисферы не могло не оказать существенного влияния на другие сообщества, населяющие природные среды, и поэтому она привлекает пристальное внимание исследователей. Однако в этой области остается множество спорных вопросов, касающихся природы и взаимоотношений обитателей пластисферы. Например, существует ли специфическое “пластисферное” сообщество микроорганизмов, обладающее повышенным сродством к синтетическим материалам? Какую роль играет пластисфера в распространении патогенных микроорганизмов, а также микробной резистентности к биоцидам, с учетом высокой скорости горизонтального переноса генов в мультивидовых биопленках? Влияет ли деструкция МП на токсичность синтетических пластмасс и содержащихся в них примесей в отношении других обитателей природных экотопов? МП в океане представляют собой устойчивые вещества, которые не являются полноценными источниками питания и, вероятно, не будут подвергаться микробному разложению длительный период времени. Эти и ряд других проблем, связанных с пластисферой, мы постараемся в той или иной степени затронуть в последующей части обзора. Основная часть сведений получена при исследовании пластисферы океана, гораздо меньше известно о поведении МП в почве.
Для глубокого понимания специфики состава и взаимоотношений микробных компонентов пластисферных сообществ, прежде всего, необходимо кратко остановиться на основных методических подходах к определению их таксономической принадлежности и особенностей физиолого-биохимических свойств.
Методы исследования микроорганизмов пластисферы. Начиная с первых этапов исследования пластисферы и до настоящего времени, основными инструментами остаются методы секвенирования ампликонов 16S РНК, которые в современной интерпретации представляют собой высокопроизводительное секвенирование (high throughput sequencing, HTS), также известное как секвенирование следующего поколения (next-generation sequencing, NGS), в основном, на базе секвенаторов Illumina, позволяющее параллельно секвенировать до десятков миллионов нитей ДНК. Этот исследовательский инструмент широко используется в геномике, секвенировании, эпигеномике и функциональной геномике. Применение технологии NGS позволяет выполнять разнообразные задачи секвенирования, в том числе геномов, транскриптомов, а также макрогеномов и разрабатывать новые подходы к функциональной геномике (Tu et al., 2020). Обычно содержание микроорганизмов на поверхности МП невелико, и оно очень сильно варьирует в зависимости от химической природы МП, состава окружающей их среды и времени года. Но, самое главное, на экстракцию ДНК и, соответственно, состав сообщества влияют физико-химические свойства МП, размер их частиц, условия окружающей среды (Pinto et al., 2019; Mughini-Gras et al., 2021). Кроме того, как мы уже отмечали, анализ сообществ пластисферы затрудняется присутствием в их составе э-укариотных микроорганизмов. Использование молекулярных методов не обеспечивает получение информации об абсолютном содержании, пространственном распределении и возможных путях взаимодействия микроорганизмов в составе мультивидовых биопленок. Правда, применение недавно разработанной техники гибридизации in situ решает некоторые из этих проблем, но с малой надежностью результатов.
В связи с этим подход, основанный на геномных технологиях, дополняется сочетанным использованием физико-химических и микроскопических методов, что требует подключения к исследованиям специалистов междисциплинарных областей: химиков, физиков, специалистов по материаловедению и инженерных работников.
Широкое распространение получило исследование архитектуры биопленок пластисферы с помощью сканирующей электронной микроскопии, СЭМ (scanning electron microscopy, SEM). Иногда этот метод сочетают с определением элементного состава биопленок, применяя энергодисперсионную спектроскопию, ЭДС (energy-dispersive spectroscopy, EDS). Использование такого приема позволяет анализировать элементный состав конкретных областей МП и характеризовать их возраст и адсорбционную способность, влияющие на колонизацию микроорганизмами (Newbury, Ritchie, 2013). Существуют усовершенствованные методы СЭМ, например, автоэмиссионная сканирующая электронная микроскопия, АЭСЭМ (field emission scanning electron microscopy, FESEM), в которой используется автоэмиссионный источник электронов (field emitter), представляющий собой так называемую “автоэмиссионную пушку” (field emission gun) ‒ одиночную вольфрамовую нить с заостренным острием в качестве источника электронов. Использование такого устройства, вместо термоионного источника электронов (thermionic electron source) в обычной СЭМ, позволяет получить электронный зонд (electron probe) размером до 0.5 нм и существенно повысить пространственное разрешение изображения (Bridier et al., 2014).
Однако любая модификация СЭМ обеспечивает хорошее пространственное, но невысокое таксономическое разрешение, в то время как данные секвенирования позволяют установить таксономический состав сообщества, но не пространственное распределение и взаимодействие между разными таксонами (Flemming, Wuertz, 2019). Поэтому для изучения биопленок пластисферы целесообразно использовать не один метод, а сочетание микроскопических и молекулярно-биологических методов.
Применение конфокальной лазерной сканирующей микроскопии, КЛСМ (laser confocal scanning microscopy, LCSM) позволяет сканировать структуру биопленок послойно, а затем с помощью специального программного обеспечения реконструировать трехмерную архитектуру биопленки (Hu et al., 2010; Bridier et al., 2013; Bridier, Briandet, 2014). Применение постоянно совершенствующихся флуоресцентных меток позволяет локализовать с помощью КЛСМ расположение в структуре биопленок компонентов матрикса ‒ нуклеиновых кислот, белков, полисахаридов, и даже идентифицировать физиологическое состояние микробных клеток (Tu et al., 2020). Таким образом, комбинирование метода КЛСМ с молекулярно-биологическими методами позволяет осуществить еще более глубокий анализ архитектуры мультивидовых микробных компонентов и пространственное взаимодействие их компонентов.
Можно сослаться, например, на перспективный новый подход, сочетающий метод конфокальной микроскопии с методом FISH (combinatorial labelling and spectral imaging – fluorescence in situ hybridization, CLASI-FISH), который использован для анализа сообществ, колонизирующих МП (Arias-Andres, 2020). С этой целью создан комбинированный набор зондов, состоящий из трех существующих филогенетических зондов (специфичных для всех бактерий, α- и γ-протеобактерий), а также четыре недавно разработанных зонда (специфичных для Bacteroidetes, Vibrionaceae, Rhodobacteraceae и Alteromonadaceae), помеченных семью флуорофорами. Этот набор зондов успешно испытан на чистых бактериальных культурах. Применение данного подхода повышает уверенность в таксономической идентификации, поскольку снижает количество ложных срабатываний. Испытание этого метода на МП, помещенных в природные среды в прибрежных зонах трех разных биогеографических регионов, показало его пригодность не только для идентификации таксонов микроорганизмов, но и визуализации их пространственного распределения в пределах микробных биопленок. Микробные сообщества оказались гетерогенными с прямыми пространственными взаимоотношениями между бактериями, цианобактериями и эукариотами, такими как диатомовые водоросли, а также представителями микрометазоа (Schlundt et al., 2020). С помощью сходного подхода детально проанализированы количественный состав и архитектура, а также некоторые функции матрикса (как барьера диффузии) у биопленок ряда возбудителей внутрибольничных инфекций (Dutta et al., 2021).
Для качественного и количественного определения некоторых свойств МП успешно используют разные виды “зондовой микроскопии”, главным образом, атомную силовую микроскопию, АСМ (atomic force microscopy, AFM), а также поверхностную зондовую микроскопию, ПЗМ (surface probe microscopy, SPM). В случае АСМ используют микромеханический зонд-кантилевер, на конце которого расположена игла, выполненная из алмаза или нитрида кремния, скользящая по поверхности образца и взаимодействующая с ним. При изменении положения иглы, регистрируемом оптическим методом, возникает электрический сигнал, который преобразуется в цифровое изображение. Форма иглы может значительно изменяться в зависимости от способа изготовления. Радиус острия иглы лабораторных кантилеверов находится в пределах 1 нм. В ПЗМ игла зонда соединена с пьезоэлектрическим элементом, с помощью которого анализируются поступающие сигналы. Эти методы визуализации позволяют исследовать микрорельеф бактериальных клеток, силу их адгезии, а также способы взаимодействия микробных биопленок с поверхностью и многие другие параметры биопленок (Bhushan, Marti, 2017; Dash et al., 2021).
Комбинирование микроскопии АСМ с ИК-спектроскопией позволяет детектировать некоторые виды молекул, присутствующие в микробных клетках, а, следовательно, анализировать физиолого-биохимическое поведение последних в бактериальных сообществах на клеточном уровне (Barlow et al., 2016). Сочетание АСМ с Рамановской спектроскопией, в свою очередь, дает возможность изучить топографию поверхности биопленок с одновременной характеристикой ее химического состава, а также проследить за динамикой формирования матрикса биопленок (Huang et al., 2020).
Рамановская спектроскопия (спектроскопия комбинационного светорассеяния) может служить мощным инструментом анализа биопленок в модификации с усилением поверхностного светорассеяния. Иногда этот вариант именуют как “спектроскопия гигантского комбинационного рассеяния” (surface-enhanced Raman spectroscopy, SERS). Суть метода состоит в усилении рамановского (“неупругого”, т.е. с изменением длины волны) светорассеяния без воздействия на релеевское (“упругое” светорассеяние без изменения длины волны). Метод позволяет идентифицировать даже очень близкие по структуре молекулы. Усиление рамановского светорассеяния достигается путем введения в анализируемую смесь, которая может быть твердой, жидкой или гелеобразной (в этом преимущество метода SERS перед ИК-спектроскопией, требующей использования сухих образцов), наночастиц электропроводящего металла (чаще всего серебра). Таким приемом можно изучать химический состав матрикса биопленок и прослеживать их формирование (Chao, Zhang, 2012). С помощью этого приема удается идентифицировать таксономически близкие микроорганизмы, например, два штамма одного вида (Cui et al., 2019; Борисова и соавт., 2020).
Важный вклад в исследование свойств МП и их изменений в процессе экспозиции в природных средах вносят исследования с применением ИК-спектроскопии (FTIR. Они позволяют выявить связи между свойствами МП и способностью микроорганизмов к их колонизации и биодеградации в условиях пластисферы (Veerasingam et al., 2020).
Применение метода ядерного магнитного резонанса, ЯМР (nuclear magnetic resonance, NMR) и различных его модификаций позволяет расшифровать метаболические процессы, происходящие в мультивидовых микробных сообществах (Herrling et al., 2019). Слишком вариабельный метод оценки численности биопленочных микроорганизмов путем определения числа КОЕ с успехом может быть заменен методом проточной цитометрии, однако он требует использования дорогостоящего оборудования (Sgier et al., 2016, 2018).
К сожалению, ограниченный объем обзора не позволяет подробнее остановиться на этих и других широко применяемых в настоящее время комбинированных физико-химических подходах к исследованию мультивидовых биопленок на МП. За дополнительной информацией следует обратиться к недавно опубликованным монографиям (He, Luo, 2020; Nag, Lahiri, 2021; Rocha-Santos et al., 2021).
Состав и особенности формирования мультивидовых биопленок на микропластиках. Изучение процессов колонизации МП микроорганизмами осуществляют с помощью трех основных приемов: сбор МП, находившихся в природных средах (морских и пресных водоемах, почве), как правило, длительное время, и определение таксономического состава сформированных на них сообществ; внедрение стерильных МП в природные среды на определенный срок (как правило, от нескольких недель до нескольких месяцев) с последующим анализом таксономического состава формирующегося сообщества и биодеградации МП; изучение формирования микробных сообществ на стерильных образцах МП в лабораторных условиях (время инкубации зависит от поставленных задач). Последний подход позволяет моделировать природные микробные сообщества, оценить взаимодействие их компонентов и влияние их на МП.
Процесс формирования микробных биопленок разные авторы подразделяют на несколько этапов (от 4 до 7). Мы не останавливаемся на данных деталях, поскольку эти этапы подробно охарактеризованы в предыдущих публикациях (Плакунов и соавт., 2016; Tu et al., 2020). Основное внимание будет уделено особенностям формирования мультивидовых биопленок на поверхности МП.
Основные этапы и закономерности формирования мультивидовых биопленок на поверхности мега- и микропластиков во многом совпадают, однако в основополагающей публикации, посвященной таксономическому составу микрофлоры МП, авторы отмечали в образцах МП, собранных в различных районах Северной Атлантики, отличия таксономического состава микробных сообществ, колонизирующих МП, от состава сообществ окружающей среды. Кроме того, были обнаружены различия и в разнообразии состава микробных сообществ на поверхности МП по сравнению с окружающей средой. Вследствие этого для комплекса сообществ, колонизирующих МП, авторы предложили специальный термин “пластисфера” (Zettler et al., 2013). В последующие годы в результате проведения множества исследований таксономического состава микроорганизмов, колонизирующих МП, эти взгляды во многом подтвердились. Наиболее интересным фактом оказалась высокая численность γ-протеобактерий (особенно Acinetobacter, Pseudomonas, Thiothrix, Alkanindiges) и β-протеобактерий (особенно Roseateles, Massilia, Hydro-genophaga, Acidovorax) на крупных частицах, а также представителей различных таксонов Bacteroidetes и Actinobacteria на мелких частицах (Harrison et al., 2014; McCormick et al., 2016; Ogonowski et al., 2018).
Как считают некоторые исследователи, общим свойством микроорганизмов, колонизирующих МП, является их способность к деструкции синтетических пластмасс. Другие виды (в том числе потенциальные патогены) можно рассматривать как “попутчики” (“hitchhikers”), сопутствующие основным обитателям сообществ, локализованных на МП (Jiang et al., 2018).
В другой работе показано, что бактерии Pirellulaceae, Phycisphaerales, Cyclobacteriaceae и Roseococcus оказались более многочисленными на пластике, чем на природных субстратах. При этом геном бактерий, формирующих биопленки на МП, оказался обогащен детерминантами, связанными с биосинтезом аминокислот, кофакторов и витаминов. Авторы полагают, что МП создают эконишу, характеризующуюся не только особенностями состава сообщества, но и уникальностью метаболических функций колонизирующих МП микроорганизмов (Miao et al., 2019).
Однако некоторые исследователи считают, что таксономический состав сообществ, населяющих МП, существенно не отличается от состава сообществ природных субстратов, но может сильно зависеть от физико-химических параметров среды, а также пространственного распределения и, в некоторой степени, от химического состава МП (Pinto et al., 2019; Wright et al., 2020).
В качестве примера сложного характера рассматриваемой проблемы целесообразно более подробно остановиться на результатах одного из новейших исследований МП на двух участках голландской части Рейна (недалеко от забора питьевой воды). Для исследования собирали три фракции МП, используя сита с диаметром ячеек 500, 100 и 10 мкм. В каждой фракции анализировали природу МП (с помощью ИК-спектроскопии) и микробный состав сообществ (микроскопическими и молекулярными методами). Проводили также микробиологический анализ состава поверхностных вод, как до фильтрации, так и после нее. Оказалось, что содержание МП варьирует в зависимости от сезона в пределах от 10 208 частиц/м3 (зимой) до 334 667 частиц/м3 (летом), причем наибольшую долю МП составляют полиамиды (30%) и поливилихлориды (26%). Кроме этих двух МП, ПС и полиуретан были преобладающими МП во фракции размером 20‒100 мкм, чем в более крупной фракции 100‒500 мкм. Установлено, что мультивидовые сообщества, сформированные на крупных частицах (100‒500 мкм) отличаются наименьшим микробным разнообразием по сравнению с поверхностными водами и мелкими (10‒100 мкм) частицами. Отмечены существенные сезонные вариации состава сообществ. При этом оказалось, что фракция более крупных МП обогащена присутствием представителей специфических микробных таксонов (в частности, Acinetobacter, Pseudomonas, Legionella, Mycobacterium и Arcobacter). Важно отметить, что в подавляющем большинстве образцов МП всех размеров обнаружены гены устойчивости к антибиотикам: erm(B) и sul1 (Mughini-Gras et al., 2021).
Таким образом, упомянутое исследование показало, что в 80 образцах МП разного размера, отобранных в течение разных сезонов (лето и зима) обнаружено 480 таксонов, принадлежащих к двум царствам: 99.9% Bacteria и 0.1% Archaea. Из них 29 типов (в основном Proteobacteria ‒ 47%, Bacteroidetes ‒ 17% и Cyanobacteria ‒ 14%), 67 классов (в основном Betaproteobacteria ‒ 21%, Gammaproteobacteria ‒ 17% и Chloroplast ‒ 11%), 102 порядка (в основном Burkholderiales ‒ 17%, Pseudomonadales ‒ 10% и Flavobacteriales ‒ 8%), 171 семейство (в основном Comamonadaceae ‒ 14%, Moraxellaceae ‒ 9% и Sporichthyaceae ‒ 5%) и 307 родов (главным образом, Acinetobacter ‒ 7%, Flavobacterium ‒ 5%, а также hgcI clade ‒ 4%).
Представители Archaea сравнительно редко детектируются на поверхности МП. Однако в одном из исследований, проведенном в бухте острова Эльба, с применением секвенирования гена 16S рРНК, а также методом FISH c флуоресцентным зондом Arch915 обнаружена специфичность в колонизации археями МП в зависимости от химической природы МП. При этом ампликоны архей варьировали в пределах 5.9 ± 10.5% от всех последовательностей на ПС по сравнению с ПЭ и ПП, где они составляли 0.2 ± 0.3 и 0.2 ± 0.4% соответственно (Vaksmaa et al., 2021).
Следует отметить, что в большинстве публикаций авторы проявляют небольшой интерес к эукариотным обитателям пластисферы. Лишь в недавно проведенном детальном исследовании этому вопросу посвящено заслуженное внимание. В результате изучены взаимодействия бактериальной и эукариотной форм жизни, входящих в состав микробиома пластикового мусора в Средиземном море. Отмечено положительное влияние на морской микробиом красных водорослей ‒ нового члена пластисферы. Установлено, что в образцах присутствует множество грибных компонентов (микобионтов), а также прокариотные микроорганизмы. Изучены водоросли ‒ колонизаторы МП, в том числе, ответственные за цветение воды. Среди них присутствуют виды, которые ранее не были обнаружены на МП (Amaral-Zettler et al., 2021). Помимо данного исследования стоит упомянуть, что в предыдущей цитированной нами работе (Vaksmaa et al., 2021) также отмечено наличие представителей Eukarya, определенных с помощью зонда EUK516 и формирующих микроколонии на химически неидентифицированных МП.
Значительно меньшее внимание уделяется составу микробиома, характерному для МП в почве. Во многом это объясняется методическими трудностями, связанными с отделением МП от почвенной массы. Между тем, влияние МП на экологические системы почвы может оказаться весьма заметным, поскольку в почву ежегодно поступает в 4‒23 раза больше отходов пластмасс, чем в океан (Li et al., 2021). В связи с возникающими трудностями таксономического анализа сообществ, колонизирующих МП в почве, основное внимание уделяется последствиям, вызываемым присутствием МП в почвенных экосистемах. Например, показано, что введение 1% МП, состоящих из НППЭ, повышает рН почвы, а добавление такого же количества МП из ВППЭ, напротив, снижает этот показатель (Boots et al., 2019). Показано, что применение неорганических удобрений может усиливать влияние МП на таксономический состав почвенных сообществ. Например, введение МП, состоящих из ПЭ, снижает относительное содержание бактерий рода Acidobacteria, являющихся важным компонентом почвенных биоценозов (Fei et al., 2020; Kalam et al., 2020).
Установлено также, что внесение в почву 0.2% МП, состоящих из ПЭ, существенно повышает содержание в ней паразитов человека и животных, а также патогенов растений (Li et al., 2021).
Учитывая трудности анализа МП в почве, наибольшее распространение получили модельные опыты, заключающиеся в размещении в разных типах и горизонтах почвы стерильных образцов МП, инкубации их в зависимости от поставленных задач в течение более или менее длительного (от нескольких недель до нескольких месяцев) времени с последующей оценкой сформировавшихся на МП мультивидовых сообществ. В ряду подобных исследований заслуживает внимания недавняя работа, посвященная колонизации девяти химически различающихся видов МП: НППЭ, ПС, пенополистирол (ППС), ПП, поликарбонат, полиамид 6 (ПА-6), ПВХ, ПЭТФ, акрилонитрил-будадиен-стирол, инкубированных в течение 3 мес. в ризосфере национального мангрового природного заповедника Чжанцзяцзе (Zhangjiajie) КНР (Xie et al., 2020). Обнаружена высокая специфичность колонизации МП в зависимости от их химического состава. Так, например, наибольшая плотность биопленок обнаружена на МП из ПВХ. На МП из ППС преобладали кокковидные формы бактерий, а на МП из ПВХ – бациллярные. Настораживает обнаружение на некоторых типах МП патогенных бактерий, относящихся к родам Vibrio и Escherichia‒Shigella. Обнаружена положительная корреляция между способностью бактерий к хемотаксису и степенью колонизации ими МП.
Авторы отметили важный факт, заключающийся в обнаружении на МП из ПЭ, ПВХ и ПА‑6 биокоррозионных нарушений поверхности, что свидетельствует о процессе их биодеградации. Ранее другие авторы обнаружили, что некоторые грибы мангровых зарослей способны осуществлять деградацию ПЭ (Sangale et al., 2019), что позволяет считать эту экологическую нишу перспективной в отношении биодеструкции МП.
Возможность влияния МП на микробные сообщества окружающей среды будет рассмотрена в разделах “Биодеградация МП в природных средах”, “Содержание и токсичность МП в природных средах, пищевых продуктах и косметике”.
Динамику формирования мультивидовых микробных биопленок на МП и механизмы взаимодействия компонентов детально возможно изучать только в модельных системах, либо помещая стерильные МП в природную среду, либо воспроизводя в лаборатории условия изучаемой среды. Мы упоминали модельные опыты с МП разных типов, помещенных в ризосферу мангровых зарослей (Xie et al., 2020). Однако подавляющее большинство таких работ выполнено в гидросферных системах. Ежегодно публикуются результаты многих десятков таких исследований, поэтому мы остановимся лишь на нескольких недавних подобных работах. Серьезное внимание привлекают ранние стадии формирования мультивидовых биопленок на МП и зависимость динамики этого процесса и состава первичных колонизаторов от химического состава пластмассы. Показано, например, зависимость морфологического разнообразия состава сообществ, анализируемых методом СЭМ на трех видах МП, состоящих из ПА, ПВХ или ПЭТФ, при инкубации в пресной (прудовой) или искусственной (аквариумной) морской воде. Пробы отбирали через 0.5, 1, 2, 5, 7, 11 и 14 сут инкубации. На формирование биопленок существенное влияние оказывает также ζ-потенциал: наибольшей отрицательной величины (‒55 мВ) ζ-потенциал достигает в пресной воде в случае МП из ПА, что коррелирует с наибольшим биоразнообразием сообществ на этих МП. Однако разнообразие сообществ, формируемых в морской воде, оказалось наибольшим на МП из ПВХ, несмотря на низкий (‒15 мВ) ζ-потенциал. Таким образом, на начальных этапах колонизации МП могут играть важную роль не только химический состав МП, но и соответствующие условия в среде инкубации (Ramsperger et al., 2020), что согласуется с ранее опубликованными данными о влиянии на колонизацию МП ионной силы и рН инкубационной среды (Bhattacharjee, 2016). В другой работе изучена колонизация МП трех типов пластмасс: ПЭ, ПП и ПС в течение более длительной (10, 20 и 30 сут) инкубации в условиях модельного микрокосма. Для выявления временных изменений структурных и функциональных характеристик биопленок, ассоциированных с МП, использованы методы микроскопической спектроскопии и высокопроизводительного секвенирования генов. Полученные результаты подтвердили, что невозможно выделить какой-либо один фактор, определяющий процесс колонизации МП, поскольку на формирование биопленок влияют как время инкубации, так и тип полимера. Кроме того, в морской воде со временем структура сообщества может изменяться. Как и в ранее процитированной работе (Sangale et al., 2019), среди сообщества колонизаторов МП обнаружены микроорганизмы, способные к биодеградации МП (Tu et al., 2021).
Переходя к лабораторным моделям, следует отметить детальное исследование микрокосмоса, реконструированного из прибрежных отложений Северной Великобритании (Humber Estuary, UK) (Harrison et al., 2014). В качестве МП использовали листочки НППЭ размером 5 × 5 × 1 мм. Инкубацию продолжали 14 сут, процесс колонизации МП отслеживали методом СЭМ, а также методом CARD-FISH (Wendeberg, 2010) со специфическими олигонуклеотидными зондами и количественно оценивали с помощью ПЦР. Оказалось, что бактерии в прибрежных морских отложениях могут быстро колонизировать МП пластисферы, при этом происходит селекция бактериальных сообществ, состав которых отличается от сообществ окружающей среды. В составе сообществ на МП доминировали представители родов Arcobacter и Colwellia, составлявшие 84–93% от общего количества последовательностей. Известно, что эти бактерии участвуют в расщеплении углеводородов в морской воде. Таким образом, наличие бактерий-деструкторов углеводородов в сообществах пластисферы на МП из ПЭ является общим свойством как бентосных, так и пелагических морских местообитаний.
После обрастания микроорганизмами удельный вес МП возрастает, а их плавучесть снижается, поэтому они могут погружаться в морской среде на большую глубину. Глубоководным МП пока уделяется недостаточно внимания. В качестве положительного примера можно сослаться на недавно опубликованную работу, в которой авторы изучили влияние глубоководной среды на состав пластисферы на глубине 3300 м в юго-западной части Атлантического океана. В качестве объекта исследования послужили МП в виде гранул ПП, а также мегапластики (пакеты из ВППЭ). Контролем служил обычный гравий. Состав сообществ устанавливали путем анализа генов 16S рРНК с помощью платформы Illumina Miseq (Agostini et al., 2021). Подтверждена зависимость состава сформированных (в течение 719 сут) сообществ от природы пластика. Обнаружены также хорошо известные в пластисфере представители таксонов, обладающие способностью к биодеградации пластиков. В частности, преобладали представители семейств Bdellovibrionaceae, Halieaceae, Microtrichaceae и Pseudomonadaceae. По-видимому, их способность к колонизации и потенциальному использованию различных пластиков в качестве источников углерода обеспечивает им преимущества среди других членов микробиома пластисферы. Среди архей на МП из ПЭ преобладали представители Crenarchaeota и Nanoarchaeota (5.1 ± 4 и 7.3 ± 4.7% соответственно). На ПП они присутствовали в значительно меньшем количестве (0.7 ± ± 0.4%).
Недостаточное внимание уделяется грибному компоненту пластисферы. Такие исследования носят пока единичный характер. В одной из немногочисленных работ, проведенной путем сбора загрязняющих воду МП, а также 30-дневной инкубации стерильных образцов МП, изучено детальное распределение и состав грибной пластисферы в речной воде на разных ее участках (источники питьевой воды, сельскохозяйственное орошение, аквакультура и конечный сток). Полученные результаты показали, что состав грибных сообществ МП различается на всех этих участках, а также в окружающей воде, а пластисфера представляет собой новую экологическую нишу для грибов, которую можно использовать как индикатор при изучении биогеографии грибов и для оценки распространения их патогенных форм, например, родов Alternaria и Cladosporium (Xue et al., 2021).
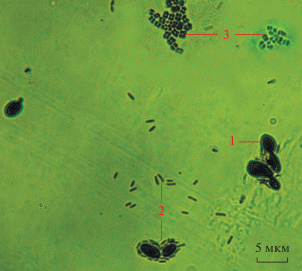
С целью методически удобного моделирования микробиологичеких процессов пластисферы в лабораторных условиях мы провели изучение динамики колонизации абиотических поверхностей МП. C этой целью была разработана методика, позволяющая исследовать жизнеспособность и начальные этапы формирования моно- и мультивидовых биопленок (в равновесии с планктонными культурами), а также рост и созревание биопленок в отсутствие планктонных культур (Плакунов и соавт., 2016). Метод основан на использовании не подвергаемых биокоррозии поверхностей: тефлоновых (политетрафторэтиленовых) кубиков с ребром 4 мм или фильтров из стекловолокна марки GF/F фирмы “Whatman” (Германия), состоящих из узких фибрилл. Окрашивание в случае тефлоновых кубиков производили кристаллическим фиолетовым для определения условной массы биопленок (микробные клетки плюс внеклеточный полимерный матрикс, ВПМ), красителем ДММС (1,9-dimethyl-methylene blue zinc chloride double salt), преимущественно окрашивающим кислые полисахариды ВПМ, а также метаболизируемым красителем МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-ди-фенилтетразолий бромидом), позволяющим выявлять в биопленках метаболически активные микроорганизмы. Для сравнения динамику колонизации макропластиков изучали на пластинках НППЭ марки 15803–020 (“СИБУР Холдинг”, Россия) с молекулярной массой ~10 000–500 000, степенью кристалличности 30% (Журина и соавт., 2020). Оказалось, что при формировании трехвидовых биопленок (Yarrowia lipolytica 367-3 + Pseudomonas aeruginosa РАО1 + Kocuria rhizophila 4А-2G или Y. lipolytica 367-3 + Chromobacterium violaceum ATCC 31532 (WT) + Micrococcus luteus HB 3.2.1) первичным колонизатором во всех случаях оказывается Y. lipolytica 367-3. Палочковидные бактерии коагрегируют с клетками аскомицетов, а кокковидные – формируют самостоятельные микроколонии (рис. 3).
Рис. 3.
Формирование мультивидовой биопленки через 3 ч инкубации со смесью планктонных культур: 1 – Y. lipolytica 367-3; 2 – P. aeruginosa РАО1; 3 – K. rhizophila 4A-2G; фазовый контраст (Журина и соавт., 2020).
Предложенный нами метод измерения роста микроорганизмов на МП позволил расшифровать возможные механизмы воздействия антибиопленочных агентов на формирование биопленок ряда грамположительных и грамотрицательных бактерий (Ганнесен и соавт., 2015; Мартьянов и соавт., 2015; Журина и соавт., 2017) и сформулировать основные принципы поиска анти- и пробиопленочных агентов (Плакунов и соавт., 2019).
Взаимодействие микробных компонентов мультивидовых биопленок пластисферы. В предыдущих обзорах (Плакунов и соавт., 2020; Котова и соавт., 2021) уже подробно обсуждены результаты исследования обрастания и биодеградации мегаобразцов ПЭТФ, помещенных в водные системы разного состава и при разных условиях. Недавно осуществлено детальное исследование роли отдельных компонентов сообществ пластисферы, колонизирующих ПЭТФ, c использованием мультиОМИК технологий (Wright et al., 2021). Авторы изолировали береговые микробные сообщества, населяющие отложения фрагментов МП, и культивировали их на питательных средах без добавления источника углерода (контроль); с добавлением листочков аморфного ПЭТФ; кристаллического порошка терефталата (ТФ); порошка ТФ, подвергнутого выветриванию, и, наконец, мономера ПЭТФ (бис-(2-оксиэтил) терефталата). Состав микробных сообществ анализировали путем секвенирования генов 16S РНК на 1, 3, 7, 14, 21, 30, 42 сут, включая анализ планктонных культур и сообществ, колонизирующих листы аморфного ПЭТФ. Состав всех микробных сообществ значительно отличался от состава инокулята: в них на ранних стадиях преобладали представители γ- и α-протеобактерий ‒ Alteromonadaceae и Thalassospiraceae соответственно, а на поздних ‒ γ-протеобактерии, представители Alcanivoraceae. В то же время наличие γ-протеобактерий Vibrionaceae не зависело от временного периода. В предсказанных геномах обнаружены кодируемые ферменты, участвующие в деградации ПЭТФ, а определение окисления полимеров методом FTIR-анализа подтвердило протекание процесса биодеградации МП. Для уточнения механизмов биодеградации МП использовали комбинированный протеогеномный и метаболомный подход с использованием двух новых морских изолятов Thioclava sp. BHET1 и Bacillus sp. BHET2. Идентификация промежуточных продуктов гидролиза ПЭТФ подтвердила, что оба изолята способны разрушать ПЭТФ. Однако, в то время как Thioclava sp. BHET1 использовала путь деградации, идентифицированный в аналогах микроорганизмов литосферы, необходимые для данного процесса ферменты отсутствовали у изолята Bacillus sp. BHET2. Таким образом, либо ферменты, используемые этой бактерией, имеют небольшую гомологию с теми, которые были охарактеризованы ранее, либо для данной бактерии характерен новый путь разложения ПЭТФ.
Остается почти не изученным вопрос о распределении функций отдельных компонентов микробного сообществ, колонизирующих МП. Первичные колонизаторы определяют начальные стадии формирования сообщества, однако в зрелых биопленках роль отдельных представителей сообщества практически не известна. Тем не менее, детальное изучение динамики формирования мультивидовых биопленок может пролить свет на их значение в биохимических процессах, происходящих в сообществе. Так, например, прослеживание в течение 72 ч включения в мультивидовую биопленку ранних и поздних колонизаторов в южных районах Индийского океана у побережья Индии показало, что состав сообществ на поверхности МП и в прибрежных водах существенно различается. В сообществах морской воды, также как и в природных биопленках, на МП в начальных стадиях преобладали протеобактерии, однако доля γ-протеобактерий в биопленках на МП достигала 85%. В сообществе биопленок доминировали представители Vibrionaceae, Alteromonadaceae и Pseudoalteromonadaceae, которые составляли 41, 25 и 8% соответственно. Преобладающими компонентами на ранних стадиях формирования биопленок (0‒9 ч) оказались представители γ-протеобактерий (Vibrionaceae), тогда как на поздних стадиях формирования биопленок (12‒36 ч) доминировали α-протеобактерии (Rajeev et al., 2019). Не исключено, что вторичные колонизаторы могут обладать ферментными системами, способными “подхватывать” продукты биодеградации МП, образуемые первичными колонизаторами.
Наименее изученной проблемой остается взаимоотношение в пластисферном сообществе прокариотических и эукариотических организмов. О наличии представителей последних в числе колонизаторов МП мы уже кратко упоминали.
Недавно сделана попытка выяснить более детально взаимодействие про- и эукариот в пластисфере некоторых районов Средиземного моря, включающих Адриатическое и Лигурийское моря (Amaral-Zettler et al., 2021). Используя молекулярно-биологические методы, а также СЭМ авторы попытались заполнить некоторые пробелы в понимании того, как бактерии и эукариоты взаимодействуют с пластиковым морским мусором, включающем МП, и как это взаимодействие может влиять на судьбу самого пластика и окружающие экосистемы.
Анализ причинно-следственных связей показал, что эукариоты (и их микробиомы) являются неотъемлемой частью пластисферы, которая может влиять на развитие смешанного сообщества и последующее его заселение многоклеточными животными. Осуществлена потенциальная оценка влияния водорослей и грибов-паразитов на многоклеточные организмы. Подробнее воздействие МП, колонизируемых смешанными сообществами, будет рассмотрена в разделе “Токсичность МП в природных средах, пищевых продуктах и косметике”.
Биодеградация МП в природных средах. Основные этапы и механизмы биодеградации синтетических пластмасс рассмотрены в недавних обзорах (Плакунов и соавт., 2020; Котова и соавт., 2021), поэтому в данном разделе мы остановимся, в основном, на процессах, специфичных для биодеградации МП. Как и в случае мегапластиков, скорость биодеградации МП зависит от их химической природы и состояния окружающей среды. Чрезвычайно важную роль играет также быстрая колонизация мультивидовыми сообществами МП, которая приводит к снижению их плавучести, в результате чего МП из поверхностных слоев воды переходят в более глубокие зоны, где они оказываются недостижимыми для воздействия, в частности, ультрафиолета, ускоряющего биодеградацию. Между свойствами МП и сообществами колонизирующих их микроорганизмов существуют двусторонние связи. С одной стороны, микроорганизмы предпочитают колонизировать МП определенного состава, с другой стороны, свойства поверхности МП изменяются в процессе колонизации и биодеградации МП. Так, например, воздействие бактериопланктона Балтийского моря в течение 14 сут на три вида МП в виде бусин, состоящих из ПЭ, ПП и ПС приводит к изменению ряда физико-химических характеристик (упругости, кристалличности, гидрофобности и топографии поверхности) МП. В процессе инкубации наблюдается изменение таксономического состава мультивидовых биопленок на поверхности МП. Между физико-химическими изменениями и изменениями состава сообществ наблюдается достоверная корреляция. Например, сообщество на ПС более разнородное, чем на ПЭ и ПП (McGivney et al., 2020). На основе анализа операционных таксономических единиц (operational taxonomic unit, OTU) установлено, что образцы МП, состоящие из ПП и ПС, значительно обогащены представителями α-протеобактерий, а также Sphingobacteriales, что, наряду с повреждениями поверхности этих МП, указывает на возможное участие данных бактерий в начальных этапах биодеградации МП. В целом, биодеградация МП в морской воде изучена гораздо детальнее, чем в пресной воде. В недавних обзорных статьях подробно охарактеризованы бактерии и грибы, для которых МП могут служить источниками углерода. Показано, что МП в виде конечных продуктов биодеградации (метана, СО2 и Н2О) могут вступать в круговорот веществ в открытых экосистемах (Sánchez, 2019; Yang et al., 2020).
В менее распространенных исследованиях, посвященных наличию и биодеградации МП в пресной воде, также обнаружены бактерии, способные использовать МП в качестве источников углерода, хотя в гораздо меньшем количестве, чем в морской воде (Harrison et al., 2018; Miao et al., 2021).
Мы уже отмечали трудности, связанные с обнаружением МП в почвенных образцах. Поэтому сведения о микроорганизмах, способных к биодеградации МП в почвах, также ограничены. По-видимому, ведущая роль в этих процессах принадлежит грибам и бациллам.
Детальный перечень микроорганизмов, способных к биодеградации МП в морской и пресной воде, а также в почве, приведен в цитируемом обзоре (Sun et al., 2022).
Еще менее исследованной областью является биодеградация МП в анаэробных условиях. В одной из немногочисленных работ исследовали колонизацию гранул МП, состоящих из ПЭ, ПП, ПЭТФ, ПС и полифенилхлорида, некоторые из которых загрязнены полихлорированными бифенилами. В качестве природных сообществ использовали анаэробные морские осадки, являющиеся главным накопителем МП в морях, включающие бактерии, способные использовать галогенорганические соединения как субстраты дыхания (Rosato et al., 2020). Инкубацию проводили в течение 14 сут, после чего измеряли количество и состав биопленок (методами окрашивания и молекулярно-генетическими методами), а также остаточное содержание полихлорированных биофенилов в МП. Сообщество, колонизирующее биопленки, существенно отличалось от сообщества в осадке и содержало повышенное количество хемоорганотрофных бактерий, способных к анаэробному метаболизму бродильного типа. Присутствие полихлорбифенильных соединений существенно не влияло на состав сообществ, колонизирующих МП, но приводило к повышенному содержанию бактерий класса Dehalococcoidia, способных к окислению водорода и восстановительному дегалогенированию гало-генорганических соединений в анаэробных условиях. Снижение содержания атомов хлора в составе МП через 14 сут инкубации свидетельствует о том, что воздействие биопленок может приводить к высвобождению в окружающую среду токсичных компонентов МП.
В целом, анализ опубликованных данных показывает, что МП подвергаются биодеструкции в большем масштабе, чем мегапластики. Это объясняется, по крайней мере, двумя причинами: значительно большей общей поверхностью, доступной для колонизации микроорганизмами, а также большей географической подвижностью МП по сравнению с крупными фрагментами пластмасс (Li et al., 2021a‒2021с).
Содержание и токсичность МП в природных средах, пищевых продуктах и косметике. Значительная доля публикаций посвящена проблеме токсичности МП и их вредному воздействию на экологические системы. Поскольку для данного обзора эта проблема не является основной, мы лишь кратко остановимся на наиболее значимых исследованиях, касающихся данных вопросов. Естественно, что наибольшее внимание привлекает вопрос возможных вредных последствий, оказываемых МП на организмы животных и человека. МП обнаруживаются в широко используемых человеком продуктах и бытовых материалах. Особое внимание привлекают данные, свидетельствующие о присутствии МП в пакетиках для заваривания чая. Так, заваривание одного чайного пакетика при температуре 95°C приводит к выделению 11.6 млрд частиц микропластика и 3.1 млрд частиц нанопластика. Частицы микропластиков включают нейлон и ПЭТФ, что установлено с помощью ИК-спектроскопии (FTIR). С одной кружкой такого чая в организм может попадать до 16 мкг частиц микропластика, что на несколько порядков превышает содержание их в других пищевых продуктах (Hernandez et al., 2019). Анализ содержания МП в пищевых продуктах подробно рассмотрен в обзоре (Kwon et al., 2020).
Немало проблем создает присутствие МП в косметической продукции. Так, среди проанализированных бытовых косметических средств 55% включали в качестве МП полиэтилен, в случае профессиональных продуктов содержание МП составляло 100% (Piotrowska et al., 2020). Анализ скрабов для лица, очищающих средств, гелей для душа и зубных паст показал высокое содержание первичных МП варьирующих размеров (в пределах от 3 до 2000 мкм). Значительная часть их попадает в сточные воды. Например, при производстве косметических средств в Китае в окружающее водную среду попадает ежегодно в среднем 209.7 трлн частиц МП (Praveena, Aris, 2020). Опасные свойства этих МП во многом объясняются их высокой адсорбционной способностью, позволяющей связывать и распространять в окружающей среде токсичные примеси, поскольку МП могут утилизироваться организмами на разных трофических уровнях – от зоопланктона до крупных морских животных.
Поскольку поверхность большинства МП имеет гидрофобный характер, основное внимание исследователей привлекали векторные свойства МП в отношении гидрофобных веществ, например, стероидных гормонов (Liu et al., 2019). Однако в последнее время убедительно доказана возможность адсорбции и распространения с помощью МП гидрофильных физиологически активных соединений, в частности, антимикробных агентов, фармацевтических препаратов и средств личной гигиены. Формирование на поверхности МП мультивидовых микробных биопленок резко меняет адсорбционные свойства этой поверхности, и, как мы уже отмечали ранее, при этом изменяется как топография распределения МП в водной среде, так и способность к адсорбции и транспортировки адсорбированных соединений: в частности, возрастает сродство к ионам ряда металлов и антибиотикам. Во многих случаях это может приводить к повышению токсичности МП (Atugoda et al., 2021). О возможности использования МП патогенными микроорганизмами для распространения в природе мы уже частично упоминали ранее. Аналогичные возможности обнаружены и у вирусов (Moresco et al., 2021).
Векторная роль МП играет очень важное значение в их взаимодействии с внешней средой, в том числе в проявлении токсических свойств. Во-первых, МП и НП ускоряют распространение колонизирующих их микроорганизмов, т.е. способствует внедрению новых обитателей в природные сообщества. Этот процесс, в свою очередь, может изменять потоки энергии и строительных материалов для роста, изменяя, таким образом, круговорот веществ в системе и выполняя роль одного из факторов микроэволюции в экотопах. Второе важное обстоятельство связано с ускорением горизонтального переноса генов между членами мультивидовых микробных сообществ, колонизирующих МП, что, в частности, способствует распространению генов устойчивости к биоцидам (антибиотикам) (Shen et al., 2019). Cовременные подходы (включая методы геномики, протеомики и метаболомики) к изучению механизмов распространения детерминант устойчивости к антибиотикам с участием микроорганизмов пластисферы охарактеризованы в недавнем обзоре (Bartkova et al., 2021).
Завершая данный раздел обзора, отметим, что краткое перечисление проблем, связанных с токсичностью МП и их влиянием на экосистемы, безусловно, не исчерпывает материалы сотен исследований, проведенных в рассматриваемой области. Подробнее с данной проблемой можно познакомиться в ряде обзорных статей и монографий (Toussaint et al., 2019; Campanale et al., 2020; Du et al., 2020; He, Luo, 2020; Prüst et al., 2020; Sana et al., 2020; Fernández-Juárez et al., 2021; Bank, 2022).
В заключение следует отметить, что, учитывая существенную роль МП и НП в экобиомах, их собственную токсичность и возможность служить векторами переноса как вредных примесей, так и факторов патогенности и устойчивости микроорганизмов к биоцидам, а также иногда прямое отрицательное воздействие на структуру природных сообществ, необходима разработка эффективных методов борьбы с МП. Эта борьба должна осуществляться по двум направлениям: путем снижения объемов поступления МП в природные среды, а также путем деструкции МП уже проникших в природные субстраты. В последнем случае очень важную роль играет биокоррозия МП с помощью микроорганизмов-деструкторов, причем мультивидовые сообщества (биопленки) в этих процессах играют решающую роль (Zhou et al., 2021). В последнее время достигнуты значительные успехи в конструировании генно-инженерными методами микроорганизмов с повышенной способностью к биодеструкции синтетических пластмасс, в том числе МП и НП (Gu et al., 2021). Значительно продвинуты достижения в разработках методических подходов применения комплекса микробных ферментов (Priya et al., 2021). Предложены конструкции новых эффективных мембранных реакторов для очистки сточных вод (Dey et al., 2021).
Все эти достижения позволяют надеяться на заметное продвижение в направлении борьбы с МП и НП, загрязняющими природные среды.
Список литературы
Борисова О.В., Галстян А.Г., Оленин А.Ю., Лисичкин Г.В., Зверев В.В. Дифференциальная диагностика бактерий по спектрам гигантского комбинационного рассеяния // Микробиология. 2020. Т. 89. С. 200–205. https://doi.org/10.31857/S0026365620010048
Borisova O.V., Galstyan A.G., Olenin A.Yu., Lisichkin G.V., Zverev V.V. Differential diagnostics of bacteria using the surface-enhanced Raman spectra // Microbiology (Moscow). 2020. V. 89. P. 192–196. https://doi.org/10.1134/S002626172001004X
Ганнесен А.В., Журина М.В., Веселова М.А., Хмель И.А., Плакунов В.К. Регуляция процесса формирования биопленок Pseudomonas chlororaphis в системе in vitro // Микробиология. 2015. Т. 84. С. 281–290. https://doi.org/10.7868/S0026365615030040
Gannesen A.V., Zhurina M.V., Veselova M.A., Khmel’ I.A., Plakunov V.K. Regulation of biofilm formation by Pseudomonas chlororaphis in an in vitro system // Microbiology (Moscow). 2015. V. 84. P. 319–327. https://doi.org/10.1134/S0026261715030042
Журина М.В., Ганнесен А.В., Мартьянов С.В., Тетенева Н.А., Штратникова В.Ю., Плакунов В.К. Никлозамид как перспективный антибиопленочный агент // Микробиология. 2017. Т. 86. С. 439–447. https://doi.org/10.7868/S0026365617040152
Zhurina M.V., Gannesen A.V., Mart’yanov S.V., Teteneva N.A., Shtratnikov V.Yu., Plakunov V.K. Niclosamide as a promising antibiofilm agent // Microbiology (Moscow). 2017. V. 86. P. 455–462. https://doi.org/10.1134/S0026261717040154
Журина М.В., Каллистова А.Ю., Панюшкина А.Е., Ганнесен А.В., Мартьянов С.В., Герасин В.А., Сивов Н.А., Тихомиров В.А., Плакунов В.К. Специфика формирования мультивидовых микробных биопленок на поверхности полиэтилена // Микробиология. 2020. Т. 89. С. 400–409. https://doi.org/10.31857/S0026365620040187
Zhurina M.V., Kallistova A.Yu., Panyushkina A.E., Gannesen A.V., Mart’yanov S.V., Gerasin V.A., Sivov N.A., Tikhomirov V.A., Plakunov V.K. Specific features of formation of multispecies microbial biofilms on polyethylene surface // Microbiology (Moscow). 2020. V. 89. P. 396–404. https://doi.org/10.1134/S0026261720040165
Ильина О.В. Пластиковое загрязнение прибрежных поверхностных вод среднего и южного Байкала / О.В. Ильина, М.Ю. Колобов, В.В. Ильинский // Водные ресурсы. 2021. Т. 48. № 1. С. 42-51.
Котова И.Б., Тактарова Ю.В., Цавкелова Е.А., Егорова М.А., Бубнов И.А., Малахова Д.В., Ширинкина Л.И., Соколова Т.Г., Бонч-Осмоловская Е.А. Микробная деградация пластика и пути ее интенсификации // Микробиология. 2021. Т. 90. С. 627–659.
Kotova I.B., Taktarova Yu.V., Tsavkelova E.A., Egorova M.A., Bubnov I.A., Malakhova D.V., Shirinkina L.I., Sokolova T.G., Bonch-Osmolovskaya E.A. Microbial degradation of plastics and approaches to its intensification // Microbiology (Moscow). V. 90. № 6. P. 671–701. doi: 10.1134/ S0026261721060084.
Мартьянов С.В., Журина М.В., Эль-Регистан Г.И., Плакунов В.К. Активирующее действие азитромицина на формирование бактериальных биопленок и борьба с этим явлением // Микробиология. 2015. Т. 84. С. 27–36. https://doi.org/10.7868/S0026365614060123
Mart’yanov S.V., Zhurina M.V., El’Registan G.I., Plakunov V.K. Activation and prevention of formation of bacterial biofilms by azithromycin // Microbiology (Moscow). 2014. V. 84. P. 723–731. https://doi.org/10.1134/S0026261714060113
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. С. 484–480. https://doi.org/10.7868/S0026365616040157
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513. https://doi.org/10.1134/S0026261716040147
Плакунов В.К., Журина М.В., Ганнесен А.В., Мартьянов С.В., Николаев Ю.А. Антибиопленочные агенты: неоднозначность терминологии и стратегия поиска // Микробиология. 2019. Т. 88. С. 705–709. https://doi.org/10.1134/S0026365619060144
Plakunov V.K., Zhurina M.V., Gannesen A.V., Mart’yanov S.V., Nikolaev Yu.A. Antibiofilm agents: Therminological ambiguity and strategy for search // Microbiology (Moscow). 2019. V. 88. P. 747–750. https://doi.org/10.1134/S0026261719060146
Плакунов В.К., Ганнесен А.В., Мартьянов С.В., Журина М.В. Биокоррозия синтетических пластмасс: механизмы деградации и способы защиты // Микробиология. 2020. Т. 89. С. 631–645. https://doi.org/10.31857/S0026365620060142
Plakunov V.K., Gannesen A.V., Mart’yanov S.V., Zhurina M.V. Biocorrosion of synthetic plastics: degradation mechanisms and methods of protection // Microbiology (Moscow). 2020. V. 89. P. 647–659. https://doi.org/10.1134/S0026261720060144
Agostini L., Moreira J.C.F., Bendia A.G., Kmit M.C.P., Waters L.G., Santana M.F.M, Sumida P.Y.G., Turra A., Pellizari V.H. Deep-sea plastisphere: long-term colonization by plastic-associated bacterial and archaeal communities in the Southwest Atlantic Ocean // Sci. Total. Environ. 2021. V. 793. Art. 148335. https://doi.org/10.1016/j.scitotenv.2021.148335
Akdogan Z., Guven B. Microplastics in the environment: a critical review of current understanding and identification of future research needs // Environ. Pollut. 2019. V. 254. Art. 113011. https://doi.org/10.1016/j.envpol.2019.11301
Amaral-Zettler L.A., Zettler E.R., Mincer T.J. Ecology of the plastisphere // Nat. Rev. Microbiol. 2020. V. 18. P. 139–151. https://doi.org/10.1038/s41579-019-0308-0
Amaral-Zettler L.A., Ballerini T., Zettler E.R., Asbun A.A., Adame A., Casotti R., Dumontet B., Donnarumma V., Engelmann J.C., Frère L., Mansui J., Philippon M., Pietrelli L., Sighicelli M. Diversity and predicted inter- and intra-domain interactions in the Mediterranean Plastisphere // Environ. Pollut. 2021. V. 286. Art. 117439. https://doi.org/10.1016/j.envpol.2021.117439
Arias-Andres M. Who is where in the Plastisphere, and why does it matter? // Mol. Ecol. Resour. 2020. V. 20. P. 617–619. https://doi.org/10.1111/1755-0998.13161
Atugoda T., Vithanage M., Wijesekara H., Bolan N., Sarmah A.K., Bank M.S., You S., Ok Y.S. Interactions between microplastics, pharmaceuticals and personal care products: implications for vector transport // Environ. Int. 2021. V. 149. Art. 106367. https://doi.org/10.1016/j.envint.2020.106367
Microplastics in the Environment: Pattern and Process / Ed. Bank M.S. Springer. University of Massachusetts, 2022. 354 p. http://www.springer.com/series/15836
Barlow D.E., Biffinger J.C., Cockrell-Zugell A.L., Lo M., Kjoller K., Cook D., Lee W.K., Pehrsson P.E., Crookes-Goodson W.J., Hung C.S., Nadeau L.J., Russell J.N. The importance of correcting for variable probe-sample interactions in AFM-IR spectroscopy: AFM-IR of dried bacteria on a polyurethane film // Analyst. 2016. V. 141. P. 4848–4854. https://doi.org/0.1039/c6an00940a
Bartkova S., Kahru A., Heinlaan M., Scheler O. Techniques used for analyzing microplastics, antimicrobial resistance and microbial community composition: a mini-review // Front. Microbiol. 2021. V. 12. Art. 603967. https://doi.org/10.3389/fmicb.2021.603967
Bhattacharjee S. DLS and zeta potential ‒ what they are and what they are not? // J. Control. Release. 2016. V. 235. P. 337–351. https://doi.org/10.1016/j.jconrel.2016.06.017
Bhushan B., Marti O. Scanning probe microscopy ‒ principle of operation, instrumentation and probes // Nanotribology and Nanomechanics / Ed. Bhushan B. Heidelberg, Germany: Springer-Verlag, 2017. P. 1‒83. https://doi.org/10.1007/978-3-319-49347-3_23
Billard J., Boucher G. The challenges of measuring plastic pollution. Field Actions Science Reports [Online], Special Issue 19 | 2019, Online since 01 March 2019, connection on 15 October 2019. URL: http://journals.openedition.org/factsreports/5319
Boots B., Russell C.W., Green D.S. Effects of microplastics in soil ecosystems: above and below ground // Environ. Sci. Technol. 2019. V. 53. P. 11496–11506. https://doi.org/10.1021/acs.est.9b03304
Brahney J., Hallerud M., Heim E., Hahnenberger M., Sukumaran S. Constraining the atmospheric limb of the plastic cycle // Proc. Natl. Acad. Sci. USA. 2021. V. 118. Art. e2020719118. https://doi.org/10.1073/pnas.2020719118
Brander S.M., Renick V.C., Foley M.M., Steele C., Woo M., Lusher A., Carr S., Helm P., Box C., Cherniak S., Andrews R.C., Rochman C.M. Sampling and quality assurance and quality control: a guide for scientists investigating the occurrence of microplastics across matrices // Appl. Spectrosc. 2020. V. 74. P. 1099–1125. https://doi.org/10.1177/0003702820945713
Bridier A., Briandet R. Contribution of confocal laser scanning microscopy in deciphering biofilm tridimensional structure and reactivity // Methods Mol. Biol. 2014. V. 1147. P. 255–266. https://doi.org/10.1007/978-1-4939-0467-9_18
Bridier A., Meylheuc T., Briandet R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM) // Micron. 2013. V. 48. P. 65–69. https://doi.org/10.1016/j.micron.2013.02.013
Cai L., Wang J., Peng J., Tan Z., Zhan Z., Tan X., Chen Q. Characteristic of microplastics in the atmospheric fallout from Dongguan city, China: preliminary research and first evidence // Environ. Sci. Pollut. Res. Int. 2017. V. 24. P. 24928–24935. https://doi.org/10.1007/s11356-017-0116-x
Cera A., Cesarini G., Scalici M. Microplastics in freshwater: What is the news from the world? // Diversity. 2020. V. 12. Art. 276. https://doi.org/10.3390/d12070276
Chao Y., Zhang T. Surface-enhanced Raman scattering (SERS) revealing chemical variation during biofilm formation: from initial attachment to mature biofilm // Anal. Bioanal. Chem. 2012. V. 404. P. 1465–1475. https://doi.org/10.1007/s00216-012-6225-y
Campanale C., Massarelli C., Savino I., Locaputo V., Uricchio V.F. A detailed review study on potential effects of microplastics and additives of concern on human health // Int. J. Environ. Res. Public Health. 2020. V. 17. Art. 1212. https://doi.org/10.3390/ijerph17041212
Conesa J.A., Iñiguez M.E. Analysis of microplastics in food samples // Handbook of Microplastics in the Environment / Eds. Rocha-Santos T., Costa M., Mouneyrac C. Springer Nature Switzerland AG, 2020. P. 2–16. https://doi.org/10.1007/978-3-030-10618-8_5-1
Crawford C.B., Quinn B. Microplastic collection techniques // Microplastic Pollutants / Eds. Crawford C.B., Quinn B. Elsevier, 2017. P. 179–202. https://doi.org/10.1016/B978-0-12-809406-8.00008-6
Cui L., Zhang D.D., Yang K., Zhang X., Zhu Y.-G. Perspective on surface-enhanced Raman spectroscopic investigation of microbial world // Anal. Chem. 2019. V. 91. P. 15345–15354. https://doi.org/10.1021/acs.analchem.9b03996
da Costa J.P., Duarte A.C. Introduction to the analytical methodologies for the analysis of microplastics // Handbook of Microplastics in the Environment / Eds. Rocha-Santos T., Costa M., Mouneyrac C. Springer Nature Switzerland AG, 2020. P. 2–31. https://doi.org/10.1007/978-3-030-10618-8_1-1
Dash S., Lahiri D., Nag M., Das D., Rani Ray R. Probing the surface-attached in vitro microbial biofilms with atomic force (AFM) and scanning probe microscopy (SPM) // Analytic al Methodologies for Biofilm Research / Eds. Nag M., Lahiri D. Springer Protocols Handbooks, 2021. P. 223–242. https://doi.org/10.1007/978-1-0716-1378-8_10
Dey T.K., Uddin M.E., Jamal M. Detection and removal of microplastics in wastewater: evolution and impact // Environ. Sci. Pollut. Res. 2021. V. 28. P. 16925–16947. https://doi.org/10.1007/s11356-021-12943-5
Du J., Xu S., Zhou Q., Li H., Fu L., Tang J., Wang Y., Peng X., Xu Y., Du X. A review of microplastics in the aquatic environmental: distribution, transport, ecotoxicology, and toxicological mechanisms // Environ. Sci. Pollut. Res. Int. 2020. V. 27. P. 11494–11505. https://doi.org/10.1007/s11356-020-08104-9
Dutta B., Nag M., Lahiri D., Rani Ray R. Analysis of biofilm matrix by multiplex fluorescence in situ hybridization (m-FISH) and confocal laser scanning microscopy (CLSM) during nosocomial infections // Analytical Methodologies for Biofilm Research / Eds. Nag M., Lahiri D. Springer Protocols Handbooks, 2021. P. 183–204. https://doi.org/10.1007/978-1-0716-1378-8_8
Fei Y., Huang S., Zhang H., Tong Y., Wen D., Xia X., Wang H., Luo Y., Barceló D. Response of soil enzyme activities and bacterial communities to the accumulation of microplastics in an acid cropped soil // Sci. Total Environ. 2020. V. 707. Art. 135634. https://doi.org/10.1016/j.scitotenv.2019.135634
Fernández-Juárez V., Jaén-Luchoro D., Brito-Echeverría J., Agawin N.S.R., Bennasar-Figueras A., Echeveste P. “The good, the bad and the double-sword” effects of microplastics and their organic additives in marine bacteria // Microb. Ecol. 2021. https://doi.org/10.1007/s00248-021-01766-z
Flemming H.-C., Wuertz S. Bacteria and archaea on earth and their abundance in biofilms // Nat. Rev. Microbiol. 2019. V. 17. P. 247–260. https://doi.org/10.1038/s41579-019-0158-9
Ganesh K.A., Anjana K., Hinduja M., Sujitha K., Dharani G. Review on plastic wastes in marine environment ‒ Biodegradation and biotechnological solutions // Mar. Pollut. Bull. 2019. V. 150. Art. 110733. https://doi.org/10.1016/j.marpolbul.2019.110733
Gu J.D. Biodegradability of plastics: the issues, recent advances, and future perspectives // Environ. Sci. Pollut. Res. 2021. V. 28. P. 1278–1282. https://doi.org/10.1007/s11356-020-11501-9
Hale R.C., Seeley M.E., La Guardia M.J., Mai L., Zeng E.Y. A global perspective on microplastics // J. Geophys. Res. Oceans. 2020. V. 125. Art. e2018JC014719.
Hammer J., Kraak M.H., Parsons J.R. Plastics in the marine environment: the dark side of a modern gift // Rev. Environ. Contam. Toxicol. 2012. V. 220. P. 1–44. https://doi.org/10.1007/978-1-4614-3414-6_1
Harrison J.P., Schratzberger M., Sapp M., Osborn M.A. Rapid bacterial colonization of low-density polyethylene microplastics in coastal sediment microcosms // BMC Microbiol. 2014. V. 14. Art. 232. https://doi.org/10.1186/s12866-014-0232-4
Harrison J.P., Hoellein T.J., Sapp M., Tagg A.S., Ju-Nam Y., Ojeda J.J. Microplastic-associated biofilms: a comparison of freshwater and marine environments // Freshwater Microplastics. The Handbook of Environmental Chemistry / Eds. Wagner M., Lambert S. Springer, Cham., 2018. V. 58. P. 181‒201. https://doi.org/10.1007/978-3-319-61615-5_9
He D., Luo Y. (eds). Microplastics in Terrestrial Environments. Springer Nature Switzerland AG, 2020. 469 p. https://doi.org/10.1007/978-3-030-56271-7
Herrling M.P., Lackner S., Nirschl H., Horn H., Guthausen G. Recent NMR/MRI studies of biofilm structures and dynamics // Annual Report. NMR Spectroscopy. 2019. https://doi.org/10.1016/bs.arnmr.2019.02.001
Hernandez L.M., Xu E.G., Larsson H.C.E., Tahara R., Maisuria V.B., Tufenkji N. Plastic teabags release billions of microparticles and nanoparticles into tea // Environ. Sci. Technol. 2019. V. 53. P. 12300–12310. https://doi.org/10.1021/acs.est.9b02540
Hu J.S., Chen H.T., Zhang J. Advances in the common identification methods of bacterial biofilm // Chin. Vet. Sci. 2010. V. 40. P. 1194–1199.
Huang Y., Chakraborty S., Liang H. Methods to probe the formation of biofilms: applications in foods and related surfaces // Anal. Methods. 2020. V. 12. P. 416–432. https://doi.org/0.1039/c9ay02214g
Jiang P., Zhao S., Zhu L., Li D. Microplastic-associated bacterial assemblages in the intertidal zone of the Yangtze Estuary // Sci. Total Environ. 2018. V. 624. P. 48–54. https://doi.org/10.1016/j.scitotenv.2017.12.105
Kalam S., Basu A., Ahmad I., Sayyed R.Z., El-Enshasy H.A., Dailin D.J., Suriani N.L. Recent understanding of soil acidobacteria and their ecological significance: A critical review // Front. Microbiol. 2020. V. 11. Art. 580024. https://doi.org/10.3389/fmicb.2020.580024
Klein M., Fischer E.K. Microplastic abundance in atmospheric deposition within the Metropolitan area of Hamburg, Germany // Sci. Total Environ. 2019. V. 685. P. 96 –103. https://doi.org/10.1016/j.scitotenv.2019.05.405
Koelmans A.A., Nor N.H.M., Hermsen E., Kooi M., Mintenig S.M., DeFrance J. Microplastics in freshwaters and drinking water: Critical review and assessment of data quality // Water Res. 2019. V. 155. P. 410–422. https://doi.org/10.1016/j.watres.2019.02.054
Kwon J.H., Kim J.W., Pham T.D., Tarafdar A., Hong S., Chun S.H., Lee S.H., Kang D.Y., Kim J.Y., Kim S.B., Jung J. Microplastics in food: A review on analytical methods and challenges // Int. J. Environ. Res. Public Health. 2020. V. 17. Art. 6710. https://doi.org/10.3390/ijerph17186710
Lassen C., Hansen S.F., Magnusson K., Norén F., Hartmann N.I.B., Jensen P.R., Nielsen T.G., Brinch A. Microplastics: occurrence, effects and sources of releases to the environment in Denmark / The Danish Environmental Protection Agency. 2015. 208 p. http://mst.dk/service/publikationer/publikationsarkiv/2015/nov/rapport-ommikroplast
Li C., Gan Y., Zhang C., He H., Fang J., Wang L., Wang Y., Liu J. “Microplastic communities” in different environments: Differences, links, and role of diversity index in source analysis // Water Res. 2021a. V. 188. Art. 116574. https://doi.org/10.1016/j.watres.2020.116574
Li C., Wang L., Ji S., Chang M., Wang L., Gan Y., Liu J. The ecology of the plastisphere: Microbial composition, function, assembly, and network in the freshwater and seawater ecosystems // Water Res. 2021b. V. 202. Art. 117428. https://doi.org/10.1016/j.watres.2021.117428
Li Q., Wu J., Zhao X., Gu X., Ji R. Separation and identification of microplastics from soil and sewage sludge // Environ. Pollut. 2019. V. 254. Art. 113076. https://doi.org/10.1016/j.envpol.2019.113076
Li H.Z., Zhu D., Lindhardt J.H., Lin S.M., Ke X., Cui L. Long-term fertilization history alters effects of microplastics on soil properties, microbial communities, and functions in diverse farmland ecosystem // Environ. Sci. Technol. 2021a. V. 55. P. 4658–4668. https://doi.org/10.1021/acs.est.0c04849
Li W., Luo Y., Pan X. Microplastics in agricultural soils // Microplastics in Terrestrial Environments / Eds. He D., Luo Y. Springer Nature Switzerland AG, 2020. P. 63–76. https://doi.org/10.1007/978-3-030-56271-7
Liu X., Xu J., Zhao Y., Shi H., Huang C.H. Hydrophobic sorption behaviors of 17β-estradiol on environmental microplastics // Hemosphere. 2019. V. 226. P. 726–735. https://doi.org/10.1016/j.chemosphere.2019.03
Liu M., Lu S., Chen Y., Cao C., Bigalke M., He D. Analytical methods for microplastics in environments: current advances and challenges // The Handbook of Environmental Chemistry / Eds. He D., Luo Y. Springer Nature Switzerland AG, 2020. P. 3–24. https://doi.org/10.1007/698_2019_436
Lo Giudice A., Caruso G., Rizzo C. Papale M., Azzaro M. Bacterial communities versus anthropogenic disturbances in the Antarctic coastal marine environment // Environ. Sustain. 2019. V. 2. P. 297–310. https://doi.org/10.1007/s42398-019-00064-2
McCormick A.R., Hoellein T.J., London M.G., Hitte J., Scott J.W., Kelly J.J. Microplastic in surface waters of urban rivers: concentration, sources, and associated bacterial assemblages // Ecosphere. 2016. V. 7. Art. e01556. https://doi.org/10.1002/ecs2.1556
McGivney E., Cederholm L., Barth A., Hakkarainen M., Hamacher-Barth E., Ogonowski M., Gorokhova E. Rapid physicochemical changes in microplastic induced by biofilm formation // Front. Bioeng. Biotechnol. 2020. V. 8. Art. 205. https://doi.org/10.3389/fbioe.2020.00205
Miao L., Wang P., Hou J., Yao Y., Liu Z., Liu S., Li T. Distinct community structure and microbial functions of biofilms colonizing microplastics // Sci. Total Environ. 2019. V. 650. P. 2395–2402. https://doi.org/10.1016/j.scitotenv.2018.09.378
Miao L., Yu Y., Adyel T.M., Wang C., Liu Z., Liu S., Huang L., You G., Meng M., Qu H., Hou J. Distinct microbial metabolic activities of biofilms colonizing microplastics in three freshwater ecosystems // J. Hazard. Mater. 2021. V. 403. Art. 123577. https://doi.org/10.1016/j.jhazmat.2020.123577
Moresco V., Oliver D.M., Weidmann M., Matallana-Surget S., Quilliam R.S. Survival of human enteric and respiratory viruses on plastics in soil, freshwater, and marine environments // Environ. Res. 2021. V. 199. Art. 111367. https://doi.org/10.1016/j.envres.2021.111367
Mughini-Gras L., van der Plaats R.Q.J., van der Wielen P.W.J.J., Bauerlein P.S., de Roda Husman A.M. Riverine microplastic and microbial community compositions: a field study in the Netherlands // Water Res. 2021. V. 192. Art. 116852. https://doi.org/10.1016/j.watres.2021.116852
Analytical Methodologies for Biofilm Research / Eds. Nag M., Lahiri D. Springer Protocols Handbooks, 2021. https://doi.org/10.1007/978-1-0716-1378-8
Napper I.E., Davies B.F.R., Clifford H., Elvin S., Koldewey H.J., Mayewski P.A., Miner K.R., Potocki M., Elmore A.C., Gajurel A.P., Thompson R.C. Reaching new heights in plastic pollution ‒ preliminary findings of microplastics on mount Everest // One Earth. 2020. V. 3. P. 621–630. https://doi.org/10.1016/j.oneear.2020.10.020
National Ocean Service. What are microplastics? 2018. https://oceanservice.noaa.gov/facts/microplastics.html
Newbury D.E., Ritchie N.W.M. Is scanning electron microscopy/energy dispersive X-ray spectrometry (SEM/EDS) quantitative? // Scanning. 2013. V. 35. P. 141–168. https://doi.org/10.1002/sca.21041
Ogonowski M., Motiei A., Ininbergs K., Hell E., Gerdes Z., Udekwu K.I., Gorokhova E. Evidence for selective bacterial community structuring on microplastics // Environ. Microbiol. 2018. V. 20. P. 2796–2808. https://doi.org/10.1111/1462-2920.14120
Palmas S., Vacca A., Mais L. Bibliometric analysis on the papers dedicated to microplastics in wastewater treatments // Catalysts. 2021. V. 11. Art. 913. https://doi.org/10.3390/catal11080913
Petersen F., Hubbar J.A. The occurrence and transport of microplastics: The state of the science // Sci. Total Environ. 2021. V. 758. Art. 143936. https://doi.org/10.1016/j.scitotenv.2020.143936
Pinto M., Langer T.M., Huffer T., Hofmann T., Herndl G.J. The composition of bacterial communities associated with plastic biofilms differs between different polymers and stages of biofilm succession // PLoS One. 2019. V. 14. Art. e0217165. https://doi.org/10.1371/journal.pone.0217165
Piotrowska A., Czerwińska-Ledwig O., Serdiuk M., Serdiuk K., Pilch W. Composition of scrub-type cosmetics from the perspective of product ecology and microplastic content // Toxicol. Environ. Health Sci. 2020. V. 12. P. 75–81. https://doi.org/10.1007/s13530-020-00051-9
Plastics – the Facts. An analysis of European plastics production, demand and waste data. Plastic Europe, Association of Plastics Monufactures. 2020. https://www.plasticseurope.org/en/resources/publications/4312-plastics-facts-2020
Prata J.C., Castro J.L., da Costa J.P., Cerqueira M., Duarte A.C., Rocha-Santos T. Airborne microplastics. Concerns over public health and environmental impacts // Handbook of Microplastics in the Environment / Eds. Rocha-Santos T., Costa M., Mouneyrac C. Springer Nature Switzerland AG, 2020. P. 1–25. https://doi.org/10.1007/978-3-030-10618-8_37-1
Praveena S.M., Aris A.Z. Sorptive properties of microplastics extracted from cosmetics // Handbook of Microplastics in the Environment / Eds. Rocha-Santos T., Costa M., Mouneyrac C. Springer Nature Switzerland AG, 2020. P. 2–12. https://doi.org/10.1007/978-3-030-10618-8_15-1
Priya A., Dutta K., Daverey A. A comprehensive biotechnological and molecular insight into plastic degradation by microbial community // J. Chem. Technol. Biotechnol. 2021. https://doi.org/10.1002/jctb.6675
Prüst M., Meijer J., Westerink R.H.S. The plastic brain: neurotoxicity of micro- and nanoplastics // Part Fibre Toxicol. 2020. V. 17. Art. 24. https://doi.org/10.1186/s12989-020-00358-y
Rajeev M., Sushmitha T.J., Toleti S.R., Pandian S.K. Culture dependent and independent analysis and appraisal of early stage biofilm-forming bacterial community composition in the Southern coastal seawater of India // Sci. Total Environ. 2019. V. 666. P. 308–320. https://doi.org/10.1016/j.scitotenv.2019.02.171
Ramsperger A.F.R.M., Stellwag A.C., Caspari A., Fery A., Lueders T., Kress H., Löder M.G.J., Laforsch C. Structural diversity in early-stage biofilm formation on microplastics depends on environmental medium and polymer properties // Water. 2020. V. 12. Art. 3216. https://doi.org/10.3390/w12113216
Rocha-Santos T., Costa M., Mouneyrac C. (eds.). Handbook of Microplastics in the Environment. Springer Nature Switzerland AG, 2021. https://doi.org/10.1007/978-3-030-10618-8_40-1
Rochman C.M., Brookson C., Bikker J., Djuric N. et al. Rethinking microplastics as a diverse contaminant suite // Environ. Toxicol. Chem. 2019. V. 38. P. 703–711. https://doi.org/10.1002/etc.4371
Rosato A., Barone M., Negroni A., Brigidi P., Fava F., Xu P., Candela M., Zanaroli G. Microbial colonization of different microplastic types and biotransformation of sorbed PCBs by a marine anaerobic bacterial community // Sci. Total Environ. 2020. V. 705. Art. 135790. https://doi.org/10.1016/j.scitotenv.2019.135790
Ruimin Qi., Davey L.J., Zhen Li., Qin L., Changrong Y. Behavior of microplastics and plastic film residues in the soil environment: a critical review // Sci. Total Environ. 2020. V. 703. Art. 134722. https://doi.org/10.1016/j.scitotenv.2019.134722
Sana S.S., Dogiparthi LK., Gangadhar L., Chakravorty A., Abhishek N. Effects of microplastics and nanoplastics on marine environment and human health // Environ. Sci. Pollut. Res. Int. 2020. V. 27. P. 44743–44756. https://doi.org/10.1007/s11356-020-10573-x
Sánchez C. Fungal potential for the degradation of petroleum based polymers: an overview of macro- and microplastics biodegradation // Biotechnol. Advan. 2019. V. 40. Art. 107501. https://doi.org/10.1016/j.biotechadv.2019.107501
Sangale M.K., Shahnawaz M., Ade A.B. Potential of fungi isolated from the dumping sites mangrove rhizosphere soil to degrade polythene // Sci. Rep. 2019. V. 9. Art. 5390. https://doi.org/10.1038/s41598-019-41448-y
Schlundt C., Mark Welch J.L., Knochel A.M., Zettler E.R., Amaral-Zettler L.A. Spatial structure in the “Plastisphere”: Molecular resources for imaging microscopic communities on plastic marine debris // Mol. Ecol. Resour. 2020. V. 20. P. 620–634. https://doi.org/10.1111/1755-0998.13119
Shen M., Zhu Y., Zhang Y., Zeng G., Wen X., Yi H., Ye S., Ren X., Song B. Micro(nano)plastics: unignorable vectors for organisms // Mar. Pollut. Bull. 2019. V. 139. P. 328–331. https://doi.org/10.1016/j.marpolbul.2019.01.004
Sgier L., Freimann R., Zupanic A., Kroll A. Flow cytometry combined with viSNE for the analysis of microbial biofilms and detection of microplastics // Nat. Commun. 2016. V. 7. Art. 11587. https://doi.org/10.1038/ncomms11587
Sgier L., Merbt S.N., Tlili A., Kroll A., Zupanic A. Characterization of aquatic biofilms with flow cytometry // J. Vis. Exp. 2018. V. 136. Art. 57655. https://doi.org/10.3791/57655
Sun Q., Li J., Wang C., Wang C., Chen A., You Y., Yang S., Liu H., Jiang G., Wu Y., Li Y. Research progress on distribution, sources, identification, toxicity, and biodegradation of microplastics in the ocean, freshwater, and soil environment // Front. Environ. Sci. Eng. 2022. V. 16. Art. 309. https://doi.org/10.1007/s11783-021-1429-z
Thompson R.C., Olsen Y., Mitchell R.P., Davis A., Rowland S.J., John A.W., McGonigle D., Russell A.E. Lost at sea: Where is all the plastic? // Science. 2004. V. 304. Art. 838. https://doi.org/10.1126/science.1094559
Toussaint B., Raffael B., Angers-Loustau A., Gilliland D., Kestens V., Petrillo M., Rio-Echevarria I.M., Van den Eede G. Review of micro- and nanoplastic contamination in the food chain // Food Addit. Contam. Part A. Chem. Anal. Control Expo. Risk Assess. 2019. V. 36. P. 639–673. https://doi.org/10.1080/19440049.2019.1583381
Tu C., Zhou Q., Zhang C., Liu Y., Luo Y. Biofilms of microplastics // Microplastics in Terrestrial Environments – Emerging Contaminants and Major Challenges. The Handbook of Environmental Chemistry / Eds. He D., Luo Y. Springer Nature Switzerland AG, 2020. V. 95. P. 299‒317. https://doi.org/10.1007/698_2020_461
Tu C., Liu Y., Li L., Li Y., Vogts A., Luo Y., Waniek J.J. Structural and functional characteristics of microplastic associated biofilms in response to temporal dynamics and polymer types // Bull. Environ. Contam. Toxicol. 2021. V. 107. P. 633–639. https://doi.org/10.1007/s00128-021-03333-1
Vaksmaa A., Knittel K., Abdala Asbun A., Goudriaan M., Ellrott A., Witte H.J., Vollmer I., Meirer F., Lott C., Weber M., Engelmann J.C., Niemann H. Microbial communities on plastic polymers in the Mediterranean Sea // Front. Microbiol. 2021. V. 12. Art. 673553. https://doi.org/10.3389/fmicb.2021.673553
Veerasingam S., Ranjani M., Venkatachalapathy R., Bagaev A., Mukhanov V., Litvinyuk D., Mugilarasan M., Gurumoorthi K., Guganathan L., Aboobacker V.M., Vethamony P. Contributions of Fourier transform infrared spectroscopy in microplastic pollution research: a review // Crit. Revs. Environ. Sci. Technol. 2020. https://doi.org/10.1080/10643389.2020.1807450
Wang S., Xue N., Li W., Zhang D., Pan X., Luo Y. Selectively enrichment of antibiotics and ARGs by microplastics in river, estuary and marine waters // Sci. Total Environ. 2020. V. 708. Art. 134594. https://doi.org/10.1016/j.scitotenv.2019.134594
Wendeberg A. Fluorescence in situ hybridization for the identification of environmental microbes // Cold Spring Harb. Protoc. 2010. Article pdb.prot5366. https://doi.org/10.1101/pdb.prot5366
Wright R.J., Erni-Cassola G., Zadjelovic V., Latva M., Christie-Oleza J.A. Marine plastic debris: a new surface for microbial colonization // Environ. Sci. Technol. 2020. V. 54. P. 11657–11672. https://doi.org/10.1021/acs.est.0c02305
Wright R.J., Bosch R., Langille M.G.I., Gibson M.I., Christie-Oleza J.A. A multi-OMIC characterization of biodegradation and microbial community succession within the PET plastisphere // Microbiome. 2021. V. 9. Art. 141. https://doi.org/10.1186/s40168-021-01054-5
Wu P., Huang J., Zheng Y., Yang Y., Zhang Y., He F., Chen H., Quan G., Yan J., Li T., Gao B. Environmental occurrences, fate, and impacts of microplastics // Ecotoxicol. Environ. Saf. 2019. V. 184. Art. 109612. https://doi.org/10.1016/j.ecoenv.2019.109612
Xie H., Chen J., Feng L., He L., Zhou C., Hong P., Sun S., Zhao H., Liang Y., Ren L., Zhang Y., Li C. Chemotaxis-selective colonization of mangrove rhizosphere microbes on nine different microplastics // Sci. Total Environ. 2020. Art. 142223. https://doi.org/10.1016/j.scitotenv.2020.1422
Xue N., Fang Q., Pan X., Zhang D. Distinct fungal plastisphere across different river functional zones: a watershed scale study // Sci. Total Environ. 2021. V. 752. Art. 141879. https://doi.org/10.1016/j.scitotenv.2020.141879
Yang Y., Liu W., Zhang Z., Grossart H.-P., Gadd G.M. Microplastics provide new microbial niches in aquatic environments // Appl. Microbiol. Biotechnol. 2020. V. 104. P. 6501–6511. https://doi.org/10.1007/s00253-020-10704-x
Zettler E.R., Mincer T.J., Amaral-Zettler L.A. Life in the “plastisphere”: Microbial communities on plastic marine debris // Environ. Sci. Technol. 2013. V. 47. P. 7137–7146. https://doi.org/10.1021/es401288x
Zhang Y., Gao T., Kang S., Allen S., Luo X., Allen D. Microplastics in glaciers of the Tibetan Plateau: Evidence for the long-range transport of microplastics // Sci. Total Environ. 2020. V. 758. https://doi.org/10.1016/j.scitotenv.2020.143634
Zhang X., Li Y., Ouyang D., Lei J., Tan Q., Xie L., Li Z., Liu T., Xiao Y., Farooq T.H., Wu X., Chen L., Yan W. Systematical review of interactions between microplastics and microorganisms in the soil environment // J. Hazard. Mater. 2021. V. 418. Art. 126288. https://doi.org/10.1016/j.jhazmat.2021.126288
Zhou Y., Kumar M., Sarsaiya S., Sirohi R., Awasthi S.K., Sindhu R., Binod P., Pandey A., Bolan N.S., Zhang Z., Singh L., Kumar S., Awasthi M.K. Challenges and opportunities in bioremediation of micro-nano plastics: a review // Sci. Total Environ. 2021. V. 802. Art. 149823. https://doi.org/10.1016/j.scitotenv.2021.149823
Ziajahromi S., Neale P.A., Rintoul L., Leusch F.D. Wastewater treatment plants as a pathway for microplastics: development of a new approach to sample wastewater-based microplastics // Water Res. 2017. V. 112. P. 93–99. https://doi.org/10.1016/j.watres.2017.01.042
Дополнительные материалы отсутствуют.
Инструменты
Микробиология



