Микробиология, 2022, T. 91, № 2, стр. 150-159
L-лактатоксидазные системы микроорганизмов
Е. Н. Бирюкова a, *, А. Ю. Аринбасарова a, А. Г. Меденцев a
a Федеральный исследовательский центр “Пущинский научный центр биологических исследований РАН”,
Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН Российской академии наук
142290 Пущино, Московская область, Россия
* E-mail: biryukovae05@rambler.ru
Поступила в редакцию 29.04.2021
После доработки 29.10.2021
Принята к публикации 02.11.2021
- EDN: EOSXZT
- DOI: 10.31857/S0026365622020045
Аннотация
Молочная кислота (лактат) считается одной из наиболее важных α-гидроксикислот в природе, участвующих во многих биологических процессах. Лактат является конечным продуктом тканевого обмена глюкозы при нехватке кислорода, основным межклеточным энергетическим веществом в мышцах и тканях мозга человека, а также натуральным компонентом вин и других пищевых продуктов. Многие микроорганизмы используют L-лактат в качестве источника углерода и энергии, что обеспечивает их выживание и конкурентоспособность по отношению к другим видам. Способность к утилизации L-лактата обусловливает патогенность некоторых видов бактерий, что актуально при исследованиях в сфере медицины и фармакологии. Ферменты, окисляющие L-лактат, классифицируются на растворимые и нерастворимые. Растворимые L-лактатоксидазные системы включают флавин-содержащие ферменты, непосредственно отдающие электроны на кислород (L-лактатоксидазы и L-лактатмонооксигеназы). Они распространены среди бактерий, дрожжей и грибов. Нерастворимые могут содержать как флавины, так и другие компоненты, включая железосерные кластеры, отдающие электроны в дыхательную цепь на уровне убихинона (коэнзима Q или менахинона). При этом процесс окисления L-лактата сопряжен с образованием трансмембранного потенциала и синтезом АТФ. Эти системы встречаются преимущественно у бактерий и водорослей. Важным аспектом изучения L-лактатоксидазных систем микроорганизмов являются исследования структуры и организации оперонов утилизации L-лактата, поскольку, используя такой подход, можно идентифицировать новые ферменты, участвующие в окислении молочной кислоты.
Лактат ‒ трехуглеродная хиральная гидроксикарбоновая кислота, существует в виде двух стереоизомеров: L (+) и D (‒); наиболее часто встречается L-форма (Amar et al., 2005). Наличие в молекуле L‑лактата гидроксильной и карбоксильной групп позволяет ему участвовать в самых разнообразных химических реакциях, обеспечивая широкое применение в медицине, косметической, текстильной, фармацевтической, пищевой и химической промышленностях.
В пищевой промышленности соли молочной кислоты ‒ лактаты натрия (Е 325), калия (Е 326), кальция (Е 327), аммония (Е 328), магния (Е 329) и железа (Е 585) ‒ используются для повышения микробиологической безопасности продукции, а также для улучшения ее качества и функционально-технологических характеристик (Rathee et al., 2016).
В медицинской практике определение концентрации лактата в крови предоставляет ценную информацию для дифференциальной диагностики гиперлактатемии при таких состояниях, как шок (септический, кардиогенный, гиповолемический, дистрибьютивный), осложнения системных заболеваний (сахарный диабет, алкоголизм, панкреатит, рак, инфекции), болезни сердца, гипоксемия, тяжелая анемия, инфаркт кишечника, интерференция лекарственных препаратов, асфиксия новорожденных, физические нагрузки, редкие врожденные нарушения обмена веществ (Gladden et al., 2004; Kubera et al., 2012).
Разработка биосенсоров является надежным методом определения L-лактата, поскольку специфичность иммобилизованного фермента к своему субстрату позволяет проводить измерения непосредственно в образце, несмотря на сложность его состава (Ashok et al., 2020). В настоящее время для определения L-лактата широко используются биосенсоры, основанные на действии фермента L-лактатоксидазы, в таком случае осуществляется определение пероксида водорода, выделяющегося в ходе ферментативной реакции (Cunha-Silva et al., 2019).
В химической промышленности ферменты L‑лактатоксидазных систем применяются в качестве биокатализаторов при синтезе 2-оксокислот, например, пирувата. Такая система биоконверсии представляет собой экологически чистое и перспективное производство (Gao et al., 2012).
В настоящее время L-лактат производится с использованием микробиологического синтеза, эффективность которого в основном зависит от продуцента, стоимости субстрата и режимов культивирования (Дерунец, 2020).
Способность микроорганизмов использовать молочную кислоту в качестве субстрата роста достаточно широко распространена среди бактерий (Garvie et al., 1980; Yun et al., 2003), грибов (Sztajer et al., 1996; Куплетская и соавт., 2007), дрожжей (Garvie et al., 1980; Бирюкова и соавт., 2017), водорослей (Jasso-Chávez et al., 2001, 2005), а также смешанных культур (Okano et al., 2010) и генетически модифицированных микроорганизмов (Reddy et al., 2008).
В утилизации L-лактата преимущественно участвуют НАД-независимые L-лактатдегидрогеназы (L-лактатоксидазы) (Garvie et al., 1980; Mizutani et al., 1983; Sakharov et al., 2010; Jiang et al., 2014; Koman et al., 2015).
НАД+-зависимые ферменты встречаются лишь у бактерий (Garvie et al., 1980; Wang et al., 2021) и грибов (Yu et al., 1991; Skory, 2000; Дерунец, 2020). Процесс окисления L-лактата у бактерий Lactobacillus plantarum происходит при высокой концентрации метаболита в среде роста, что маловероятно в обычных условиях (Goffin et al., 2004; Wang et al., 2021).
НАД+-зависимые L-лактатдегидрогеназы грибов рода Rhizopus spp. используется в микробиологическом синтезе молочной кислоты (Zhou et al., 1999), преимуществом которого является применение крахмалистых субстратов без предварительного осахаривания (Bulut et al., 2004; Zhang et al., 2007).
РАСТВОРИМЫЕ L-ЛАКТАТОКСИДАЗЫ
К растворимым ферментам, участвующим в окислении L-лактата, относятся оксидазные системы, содержащие в качестве кофактора флавины или железосерные кластеры (Fe-S): L-лактатоксидазы и L-лактатмонооксигеназы (Garvie, 1980; Fra-aije et al., 1998; Jiang et al., 2014; Braymer et al., 2021).
Монооксигеназы (EC 1.13.12.4) обнаружены у бактерий порядка Actinomycetales (включая роды Mycobacterium, Nocardia, Streptomyces, Rhodococcus и Frankia), грибов Beauveria и архей Halopiger salifodinae (Maeda-Yorita et al., 1995; Kelsey et al., 2018). Механизм действия ферментов заключается в передаче электронов от флавина непосредственно на кислород, с образованием ацетата, углекислого газа и воды:
L-лактатмонооксигеназа Mycobacterium smegmatis представляет собой флавопротеин, молекулярная масса которого составляет 300‒400 кДа (Kean, Karplus, 2019). Фермент является октамером с идентичными субъединицами (Lockridge et al., 1972; Xia, Mathews, 1990), активный центр которого содержит гистидин 290 (Giegel et al., 1990), имеет форму компактно-свернутой петли и крышки, что обеспечивает стабильность фермента (Kelsey et al., 2018).
Монооксигеназа проявляет строгую субстратную специфичность. Оптимум рН фермента составляет 5.6‒6.0 (Sullivan et al., 1977).
L-лактатоксидазы катализируют окисление L‑лактата с образованием пирувата и перекиси водорода (Duncan et al., 1989; Leiros et al., 2006; Furuichi et al., 2008):
L-лактатоксидаза бактерий Aerococcus viridans представляет собой флавопротеин, тетрамер с молекулярной массой субъединиц 48 кДа (Duncan et al., 1989; Umena et al., 2005). Механизм действия фермента заключается в переносе двух электронов и двух протонов от восстановленного ФМН (флавинмононуклеотида) на молекулярный кислород (по типу пинг-понг) (Furuichi et al., 2008). L-лактатоксидаза проявляет строгую субстратную специфичность к L-лактату; Km фермента составляет 5.3 мМ (Morimoto et al., 1998; Stoisser et al., 2016).
Растворимые L-лактатоксидазы применяются в разработке лактатных биосенсоров, что находит широкое применение в клинической и спортивной медицине, а также для контроля качества пищевых продуктов (Hiraka et al., 2019).
L-лактатоксидазная активность обнаружена также у дрожжей (Solmo et al., 1962; Pajot, Claisse, 1974; Pallotta et al., 2004; Смуток и соавт., 2006; Lederer, 2011; Бирюкова и соавт., 2009, 2017) и грибов (Sztajer et al., 1996, Куплетская и соавт., 2007).
Показано, что дрожжи Yarrowia lipolytica синтезируют L-лактатоксидазу в процессе роста на L‑лактате в качестве единственного источника углерода и энергии, а также при воздействии стрессоров (оксидантов, повышенной температуры) (Бирюкова и соавт., 2009, 2011, 2017; Аринбасарова и соавт., 2014; Arinbasarova et al., 2018). Установлено (Аринбасарова и соавт., 2014), что фермент локализуется в пероксисомах наряду с каталазой и изоцитратлиазой, маркерными ферментами пероксисом. После очистки с помощью ионообменной хроматографии оказалось, что фермент содержит флавин и является тетрамером с молекулярной массой, равной 200‒230 кДа, и субъединиц ‒ 50‒56 кДа (Бирюкова и соавт., 2017). Оптимум рН фермента составляет 7.0‒8.5; Kм ‒ 50 мкМ (при 22°С и рН 8.0). L-лактатоксидаза проявляет строгую субстратную специфичность к L-лактату.
Изучен синтез фермента дрожжами Y. lipolytica в условиях глубинного культивирования в лабораторных биореакторах АНКУМ-2М. Показано, что в оптимальном режиме выращивания дрожжей на L-лактате в среде накапливалось 24.5 Е/л фермента, продуктивность составляла 2.0 Е/(л ч). Увеличение биосинтеза L-лактатоксидазы до 75 Е/л и продуктивности до 3.2 Е/(л ч) достигалось на среде с L-лактатом (1%) и глюкозой (2%) (Бирюкова и соавт., 2017).
Растворимая L-лактатоксидаза обнаружена также у грибов Geotrichum candidum (Sztajer et al., 1996; Куплетская и соавт., 2007). Фермент представляет собой флавопротеин, октамер с молекулярной массой 360‒450 кДа, субъединиц ‒ 52 кДа. Оптимум рН L-лактатокидазы составляет 8‒11, температуры ‒ 30‒45°С, Кm ‒ 3.6 мM. Фермент проявляет строгую субстратную специфичность к L-лактату (Sztajer et al., 1996).
N-терминальная последовательность L-лактатоксидазы G. candidum (Tyr-Tyr-Ser-Ala-Ser-Ser-Ala-Trp-Pro-Gln-Ile-Ala-Gly-Tyr-Lys-Leu-Pro-Glu-Val-Asp-Asn-Glu-Pro-Val-Gly-) оказалась схожей с таковой бактерий M. smegmatis и M. phlei (Chapman et al., 1991, 1996). Отличие заключалось лишь в образовании продуктов реакции: у G. сandidum ‒ пируват и перекись водорода, у M. smegmatis и M. phlei ‒ ацетат, СО2 и Н2О.
Окисление L-лактата у дрожжей Saccharomyces сerevisiae (Pajot, Claisse, 1974) и Hansenula рolymorpha (Lederer, 2011) происходит посредством флавоцитохрома b2 (Labeyrie, Baydras, 1972), локализованного в митохондриях (Black et al., 1989). Обнаружена схожесть между ферментами дрожжей: молекулярная масса флавоцитохрома b2 S. cerevisiae составляет ‒ 230 кДа, H. рolymorpha ‒ 236 кДа. Оба фермента представляют собой тетрамеры, состоящие из идентичных субъединиц (Labeyrie, Baudras, 1972; Lederer, 2011), каждая из которых имеет две структурные области: более мелкий домен для связывания гема и более крупный ‒ флавина.
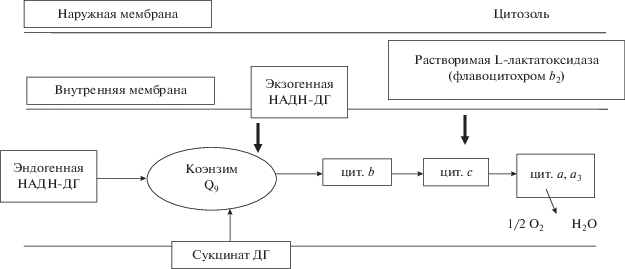
Первоначально считалось (Solmo, 1962), что флавоцитохром b2S. сerevisiae является нерастворимым белком и связан с митохондриальной мембраной. Однако при дальнейших исследованиях оказалось, что фермент растворим, локализуется в межмембранном пространстве митохондрий. Посредством флавоцитохрома b2 осуществляется передача электронов на цитохром с (рис. 1) (Daum et al., 1982; Lockridge et al., 1992; Lederer, 2011), содержащий простетическую группу с протогемом IX (Black et al., 1989; Xia, Mathews, 1990; Lederer, 1991). Краткая схема взаимодействия флавоцитохрома b2 дрожжей S. cerevisiae и H. рolymorpha с дыхательной цепью митохондрий представлена на рис. 1.
Рис. 1.
Схема взаимодействия растворимой L-лактатоксидазы дрожжей S. cerevisiae (Pajot, Claisse, 1974) и H. рolymorpha (Lederer, 2011) с дыхательной цепью митохондрий.
Растворимые ферменты, участвующие в утилизации L-лактата, представлены в табл. 1.
Таблица 1.
Растворимые ферменты, окисляющие L-лактат
| Название микроорганизма | Название фермента | Молекулярная масса | Ссылка |
|---|---|---|---|
| Aerococcus viridans | L-лактатоксидаза | Тетрамер, 162 кДа | Furuichi et al., 2008 |
| Mycobacterium smegmatis | L-лактатоксидаза | Октамер, 300‒400 кДа | Stoisser et al., 2016; Hiraka et al., 2019 |
| Yarrowia lipolytica | L-лактатоксидаза | Тетрамер, 200‒230 кДа | Бирюкова и соавт., 2017 |
| Geotrichum candidum | L-лактатоксидаза | Октамер, 360‒450 кДа | Sztajer et al., 1996 |
| Hansenula polymorpha | Флавоцитохром b2 | Тетрамер, 236 кДа | Lederer, 2011 |
| Saccharomyces cerevisiae | Флавоцитохром b2 | Тетрамер, 230 кДа | Lederer, 1991 |
НЕРАСТВОРИМЫЕ L-ЛАКТАТОКСИДАЗЫ
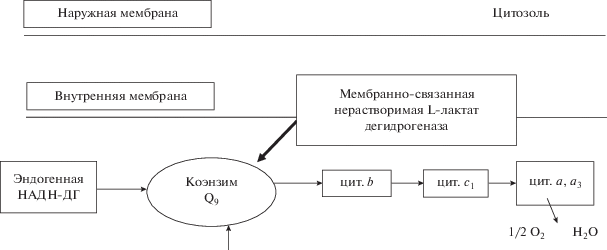
Нерастворимые ферменты, окисляющие L-лактат, обнаружены преимущественно у бактерий (Futai, Kimura, 1977; Goffin et al., 2004; Stansen et al., 2005; Thomas et al., 2011). Они связанны с цитоплазматической мембраной и отдают электроны непосредственно в дыхательную цепь на уровне убихинона (коэнзима Q или менахинона) (рис. 2).
Рис. 2.
Схема взаимодействия нерастворимой L-лактатдегидрогеназы бактерий E. сoli (Futai, Kimura, 1977), Lactobacillus plantarum (Goffin et al., 2004), Corynebacterium glutamicum (Stansen et al., 2005) с дыхательной цепью переноса электронов в мембране бактерий.

Нерастворимая L-лактатдегидрогеназа E. сoli представляет собой олигомер с молекулярной массой 480 кДа. Фермент является флавопротеином, у которого на 1 моль полипептида приходится 1 моль флавина, связанного с дыхательной цепью переноса электронов на уровне менахинона (Futai, Kimura, 1977) (рис. 2). Оптимум рН фермента определен как 8.0‒9.0, Km ‒ 1.2 × 10–4 М, Vmax ‒ 3126 мкмоль мин–1 мг–1.
Изучение L-лактатдегидрогеназы E. сoli оказалось перспективным, поскольку на основе оперона lldPRD бактерии был разработан цельноклеточный L-лактатный биосенсор для мониторинга концентрации L-лактата в культурах клеток млекопитающих, применяемый для количественного определения метаболитов в сложных образцах с высокой точностью, чувствительностью и надежностью на ранней фазе культивирования (Goers et al., 2017).
Существуют ферменты, окисляющие L-лактат, у которых вместо флавина в качестве кофактора содержатся железосерные кластеры, непосредственно взаимодействующие с дыхательной цепью переноса электронов. Такие L-лактатоксидазные системы достаточно хорошо изучены у бактерий Bacillus subtilis (Chai et al., 2009), Campylobacter jejuni (Thomas et al., 2011), Pseudomonas stutzeri A1501 (Gao et al., 2015).
L-лактатдегидрогеназа P. stutzeri A1501 представляет собой димер с молекулярной массой, равной 111 кДа (Gao et al., 2015). Оптимум рН фермента составляет 7.0, температуры ‒ 30°С, Km ‒ 55.4 ± 0.27 мкМ. L-лактатдегидрогеназа проявляет строгую субстратную специфичность к L-лактату.
L-лактатоксидазная система C. jejuni состоит из нескольких ферментов: железосерной L-лактатдегидрогеназы и флавин-железосерной оксидоредуктазы, связанных с мембраной (Thomas et al., 2011).
Нерастворимые ферменты, участвующие в окислении L-лактата, представлены в табл. 2.
Таблица 2.
Нерастворимые ферменты, окисляющие L-лактат
| Название микроорганизма | Название фермента | Молекулярная масса | Ссылки |
|---|---|---|---|
| Escherichia coli | ФМН-зависимая L-лактатдегидрогеназа | Олигомер, 480 кДа | Futai, Kimura, 1977 |
| Lactobacillus plantarum | ФМН-зависимая L-лактатдегидрогеназа | Димер, 155 кДа | Goffin et al., 2004 |
| Pseudomonas stutzeri A150 | Fe-S-зависимая L-лактатдегидрогеназа | Димер, 200 кДа | Gao et al., 2015 |
| Bacillus subtilis | Fe-S-зависимая L-лактатдегидрогеназа | 146 кДа | Chai et al., 2009 |
| Campylobacter jejuni | Fe-S-зависимая L-лактатдегидрогеназа | 3 субъединицы | Thomas et al., 2011 |
| Euglena gracilis | ФАД-зависимая L-лактатдегидрогеназа | Мономер, 62 кДа | Jasso-Chávez et al., 2001, 2005 |
L-ЛАКТАТОКСИДАЗНЫЕ СИСТЕМЫ ВОДОРОСЛЕЙ
Помимо бактерий и дрожжей ферменты, окисляющие L-лактат, были обнаружены у водорослей Euglena gracilis (Jasso-Chávez et al., 2001, 2005), принадлежащих к наиболее примитивному эукариотическому типу клеток, содержащих митохондрии. L-лактатдегидрогеназа E. gracilis представляет собой мономер с молекулярной массой 62 кДа, содержащий в качестве кофактора нековалентно связанный ФАД. Фермент прочно связан c внутренней мембраной митохондрий и передает восстановительные эквиваленты на пул убихинона, затем на комплекс цитохром b-с1 и цитохром с редуктазу или цианид-резистентную оксидазу (рис. 3). Оптимум pH фермента составляет 6.5‒7.0.
Рис. 3.
Схема взаимодействия нерастворимой L-лактатдегидрогеназы водорослей Euglena gracilis с дыхательной цепью митохондрий.
Считается, что наличие у E. gracilis мембранно-связанной L-лактатдегидрогеназной активности предполагает тесную филогенетическую связь между дыхательными цепями бактерий и водорослей (Jasso-Chávez et al., 2001, 2005).
ПАТОГЕННОСТЬ
Способность некоторых микроорганизмов, например, Desulfovibrio vulgaris (Goldstein et al., 2003; Berry, Reinisch, 2013; Vita et al., 2015), Neisseria gonorrhoeae (Smith et al., 2011), Neisseria meningitidis (Exley et al., 2005, 2007), Staphylococcus aureus (Ferreira et al., 2013) и др. окислять L-лактат может приводить к активации патогенности. Известно, что патогенные бактерии вызывают опасные для человека и животных заболевания: D. vulgaris ‒ абсцессы и холециститы (Goldstein et al., 2003; Berry, Reinisch, 2013); Neisseria gonorrhoeae ‒ гонорею; N. meningitidis ‒ менингит (Smith et al., 2001, 2011). Ввиду наличия в организме человека достаточного количества L-лактата, в процессе эволюции у патогенов сформировались L-лактатоксидазные системы, отличительной особенностью которых является присутствие сразу нескольких ферментов, окисляющих L-лактат.
N. gonorrhoeae имеет две флавин-содержащие L-лактатдегидрогеназы (НАД+-зависимую и НАД+-независимую) и одну D-лактатдегидрогеназу (Atack et al., 2014). Последняя, возможно, активируется в качестве альтернативного пути окисления лактата. Механизм устойчивости N. gonorrhoeae обусловлен гликозилированием липополисахаридов (ЛПС) бактерии (Smith et al., 2001, 2007); N. meningitidis ‒ синтезом полисиаловой капсулы, что обеспечивает им высокую устойчивость и патогенность (Exley et al., 2005).
Изучение механизмов окисления L-лактата у патогенных бактерий является актуальным, поскольку обеспечивает новый подход к исследованию и разработке препаратов, способных блокировать пути окисления метаболита. Поэтому возникает необходимость идентифицировать опероны утилизации L-лактата, что позволит в дальнейшем выяснить различия в регуляторных механизмах, функциях и свойствах L-лактатоксидазных систем.
РЕГУЛЯЦИЯ ОКИСЛЕНИЯ L-ЛАКТАТА МИКРООРГАНИЗМАМИ
Одним из удивительных свойств живых организмов является сохранение постоянного баланса между необходимыми для поддержания жизнедеятельности различными процессами и огромным количеством биосинтетических путей. Клеточный гомеостаз достигается благодаря функционированию эффективной и сложной системы регуляции, приводящей каждый отдельный метаболический процесс в строгое соответствие с нуждами клетки.
При изучении L-лактатоксидазных систем микроорганизмов обнаружено, что регуляторные механизмы утилизации L-лактата отличаются. Для того чтобы выявить эти различия рассмотрим структуру lac-оперонов у E. coli, C. glutamicum и Pseudomonas stutzeri A1501. Все lac-опероны перечисленных бактерий содержат ген lldR, кодирующий регуляторный белок LldR, регуляторную последовательность и структурные гены. LldR этих бактерий принадлежат к подсемейству FadR, являющихся консервативными доменами. LldR может быть как репрессором, так и активатором транскрипции lac-оперона.
Индуцирующим фактором транскрипции lac-оперона у E. coli является L-лактат. При отсутствии L-лактата в среде происходит связывание двух молекул LldR с двумя регуляторными последовательностями, что приводит к образованию петель ДНК и репрессии транскрипции. При наличии L-лактата происходит связывание LldR с регуляторной последовательностью, приводящее к конформационным изменениям и дестабилизации петли ДНК, обеспечивая транскрипцию. Для активации транскрипции на этом уровне LldR также может взаимодействовать с РНК-полимеразой или другими регуляторами (Aguilera et al., 2008).
Lac-оперон C. glutamicum содержит гены lldR и NCgl2816, кодирующие, соответственно, L-лактатдегидрогеназу и пермеазу. LldR связывается с областью промотора − 1TNGTNNNACNA10, расположенной выше NCgl2816-lldD. Сверхэкспрессия lldR приводит к снижению мРНК NCgl2816-lldD, активности LldD и, как следствие, к замедлению роста клеток бактерий, выращенных на L-лактате в качестве единственного источника углерода и энергии.
Необходимо отметить, что при наличии в среде роста L-лактата и глюкозы удельная активность L-лактатдегидрогеназы остается высокой; только глюкозы ‒ снижается почти в 7 раз. Из этого следует, что оперон NCgl2816-lldD имеет специфическую регуляцию L-лактатом. Поэтому при росте C. glutamicum на L-лактате или в условиях, ведущих к его накоплению, происходит индукция lac-оперона (Georgi et al., 2008).
Таким образом, lac-опероны E. coli и C. glutamicum имеют только один ген lldD, ответственный за утилизацию L-лактата.
Отличительной особенностью lac-оперона P. aeruginosa является наличие двух генов lldD и lldE, кодирующих L- и D-лактатдегидрогеназы соответственно, координация которых осуществляется под действием одного регуляторного белка LldR (Gao et al., 2012, 2015).
Изучение геномных последовательностей lac-оперонов бактерий перспективно, поскольку могут быть обнаружены консервативные компоненты, в частности, ген lldP, кодирующий L-лактатпермеазу, что может быть использовано в качестве маркера идентификации у других видов микроорганизмов (Jiang et al., 2012). Кроме того, используя такой подход можно выявить новые ферменты, участвующие в окислении L-лактата.
Важным аспектом исследования L-лактатоксидазных систем является идентификация и дальнейшее изучение lac-оперонов, что незаменимо в разработке препаратов, блокирующих пути утилизации L-лактата у микроорганизмов. Кроме того, на основе структуры lac-оперонов перспективно создание мутантных микроорганизмов с конститутивно выраженной активностью ферментов L-лактатоксидазных систем в отношении только одного изомера молочной кислоты, что актуально для их биосинтеза.
ЗАКЛЮЧЕНИЕ
В настоящее время лактат широко используется для синтеза биополимеров, на основе которых производят биоразлагаемый пластик (Flieger et al., 2003), этил-, пропил-, бутилацетаты (“зеленые растворители”) (Rathee et al., 2016; Головатюк, 2020); пропиленгликоль (Datta et al., 2006) и другие ценные химические соединения.
В обзоре затронуты другие аспекты ‒ изучение ферментов, окисляющих L-лактат. Эти ферменты применяются в качестве биокатализаторов при синтезе 2-оксокислот, например, пирувата. Оптимальные условия биокатализа пировиноградной кислоты достигаются при использовании в качестве субстрата дешевого D,L-лактата и целых клеток Pseudomonas stutzeri, в результате чего выход пирувата составляет 98%. Такая система биоконверсии представляет собой экологически чистое и перспективное производство пировиноградной кислоты (Gao et al., 2012).
Ферменты L-лактатоксидазных систем характеризуются строгой субстратной специфичностью и применяются для хирального разделения рацемических смесей 2-гидроксикислот (Gao et al., 2011; Бирюкова и соавт., 2017).
Имея уникальную способность непосредственно использовать О2 в качестве акцептора электронов, L-лактатоксидазы повсеместно используются для разработки высокочувствительных биосенсоров, преимуществом которых является широкий линейный диапазон и низкие пределы обнаружения L-лактата (Hiraka et al., 2019).
Ферменты, окисляющие L-лактат, широко распространены среди бактерий, дрожжей, грибов и водорослей.
В процессе эволюции у микроорганизмов сформировалось большое многообразие L-лактатоксидазных систем, что обеспечило им выживаемость и конкурентоспособность по сравнению с другими видами. Показано, что способность к утилизации L-лактата у некоторых видов бактерий обусловливает патогенность. Полагают, что L-лактатоксидазные системы N. gonorrhoeae и N. meningitidis являются составной частью механизма активации устойчивости, обусловленного гликозилированием липополисахаридов и синтезом полисиаловой капсулы соответственно (Smith et al., 2001; Exley et al., 2005; Smith et al., 2007).
Утилизация L-лактата в основном связана с функционированием L-лактатоксидазных систем, которые классифицируются на растворимые и нерастворимые. Растворимые являются ферментами, содержащими ФМН, непосредственно отдающие электроны на кислород с образованием пирувата, перекиси водорода и воды. Таким образом, в этом случае только пировиноградная кислота обеспечивает дальнейший рост и развитие микробной клетки.
У дрожжей S. cerevisiae и H. рolymorpha в окислении L-лактата также участвует дыхательная цепь (на уровне цитохрома с) с образованием 1 моля АТФ в третьем пункте сопряжения, что связано с функционированием флавоцитохрома b2.
Окисление L-лактата нерастворимыми ферментами связано с дыхательной цепью переноса электронов на уровне хинонов (коэнзима Q или менахинона). Этот механизм предполагает образование трансмембранного протонного градиента и синтеза 2 молей АТФ во втором и третьем пунктах сопряжения в дыхательной цепи.
Таким образом, можно полагать, что утилизация L-лактата с участием нерастворимых L-лактатоксидазных ферментов является для клетки микроорганизмов наиболее энергетически выгодным.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВНастоящая статья не содержит результатов исследований с использованием животных в качестве объектов.КОНФЛИКТ ИНТЕРЕСОВАвторы заявляют об отсутствии конфликта интересов.
Список литературы
Аринбасарова А.Ю., Бирюкова Е.Н., Меденцев А.Г. Синтез и локализация L-лактатоксидазы у дрожжей Yarrowia lipolytica // Микробиология. 2014. Т. 83. С. 519‒524.
Arinbasarova A.Y., Biryukova E.N., Suzina N.E., Medentsev A.G. Synthesis and localization of L-lactate oxidase in yeasts Yarrowia lipolytica // Microbiology (Moscow). 2014. V. 83. P. 505‒509.
Бирюкова Е.Н., Аринбасарова А.Ю., Меденцев А.Г. Синтез L-лактатоксидазы дрожжами Yarrowia lipolytica в условиях глубинного культивирования // Прикл. биохимия и микробиология. 2017. Т. 53. № 2. С. 213‒218.
Biryukova E.N., Arinbasarova A.Y., Medentsev A.G. Synthesis of L-lactate oxidaze in yeast Yarrowia lipolytica during submerged cultivation // Appl. Biochem. Microbiol. 2017. V. 53. P. 217‒221.
Бирюкова Е.Н., Аринбасарова А.Ю., Сузина Н.Е., Сорокин В.В., Меденцев А.Г. Изменение ультраструктуры дрожжей Yarrowia lipolytica в стрессовых условиях // Микробиология. 2011. Т. 80. С. 344‒348.
Biryukova E.N., Arinbasarova A.Y., Suzina N.E., Medentsev A.G., Sorokin V.V. Ultrastructural changes in Yarrowia lipolytica cells under stress conditions // Microbiology (Moscow). 2011. V. 80. P. 350‒354.
Бирюкова Е.Н., Ступарь Я.О., Аринбасарова А.Ю., Меденцев А.Г. Yarrowia lipolytica ‒ продуцент L-лактатоксидазы // Микробиология. 2009. Т. 78. С. 716‒718.
Biryukova E.N., Stupar Y.O., Arinbasarova A.Y., Medentsev A.G. Yarrowia lipolytica, a producer of L-lactate oxidase // Microbiology (Moscow). 2009. V. 78. P. 650‒652.
Головатюк А.А. Биополимеры на основе молочной кислоты // Материалы XII Международной студенческой конференции “Студенческий научный форум”. 2020. scienceforum.ru/2020/article/2018021196
Дерунец А.С. Биологические основы совершенствования культивирования молочнокислых бактерий для разработки высокоэффективной технологии получения молочной кислоты. Дис. … канд. биол. наук. Российский химико-технологический университет им. Д.И. Менделеева. М., 2020.
Куплетская М.Б., Сухачева М.В., Кураков А.В., Нетрусов А.И. Поиск микроорганизмов-продуцентов L-лактатоксидазы // Прикл. биохимия и микробиология. 2007. Т. 43. № 2. С. 199‒202.
Смуток О.В., Осьмак Г.С., Гайда Г.З., Гончар М.В. Скрининг дрожжей – продуцентов стабильной формы L-лактат цитохром с-оксидоредуктазы и исследование регуляции ее синтеза // Микробиология. 2006. Т. 75. С. 29‒34.
Smutok O.V., Os’mak G.S., Gaida G.Z., Gonchar M.V. Screening of yeasts producing stable L-lactate cytochrome c oxidoreductase and study of the regulation of enzyme synthesis // Microbiology (Moscow). 2006. V. 75. P. 20‒24.
Aguilera L., Campos E., Giménez R., Badía J., Aguilar J., Baldoma L. Dual role of LldR in regulation of the lldPRD operon, involved in L-lactate metabolism in Escherichia coli // J. Bacteriol. 2008. V. 190. P. 2997‒3005.
Amar K.M., Lawrence T.D. Natural fibers, biopolymers, and biocomposites // CRC Press. 2005. P. 528‒569.
Arinbasarova A., Machulin A., Biryukova E., Sorokin V., Medentsev A., Suzina N. Structural changes in the cell envelope of Yarrowia lipolytica yeast under stress conditions // Can. J. Microbiol. 2018. V. 64. P. 359‒365. https://doi.org/10.1139/cjm-2018-0034
Ashok Y., Maksimainen M.M., Kallio T., Kilpeläinen P., Lehtiö L. FMN-dependent oligomerization of putative lactate oxidase from Pediococcus acidilactici // PLoS One. 2020. V. 15. Art. e0223870. https://doi.org/10.1371/journal.pone.0223870
Atack J.M., Ibranovic I., Ong C.-L.Y., Djoko K.Y., Chen N.H., Hoven R., Jennings M., Edwards J.L., McEwan A.G. A role for lactate dehydrogenases in the survival of Neisseria gonorrhoeae in human polymorphonuclear leukocytes and cervical epithelial cells // J. Infect. Dis. 2014. V. 210. P. 1311‒1318.
Berry D., Reinisch W. Intestinal microbiota: a source of novel biomarkers in inflammatory bowel diseases? // Best Pract. Res. Clin. Gastroenterol. 2013. V. 27. P. 47‒58.
Black M.T., Gunn F.J., Chapman S.K., Reid G.A. Structural basis for the kinetic differences between flavocytochrome b2 from the yeasts Hansenula anomala and Saccharomyces cerevisiae // Biochem. J. 1989. V. 263. P. 973‒976.
Braymer J.J., Freibert S.A., Rakwalska-Bange M., Lill R. Mechanistic concepts of iron-sulfur protein biogenesis in Biology // Biochim. Biophys. Acta. Molecular Cell Research. 2021. V. 1868. P. 118863.
Bulut S., Elibol M., Ozer D. Effect of different carbon sources on L(+)-lactic acid production by Rhizopus oryzae // Biochem. Eng. J. 2004. V. 21. P. 33–37.
Chai Y., Kolter R., Losick R. A widely conserved gene cluster required for lactate utilization in Bacillus subtilis and its involvement in biofilm formation // Bacteriol. 2009. V. 191. P. 2423‒2430.
Chapman S.K., Reid G.A., Bell C., Short D., Daff S. Flavocytochrome b2: an ideal model system for studying protein-mediated electron transfer // Biochem. Soc. Trans. 1996. V. 24. P. 73‒77.
Chapman S.K., White S.A. and Reid G.A. Flavocytochrome b2 // Adv. Inorg. Chem. 1991. V. 36. P. 257‒301.
Cunha-Silva H., Pires F., Dias-Cabral A.C., JuliaArcos-Martinez M. Inhibited enzymatic reaction of crosslinked lactate oxidase through a pH-dependent mech // Colloids and Surfaces B: Biointerfaces. 2019. V. 184. Art. 110490. https://doi.org/10.1016/j.colsurfb.2019.110490
Datta R., Henry M.J.R. Lactic acid: recent advances in products, processes and technologies // Chem. Technol. Biotechnol. 2006. V. 81. P. 1119–1129.
Duncan J.D., Wallis J.O., Azari M.R. Purification and properties of Aerococcus viridans lactate oxidase // Biochem. Biophys. Res. Commun. 1989. V. 164. P. 919‒926.
Exley R.M., Shaw J., Mowe E., Sun Y.-H., West N.P., Williamson M., Botto M., Smith H., Tang C.M. Available carbon source influences the resistance of Neisseria meningitidis against complement // J. Exp. Med. 2005. V. 201. P. 1637‒1645.
Exley R.M., Wu H., Shaw J., Schneider M.C., Smith H., Jerse A.E., Tang C.M. Lactate acquisition promotes successful colonization of the murine genital tract by Neisseria gonorrhoeae // Infect. Immun. 2007. V. 75. P. 1318‒1324.
Flieger M., Kantorova M., Prell A., Rezanka T., Votruba J. Biodegradable plastics from renewable sources // Folia Microbiol. 2003. V. 48. P. 27‒44.
Fraaije M.W., Van Berkel W.J.H., Benen J.A., Visser J., Mattevi A. A novel oxidoreductase family sharing a conserved FAD-binding domain // Trends Biochem. Sci. 1998. V. 23. P. 206‒207.
Furuichi M., Suzuki N., Dhakshnamoorhty B., Minagawa H., Yamagishi R., Watanabe Y., Goto Y., Kaneko H., Yoshida Y., Yagi H., Waga I., Kumar P.K.R., Mizuno H. X-ray structures of Aerococcus viridans lactate oxidase and its complex with D-lactate at pH 4.5 show an alpha-hydroxyacid oxidation mechanism // J. Mol. Biol. 2008. V. 378. P. 436‒446.
Futai M., Kimura H. Inducible membrane-bound L-lactate dehydrogenase from Escherichia coli. Purification and properties // J. Biol. Chem. 1977. V. 252. P. 5820‒5827.
Gao C., Hu C., Zheng Z., Ma C., Jiang T., Dou P., Zhang W., Che B., Wang Y., Lv M., Xu P. Lactate utilization is regulated by the FadR-type regulator LldR in Pseudomonas aeruginosa // J. Bacteriol. 2012. V. 194. P. 2687‒2692. https://doi.org/10.1128/JB.06579-11
Gao C., Qiu J., Ma C., Xu P. Efficient production of pyruvate from D,L-lactate by the lactate-utilizing strain Pseudomonas stutzeri SDM // PLoS One. 2012. V. 7. Art. e40755. https://doi.org/10.1371/journal.pone.0040755
Gao C., Wang Y., Zhang Y., Lv M., Dou P., Xu P., Maa C. NAD-independent L-lactate dehydrogenase required for L-lactate utilization in Pseudomonas stutzeri A1501 // J. Bacteriol. 2015. V. 197. P. 2239‒2247.
Gao C., Zhang W., Ma C., Liu P., Xu P. Kinetic resolution of 2-hydroxybutanoate racemic mixtures by NAD-independent L-lactate dehydrogenase // Bioresour. Technol. 2011. V. 102. P. 4595‒4599.
Garvie E.I. Bacterial lactate dehydrogenases // Microbiol. Rev. 1980. V. 44. P. 106‒139.
Georgi T., Engels V., Wendisch V.F. Regulation of L-lactate utilization by the FadR-type regulator LldR of Corynebacterium glutamicum // J. Bacteriol. 2008. V. 190. P. 963‒971. https://doi.org/10.1128/JB.01147-07
Gladden L.B. Lactate metabolism: a new paradigm for the third millennium // J. Physiol. 2004. V. 558. P. 5‒30. https://doi.org/10.1113/jphysiol.2003.058701
Goers L., Ainsworth C., Goey C.H., Kontoravdi C., Freemont P.S., Polizzi K. Whole-cell Escherichia coli lactate biosensor for monitoring mammalian cell cultures during biopharmaceutical production // Biotechnol. Bioeng. 2017. V. 114. P. 1290‒1300.
Goffin P., Lorquet F., Kleerebezem M., Hols P. Major role of NAD-dependent lactate dehydrogenases in aerobic lactate utilization in Lactobacillus plantarum during early stationary phase // J. Bacteriol. 2004. V. 186. V. 19. P. 6661‒6666.
Goldstein E.J., Citron D.M., Peraino V.A., Cross S.A. Desulfovibrio desulfuricans bacteremia and review of human Desulfovibrio infections // J. Clin. Microbiol. 2003. V. 41. P. 2752‒2754.
Hiraka K., Kojima K., Tsugawa W., Asano R., Ikebukuro K., Sode K. Rational engineering of Aerococcus viridans L-lactate oxidase for the mediator modification to achieve quasi-direct electron transfer type lactate sensor // Biosens. Bioelectron. 2019. V. 151. P. 111974. https://doi.org/10.1016/j.bios.2019.111974
Jasso-Chávez R., Torres-Márquez E., Moreno-Sanchez R. The membrane-bound and lactate dehydrogenase activities in mitochondria from Euglena gracilis // Arch. Biochem. Biophys. 2001. V. 390. P. 295‒303. https://doi.org/10.1006/abbi.2001.2353
Jasso-Chavez R., Garcia-Cano I., Marin-Hernandez A., Mendoza-Cozat D., Rendon J.L., Moreno-Sanchez R. The bacterial-like lactate shuttle components from heterotrophic Euglena gracilis // Biochim. Biophys. Acta ‒ Bioenergetics. 2005. V. 1709. P. 181‒190.
Jiang T. Gao C., Su F., Zhang W., Hu C., Dou P., Zheng Z., Tao F., Ma C., Xu P. Genome sequence of Pseudomonas stutzeri SDM-LAC, a typical strain for studying the molecular mechanism of lactate utilization // J. Bacteriol. 2012. V. 194. P. 894‒895.
Jiang T., Gao C., Ma C., Xu P. Microbial lactate utilization: enzymes, pathogenesis, and regulation // Trends Microbiol. 2014. V. 22. P. 589‒599.
Kean K.M., Karplus P.A. Structure and role for active site lid of lactate monooxygenase from Mycobacterium smegmatis // Protein Sci. 2019. V. 28. P. 135‒149. https://doi.org/10.1002/pro.3506
Koman V.B., Santschi C., Martin O.J.F. Multiscattering-enhanced optical biosensor: multiplexed, non-invasive and continuous measurements of cellular processes // Biomed. Opt. Express. 2015. V. 6. P. 2353‒2365.
Kubera B., Hubold C., Otte S., Lindenberg A.S., Zeiss I., Krause R., Steinkamp M., Klement J., Entringer S., Pellerin L., Peters A. Rise in plasma lactate concentrations with psychosocial stress: a possible sign of cerebral energy demand // Obes. Facts. 2012. V. 5. P. 384‒392. https://doi.org/10.1159/000339958
Labeyrie F., Baydras A. Differences in quaternary structure and constitutive chains between two homologous forms of cytochrome b2 (L-lactate: cytochrome c oxodoreductase) // Eur. J. Biochem. 1972. V. 25. P. 33‒40.
Lederer F. Another look at the interaction between mitochondrial cytochrome c and flavocytochrome b2 // Eur. Biophys. J. 2011. V. 40. P. 1283‒1299.
Leiros I., Wang E., Rasmussen T., Oksanen E., Repo H., Petersen S.B., Heikinheimoa P., Houghb E. The 2.1 A structure of Aerococcus viridans L-lactate oxidase (LOX) // Acta Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. 2006. V. 62. P. 1185‒1190. https://doi.org/10.1107/S1744309106044678
Linder M.C., Hazegh-Azam M. Copper biochemistry and molecular biology // Am. J. Clin. Nutr. 1996. V. 63. P. 797‒811.
Lockridge O., Massey V., Sullivan P.A. Mechanism of action of the flavoenzyme lactate oxidase // J. Biol. Chem. 1972. V. 247. P. 6097‒8106.
Maeda-Yorita K., Aki K., Sagai H., Misaki H., Massey V. L‑Lactate oxidase and L-lactate monooxygenase: mechanistic variations on a common structural theme // Biochimie. 1995. V. 77. P. 631‒642.
Mizutani F., Sasaki K., Shimura Y. Sequential determination of L-lactate and lactate dehydrogenase with immobilized enzyme electrode // Anal. Chem. 1983. V. 55. P. 35‒38.
Morimoto Y., Yorita K., Aki K., Misaki H., Massey V. L-lactate oxidase from Aerococcus viridans crystallized as an octamer. Preliminary X-ray studies // Biochimie. 1998. V. 80. P. 309‒312.
Okano K., Tanaka T., Ogino C. Biotechnological production of enantiomeric pure lactic acid from renewable resources: recent achievements, perspectives, and limits // Appl. Microbiol. Biotechnol. 2010. V. 85. P. 413‒423.
Pajot P., Claisse M. Utilization by yeast of D-lactate and L‑lactate as sources of energy in the presence of antimycin // Eur. J. Biochem. 1974. V. 49. P. 275‒285.
Pallotta M.L., Valenti D., Iacovino M., Passarella S. Two separate pathways for L-lactate oxidation by Saccharomyces cerevisiae mitochondria which differ in energy production and carrier involvement // Biochim. Biophys. Acta. 2004. V. 1608. P. 104‒113.
Rathee K., Dhull V., Dhull R., Singh S. Biosensors based on electrochemical lactate detection: a comprehensive review // Biochem. Biophys. Reports. 2016. V. 5. P. 35‒54. https://doi.org/10.1016/j.bbrep.2015.11.010
Reddy G., Altaf M., Naveena B.J. Amylolytic bacterial lactic acid fermentation. A review // Biotechnol. Adv. 2008. V. 26. P. 22‒34.
Sakharov D.A.S.M.U., Vagin M.Yu., Yashina E.I., Karyakin A.A., Tonevitsky A.G. Relationship between lactate concentrations in active muscle sweat and whole blood // Bull. Experim. Biol. Med. 2010. V. 150. P. 83‒85.
Skory C.D. Isolation and expression of lactate dehydrogenase genes from Rhizopus oryzae // Appl. Environ. Microbiol. 2000. V. 66. P. 2343‒2348.
Smith H., Yates E., Cole J., Parsons N. Lactate stimulation of gonococcal metabolism in media containing glucose: mechanism, impact on pathogenicity, and wider implications for other pathogens // Infect. Immun. 2001. V. 69. P. 6565‒6572.
Smith H., Tang C., Exley R. Effect of host lactate on gonococci and meningococci: new concepts on the role of metabolites in pathogenicity // Infect. Immun. 2007. V. 75. P. 4190‒4198.
Solmo M.L. L-lactic dehydrogenase in aerobic yeast. Comparison of the properties of the bound enzyme and the soluble enzyme // Biochim. Biophys. Acta. 1962. V. 65. P. 333‒346.
Spehar-Délèze A.-M., Anastasova S., Vadgama P. Monitoring of lactate in interstitial fluid, saliva and sweat by electrochemical biosensor: the uncertainties of biological interpretation // Chemosensors. 2021. V. 9. Art. 195. P. 2‒17.
Stansen C., Delaunay S., Eggeling L., Goergen J.L., Wendisch V.F. Characterization of a Corynebacterium glutamicum lactate utilization operon induced during temperature-triggered glutamate production // Appl. Environ. Microbiol. 2005. V. 71. P. 5920‒5928.
Stoisser T., Brunsteiner M., Wilson D.K., Nidetzky B. Conformational flexibility related to enzyme activity: evidence for a dynamic active-site gatekeeper function of Tyr215 in Aerococcus viridans lactate oxidase // Sci. Rep. 2016. V. 6. P. 27892.
Sullivan P.A., Soon C.Y., Schreurs W.J., Cutfield J.F., Shepherd M.G. The structure of L-lactate oxidase from Mycobacterium smegmatis // Biochem. J. 1977. V. 165. P. 375‒383.
Sztajer H., Wang W., Lünsdorf H., Stocker A., Schmid R.D. Purification and some properties of a novel microbial lactate oxidase // Appl. Microbiol. Biotechnol. 1996. V. 45. P. 600‒606.
Thomas M.T., Shepherd M., Poole R.K., van Vliet A.H., Kelly D.J., Pearson B.M. Two respiratory enzyme systems in Campylobacter jejuni NCTC 11168 contribute to growth on L-lactate // Environ. Microbiol. 2011. V. 13. P. 48‒61.
Umena Y., Yorita K., Matsuoka T., Abe M., Kita A., Fukui K., Tsukihara T, Morimoto Y. Crystallization and preliminary X-ray diffraction study of L-lactate oxidase (LOX), R181M mutant, from Aerococcus viridans // Acta Cryst. 2005. V. 61. P. 439‒441.
Vita N., Valette O., Brasseur G., Lignon S., Denis Y., Ansaldi M., Dolla A., Pieulle L. The primary pathway for lactate oxidation in Desulfovibrio vulgaris // Front. Microbiol. 2015. V. 6. Art. 606. https://doi.org/10.3389/fmicb.2015.00606
Wang Y., Wu J., Lv M., Shao Z., Hungwe M., Wang J., Bai X., Xie J., Wang Y., Geng W. Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry // Front. Bioeng. Biotechnol. 2021. V. 9. P. 612285.
Xia Z.X., Mathews F.S. Molecular structure of flavocytochrome b2 at 2.4 Å resolution // J. Mol. Biol. 1990. V. 212. P. 837‒863.
Yu R.-Chui, Hang D. Purification and characterization of NAD-dependent lactate dehydrogenase from Rhizopus oryzae // Food Chem. 1991. V. 41. P. 219‒225.
Zhang Z.Y., Jin B., Kelly J.M. Production of lactic acid from renewable materials by Rhizopus fungi // Biochem. Eng. J. 2007. V. 35. P. 251‒263.
Zhou Y., Domínguez J.M., Cao N., Du J., Tsao G.T. Optimization of L-lactic acid production from glucose by Rhizopus oryzae ATCC 52311 // Appl. Biochem. Biotechnol. 1999. V. 77‒79. P. 401‒407.
Дополнительные материалы отсутствуют.


