Микробиология, 2022, T. 91, № 3, стр. 312-320
Гликополимеры клеточной стенки как диагностический признак Arthrobacter crystallopoietes
Н. В. Потехина a, *, Е. В. Арискина b, А. С. Шашков c, Е. М. Тульская a, Л. И. Евтушенко b
a Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
b ФИЦ Пущинский научный центр биологических исследований РАН, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина, Всероссийская коллекция микроорганизмов
142290 Пущино, Россия
c Институт органической химии имени Н.Д. Зелинского РАН
119991 Москва, Россия
* E-mail: potekhina56@mail.ru
Поступила в редакцию 26.11.2021
После доработки 18.01.2022
Принята к публикации 21.01.2022
- EDN: WYVBCD
- DOI: 10.31857/S002636562230005X
Аннотация
Изучен состав и структура гликополимеров клеточной стенки Arthrobacter crystallopoietes ВКМ Аc-1107Т (семейство Micrococcaceae, филум Actinobacteria), отнесенного ранее к группе “Arthrobacter globiformis” на основе высокого сходства последовательностей генов 16S рРНК и традиционных хемотаксономических признаков. С использованием химических и ЯМР-спектроскопических методов идентифицированы тейхоевая кислота – 1,3-поли(глицерофосфат), замещенный остатками β-глюкозы, и дигликозил-1-фосфатный полимер с повторяющимся звеном -6)-α-D-GalpNAc-(1 → 6)-α-D-GlcpNAc-(1-P-. Результаты филогеномного (таксогеномного) анализа – определения средней идентичности аминокислот (AAI) и сходства консервативных белков (POCP) – свидетельствуют о принадлежности A. crystallopoietes к новому роду. При этом состав и структура гликополимеров клеточной стенки могут рассматриваться как важный диагностический признак этого рода, который будет описан в будущем на основе A. сrystallopoietes.
Изучение полимеров клеточных стенок микроорганизмов важно для ряда областей фундаментальной и прикладной науки, в том числе, систематики микроорганизмов. Хотя в последние годы развитие систематики прокариот основывается преимущественно на данных филогеномики (таксогеномики), сведения о фенотипических характеристиках, в частности, хемотаксономических, отражающих химический состав клеток и клеточных стенок, являются по-прежнему актуальными (Сhun et al., 2018; Nouioui et al., 2018; Salam et al., 2020).
Основным гликополимером клеточных стенок грамположительных бактерий является, как известно, пептидогликан, характеризующийся высокой степенью структурного разнообразия (Schleifer, Kandler, 1972; Schumann, 2011). Типы и вариации структур пептидогликана служат важными диагностическими признаками таксонов разного ранга (Schumann et al., 2009; Schumann, 2011). Помимо пептидогликана клеточные стенки грамположительных бактерий обычно содержат вторичные гликополимеры (secondary cell wall glyсopolymers; Kohler et al., 2009). К ним относятся ковалентно связанные с пептидогликаном тейхоевые кислоты и поли(гликозилфосфаты), а также не содержащие фосфата (бесфосфатные) гликополимеры ‒ нейтральные и кислые, в том числе тейхуроновые, тейхулозоновые и связанные с мембраной липотейхоевые кислоты (Kohler et al., 2009; Potekhina et al., 2011; Шашков с соавт., 2020а, б; Потехина с соавт., 2021).
Вторичные гликополимеры бактерий в сравнении с пептидогликанами являются менее изученными в таксономическом аспекте. Однако имеющиеся в литературе сведения указывают на то, что набор, структуры и отдельные структурные компоненты гликополимеров могут быть специфичными для видов, родов и высших таксонов актинобактерий (Takeuchi, Yokota, 1989; Schumann et al., 2009; Potekhina et al., 2011; Evtushenko, Ariskina, 2015; Goodfellow, Jones, 2015; Nouioui et al., 2018; Шашков с соавт. 2020б; Потехина с соавт. 2021).
Вид A. crystallopoietes входит в состав ревизованного в 2016 г. рода Arthrobacter, но занимает обособленное от A. globiformis и других видов группы “A. globiformis” (A. humicola, A. oryzae и A. pascens) положение на филогенетических дендрограммах, построенных на основе последовательностей генов 16S рРНК с использованием разных методов (Busse et al., 2012; Busse, 2016). A. crystallopoietes, однако, был условно отнесен к группе “A. globiformis” с учетом его высокого сходства с A. globiformis по последовательностям генов 16S рРНК (97.6%), а также сходства с A. globiformis и другими видами группы “A. globiformis” по ключевым хемотаксономическим признакам – пептидогликану типа A3α, преобладающему менахинону MK-9(H2) и составу полярных липидов (Busse et al., 2012; Busse, 2016).
Филогенетическая обособленность вида A. crystallopoietes, наряду с его отличиями от видов группы “A. globiformis” по составу межпептидного мостика пептидогликана (количеству остатков аланина), стали основанием для предположения о принадлежности A. crystallopoietes к отдельной группе родового ранга, отличной от “A. globiformis” (Busse, 2016).
Кроме того, согласно ранним работам (Садиков с соавт. 1983; Takeuchi, Yokota, 1989), A. crystallopoietes отличается от представителей группы “A. globiformis” (A. globiformis и A. pascens) по составу гликополимеров клеточной стенки. Клеточная стенка A. crystallopoietes содержит тейхоевую кислоту и гликозилфосфатный полимер, в то время как A. globiformis и A. pascens характеризуются наличием бесфосфатных гликополимеров. Однако точные химические структуры вышеупомянутых полимеров не установлены. Нет также информации о наличии или отсутствии в клеточной стенке A. crystallopoietes нейтральных полисахаридов, характерных для A. globiformis, A. pascens, A. citreus, A. ramosus и некоторых других видов Arthrobacter (Садиков с соавт.б 1983; Takuchi, Yokota, 1989; Zhou et al., 2009; Busse, 2016; Busse, Moore, 2018; Потехина с соавт. 2021). Кроме того, выводы о наличии или отсутствии в клеточной стенке гликополимеров того или иного типа, основанные на результатах исследований с использованием только деструктивных химических методов (анализ продуктов кислотной деградации клеточных стенок и выделенных из них препаратов углеводсодержащих полимеров), могут быть ошибочными. Для подтверждения или установления структуры полимеров требуется использование методов ЯМР-спектроскопии (Fiedler, Schäffler, 1987; Takeuchi, Yokota, 1989; Шашков с соавт. 2020а, б).
Следует также отметить, что с накоплением данных о полных геномах и развитием филогеномики (таксогеномики) стало очевидно, что результатов сравнительного изучения генов 16S рРНК часто недостаточно для разграничения родов (Konstantinidis, Tiedje, 2005; Qin et al., 2014). Для установления родовой принадлежности прокариотных микроорганизмов и определения структуры таксонов выше видового ранга лучшее разрешение обеспечивают методы сравнительной геномики, в их числе определение средней идентичности аминокислот (AAI) и сходства консервативных белков (POCP) (Konstantinidis, Tiedje, 2005; Kim et al., 2021) и POCP (Qin et al., 2014).
Целью настоящей работы было определение состава и структур вторичных гликополимеров клеточной стенки типового штамма вида А. сrystallopoietes, сопровождаемое уточнением таксономического статуса этого вида на основе таксогеномного анализа.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изученный штамм A. crystallopoietes ВКМ Ac-1107T (=DSM 20117T) получен из Всероссийской коллекции микроорганизмов (ВКМ) (https:// www.vkm.ru).
Культуру выращивали аэробно при 28°С в колбах на качалке до середины логарифмической фазы роста на пептонно-дрожжевой среде (Potekhina et al., 2011). Клеточные стенки получали методом дифференциального центрифугирования после разрушения клеток на ультразвуковом дезинтеграторе UP100H (“Hielscher”, Германия). Выделение гликополимеров из клеточных стенок проводили трихлоруксусной кислотой, как описано в работе (Potekhina et al., 2011). Для изучения качественного состава клеточной стенки и препаратов гликополимеров проводили кислотный гидролиз 2 M HCl, 3 ч, 100°С; продукты гидролиза анализировали методом электрофореза и хроматографии на бумаге как описано ранее (Potekhina et al., 2011).
Полную структуру полимеров, включающую состав мономеров, положение фосфодиэфирных связей в цепи, а также положение и конфигурацию гликозидных связей устанавливали методом ЯМР-спектроскопии. ЯМР-спектры препаратов снимали в растворах 99.96%-ной дейтерированной воды при температурах, обеспечивающих минимальное перекрывание остаточного сигнала дейтерированной воды с сигналами полимеров, на спектрометре Avance 600 (“Bruker”, Германия). Для отсчета химических сдвигов использовали внутренние стандарты натриевой соли 3-(триметилсилил)-2,2,3,3-тетрадейтеропропионовой кислоты TSP (δH 0.0 и δC ‒1.6) и внешний стандарт – 80%-ную фосфорную кислоту (δP 0.0) при 313 К. Двумерные ЯМР-эксперименты выполняли с использованием стандартного математического обеспечения (“Bruker Optik GmbH”, Германия). Время смешивания 150 мс и время спин-лока 250 мс были выбраны для экспериментов по двумерной спектроскопии 1H,1H ROESY и TOCSY соответственно. Двумерные 1H,13С HSQC, HMBC и 1Н,31P HMBC-эксперименты были оптимизированы для константы спин-спинового взаимодействия JH,C 8 Гц.
Филогеномный (таксогеномный) анализ проводили на основе 24 геномных последовательностей, доступных в базах данных GenBank и GOLD: Acaricomes phytoseiuli DSM 14247T AQXM00000000, Arthrobacter agilis DSM 20550T VHIM00000000, A. citreus DSM 20133T VTFV00000000, A. crystallopoietes DSM 20117T CP018863, A. globiformis NBRC 12137T, BAEG00000000, A. koreensis DSM 16760T WACG00000000, A. luteolus DSM 13067T WBJQ00000000, A. oryzae DSM 25586T RBIR00000000, A. pascens DSM 545T JAFHKT000000000, A. pigmenti DSM 16403T JAATJL000000000, A. psychrolactophilus B7T QJVC00000000, A. woluwensis DSM 10495T FNSN00000000, Citricoccus muralis DSM 14442T QREH00000000, Glutamicibacter protophormiae DSM 20168T JAGIOJ000000000, Haematomicrobium sanguinis DSM 21259T JIAG00000000, Micrococcus luteus NCTC 2665T LS483396, Paenarthrobacter aurescens NBRC 12136T BJMD00000000, Paeniglutamicibacter sulfureus DSM 20167T Gold Id:Ga0480495, Pseudarthrobacter polychromogenes CGMCC 1.1927T BMKU00000000, Pseudoglutamicibacter cumminsii DSM 10493T JAFBCO000000000, Psychromicrobium silvestre DSM 102047T JACBYQ000000000, Sinomonas atrocyanea KCTC 3377T CP014518, Specibacter cremeus C1-50T RWKQ00000000.
Показатели AAI рассчитывали по аминокислотным последовательностям аннотированных полных геномов на портале http://enve-omics.ce.gatech.edu/ с использованием калькулятора AAI (Rodriguez-R, Konstantinidis, 2016). Значения POCP рассчитывали с использованием скрипта runPOCP.sh (Pantiukh, Grouzdev, 2017) на основе ранее описанного подхода (Qin et al., 2014).
Дендрограмма, отражающая сходство геномов по 90 коровым генам (длина белковых последовательностей – 31358 аминокислот) была построена по методу максимального правдоподобия (Maximum Likelihood, ML) c применением программ web-сервера M1CR0B1AL1Z3R (https://microbializer.tau.ac.il/index.html; Avram et al., 2019). В качестве внешней группы использовали штамм Microbacterium lacticum DSM 20427.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В кислотных гидролизатах (2 M HCl, 3 ч, 100°С) клеточной стенки A. crystallopoietes ВКМ Аc-1107Т и выделенных из нее методом экстракции трихлоруксусной кислотой препаратов гликополимеров были идентифицированы продукты деградации, характерные для тейхоевых кислот (моно- и бисфосфаты глицерина), а также глюкоза, глюкозамин и галактозамин. Анализ препарата гликополимеров с помощью электрофореза выявил две фракции с подвижностью mGroP 0.68 и mGroP 0.9, что указывало на наличие не менее двух фосфатсодержащих полимеров.
Спектр ЯМР 13С (рис. 1) препарата гликополимеров содержал сигналы разной интенсивности, что характерно для полимера с нерегулярной структурой или смеси полимеров. Часть сигналов (табл. 1), судя по величине химических сдвигов δС 92.1 м.д. (остаток GNα) и 96.4 м.д. (остаток GNβ), принадлежала остаткам сахаров со свободной гидроксильной группой при С-1. Четыре сигнала с δС 98.7 м.д. (остаток GaN), 98.4 м.д. (остаток GaN'), 98.2 м.д. (остаток GaN'') и 103.6 м.д. (остаток G) были характерны для аномерных атомов углерода при гликозидных связях, и один сигнал с δС 95.1 м.д. принадлежал аномерному атому углерода при фосфодиэфирной связи (табл. 1).
Рис. 1.
Спектр 13С ЯМР гликополимеров клеточной стенки Arthrobacter crystallopoietes ВКМ Ac-1107T. Арабские цифры − номера атомов в остатках G (β-Glcp), GaN (α-GalpNAc), GN (α-GlcpNAc), GNα (концевой остаток α-GlcpNAc), GNβ (концевой остаток β-GlcpNAc) и Gro (остаток глицерина); t (terminal) − концевой остаток.

Таблица 1.
Химические сдвиги в спектрах 1H и 13C ЯМР гликополимеров клеточной стенки Arthrobacter crystallopoietes ВКМ Ac-1107T и фрагментов Полимера I
| Остаток | Химические сдвиги ЯМР 13C (δC TSP –1.6) и 1H (δH TSP 0.0) | |||||
|---|---|---|---|---|---|---|
| C-1 H-1 |
C-2 H-2 |
C-3 H-3 (H-3e,3a) |
C-4 H-4 |
C-5 H-5 |
C-6 H-6 (H-6a,6b) |
|
| Полимер I | ||||||
| -6)-α-D-GalpNAc-(1→ (GaN) | 98.7 4.90 |
51.1** 4.21 |
68.8 3.96 |
69.4 4.05 |
70.9 4.14 |
65.8* 4.04, 4.00 |
| →6)-α-D-GlcpNAc-(1-P- (GN) | 95.1* 5.47 |
55.0** 3.96 |
72.0 3.79 |
70.6 3.93 |
73.2 3.99 | 66.7 4.08, 3.69 |
| Дисахариды Полимера I | ||||||
| α-GalpNAc-(1→ (GaNꞌ) | 98.4 4.95 |
51.1 4.18 |
68.9 3.96 |
69.7 4.01 |
72.2 4.00 |
62.4 3.77, 3.75 |
| →6)-α-D-GlcpNAc (GNα) | 92.1 5.20 |
55.3 3.88 |
72.0 3.76 |
71.0 3.60 |
71.6 3.98 |
66.8 4.02, 3.67 |
| α-D-GalpNAc-(1→ (GaNꞌꞌ) | 98.2 4.95 |
51.0 4.21 |
69.0 3.96 |
69.7 4.01 |
72.2 4.00 | 62.4 3.77, 3.75 |
| →6)-β-D-GlcpNAc (GNβ) | 96.4 4.72 |
57.9 3.68 |
75.2 3.53 |
70.7 3.59 |
75.6 3.59 |
66.7 3.97, 3.74 |
| Полимер II | ||||||
| -1)-snGro-(3-P- (Gro) 2) ↑ |
65.9*** 4.21, 4.18 |
78.2 4.21 |
66.2*** 4.12, 4.11 |
|||
| β-D-Glcp-(1 (G) | 103.6 4.63 |
74.4 3.32 |
76.9 3.52 |
70.9 3.40 | 77.2 3.47 |
61.5 3.92, 3.77 |
Расшифровать сигналы в одномерных спектрах и сделать выводы о структуре полимеров удалось на основе двумерных гомоядерных 1Н,1Н COSY, TOCSY и ROESY, а также гетероядерных 1Н,13С HSQC и HMBC и 1Н,31P HMBC-экспериментов (спектры не приводятся).
Анализ спектров 1Н,1Н COSY, TOCSY и ROESY показал наличие в полимере замещенных по гидроксилу при С-6 остатков 2-ацетамидо-2-дезокси-α-галактопиранозы (α-GalpNAc, остаток GaN), 2-ацетамидо-2-дезокси-α-глюкопиранозы (α-GlcpNAc, остаток GNα) и 2-ацетамидо-2-дезокси-β-глюкопиранозы (β-GlcpNAc, остаток GNβ), а также незамещенных остатков β-глюкопиранозы (β-Glcp, остаток G) и тризамещенных остатков глицерина (остаток Gro).
Спектр 1Н,31P HMBC показал, что остатки фосфорной кислоты локализованы по гидроксилу при С-1 (остаток GNα) и С-6 (остаток GaN), что характерно для полимерной цепи, построенной из дигликозилфосфатных звеньев (Полимер I), а также по гидроксилам при С-1,3 остатков глицерина, составляющих цепь тейхоевой кислоты (Полимер II).
Анализ двумерного 1Н,13С HSQC спектра позволил идентифицировать все сигналы в одномерном спектре ЯМР 13С (табл. 1). Из анализа химических сдвигов следует, что остатки GNα и GNβ замещены по гидроксилу при С-6 (слабопольный сдвиг 66.7 и 66.8 м.д.; 61–62 м.д. в соответствующих незамещенных остатках), a остаток глицерина дополнительно замещен по гидроксилу при С-2 (78.2 м.д.).
Окончательное заключение о строении цепей полимеров следовало из анализа спектров 1Н, 1Н ROESY и 1Н, 13С HMBC (табл. 1). В спектре 1Н, 1Н ROESY наблюдалась корреляция аномерных протонов остатков GaN и протонов при С-6 остатков GN (4.90/4.08; 3.69), что свидетельствовало о пространственной близости этих атомов и наличии 1→6 связи между остатками. Корреляционный пик Н-1 (G)/Н-2 (Gro) (4.63/4.21) типичен для 1→2 связи между этими остатками. Спектр 1Н, 13С HMBC содержал корреляционные пики для атомов остатков, соединенных гликозидной связью: H-6,6′ (GNα)/C-1 (GaNꞌ) (4.02; 3.67/98.4) и (GNβ)/C-1 (GaNꞌꞌ) (3.97; 3.74/98.2) и H-2 (Gro)/C-1 (G) (4.21/103.6). Эти пики соответствуют структуре повторяющихся звеньев двух полимеров: -6)-α-GalpNAc-(1→6)-α-GlcpNAc-(1-P- (Полимер I) и -1)-[β-Glcp-(1→2)]-snGro-(3-P- (Полимер II).
Таким образом, с использованием ЯМР-спектроскопических методов нами впервые установлены полные структуры углеводсодержащих полимеров клеточной стенки A. crystallopoietes. Идентифицированные полимеры представляют собой тейхоевую кислоту – 1,3-поли(глицерофосфат), замещенный остатками β-глюкозы, и дигликозил-1-фосфатный полимер с повторяющимся звеном -6)-α-D-GalpNAc-(1→6)-α-D-GlcpNAc-(1-P-. Бесфосфатные гликополимеры, свойственные другим изученным видам группы “A. globiformis” и Arthrobacter sensu lato (Садиков с соавт., 1983; Takeuchi, Yokota, 1989), у A. сrystallopoietes обнаружены не были.
Для уточнения таксономического статуса A. сrystallopoietes нами были определены значения AAI и POCP (табл. 2). Дендрограмма (рис. 2) отражает сходство исследованных штаммов по показателям POCP (90 коровых генов, длина белковых последовательностей 31358 аминокислот). Как видно, A. сrystallopoietes образует общую группу с A. citreus, но оба вида обособлены друг от друга, а также от A. globiformis, и других видов Micrococcaceae, о чем свидетельствуют значения POCP и AAI на родовом уровне (табл. 2).
Таблица 2.
Сходство (%) средней идентичности аминокислот (AAI) и консервативных белков (POCP) 23 видов актинобактерий
| № | Виды | Cправа от диагонали – AAI; слева от диагонали – POCP | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | ||
| 1 | Arthrobacter crystallopoietes | * | 61.5 | 61.8 | 58.4 | 59.4 | 60.1 | 60.2 | 56.3 | 57.3 | 52.5 | 50.8 | 46.8 | 54.3 | 52.2 | 47.9 | 46.2 | 59.0 | 62.9 | 60.0 | 39.9 | 49.4 | 57.3 | 53.8 |
| 2 | Arthrobacter globiformis | 64.6 | * | 79.9 | 70.0 | 55.5 | 55.6 | 55.3 | 56.9 | 56.2 | 56.9 | 56.5 | 48.6 | 47.9 | 48.0 | 48.9 | 43.9 | 69.4 | 54.7 | 72.1 | 37.8 | 53.4 | 61.0 | 56.6 |
| 3 | Arthrobacter pascens | 65.0 | 84.1 | * | 68.4 | 55.8 | 55.5 | 55.5 | 56.8 | 56.9 | 56.6 | 56.3 | 49.3 | 48.2 | 48.5 | 49.1 | 44.8 | 69.1 | 55.5 | 72.2 | 38.4 | 53.1 | 60.7 | 56.2 |
| 4 | Arthrobacter oryzae | 64.2 | 77.3 | 77.4 | * | 59.0 | 58.9 | 58.0 | 59.1 | 55.9 | 58.1 | 57.5 | 52.0 | 47.6 | 48.9 | 51.4 | 46.7 | 65.8 | 55.2 | 68.4 | 39.5 | 56.7 | 64.8 | 59.3 |
| 5 | Arthrobacter citreus | 65.6 | 62.9 | 63.0 | 63.2 | * | 89.4 | 83.4 | 63.7 | 59.5 | 57.1 | 55.7 | 54.8 | 55.1 | 54.2 | 55.2 | 52.3 | 60.2 | 57.5 | 58.6 | 45.0 | 55.5 | 55.9 | 55.5 |
| 6 | Arthrobacter koreensis | 65.8 | 63.0 | 63.1 | 63.1 | 91.9 | * | 83.2 | 64.3 | 59.8 | 57.6 | 55.3 | 55.4 | 55.6 | 54.4 | 55.9 | 53.3 | 59.2 | 58.1 | 58.9 | 46.4 | 55.5 | 55.8 | 54.6 |
| 7 | Arthrobacter luteolus | 65.7 | 62.4 | 62.9 | 63.0 | 83.2 | 82.9 | * | 61.1 | 58.5 | 56.2 | 54.8 | 52.4 | 55.1 | 53.7 | 53.2 | 50.4 | 59.2 | 57.2 | 58.1 | 44.1 | 53.8 | 55.1 | 55.0 |
| 8 | Arthrobacter agilis | 65.1 | 63.7 | 63.7 | 63.7 | 66.3 | 66.1 | 65.7 | * | 65.9 | 58.2 | 53.2 | 55.2 | 52.6 | 50.0 | 56.7 | 52.2 | 59.7 | 52.8 | 61.1 | 43.9 | 55.3 | 54.1 | 52.5 |
| 9 | Arthrobacter pigmenti | 65.1 | 62.9 | 63.2 | 62.8 | 65.0 | 65.0 | 64.9 | 68.9 | * | 55.0 | 51.3 | 50.4 | 48.9 | 47.7 | 53.4 | 46.9 | 58.8 | 52.0 | 58.5 | 39.5 | 53.5 | 51.7 | 53.6 |
| 10 | Arthrobacter psychrolactophilus | 61.2 | 63.9 | 63.6 | 63.4 | 61.5 | 61.3 | 61.0 | 61.1 | 60.0 | * | 57.2 | 53.6 | 48.1 | 52.3 | 53.4 | 47.6 | 63.1 | 53.6 | 60.1 | 40.4 | 57.8 | 52.9 | 60.7 |
| 11 | Arthrobacter woluwensis | 61.2 | 66.0 | 66.1 | 65.9 | 61.3 | 60.9 | 60.4 | 61.2 | 60.2 | 61.5 | * | 54.5 | 48.0 | 50.0 | 54.3 | 47.6 | 61.7 | 51.0 | 57.2 | 42.8 | 58.5 | 55.1 | 55.0 |
| 12 | Acaricomes phytoseiuli | 61.3 | 63.2 | 62.6 | 63.2 | 61.6 | 61.6 | 61.2 | 61.6 | 60.8 | 62.0 | 61.4 | * | 47.4 | 46.7 | 58.2 | 52.0 | 52.4 | 45.8 | 52.5 | 47.9 | 63.5 | 47.9 | 50.3 |
| 13 | Citricoccus muralis | 58.0 | 56.7 | 56.2 | 56.3 | 57.7 | 57.9 | 57.4 | 57.4 | 56.0 | 55.2 | 55.6 | 55.7 | * | 52.1 | 47.8 | 62.8 | 50.0 | 54.3 | 49.3 | 46.3 | 45.9 | 48.6 | 46.4 |
| 14 | Glutamicibacter protophormiae | 58.1 | 56.6 | 56.7 | 56.9 | 57.8 | 57.5 | 57.6 | 57.0 | 55.9 | 56.7 | 56.6 | 56.2 | 55.4 | * | 47.2 | 50.1 | 52.3 | 63.0 | 49.8 | 45.1 | 46.8 | 48.6 | 49.8 |
| 15 | Haematomicrobium sanguinis | 59.4 | 58.8 | 58.9 | 58.7 | 59.7 | 59.6 | 59.3 | 59.3 | 58.8 | 57.3 | 58.0 | 59.9 | 54.8 | 55.0 | * | 51.4 | 53.1 | 47.5 | 51.5 | 44.8 | 57.2 | 47.4 | 49.7 |
| 16 | Micrococcus luteus | 57.1 | 56.5 | 56.6 | 56.8 | 57.3 | 57.6 | 57.4 | 57.3 | 56.1 | 55.3 | 56.1 | 56.4 | 63.3 | 55.8 | 55.9 | * | 46.2 | 48.7 | 46.3 | 51.1 | 48.0 | 44.6 | 44.9 |
| 17 | Paenarthrobacter aurescens | 64.2 | 74.6 | 75.4 | 73.5 | 63.2 | 63.1 | 62.9 | 63.7 | 62.9 | 63.9 | 66.2 | 62.5 | 56.1 | 57.0 | 58.7 | 56.0 | * | 55.6 | 71.2 | 39.8 | 57.6 | 60.3 | 58.4 |
| 18 | Paeniglutamicibacter sulfureus | 62.2 | 59.5 | 60.1 | 60.0 | 60.5 | 60.6 | 60.5 | 59.7 | 58.9 | 59.1 | 58.8 | 58.2 | 57.3 | 63.4 | 56.7 | 56.6 | 60.4 | * | 54.8 | 43.7 | 48.1 | 53.7 | 53.4 |
| 19 | Pseudarthrobacter polychromogenes | 64.9 | 77.4 | 77.8 | 76.0 | 63.8 | 64.3 | 63.3 | 64.2 | 63.3 | 64.1 | 65.9 | 62.6 | 56.9 | 56.7 | 58.7 | 56.4 | 74.6 | 60.4 | * | 39.3 | 54.5 | 60.5 | 55.0 |
| 20 | Pseudoglutamicibacter cumminsii | 55.2 | 54.1 | 54.2 | 54.3 | 55.1 | 55.4 | 55.0 | 54.2 | 53.5 | 53.4 | 54.2 | 54.2 | 54.8 | 55.1 | 53.2 | 55.0 | 54.3 | 55.9 | 54.2 | * | 42.9 | 39.2 | 39.7 |
| 21 | Psychromicrobium silvestre | 62.0 | 64.5 | 64.3 | 64.3 | 61.9 | 61.9 | 61.3 | 62.4 | 61.6 | 63.6 | 62.2 | 68.7 | 55.2 | 56.0 | 59.3 | 55.9 | 64.1 | 58.1 | 64.0 | 54.1 | * | 52.3 | 56.4 |
| 22 | Sinomonas atrocyanea | 62.0 | 65.3 | 64.9 | 65.7 | 61.7 | 61.7 | 61.2 | 61.7 | 60.6 | 60.8 | 63.9 | 61.7 | 57.0 | 56.6 | 58.2 | 57.1 | 64.7 | 59.4 | 65.2 | 55.0 | 62.5 | * | 56.6 |
| 23 | Specibacter cremeus | 63.2 | 65.5 | 65.1 | 65.3 | 62.3 | 62.3 | 61.9 | 62.4 | 61.8 | 70.4 | 62.8 | 63.1 | 56.2 | 57.3 | 58.6 | 56.8 | 64.7 | 60.1 | 64.8 | 54.5 | 65.1 | 63.4 | * |
Рис. 2.
Дендрограмма, построенная на основе конкатенированных последовательностей 90 консервативных белков (31358 аминокислот) по методу максимального правдоподобия (Maximum-Likelihood) с использованием ресурсов web-сервера M1CR0B1AL1Z3R (https://microbializer.tau.ac.il/index.html; Avram et al., 2019). В качестве внешней группы использовали штамм Microbacterium lacticum DSM 20427. Цифрами у оснований ветвлений показаны величины статистической достоверности (bootstrap) > 50% (100 повторов). Масштаб соответствует одной замене на каждые 100 нуклеотидов.
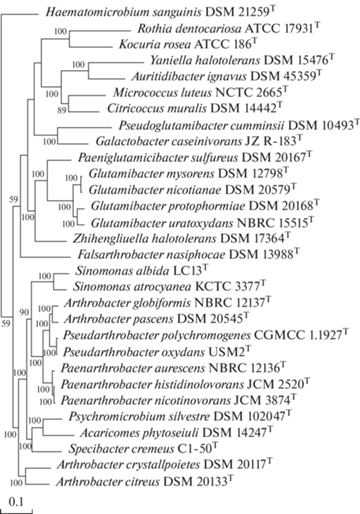
Значение POCP для A. сrystallopoietes и A. citreus (59.4%), а также для A. сrystallopoietes по отношению к видам группы “A. globiformis” (A. globiformis, А. рascens и А. oryzae) (61.5%, 61.8% и 58.4% соответственно) близки или ниже, чем между типовыми видами родов Micrococcaceae (например, А. globiformis и Paenarthrobacter aurescens – 69.4%, Acaricomes phytoseiuli и Psychromicrobium silvestre – 63.5%, Glutamicibacter protophormiaeи и Paeniglutamicibacter sulfureus – 63.0%, Micrococcus luteus и Citricoccus muralis – 62.9%).
Значения AAI между A. сrystallopoietes и каждым из видов группы “А. globiformis” – А. globiformis (64.6%), А. рascens (65.0%), А. оryzae (64.2%), а также между A. сrystallopoietes и A. citreus (65.6%), были также близки или ниже значений для видов разных родов этой группы (табл. 2). Так, показатели AAI составили соответственно 77.4%, 74.6%, 65.5% и 65.3% для A. globiformis и Pseudarthrobacter polychromogenes, Paenarthrobacter aurescens, Specibacter cremeus и Sinomonas atrocyanea. Определенные значения AAI соответствуют междуродовым для некоторых других групп бактерий (Nicholson et al., 2020; Ramírez-Durán et al., 2021).
Таким образом, результаты таксогеномного анализа показывают, что A. сrystallopoietes обособляется на родовом уровне от видов группы “A. globiformis” и Arthrobacter sensu lato в целом, а также от других представителей семейства Micrococcaceae. При этом A. сrystallopoietes, в отличие от других видов рода Arthrobacter, имеющих пептидогликан типа A3α и бесфосфатные (нейтральные) гликополимеры клеточной стенки (Садиков с соавт., 1983; Takeuchi, Yokota, 1989), характеризуется наличием фосфатсодержащих полимеров ‒ тейхоевой кислоты [1,3-поли(глицерофосфата), замещенного остатками β-глюкозы] и поли(дигликозил-1-фосфата).
Полученные данные свидетельствуют о том, что состав и структура гликополимеров клеточной стенки может рассматриваться как важный диагностический признак нового рода, который будет описан в будущем на основе A. сrystallopoietes.
Список литературы
Потехина Н.В., Шашков А.С., Тульская Е.М., Арискина Е.В., Дорофеева Л.В., Евтушенко Л.И. Галактофуранан клеточной стенки актинобактерий рода Paenarthrobacter // Микробиология. 2021. Т. 90. С. 122–128. (Potekhina N.V., Shashkov A.S., Аriskina E.V., Tul’skaya E.M., Dorofeeva L.V., Evtushenko L.I. Cell wall galactofuranan of the Paenarthrobacter actinobacteria // Microbiology (Moscow). 2021. V. 90. P. 106–111).https://doi.org/10.1134/S0026261720060156
Садиков Б.М., Потехина Н.В., Кузнецов В.Д., Наумова И.Б. Обнаружение тейхоевых кислот в клетках бактерий рода Arthrobacter // ДАН СССР. 1983. Т. 271. С. 459–461. (Sadikov B.M., Potekhina N.V., Kuznetsov V.D., Naumova I.B. Detection of teichoic acids in cells of bacteria of the genus Arthrobacter // Doklady Akademii Nauk SSSR. 1983. V. 271. P. 459–461).
Шашков А.С., Тульская Е.М., Дорофеева Л.В., Евтушенко Л.И., Потехина Н.В. Гликозил-1-фосфатные полимеры и тейхулозоновая кислота из клеточной стенки Glutamicibacter protophormiae ВКМ Ac-2104T // Биохимия. 2020а. Т. 85. С. 736−742. (Shashkov A.S., Tul’skaya E.M., Dorofeeva L.V., Evtushenko L.I., Potekhina N.V. Two glycosyl 1-phosphate polymers and teichulosonic acid from Glutamicibacter protophormiae VKM Ac-2104T cell wall // Biochemistry (Moscow). 2020a. V. 85. P. 629–635).
Шашков А.С., Тульская Е.М., Стрешинская Г.М., Дмитренок А.С., Потехина Н.В., Сенченкова С.Н., Пискункова Н.Ф., Дорофеева Л.В., Евтушенко Л.И. Рамноманнаны и тейхуроновая кислота из клеточной стенки Rathayibacter tritici ВКМ Ас-1603Т // Биохимия. 2020б. Т. 85. С. 428−437. (Shashkov A.S., Tul’skaya E.M., Streshinskaya G.M., Dmitrenok A.S., Potekhina N.V., Senchenkova S.N., Piskunkova N.F., Dorofeeva L.V., Evtushenko L.I., Rhamnomannans and teichuronic acid from cell wall of Rathayibacter tritici VKM Ac-1603T // Biochemistry (Moscow). 2020b. V. 85. P. 369–377).
Avram O., Rapoport D., Portugez S., Pupko T. M1CR0B1AL1Z3R-a user-friendly web server for the analysis of large-scale microbial genomics data // Nucleic Acids Res. 2019. V. 47. P. W88–W92. https://doi.org/10.1093/nar/gkz423
Busse H.J. Review of the taxonomy of the genus Arthrobacter, emendation of the genus Arthrobacter sensu lato, proposal to reclassify selected species of the genus Arthrobacter in the novel genera Glutamicibacter gen. nov., Paeniglutamicibacter gen. nov., Pseudoglutamicibacter gen. nov., Paenarthrobacter gen. nov. and Pseudarthrobacter gen. nov., and emended description of Arthrobacter roseus // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 9−37.
Busse H.-J., Moore E.R.B. Reclassification of Arthrobacter nasiphocae (Collins et al. 2002) as Falsarthrobacter nasiphocae gen. nov., comb. nov. // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 1361–1364.
Busse H.-J., Wieser M., Buczolitz S. Genus III. Arthrobacter Cohn and Dimmick 1947, 301AL emend Koch, Schumann and Stackebrandt 1995, 838 // Bergey’s Manual of Systematic Bacteriology, 2nd ed. / Eds. Goodfellow M., Kämpfer P., Busse H.-J., Trujillo M., Suzuki K.-i., Ludwig W. and Whitman W.B. New York e.a.: Springer, 2012. V. 5. Part A. P. 578–624.
Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Rooney A.P., Yi. H., Xu X.W., De Meyer S., Trujillo M. E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 461–466.
Evtushenko L.I., Ariskina E.V. Nocardioidaceae // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. P. 1–18. https://doi.org/10.1002/9781118960608.fbm00042.
Fiedler F., Schäffler M.J. Teichoic acids in cell wall of strains of “nicotianae” group of Arthrobacter: a chemotaxonomic marker // System. Appl. Microbiol. 1987. V. 9. P. 16–21.
Goodfellow M., Jones A.L. Corynebacteriales ord. nov. // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. P. 1–14. https://doi.org/10.1002/9781118960608.obm00009.
Kim D., Park S., Chun J. Introducing EzAAI: a pipeline for high throughput calculations of prokaryotic average amino acid identity // J. Microbiol. 2021. V. 59. P. 476-480.
Kohler T., Xia G., Kulauzovic E., Peschel A. Teichoic acids, lipoteichoic acids, and related cell wall glycopolymers of Gram-positive bacteria // Microbial Glycobiology: Structures, Relevance and Applications / Eds. Moran A., Holst O., Brennan P., von Itzstein M. Amsterdam: Elsevier, 2009. P. 75–91.
Konstantinidis K.T., Tiedje J.M. Towards a genome-based taxonomy for prokaryotes // J. Bacteriol. 2005. V. 187. P. 6258–6264.
Nicholson A.C., Gulvik C.A., Whitney A.M., Humrighouse B.W., Bell M.E., Holmes B., Steigerwalt A.G., Villarma A., Sheth M., Batra D., Rowe L.A., Burroughs M., Pryor J.C., Bernardet J.F., Hugo C., Kämpfer P., Newman J.D., McQuiston J.R. Division of the genus Chryseobacterium: Observation of discontinuities in amino acid identity values, a possible consequence of major extinction events, guides transfer of nine species to the genus Epilithonimonas, eleven species to the genus Kaistella, and three species to the genus Halpernia gen. nov., with description of Kaistella daneshvariae sp. nov. and Epilithonimonas vandammei sp. nov. derived from clinical specimens // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 4432–4450.
Nouioui I., Carro L., Garcia-Lopez M., Meier-Kolthoff J.P., Woyke T., Kyrpides N.C., Pukall R., Klenk H.P., Goodfellow M., Goker M. // Genomebased taxonomic classification of the phylum Actinobacteria / Front. Microbiol. 2018. V. 9. Art. 2007. https://doi.org/10.3389/fmicb.2018.02.007
Pantiukh, K., Grouzdev D. POCP-matrix calculation for a number of genomes // Figshare. 2017. https://doi.org/10.6084/m9.figshare.4577953.v1.
Potekhina N.V., Streshinskaya G.M., Tul’skaya E.M., Shashkov A.S. Cell wall teichoic acids in the taxonomy and characterization of Gram-positive bacteria // Taxonomy of Prokaryotes, Methods in Microbiology / Eds. Rainey F.A. Oren A. London: Academic Press, 2011. V. 38. Ch. 6, P. 132–164.
Qin Q.L., Xie B.B., Zhang X.Y., Chen X.L., Zhou B.C., Zhou J., Oren A., Zhang Y.Z. A proposed genus boundary for the prokaryotes based on genomic insights // J. Bacteriol. 2014. V. 196. P. 2210–2215.
Ramírez-Durán N., de la Haba R.R., Vera-Gargallo B., Sánchez-Porro C., Alonso-Carmona S., Sandoval-Trujillo H., Ventosa A. // Taxogenomic and comparative genomic analysis of the genus Saccharomonospora focused on the identification of biosynthetic clusters PKS and NRPS / Front. Microbiol. 2021. V. 12. Art. 603791. https://doi.org/10.3389/fmicb.2021.603791
Rodriguez-R L.M., Konstantinidis K.T. The enveomics collection: a toolbox for specialized analyses of microbial genomes and metagenomes // Peer J. Preprints. 2016. 4:e1900v1. https://doi.org/10.7287/peerj.preprints.1900v1.
Salam N., Jiao J.Y., Zhang X.T., Li W.J. Update on the classification of higher ranks in the phylum Actinobacteria // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 1331–355.
Schleifer K.H., Kandler O. Peptidoglycan types of bacterial cell walls and their taxonomic implications // Bacteriol. Rev. 1972. V. 36. P. 407–477.
Schumann P. Peptidoglycan Structure // Taxonomy of Prokaryotes, Methods in Microbiology / Eds. Rainey F.A., Oren A. London: Academic Press, 2011, V. 38, Ch. 6, P. 101–129.
Schumann P., Kämpfer P., Busse H.-J., Evtushenko L.I. Proposed minimal standards for describing new genera and species of the suborder Micrococcineae // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 1823–1849.
Takeuchi M., Yokota A. Cell-wall polysaccharides in coryneform bacteria // J. Gen. Appl. Microbiol. 1989. V. 35. P. 233–252.
Zhou Y., Wei W., Wang X., Lai R. Proposal of Sinomonas flava gen. nov., sp. nov., and description of Sinomonas atrocy-anea comb. nov. to accommodate Arthrobacter atrocyaneus // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 259–263.
Дополнительные материалы отсутствуют.


