Микробиология, 2022, T. 91, № 3, стр. 300-311
Генетические детерминанты утилизации ксилана у планктомицета класса Phycisphaerae, Humisphaera borealis M1803T
Д. Г. Наумов a, *, И. С. Куличевская a, С. Н. Дедыш a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: daniil_naumoff@yahoo.com
Поступила в редакцию 13.01.2022
После доработки 29.01.2022
Принята к публикации 31.01.2022
- EDN: VTIEFZ
- DOI: 10.31857/S0026365622300048
Аннотация
Планктомицеты класса Phycisphaerae представлены аэробными и анаэробными гетеротрофными бактериями, населяющими широкий спектр морских и наземных местообитаний, однако их функции в экосистемах пока изучены слабо. Humisphaera borealis M1803T – один из немногочисленных охарактеризованных планктомицетов этого класса, являющийся первым представителем ранее некультивируемой группы WD2101, характерной для почв и торфяников. Настоящая работа посвящена анализу генетических детерминант, обуслoвливающих способность Humisphaera borealis M1803T к росту на ксилане, одном из полимеров клеточной стенки растений. Анализ полногеномной последовательности этого планктомицета позволил выявить пять генов, кодирующих белки, гомологичные ранее известным эндо-β-ксиланазам. Для двух из этих белков были обнаружены эволюционно более близкие экспериментально охарактеризованные гомологи, обладающие иными субстратными специфичностями. У представителя семейства GH10 гликозил-гидролаз оказался разрушенным активный центр фермента. Два белка из семейств GH62 и GH141 рассматриваются нами как наиболее вероятные кандидаты на роль β-ксиланазы, ответственной за утилизацию ксилана. Проведен филогенетический анализ белков семейств GH10, GH62 и GH141. Обсуждается роль горизонтальных переносов в эволюции генов гликозил-гидролаз и их близких гомологов.
Класс Phycisphaerae объединяет аэробных и анаэробных гетеротрофных планктомицетов, утилизирующих широкий спектр органических соединений и населяющих морские и наземные экосистемы (Fukunaga et al., 2009). Ключевое отличие этих микроорганизмов от представителей другого класса планктомицетов, Planctomycetia, заключается в способе размножения (Ward, Dedysh, 2022). Представители Planctomycetia являются почкующимися бактериями, тогда как планктомицеты класса Phycisphaerae размножаются бинарным делением. Число ныне доступных в культурах и охарактеризованных представителей Planctomycetia, а также пул данных об организации клеток и биологии этих планктомицетов, значительно превышают таковые для Phycisphaerae. Последний класс включает три порядка – Phycisphaerales (Fukunaga et al., 2009), Sedimentisphaerales (Spring et al., 2018) и Tepidisphaerales (Kovaleva et al., 2015), общее число охарактеризованных представителей в которых не превышает одного десятка.
Порядок Tepidisphaerales до недавнего времени насчитывал лишь один род – Tepidisphaera, единственный описанный вид которого, Tepidisphaera mucosa, представлен термофильными, полисахарид-использующими планктомицетами из наземных термальных источников (Kovaleva et al., 2015). Культивируемое разнообразие порядка Tepidisphaerales недавно было пополнено мезофильным представителем, изолированным из евтрофного озера бореальной зоны – Humisphaera borealis M1803T (Dedysh et al., 2021). Этот планктомицет является первым полученным в культуре микроорганизмом ранее некультивируемой филогенетической группы в пределах порядка Tepidisphaerales – WD2101. По данным молекулярных исследований микробного разнообразия, планктомицеты группы WD2101 являются типичными обитателями богатых органическим веществом почв и торфяников (Ivanova et al., 2016; Dedysh, Ivanova, 2019; Dedysh et al., 2021). Анализ генома H. borealis M1803T выявил полный набор генов, кодирующих синтез специализированных клеточных структур – микро-компартментов планктомицетного типа – участвующих в утилизации моносахаридов клеточных стенок растений, таких как рамноза (Dedysh et al., 2021). Электронно-микроскопический анализ ультраструктуры клеток подтвердил наличие этих микро-компартментов в клетках, выращенных на рамнозе, что позволило предположить участие этих планктомицетов в процессах деструкции растительных остатков в болотных экосистемах. В числе ростовых субстратов культуры H. borealis M1803T был также идентифицирован ксилан, один из полимеров клеточной стенки растений, однако детальных исследований роста на этом субстрате выполнено не было.
Планктомицеты обладают большим гликолитическим потенциалом, а их геномы кодируют широкий спектр гликозил-гидролаз (Ivanova et al., 2017; Kulichevskaya et al., 2020; Drula et al., 2022). Гликозил-гидролазы или гликозидазы (К.Ф. 3.2.1) – обширная группа ферментов, ответственных за расщепление O-гликозидных связей в различных субстратах, включая гетерополисахариды, гликопротеины и гликолипиды (Наумов, 2011). В соответствии с субстратной специфичностью у них выделяют (McDonald et al., 2009) более двухсот вариантов энзиматических активностей (К.Ф. 3.2.1.1–К.Ф. 3.2.1.215). На основании гомологии аминокислотных последовательностей большинство известных гликозил-гидролаз объединены в базе данных CAZy (Lombard et al., 2014; Terrapon et al., 2017; Garron, Henrissat, 2019; Drula et al., 2022) в 165 семейств: GH1–GH173 (кроме GH21, GH40, GH41, GH60, GH61, GH69, GH145 и GH155). В пределах одного семейства, как правило, бывают представлены ферменты с различающимися энзиматическими активностями, а одна и та же субстратная специфичность может быть обнаружена у представителей разных семейств. Используя данные филогенетического анализа, в пределах семейств удается различать более-менее монофункциональные подсемейства, что позволяет довольно надежно предсказывать биологическую функцию у экспериментально неохарактеризованных белков. В настоящей работе этот подход был применен для поиска генов, кодирующих потенциальные ксиланазы H. borealis M1803T.
Эндо-β-ксиланазы (К.Ф. 3.2.1.8 и К.Ф. 3.2.1.32) – широко распространeнная среди живых организмов и биотехнологически востребованная группа гликозил-гидролаз (Kulkarni et al., 1999; Beg et al., 2001; Pollet et al., 2010; Наумов, 2016; Linares-Pasten et al., 2018; Nguyen et al., 2018; Nordberg Karlsson et al., 2018; Capetti et al., 2021; Gupta et al., 2021). Они отвечают за деградацию разнообразных гетероксиланов – структурно очень неоднородной группы полисахаридов, составляющих основу гемицеллюлозы клеточной стенки высших растений. Известные эндо-β-ксиланазы отнесены в базе данных CAZy к 17-ти семействам гликозил-гидролаз: GH3, GH5, GH6, GH8, GH9, GH10, GH11, GH16, GH18, GH26, GH30, GH43, GH44, GH51, GH62, GH98 и GH141 (Drula et al., 2022). Однако лишь в двух из этих семейств (GH10 и GH11) среди биохимически охарактеризованных представителей явно доминируют носители эндо-β-ксиланазных ферментативных активностей.
Секвенирование (Dedysh et al., 2021) и дальнейшее аннотирование генома H. borealis M1803T показали (Drula et al., 2022), что он кодирует по одному белку из пяти семейств гликозил-гидролаз из вышеупомянутого списка (GH5, GH10, GH18, GH62 и GH141). Целью настоящей работы, таким образом, явилaсь экспериментальная верификация способности H. borealis M1803T к росту на ксилане и выявление наиболее вероятных кандидатов на роль β-ксиланазы среди белков, закодированных в геноме этого микроорганизма.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследуемый микроорганизм и оценка его роста на ксилане. Объектом исследования являлась культура планктомицета H. borealis M1803T (=KCTC 25269T), выделенного и описанного ранее авторами этой работы (Dedysh et al., 2021). Культуру поддерживали на среде MPYVG (модификация среды DSMZ № 621), содержащей (г/л дистиллированной воды): 0.1 пептона (“Fluka”), 0.25 дрожжевого экстракта, 0.1 NH4NO3, 0.5 глюкозы, 20 мл минерального раствора Хатнера и 1 мл раствора витаминов Хатнера (Staley et al., 1992). С целью оценки способности к росту на ксилане, штамм M1803T культивировали при 22°С в 160 мл сывороточных флаконах с 30 мл жидкой питательной среды, содержащей 20 мл/л минерального раствора Хатнера, 0.1 г/л NH4NO3, 1 мл/л раствора смеси витаминов и 0.05 г/л дрожжевого экстракта. Ксилан (“Sigma-Aldrich”) добавляли в среду в концентрации 0.1%. Параллельно оценивали рост культуры M1803T на аналогичной среде с глюкозой (0.05%) и в контроле без источника углерода. Опыты проводили в трехкратной повторности. Аликвоты суспензий для определения численности клеток отбирали в начале эксперимента, а также на 10 и 20 день культивирования. Подсчет числа клеток планктомицета осуществляли на покрытых 0.1% раствором желатина тефлоновых предметных стеклах с окошками методом фазово-контрастной микроскопии. Численность клеток в пробах определяли путем учета их количества в 50 полях зрения микроскопа для каждого варианта опыта с последующим расчетом числа клеток в 1 мл культуры.
Поиск и филогенетический анализ потенциальных β-ксиланаз. Наличие в геноме H. borealis M1803T генов белков, принадлежащих семействам гликозил-гидролаз, которые содержат экспериментально охарактеризованных представителей с β-ксиланазными активностями, определяли с помощью базы данных CAZy (Drula et al., 2022). Для найденных белков искали ближайших гомологов по алгоритму blastp на сайте NCBI (http://www.ncbi.nlm.nih.gov/), дальнейший анализ последних проводили с помощью программы PSI Protein Classifier (Наумов, Каррерас, 2009). Списки экспериментально охарактеризованных представителей для анализируемых семейств гликозил-гидролаз составляли на основании информации, имеющейся в базе данных CAZy.
Для филогенетического анализа отбирали по несколько десятков ближайших гомологов исследуемых белков бактерии H. borealis M1803T. Множественное выравнивание аминокислотных последовательностей проводили вручную в программе-редакторе BioEdit (http://www.mbio.ncsu.edu/BioEdit/ bioedit.html), при этом учитывали результаты попарных выравниваний с помощью программы blastp.
В качестве внешней группы при исследовании филогении семейства GH62 использовали наиболее близкий к белку IPV69_21845 из H. borealis экспериментально охарактеризованный фермент (GenPept, DAC80243.1) и 26 его ближайших гомологов. Для семейства GH10 в качестве внешней группы были использованы 9 белков, филогенетически наиболее близких к кластеру планктомицетных белков (согласно работе Наумов и соавт., 2014), а так же дополнительно еще 12 их ближайших гомологов. Для семейства GH141 специально внешняя группа не подбиралась; при визуализации древа в качестве внешней была выбрана наиболее дивергентная группа из числа проанализированных белков.
Результаты множественного выравнивания (после удаления наиболее вариабельных участков последовательностей) использовали для построения филогенетических деревьев с помощью программы PROTPARS (метод максимальной экономии, Protein Sequence Parsimony method, MP) из пакета PHYLIP (http://evolution.gs.washington.edu/ phylip.html). Статистическую надежность узлов оценивали с использованием бутстреп-анализа (по 1000 псевдореплик для каждого древа). Программу TreeView Win32 (http://taxonomy.zoology.gla.ac.uk/rod/treeview.html) применяли для получения графических изображений деревьев.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рост Humisphaera borealis M1803T на ксилане. Микроскопический анализ культуры H. borealis M1803T после 20 сут инкубации во флаконах с ксиланом показал активное развитие клеток планктомицета на поверхности микрочастиц этого биополимера (рис. 1а). Численность клеток штамма M1803T за 20 сут инкубации с ксиланом возросла более чем на порядок, тогда как в контрольном варианте значимого изменения численности клеток зарегистрировано не было (рис. 1б). Удельная скорость роста штамма M1803T на ксилане составила 0.006 ч–1. Рост на глюкозе, как и предполагалось, был более активным.
Рис. 1.
(а) Микрофотография клеток Humisphaera borealis M1803T после 20 сут инкубации с ксиланом в качестве ростового субстрата. Маркер ‒ 10 мкм. (б) Динамика изменения численности клеток штамма M1803T при росте на ксилане (1), глюкозе (2) и в контроле (3) в начале эксперимента и после 10 и 20 сут инкубации.

Семейства GH5 и GH18. Согласно базе данных CAZy (Drula et al., 2022), белок IPV69_13055 (Ge-nPept, QOV92224.1) из семейства GH5 гликозил-гидролаз принадлежит подсемейству GH5_19, которое содержит два экспериментально охарактеризованных представителя. Один из них (QFQ13828.1) является экзо-маннаназой (К.Ф. 3.2.1.100), а другой (AEH51033.1) – β-маннозидазой (К.Ф. 3.2.1.25). Эндо-β-1,4-ксиланазная активность (К.Ф. 3.2.1.8) экспериментально продемонстрирована для 16 белков семейства GH5, принадлежащих пяти другим подсемействам: GH5_2, GH5_4, GH5_21, GH5_25 и GH5_35. Согласно филогенетическому древу семейства GH5, опубликованному в работе (Aspeborg et al., 2012), подсемейства GH5_4 и GH5_25, а также GH5_21 и GH5_35 образуют совместные монофилетические кластеры. Подсемейства GH5_2 и GH5_26 близки ко второму из этих кластеров. Однако подсемейство GH5_19 находится на древе далеко от этих двух кластеров и образует совместный кластер с подсемействами GH5_18 и GH5_42. Все пять энзиматически охарактеризованных представителей подсемейства GH5_18 (AAN25133.1, ACU71175.1, AEE72695.1, AEW98905.1 и EEI79871.1) обладают β-маннозидазой активностью (К.Ф. 3.2.1.25), а подсемейство GH5_42 не содержит экспериментально изученных белков (Drula et al., 2022). На основании этих данных можно предположить, что гликозидаза IPV69_13055 способна расщеплять какие-то субстраты, содержащие остатки β-D-маннозы, но не обладает β-ксиланазной активностью.
Согласно базе данных CAZy (Drula et al., 2022), семейство GH18 гликозил-гидролаз среди 486 энзиматически охарактеризованных представителей содержит единственную β-ксиланазу из гриба Purpureocillium lilacinum (GenPept, XP_018173934.1). Ее сравнение с белком IPV69_11765 (QOV91983.1) показало, что у них лишь 26% идентичности аминокислотных последовательностей, что указывает на принадлежность к разным подсемействам (если применять 30% критерий; Naumoff, 2005). Это позволяет предположить, что гликозидаза IPV69_11765 не обладает β-ксиланазной активностью.
Семейство GH62. Семейство GH62 гликозил-гидролаз вместе с семействами GH43 и GH117 образуют клан GH-F (Drula et al., 2022), который на более высоком иерархическом уровне принадлежит фуранозидазному суперсемейству (Naumoff, 2001; Pons et al., 2004; Наумов, 2011, 2012), характеризующемуся трехмерной структурой каталитических доменов в виде пятилопастного β-пропеллера и тремя формирующими активный центр высоко консервативными кислыми аминокислотными остатками (Asp/Glu). Следует отметить, что для гликозидаз семейства GH43 характерно наличие двух основных вариантов энзиматических активностей: α-L-арабинофуранозидазной (К.Ф. 3.2.1.55) и β-ксилозидазной (К.Ф. 3.2.1.37). Обе активности часто встречаются у представителей одного и того же подсемейства, а иногда проявляются и одним белком (Mewis et al., 2016). Эти факты указывают на то, что β-пропеллерные каталитические домены способны узнавать в субстратах как α-L-арабинофуранозидные, так и β‑D-ксилопиранозидные остатки моносахаридов. Подавляющее большинство энзиматически охарактеризованных представителей семейства GH62 обладают только α-L-арабинофуранозидазной активностью (Drula et al., 2022). Однако два многодоменных белка проявляют сразу несколько активностей. Так, метагеномная гликозидаза (GenPept, DAC80243.1) содержит три каталитических домена, относящихся к семействам CE1 карбогидрат-эстераз (обуслoвливает ферулоил-эстеразную активность – К.Ф. 3.1.1.73), GH62 (α-L-арабинофуранозидаза) и GH10 (β-ксиланаза). Тем не менее, субклонирование и последующая экспрессия изолированного GH62-домена этого белка показали, что он обладает и некоторой ксиланазной активностью (Holck et al., 2019). Гликозидаза из Ruminiclostridium josui (WP_024831741.1) содержит два каталитических домена, относящихся к семействам GH62 гликозил-гидролаз и CE6 карбогидрат-эстераз. Их субклонирование (Wang et al., 2018) показало, что первый из них отвечает за α-L-арабинофуранозидазную и эндо-β-ксиланазную активности, а второй – за ацетилксилан-эстеразную (К.Ф. 3.1.1.72). Таким образом, GH62-домены, по крайней мере, двух ранее известных белков обладают β-ксиланазной активностью. Белок IPV69_21845 (QOV88842.1) из H. borealis содержит только один домен, он относится к семейству GH62 гликозил-гидролаз. Сравнение данного белка со всеми известными экспериментально охарактеризованными представителями этого семейства показало, что он обладает 45% идентичности с метагеномной гликозидазой (DAC80243.1) и лишь 30–39% с остальными 24 белками. Эти данные позволяют предполагать о возможном наличии у гликозидазы IPV69_21845, наряду с арабинофуранозидазной, еще и эндо-β-ксиланазной активности, что делает его одним из возможных кандидатов на роль β-ксиланазы этого организма.
Нами был проведен филогенетический анализ (рис. 2) аминокислотных последовательностей GH62-домена из гипотетической гликозидазы IPV69_21845 и метагеномной гликозидазы (DAC80243.1), а также из их близких гомологов (суммарно 103 белка). Все проанализированные белки обладают триадой каталитически важных аминокислотных остатков (Asp-64, Asp-179 и Glu-227 в случае IPV69_21845), что указывает на наличие у них гликозидазных активностей. Ближайшими гомологами метагеномной гликозидазы является обширная группа белков, закодированных в геномах разнообразных планктомицетов. При этом два белка оказались практически идентичны ей в пределах GH62-домена (положения от 406 до 714): NLK41752.1 (100%) и HDS84024.1 (98%). Это позволяет предполагать, что полифункциональная метагеномная гликозидаза (DAC80243.1) также принадлежала какому-то планктомицету из класса Phycisphaerae.
Рис. 2.
Филогенетическое древо семейства GH62 гликозил-гидролаз, построенное методом максимальной экономии. Статистическую надежность узлов древа оценивали с помощью бутстреп-анализа, около каждого узла указано число подтверждающих псевдореплик из 1000. Латинскими буквами обозначена таксономическая принадлежность организмов-хозяев белков: A – Armatimonadetes, B – Bacteroidetes, C – Chloroflexi, D – Deltaproteobacteria, E – Eukaryota (Alveolata), I – Acidobacteria, K – candidate division KSB1, M – bacterial metagenome, N – Candidatus Nealsonbacteria, O – Candidatus Omnitrophica, P – Planctomycetes, R – Candidatus Poribacteria и V – Verrucomicrobia. Красным цветом указаны белок IPV69_21845 (QOV88842.1) из Humisphaera borealis M1803T и экспериментально охарактеризованная бифункциональная β-ксиланаза/α-L-арабинофуранозидаза (DAC80243.1), закодированная в бактериальном метагеноме из сточных вод. Подписаны названия штаммов организмов-хозяев белка IPV69_21845 и двух его ближайших гомологов. Синим треугольником обозначен кластер, содержащий 22 белка (94.9% бутстреп-поддержки) из Armatimonadetes (MBB6053333.1), Planctomycetes (HFG32237.1, HFJ73202.1, HGS95713.1, MBM4035677.1 и MBM4043100.1) и Verrucomicrobia (HFG26915.1, HGF95708.1, HGS23301.1, HGT44975.1, MBB5032842.1, MBE2282078.1, MBE7495167.1, MBI2929915.1, MBI4660194.1, MBI5383639.1, MBI5690282.1, MBL9117542.1, MBL9177803.1, MBL9182578.1, MBN8420223.1 и MBP8261673.1).
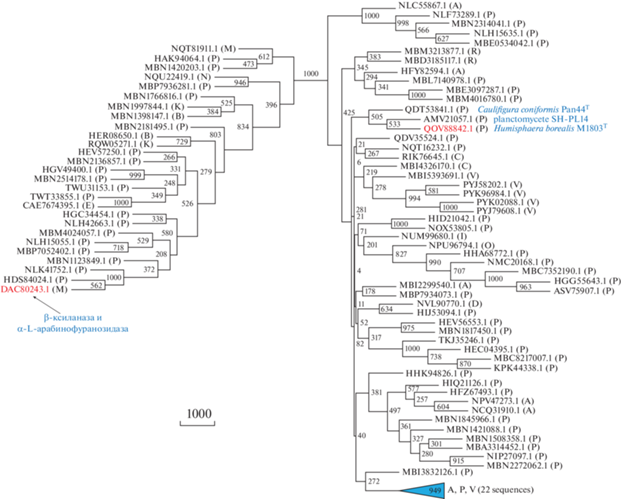
Гипотетическая гликозидаза IPV69_21845 из H. borealis и ее ближайший гомолог из неохарактеризованного планктомицета SH-PL14 (AMV21057.1) являются однодоменными белками и имеют 61% идентичности аминокислотных последовательностей. Они принадлежат обширному кластеру (рис. 2), содержащему, главным образом, белки планктомицетов и, в существенно меньшей степени, белки бактерий фил Armatimonadetes и Verrucomicrobia, остальные филы представлены лишь единичными представителями (Acidobacteria, Chloroflexi, Proteobacteria и др.) или не представлены вовсе (например, Actinobacteria, Bacteroidetes и Firmicutes). Полученные результаты филогенетического анализа (рис. 2) позволяют предполагать, что последний общий предок генов всех исследованных нами белков семейства GH62 гликозил-гидролаз был геном какого-то планктомицета. Дальнейшая эволюция этого гена сопровождалась многочисленными горизонтальными переносами в геномы бактерий других фил и даже возвратным переносом от веррукомикробий обратно в планктомицеты (один или два случая в кластере, обозначенном на рис. 2 синим цветом).
Семейство GH10. Почти все энзиматически охарактеризованные представители семейства GH10 обладают эндо-β-ксиланазными активностями (К.Ф. 3.2.1.8 и К.Ф. 3.2.1.32). Проведенный нами ранее сравнительный анализ белков этого семейства из планктомицетов показал, что они могут быть разбиты на две основные группы (Наумов и соавт., 2014; Naumoff, 2014; Наумов, 2016). Одна из этих групп представлена лишь у некоторых планктомицетов, обычно в виде нескольких паралогов, на филогенетическом древе они не образуют самостоятельного кластера среди белков из других прокариот – это вполне типичная картина для широкого спектра семейств гликозил-гидролаз (если рассматривать представителей какого-либо одного бактериального таксона высокого иерархического уровня). Вторая группа белков оказалась представленной у всех гетеротрофных планктомицетов, всегда бывает только один паралог, на филогенетическом древе они образуют единый кластер, в пределах него положение белков хорошо согласуется с таксономией организмов-хозяев (т.е. наблюдается строго вертикальное наследование без горизонтальных переносов, потерь и дупликаций генов). Анализ множественного выравнивания аминокислотных последовательностей показал, что все белки второй группы имеют разрушенный активный центр – в них отсутствуют два ключевых остатка Glu (см. рис. S1 в работе Rakitin et al., 2021), выполняющих роль донора протона и нуклеофила – что делает невозможным наличие у них какой-либо ферментативной активности. Это позволило нам при аннотации геномов указать отсутствие у соответствующих белков энзиматических активностей в случае планктомицетов Paludisphaera borealis (GenPept, APW63099.1), Limnoglobus roseus (QEL20001.1), Frigoriglobus tundricola (QJX00392.1) и Telmatocola sphagniphila (QVL33104.1). Разрушенные активные центры удалось также обнаружить у целого ряда других прокариотических белков семейства GH10 (неопубликованные данные), однако они не находились в близком эволюционном родстве с белками планктомицетного кластера. Это указывает на то, что утрата ферментативной функции происходила неоднократно в процессе эволюции белков данного семейства.
Проведенный в ходе настоящей работы филогенетический анализ (рис. 3) аминокислотных последовательностей GH10-доменов (всего проанализирован 181 белок) позволил подробнее изучить строение планктомицетного кластера, соответствующего второй группе белков. Он состоит из двух подкластеров, соответствующих классам Phycisphaerae (имеет 49.1% бутстреп-поддержки) и Planctomycetia (99.9%). При этом подкластер Planctomycetia почти не содержит белков из каких-либо иных таксонов бактерий (см. подпись к рис. 3) и, в свою очередь, образован четырьмя кластерами, соответствующими порядкам Gemmatales (82.5%), Isosphaerales (99.9%), Pirellulales (93.7%) и Planctomycetales (87.4%). Подкластер Phycisphaerae содержит несколько метагеномных белков, проаннотированных как представителей других фил бактерий: Acidobacteria (MBE3132059.1), Actinobacteria (NIA06888.1), Chloroflexi (NIA21059.1), Cyanobacteria (KAA0216956.1 и MBC6952665.1), Gemmatimonadetes (TFG86988.1) и Proteobacteria (KPJ65876.1), а так же Candidatus Dependentiae (MBN2267663.1). Это может объясняться как множественными горизонтальными переносами генов, так и несовершенством алгоритмов аннотации метагеномов из бактерий класса Phycisphaerae. Как и у остальных белков планктомицетного кластера, у белка IPV69_18965 (QOV88313.1) из H. borealis отсутствуют оба каталитически важных остатка Glu, что исключает его из возможных кандидатов на роль β-ксиланазы этого организма.
Рис. 3.
Филогенетическое древо семейства GH10 гликозил-гидролаз, построенное методом максимальной экономии. Статистическую надежность узлов древа оценивали с помощью бутстреп-анализа, около каждого узла указано число подтверждающих псевдореплик из 1000. Латинскими буквами обозначена таксономическая принадлежность организмов-хозяев белков: C – Chloroflexi, D – Gammaproteobacteria, G – Gemmatimonadetes, I – Acidobacteria, J – Candidatus Dependentiae, M – bacterial metagenome, T – Actinobacteria и Y – Cyanobacteria. Все неподписанные белки принадлежат планктомицетам класса Phycisphaerae. Красным цветом указан белок IPV69_18965 (QOV88313.1) из Humisphaera borealis M1803T. Подписаны названия организмов-хозяев белка IPV69_18965 и четырех его ближайших гомологов. Желтыми треугольниками обозначены кластеры, соответствующие порядкам Gemmatales, Isosphaerales, Pirellulales и Planctomycetales. Внутри каждого треугольника указана бутстреп-поддержка соответствующего кластера, а справа от него – число относящихся белков. Кластер Pirellulales (помечен звездочкой) содержит также белок из водного метагенома, проаннотированного как Candidatus Nealsonbacteria (NQU20226.1). В качестве внешней группы (на рисунке не указана) служил 21 белок, представляющий пять фил прокариот: Crenarchaeota (RLF19374.1), Cyanobacteria (ABW28526.1, ACK64415.1, ACU99283.1, ADN16869.1, NHC56590.1 и NJN38475.1), Firmicutes (AGC67515.1, EEQ57087.1, EGN35770.1, EMS72420.1, HIR57335.1, HIS30199.1, HIS30200.1, HIS30214.1, MBQ1860455.1, MBQ3079900.1, MBQ6240474.1 и WP_148410326.1), Spirochaetes (AEF81843.1) и Verrucomicrobia (HGY63858.1).

Семейство GH141. Согласно базе данных CAZy (Drula et al., 2022), только два белка семейства GH141 были охарактеризованы энзиматически: это α-L-фукозидаза (К.Ф. 3.2.1.51) из Bacteroides thetaiotaomicron (GenPept, AAO76109.1) и β-ксиланаза (К.Ф. 3.2.1.8) из Hungateiclostridium thermocellum (ABN53397.1). Эти два белка принадлежат разным подсемействам, но имеют в гомологичных положениях по два высококонсервативных в пределах семейства GH141 остатка Asp, выполняющих роль донора протона и нуклеофила (Heinze et al., 2017; Ndeh et al., 2017). Белок IPV69_20890 (QOV88669.1) из H. borealis не принадлежит ни одному из этих двух подсемейств, имея с указанными белками не более 27% идентичности аминокислотных последовательностей, однако обладает обоими консервативными остатками Asp (в положениях 489 и 525). Это делает его еще одним возможным кандидатом на роль β-ксиланазы данного организма.
Нами был проведен филогенетический анализ (рис. 4) аминокислотных последовательностей гипотетической гликозидазы IPV69_20890 и 109 ее ближайших гомологов. Оба энзиматически охарактеризованных белка семейства GH141 не были вовлечены в анализ, т.к. из-за их существенной дивергенции не удалось построить однозначного множественного выравнивания. Белок IPV69_20890 попал в стабильный кластер (100% бутстреп-поддержки; в правом верхнем углу на рис. 4), содержащий преимущественно белки из бактерий филы Armatimonadetes. Белки из других фил (Lentisphaerae и Planctomycetes) внутри этого кластера не проявляют тенденции к кокластеризации, что указывает на вероятное появление соответствующих генов посредством серии независимых горизонтальных переносов от арматимонад. Остальные проанализированные белки семейства сформировали на древе еще восемь кластеров. Один из них образован исключительно белками планктомицетов, главным образом из рода Paludisphaera (100% бутстреп-поддержки; в левом верхнем углу на рис. 4). Все остальные кластеры (I–VII) также содержат какое-то количество планктомицетных белков. В составе кластера IV содержится стабильный подкластер (100% бутстреп-поддержки) из семи планктомицетных белков (MBC8871159.1, MBM4047734.1, NLF73417.1, NLY00979.1, NOX55446.1, NOZ20755.1 и NUQ63536.1), но все они закодированы в метагеномах, и поэтому затруднительно с уверенностью говорить о более точной таксономической принадлежности их организмов-хозяев.
Рис. 4.
Филогенетическое древо семейства GH141 гликозил-гидролаз, построенное методом максимальной экономии. Статистическую надежность узлов древа оценивали с помощью бутстреп-анализа, около каждого узла указано число подтверждающих псевдореплик из 1000. Латинскими буквами обозначена таксономическая принадлежность организмов-хозяев белков: A – Armatimonadetes, L – Lentisphaerae, N – Candidatus Nealsonbacteria, P – Planctomycetes, V – Verrucomicrobia, W – Candidatus Hydrogenedentes, X – Kiritimatiellaeota и Z – Nitrospirae. Красным цветом указан белок IPV69_20890 (QOV88669.1) из Humisphaera borealis M1803T. Подписаны названия организмов-хозяев для белка IPV69_20890, а также для пяти белков палюдисферного кластера (см. текст). Семью желтыми треугольниками обозначены кластеры белков, пронумерованные латинскими цифрами (I–VII). Внутри каждого треугольника указана бутстреп-поддержка соответствующего кластера, а рядом с ним – число относящихся к нему белков и таксономическая принадлежность их организмов-хозяев.

Пять из этих семи кластеров (II–V и VII) содержат некоторое количество белков из филы Lentisphaerae, по четыре кластера – из Armatimonadetes (II, III, VI и VII) и Verrucomicrobia (II, IV, V и VII), три кластера (II, VI и VII) – из Kiritimatiellaeota. Еще три филы бактерий представлены лишь в одном кластере каждая: Nitrospirae (I), Candidatus Hydrogenedentes (I) и Candidatus Nealsonbacteria (V). Это указывает на то, что последний общий предок генов всех исследованных нами белков семейства GH141 гликозил-гидролаз был, по всей видимости, геном какого-то планктомицета. Дальнейшая эволюция этого гена сопровождалась многочисленными горизонтальными переносами в геномы бактерий ряда других фил и даже возвратным переносом от арматимонад обратно в планктомицеты.
Палюдисферный кластер содержит белок из Paludisphaera borealis PX4T (APW58834.1), который на основе дальних эволюционных связей (семейство PF13229 в базе данных Pfam; Mistry et al., 2021) был нами исходно проаннотирован как “putative beta-solenoid-type carbohydrate-active enzyme (GH, PL, or CE) of unknown function”, т.к. семейство GH141 гликозил-гидролаз в то время еще не было известно (Ivanova et al., 2017). Все проанализированные в работе белки этого семейства (за единственным исключением метагеномного белка HFH06191.1 из Candidatus Hydrogenedentes; кластер I) обладают обоими высококонсервативными остатками Asp, указывая на то, что все они, вероятно, обладают ферментативными активностями.
Особенности эволюции гликозил-гидролаз изученных семейств. Гликозил-гидролазы относятся к числу тех белков, которые, выполняя факультативные для организма функции, не являются облигатными компонентами протеомов (никакие семейства этих ферментов не представлены у большинства биологических видов, а некоторые микроорганизмы не содержат их вовсе). Для гликозил-гидролаз прокариот не характерно вертикальное наследование: их гены легко приобретаются путем горизонтальных переносов и дальнейших дупликаций, а затем быстро утрачиваются при отсутствии селективных преимуществ от их наличия (Наумов, 2011).
В этом смысле совершенно необычный случай представляет собой исследованная в настоящей работе группа планктомицетных белков из семейства GH10 гликозил-гидролаз (рис. 3). Объяснение этого феномена мы видим в вероятном отсутствии ферментативных активностей у этих белков вследствие утраты активного центра. Пока неизвестная новая функция этой группы ортологов очевидно является облигатной для бактерий данной филы, что обеспечивает стабильное вертикальное наследование их генов.
Исследованные в настоящей работе две другие группы белков, представляющие семейства GH62 и GH141, продемонстрировали типичную для гликозил-гидролаз модель эволюции, характеризующуюся многочисленными горизонтальными переносами между разными филами бактерий. В обоих семействах как раз планктомицеты, по всей видимости, являлись источниками таких переносов, а направлены они были исключительно в другие грамотрицательные бактерии. В случае семейства GH62 это были преимущественно представители фил Armatimonadetes и Verrucomicrobia (рис. 2), а в случае семейства GH141 – Armatimonadetes, Lentisphaerae и Verrucomicrobia (рис. 4).
Следует отметить, что еще два изученных нами семейства – GH5 и GH18 – также вполне вписываются в общую закономерность, однако там планктомицеты скорее являлись получателями горизонтально перенесенных генов. Ближайшие гомологи для белка IPV69_13055 из семейства GH5 принадлежали бактериям филы Chloroflexi, а среди ближайших гомологов белка IPV69_11765 (GH18) преобладали бактерии филы Verrucomicrobia (данные не приводятся).
В целом, полученные в настоящей работе данные хорошо согласуются с ранее сделанными нами (Наумов, Дедыш, 2018) наблюдениями о неслучайной направленности горизонтальных переносов генов гликозил-гидролаз между разными группами прокариот: грамотрицательные и грамположительные бактерии относительно редко обмениваются генами, среди первых обособленное положение занимают представители филы Proteobacteria. Наиболее интенсивные переносы обнаружены, с одной стороны, внутри группы фил, включающей Armatimonadetes, Planctomycetes и Verrucomicrobia, а с другой стороны между представителями фил Acidobacteria, Bacteroidetes и Balneolaeota.
Результаты, полученные в настоящей работе, указывают на белки IPV69_21845 (семейство GH62) и IPV69_20890 (GH141), как на наиболее вероятные кандидаты на роль β-ксиланазы у Humisphaera borealis M1803T. У белка IPV69_21845 можно ожидать одновременного наличия α-L-арабинофуранозидазной и β-ксиланазной активностей, тогда как IPV69_20890, вероятно, обладает либо α-L-фукозидазной, либо β-ксиланазной активностями. Изучение характеристик этих ферментов представляет интерес для дальнейших биохимических исследований и более глубокого понимания функциональной роли планктомицетов класса Phycisphaerae в деструкции растительных остатков в природных экосистемах.
Список литературы
Наумов Д.Г. Иерархическая классификация гликозил-гидролаз // Биохимия. 2011. Т. 76. С. 764–780.
Naumoff D.G. Hierarchical classification of glycoside hydrolases // Biochemistry (Moscow). 2011. V. 76. P. 622–635.
Наумов Д.Г. Семейство GH10 гликозилгидролаз: структура и эволюционные связи // Мол. биология. 2016. Т. 50. С. 151–160.
Naumoff D.G. GH10 family of glycoside hydrolases: structure and evolutionary connections // Mol. Biol. (Moscow). 2016. V. 50. P. 132–140.
Наумов Д.Г. Фуранозидазное суперсемейство: поиск гомологов // Мол. биология. 2012. Т. 46. С. 354–360.
Naumoff D.G. Furanosidase superfamily: search of homologues // Mol. Biol. (Moscow). 2012. V. 46. P. 322–327.
Наумов Д.Г., Дедыш С.Н. Малоизученные группы бактерий – источник новых ферментов: β-галактозидазы из планктомицетов и веррукомикробий // Микробиология. 2018. Т. 87. С. 695–705.
Naumoff D.G., Dedysh S.N. Bacteria from poorly studied phyla as a potential source of new enzymes: β-galactosidases from Planctomycetes and Verrucomicrobia // Microbiology (Moscow). 2018. V. 87. P. 796–805.
Наумов Д.Г., Иванова А.А., Дедыш С.Н. Филогения β‑ксиланаз планктомицетов // Мол. биология. 2014. Т. 48. С. 508–517.
Naumoff D.G., Ivanova A.A., Dedysh S.N. Phylogeny of β‑xylanases from Planctomycetes // Mol. Biol. (Moscow). 2014. V. 48. P. 439–447.
Наумов Д.Г., Каррерас М. Новая программа PSI Protein Classifier автоматизирует анализ результатов программы PSI-BLAST // Мол. биология. 2009. Т. 43. С. 709–721.
Naumoff D.G., Carreras M. PSI protein classifier: a new program automating PSI-BLAST search results // Mol. B-iol. (Moscow). 2009. V. 43. P. 652–664.
Aspeborg H., Coutinho P.M., Wang Y., Brumer H. 3rd, Henrissat B. Evolution, substrate specificity and subfamily classification of glycoside hydrolase family 5 (GH5) // BMC Evol. Biol. 2012. V. 12. Art. 186.
Beg Q.K., Kapoor M., Mahajan L., Hoondal G.S. Microbial xylanases and their industrial applications: a review // Appl. Microbiol. Biotechnol. 2001. V. 56. P. 326–338.
Capetti C.C.M., Vacilotto M.M., Dabul A.N.G., Sepulchro A.G.V., Pellegrini V.O.A., Polikarpov I. Recent advances in the enzymatic production and applications of xylooligosaccharides // World J. Microbiol. Biotechnol. 2021. V. 37. Art. 169.
Dedysh S.N., Beletsky A.V., Ivanova A.A., Kulichevskaya I.S., Suzina N.E., Philippov D.A., Rakitin A.L., Mardanov A.V., Ravin N.V. Wide distribution of Phycisphaera-like planctomycetes from WD2101 soil group in peatlands and genome analysis of the first cultivated representative // Environ. Microbiol. 2021. V. 23. P. 1510–1526.
Dedysh S.N., Ivanova A.A. Planctomycetes in boreal and subarctic wetlands: diversity patterns and potential ecological functions // FEMS Microbiol. Ecol. 2019. V. 95. Art. fiy227.
Drula E., Garron M.-L., Dogan S., Lombard V., Henrissat B., Terrapon N. The carbohydrate-active enzyme database: functions and literature // Nucleic Acids Res. 2022. V. 50 (Database issue). P. D571–D577. (http://www.cazy.org/).
Fukunaga Y., Kurahashi M., Sakiyama Y., Ohuchi M., Yokota A., Harayama S. Phycisphaera mikurensis gen. nov., sp. nov., isolated from a marine alga, and proposal of Phycisphaeraceae fam. nov., Phycisphaerales ord. nov. and Phycisphaerae classis nov. in the phylum Planctomycetes // J. Gen. Appl. Microbiol. 2009. V. 55. P. 267–275.
Garron M.-L., Henrissat B. The continuing expansion of CAZymes and their families // Curr. Opin. Chem. Biol. 2019. V. 53. P. 82–87.
Gupta G.K., Dixit M., Kapoor R.K., Shukla P. Xylanolytic enzymes in pulp and paper industry: new technologies and perspectives // Mol. Biotechnol. 2022. V. 64. P. 130–143. https://doi.org/10.1007/s12033-021-00396-7
Heinze S., Mechelke M., Kornberger P., Liebl W., Schwarz W.H., Zverlov V.V. Identification of endoxylanase XynE from Clostridium thermocellum as the first xylanase of glycoside hydrolase family GH141 // Sci. Rep. 2017. V. 7. Art. 11178.
Holck J., Djajadi D.T., Brask J., Pilgaard B., Krogh K.B.R.M., Meyer A.S., Lange L., Wilkens C. Novel xylanolytic triple domain enzyme targeted at feruloylated arabinoxylan degradation // Enzyme Microb. Technol. 2019. V. 129. Art. 109353.
Ivanova A.A., Kulichevskaya I.S., Merkel A.Y., Toshchakov S.V., Dedysh S.N. High diversity of Planctomycetes in soils of two lichen-dominated sub-arctic ecosystems of northwestern Siberia // Front. Microbiol. 2016. V. 7. Art. 2065.
Ivanova A.A., Naumoff D.G., Miroshnikov K.K., Liesack W., Dedysh S.N. Comparative genomics of four Isosphaeraceae planctomycetes: a common pool of plasmids and glycoside hydrolase genes shared by Paludisphaera borealis PX4T, Isosphaera pallida IS1BT, Singulisphaera acidiphila DSM 18658T, and strain SH-PL62 // Front. Microbiol. 2017. V. 8. Art. 412.
Kovaleva O.L., Merkel A.Yu., Novikov A.A., Baslerov R.V., Toshchakov S.V., Bonch-Osmolovskaya E.A. Tepidisphaera mucosa gen. nov., sp. nov., a moderately thermophilic member of the class Phycisphaerae in the phylum Planctomycetes, and proposal of a new family, Tepidisphaeraceae fam. nov., and a new order, Tepidisphaerales ord. nov. // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 549–555.
Kulichevskaya I.S., Naumoff D.G., Miroshnikov K.K., Ivanova A.A., Philippov D.A., Hakobyan A., Rijpstra W.I.C., Damsté J.S.S., Liesack W., Dedysh S.N. Limnoglobus roseus gen. nov., sp. nov., a novel freshwater planctomycete with a giant genome from the family Gemmataceae // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 1240–1249.
Kulkarni N., Shendye A., Rao M. Molecular and biotechnological aspects of xylanases // FEMS Microbiol. Rev. 1999. V. 23. P. 411–456.
Linares-Pasten J.A., Aronsson A., Karlsson E.N. Structural considerations on the use of endo-xylanases for the production of prebiotic xylooligosaccharides from biomass // Curr. Protein Pept. Sci. 2018. V. 19. P. 48–67.
Lombard V., Golaconda Ramulu H., Drula E., Coutinho P.M., Henrissat B. The carbohydrate-active enzymes database (CAZy) in 2013 // Nucleic Acids Res. 2014. V. 42 (Database issue). P. D490–D495.
McDonald A.G., Boyce S., Tipton K.F. ExplorEnz: the primary source of the IUBMB enzyme list // Nucleic Acids Res. 2009. V. 37 (Database issue). P. D593–D597.
Mewis K., Lenfant N., Lombard V., Henrissat B. Dividing the large glycoside hydrolase family 43 into subfamilies: a motivation for detailed enzyme characterization // Appl. Environ. Microbiol. 2016. V. 82. P. 1686–1692.
Mistry J., Chuguransky S., Williams L., Qureshi M., Salazar G.A., Sonnhammer E.L.L., Tosatto S.C.E., Paladin L., Raj S., Richardson L.J., Finn R.D., Bateman A. Pfam: the protein families database in 2021 // Nucleic Acids Res. 2021. V. 49 (Database issue). P. D412–D419.
Naumoff D.G. Bioinformatic analysis of endo-β-xylanases from Planctomycetes // The Ninth International Conference on the Bioinformatics of Genome Regulation and Structure / Systems Biology. Abstracts. June 23–28, 2014. Novosibirsk. Russia. P. 112. (http://conf.bionet.nsc.ru/bgrssb2016/wp-content/uploads/sites/2/2015/11/BGRS2014.pdf).
Naumoff D.G. β-Fructosidase superfamily: homology with some α-L-arabinases and β-D-xylosidases // Proteins. 2001. V. 42. P. 66–76.
Naumoff D.G. GH97 is a new family of glycoside hydrolases, which is related to the α-galactosidase superfamily // BMC Genomics. 2005. V. 6. Art. 112.
Ndeh D., Rogowski A., Cartmell A., Luis A.S., Baslé A., Gray J., Venditto I., Briggs J., Zhang X., Labourel A., Terrapon N., Buffetto F., Nepogodiev S., Xiao Y., Field R.A., Zhu Y., O’Neil M.A., Urbanowicz B.R., York W.S., Davies G.J., Abbott D.W., Ralet M.C., Martens E.C., Henrissat B., Gilbert H.J. Complex pectin metabolism by gut bacteria reveals novel catalytic functions // Nature. 2017. V. 544. P. 65–70.
Nguyen S.T.C., Freund H.L., Kasanjian J., Berlemont R. Function, distribution, and annotation of characterized cellulases, xylanases, and chitinases from CAZy // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 1629–1637.
Nordberg Karlsson E., Schmitz E., Linares-Pastén J.A., Adlercreutz P. Endo-xylanases as tools for production of substituted xylooligosaccharides with prebiotic properties // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 9081–9088.
Pollet A., Delcour J.A., Courtin C.M. Structural determinants of the substrate specificities of xylanases from different glycoside hydrolase families // Crit. Rev. Biotechnol. 2010. V. 30. P. 176–191.
Pons T., Naumoff D.G., Martínez-Fleites C., Hernández L. Three acidic residues are at the active site of a β-propeller architecture in glycoside hydrolase families 32, 43, 62, and 68 // Proteins. 2004. V. 54. P. 424–432.
Rakitin A.L., Naumoff D.G., Beletsky A.V., Kulichevskaya I.S., Mardanov A.V., Ravin N.V., Dedysh S.N. Complete genome sequence of the cellulolytic planctomycete Telmatocola sphagniphila SP2T and characterization of the first cellulolytic enzyme from planctomycetes // Syst. Appl. Microbiol. 2021. V. 44. Art. 126276.
Spring S., Bunk B., Spröer C., Rohde M., Klenk H.P. Genome biology of a novel lineage of planctomycetes widespread in anoxic aquatic environments // Environ. Microbiol. 2018. V. 20. P. 2438–2455.
Staley J.T., Fuerst J.A., Giovannoni S., Schlesner H. The Order Planctomycetales and the Genera Planctomyces, Pirellula, Gemmata, and Isosphaera // The Prokaryotes: A Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications / Eds. Balows A., Trüper H.G., Dworkin W. , Harder K.-H., Schleifer. N.Y.: Springer, 1992. P. 3710–3731.
Terrapon N., Lombard V., Drula E., Coutinho P.M., Henrissat B. Chapter 6. The CAZy database/the Carbohydrate-Active Enzyme (CAZy) database: principles and usage guidelines // A Practical Guide to Using Glycomics Databases / Ed. Aoki-Kinoshita K.F. Tokyo: Springer, 2017. P. 117–131.
Wang Y., Sakka M., Yagi H., Kaneko S., Katsuzaki H., Kunitake E., Kimura T., Sakka K. Ruminiclostridium josui Abf62A-Axe6A: a tri-functional xylanolytic enzyme exhibiting α-L-arabinofuranosidase, endoxylanase, and acetylxylan esterase activities // Enzyme Microb. Technol. 2018. V. 117. P. 1–8.
Ward N.L., Dedysh S.N. Planctomycetes // Bergey’s Manual of Systematics of Archaea and Bacteria / Eds. Trujillo M.E., Dedysh S., DeVos P., Hedlund B., Kämpfer P., Rainey F.A., Whitman W.B. 2022. https://doi.org/10.1002/9781118960608.pbm00021.pub2
Дополнительные материалы отсутствуют.


