Микробиология, 2022, T. 91, № 3, стр. 334-340
Действие наночастиц углеродной природы с различной структурной организацией на биологические системы штамма Escherichia coli K12 TGI
Е. В. Сорокина a, *, Е. А. Образцова b
a Кафедра микробиологии, биологический факультет, Московский государственный университет
им. М.В. Ломоносова
119234 Москва, Россия
b Институт биоорганической химии им. ак. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
* E-mail: evsorokina77@mail.ru
Поступила в редакцию 21.01.2022
После доработки 25.01.2022
Принята к публикации 26.01.2022
- EDN: BHNPKQ
- DOI: 10.31857/S0026365622300073
Аннотация
Исследование взаимодействия наночастиц различной природы с биологическими объектами вызывает повышенный интерес, вызванный началом широкого применения нанообъектов в продуктах массового и промышленного потребления. Однако воздействие используемых наноматериалов на биологические системы, в том числе и на человека, полностью не изучено. Результаты, полученные в последнее время в различных лабораториях, не дают точного ответа об их безопасности. Ранее мы обнаружили, что воздействие одностенных и многостенных углеродных нанотрубок на бактериальные клетки приводит к их разрушению. Для объяснения этого эффекта в данной работе был проведен анализ воздействия на бактериальные клетки двух других видов углеродных наночастиц – из алмаза и графита. В качестве тест-системы использованы бактерии штамма Escherichia coli K12 TGI с созданным светящимся фенотипом. Было изучено влияние на эти клетки наночастиц алмаза, полученных детонационным методом, и графита, полученных методом обработки ультразвуком. На основании данных биолюминесценции и растровой электронной микроскопии показано, что данные виды наночастиц не являются токсичными для бактериальных клеток. Полученные результаты демонстрируют, что безопасность наноматериалов зависит не только от их состава, но и от внутренней структуры. Это поможет в дальнейшем разработать критерии безопасности наноматериалов и установить условия и нормы их применения.
В мире современных технологий появляется много новых материалов, особое место среди которых занимают наноматериалы. Среди наноструктурированных объектов можно выделить большой класс материалов, имеющих углеродную природу. Углерод является уникальным элементом – он образует достаточно много аллотропов, которые отличаются по своим свойствам кардинально (Carbon, 2006). Наиболее известными формами углерода можно назвать алмаз и графит. В алмазе каждый атом углерода связан с 4 соседями одинаковыми по длине и разделенными одинаковыми углами связями, что обеспечивает высокую стабильность кристаллов алмаза, делая его самым прочным из известных материалов (Pierson, 1994). При этом алмаз является оптически прозрачным в видимой части спектра (поглощение начинается только в ультрафиолетовой области) и является электрическим изолятором. В графите атомы углерода объединены в слоистую структуру. В плоскости слоя каждый атом углерода связан с 3 соседними атомами, одинаковыми по длине и разделенными равными углами связями. Между слоями связь не такая сильная. В результате атомы внутри каждого слоя связаны очень сильно, обеспечивая с одной стороны прочность, а с другой стороны гибкость и упругость слоя. Слои можно разделить, не прикладывая значительных усилий. Как следствие этих структурных особенностей, электронные свойства графита также являются анизотропными. Графит поглощает свет в широком диапазоне – от далекого ИК до УФ. Одним из наиболее востребованных и перспективных так называемых “новых” углеродных материалов являются углеродные нанотрубки.
Судьба наночастиц в клетке жизненно важна для их применения, биочувствительности, доставки лекарств, подавления лекарственной устойчивости, доставки генов и анализа цитотоксичности. Чу и соавт. (Chu et al., 2014) показали, что морфология наночастиц определяет их клеточную судьбу. Наночастицы с острыми формами, независимо от их химического состава и размера могут проникать через мембраны эндосом, которые переносят их в клетки, и попадать в цитоплазму, что, в свою очередь, значительно снижает скорость выделения наночастиц из клеток. Такие особенности наночастиц острой формы необходимы для доставки лекарств, доставки генов, субклеточного таргетирования и долгосрочного отслеживания в клетках (Chu et al., 2014).
Ранее было исследовано влияние наноструктур на бактериальные клетки и сделан вывод, что нанотрубки могут механически нарушать клеточную стенку и вызывать гибель бактерий (Образцова и соавт., 2009, Зарубина и соавт., 2009, 2011). Эти данные подтверждаются результатами исследований других групп (Максимова, 2019).
Чтобы более детально разобраться в механизмах взаимодействия углеродных наноструктур с живыми клетками в этой работе мы проанализировали воздействие наночастиц из алмаза и графита на ту же тест-систему. Эти наноструктуры и сами по себе все шире применяются в высокотехнологичных продуктах и даже в предметах повседневного быта, поэтому оценка их безопасности вызывает повышенный интерес (Schrand et al., 2007; Zhang et al., 2012, Zhao et al., 2020).
В настоящее время алмазные частицы нанометрового размера предлагают применять как маркеры для мониторинга различных биомедицинских образцов (Torelli et al., 2019).
Люминесценция (интенсивность и длина волны) наночастиц алмаза чувствительна к изменению электрических, магнитных полей, температуры (Wu et al., 2016). Это позволяет локально детектировать изменение этих параметров, например, в клетке или для отдельных молекул, нанесенных на подложку. Кроме того, интерес к наноалмазу, как носителю биологически активных веществ, в том числе лекарственных, возрастает с каждым годом (Perevedentseva et al., 2021).
Предложено применять наноалмазы для создания износостойких покрытий хирургических инструментов, элементов космических аппаратов (Nistor, May, 2017). В повседневной жизни наночастицы алмаза можно встретить в материалах для шлифования, полировки, в качестве армирующих добавок в сверлах, пилах, бурах и других инструментах. С такими частицами встречается практически каждый человек.
Графитные наноструктуры представляют собой плоские частицы, состоящие из одного (графена) или нескольких слоев атомов. Нано- и микрочастицы графита применяются в смазочных материалах, для создания проводящих покрытий в качестве добавки, улучшающей проводимость различных изделий, в качестве поглощающего покрытия (например, на деталях антенн, детекторов) (Pete, 1996; Camargo et al., 2021). Из графита также изготавливают прочные волокна, которые сейчас применяются даже в спортивном инвентаре, предметах одежды, кухонной утвари и т.д. (Meng et al., 2018). Графитовый порошок добавляют в резины, бетоны, асфальты и т.д. для улучшения механических свойств (Dimov et al., 2018). Таким образом, даже обычный человек сталкивается с этими частицами повсеместно.
Стремительное развитие нанотехнологий в биологии, медицине и промышленности вызывает необходимость разработки методов оценки рисков использования наночастиц и наноматериалов. В этой связи целью данной работы является сравнительный анализ отмеченных выше углеродных наноматериалов и оценка их биотоксичности на примере штамма Escherichia coli.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В данной работе рассмотрено воздействие двух типов углеродных наноструктур на бактериальные клетки – это наночастицы графита и алмаза. В качестве наночастиц алмаза были использованы порошки ультрадисперсного алмаза типа УДС-С, полученного детонационным методом (ФНЦП “Алтай”, Бийск). По данным производителя образцы состоят из агломерированных частиц алмаза размером 4‒5 нм и содержат не более 15% неалмазных примесей. Типичное изображение такого образца представлено на рис. 1а. Ранее такие порошки были подробно исследованы (Аполонская и соавт., 2009). Наночастицы графита были получены из кристаллов высокоориентированного пиролитического графита с помощью обработки ультразвуком аналогично (Pavlova et al., 2016), но без использования каких-либо поверхностно-активных веществ для исключения влияния этих веществ на бактериальные клетки.
Рис. 1.
Изображения, полученные с помощью растровой электронной микроскопии образцов наночастиц алмаза (а) и графита (б).

Отказ от использования поверхностно-активных веществ приводил к снижению стабильности суспензий в долгосрочной перспективе, но на временах проведения экспериментов характеристики образцов можно считать постоянными. Характерное изображение полученного материала представлено на рис. 1б. Видно, что полученный материал состоит из плоских частиц графита, состоящих из малого числа слоев и имеющих латеральные размеры от десятков нанометров до нескольких микрон.
Для проведения экспериментов были использованы суспензии этих двух видов наночастиц в дистиллированной воде в концентрациях 160.0 мкг/мл. Непосредственно перед проведением экспериментов суспензии наночастиц дополнительно обрабатывали ультразвуком в течение 20 мин.
Одним из удобных и доступных методов первичной интегральной оценки действия физических факторов, различных химических веществ и их смесей, объектов окружающей среды (воды, почв, воздуха), а также и в научных исследованиях являются широко используемые тест-системы на основе бактериальной люминесценции. В данной работе мы использовали штамм бактерии Escherichia coli K12 TGI с созданным светящимся фенотипом. В анализах использовали нативные клетки ночной культуры биотеста, бактерии штамма E. coli K12 TGI с созданным светящимся фенотипом при клонировании lux-оперона из светящихся почвенных бактерий Photorhabdus luminescencens ZMI. Штамм получен и хранится на кафедре микробиологии биологического факультета МГУ имени М.В. Ломоносова, известен как биосенсор тест-системы “Эколюм-06”. Нативные клетки концентрировали центрифугированием при 6000 g в течение 15 мин. Клетки суспендировали в дистиллированной воде. Исследуемые образцы состояли из суспензии бактерий 2.6 × 108 кл./мл. Такие пробы инкубировали с наночастицами 48 ч, далее крупные углеродные частицы осаждали при 6000 g в течение 1 мин. Для анализа показателей индекса токсичности (биологической активности) в пробирки объемом 1.5 мл вносили по 900 мкл н-адосадочной жидкости каждого образца клеток. Контрольные образцы были без наночастиц, состояли из нативных клеток и дистиллированной воды.
В эксперименте также использовали и лиофильно высушенные клетки биосенсора, которые регидратировали холодной дистиллированной водой в течение 30 мин и использовали водные суспензии клеток 2.3–2.7 × 107 кл./мл. Ранее исходный биосенсор был охарактеризован нами с помощью атомно-силовой микроскопии (Образцова и соавт., 2009; Зарубина и соавт., 2009, 2011).
Плотность бактериальных суспензий определяли нефелометрически (λ = 670 нм) на фотоэлектроколориметре KF77 и выражали числом клеток в 1 мл по калибровочной кривой.
К клеткам Е. соli (500 мкл), провзаимодействовавших с наночастицами, добавляли среду LB (500 мкл) и регистрировали изменения роста по плотности бактериальной суспензии, которую определяли при длине волны 560 нм на МФУ Clariostar BMG в культуральных планшетах и выражали в % относительно контроля. Оптическая плотность (ОП) позволила оценить суммарное накопление бактериальной биомассы, включая живые и мертвые, метаболически активные и неактивные, активно растущие и покоящиеся клетки.
Интенсивность свечения бактерий (имп./с) контрольного и опытного образцов регистрировали одновременно с помощью люминометра Биотос-6 при комнатной температуре 20‒22°С при экспозиции биосенсора с исследуемыми образцами во времени от 5 мин до 48 ч. Оценивали токсичность исследуемых веществ по снижению интенсивности люминесценции клеток биосенсора. Индекс токсичности (Т) образцов определялся автоматически по формуле: Т = 100 × (Iк – I)/Iк, где Iк и I – интенсивность свечения контрольного и опытного образцов соответственно. Оценку токсичности классифицировали по трем группам: значение Т < 20 – образец нетоксичен; значение Т > 20, но <50 – образец токсичен; значение Т > 50 – образец очень токсичен (Образцова и соавт., 2009; Зарубина и соавт., 2009, 2011).
Иногда при действии малых концентраций веществ наблюдается стимуляция свечения тест-организма (Т с отрицательным знаком). Анализ осуществляли при фиксированном времени экспозиции каждого контрольного и опытного образца, одновременно регистрируя их интенсивность люминесценции в трех повторностях.
Статистическая обработка полученных результатов проводилась стандартными методами с использованием критерия Стьюдента при уровне значимости (α = 0.1) для проверки гипотезы о значимости различий полученных данных.
Анализ осуществляли при фиксированном времени экспозиции каждого контрольного и опытного образца, одновременно регистрируя их интенсивность люминесценции; погрешность измерений составила не более 5%.
Исследование морфологии клеток бактериального биотеста с созданным светящимся фенотипом до и после взаимодействия с углеродными наночастицами было проведено методом сканирующей электронной микроскопии с помощью микроскопа Zeiss Merlin (“Zeiss”, Германия). Для проведения измерений бактериальные клетки наносили на чистые кремниевые подложки. Для фиксации и дегидратации образцов был использован протокол, описанный в работе (Grafskaia et al., 2020). Клетки фиксировали глутаровым альдегидом в течение 12 ч при 4°С. Затем образцы были обезвожены путем постепенного увеличения процентного содержания этанола в растворе (10, 30, 50, 70, 90% с инкубацией 10 мин в каждом растворе). Далее образцы были инкубированы в растворе гексаметилдисилазана в этаноле (1 : 1) в течение 10 мин и в 100% гексаметилсилазане до полного высыхания. Таким образом, форма бактериальных клеток была сохранена и не повреждалась во время проведения измерений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследовано действие наночастиц графита и алмаза на нативных клетках Е. coli c lux-опероном и на биосенсоре “Эколюм-06” по нескольким показателям, в частности, по индексу токсичности (изменению биолюминесценции), выживаемости и по морфологии (методом растровой электронной микроскопии) клеток бактерий.
Регистрируя изменения люминесценции при воздействии различных наноматериалов, мы провели оценку их токсичности. В отличие от наблюдаемого нами ранее разрушающего действия углеродных нанотрубок на клетки биосенсора “Эколюм-06” (Образцова и соавт., 2009; Зарубина и соавт., 2009, 2011), в настоящей работе бактерии, имеющие прямой контакт и c алмазными и графитными наночастицами, сохраняли характерную для данного вида бактерий морфологию (рис. 2). Наблюдения проводили в течение 7 дней. Как видно из изображений, представленных на рис. 2, на протяжении этого периода морфологических изменений бактерий не происходило даже при непосредственном контакте клеток E. coli с наночастицами графита и алмаза. Это позволяет нам заключить, что, в отличие от случая взаимодействия с углеродными нанотрубками, клеточная стенка и мембрана бактерий остаются целостными, и клетки более устойчивы к механическому воздействию этих частиц.
Рис. 2.
Изображения, полученные с помощью растровой электронной микроскопии образцов бактериального биосенсора через 3 ч (а, в, д) и через 2 сут (б, г, е) после начала эксперимента; а, б – контрольные образцы; в, г – образцы с наночаcтицами алмаза; д, е – образцы с наночастицами графита.
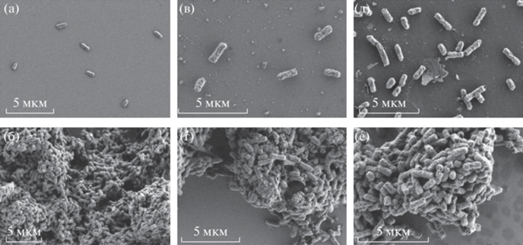
Отсутствие негативных изменений в структурах бактериальных клеток было также подтверждено с помощью наблюдения за изменениями интенсивности биолюминесценции и по выживаемости клеток.
Известно, что биотестирование на основе бактериальной люминесценции является экспрессным (30 мин) методом первичной интегральной оценки токсичности. Для выявления токсичности различных наночастиц время экспозиции может быть выбрано индивидуально. Исследования с генно-инженерным биотестом с созданным светящимся фенотипом позволяет использовать его для изучения токсического действия наночастиц на активность люминесценции и других свойств в течение многих суток, в отличие от известных биотестов на основе природных светящихся бактерий (Зарубина, Сорокина, 2017).
Индексы токсичности наночастиц алмаза и графита во времени представлены в табл. 1. Инкубация клеток биосенсора с наночастицами в концентрациях до 160 мкг/мл вызывала даже небольшой стимулирующий эффект.
Таблица 1.
Эффективность действия (по индексу токсичности Т) образцов наночастиц алмаза и графита, определяемая методом биотестирования на основе люминесценции
| Время экспозиции биотеста с наночастицами, ч | Индекс токсичности (Т) | |
|---|---|---|
| алмазные наночастицы | графитные наночастицы | |
| 1 | ‒28 ± 2 | ‒21 ± 1 |
| 24 | ‒17 ± 1 | 3 ± 1 |
| 48 | ‒9 ± 1 | 18 ± 2 |
Анализируя концентрации исследуемых наночастиц на их биологическую активность, можно выделить зоны концентраций, где каждый вид наночастиц был нетоксичен, токсичен или очень токсичен. Частицы алмаза и графита в диапазоне концентраций до 160 мкг/мл были нетоксичны, индекс токсичности регистрировали при значениях Т ~ ‒28 и ‒21 соответственно. Многие авторы принимают показатели стимуляции люминесценции биотеста, считая их нетоксичными (Дерябин, 2009). Некоторые авторы связывают стимуляцию люминесценции светящихся бактерий с механизмом действия веществ высокой липофильности, в то время как гидрофильные вещества преимущественно вызывают эффект тушения люминесценции. При этом стимуляция и ингибирование свечения бактерий является показателем проявления биологической активности (Зарубина, Сорокина, 2015, 2017).
На сегодняшний день используются различные подходы для оценки токсичности веществ, негативное действие которых может проявляться отдаленно во времени; эти вещества способны нарушать метаболические процессы, протекающие в клетке, и могут оказывать влияние на репродукцию клеток. В нашей работе мы также проанализировали прирост биомассы Е. coli на среде LB (см. раздел “Материалы и методы исследования”) с помощью мониторинга ОП при 560 нм (рис. 3) и дополнительно регистрировали показатель КОЕ. Исследование кривой роста бактерий после инкубации с наночастицами позволило оценить истинное значение токсичности и биологическую активность исследуемых веществ. На рис. 3 представлен полученный в эксперименте по инкубации бактерий с графитом и с алмазом в течение 24 ч график зависимости ОП от времени. Из рисунка видно, что рост клеток в присутствии наночастиц алмаза оставался на том же уровне, что и в контроле, и не зависел от концентрации наночастиц. Оптическая плотность суспензии после обработки клеток наночастицами алмаза возросла максимально на 3%. На основании полученных нами данных можно сделать вывод, что наночастицы алмаза в исследованных концентрациях не оказывали влияния на клеточное деление. Однако частицы графита значительно стимулировали рост оптической плотности, и к 20 ч культивирования клеток наблюдался значительный прирост биомассы в 2.5 раза. Ростовые характеристики изменялись после инкубации с наночастицами графита, стимулируя рост и по плотности, и по КОЕ. Считается, что в зависимости от концентрации наночастиц, у микроорганизмов могут активироваться адаптационные механизмы регуляции на уровне генома, в результате которых бактерии приобретают устойчивость, что повышает их выживаемость в условиях стресса (Зарубина и соавт., 2017). Мы установили, что исследуемые наночастицы графита и алмаза при концентрации 160 мкг/мл обладают слабовыраженной токсичностью.
Рис. 3.
Оптическая плотность при 560 нм в суспензиях клеток биосенсора, выращенных с наночастицами алмаза и графита относительно контроля без наночастиц.

Таким образом, использованный нами метод на основе бактериальной люминесценции показал различия в действии ранее изученных углеродных нанотрубок, которые были токсичны, и новых наночастиц на основе алмаза и графита. Алмазные и графитные наночастицы в водных суспензиях в изученном диапазоне концентрации оказались безопасными и нетоксичными.
В рамках данной работы установлено, что инкубация наночастиц алмаза и графита в течение 24 ч с клетками биосенсора и с нативными клетками E. coli не оказывала на них повреждающего действия, в отличие от углеродных нанотрубок. Полученные результаты интересны как для дальнейших исследований воздействия данных наноматериалов на живые клетки, так и их применения, например, в медицине. Методы биотестирования на основе светящихся микроорганизмов дают полезную информацию о выборе подходящих и безопасных типов наночастиц, их размеров и свойств поверхности, что позволяет свести к минимуму их токсичность и подобрать те концентрации, которые безопасны для исследованных нами микроорганизмов биотеста “Эколюм-06”, который, как показано многочисленными исследованиями, коррелирует с ответной реакцией высших организмов, оцененной по LD50 (Danilov et al., 2002).
Список литературы
Аполонская И.А., Тюрнина А.В., Копылов П.Г., Образцов А.Н. Термическое окисление детонационного наноалмаза // Вестн. Московского ун-та. Серия 3: Физика. Астрономия. 2009. Т. 64. № 4. С. 72‒75.
Apolonskaya I.A., Tyurnina A.V., Kopylov P.G., Obraztsov A.N. Thermal oxidation of detonation nanodiamond // Moscow University Physics Bulletin. 2009. V. 64. № 4. C. 433‒436.
Данилов В.С., Зарубина А.П., Ерошников Г.Е., Соловьева Л.Н., Карташев Ф.В., Завильгельский Г.Б. Сенсорные биолюминесцентные системы на основе lux-оперонов разных видов люминесцентных бактерий // Вестн. Московского ун-та. Серия Биология. 2002. Т. 57. № 3. С. 20‒24.
Danilov V.S., Zarubina A.P., Eroshnicov G.E., Solov’eva L.N., Kartashev F.V., Zavil’gelsky G.B. The biolumiscent sensor systems with lux-operons from various species of luminescent bacteria // Moscow University Biological Sciences Bulletin. 2002. V. 57. № 3. P. 20‒24.
Дерябин Д.Г. Бактериальная биолюминесценция: фундаментальные и прикладные аспекты. М.: Наука, 2009. 246 с.
Зарубина А.П., Лукашов Е.П., Деев Л.И., Пархоменко И.М., Рубин А.Б. Биотестирование биологических эффектов одностенных углеродных нанотрубок с использованием тест-системы люминесцентных бактерий // Российские нанотехнологии. 2009. Т. 4. № 11‒12. С. 152‒155.
Зарубина А.П., Лукашов Е.П., Деев Л.И., Паpхоменко И.М., Обpазцова Е.А., Новоселова Л.А., Рубин А.Б. Оценка рисков токсичности углеродных наноматериалов // Нано- и микросистемная техника. 2011. № 10. С. 21‒26.
Зарубина А.П., Сорокина Е.В. Первый среди равных. Один из самых экспрессных и доступных методов биотестирования ‒ биолюминесцентный тест // Евразийский Союз Ученых (ЕСУ). Биологические науки. 2015. Т. 17. № 8. С. 161‒163.
Зарубина А.П. Сорокина Е.В. Биотестирование с использованием бактериального люминесцентного теста: достоинства и усовершенствования метода // Успехи современной биологии. 2017. Т. 137. № 6. С. 613‒620.
Зарубина А.П., Сорокина Е.В., Пархоменко И.М., Гапочка М.Г. Действие нейромедиаторов в условиях искусственного электромагнитного загрязнения среды // Радиационная биология. Радиоэкология. 2017. № 6. С. 20‒30.
Образцова Е.А., Лукашев Е.П., Зарубина А.П., Пархоменко И.М., Яминский И.В. Бактерицидное действие одностенных углеродных нанотрубок // Вестн. Московского ун-та. Серия 3: Физика. Астрономия. 2009. № 3. С. 81‒84.
Obraztsova E.A., Lukashev E.P., Zarubina A.P., Parkhomenko I.M., Yaminsky I.V. Bactericidal action of single-walled carbon nanotubes // Bulletin of Moscow University. Series 3: Physics, Astronomy. 2009. № 3. P. 81‒84.
Camargo J.R., Orzari L.O., Araújo D.A.G., Oliveira P.R., Kalinke C., Rocha D.P., Santos A.L., Takeuchi R.M., Munoz R.A.A., Bonacin J.A, Janegitz B.C. Development of conductive inks for electrochemical sensors and biosensors // Microchem. J. 2021. V. 164. P. 105998.
Carbon. The Future Material for Advanced Technology Applications / Eds. Messina G., Santangelo S. Berlin‒Heidelberg: Springer-Verlag, 2006. 551 p.
Chu Z., Zhang S., Zhang B., Zhang C., Fang C.Y., Rehor I., Cigler P., Chang H.C., Lin G., Liu R., Li Q. Unambiguous observation of shape effects on cellular fate of nanoparticles // Sci. Rep. 2014. V. 28. P. 4495. https://doi.org/10.1038/srep04495
Dimov D., Amit I., Gorrie O., Barnes M.D., Townsend N.J., Neves A.I.S., Withers F., Russo S., Craciun M.F. Ultrahigh performance nanoengineered graphene-concrete composites for multifunctional applications // Adv. Funct. Mater. 2018. V. 28. P. 1705183.
Grafskaia E., Pavlova E., Babenko V.V., Latsis I., Malakhova M., Lavrenova V., Bashkirov P., Belousov D., Klinov D., Lazarev V. The Hirudo medicinalis microbiome is a source of new antimicrobial peptides // Int. J. Mol. Sci. 2020. V. 21. P. 7141.
Meng F., Wang H., Huang F., Guo Y., Wang Z., Hui D., Zhou Z. Graphene-based microwave absorbing composites: a review and prospective // Composites. Part B. 2018. V. 137. P. 260–277.
Nistor P.A., May P.W. Diamond thin films: giving medical applications new shine // J. Royal Soc. Interface. 2017. V. 14. P. 1‒15.
Pavlova A.S., Obraztsova E.A., Belkin A.V., Monat C., Rojo-Romeo P., Obraztsova E.D. Liquid-phase exfoliation of flaky graphite // J. Nanophotonics. 2016. V. 10. P. 012525.
Perevedentseva E., Lin Y., Cheng C. A review of recent advances in nanodiamond-mediated drug delivery in cancer // Expert Opin. Drug Deliv. 2021. V. 18. P. 369‒382.
Pete Scala E. A brief history of composites in the U.S. ‒ the dream and the success // J. Minerals. 1996. V. 48. P. 45–48.
Pierson H.O. Handbook of Carbon, Graphite, Diamond and Fullerenes. Properties, Processing and Applications. Elsevier Inc., 1994. 400 p.
Schrand A.M., Huang H., Carlson C., Schlager J.J., Osawa E., Hussain S.M., Dai L. Are diamond nanoparticles cytotoxic // J. Phys. Chem. B. 2007. V. 111. P. 2‒7.
Torelli M.D., Nunn N.A., Shenderova O.A. A perspective on fluorescent nanodiamond bioimaging // Small. 2019. V. 15. e1902151.
Wu Y., Jelezko F., Plenio M., Weil T. Diamond quantum devices in biology // Angew. Chem. Int. Edn. 2016. V. 55. P. 6586–6598.
Zhang X., Hu W., Li J., Taob L., Weib Y. A comparative study of cellular uptake and cytotoxicity of multi-walled carbon nanotubes, graphene oxide, and nanodiamond // Toxicol. Res. 2012. V. 1. P. 62. https://doi.org/10.1039/C2TX20006F
Zhao J., Lin M., Wang Z., Cao X., Xing B. Engineered nanomaterials in the environment: Are they safe? // Crit. Rev. Environ. Sci. Technol. 2020. P. 1443‒1478. Published online. https://doi.org/10.1080/10643389.2020.1764279
Дополнительные материалы отсутствуют.


