Микробиология, 2022, T. 91, № 3, стр. 341-352
Биодеградация азокрасителя Methyl Red метаногенными микробными сообществами, выделенными из донных отложений реки Волга
Ю. В. Тактарова a, *, Л. И. Ширинкина a, А. С. Будённая a, М. А. Гладченко a, И. Б. Котова a
a Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: yvtaktarova@gmail.com
Поступила в редакцию 21.01.2022
После доработки 25.01.2022
Принята к публикации 26.01.2022
- EDN: CPHYBS
- DOI: 10.31857/S0026365622300085
Аннотация
Азокрасители ‒ растворимые, стабильные в окислительных условиях ксенобиотики, которые повсеместно используются в человеческой практике, содержатся в жидких и твердых производственных и бытовых отходах и регулярно попадают в окружающую среду. В работе исследовали возможность деструкции технического азокрасителя Methyl Red (MR) анаэробными микробными сообществами, выделенными из донных отложений реки Волга, и их состояние при контакте с данным ксенобиотиком. Впервые показана способность таких неадаптированных к азокрасителю сообществ к деградации MR с образованием устойчивого N,N-диметил-п-фенилендиамина и биоразлагаемой 2-аминобензойной кислоты. Сравнение активности метаногенеза в сообществах без и с MR показало снижение образования биогаза на 43.80%, что свидетельствует о токсическом действии MR (и, возможно, ароматических интермедиатов его разложения) на микроорганизмы. С помощью высокопроизводительного секвенирования гена 16S рРНК показаны значительные изменения в структурно-функциональной организации метаногенного сообщества в присутствии MR и смена доминирующих групп. Так, представительство бактерий сем. Geobacteriaceae в сообществе с MR увеличилось почти в 5 раз, а сем. Clostridiaceae – снизилось в 3 раза, причем доминирующим стал род Proteiniclasticum. При добавлении MR представители сем. Methanobacteriaceae, Methanofastidiosaceae, Methanoregulaceae, Methanosaetaceae, Methanomassillicoccaceae, составляющие в исходном сообществе суммарно 33.32% от общего числа архей, обнаружены не были. Увеличение в сообществе с MR доли микроорганизмов сем. Desulfоvibrionaceae, Desulfosarcinaceae и Gallionellaceae предположительно связано с их возможным участием в разрушении MR, так как в метаногенных сообществах они обычно выступают в качестве синтрофов. Подтверждено, что для обесцвечивания MR необходимо присутствие живых клеток, адсорбция является только его начальной стадией, а влияние химического восстановления азосвязи минимально. Наша первичная лабораторная модель показывает, что естественные сообщества потенциально способны разрушить MR, но и азокраситель оказывает значительное воздействие на их структуру.
В настоящее время во всем мире отмечается интенсивное загрязнение биосферы устойчивыми синтетическими соединениями ‒ ксенобиотиками, присутствующими практически во всех объектах и материалах, созданных человеком. Азокрасители относятся к растворимым ксенобиотикам, широко применяемым в лакокрасочной, нефтехимической, текстильной, типографской, фармацевтической и пищевой отраслях (Rawat et al., 2016) и регулярно попадающим в сточные воды и твердые отходы данных производств. Значительное присутствие в окружающей среде показывают также ароматические амины, которые используются как самостоятельные вещества или образуются как интермедиаты разложения азокрасителей. Отказаться одномоментно от этих соединений невозможно, поэтому становятся актуальными исследования возможности их микробной деструкции, а также их воздействия на естественные и антропогенные экосистемы. Также малоизученным представляется вопрос об отдаленных последствиях постоянного присутствия азокрасителей и ароматических аминов в природе даже в малых концентрациях.
Азокрасители активно используются из-за простоты синтеза, высокой стабильности, устойчивости к окислению и облучению, а также способности окрашивать разнообразные материалы. Их молекулы содержат азогруппы (‒N=N‒), связывающие бензольные или нафталиновые кольца (Гордон, Грегори, 1987). Для их удаления из сточных вод применяют физико-химические (адсорбция, осаждение, химическое окисление и восстановление, фото- и электрохимическое разложение) и биологические методы (Линькова и соавт., 2011). Однако остается актуальной задача поиска микробных сообществ, способных осуществлять биодеградацию этих соединений с образованием безопасных продуктов.
В природе микробные сообщества являются деструкторами сложных органических веществ, способствуя самоочищению экосистем. При этом сложное соединение может изменяться незначительно (трансформироваться), распадаться на менее сложные части (фрагментироваться) или превращаться в простые неорганические вещества и метан, т.е. претерпевать полную минерализацию. Ксенобиотики попадают не только в аэрируемую зону водоема, но и в донные отложения, где создаются микроаэрофильные и анаэробные условия. Тогда в конверсии ксенобиотиков участвуют факультативно и облигатно анаэробные микроорганизмы (денитрификаторы, сульфат- и металлоредукторы, метаногены) (Хоменков и соавт., 2008). При окислении одинакового донора электронов выход энергии в электронтранспортной цепи зависит от окислительно-восстановительного потенциала использованного акцептора, который убывает в ряду “кислород‒нитрат‒железо‒сульфат‒карбонат”. Однако карбонатное дыхание с образованием метана не нуждается в дополнительных экзогенных акцепторах электронов, поскольку углекислый газ образуется повсеместно. Конечный продукт метан может быть использован как энергоресурс.
Разложение азокрасителей состоит из двух этапов – разрыва азосвязей (обесцвечивания) и деградации образовавшихся бесцветных ароматических аминов. В анаэробных условиях обесцвечивание происходит за счет четырехэлектронного восстановления азосвязи. Считается, что эта реакция может приводить к неспецифической детоксикации, так как часто интермедиаты менее токсичны, чем исходные азокрасители (Razo-Flores et al., 1997). Обесцвечивание может происходить как внутри, так и вне клеток различными путями. Ферментативное восстановление может происходить под действием специфичных или неспецифичных азоредуктаз (Stolz, 2001), либо как побочная реакция, катализируемая ферментами с другими функциями. Однако многие азокрасители – это молекулы с большой молекулярной массой, диссоциирующие в растворе, поэтому их проникновение в клетку затруднено. Непрямое биологическое восстановление азосвязей возможно с помощью окислительно-восстановительных медиаторов (НАДН, НАДФН, ФАД и др.) в бескислородных условиях. Их молекулы могут восстанавливаться за счет мембранных ферментов, а некоторое количество внутриклеточных медиаторов может попадать в среду при лизисе клеток.
Прямое и непрямое химическое восстановление азосвязей может происходить за счет восстановленных форм органических и неорганических соединений (часто это цистеин, сульфид, Fe2+), присутствующих в среде как химические соединения, либо произведенные за счет метаболизма культивируемых в этой среде микроорганизмов. В первом случае восстановитель непосредственно вступает в химическую реакцию с азокрасителем, а во втором – эта реакция опосредуется транспортом электронов от восстановителя по электрон-транспортной цепи клетки к азокрасителю как акцептору (Stolz, 2001).
При разрыве азосвязи образуются разнообразные аминоароматические интермедиаты, которые в присутствии кислорода подвергаются автополимеризации, поэтому, несмотря на более длинный путь анаэробной конверсии, она является более эффективной для их полной минерализации. В анаэробных условиях наиболее часто периферические метаболические пути приводят к образованию бензоил-КоА, который далее дециклизуется специфической мультисубъединичной АТФ-зависимой редуктазой. Наличие заместителей и химическая стабильность бензольного кольца значительно затрудняет полную минерализацию аминоароматических соединений (Хоменков и соавт., 2008).
Способность к разрушению аминоароматики выявлена у многих нитрат-, сульфат- и железоредукторов (Johann, Georg, 1997; Савельева и соавт., 2002; Savelieva et al., 2004), некоторых фототрофов и бродильщиков (Whittle et al., 1976; Kluge et al., 1990; Johann, Georg, 1997), однако каждый из них характеризуется определенным набором разрушаемых веществ. В анаэробных условиях наибольшая эффективность и глубина биодеструкции таких соединений достигается в агрегированных микробных сообществах, а развитие молекулярно-генетических методов идентификации микроорганизмов позволяет анализировать структуру таких консорциумов и прослеживать их сукцессию при контакте с ксенобиотиками.
Известно, что азокрасители и ароматические амины в зависимости от концентрации могут обладать токсичностью по отношению к микроорганизмам, влияющей на их жизнеспособность и функционирование. У ранее исследованных метаногенных сообществ при контакте с этими веществами снижалось общее количество клеток и биоразнообразие, менялось соотношение компонентов сообщества вплоть до смены доминирования, изменялась морфология агрегатов и клеток и ингибировался ацетокластический метаногенез (Линькова, 2011).
Для прогнозирования локальных и глобальных последствий постоянного присутствия поллютантов в окружающей среде уже недостаточно рассматривать микробный компонент как “черный ящик” (Andren, Balandreau, 1999), поскольку именно микробное разнообразие может быть важным параметром, влияющем на направление развития и функционирования экосистем (Friedlingstein et al., 2006; McGuire et al., 2010).
Поскольку именно микробное сообщество является функциональной единицей, взаимодействующей с окружающей средой, то изменения под действием устойчивых загрязнителей состава физиологических групп и метаболических путей в нем может катастрофически отразиться на всей экосистеме. На начальных этапах прогностического моделирования может помочь использование простых лабораторных моделей влияния ксенобиотика на структурно-функциональную организацию микробного сообщества (содержимое микробного “черного ящика”).
Целью настоящей работы было изучение процесса биодеградации технического азокрасителя Methyl Red метаногенными микробными сообществами из донных отложений реки Волга и состояния этих сообществ при контакте с данным ксенобиотиком.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Источник биологического материала. Источником выделения активных метаногенных микробных сообществ были пробы донных отложений реки Волга (Московская область, г. Дубна, район Ратмино), взятые 06.09.2020 г. Температура воды в месте отбора составляла 17°С, рН 8.09. Усредненные пробы (без сохранения слоев) ила отбирали с помощью пробоотборника на глубине около 7 м в 40 м от берега. Мощность донных отложений в этом месте составляла 80‒120 см. Пробу ила хранили при 3–5°С в герметичных флаконах без доступа воздуха в течение 7 сут, а затем использовали в качестве инокулята при посеве.
Исследуемый ксенобиотик и предполагаемые интермедиаты. В качестве субстрата был использован технический азокраситель Methyl Red (MR, Метиловый красный, 4-диметиламиноазобензол-2-карбоновая кислота), его основные характеристики приведены в табл. 1. Это синтетический анилиновый краситель, кислотно-основный индикатор, в кислой среде (при рН от 0 до 4.4) имеющий красный цвет, а в нейтральной и щелочной (при рН от 6.2 до 14) ‒ желтый. Представляет собой порошок темно-красного цвета, плохо растворимый в воде. Его получают из антраниловой кислоты и диметиланилина путем диазотирования. Метиловый красный используют для титрования алифатических аминов, гетероциклов, содержащих азот, и различных фармацевтических препаратов в 1,4-диоксане (Красько и соавт., 2017). Также используется в качестве индикатора в химической промышленности. Метиловый красный относится к 3-му классу опасности для человека.
Таблица 1.
Основные характеристики азокрасителя Methyl Red и возможных интермедиатов биодеградации MR
| Название | Молярная масса, г/моль | Назначение | Характерные максимумы поглощения, нм |
|---|---|---|---|
| Methyl Red (Метиловый красный, метиленовый красный, С.I.13020) | 269 | Технический краситель | 431 |
| N,N-диметил-п-фенилендиамин (N,N-диметил-1,4-фенилендиамин, N,N-dimethyl-p-phenylenediamine, ДМФ) | 136 | ‒ | 297 и 242 |
| 2-Аминобензойная кислота (2-АБК, o-anthranilic acid) | 137 | ‒ | 310 |
| 1,4-Фенилендиамин (1,4-phenylenediamine) | 108 | ‒ | 302 и 329 |
Азокраситель хранили в виде анаэробного концентрированного раствора в стерильной дистиллированной воде и добавляли в опытные флаконы с помощью стерильных шприцев. В качестве предполагаемых интермедиатов разложения азокрасителя рассматривали (табл. 1, рис. 1): N,N-диметил-п-фенилендиамин (ДМФ), 1,4-фенилендиамин, 2-аминобензойную (антраниловую) кислоту (2-АБК).
Среды и условия культивирования. Инкубацию осуществляли в анаэробных условиях на минеральной среде (Razo-Flores et al., 1997) следующего состава (мг/л): NH4Cl – 280; CaCl2 · 2H2O ‒ 10; K2HPO4 ‒ 250; MgSO4 · 7H2O ‒ 100; NaHCO3 ‒ 5000; дрожжевой экстракт ‒ 100; резазурин ‒ 0.2; раствор микроэлементов: H3BO3 ‒ 0.05; FeCl3 · 4H2O ‒ 2; ZnCl2 ‒ 0.05; MnCl2 · 4H2O ‒ 0.05; CuCl2 · 2H2O ‒ 0.03; AlCl3 · 6H2O ‒ 2; NiCl2 · 6H2O ‒ 0.05; Na2SeO3 · · 5H2O ‒ 0.1 и 36% HCl (100 мкл/л); рН 7.0. Накопительные культуры культивировали во флаконах объемом 120 мл с герметично закрывающимися резиновыми пробками, зажатыми алюминиевыми колпачками, в минеральной среде. Объем жидкой фазы составлял 40 мл. Газовая фаза была заменена на инертный газ (аргон) для создания анаэробиоза. В каждый флакон после стерилизации добавляли азокраситель из анаэробного концентрированного раствора до конечной концентрации 1.0 мМ и вносили инокулят в количестве 10% от объема среды. Культивирование проводили при 30°С без перемешивания. Отбор проб, а также внесение различных добавок осуществляли с помощью стерильных шприцев, не нарушая условий анаэробиоза и стерильности. Все эксперименты проводили в трех повторностях. Для отслеживания метаногенеза за счет биоразложения азокрасителя были поставлены контрольные варианты: с биологическим материалом, но без добавления азокрасителя (биологический контроль) и без биологического материала, но с добавлением азокрасителя (абиотический контроль). Культивирование проводили в статичных условиях, в темноте при 30°С.
Аналитические методы исследования. Спектрофотометрическое сканирование проводили в диапазоне длин волн от 200 до 600 нм в фосфатном буфере, предварительно центрифугируя пробу, на спектрофотометре “Shimadzu” UV-1202 (Япония). Концентрации MR и возможных интермедиатов его разложения (табл. 1) определяли по величине оптической плотности при длинах волн максимумов поглощения (431 нм для MR, 310 нм для 2-АБК, 297 и 242 нм для ДМФ, 302 и 329 нм для 1,4-фенилендиамина), используя калибровочные кривые для каждого вещества. Расчет концентрации субстрата проводили по формуле:
где С (мМ) – концентрация вещества; OD ‒ оптическая плотность; tgα ‒ тангенс угла наклона калибровочной кривой; X ‒ разведение азокрасителя; M ‒ молекулярная масса.
Концентрацию ароматических аминов определяли также с помощью ВЭЖХ на хроматографе “Gilson” (Франция), используя колонку с обращенной фазой 250 × 4 мм, Диасорб 130-С16Т, 6 мкм, “BCM” (Россия) в системе уксусная кислота (1%)–метанол (в соотношении 50 : 50 по объему). Скорость подачи элюента – 0.6 мл/мин, давление – 150 бар. Времена удержания ароматических аминов составляли: для 1,4-фенилендиамина ‒ 3.2 мин, для ДМФ – 4.4 мин и для 2-АБК – 5.2 мин. В качестве детектора использовали спектрофотометр, настроенный на длину волны 225 нм (оптимум поглощения ароматических соединений). Объем вводимой пробы – 20 мкл. Расчет концентрации компонентов смеси проводили по площадям пиков, отнесенным к площадям пиков веществ в стандартных растворах.
Для анализа состава газообразных (водород, метан и углекислый газ) продуктов применяли газовую хроматографию (ГХ) на хроматографе Кристалл 2000М (ЗАО СКБ “Хроматэк”, Россия) со следующими параметрами: детектор: ДТП (детектор по теплопроводности, катарометр), колонка: набивная, с внутренним диаметром 3 мм, длиной 1 м, неподвижная фаза – уголь. Температура термостата колонок: 110°С. Температура детектора: 150°С. Газ-носитель – аргон, расход 30 мл/мин, давление 20 кПа. Объем вводимой пробы 1 мл, время анализа ‒ 4 мин. Программное обеспечение “Хроматэк-аналитик 2.5”. Пробу отбирали из газовой фазы флаконов с помощью стерильных шприцев и вводили образец в хроматографическую колонку через систему ввода. Количественное определение компонентов рассчитывали по площади под хроматографическим пиком. Избыточное давление во флаконах измеряли с помощью манометра “WIKA” (Германия) и учитывали эти данные при расчете конечных концентраций газовых метаболитов. Для пересчета числового значения объемной концентрации газа, выраженной в процентах, в молярную концентрацию (мМ) использовали следующую формулу:
где Р1 – парциальное давление газа (%/100); Vж.ф. – объем жидкой фазы во флаконе, мл; Vг.ф. – объем газовой фазы во флаконе, мл; Т0 – температура при нормальных условиях, 273°К; Т1 – рабочая температура, К; Р0 – давление при нормальных условиях, 1 атм.; Робщ ‒ общее давление во флаконе, атм.; 22.4 – объем 1 моль газа при 273 К, л моль–1.
Морфологические изменения в сообществах отслеживали с помощью световой микроскопии фиксированных окрашенных препаратов при общем увеличении 1000×. Препараты фиксировали в пламени горелки, окрашивали фуксином и просматривали с помощью масляной иммерсии.
Филогенетический анализ состава микробных сообществ был проведен на основе данных высокопроизводительного секвенирования участков гена 16S рРНК. Для выделения тотальной ДНК из проб использовали набор FastDNA Spin Kit for Soil (“MP Biomedicals”, США), следуя инструкциям производителя. Концентрацию и чистоту препаратов ДНК оценивали спектрофотометрически при λ 260 и 280 нм на приборе NanoDrop 2000C (“Thermo Fisher Scientific”, США). Фрагменты генов 16S рРНК амплифицировали с помощью ПЦР с использованием “универсальных” праймеров для участка V4 в соответствии с ранее описанной методикой (Fadrosh et al., 2014). Использовали систему праймеров 515F (5'-GTGBCAGCMGCCGCGGTAA-3') (Hugerth et al., 2014) и Pro-mod-805R (5'-GACTACNVGGGTMTCTAATCC-3') (Merkel et al., 2019). Эти ПЦР-фрагменты секвенировали на высокопроизводительном геномном анализаторе MiSeq “Illumina” (США) с использованием набора реактивов для считывания 150 нуклеотидов с каждого конца в Центре “Биоинженерия” ФИЦ Биотехнологии РАН. Анализ нуклеотидных последовательностей проводили при помощи программного пакета QIIME (версия 1.9.0) – http://qiime.org (Bolyen et al., 2019). Для построения круговых диаграмм, иллюстрирующих целостный филогенетический состав микробных сообществ, использовали графическую программу Krona.
Статистическую обработку данных проводили, используя пакет программ MS Excel 2016, 2019.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Процесс биодеградации MR метаногенными микробными сообществами, выделенными из донных отложений реки Волга. На протяжении 28 сут наблюдения во всех опытных и контрольных образцах рН оставался равен 7. В вариантах абиотического контроля концентрация азокрасителя оставалась неизменной, тогда как в опытных вариантах наблюдали обесцвечивание культуральной жидкости (доп. материалы, рис. S1 ).
В этих вариантах спектрофотометрический анализ культуральной жидкости в динамике показал полное исчезновение пика азокрасителя на 7 сут, что свидетельствует о его разложении (рис. 2).
Рис. 2.
Обесцвечивание азокрасителя MR микробными сообществами из донных отложений р. Волга: 1 – убыль субстрата; 2 – процент обесцвечивания.
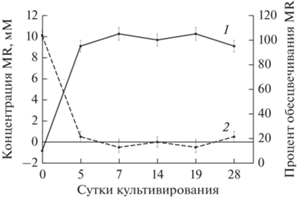
На 7 сут в культуральной жидкости были зафиксированы интермедиаты процесса –ДМФ и 2-АБК. Концентрация 2-АБК была максимальной на 5 сут, затем начинала снижаться, т.е. интермедиат подвергался дальнейшему разрушению. На 28 сут 2-АБК в опытных вариантах не регистрировалась (рис. 3, 4).
Рис. 3.
Изменение спектров в образцах с азокрасителем MR и микробными сообществами из донных отложений р. Волга: 1 – 0 сут; 2 – 7 сут.

Рис. 4.
Изменение концентрации 2-аминобензойной кислоты, интермедиата разложения азокрасителя MR микробными сообществами из донных отложений р. Волга.

Анализ структурной формулы азокрасителя MR позволяет предположить, что при восстановлении азосвязи могут образоваться ДМФ и 2‑АБК с максимумами поглощения 242 и 310 нм (рис. 5). Это подтверждено и результатами ВЭЖХ: появлением пиков на 4.4 и 5.2 мин соответственно, и не противоречит данным литературы (Емашова и соавт., 2009).
Рис. 5.
Предполагаемая схема распада красителя MR при восстановлении азосвязи в анаэробных условиях.

Образование биогаза (смеси СН4 и СО2) как конечного продукта деструкции шло и в опытных вариантах, и в биоконтроле (рис. 6). Выделение молекулярного водорода зарегистрировано не было. В случае опытных вариантов биогаз образовывался в меньших количествах по сравнению с биоконтролем (на 43.8%), что свидетельствует о токсичном воздействии MR на микробиоту донных осадков р. Волга. Это согласуется с имеющимися литературными данными для микробных сообществ другого происхождения (Емашова и соавт., 2009).
Рис. 6.
Образование газов микробными сообществами из донных отложений р. Волга, 28 сут: 1 – CO2; 2 – CH4.

Таким образом, микробные сообщества, выделенные из илов р. Волга, способны к частичной деградации MR при инкубации в синтетической среде с азокрасителем в качестве единственного источника углерода и энергии, при 30°С и нейтральном рН. Однако присутствие в среде азокрасителя и, возможно, образовавшихся ароматических аминов приводит к подавлению метаногенеза в них и тормозит полную минерализацию начального субстрата.
Анализ компонентного состава микробных сообществ из донных отложений р. Волга. Для изучения влияния MR (и, возможно, интермедиатов его обесцвечивания) на микробные сообщества из донных осадков р. Волга были просмотрены фиксированные окрашенные препараты для исходных образцов и опытных вариантов, обесцвечивающих азокраситель. Основная часть клеток во всех препаратах проб ила была представлена короткими палочками и кокками, иногда встречались спириллы. В сообществе, продолжительное время контактировавшем с азокрасителем, наблюдали значительное снижение численности клеток. Часть клеток имела неправильную форму и поврежденные края, что может свидетельствовать об их нежизнеспособности (рис. 7).
Рис. 7.
Морфология клеток контрольных (а) и опытных (б) образцов из донных отложений р. Волга. Окраска фуксином, увеличение ×1000.
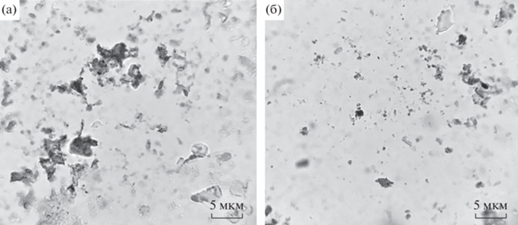
Аналогичные результаты получены для анаэробных сообществ из очистных сооружений и илов озера Цайдам (Емашова и соавт., 2009; Линькова и соавт., 2013).
Анализ филогенетического разнообразия микроорганизмов из донных отложений р. Волга до и после контакта с азокрасителем MR проводили с помощью высокопроизводительного секвенирования гена 16S рРНК. Исследование выявило значительные отличия в составе сообществ, контактировавших с MR. Так, доминирующие группы среди бактерий в контрольном образце были представлены видами из семейств Clostridiaceae (4.73‒5.05%), Anaerolineaceae (5.99‒6.10%), Geobacteriaceae (2.90‒3.03%), а также штаммами LCP-89 (3.21‒3.37%), Bacteroidetes vadinHA17 (11.03‒11.19%) (рис. 8). Среди архей наиболее многочисленными оказались семейства Nitroso-sphaeraeae (15.38%), Methanobacteriaceae (10.99%), Methanosarcinaceae (5.52%), и некоторые другие (рис. 9).
Рис. 8.
Состав микробного сообщества из донных отложений р. Волга до и после контакта с азокрасителем MR, по данным анализа последовательностей фрагментов генов 16S рРНК.

Рис. 9.
Археи, представленные в сообществе из донных отложений р. Волга, до и после контакта с азокрасителем MR, по данным анализа последовательностей фрагментов генов 16S рРНК.

В сообществе с азокрасителем MR доминирующими семействами среди бактерий оказались Geobacteriaceae (14.18‒14.32%), Anaerolineaceae (6.91‒6.93%), Comamonadaceae (4.46‒4.56%), Rhodocyclaceae (6.03‒6.29%), Prolixibacteriaceae (5.67‒5.71%), а также штамм Bacteroidetes vadinHA17 (9.36‒9.49%). Среди архей в этом случае наиболее многочисленными были семейства Nitrososphaeraceae (24.32%), SCGCAAAO11-D5 (8.11%), Altiarchaeaceae (8.11%).
При добавлении MR снизилось общее разнообразие архей. Семейства Methanobacteriaceae, Methanofastidiosaceae, Methanoregulaceae, Methanosaetaceae, Methanomassillicoccaceae, составляющие в контроле суммарно 33.32% от общего числа архей, не были представлены в опытном варианте, что подтверждает данные об угнетении метаногенеза под действием азокрасителя. Cемейства Altiarchaeaceae, Methanoperedenaceae, а также штаммы SCGCAAA011-D5, GW2011, DSEG выявлены в образце с азокрасителем, но отсутствуют в контроле. В опыте процентное соотношение представителей сем. Nitrososphaeraceae и пор. Woeseaechaeales c неопределенным семейством увеличивается на 7.64 и 6.26% соответственно, а cем. Methanomassiliicoccaceae и типа Bathyarchaeia с неопределенным семейством, наоборот, снижается на 2.82 и 11.58% соответственно.
Семейство Geobacteriaceae, представленное в контроле 2.90‒3.00% от общего числа видов, в варианте с красителем увеличило долю до 14.18‒14.32%, тогда как представители семейства Clostridiaceae после контакта с азокрасителем снизили свою численность с 4.73 до 1.22‒1.37% от общего числа видов. В контрольной пробе данное семейство представлено в основном родом Сlostridium (sensu stricto, 86.00%), тогда как в образце с MR на этот род приходится 2.00%, а на род Proteiniclasticum 82.00‒83.00%. Группа Proteiniclasticum, согласно литературным данным (Zhang et al., 2010), встречается в илах очистных сооружений, участвуя в синтрофных взаимодействиях посредством ускорения разложения пропионата. Довольно многочисленным и в контроле (11.19%), и в опыте (9.48%) является штамм Bacteroidetes vadinHA17. Представители шести групп (сем. Pedosphaera-ce-ae, Steroidobacteraceae, Peptostreptococcaceae, Desulfobulbaceae, Hungateiclostridiaceae и штамм LCP89), имеющиеся в контроле в количестве 1% и более, практически не встречаются в пробе с азокрасителем. Возможно, на данные группы микроорганизмов азокраситель MR оказывает токсическое воздействие. Однако есть микроорганизмы, встречающиеся в вариантах с азокрасителем чаще, чем в контроле: сем. Desulfоvibrionaceae (0.52‒0.55% в контроле, 1.25‒1.37% в опыте), Desulfosarcinaceae (0.90‒0.92% в контроле, 1.17‒1.29% в опыте), штаммы PHOS-HE36 (0.54‒0.58% в контроле, 1.05% в опыте), Family XI (0.11‒0.18% в контроле, 1.22‒1.23% в опыте). Представители сем. Gallionellaceae, также увеличившие свое представительство в варианте с MR (0.08‒0.12% в контроле, 2.98‒3.15% в опыте), по литературным данным являются индикатором биодеградации загрязняющих веществ, в частности, хлорированных углеводородов в грунтовых водах (Guan et al., 2013). Микроорганизмы сем. Desulfosarcinaceae ‒ это сульфатредуцирующие бактерии, способные к анаэробной деградации различных органических веществ, в том числе, насыщенных углеводородов (Watanabe et al., 2017). Не исключено, что увеличение количества микроорганизмов этих групп связано с их возможным участием в различных стадиях процесса минерализации азокрасителя MR, так как в метаногенных сообществах они обычно выступают в качестве синтрофов. Таким образом, согласно полученным данным, можно сделать вывод о смене доминирующих микробных групп в сообществе в результате добавления азокрасителя MR.
В целом, под действием этого ксенобиотика меняется структурно-функциональная организация исходных анаэробных сообществ донных отложений р. Волга.
Оценка вклада небиологических факторов в процесс разложения азокрасителя. Одним из методов удаления азокрасителей из сточных вод является их адсорбция на частицах биомассы (живых или мертвых клетках), во время которой концентрация соединения достигает насыщения. Такой адсорбент нуждается в регенерации, либо должен быть удален вместе с азокрасителем и утилизирован. Однако адсорбция может быть начальной стадией процесса биодеградации азокрасителя. Для проверки вклада адсорбции в этот процесс нами были поставлены на инкубацию варианты с живым и автоклавированным при 1 атм илом из р. Волга в той же среде при 30°C в статичных условиях и при перемешивании (220 об./мин). В пенициллиновые флаконы объемом 15 мл вносили раствор MR до конечной концентрации 5 мМ, 5 мл посевного материала и 5 мл анаэробной среды. Газовая фаза была заменена на аргон. Эксперимент продолжался 29 сут, отбор проб проводили 1 раз в неделю. Показано, что в течение первых 9 сут происходило снижение концентрации субстрата в среде, вероятно, вызванное адсорбцией, причем в статичных вариантах (рис. 10а) этот процесс шел более активно, чем при инкубации на качалке (рис. 10б), где одновременно происходила десорбция субстрата из-за перемешивания.
Рис. 10.
Убыль азокрасителя MR в статичных условиях (а) и в условиях постоянного перемешивания (б) в присутствии анаэробных консорциумов: 1 – живого; 2 – автоклавированного.
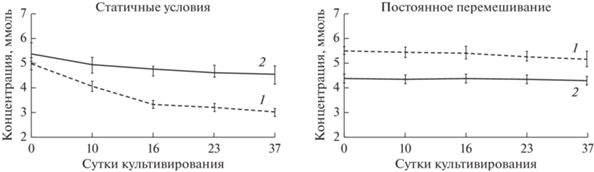
Позднее в вариантах с автоклавированным илом наблюдали только незначительные колебания концентрации субстрата, тогда как в вариантах с живыми клетками обесцвечивание MR протекало полностью. Разложение азокрасителя живым илом активнее идет в статичных условиях, поскольку для стабильности и эффективности синтрофных процессов важна определенная пространственная организация сообщества, которая нарушается перемешиванием. Адсорбция практически не осуществляется в условиях постоянного перемешивания, поэтому снижения концентрации MR в пробах с автоклавированным анаэробным илом не наблюдали. Полученные данные подтверждают, что обесцвечивание азокрасителя в основном эксперименте не является следствием исключительно адсорбции, а происходит в результате начальной стадии адсорбции и, что более важно, последующего восстановления азосвязи живыми микроорганизмами.
Естественные водоемы в зависимости от условий могут содержать большое количество экологических ниш. Микробные сообщества донных отложений имеют большое значение, так как для них характерны высокая концентрация клеток и разнообразие групп микроорганизмов-деструкторов, и они могут быстрее реагировать на изменение внешних условий. Так, для представителей Bacteroidetes показана способность к разложению высокомолекулярных органических веществ (Kirchman, 2002), а планктомицеты могут участвовать в гидролизе сложных углеводов (Glöckner et al., 2003). Для анаэробных сообществ, выделенных из илов природных водоемов, установлена возможность полной минерализации до биогаза различных ароматических ксенобиотиков: бисфенола F (Inoue et al., 2008), полихлорбифенилов (Ye, 1992), хлорзамещенных фенолов и бензойной кислоты (Hagglbom et al., 1993), полициклических ароматических углеводородов (Hilyard, 2008). Такие исследования важны для оценки возможности самоочищения из-за высокой ценности водоемов и большого количества локальных загрязнений. В то же время, результаты лабораторных экспериментов нельзя напрямую экстраполировать на условия реального загрязнения водоемов, так как они представляют собой гетерогенные системы, включающие большое количество взаимосвязанных биотических и абиотических факторов.
Полученные нами данные можно рассматривать в качестве приближенной модели взаимодействия широко распространенного ксенобиотика и микробиоты донных отложений естественного водоема, которая определяет подходы к более глубоким исследованиям. Показано, что имеется потенциальная возможность деструкции азокрасителя анаэробными микробными сообществами донных отложений природного водоема. Однако поскольку условия в естественном месте обитания обычно не соответствуют оптимальным для быстрой минерализации ксенобиотика, а физико-химические параметры часто флуктуируют, то полное разрушение азокрасителя, скорее всего, будет длительным. Поскольку контакт микробного сообщества с азокрасителем (и интермедиатами его разрушения) приводит, как показано нами, к негативным морфологическим и структурно-функциональным изменениям, то очевидно, что такие ксенобиотики не являются веществами инертными и безразличными для микробных сообществ, а значит и для всей экосистемы. Лабораторное моделирование ответа резидентных микроорганизмов на присутствие азокрасителя в среде поможет прогнозированию потенциальной реакции микробного компонента экосистемы в реальных условиях.
Наши данные еще раз подтверждают необходимость удаления азокрасителей из сточных вод и тщательного слежения за их присутствием в биосфере.
Другим аспектом данной работы является возможность адаптации анаэробных микробных сообществ из донных отложений естественных водоемов для деградации азокрасителей.
Список литературы
Гордон П., Грегори П. Органическая химия красителей. М.: Мир, 1987. 344 с.
Емашова Н.А., Котова И.Б., Нетрусов А.И., Калюжный С.В. Особенности разложения азокрасителей анаэробными микробными сообществами // Прикл. биохимия и микробиология. 2009. Т. 45. С. 95–201.
Yemashova N.A., Kotova I.B., Netrusov A.I., Kalyuzhnyi S.V. Special traits of decomposition of azo dyes by anaerobic microbial communities // Appl. Biochem. Microbiol. 2009. V. 45. P. 176‒181.
Линькова Ю.В., Котова И.Б., Нетрусов А.И. Способность микробных сообществ из донных отложений оз. Цайдам к метаногенной деструкции аминоароматических ксенобиотиков // Вода: химия и экология. 2013. № 1. С. 64‒70.
Линькова Ю.В., Куликова И.А., Котова И.Б., Нетрусов А.И. Деградация азокрасителей и ароматических аминов метаногенными микробными сообществами из илов очистных сооружений // Вода: химия и экология. 2011. № 7. С. 51‒58.
Красько С.А., Богомазова А.А., Михайлова Н.Н., Дехтярь Т.Ф. Индикаторы. Уч. пособие / Под общ. ред. проф. Злотского С.С. М.: УГНТУ, 2017. Вып. 7. 62 с.
Савельева О.В., Котова И.Б., Скляр В.И., Калюжный С.В., Нетрусов А.И. Выделение штамма Pseudomonas ASA2 из метаногенного сообщества, расщепляющего аминобензоат и аминосалицилат // Микробиология. 2002. Т. 71. № 2. С. 1‒2.
Savel’eva O.V., Kotova I.B., Sklyar V.I., Kalyuzhnyi S.V., Netrusov A.I. Isolation of strain Pseudomonas sp. ASA2 from a methanogenic community degrading aminobenzoate and aminosalicylate // Microbiology (Moscow). 2002. V. 71. P. 241‒242.
Хоменков В.Г., Шевелёв А.Б, Жуков В.Г., Загустина H.А. Организация метаболических путей и молекулярно-генетические механизмы биодеградации ксенобиотиков у микроорганизмов (обзор) // Прикл. биохимия и микробиология. 2008. Т. 44. С. 132‒152.
Khomenkov V.G., Shevelev A.B., Zhukov V.G., Zagustina N.A., Bezborodov A.M., Popov V.O. Organization of metabolic pathways and molecular-genetic mechanisms of xenobiotic degradation in microorganisms: a review // Appl. Biochem. Microbiol. 2008. V. 44. P. 117‒132.
Andren O., Balandreau J. Biodiversity and soil functioning ‒ from black box to can of worms? // Appl. Soil. Ecol. 1999. V. 2. P. 105‒108.
Bolyen E., Rideout J.R., Dillon M.R., Bokulich N.A., Abnet C.C., Al-Ghalith G.A., Alexander H., Alm E.J., Arumugam M., Asnicar F., Bai Y., Bisanz J.E., Bittinger K., Brejnrod A., Brislawn C.J., Brown C.T., Callahan B.J., Caraballo-Rodríguez A.M., Chase J., Caporaso J.G. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2 // Nat. Biotechnol. 2019. V. 37. P. 852‒857.
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. P. 1‒7.
Friedlingstein P., Betts R.A., Bopp L. Climate–carbon cycle feedback analysis: Results from the C4 MIP model intercomparison // J. Climate. 2006. V. 19. P. 3338‒3353.
Glockner F.O., Kube M., Bauer M. Complete genome sequence of the marine planctomycete Pirellula sp. strain 1 // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 8298–8303.
Guan X., Liu F., Xie Y. et al. Microbiota associated with the migration and transformation of chlorinated aliphatic hydrocarbons in groundwater // Environ. Geochem. Health. 2013. V. 35. P. 535–549.
Hagglbom M.M., Rivera M.D., Young L.Y. Influence of alternative electron acceptors on the anaerobic biodegradability of chlorinated phenols and benzoic acids // Appl. Env. Microbiol. 1993. V. 59. P. 1162‒1167.
Hilyard E.J., Jones-Meehan J.M., Spargo B.J., Hill R.T. Enrichment, isolation, and phylogenetic identification of polycyclic aromatic hydrocarbondegrading bacteria from Elizabeth River sediments // Appl. Env. Microbiol. 2008. V. 74. P. 1176‒1172.
Hugerth L.W., Wefer H.A., Lundin S., Jakobsson H.E., Lindberg M., Rodin S., Engstrand L., Andersson A.F. DegePrime, a program for degenerate primer design for broad-taxonomic-range PCR in microbial ecology studies // Appl. Environ. Microbiol. 2014. V. 80. P. 5116‒5123.
Inoue D., Hara S., Kashihara M., Murai Y., Danzl E., Sei K., Tsunoi S., Fujita M., Ike M. Degradation of bis(4-hydroxyphenyl) methane (bisphenol F) by Sphingobium yanoikuyae strain FM-2 isolated from river water // Appl. Environ. Microbiol. 2008. V. 74. P. 352‒358.
Johann H., Georg F. Microbial anaerobic aromatic metabolism // Anaerobe. 1997. V. 3. P. 1‒22.
Kirchman D.L. The ecology of Cytophaga-Flavobacteria in aquatic environments // FEMS Microbiol. Ecol. 2002. V. 39. P. 91–100.
Kluge C., Tschech A., Fuchs G. Anaerobic metabolism of resorcylic acid and resorcinol in a fermenting and in denitrifying bacterium // Arch. Microbiol. 1990. V. 155. P. 68‒74.
McGuire K.L., Treseder K.K. Microbial communities and their relevance for ecosystem models: Decomposition as a case study // Soil Biol. Biochem. 2010. V. 42. P. 529‒535.
Merkel A.Yu., Tarnovetskii I.Yu., Podosokorskaya O.A., Toshchakov S.V. Analysis of 16S rRNA primer systems for profiling of thermophilic microbial communities // Microbiology (Moscow). 2019. V. 88. P. 671–680.
Rawat D., Mishra V., Sharma R.Sh. Detoxification of azo dyes in the context of environmental processes // Chemosphere. 2016. V. 155. P. 591‒605.
Razo-Flores E. Biotransformation and biodegradation of N‑substituted aromatics in methanogenic granular sludge. Ph.D. Thesis. Wageningen University. Wageningen, The Netherlands. 1997. 162 p.
Savelieva O., Kotova I., Roelofsen W., Stams A.J.M., Netrusov A. Conversion of aminoaromatic acids by a methanogenic enrichment and by a novel Citrobacter freundii strain // Arch. Microbiol. 2004. V. 181. P. 163‒170.
Stolz A. Basic and applied aspects in the microbial degradation of azo dyes // Appl. Microbiol. Biotechnol. 2001. V. 56. P. 69‒80.
Watanabe M., Higashioka Y., Kojima H., Fukui M. Desulfosarcina widdelii sp. nov. and Desulfosarcina alkanivorans sp. nov., hydrocarbon-degrading sulfate-reducing bacteria isolated from marine sediment and emended description of the genus Desulfosarcina // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 2994‒2997.
Whittle P.J., Lunt D.O., Evans W.C. Anaerobic photometabolism of aromatic compounds by Rhodopseudomonas sp. // Biochem. Soc. Trans. 1976. V. 4. P. 490‒491.
Ye D., Quensen J.F. 3rd, Tiedje J.M., Boyd S.A. Anaerobic dechlorination of polychlorobiphenyls (Aroclor 1242) by pasteurized and ethanol-treated microorganisms from sediments // Appl. Env. Microbiol. 1992. V. 58. P. 1110‒1114.
Zhang K., Song L., Dong X. Proteiniclasticum ruminis gen. nov., sp. nov., a strictly anaerobic proteolytic bacterium isolated from yak rumen // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 2221‒2225.
Дополнительные материалы
- скачать ESM.docx
- Рис. S1. Обесцвечивание проб азокрасителя MR сообществом из р. Волга: 1-3- опытные варианты, 4, 5 -биоконтроль.



