Микробиология, 2022, T. 91, № 3, стр. 376-388
Структурно-функциональная характеристика бактериальных обрастаний тростника южного Phragmites australis (Cav.) в Рыбинском водохранилище
Р. А. Федоров a, *, И. В. Рыбакова a, Н. Л. Белькова b, Н. А. Лаптева a
a Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Борок, Россия
b Лимнологический институт СО РАН
664033 Иркутск, Россия
* E-mail: fedor-off@yandex.ru
Поступила в редакцию 20.09.2021
После доработки 23.01.2022
Принята к публикации 28.01.2022
- EDN: HZGQUB
- DOI: 10.31857/S0026365622300103
Аннотация
Представлены многолетние данные по численности и биомассе бактериальных обрастаний одного из массовых видов высших водных растений Рыбинского водохранилища – тростника южного Phragmites australis (Cav.). Определена суточная продукция бактериального и фитоэпифитона, а также скорость бактериальной деструкции органических веществ. Учтено количество микроорганизмов разных физиолого-трофических групп, рассчитана их доля в общей численности бактериоэпифитона. Молекулярно-генетическими методами определено таксономическое разнообразие эпифитона. Показано, что деструкторами клетчатки являются бактерии рода Cellvibrio (класс Gammaproteobacteria).
Рыбинское водохранилище – крупное равнинное эвтрофное водохранилище озерного типа (Верхняя Волга). С конца XX в. наблюдается интенсивное зарастание водохранилища с заметным господством воздушно-водных растений (94.0%) над погруженными (2.7%) и имеющими плавающие листья (2.5%). Мониторинг выявил непрерывное увеличение площадей, занятых тростником, двукисточником и манником, и нарастание их доли среди сообществ воздушно-водных растений (Ляшенко, 1999). Тростник южный Phragmites australis (Cav.) – высокопродуктивный космополит, на долю которого приходится 21.7% (40.4 км2) суммарной площади зарослей всех доминирующих видов растений водохранилища и 30.9% площади зарослей гелофитов (Папченков, 2013).
В зарослях высших водных растений формируется свой микроклимат: температура воды на 2‒3°С больше, чем в пелагиали, выше pH, содержание растворенного кислорода, биогенных элементов, взвешенного и растворенного органического вещества (ОВ) в воде (Рыбакова, Васильева, 2003; Yang et al., 2018). Исследователями отмечено, что в мелководном озере удельная скорость роста прикрепленных бактерий в 2‒4 раза выше, чем в сообществах бактериопланктона, и продукция бактерий на макрофитах превышает продукцию бактериопланктона на 1 м2 площади озера (Theil-Nielsen et al., 1999). Большинство эпифитных бактерий являются потенциальными деструкторами органического вещества (ОВ) и, по окончании вегетации макрофитов, вместе с грибами участвуют в разложении отмирающих частей растений (Zhao et al., 2021). Но по сравнению с грибами, бактерии, имеющие высокие скорости роста, могут более активно разлагать клетчатку (Тимакова, 1984; Schneider et al., 2012).
Разнообразие метаболических особенностей эпифитных микроорганизмов и их высокая активность отмечались рядом исследователей. Есть данные, что погруженные макрофиты работают как ниша для азотистых бактерий (Coci et al., 2010), в обрастаниях регистрировали микроорганизмы с амилолитическими и протеолитическими свойствами (Якушин, 1978). В эпифитоне высших водных растений регистрируют процессы азотфиксации, нитрификации и денитрификации, окисления железа, восстановления сульфата и метаногенеза (Одинцов, Лаптева, 1984; Basberg et al., 1998; Islam, Singhal, 2004; Srivastava et al., 2017). Эпифитон с его разнообразным сложным составом может адаптироваться к изменчивости внешней среды, влиять на нее и поддерживать высокую метаболическую активность за счет саморегулирования структуры сообщества (Yan et al., 2011; Wu et al., 2014; Shangguan et al., 2015), играя при этом важную роль в преобразовании и деминерализации питательных веществ (Rogers et al., 1982).
Эпифитные бактерии макрофитов и их влияние на метаболические процессы до сих пор остаются малоизученным вопросом для экосистемы Рыбинского водохранилища.
Цель работы – изучение структуры, функционирования и разнообразия бактериоэпифитона тростника южного Phragmites australis, как одного из массовых видов высших водных растений Рыбинского водохранилища.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб эпифитона тростника и первичная пробоподготовка. Растения тростника южного Phragmites australis для исследования отбирали в прибрежной зоне Волжского плеса Рыбинского водохранилища (координаты N 58.067, E 38.264) в летне-осенний период 2000–2003 гг. и 2005–2007 гг. Работы по обработке материала проводили в лабораторных условиях. Для определения количественных показателей и функциональных характеристик эпифитона обрастания тростника смывали безбактериальной природной водой (профильтрованная через фильтр с диаметром пор 0.17 мкм и стерилизованная автоклавированием). Учитывали площадь и вес растений.
Для изучения таксономического разнообразия микроорганизмов стерильным скальпелем соскабливали обрастания с тростника, готовили суспензию биологического материала в трис-солевом буфере (10 мМ трис-HCl, pH 7.5; 0.1 M NaCl; 2 мМ ЭДТА). Каждую пробу делили на две пробирки, одну использовали сразу для выделения тотальной ДНК, а во вторую добавляли 2 мкл моноазида этидиумбромида (ЕМА, 50 мкг/мл). Пробирку с ЕМА обрабатывали по протоколу (Nocker et al., 2006), позволяющему провести селекцию живых и жизнеспособных клеток. Затем проводили выделение тотальной ДНК методом ферментативного лизиса. Все эксперименты проводили в трех повторностях.
Микроскопия. Численность и размерно-морфологические группы эпифитных бактерий определяли методом эпифлуоресцентной микроскопии на черных ядерных фильтрах с диаметром пор 0.17 мкм (ОИЯИ, Дубна, Россия). Препараты просматривали на микроскопе Люмам-И1 при увеличении ×1000, с использованием флуорохрома ДАФИ (4,6-диамидино-2-фенилиндол) (Porter, Feig, 1980). Измеряя бактерии, учитывали их по трем морфологическим группам: кокки и эллипсоиды размером до 1 мкм, крупные палочки и нити. Рассчитывали содержание углерода в сырой биомассе (Norland, 1993).
Морфологическое разнообразие форм бактериальных клеток эпифитона непосредственно из обрастаний, а также из накопительных культур бактерий, разрушающих клетчатку, изучали под электронным микроскопом марки JEM-100С (“Jeol”, Япония) при увеличении ×6600–16 000. Подготовку препаратов проводили по способу обрастания или осаждения бактерий на электронно-микроскопических сеточках (Кузнецов, 1974). Образцы для исследований брали из пробирок с интенсивным разрушением фильтровальной бумаги и окрашиванием ее в оранжевый или желтый цвет.
Первичную (Pf) и бактериальную (Pb) продукцию эпифитона определяли в 2006 г. и весной 2007 г. модифицированным радиоуглеродным методом по ассимиляции углекислоты в темноте и на свету с использованием NaН14CO3 (ПО “Изотоп”) (Кузнецов, Дубинина, 1989). В склянки со стерильной природной водой (50 мл) вносили 4 мл исходного смыва с растений. Для определения темновой ассимиляции бактерий и первичной продукции водорослей эпифитона вносили 0.5 мл раствора гидрокарбоната с активностью 1 мл 0.54 × × 105 имп./мин. Пробы инкубировали в лотках в течение суток в условиях, приближенных к условиям водоема. После фиксации формалином бактериальные пробы фильтровали через фильтры с диаметром пор 0.2 мкм, альгологические – с диаметром пор 0.5 мкм. Радиоактивность фильтров определяли на сцинтилляционном счетчике Mark-II. Контролем служили пробы, зафиксированные сразу после внесения радионуклида. Первичную и бактериальную продукцию рассчитывали по формуле Стимана Нильсена (Steemann Nielsen, 1952):
Время удвоения численности бактерий рассчитывали комбинированным методом по формуле: D = t lg2/lg(bo + Pb) ‒ lg bo, где D ‒ время удвоения бактерий, ч; t – длительность опыта по определению прироста биомассы бактерий по гетеротрофной ассимиляции СО2, ч; bo – исходная биомасса бактерий в 1 л воды, мкг С/л; Pb – продукция бактериальной биомассы, мкг С/л за время t. Для оценки удельной скорости роста (µ) использовали формулу D = lg2/µ, где D ‒ время удвоения численности бактерий, ч. Удельную продукцию эпифитных бактерий определяли как произведение их удельной скорости роста и биомассы (Романенко, Кузнецов, 1974).
Деструкцию органического вещества (ОВ) оценивали кислородным методом (Романенко, Кузнецов, 1974). Для оценки потенциальной способности бактериоэпифитона разрушать клетчатку использовали метод, предложенный Тимаковой и Романенко (Тимакова, Романенко, 1984).
Численность бактерий различных физиолого-трофических групп в эпифитоне определяли методом предельных разведений и посевом на элективные питательные среды (Романенко, Кузнецов, 1974). В период наивысшего развития растений, в стадии начального и массового их разложения учитывали численность сапрофитной, углеводородокисляющей микрофлоры и бактерий, разлагающих клетчатку. Из числа сапрофитов дополнительно определяли численность и активность бактерий, выделяющих каталазу. После инкубации сапрофитов, выросших на рыбопептонном агаре (РПА), в чашке с крайним разведением, на колонии наносили 10% раствор Н2О2 и учитывали колонии, в которых идет разложение перекиси водорода. Для определения активности каталазоактивной микрофлоры в эпифитоне тростника использовали модифицированный метод Баха и Опарина (Большой практикум…, 1962). Для этого к 20 мл суспензии обрастаний добавляли 25 мл 0.2% Н2О2 и помещали в холодильник на 1.5 ч при температуре 7°С, затем отбирали 5 мл материала, фиксировали 5 мл 10% Н2SО4 и титровали 0.1 N раствором КМnО4.
Для установления взаимосвязей между параметрами использовали ранговый коэффициент корреляции Спирмена для уровня значимости 0.05.
Молекулярно-генетические методы. Выделение геномной ДНК проводили методом ферментативного лизиса (Белькова, 2009). Амплификацию фрагмента гена 16S рРНК вели на консервативных бактериальных праймерах, как было предложено ранее (Rybakova et al., 2009). Для лигирования ампликонов использовали набор GeneJETTM PCR Cloning Kit (“Fermentas”). Компетентные клетки Escherichia coli (штамм XL-1) для трансформации получали, используя методику трансформации C-aCl2-зависимых клеток (Sambrook et al., 1989). Секвенирование осуществляли на автоматическом секвенаторе ABI310A (ABI PRISM 310 Genetic Analyzer). Анализ полученных последовательностей проводили путем их сравнения с последо-вательностями, зарегистрированными в международной базе данных с помощью пакета программ FASTA (http:// www.ebi.ac.uk/fasta33). Наличие химерных структур определяли анализом последовательностей с имеющейся базой данных с помощью пакета программ CHECK CHIMERA (http:// rdp8.cme.msu.edu/html/analyses.html). Нуклеотидные последовательности зарегистрированы под следующими номерами: АМ901043–АМ901047, FM177212–FM177222, FM177234–FM177237, LT797787‒LT797796.
РЕЗУЛЬТАТЫ
Численность и биомасса бактерий. За период наблюдений 2000–2006 гг. в эпифитоне тростника отмечали тенденцию роста численности и биомассы гетеротрофных бактерий (табл. 1). В составе бактериоперифитона снижалась доля кокков и мелких эллипсоидов и, напротив, возрастала доля крупных палочек. В результате средний объем бактериальной клетки в 2005–2006 гг. по сравнению с таковым в 2000–2003 гг. увеличился в 1.6 раза (табл. 1), а биомасса гетеротрофных бактерий в обрастаниях тростника оказалась выше в 3 раза. Данные процессы отмечены и в эпифитоне других массовых видов макрофитов Рыбинского водохранилища (Рыбакова, 2016).
Таблица 1.
Многолетние изменения численности (N), среднего объема клеток (V) и биомассы (B) бактериальных обрастаний тростника южного
| Период | N × 106 | V, мкм3 | B | ||
|---|---|---|---|---|---|
| кл./г | кл./см2 | мкг/г | мкг/см2 | ||
| 07‒10.2000 г. | $\frac{{127{\kern 1pt} --{\kern 1pt} 903}}{{427 \pm 319}}$ | $\frac{{12.3{\kern 1pt} - {\kern 1pt} 87.7}}{{41.5 \pm 31.0}}$ | $\frac{{0.033{\kern 1pt} - {\kern 1pt} 0.150}}{{0.090 \pm 0.047}}$ | $\frac{{4.2{\kern 1pt} - {\kern 1pt} 89.8}}{{36.3 \pm 29.4}}$ | $\frac{{0.4{\kern 1pt} - {\kern 1pt} 8.7}}{{3.5 \pm 2.9}}$ |
| 08‒09.2001 г. | $\frac{{569{\kern 1pt} - {\kern 1pt} 1515}}{{847 \pm 388}}$ | $\frac{{55.2{\kern 1pt} - {\kern 1pt} 147.1}}{{82.0 \pm 37.8}}$ | $\frac{{0.063{\kern 1pt} - {\kern 1pt} 0.136}}{{0.091 \pm 0.034}}$ | $\frac{{39.1{\kern 1pt} - {\kern 1pt} 206.4}}{{84.0 \pm 69.5}}$ | $\frac{{3.8{\kern 1pt} - {\kern 1pt} 20.0}}{{8.2 \pm 6.8}}$ |
| 07‒09.2002 г. | $\frac{{664{\kern 1pt} - {\kern 1pt} 1018}}{{793 \pm 195}}$ | $\frac{{64.5{\kern 1pt} - {\kern 1pt} 98.8}}{{77.0 \pm 18.9}}$ | $\frac{{0.085{\kern 1pt} - {\kern 1pt} 0.114}}{{0.099 \pm 0.015}}$ | $\frac{{56.4{\kern 1pt} - {\kern 1pt} 116.4}}{{80.4 \pm 31.7}}$ | $\frac{{5.5{\kern 1pt} - {\kern 1pt} 11.3}}{{7.8 \pm 3.1}}$ |
| 07‒09.2003 г. | $\frac{{854{\kern 1pt} - {\kern 1pt} 5966}}{{3508 \pm 2696}}$ | $\frac{{82.9{\kern 1pt} - {\kern 1pt} 579.2}}{{340.5 \pm 261.7}}$ | $\frac{{0.047{\kern 1pt} - {\kern 1pt} 0.070}}{{0.058 \pm 0.010}}$ | $\frac{{60.0{\kern 1pt} - {\kern 1pt} 329.5}}{{189.1 \pm 137.1}}$ | $\frac{{5.8{\kern 1pt} - {\kern 1pt} 32.0}}{{18.4 \pm 13.3}}$ |
| 07‒10.2005 г. | $\frac{{663{\kern 1pt} - {\kern 1pt} 6057}}{{2799 \pm 1951}}$ | $\frac{{169.0{\kern 1pt} - {\kern 1pt} 619.6}}{{338.5 \pm 173.3}}$ | $\frac{{0.106{\kern 1pt} - {\kern 1pt} 0.277}}{{0.163 \pm 0.067}}$ | $\frac{{140.7{\kern 1pt} - {\kern 1pt} 643.6}}{{357.0 \pm 225.3}}$ | $\frac{{14.0{\kern 1pt} - {\kern 1pt} 49.5}}{{32.1 \pm 15.1}}$ |
| 07‒10.2006 г. | $\frac{{1221{\kern 1pt} - {\kern 1pt} 3366}}{{2131 \pm 738}}$ | $\frac{{131.3{\kern 1pt} - {\kern 1pt} 231.6}}{{170.6 \pm 35.0}}$ | $\frac{{0.066{\kern 1pt} - {\kern 1pt} 0.141}}{{0.107 \pm 0.026}}$ | $\frac{{111.5{\kern 1pt} - {\kern 1pt} 297.8}}{{219.6 \pm 62.3}}$ | $\frac{{12.0{\kern 1pt} - {\kern 1pt} 26.1}}{{20.3 \pm 5.0}}$ |
| Средняя | 1751 ± 1048 | 175.0 ± 93.0 | 0.101 ± 0.033 | 161.1 ± 92.6 | 15.1 ± 7.7 |
Сезонную динамику развития бактериальных обрастаний наблюдали в 2006 г. на вегетирующих растениях тростника до ухода воды из прибрежной зоны водоема и обнажения растений. Далее исследования продолжили в 2007 г. с момента затопления прибрежья с перезимовавшими отмершими частями тростника (рис. 1). Общая численность бактерий в перифитоне вегетирующих растений в этот период колебалась от 734 × 106 кл./г в мае до 3366 × 106 кл./г в октябре (в расчете на 1 см2 на рис. 1) (средняя 1930 ± 793 × 106 кл./г или 162.5 ± 37.9 × 106 кл./см2). Биомасса изменялась в пределах 86.1–297.8 мкг/г в среднем составив 199.4 ± 70.5 мкг/г или 18.9 ± 5.2 мкг/см2. Отмечали весенне-летний подъем численности бактерий, а также осенний ‒ в период массового отмирания растений.
Рис. 1.
Сезонная динамика развития бактериальных обрастаний тростника. Слева по оси – численность (Nb), млн кл./см2; справа – биомасса (Вb), мкг/см2; внизу – дата отбора проб: число и месяц.

На прошлогоднем тростнике численность бактерий менялась незначительно, составив в мае–июне в среднем из двух определений 951 × 106 кл./г, что в 1.5 раза меньше, чем на вегетирующем. Общая биомасса бактерий в этот период на мертвом тростнике также варьировала незначительно, в пределах 120.3–126.1 мкг/г, в то время как на вегетирующих растениях к летним месяцам достигала 297.8 мкг/г.
Результаты дифференцированного учета численности бактерий перифитона по морфологическим группам за шестилетний период показали преобладание кокков и мелких эллипсоидов размером до 1 мкм. Их численность существенно варьировала 101–5776 × 106 кл./г (средняя 1358 × 106 кл./г), биомасса менялась от 2.9 до 243.6 мкг/г (средняя 63.4 мкг/г). Доля кокков и мелких эллипсоидов в общей численности бактерий эпифитов составляла 76.6 ± 15.4%, в суммарной биомассе ‒ 44.3 ± 17.1%. Численность крупных палочек за этот же период варьировала от 4.6 до 1738 × 106 кл./г (средняя 350.1 × 106 кл./г), их биомасса от 0.9 до 425.3 мкг/г (в среднем 89.1 мкг/г). Количество бактериальных нитей изменялось в пределах 1.7–49.1 × 106 кл./г (среднее 14.9 × 106 кл./г), биомасса от 0.5 до 34.1 мкг/г (средняя 11.9 мкг/г). Крупные бактериальные клетки при меньшей численности (доля палочек составляла 21.9 ± 15.7% общей численности бактерий, нитей – 1.6 ± 1.0%) образовывали значительную часть общей биомассы бактериоэпифитона – 45.4 ± 19.6% и 10.4 ± 4.7% соответственно.
Определения в мае‒июне показали, что доля кокков и мелких эллипсоидов в общей численности бактерий эпифитона при одновременном определении в весенний период составила 78.0% – на вегетирующих растениях и 64.9% – на прошлогодних, а в общей биомассе бактерий не превышала 30.6 и 19.6% соответственно. Крупные палочки и бактериальные нити суммарно в общей численности бактерий составили 22.1% на вегетирующих растениях и 30.8% на прошлогодних. Однако эти морфологические группы бактерий вносили наибольший вклад в биомассу на тех и на других растениях: 69.5% на живых и 80.5% на отмерших.
Физиологотрофические группы бактерий в эпифитоне тростника. В летне-осенний период 2000–2002 гг. в обрастаниях тростника нами были учтены количества сапрофитных микроорганизмов, растущих на РПА. Эта группа бактерий наиболее быстро реагирует на поступление легкорастворимых органических веществ. Численность их значительно варьировала (2.8–44.9 × 106 кл./г, средняя 20.3 × 106 кл./г). Летом доля сапрофитной микрофлоры в общей численности бактерий составляла 4.7%, к осени она возрастала до 5.5%. Количество сапрофитных бактерий, растущих на РПА/10, как правило, было на порядок больше.
Об окислительно-восстановительных процессах в обрастаниях тростника судили по каталазной активности бактериальных обрастаний, которая изменялась в пределах 0.91–4.46 мг Н2О2/г ч (средняя 2.47 мг Н2О2/г ч). В среднем ферментативная активность сапрофитной микрофлоры, вырабатывающей фермент каталазу, летом составила 1.08 мг Н2О2/г ч, осенью 3.85 мг Н2О2/г ч, что свидетельствует о возрастании окислительных процессов в период старения и разложения растений. При этом численность каталазоактивной микрофлоры находилась в пределах 1.4–9.6 × 106 кл./г (средняя 4.8 × 106 кл./г) и максимум отмечали в конце сентября. В общей численности сапрофитной микрофлоры доля бактерий, вырабатывающих каталазу, составила 15.6–50.0% (средняя 28.5%).
В обрастаниях тростника наблюдали возрастание численности углеводородокисляющих микроорганизмов: в 2001 г. – в среднем 410 × 103 кл./г, в 2002 г. – 895 × 103 кл./г) и в 2006 г. – 4372 × 103 кл./г). Максимальные величины наблюдали в июле–августе, а также в сентябре при высоких положительных температурах. В результате средняя за три года исследований численность углеводород-окисляющих бактерий в обрастаниях тростника составила 1892 × 103 кл./г, что в общей численности бактерий соответствует 0.13%.
Численность культивируемых микроорганизмов, разрушающих клетчатку, менялась в пределах 0.3 × 103–2.9 × 106 кл./г (средняя 4.5 × 105 кл./г). Наблюдения показали, что количество этих микроорганизмов в эпифитоне вегетирующего тростника в мае–июне было невысоким – в пределах 11–13 × 103 кл./г, в то время как на прошлогодних растениях в этот же период – на порядок больше (95–142 × 103 кл./г). К середине лета численность бактерий, разрушающих клетчатку, на вегетирующих растениях уже достигала максимальных значений (2887 × 103 кл./г), затем к осени снижалась (в октябре – 18 × 103 кл./г). Доля этих микроорганизмов в общей численности бактерий эпифитона тростника изменялась от 0.001% весной и поздней осенью, до 0.11% в период их максимального развития (июнь–июль). Наиболее активную деструкцию клетчатки бактериоэпифитоном регистрировали в августе (6.83 мкг О2/млн кл. сут, осенью она снижалась до 2.32 мкг О2/млн кл. сут, в среднем составив 4.27 мкг О2/млн кл. сут).
Микроорганизмы, разрушающие клетчатку, и выращенные на элективной среде, имели следующие морфотипы: эллипсоиды размером от 1 до 2 мкм с включениями разной электронной плотности, вибриоидные клетки более 2 мкм с одним жгутиком, крупные палочки более 3 мкм, нитевидные клетки со скользящим типом движения, а также бактериальные палочки с заостренным концом, по-видимому из рода Cytophaga, обладающие высокой способностью к лизису волокон клетчатки. Часто в накопительных культурах присутствовали бактерии рода Caulobacter, в том числе и делящиеся клетки.
Таксономическое разнообразие микроорганизмов, ассоциированных с макрофитами. В эпифитоне тростника определены представители пяти фил эубактерий: Proteobacteria, Cyanobacteria, Verrucomicrobia, Bacteroidetes и Lentisphaerae (табл. 2). Всего охарактеризовано 23 операционные таксономические единицы (ОТЕ). Самую большую долю общего числа проанализированных последовательностей (84.6%) составили Proteobacteria, среди которых преобладали представители класса Gammaproteobacteria (60.0%). Остальные таксоны представлены единичными последовательностями. Кроме того, были получены последовательности 18S рДНК эукариотических организмов: две последовательности показали 99.9% гомологию с ДНК Ochromonas danica (M32704; Eukaryota; Ochromonadales; Ochromonadaceae; Ochromonas), а одна (94.5%) с Acricotopus lucens (AJ586561; E-ukaryota; Arthropoda; Chironomoidea; Chironomidae; Acricotopus).
Таблица 2.
Идентификация микроорганизмов в эпифитоне и накопительных культурах из обрастаний тростника
| Номер ОТЕ | Число ОТЕ | Ближайший гомолог, % | Таксономическое положение |
|---|---|---|---|
| Разнообразие микроорганизмов в эпифитоне тростника | |||
| 1 | 1 | JQ692104 Rhodobacter megalophilus R6W-5-1, 99.4 | Proteobacteria, Alphaproteobacteria, Rhodobacterales, Rhodobacteraceae, Rhodobacter |
| 2 | 1 | KC527607 Arsenic-oxidizing bacterium C02, 99.6 FJ455532 Dongia mobilis LM22, 98.2 |
Proteobacteria, Alphaproteobacteria, Rhodospirillales, Rhodospirillaceae, Dongia |
| 3 | 1 | KT720387 Roseomonas sp. LB1-9, 97.8 | Proteobacteria, Alphaproteobacteria, Rhodospirillales, Acetobacteraceae, Roseomonas |
| 4 | 1 | KT343635 Candidatus Finniella lucida strain
FinLu02, 88.1 KU341206 Uncultured bacterium clone VLSb89, 98.3 |
Proteobacteria, Alphaproteobacteria, Rickettsiales, Candidatus Paracaedibacteraceae, Candidatus Finniella |
| 5 | 2 | AF532187 Monochloroacetic-acid-degrading
bacterium MCAA1, 99.2 LC027550 Xanthobacter autotrophicus ZJRR-16, 98.5 |
Proteobacteria, Alphaproteobacteria, Rhizobiales, Xanthobacteraceae, Xanthobacter |
| 6 | 1 | KF804094 Pseudoxanthobacter sp. S50, 99.2 | Proteobacteria, Alphaproteobacteria, Rhizobiales, Xanthobacteraceae, Pseudoxanthobacter |
| 7 | 1 | CP002056 Methylotenera versatilis 301, complete genome, 97.4 AY424823 Uncultured clone, 98.5 |
Proteobacteria, Betaproteobacteria, Methylophilales, Methylophilaceae, Methylotenera |
| 8 | 1 | KU900867 Methylophilus sp. VMB9, 99.2 | Proteobacteria, Betaproteobacteria, Methylophilales, Methylophilaceae, Methylophilus |
| 9 | 1 | EF626687 Aquabacterium fontiphilum CS-6, 98.4 DQ327689 Uncultured clone, 98.9 |
Proteobacteria, Betaproteobacteria, Burkholderiales, unclassified Burkholderiales, Burkholderiales Genera incertae sedis, Aquabacterium |
| 10 | 1 | JQ246448 Comamonas sp. WYH22-42, 98.8 | Proteobacteria, Betaproteobacteria, Burkholderiales, Comamonadaceae, Comamonas |
| 11 | 7 | KR066643 Enterobacter sp. 126, 98.1–99.6 | Proteobacteria, Gammaproteobacteria, Enterobacterales, Enterobacteriaceae, Enterobacter |
| 12 | 8 | EF028122 Pseudomonas sp., 98.9–100 | Proteobacteria, Gammaproteobacteria, Pseudomonadales, Pseudomonadaceae, Pseudomonas |
| 13 | 2 | AJ414655 Methylobacter sp., 95.9 DQ984191 Uncultured clone, 96.4 |
Proteobacteria, Gammaproteobacteria, Methylococcales, Methylococcaceae, Methylobacter |
| 14 | 1 | DQ295890 Crenothrix sp., 96.3 GU205747 Uncultured bacterium ZSB-H4-5, 98.0 |
Proteobacteria, Gammaproteobacteria, Methylococcales, Crenotrichaceae, Crenothrix |
| 15 | 1 | HG794333 Serratia sp. HC85, 99.8 | Proteobacteria, Gammaproteobacteria, Enterobacterales, Yersiniaceae, Serratia |
| 16 | 1 | GQ923773 Legionella sp. 24644, 96.0 KU713260 Uncultured bacterium clone DWTP1.2A.C03, 98.8 |
Proteobacteria, Gammaproteobacteria, Legionellales, Legionellaceae, Legionella |
| 17 | 1 | HQ540311 Sandaracinus amylolyticus NOSO 4, 95.1 KU655394 Uncultured clone, 100 |
Proteobacteria, Deltaproteobacteria, Myxococcales, Sorangiineae, Sandaracinaceae, Sandaracinus |
| 18 | 1 | AB246770 Myxobacterium sp., 96.1 JX222095 Uncultured clone, 98.9 |
Proteobacteria, Deltaproteobacteria, Myxococcales |
| 19 | 1 | KX417306 Terrimonas sp., 98.2 JX576052 Uncultured Bacteroidetes bacterium clone b19-12, 98.8 |
Bacteroidetes, Chitinophagia, Chitinophagales, Chitinophagaceae, Terrimonas |
| 20 | 1 | FJ263934 Chitinophagaceae bacterium HU1-GB11, 97.2 KC189667 Uncultured clone, 99.4 |
Bacteroidetes, Chitinophagia, Chitinophagales, Chitinophagaceae, unclassified Chitinophagaceae |
| 21 | 1 | CP016094 Opitutaceae bacterium IG16b, complete genome, 99.4 | Verrucomicrobia, Opitutae, Opitutales, Opitutaceae, Opitutus |
| 22 | 2 | KJ939031 Leptolyngbya sp., 96.4–99.0 | Cyanobacteria, Synechococcales, Leptolyngbyaceae, Leptolyngbya |
| 23 | 1 | FJ394915 Victivallaceae bacterium NML 080035, 97.8 KT797615 Uncultured clone, 99.0 |
Lentisphaerae, Lentisphaeria, Victivallales, Victivallaceae, Victivallis |
| Разнообразие целлюлозоразрушающих бактерий в накопительных культурах | |||
| 24 | 1 | HE795994 Lacibacterium aquatile, type strain LTC-2T, 98.7 | Proteobacteria, Alphaproteobacteria, Rhodospirillales, Rhodospirillaceae |
| 25 | 1 | FN293046 Azospirillum sp. Z012, 98.9 | Proteobacteria, Alphaproteobacteria, Rhodospirillales, Rhodospirillaceae, Azospirillum |
| 26 | 1 | KM187490 Agrobacterium sp. HP5I, 99.7 | Proteobacteria, Alphaproteobacteria, Rhizobiales, Rhizobiaceae, Rhizobium/Agrobacterium group, Agrobacterium |
| 27 | 24 | Cellvibrio sp., 98.6–100 | Proteobacteria, Gammaproteobacteria, Cellvibrionales, Cellvibrionaceae, Cellvibrio |
| 28 | 1 | EU111740 Pseudomonas sp. CT29, 99.7 | Proteobacteria, Gammaproteobacteria, Pseudomonadales, Pseudomonadaceae, Pseudomonas |
| 29 | 1 | AB680783 Runella sp. NBRC 15147, 100 | Bacteroidetes, Cytophagia, Cytophagales, Cytophagaceae, Runella |
| 30 | 8 | KT750857 Exiguobacterium sp. EM048, 99.7–99.9 | Firmicutes, Bacilli, Bacillales, Bacillales Family XII. Incertae Sedis, Exiguobacterium |
В эпифитонном микробном сообществе доминировали органогетеротрофные бактерии Enterobacter и Pseudomonas (Gammaproteobacteria). Преимущественное большинство генотипов было представлено небольшим числом последовательностей. В целом, отмечено значительное разнообразие микробного сообщества.
В накопительных культурах целлюлозоразрушающих микроорганизмов (табл. 2) генетическое разнообразие было невелико и представлено доминирующими с высоким процентом гомологии генотипами целлюлозоразрушающих бактерий рода Cellvibrio (Gammaproteobacteria) и Exiguobacterium (Firmicutes).
Продукционно-деструкционные процессы в обрастаниях тростника. Бактериальная продукция эпифитона (Pb) менялась в пределах 15–117 мкг С/г сут или 1.51–9.44 мкг С/см2 сут (средняя 41.2 мкг С/г сут или 3.79 мкг С/см2 сут) (рис. 2). Между биомассой бактериоперифитона и его продукцией наблюдали положительную умеренную корреляцию (R = 0.67).
Рис. 2.
Динамика суточной продукции бактерий (Pb), бактериальной деструкции (Db) и первичной продукции (Pf) в обрастаниях тростника южного в течение вегетационного сезона. Слева ‒ мкг С/см2 (единицы, одинаковые для всех измерений, кроме температуры), справа – температура T, °С; внизу – дата отбора проб: число, месяц.
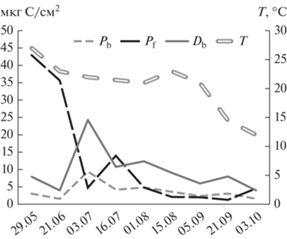
В мае–июне на вегетирующих растениях тростника Pb в 1.3 раза превышала таковую на прошлогодних растениях. На молодых растениях тростника Pb достигала максимальных значений в начале июля. Удельная продукция эпифитных бактерий в июле также достигала высоких величин: 0.77–1.52 сут–1 (в среднем 1.15 сут–1), что соответствует времени удвоения биомассы бактерий 10.9–21.6 ч (в среднем 16.3 ч). Высокая продуктивность эпифитных бактерий в этот период не была связана с высокой температурой воды (коэффициент корреляции между этими параметрами составил 0.19). В августе величины Pb снизились (рис. 2). Удельная продукция эпифитных бактерий уменьшилась до 0.87–1.03 сут–1 (в среднем 0.95 сут–1), что, примерно, соответствует времени удвоения биомассы бактерий 16.1–19.1 ч (в среднем 17.6 ч). В начале сентября, при высокой температуре воды, удельная продукция была относительно высокой 0.77 сут–1, что соответствует времени удвоения биомассы бактерий 21.6 ч. Относительно высокая бактериальная продукция в начале осени, по-видимому, в значительной степени связана с началом разложения тканей макрофитов. Так, до конца сентября оставалась высокой численность целлюлозоразрушающих (200 × 103 кл./г) и углеводородокисляющих (2000 × 103 кл./г) бактерий. Таким образом, бактериальное сообщество перифитона еще в период вегетации использовало ткани растения как питательный субстрат, что, в определенной степени, способствовало более интенсивному росту бактериоэпифитона в этот период. В октябре, продукция бактерий снизилась до минимальных величин (рис. 2), величина удельной продукции уменьшилась до 0.26 сут–1, а время удвоения биомассы бактерий возросло до 64 ч.
Скорость образования первичной продукции (Pf) в эпифитоне изменялась в пределах 12.0–365.0 мкг С/г сут или 1.28–42.92 мкг С/см2 сут (средняя 118 мкг С/г сут или 12.57 мкг С/см2 сут), с максимальными величинами в конце июня.
К осени первичная продукция в обрастаниях тростника снижалась до минимума (рис. 2). На вегетирующих растениях высокую скорость первичной продукции регистрировали весной и в начале лета. Весной активно заселялся водорослями и мертвый растительный субстрат. При одновременном определении на прошлогодних растениях тростника скорость первичной продукции альгоэпифитона была в 1.7 раза выше, чем на вегетирующих.
Высокие величины отношения бактериальной продукции к первичной продукции фитоэпифитона (в пяти опытах из семи бактериальная продукция превышала величину первичной продукции) свидетельствовали, что в функционировании сообщества эпифитных бактерий сообщество автотрофных организмов перифитона являлось лишь дополнительным источником органического углерода.
В мае–июне, в начальной стадии формирования обрастаний макрофитов, величины продукции эпифитных бактерий (Pb) были невысокими (рис. 2). Удельная продукция бактерий изменялась в пределах 0.39–0.99 сут–1 (в среднем 0.69 сут–1), а время удвоения биомассы бактерий – 16.8–42.6 ч (в среднем 29.7 ч). В это время первичная продукция эпифитона была выше, чем в последующие летние месяцы. Отношение бактериальной продукции к первичной продукции не превышало 0.07. В этот период фитоэпифитон мог полностью обеспечивать энергетические потребности эпифитных бактерий и быть для них источником органического углерода. На рисунке четко выражен пик роста бактериальной продукции и возрастание деструкции вслед за пиком первичной продукции альгоэпифитона.
Деструкция ОВ в эпифитоне тростника шла с интенсивностью 34.0–301.0 мкг С/г сут (средняя 105.5 мкг С/г сут). Максимальные величины скорости деструкции ОВ отметили в июле, минимальные – в октябре. В начале сезона (май‒июнь) деструкции ОВ на молодых вегетирующих растениях протекала в 1.3 раза активнее, чем на прошлогодних растениях. Скорость деструкции ОВ в обрастаниях тростника была тесно связана с продукцией эпифитных бактерий (R = 1.0) и не зависела (R = 0.19) от температуры окружающей среды (рис. 2). Высокие значения отношения первичной продукции эпифитона к деструкции органического вещества весной и в начале лета (в среднем за май‒июнь 8.50) свидетельствуют, что бактериоэпифитон может обеспечить энергетические потребности сообщества за счет обрастаний водорослей. В летние месяцы и до момента ухода воды из прибрежья в октябре это соотношение составляет в среднем за четыре месяца 0.54, и можно предположить, что развитие бактериальных обрастаний в этот период происходит, в основном, за счет органического вещества макрофитов.
Одновременные с изучением эпифитона замеры продукционно-деструкционных процессов в бактериопланктоне зарослей тростника показали, что скорость бактериальной продукции, первичной продукции фитопланктона и бактериальная деструкция в среднем протекали со скоростью 52.6, 561 и 449 мкг С/л сут соответственно.
ОБСУЖДЕНИЕ
Практически во всех водохранилищах Волги высокопродуктивный тростник южный является одним из доминантных водных растений, а в Рыбинском водохранилище наблюдается тенденция нарастания продуктивности растительного сообщества связанная с развитием именно гелофитов (Папченков, 2020). Ежегодно в прибрежной зоне образуются тысячи тонн растительного материала, подвергающихся затем бактериальной деструкции. Гетеротрофные бактерии численно и биохимически доминируют во всех местообитаниях, являясь основными факторами минерализации органического вещества, (Azam, Malfatti, 2007; Stocker, 2012), что тесно связано с процессами самоочищения водоемов (Олейник, 1991; Lalke et al., 1996; Kosten et al., 2009). Эпифитные бактерии по окончании вегетации участвуют в разложении отмершего растительного материала (Rogers, 1982).
Обнаруженные высокая численность и биомасса эпифитных бактериальных сообществ, свидетельствует об их высоком потенциале участия в утилизации растительных остатков. Для тростника обыкновенного данные процессы начинаются с начала вегетации (рис. 1, 2), и замедляются с понижением температуры до неблагоприятной для бактериального сообщества, возобновляясь весной на перезимовавшем растительном материале. Литературных данных о подледной деградации тростника нами не найдено. Показатели обилия бактерий эпифитов тростника в разных водоемах неодинаковы. Так, численность и биомасса бактерий в обрастаниях тростника в эвтрофном Иваньковском водохранилище (Верхняя Волга), соответственно, была в 1.5 и 2.0 раза выше, чем в Рыбинском водохранилище (Рыбакова, Копылов, 2017).
Наблюдение за сезонной динамикой развития бактериальных обрастаний тростника показало, что колебания численности и биомассы скорее были связаны с сезонными изменениями в развитии растений и возрастом биопленок (рис. 1). Два выявленных пика наблюдали в весенне-летний период и осенью ‒ в период массового отмирания растений, первый при температуре воды 22.0°С, второй при 14.5°С.
Сравнение эпифитона на прошлогоднем (мертвом) и молодом вегетирующем тростнике показало, что на вегетирующих растениях нарастание шло быстрее, и биомасса эпифитона была более чем в 2 раза выше, что, вероятно, связано с развитием альгоэпифитона и использованием его органического вещества, в то время как прошлогодний тростник был обеднен необходимыми компонентами (Корелякова, 1970).
Несмотря на значительный интерес исследователей к роли эпифитных бактерий в разложении растений, количественная информация о развитии эпифитных бактерий на живых растениях немногочисленна. По литературным данным численность гетеротрофных бактерий в эпифитоне для плавающих и погруженных макрофитов на Ceratophylum и Potamogeton от 0.4 до 2 × 108 кл./см2 (Theil-Nielsen, Sondergaard, 1999), на листьях разного возраста Ranunculus penicillatus от 1 × 105 до 3 × 107 кл./см2 (Hossell, Baker, 1979), бактериальная колонизация на Ceratophyllum demersum в пределах от 4 до 18 × 106 кл./см2 (Hempel et al., 2008). Полученные нами для тростника данные находятся в этих диапазонах.
В Рыбинском водохранилище при площади зарослей 40.4 км2 фитомасса тростника составила 149.4 тыс. тонн, т.е. на 1 м2 зарослей приходилось 3.7 кг сырой растительной массы (Папченков, 2013). Исходя из того, что примерно половина растения находится под водой и обрастает эпифитоном, а на 1 г растения приходится в среднем 161.1 мкг биомассы бактерий, доля биомассы бактериэпифитона в фитомассе погруженной части тростника с 1 м2 составила 0.008%, что на порядок меньше, чем в озере Нарочь, развивающемся по макрофитному типу – 0.11% (Инкина, 1989). Эти расчеты позволяют соотнести долю бактерий эпифитов, потенциальных деструкторов органического вещества образованного высшими водными растениями, с биомассой этих растений.
Большое видовое и функциональное разнообразие эпифитона, метаболическая активность в окислительно-восстановительных зонах обрастаний (Larned, 2010; Wu et al., 2014), способствуют его адаптации к среде с высоким содержанием питательных веществ, позволяя регулировать структуру сообщества (Shangguan et al., 2015). Самой многочисленной группой культивируемых бактерий, объединенных общими пищевыми предпочтениями, являются микроорганизмы, растущие на рыбо-пептонном агаре. Эта группа бактерий наиболее быстро реагирует на поступление легкорастворимых органических веществ. Доля их в общей численности бактерий эпифитов тростника достигает нескольких процентов и повышается в период массового отмирания растений при высвобождении лабильных питательных веществ в водную среду уже на начальных стадиях разложения первичных продуцентов (Zhao et al., 2017). По нашим данным около 30% микроорганизмов в обрастаниях тростника, использующих легко усваиваемые органические вещества, способны вырабатывать фермент каталазу; и доля их от всех сапрофитов возрастает к осени более чем вдвое, свидетельствуя об усилении окислительных процессов в период старения и разложения растений.
Изменения численности углеводородокисляющих микроорганизмов могут являться показателем антропогенных загрязнений, а также свидетельствовать о внутриводоемном поступлении углеводородов, связанном с выделениями и разрушением высших водных растений (Рыбакова, Васильева, 2003). Так как в районе нашего исследования антропогенная нагрузка считается невысокой, наблюдаемое ежегодное возрастание количеств этих микроорганизмов в обрастаниях тростника в конце лета–осенью, скорее связано с сезонными изменениями в эпифитоне и отмиранием растений.
Основной составляющей высшей водной растительности является клетчатка, содержание ее в разных группах растений неодинаково и может колебаться в пределах от 16.7 до 42.0% от суммы органических веществ. В полупогруженных в воду растениях, таких как тростник, относящихся к жесткой водной растительности, этих веществ примерно в 1.5 раза больше, чем у погруженной и плавающей, мягкой водной растительности, и к осени количество клетчатки увеличивается до максимальных величин (Корелякова, 1970). Изучение процессов утилизации в водных системах этого трудноразлагаемого вещества является сложным вопросом из-за отсутствия единых стандартов и методов. Мы показали, что активно разрушающие клетчатку микроорганизмы развивались не в период отмирания растений, как можно было бы ожидать, а на растущих растениях, имея высокую численность в середине лета. Осенью их численность снижалась. В весенний и раннелетний периоды разлагающих клетчатку бактерий регистрировали больше на мертвом тростнике, чем на вегетирующих молодых растениях. Вероятно, это связано с зимней мацерацией тростника и, как следствие, лучшей доступностью клетчатки, что позволяет при весеннем затоплении зарослей интенсивно развиваться микроорганизмам этой физиолого-трофической группы. Изучение культивируемых разрушителей клетчатки с помощью электронного микроскопа позволило нам выявить основные морфотипы бактерий. Среди них бактерии из рода Cytophaga, собственно разрушители клетчатки и, возможно, как сопутствующие этому процессу, бактерии рода Caulobacter, что косвенно подтверждается их активным состоянием в накопительной культуре Cytophaga, о чем свидетельствуют обнаруженные делящиеся клетки. Молекулярно-генетическими методами показано присутствие бактерий рода Cellvibrio (Gammaproteobacteria), разрушающих клетчатку, и Exiguobacterium (Firmicutes), развивающихся на глюкозе, сахарозе и других сахарах, образующихся в процессе ее деградации (табл. 2).
Полученные нами результаты по генетическому разнообразию обрастаний тростника согласуются с литературными данными (Yamamoto, 2005), где для воздушных и погруженных стеблей тростника определены преимущественно изоляты, принадлежащие к классам Gammaproteobacteria и Betaproteobacteria.
Примечательно, что природное водное микробное сообщество в зарослях тростника Рыбинского водохранилища представлено двумя основными филогенетическими линиями: протеобактериями и цианобактериями. Подавляющее большинство последовательностей составляют класс Гаммапротеобактерий – это представители широко распространенного рода Pseudomonas. Родство всех проанализированных последовательностей с представителями рода Pseudomonas составило от 98.8 до 99.7%. Кроме представителей псевдомонад, были получены последовательности, имеющие гомологию с представителями родов Pantoea и Enterobacter. При этом идентифицированные энтеробактерии выделены как эндофитные или ризосферные бактерии. Цианобактерии представлены родами Synechoccocus, Anabaena и Aphanizomenon с высоким процентом их гомологии с культивируемыми представителями (98.9‒99.8%) (Лаптева и соавт., 2015).
Молекулярно-генетическими методами также было установлено, что альфапротеобактерии, бетапротеобактерии, гаммапротеобактерии и сфингобактерии могут эффективно разлагать органическое вещество (Shangguan et al., 2015). Другая группа бактерий, включая виды Achromobacter, Alcaligenes, Bacillus, Hydrogenophaga и Pseudomonas имеет гетеротрофные возможности нитрификации и аэробной денитрификации (Feng et al., 2015). При этом некоторые авторы сообщают, что видоспецифичность хозяина сильно влияет на структуру и функциональные особенности эпифитонного сообщества бактерий (Zhang et al., 2018). Деструкция частей живых растений и их остатков после отмирания представляет собой сложный процесс, который зависит от многих составляющих, в том числе от химических свойств макрофитов (Sariyildiz, 2003). В нашей работе изменения в структуре различных физиолого-трофических групп мы наблюдали в связи с температурными изменениями и процессами роста и старения обрастаний, что отмечается и другими исследователями (Cai et al., 2013; Zhao et al., 2021).
Продукционно-деструкционные процессы в эпифитоне макрофитов меняются в течение сезона. Максимально высокую бактериальную продукцию в обрастаниях тростника мы наблюдали вслед за пиком образования первичной продукции эпифитными водорослями (рис. 2). Подъем не был связан с температурой воды в зарослях. Вероятно, это связано с видовой трансформацией фитоценоза обрастаний (Девяткин, 1983). В своей работе автор отмечает, что в процессе старения обрастаний возрастает его гетеротрофная составляющая.
В осенние месяцы на фоне уменьшения температуры и вторичная и первичная продукция в эпифитоне постепенно снижались, но скорость этих процессов регистрировали на уровне некоторых замеров в летние месяцы. Относительно высокая бактериальная продукция в этот период, вероятно, поддерживалась начинающимся разложением макрофитов. До значительного понижения температуры в обрастаниях тростника оставалась высокой численность целлюлозоразрушающих и углеводородокисляющих бактерий. При этом скорость деструкции органических веществ в обрастаниях тростника была тесно связана с продукцией эпифитных бактерий и не зависела от температуры окружающей среды.
Полученные нами величины продукции эпифитных бактерий тростника оказались в большинстве случаев выше зарегистрированных для эпифитона четырех видов макрофитов реки Шпрее (0.127–1.272 мкг С/см2 сут) в условиях близких температур воды (Fischer, Pusch, 2001) и выше суточной продукции в обрастаниях тростника Рыбинского водохранилища, определенной по включению 3Н-тимидина (0.293 мкг С/см2), которая, в свою очередь, превышала продукцию в обрастаниях других высших водных растений (Копылов и соавт., 2014).
Используя данные по фитомассе тростника южного прибрежной зоны водохранилища (Папченков, 2013) и приняв, что в среднем подводная часть растений составляет 1 м, мы рассчитали продукцию бактериальных обрастаний на 1 м2 (1 м3), которая составила 152.4 мг С в сутки. В столбе воды зарослей суточная продукция бактериопланктона показала лишь 52.6 мг С/м3. При этом бактериальная продукция обрастаний тростника сравнима с таковой для микрофлоры донных отложений и даже превышает ее (Буторин, 1984).
Высокая первичная продукция макрофитов и эпифитных водорослей в прибрежной зоне в сочетании с постоянной потерей лабильного ОВ из-за разлагающихся макрофитов поддерживают более высокую продукцию бактериальных обрастаний и бактериопланктона в зарослях макрофитов по сравнению с открытыми участками водоема (Wetzel et al., 1998), влияя на циклы питательных веществ (Liu et al., 2016; Yang et al., 2018).
Таким образом, наше исследование показывает специфичность ассоциированного с тростником эпифитонного сообщества, большее влияние растения-хозяина на структуру и активность бактериальных биопленок, чем сезонное изменение условий среды.
Приведенные данные убеждают, что сообщество эпифитных бактерий разнообразно по своей трофической направленности и представляет собой комплекс потенциальных деструкторов высокомолекулярных соединений, содержащихся в тканях макрофитов или образующихся в процессе их разрушения. Это позволяет ему играть основную роль в утилизации органического вещества в прибрежной зоне водохранилища, так как численность и функциональная активность бактериального сообщества обрастаний сравнимы и часто превышают таковые для бактериопланктона и бентоса.
Список литературы
Белькова Н.Л. Молекулярно-генетические методы анализа микробных сообществ // Разнообразие микробных сообществ внутренних водоемов России: Учебно-методическое пособие / Под ред. Андреевой А.М. Ярославль: Изд-во ООО “Принтхаус”, 2009. С. 53–63.
Большой практикум по микробиологии: учебное пособие для государственных университетов СССР // Аристовская Т.В., Владимирская М.Е., Голлербах М.М. [и др.] / Под общ. ред. Селиберга Г.Л. . М.: Высшая школа, 1962. 491 с.
Буторин А.Н. Активность микрофлоры в поверхностном слое донных отложений озер Северо-Двинской системы. Л.: “Наука”, 1984. Инф. бюлл. № 64. С. 3‒5.
Девяткин В.Г. Состав и продуктивность фитопланктона в прибрежной зоне Рыбинского водохранилища // Пресноводные гидробионты и их биология. Л.: 1983. С. 52‒70.
Инкина Г.А. Микрофлора в обрастаниях высших водных растений // Гидробиол. журн. 1989. Т. 25. № 4. С. 54‒57.
Копылов А.И., Косолапов Д.Б., Рыбакова И.В., Заботкина Е.А. Микробное сообщество эпифитона водохранилища: роль вирусов в смертности гетеротрофных бактерий и пикоцианобактерий // Успехи современной биологии. 2014. Т. 134. № 2. С. 111‒120.
Корелякова И.Л. Химический состав высшей водной растительности Киевского водохранилища // Гидробиол. журн. 1970. Т. 6. № 5. С. 20‒28.
Кузнецов С.И. Метод изготовления препаратов для получения электронно-микроскопических снимков бактерий из воды и озерного ила // Флора, фауна и микроорганизмы Волги. Рыбинск: Ин-т биол. внутр. вод АН СССР, 1974. С. 303–309.
Кузнецов С.И., Дубинина Г.А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 288 с.
Лаптева Н.А., Рыбакова И.В., Суханова Е.В., Белькова Н.Л. Структура и функциональная активность бактериопланктона в воде среди зарослей макрофитов в прибрежье Рыбинского водохранилища // Гидробиол. журн. 2015. Т. 51. № 5. С. 94‒104. Lapteva N.A., Rybakova I.V., Sukhanova Ye.V., Bel’kova N.L. Structure and functional activity of bacterioplankton in water within macrophytes thickets in the coastal zone of the Rybinsk reservoir // Gidrobiologicheskiy Zhurnal. 2015. V. 51. P. 94—104.
Ляшенко Г.Ф. Динамика высшей водной растительности Рыбинского водохранилища // Ботанический журн. 1999. № 12. С. 106‒111.
Одинцов В.С., Лаптева Н.А. Азотфиксирующая активность эпифитов на некоторых макрофитах Японского моря // Биология моря. 1984. № 1. С. 60–62.
Олейник Г.Н. Бактериальная деструкция органического вещества в водоемах и водотоках // Водные ресурсы. 1991. № 2. С. 89–97.
Папченков В.Г. Степень зарастания Рыбинского водохранилища и продуктивность его растительного покрова // Биология внутренних вод. 2013. № 1. С. 24‒31.
Papchenkov V.G. The degree of overgrowth of the Rybinsk Reservoir and productivity of its vegetation cover // Inland Water Biol. 2013. № 1. P. 18–25.
Папченков В.Г., Папченкова Г.А. Динамика и зарас-тание водохранилищ Волги // Водные ресурсы. 2020. Т. 47. № 4. C. 402–410.
Романенко В.И., Кузнецов С.И. Экология микроорганизмов пресных водоемов. Лабораторное руководство. Л.: Наука, 1974. 194 с.
Рыбакова И.В., Васильева М.И. Микробиологическая характеристика мелководий Волжского плеса Рыбинского водохранилища // Тезисы межд. конф. “Экологические проблемы бассейнов крупных рек-3”. Тольятти, 15‒19 сентября, 2003 г. С. 244.
Рыбакова И.В., Белькова Н.Л., Лаптева Н.А., Суханова Е.В. Адаптация молекулярно-генетических методов для изучения таксономического разнообразия микробных сообществ, ассоциированных с макрофитами // Биология внутренних вод. 2009. № 1. С. 102‒110.
Rybakova I.V., Bel’kova N.L., Lapteva N.A., Sukhanova E.V. Adapting molecular-genetic methods for studying the taxonomic diversity of microbial communities associated with macrophytes // Inland Water Biol. 2009. V. 2. P. 96–103.
Рыбакова И.В. Бактериальные обрастания массовых видов высших водных растений Рыбинского водохранилища // Труды ИБВВ РАН. 2016. Вып. 74(77). С. 50–58.
Рыбакова И.В., Копылов А.И. Гетеротрофные бактерии в эпифитоне высших водных растений Иваньковского водохранилища // Биология внутренних вод. 2017. № 2. С. 117‒120. Rybakova I.V., Kopylov A.I. Heterotrophic bacteria in epiphiton of higher aquatic plants in the Ivankovo Reservoir // Inland Water Biol. 2017. V. 10. P. 239−242.
Тимакова Т.М. Разложение клетчатки в Иваньковском и Угличском водохранилищах. М.: Наука, 1984. С. 124–139.
Тимакова Т.М., Романенко В.И. Целлюлозные бактерии и потенциальная способность разложения целлюлозы в озерах Карелии // Микробиология. 1984. Т. 53. С. 142–148.
Якушин В.М. Развитие бактерий среди зарослей и в перифитоне тростника в Северо-Крымском канале // Гидробиологический журн. 1978. Т. 14. С. 36–40.
Azam F., Malfatti F. Microbial structuring of marine ecosystems // Nat. Rev. Microbiol. 2007. V. 5. P. 782–791.
Asaeda T., Sultana M., Manatunge J., Fujino T. The effect of epiphytic algae on the growth and production of Potamogeton perfoliatus L. in two light conditions // Environ. Exp. Bot. 2004. V. 52. P. 225–238.
Basberg L., Banks D., Sæther O. Redox processes in groundwater impacted by landfill leachate // Aquat. Geochem. 1998. V. 4. P. 253–272.
Bronmark C. Interactions between epiphytes, macrophytes and freshwater snails: a review // J. Mollusc. Stud. 1989. V. 55. P. 299–311.
Corstanje R., Reddy K.R., Portier K.M. Typha latifolia and Cladium jamaicense litter decay in response to exogenous nutrient enrichment // Aquat. Bot. 2006. V. 84. I. 1. P. 70‒78.
Cai X., Gao G., Tang X., Dong B., Dai J., Chen D., Song Y. The response of epiphytic microbes to habitat and growth status of Potamogeton malaianus Miq. in Lake Taihu // J. Basic Microbiol. 2013. V. 53. P. 828–837.
Coci M., Nicol G.W., Pilloni G.N., Schmid M., Kamst-van Agterveld M.P., Bodelier P.L., Laanbroek H.J. Quantitative assessment of ammonia-oxidizing bacterial communities in the epiphyton of submerged macrophytes in shallow lakes // Appl. Environ. Microbiol. 2010. V. 76. P. 1813–1821.
Feng C., Huang L., Yu H., Yi X., Wei C. Simultaneous phenol removal, nitrification and denitrification using microbial fuel cell technology // Water Res. 2015. V. 76. P. 160–170.
Fischer H., Pusch M. Comparison of bacterial production in sediments, epiphyton and the pelagic zone of lowland river // Freshwat. Biol. 2001. V. 46. P. 1335–1348.
Hempel M., Blume M., Blindow I., Gross E.M. Epiphytic bacterial community composition on two common submerged macrophytes in brackish water and freshwater // Microbiol. 2008. V. 8. Art. 58.
Hossell J.C., Baker J.H. Epiphytic bacteria on the freshwater plant Ranunculus penicillatus enumeration, distribution and identification // Arch. Hydrobiol. 1979. V. 86. P. 322–337.
Islam J., Singhal N. A laboratory study of landfill-leachate transport in soils // Water Res. 2004. V. 38. P. 2035–2042.
Kosten S., Lacerot G., Jeppesen E., Marques D.D.M., Nes E.H.V., Mazzeo N., Scheffer M. Effects of submerged vegetation on water clarity across climates // Ecosystems. 2009. V. 12. P. 1117–1129.
Lalke E., Donderski W., Blotevogel K. Role of epiphytic bacteria in the utilization of organic matter // Oceanol. Stud. Mar. Biol. [Pol. Acad. Sci.]. 1996. V. 25. P. 19–30.
Larned S.T. A prospectus for periphyton: recent and future ecological research // J. North. Am. Benthol. Soc. 2010. V. 29. P. 182–206.
Nocker A., Camper A.K. Selective removal of DNA from dead cells of mixed bacterial communities by use of ethidium monoazide // Appl. Environ. Microbiol. 2006. V. 72. P. 1997–2004.
Liu J., Liu W., Wang F., Kerr P., Wu Y. Redox zones stratification and the microbial community characteristics in a periphyton bioreactor // Bioresour. Technol. 2016. V. 204. P. 114–121.
Norland S. The relationship between biomass and volume of bacteria // Handbook of Methods in Aquatic Microbial Ecology / Eds. Kemp P., Sherr B., Sherr E., Cole J. Boca Raton: Lewis Publishers, 1993. P. 303–308.
Porter R.G., Feig Y.S. The use of DAPI for identification and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. P. 943–948.
Qin B.Q., Song Y.Z., Gao G. The role of periphytes in the shift between macrophyte and phytoplankton dominated systems in a shallow, eutrophic lake (Lake Taihu, China) // Sci. China Ser. C. 2006. V. 49. P. 597–602.
Rogers K.H., Breen C.M. Decomposition of Potamogeton crispus L.: the effect of drying on the pattern of mass and nutrient loss // Aquat. Bot. 1982. V. 12. P. 1–12.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning. A Laboratory Manual. N.: Cold Spring Harbor Laboratory Press, 1989. V. 2. 345 p.
Schneider T., Keiblinger K.M., Schmid E., Sterflinger-Gleixner K., Ellersdorfer G., Roschitzki B., Richter A., Eberl L., Zechmeister-Boltenstern S., Riedel K. Who is who in litter decomposition? Metaproteomics reveals major microbial players and their biogeochemical functions // ISME J. 2012. V. 6. P. 1749–1762.
Shangguan H., Liu J., Zhu Y., Tong Z., Wu Y. Start-up of a spiral periphyton bioreactor (SPR) for removal of COD and the characteristics of the associated microbial community // Bioresour. Technol. 2015. V. 193. P. 456–462.
Srivastava J.K., Chandra H., Kalra S.J.S., Mishra P., Khan H., Yadav P. Plant–microbe interaction in aquatic system and their role in the management of water quality: a review // Appl. Water Sci. 2017. V. 7. P. 1079–1090.
Steemann Nielsen E. The use of radioactive carbon (14C) for measurement organic production in the sea // J. Conseil. Perman. Intern. Explorat. Mer. 1952. V. 18. P. 117‒140.
Stocker R. Marine microbes see a sea of gradients // Science. 2012. V. 338. P. 628–633.
Theil-Nielsen J., Sondergaard M. Production of epiphytic bacteria and bacterioplankton in three shallow lakes // O-ikos. 1999. V. 86. P. 283‒292.
Wetzel R.G., Sondergaard M. Role of submerged macrophytes for the microbial community and dynamics of dissolved organic carbon in aquatic ecosystem // The Structuring Role of Aquatic Macrophytes in Lakes / Eds. Jeppe-sen E., Søndergaard M., Søndergaard M., Christoffersen K. Springer, New York, NY, 1998. P. 133‒148.
Wu Y., Xia L., Yu Z., Shabbir S., Kerr P.G. In situ bioremediation of surface waters by periphytons // Bioresour. Technol. 2014. V. 151. P. 367–372.
Yamamoto M., Murai H., Takeda A., Okunishi S., Morisaki H. Bacterial flora in the biofilm formed on the submerged surface of the reed Phragmites australis // Microb. Environ. 2005. V. 20. P. 14–24.
Yang Y., Chen W., Yi Z., Pei G. The integrative effect of periphyton biofilm and tape grass (Vallisneria natans) on internal loading of shallow eutrophic lakes // Environ. Sci. Pollut. Res. 2018. V. 25. P. 1773–1783.
Zhang L., Zhang S., Lv X., Qiu Z., Zhang Z., Yan L. Dissolved organic matter release in overlying water and bacterial community shifts in biofilm during the decomposition of Myriophyllum verticillatum // Sci. Total Environ. 2018. V. 633. P. 929–937.
Zhao B., Xing P., Wu Q.L. Microbes participated in macrophyte leaf litters decomposition in freshwater habitat // FEMS Microbiol. Ecol. 2017. V. 93. fix108.
Zhao B., Xing P., Wu Q.L. Interactions between bacteria and fungi in macrophyte leaf litter decomposition // Environ. Microbiol. 2021. V. 23. P. 1130–114.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


