Микробиология, 2022, T. 91, № 4, стр. 507-516
Влияние немодифицированных многостенных углеродных нанотрубок на формирование и разрушение бактериальных биопленок
Ю. Г. Максимова a, b, *, Я. Е. Быкова a, b, А. С. Зорина a, С. М. Никулин c, А. Ю. Максимов a, b
a Институт экологии и генетики микроорганизмов УрО РАН – филиал Пермского
федерального исследовательского центра УрО РАН
614081 Пермь, Россия
b Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
c Акционерное общество “Уральский научно-исследовательский институт композиционных материалов” (“УНИИКМ”)
614014 Пермь, Россия
* E-mail: maks@iegm.ru
Поступила в редакцию 15.11.2021
После доработки 23.03.2022
Принята к публикации 24.03.2022
- EDN: PXWGDO
- DOI: 10.31857/S0026365621100694
Аннотация
Изучено влияние немодифицированных многостенных углеродных нанотрубок (МУНТ) на биопленки грамотрицательных бактерий, типичных представителей сообщества активного ила, и грамположительных родококков, играющих важную роль в биодеградации ксенобиотиков. Было показано, что наноматериалы этого типа не только не приводят к полному ингибированию биопленкообразования изученных бактерий, но и оказывают на них пробиопленочное действие. В присутствии МУНТ в условиях динамического равновесия с суспензионной культурой формировались менее массивные биопленки Burkholderia dolosa БОС, Rhodococcus erythropolis 4-1, R. ruber gt1, но достоверно более массивные биопленки Acinetobacter guillouiae 11h, Alcaligenes faecalis 2 и R. erythro-polis 11-2, однако после предварительной адгезии клеток и в отсутствии суспензионной культуры все изученные штаммы формировали достоверно более массивную биопленку. Более интенсивному разрушению в присутствии МУНТ были подвержены биопленки грамотрицательных подвижных бактерий. Воздействие углеродных наноматериалов на метаболическую активность и жизнеспособность изученных бактерий было оценено по восстановлению соли тетразолия и окислительно-восстановительного индикатора резазурина, общему содержанию АТФ и нарушению цитоплазматической мембраны. Достоверно возрастала дыхательная активность клеток биопленок R. erythropolis 11-2 и R. ruber gt1, выращенных в присутствии МУНТ, и зрелых, выращенных на среде LB, биопленок R. erythropolis ИЛ БИО и R. erythropolis 11-2 при последующем воздействии на них МУНТ. Было отмечено отсутствие отрицательного воздействия МУНТ на восстановление метаболизируемого красителя ХТТ клетками. Комплексные исследования биопленкообразования и метаболической активности бактериальных клеток подтвердили отсутствие цитотоксического действия немодифицированных МУНТ на клетки грамотрицательных представителей сообщества активного ила и грамположительных родококков в составе биопленок.
Углеродные нанотрубки (УНТ) представляют собой полую цилиндрическую структуру из плоскостей графена и, в зависимости от количества этих плоскостей, подразделяются на одно- (ОУНТ) и многостенные (МУНТ) (Aqel et al., 2012). Благодаря своим уникальным свойствам, среди которых высокая электро- и теплопроводность, прочность, значительная удельная поверхность и химическая инертность, наноматериалы этого типа нашли применение в таких областях, как материаловедение, электроника, техническая химия, медицина, природоохранные мероприятия, биотехнологии. Получение больших объемов наноматериалов приводит к неизбежному их попаданию в окружающую среду, что ставит вопрос о воздействии на биоценозы, и в первую очередь на микробиоценозы естественной среды, а также на представителей сообщества активного ила очистных сооружений.
Взаимодействие микроорганизмов с УНТ может быть различным. Во-первых, накоплено достаточно данных о цитотоксических свойствах УНТ, что предполагает возможность использования их как антимикробных агентов (Kang et al., 2007, 2008), а микроорганизмов в качестве тест-объектов для изучения токсичности наноматериалов (Зарубина и соавт., 2009). Во-вторых, высокие адсорбционные способности УНТ позволяют применять их в технологиях очистки воды как носитель для иммобилизации (агрегации) микробных клеток (Yan et al., 2004; Das et al., 2014; Özdemir et al., 2017), в биокатализе (Максимова и соавт., 2017), биодеградации токсичных веществ (Qu et al., 2016), в качестве электронопроводящего материала в микробных топливных элементах (Ghasemi et al., 2013) и биосенсорах (Tоlmaciu, Morris, 2015).
Следуя современным представлениям микробиологии, основной формой существования микроорганизмов в природе является адгезированное состояние и формирование многовидовых сообществ, погруженных в вырабатываемый ими полимерный матрикс (Ножевникова и соавт., 2015). Биопленки имеют большое значение в технологиях очистки окружающей среды, биотехнологиях, связанных с получением энергии (микробные топливные элементы) и конструированием биосенсоров, а также представляют собой проблему медицинского характера, являясь трудно поддающейся антибиотикотерапии и антисептике формой существования болезнетворных микроорганизмов.
Биопленочный фенотип микроорганизмов существенно отличается от фенотипа одиночных планктонных клеток, в связи с чем результаты воздействия многих факторов внешней среды, химических веществ, биоцидов и антибиотиков, а также наноматериалов, могут значительно отличаться. Данные, касающиеся воздействия углеродных наноматериалов на бактериальные биопленки, достаточно противоречивы. С одной стороны, антимикробные свойства нанотрубок предотвращают адгезию клеток и формирование биопленок (Upadhyayula, Gadhamshetty, 2010; Sun, Zhang, 2016), с другой стороны, есть сведения, что биопленки могут нарастать на таких материалах: мертвые клетки на поверхности экранируют токсический эффект УНТ, в результате чего происходит образование биопленки по принципу “живое на мертвом” (Goodwin et al., 2015, 2016). В ряде исследований показано антибактериальное действие МУНТ на микробные биопленки. Продемонстрировано, что модификация нанотрубками полидиметилсилоксановых композитов снижает колонизацию этих поверхностей пионерными биопленками эу-кариотов (Sun, Zhang, 2016), а дисперсия МУНТ в структуре полиэфирсульфоновых мембран обеспечивает устойчивость таких композитных материалов к обрастанию биопленками модельных организмов Escherichia coli и Pseudomonas aeruginosa (Madenli et al., 2020). Продемонстрирован эффект ингибирования биопленкообразования Klebsiella oxytoca, Pseudomonas aeruginosa и Staphylococcus epidermidis МУНТ различной длины (Malek et al., 2016). Различные модификации МУНТ увеличивают их антимикробную активность. МУНТ, конъюгированные с антителами, применялись для фототермальной инактивации (обработки инфракрасным светом с целью эрадикации) стрептококков группы А (Levi-Polyachenko et al., 2014). МУНТ, покрытые антимикробным пептидом низином, обладали антиадгезивными свойствами и были эффективны против образования биопленок (Dong et al., 2014). Поверхности, модифицированные МУНТ и импрегнированные антибиотиком, препятствовали формированию биопленок патогенных микроорганизмов на эндопротезах (Hirschfeld et al., 2017). УНТ также используют в технологиях очистки воды, благодаря таким качествам, как большая площадь поверхности и простота функционализации. Они сами являются фильтрами, либо входят в состав мембран различного состава, так как препятствуют биообрастанию, способствуют дезинфекции, а также обладают прочностью и проницаемостью (Ihsanullah, 2019).
В свою очередь, углеродные наноматериалы могут способствовать образованию биопленок электрогенных микроорганизмов, что используется при конструировании микробных топливных элементов (Zhang et al., 2017; Jiang et al., 2018). Показано, что модификация нанотрубками анода микробных топливных элементов улучшает их электрохимические характеристики и повышает производительность (Zhang et al., 2018). Таким образом, две противоположные задачи – борьба с “вредными” биопленками и содействие образованию “полезных” биопленок могут решаться с помощью различных углеродных материалов, их функционализации и модификации. Однако воздействие углеродных нанотрубок в гораздо большей степени исследовано в отношении микробных клеток в суспензии, чем их биопленок.
В связи с этим целью работы явилось изучение влияния МУНТ на биопленкообразование и разрушение биопленок бактерий различных систематических групп, а также на жизнеспособность и метаболическую активность бактериальных клеток в составе биопленок.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальные штаммы и характеристики МУНТ. Объектами исследования явились грамотрицательные бактерии, ранее выделенные нами из активного ила очистных сооружений: Alcaligenes faecalis 2, Acinetobacter guillouiae 11h (Демаков и соавт., 2015), Achromobacter pulmonis ПНОС, Burkholderia dolosa БОС (Максимова и соавт., 2020), и грамположительные бактерии, ранее выделенные из почв: R. erythropolis ИЛ БИО, R. erythropolis 11-2, R. ruber gt1 (Максимов и соавт., 2003).
МУНТ синтезировали в Уральском научно-исследовательском институте композиционных материалов (г. Пермь, Россия) осаждением природного газа с содержанием метана около 97 об. %. Осаждение МУНТ проводили на катализаторе, содержащем оксиды магния, никеля, кобальта и частицы металлического сплава никеля и кобальта, МУНТ содержали 83.0% С, 16.6% MgO, 0.3% Со, 0.1% Ni и обладали следующими характеристиками: внешний диаметр 5–35 нм, внутренний диаметр 3–14 нм, длина не менее 2 мкм, удельная поверхность, измеренная по методу БЭТ, не менее 400 м2/г.
Условия культивирования биопленок и определение их биомассы. Бактериальные биопленки выращивали в 96-луночном полистироловом планшете “Медполимер” (Россия) в среде LB (“Sigma-Aldrich”, США) в присутствии МУНТ (200 мкг/мл). Предварительно для получения однородной суспензии среду с МУНТ обрабатывали УЗ в ультразвуковой ванне Elma Ultrasonic 30S (“Elma”, Германия) при 37 кГц 10 раз по 1 мин. В лунки планшета вносили 200 мкл среды, инокулировали 5 мкл бактериальной суспензии, содержащей 109 КОЕ/мл. Контролем служили биопленки, выращенные на среде LB без МУНТ.
После 3–7 сут инкубации в термостате при 30°С планктонные клетки удаляли из лунок декантацией, отмывали биопленку 200 мкл калий-фосфатного буфера дважды и определяли биомассу образованной биопленки. Биопленку окрашивали 0.1% кристаллическим фиолетовым в течение 40 мин в темноте, удаляли краситель, отмывали 1 раз калий-фосфатным буфером и экстрагировали краситель 200 мкл 96% спирта. Биопленкообразование оценивали по оптической плотности раствора красителя при 540 нм на планшетном ридере Infinite M1000 pro (“TECAN”, Швейцария).
Во втором варианте изучали формирование биопленки из предварительно адгезированных клеток (Gannesen et al., 2018): 200 мкл бактериальной суспензии вносили в лунки полистиролового планшета для адгезии клеток, через 2 ч удаляли, отмывали однократно калий-фосфатным буфером и вносили по 200 мкл среды LB с МУНТ и без нанотрубок в качестве контроля; раз в сутки среду заменяли на свежую. Биомассу биопленок определяли как описано выше.
Для определения массивности полимерного матрикса биопленки, выращенные в лунках черного непрозрачного планшета (“Nunc”, Дания), окрашивали 150 мкл водного раствора konA-тетраметилродамина (500 мкг/мл) в течение 40 мин в темноте, удаляли краситель, отмывали биопленку 1 раз 150 мкл 0.9% NaCl. В качестве контроля краситель вносили в пустую лунку, удаляли и отмывали, как описано выше. Массивность полимерного матрикса оценивали по интенсивности флуоресценции на планшетном ридере Infinite M1000 pro (“TECAN”, Швейцария) при длине волны возбуждения/испускания 555/580 нм (Зорина и соавт., 2019).
Влияние МУНТ на разрушение биопленок оценивали по биомассе биопленки, определенной описанным выше методом, после суточной инкубации выращенных на среде LB биопленок с 0.9% NaCl, содержащим 200 мкг/мл МУНТ. Контролем служили биопленки, инкубированные с 0.9% NaCl без МУНТ.
Оценка влияния МУНТ на метаболическую активность биопленок. Воздействие МУНТ на дыхательную активность биопленок оценивали колориметрическим методом с использованием набора реактивов ХТТ Cell Proliferation Assay Kit (“Roche”, Германия). Биопленки грамположительных и гра-мотрицательных бактерий выращивали в полистирольном плоскодонном 96-луночном планшете в 200 мкл среды LB с добавлением МУНТ (200 мкг/мл) в течение 7 и 3 сут соответственно, контролем служили биопленки, выращенные на среде LB без МУНТ. Сформированные биопленки отмывали и вносили 100 мкл 0.9% раствора NaCl с добавлением 50 мкл реактива ХТТ (2,3-бис-(2-м-етокси-4-нитро-5-сульфофенил)-2Н-тетразолий-5-карбоксанилид). Измерения проводили на планшетном ридере Infinite M1000 pro (“TECAN”, Швейцария) при ОП480 через каждый час в течение 7 ч. Во второй серии опытов выращенные, как описано выше, на среде LB биопленки отмывали, вносили 100 мкл 0.9% NaCl с МУНТ (200 мкг/мл) и добавляли 50 мкл реактива ХТТ, контролем служил 0.9% NaCl без добавок. Измерения проводили, как описано выше. Уровень влияния МУНТ на метаболическую активность бактериальных клеток определяли как отношение оптической плотности экспериментального образца к оптической плотности контрольного образца (ОПэкспер/ОПконтр) через 6 ч инкубации. При значении, превышающем 1, делали вывод о повышении дыхательной активности, менее 1 – о снижении дыхательной активности.
Метаболическую активность клеток биопленок оценивали по уровню флуоресценции после окраски PrestoBlueTM Cell Viability Reagent (“Invitrogen”, США). Биопленки грамотрицательных и грамположительных бактерий выращивали в черном полистироловом плоскодонном 96-луночном планшете (“Nunc”, Дания) в 200 мкл среды LB в течение 3 и 7 сут соответственно, отмывали фосфатным буфером, вносили 0.9% NaCl с МУНТ (200 мкг/мл), инкубировали в термостате. Через 1 ч биопленки отмывали 100 мкл 0.9% NaCl однократно. В лунки вносили 90 мкл 0.9% NaCl и 10 мкл PrestoBlueTM Cell Viability Reagent. После 10 мин инкубации при температуре 37°С измеряли уровень флуоресценции при λ возбуждения/испускания 560/590 нм. Условные единицы флуоресценции контрольных образцов (1 ч инкубации с 0.9% NaCl без внесения МУНТ) принимали за 100%. Окраску реактивом PrestoBlueTM Cell Viability Reagent проводили отдельно для биопленок и планктонных клеток.
Эпифлуоресцентная микроскопия биопленок. Биопленки грамотрицательных и грамположительных бактерий выращивали в течение 3 и 7 сут соответственно в чашках Петри на предметных стеклах (25 × 75 мм) в среде LB, содержащей 200 мкг/мл МУНТ, или среде LB без МУНТ в качестве контроля. Среду инокулировали клетками соответствующего штамма. Стекла с биопленками отмывали фосфатным буфером (рН 7) однократно, окрашивали красителем LIVE/DEAD® (Syto 9/пропидиум иодид) BacLightTM Bacterial Viability Kit (“Invitrogen”, США) из расчета 3 мкл смеси красителя на 1 мл физиологического раствора (0.9% NaCl), инкубировали в темноте в течение 20 мин и просматривали в световом микроскопе Leica DM LS (Германия) с флуоресценцией. Процент живых и мертвых клеток подсчитывали с помощью программы BioFilmAnalyzer (Bogachev et al., 2018).
Статистический анализ результатов проводили с помощью стандартного пакета лицензионной программы MS Excel 2007, определяли среднее арифметическое, стандартное отклонение, стандартную ошибку среднего. Достоверность различий определяли с использованием критерия Стьюдента. Авторы принимали, что варьирование результатов в их экспериментах подчиняется закону нормального распределения. Различия считали достоверными при уровне значимости p < 0.05 (n = 7–14).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
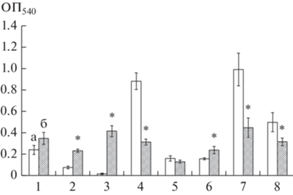
Влияние МУНТ на биопленкообразование и разрушение биопленок. Изучено влияние МУНТ на биопленкообразование актино- и протеобактерий (рис. 1). В первом варианте опыта биопленкообразование оценивали в присутствии планктонной культуры. Показано, что МУНТ в среде культивирования приводили к увеличению биомассы биопленок A. faecalis 2, A. guillouiae 11h и R. erythropolis 11-2 и ее снижению у B. dolosa БОС и R. ruber gt1. Увеличение биомассы сформированных биопленок может быть связано с двумя факторами: во-первых, УНТ в среде культивирования могут способствовать агрегации клеток и приводить к повышенной адгезии. При биопленкообразовании в присутствии планктонной культуры возникает динамическое равновесие между прикрепленной и неприкрепленной культурами, и увеличение или уменьшение биомассы биопленки происходит за счет влияния МУНТ на планктонную культуру или формирующуюся биопленку: может происходить снижение или стимуляция роста клеток, повышенная агрегация и включение планктонных клеток в состав биопленки в процессе роста, или наоборот, дисперсия клеток. Также увеличение биомассы биопленок может быть ответом клетки на различные стрессовые факторы. Как следует из накопленных знаний, касающихся формирования биопленок, микробные популяции переходят от планктонного способа существования к прикрепленному под воздействием различных стрессовых условий (Плакунов и соавт., 2017). Менее массивные биопленки могут формироваться за счет снижения выработки полимерного матрикса, либо за счет отрицательного влияния внешних факторов на жизнеспособность, рост и размножение клеток. В данном эксперименте полного ингибирования биопленкообразования в присутствии МУНТ отмечено не было.
Рис. 1.
Биомасса биопленок A. pulmonis ПНОС (1), A. guillouiae 11h (2), A. faecalis 2 (3), B. dolosa БОС (4), R. erythropolis ИЛ БИО (5), R. erythropolis 11-2 (6), R. erythropolis 4-1 (7), R. ruber gt1 (8), сформированных в присутствии планктонной культуры в среде LB (а) и в среде LB с МУНТ (б), (* p < 0.05).
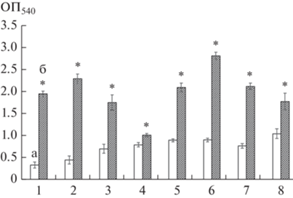
Во втором варианте экспериментов бактериальные клетки предварительно адгезировали в лунках полистиролового планшета в течение 2 ч, после чего суспензию удаляли и заменяли свежей питательной средой. Формирование биопленок в данном случае было первичным по отношению к планктонному росту, однако не был исключен переход клеток биопленки в планктонное состояние и размножение клеток в суспензии. Для всех изученных культур отмечали эффективное биопленкообразование в присутствии МУНТ, что свидетельствовало о пробиопленочном эффекте этих наноматериалов (рис. 2).
Рис. 2.
Формирование биопленок после предварительной адгезии клеток A. pulmonis ПНОС (1), A. guillouiae 11h (2), A. faecalis 2 (3), B. dolosa БОС (4), R. erythropolis ИЛ БИО (5), R. erythropolis 11-2 (6), R. erythropolis 4-1 (7), R. ruber gt1 (8) в среде LB (а) и в среде LB с МУНТ (б), (* p < 0.05).
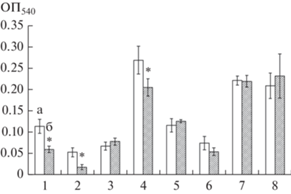
Показано усиление процесса разрушения биопленок A. pulmonis ПНОС, B. dolosa БОС и A. guillouiae 11h под воздействием МУНТ, тогда как на биопленки грамположительных бактерий рода Rhodococcus углеродные наноматериалы влияние не оказывали (рис. 3). Разрушение биопленки является следствием как более активной миграции клеток и перехода в планктонное состояние, так и отрыва целых фрагментов биопленки. Нами было показано, что под влиянием МУНТ интенсивнее разрушались биопленки грамотрицательных подвижных бактерий, что может быть обусловлено их меньшей прочностью, а также более активным переходом подвижных клеток из прикрепленного состояния в свободно плавающее.
Рис. 3.
Разрушение биопленок A. pulmonis ПНОС (1), A. guillouiae 11h (2), A. faecalis 2 (3), B. dolosa БОС (4), R. erythropolis ИЛ БИО (5), R. erythropolis 11-2 (6), R. erythropolis 4-1 (7), R. ruber gt1 (8) в 0.9% NaCl (а) и в 0.9% NaCl с МУНТ (б), (* p < 0.05).
Оценка воздействия МУНТ на жизнеспособность и метаболическую активность клеток в составе биопленок. Жизнеспособность и метаболическую активность клеток в составе биопленок оценивали различными методами. Прямой высев клеток биопленок и определение КОЕ не является достаточно точным методом вследствие неравномерного разрушения клеточных агрегатов (Плакунов и соавт., 2016), поэтому в данной работе были использованы косвенные методы, среди которых оценка дыхательной активности с использованием реактива ХТТ Cell Proliferation Assay Kit и метаболической активности с использованием PrestoBlueTM Cell Viability Reagent, а также оценка общего содержания АТФ и соотношения живых и мертвых клеток (клеток с интактной и нарушенной мембраной) методом флуоресцентной микроскопии при окраске красителем LIVE/DEAD®. Изучена динамика изменения оптической плотности раствора красителя ХТТ, добавленного к бактериальным биопленкам, выращенным с МУНТ в среде культивирования и в среде без нанотрубок. Бактериальные биопленки для данного эксперимента были выращены в присутствии планктонной культуры. Более интенсивное восстановление соли тетразолия, входящей в состав ХТТ, до оранжевого раствора формазана связано с увеличением количества дегидрогеназ, участвующих в переносе электронов от донора к соединению тетразолия, и поэтому может коррелировать с количеством жизнеспособных клеток. В присутствии МУНТ достоверно увеличивалась дыхательная активность клеток биопленок R. erythropolis 11-2 (рис. 4а) и R. ruber gt1 (рис. 4б). У культур A. faecalis 2, A. guillouiae 11h и R. erythropolis 11-2 отмечена корреляция между общим биопленкообразованием и относительным содержанием живых клеток, оцененным по изменению ОП480 раствора ХТТ, однако в отношении R. ruber gt1 получены противоположные данные (табл. 1). Определено, что R. ruber gt1, в отличие от R. erythropolis 11-2, в присутствии МУНТ формировал биопленку, массивность которой была достоверно меньше, чем на среде LB без добавок. Такое противоречие могло объясняться снижением продукции полимерного матрикса. Полимерный матрикс биопленок, синтезируемый в присутствии и отсутствии МУНТ, был окрашен конканавалин А-тетраметилродамином, и было показано, что полисахаридная основа внеклеточного матрикса R. ruber gt1 незначительно, но достоверно менее массивна при формировании биопленки в присутствии МУНТ (рис. 5). Можно предположить, что такая же тенденция будет прослеживаться и при формировании биопленки из предварительно адгезированных клеток, однако в последнем случае формируется значительно более массивная биопленка под воздействием МУНТ, чем в состоянии динамического равновесия с планктонными клетками.
Рис. 4.
Дыхательная активность 7-суточных биопленок R. erythropolis 11-2 (а) и R. ruber gt1 (б), выращенных на среде LB в присутствии МУНТ (1) и на среде LB без добавок (2).

Таблица 1.
Воздействие МУНТ на метаболическую активность клеток биопленок
| Штаммы | Коэффициент интенсивности воздействия МУНТ на дыхательную активность, I | Метаболическая активность биопленок/планктонных культур после воздействия МУНТ, % | |
|---|---|---|---|
| выращивание биопленок в присутствии МУНТ | воздействие МУНТ на выращенные биопленки | ||
| A. pulmonis ПНОС | 1.0 | 1.9 | 32/94 |
| A. guillouiae 11h | 1.9 | 1.7 | 107/136 |
| A. faecalis 2 | 1.5 | 1.3 | 88/95 |
| B. dolosa БОС | 1.3 | 1.2 | 81/124 |
| R. erythropolis 4-1 | 0.9 | 1.1 | 86/89 |
| R. erythropolis ИЛ БИО | 0.9 | 3.3* | 162/88 |
| R. erythropolis 11-2 | 1.8* | 1.9* | 99 /257 |
| R. ruber gt1 | 3.7* | 1.2 | 92/89 |
Рис. 5.
Массивность полимерного матрикса биопленок R. erythropolis ИЛ БИО и R. ruber gt1 при формировании биопленок на среде LB (1) и на среде LB с МУНТ (2).

В то же время, восстановление ХТТ было более интенсивным при добавлении МУНТ к выращенным на среде LB биопленкам всех изученных штаммов бактерий, и у R. erythropolis ИЛ БИО и R. erythropolis 11-2 эта разница была достоверна (рис. 6, табл. 1). Увеличение содержания формазана при восстановлении ХТТ под воздействием зрелых биопленок в присутствии МУНТ могло быть связано либо с более интенсивной работой дыхательной цепи вследствие адаптивного ответа клеток на присутствие наноматериалов, либо более активным переносом электронов с помощью дегидрогеназ, опосредованным электронопроводящими свойствами углеродных нанотрубок. Как следовало из результатов исследования абиотического контроля, МУНТ без клеток на реагент не воздействовали.
Рис. 6.
Дыхательная активность биопленок R. erythropolis 11-2 (а) и R. ruber gt1 (б), выращенных на среде LB, определенная по восстановлению ХТТ в 0.9% Na-Cl с МУНТ (1) и в 0.9% NaCl без добавок (2).

Общую интенсивность метаболизма клеток биопленок также оценивали по появлению флуоресценции при окраске PrestoBlueTM Cell Viability Reagent. Оценка уровня метаболической активности связана с трансформацией в живых клетках окислительно-восстановительного индикатора резазурина в флуоресцирующий резоруфин. Показано, что метаболизм биопленок и планктонных культур незначительно изменялся после часового воздействия МУНТ, а у ряда штаммов превышал таковой в контрольных условиях. Снижение флуоресценции отмечено только у биопленок A. pulmonis ПНОС (табл. 1). Дополнительно оценили влияние МУНТ в течение 1 ч на разрушение биопленок: было определено достоверное отличие от контроля только для биопленок R. erythropolis 4-1 и A. guillouiae 11h, причем биопленки R. erythropolis 4-1 разрушались активнее под действием МУНТ (массивность биопленки была снижена на 27%), а A. guillouiae 11h – в присутствии 0.9% NaCl без нанотрубок (массивность биопленки превышала контрольную почти в 2 раза). У остальных штаммов достоверной разницы в массивности биопленок после часовой инкубации с МУНТ в растворе 0.9% NaCl и контролем без МУНТ не наблюдали, следовательно, отличие уровня флуоресценции не было связано с разрушением биопленок.
Нарушение цитоплазматической мембраны клеток в биопленках оценивали с помощью окраски LIVE/DEAD® и подсчитывали количество живых и мертвых клеток, используя программу BioFilmAnalyzer. Было показано, что при выращивании в присутствии МУНТ формируются биопленки, содержащие даже бóльшие количества живых клеток, чем на среде LB без добавок (табл. 2). Данный факт мог быть связан с более активной адгезией и инициацией процесса биопленкообразования как грамотрицательных, так и грамположительных бактерий, и отсутствием повреждающего действия МУНТ на клетки.
Таблица 2.
Оценка жизнеспособности клеток биопленок при воздействии МУНТ
| Штаммы | Клетки с ненарушенной мембраной, % | |
|---|---|---|
| LB | LB + МУНТ | |
| B. dolosa БОС | 19.3 ± 4.3 | 89.7 ± 3.7 |
| A. faecalis 2 | 65.0 ± 4.4 | 90.0 ± 5.4 |
| R. erythropolis 4-1 | 77.1 ± 3.1 | 95.5 ± 4.1 |
| R. erythropolis ИЛ БИО | 93.3 ± 3.8 | 65.2 ± 5.9 |
| R. erythropolis 11-2 | 48.6 ± 10.6 | 83.6 ± 5.3 |
| R. ruber gt1 | 33.2 ± 6.5 | 55.5 ± 8.9 |
Определение энергетического статуса клеток в составе биопленок, сформированных в присутствии МУНТ. Изучили влияние МУНТ на содержание АТФ в клетках биопленок. Известно, что общее содержание АТФ в биопленке может говорить как о количестве жизнеспособных клеток, так и о стрессовом состоянии клетки, при котором количество АТФ может либо снижаться, либо возрастать при разобщении энергетического и конструктивного метаболизма. Показано, что у A. guillouiae 11h, A. faecalis 2 и R. ruber gt1 общее содержание АТФ при выращивании биопленок в присутствии МУНТ возрастает (рис. 7), что коррелирует с данными, полученными другими методами: у представителей грамотрицательных бактерий увеличивается как общее биопленкообразование в присутствии МУНТ, так и метаболическая активность за счет жизнеспособных клеток биопленки, а у R. ruber gt1 при меньшей биомассе биопленки, сформированной в присутствии МУНТ, содержание жизнеспособных клеток не снижается, а уменьшается только массивность полисахаридного матрикса.
Рис. 7.
Содержание АТФ в клетках биопленок A. guillouiae 11h (1), A. faecalis 2 (2), R. erythropolis ИЛ БИО (3), R. erythropolis 11-2 (4), R. ruber gt1 (5) при росте на среде LB (а) и на среде LB с МУНТ (б).

Таким образом, показано, что МУНТ не оказывает ингибирующего действия на биопленкообразование и метаболическую активность клеток представителей экологически и биотехнологически значимых групп бактерий: грамположительных родококков, имеющих большой потенциал для использования в технологиях очистки окружающей среды от нефтепродуктов и тяжелых металлов (Ившина и соавт., 2013), и грамотрицательных бактерий водной среды, которые являются типичными представителями сообщества активного ила. Снижение биомассы биопленок, формируемых в присутствии МУНТ в условиях динамического равновесия с планктонной культурой, было связано в большей степени с выработкой полисахаридного матрикса, а не с нарушением жизнеспособности клеток. Предварительно адгезированные клетки изученных культур формировали достоверно более массивные биопленки в присутствии МУНТ.
Диаметр МУНТ превышает диаметр ОУНТ, в результате чего цитотоксическое действие немодифицированных МУНТ отмечается реже (Zardini et al., 2012) и, как было показано в данной работе, практически не проявляется в отношении бактериальных клеток, находящихся в составе биопленок. Однако следует отметить, что в окружающей среде МУНТ могут подвергаться различным модификациям под воздействием ультрафиолетового облучения и гуминовых кислот почвы, что может внести коррективы во взаимоотношения МУНТ c бактериальными биопленками (Sartori et al., 2021). В данной работе отмечено изменение интенсивности дыхательной активности бактериальных клеток в двух различных вариантах экспериментов: при выращивании биопленок в присутствии МУНТ и при воздействии МУНТ на предварительно выращенные зрелые биопленки. Повышение дыхательной активности биопленки, выращенной в присутствии МУНТ, свидетельствует, главным образом, о большем количестве жизнеспособных клеток, а более интенсивное восстановление соли тетразолия до формазана под воздействием МУНТ у клеток выращенных биопленок связано с более активным переносом электронов с помощью дегидрогеназ, опосредованным воздействием МУНТ на мембрану, либо является следствием общего адаптивного ответа клетки. Полной эрадикации биопленок в присутствии МУНТ не наблюдали, при этом более интенсивному разрушению были подвержены биопленки подвижных грамотрицательных бактерий, а не грамположительных родококков.
Список литературы
Демаков В.А., Васильев Д.М., Максимова Ю.Г., Павлова Ю.А., Овечкина Г.В., Максимов А.Ю. Бактерии активного ила биологических очистных сооружений, трансформирующие цианопиридины и амиды пиридинкарбоновых кислот // Микробиология. 2015. Т. 84. С. 369–378.
Demakov V.A., Vasil’ev D.M., Pavlova Y.A., Ovechkina G.V., Maksimov A.Y., Maksimova Y.G. Activated sludge bacteria transforming cyanopyridines and amides of pyridinecarboxylic acids // Microbiology (Moscow). 2015. V. 84. P. 433–441.
Зарубина А.П., Лукашев Е.П., Деев Л.И., Пархоменко И.М., Рубин А.Б. Биотестирование биологических эффектов одностенных углеродных нанотрубок с использованием тест-системы люминесцентных бактерий // Российские нанотехнологии. 2009. Т. 4. № 11–12. С. 152–155.
Zarubina A.P., Lukashev E.P., Deev L.I., Parkhomenko I.M., Rubin A.B. Biotesting the biological effects of single-wall carbon nanotubes using bioluminescent bacteria test-system // Nanotechnologies in Russia. 2009. V. 4. № 11–12. P. 871–875.
Зорина А.С., Максимова Ю.Г., Демаков В.А. Биопленкообразование моно- и смешанных культур штаммов Alcaligenes faecalis 2 и Rhodococcus ruber gt 1 // Микробиология. 2019. Т. 88. С. 175–183.
Zorina A.S., Maksimova Y.G., Demakov V.A. Biofilm formation by monocultures and mixed cultures of Alcaligenes faecalis 2 and Rhodococcus ruber gt 1 // Microbiology (Moscow). 2019. V. 88. P. 164–171.
Ившина И.Б., Куюкина М.С., Костина Л.В. Aдаптационные механизмы неспецифической устойчивости алканотрофных актинобактерий к ионам тяжелых металлов // Экология. 2013. С. 115–123.
Ivshina I.B., Kuyukina M.S., Kostina L.V. Adaptive mechanisms of nonspecific resistance to heavy metal ions in alkanotrophic actinobacteria // Russ. J. Ecol. 2013. V. 44. P. 123‒130.
Максимов А.Ю., Кузнецова М.В., Овечкина Г.В., Козлов С.В., Максимова Ю.Г., Демаков В.А. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt1 // Прикл. биохимия и микробиология. 2003. Т. 39. С. 63–68.
Maksimov A.Yu., Kuznetsova M.V., Ovechkina G.V., Kozlov S.V., Maksimova Yu.G., Demakov V.A. Effects of nitriles and amides on the growth and nitrile hydratase activity of the Rhodococcus sp. strain gt1 // Appl. Biochem. Microbiol. 2003. V. 39. P. 55–59.
Максимова Ю.Г., Никулин С.М., Осовецкий Б.М., Демаков В.А. Гетерогенный биокатализатор на основе клеток нитрилгидролизующих бактерий и многослойных углеродных нанотрубок для трансформации нитрилов и амидов // Прикл. биохимия и микробиология. 2017. Т. 53. С. 462–469.
Maksimova Y.G., Demakov V.A., Osovetskii B.M., Nikulin S.M. Heterogeneous biocatalyst for nitrile and amide transformation based on cells of nitrile-hydrolyzing bacteria and multiwalled carbon nanotubes // Appl. Biochem. Microbiol. 2017. V. 53. P. 506–512.
Максимова Ю.Г., Сергеева А.А., Овечкина Г.В., Максимов А.Ю. Деградация пиридина суспензиями и биопленками штаммов Achromobacter pulmonis ПНОС и Burkholderia dolosa БОС, выделенных из активного ила очистных сооружений // Биотехнология. 2020. Т. 36. № 2. С. 86–98.
Maksimova Yu.G., Sergeeva A.A., Ovechkina G.V., Maksimov A.Yu. Pyridine degradation by suspensions and biofilms of Achromobacter pulmonis PNOS and Burkholderia dolosa BOS strains isolated from activated sludge of sewage treatment plants // Biotechnology (Biotekhnologiya). 2020. V. 36. № 2. P. 86–98.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multi-species biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 731–750.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. С. 484–489.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Управление формированием микробных биопленок: анти- и пробиопленочные агенты // Микробиология. 2017. Т. 86. С. 402–420. Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. Controlling of microbial biofilms formation: anti- and probiofilm agents // Microbiology (Moscow). 2017. V. 86. P. 423‒438.
Aqel A., El-Nour K.M.M.A., Ammar R.A.A., Al-Warthan A. Carbon nanotubes, science and technology part (I) structure, synthesis and characterisation // Arabian J. Chem. 2012. V. 5. P. 1–23.
Bogachev M., Volkov V., Markelov O., Trizna E., Baydamshina D., Melnikov V., Zelenikhin P., Murtazina R., Sharafutdinov I., Kayumov A. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images // PLoS One. 2018. V. 13. e0193267.
Das R., Hamid S.B.A., Ali M.E., Ismail A.F., Annuar M.S.M., Ramakrishna S. Multifunctional carbon nanotubes in water treatment: The present, past and future // Desalination. 2014. V. 354. P. 160–179.
Dong X., McCoy E., Zhang M., Yang L. Inhibitory effects of nisin-coated multi-walled carbon nanotube sheet on biofilm formation from Bacillus anthracis spores // J. Environ. Sci. 2014. V. 26. P. 2526–2534.
Gannesen A.V., Lesouhaitier O., Racine P.-J., Barreau M., Netrusov A.I., Plakunov V.K., Feuilloley M.G.J. Regulation of monospecies and mixed biofilms formation of skin Staphylococcus aureus and Cutibacterium acnes by human natriuretic peptides // Front. Microbiol. 2018. V. 9. Art. 2912.
Ghasemi M., Daud W.R.W., Hassan S.H.A., Ohc S.-E., Ismail M., Rahimnejad M., Jahim J.M. Nano-structured carbon as electrode material in microbial fuel cells: A comprehensive review // J. Alloys Compd. 2013. V. 580. P. 245–255.
Goodwin D.G., Jr., Marsh K.M., Sosa I.B., Payne J.B., Gorham J.M., Bouwer E.J., Fairbrother D.H. Interactions of microorganisms with polymer nanocomposite surfaces containing oxidized carbon nanotubes // Environ. Sci. Technol. 2015. V. 49. P. 5484–5492.
Goodwin D.G., Jr., Xia Z., Gordon T.B., Gao C., Bouwerb E.J., Fairbrother D.H. Biofilm development on carbon nanotube/polymer nanocomposites // Environ. Sci.: Nano. 2016. V. 3. P. 545–558.
Hirschfeld J., Akinoglu E.M., Wirtz D.C., Hoerauf A., Bekeredjian-Ding I., Jepsen S., Haddouti E.-M., Limmer A., Giersig M. Long-term release of antibiotics by carbon nanotube-coated titanium alloy surfaces diminish biofilm formation by Staphylococcus epidermidis // Nanomedicine: Nanotechnology, Biology and Medicine. 2017. V. 13(4). P. 1587–1593.
Ihsanullah. Carbon nanotube membranes for water purification: Developments, challenges, and prospects for the future // Separat. Purificat. Technol. 2019. V. 209. P. 307–337.
Jiang Z., Zhang D., Zhou L., Deng D., Duan M., Liu Y. Enhanced catalytic capability of electroactive biofilm modified with different kinds of carbon nanotubes // Anal. Chim. Acta. 2018. V. 1035. P. 51–59.
Kang S., Pinault M., Pfefferle L.D., Elimelech M. Single-walled carbon nanotubes exhibit strong antimicrobial activity // Langmuir. 2007. V. 23. P. 8670–8673.
Kang S., Herzberg M., Rodrigues D.F., Elimelech M. Antibacterial effects of carbon nanotubes: size does matter! // Langmuir. 2008. V. 24. P. 6409–6413.
Levi-Polyachenko N., Young C., MacNeill C., Braden A., Argenta L., Reid S. Eradicating group A streptococcus bacteria and biofilms using functionalised multi-wall carbon nanotubes // Int. J. Hyperthermia. 2014. V. 30. P. 490–501.
Madenli E.C., Yanar N., Choi H. Enhanced antibacterial properties and suppressed biofilm growth on multi-walled carbon nanotube (MWCNT) blended polyethersulfone (PES) membranes // J. Environ. Chem. Engin. 2020. V. 9. Art. 104755.
Malek I., Schaber C.F., Heinlein T., Schneider J.J., Gorb S.N., Schmitz R.A. Vertically aligned multi walled carbon nanotubes prevent biofilm formation of medically relevant bacteria // J. Mater. Chem. B. 2016. V. 4. P. 5228–5235.
Özdemir S., Oduncu M.K., Kilinc E., Soylak M. Tolerance and bioaccumulation of U(VI) by Bacillus mojavensis and its solid phase preconcentration by Bacillus mojavensis immobilized multiwalled carbon nanotube // J. Environ. Manage. 2017. V. 187. P. 490‒496.
Qu Y., Wang J., Zhou H., Ma Q., Zhang Z., Li D., Shen W., Zhou J. Concentration-dependent effects of carbon nanotubes on growth and biphenyl degradation of Dyella ginsengisoli LA-4 // Environ. Sci. Pollut. Res. 2016. V. 23. P. 2864–2872.
Sartori D.R., Bertuola M., Miñan A., Gonik E., Gonzalez M.C., de Melé M.F.L. Environmentally induced changes of commercial carbon nanotubes in aqueous suspensions. Adaptive behavior of bacteria in biofilms // ACS Omega. 2021. V. 6. P. 5197–5208.
Sun Y., Zhang Z. New anti-biofouling carbon nanotubes-filled polydimethylsiloxane composites against colonization by pioneer eukaryotic microbes // Int. Biodeterior. Biodegrad. 2016. V. 110. P. 147–154.
Tolmaciu C.-M., Morris M.C. Carbon nanotube biosensors // Front. Chem. 2015. V. 3. A. 59.
Upadhyayula V.K.K., Gadhamshetty V. Appreciating the role of carbon nanotube composites in preventing biofouling and promoting biofilms on material surfaces in environmental engineering: a review // Biotechnol. Adv. 2010. V. 28. P. 802–816.
Yan H., Pan G., Zou H., Li X., Chen H. Effective removal of microcystins using carbon nanotubes embedded with bacteria // Chin. Sci. Bull. 2004. V. 49. P. 1694–1698.
Zardini H.Z., Amiri A., Shanbedi M., Maghrebi M., Baniadam M. Enhanced antibacterial activity of amino acids-functionalized multi walled carbon nanotubes by a simple method // Colloids Surf. B. 2012. V. 92. P. 196–202.
Zhang P., Liu J., Qu Y., Zhang J., Zhong Y., Feng Y. Enhanced performance of microbial fuel cell with a bacteria/multi-walled carbon nanotube hybrid biofilm // J. Power Sourc. 2017. V. 361. P. 318–325.
Zhang Y., Chen X., Yuan Y., Lu X., Yang Z., Wang Y., Sun J. Long-term effect of carbon nanotubes on electrochemical properties and microbial community of electrochemically active biofilms in microbial fuel cells // Int. J. Hydrogen Energy. 2018. V. 43. P. 16240–16247.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


