Микробиология, 2022, T. 91, № 4, стр. 492-506
Микробное сообщество морского меромиктического желоба (Бухта Биофильтров), расположенного в Кандалакшском заливе Белого моря
А. С. Саввичев a, *, А. А. Кулакова a, Е. Д. Краснова b, Д. А. Воронов c, В. В. Кадников d, А. В. Белецкий d, В. В. Козяева d, И. И. Русанов a, М. А. Летарова a, Е. Ф. Веслополова a, В. В. Беленкова a, Н. А. Демиденко e, В. М. Горленко a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
117312 Москва, Россия
b Беломорская биологическая станция им. Н.А. Перцова
биологического факультета МГУ им. М.В. Ломоносова
Москва, Россия
c Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Россия
d Институт биоинженерии им. К.Г. Скрябина, ФИЦ Биотехнологии РАН
117312 Москва, Россия
e Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
* E-mail: savvichev@mail.ru
Поступила в редакцию 17.02.2022
После доработки 14.03.2022
Принята к публикации 17.03.2022
- EDN: RYNSHU
- DOI: 10.31857/S002636562210010X
Аннотация
В сентябре 2020 г. и в марте 2021 г. были проведены исследования состава микробного сообщества и активности микробных процессов водной толщи меромиктического желоба, расположенного в Бухте Биофильтров (Кандалакшский залив Белого моря). Показано, что зона хемоклина в воде простиралась от 8 до 9 м. В монимолимнионе желоба присутствовал сероводород, концентрация которого у дна достигала 25‒38 мг л–1. Условия редокс-зоны были благоприятны для развития как анаэробных аноксигенных фототрофов, так и аэробных сероокисляющих хемоавтотрофов. В этой зоне формируется бактериальная пластина, окрашенная в розовато-коричневый цвет. По результатам секвенирования фрагмента гена 16S рРНК установлено, что в марте в подледный период в хемоклине доминируют зеленые серобактерии (ЗСБ) Chlorobium phaeovibrioides. Вторыми по численности были аэробные сероокисляющие бактерии Sulfurimonas sp. Из проб, отобранных в хемоклине, на селективных средах вырастали в основном коричнево-окрашенные колонии Chlorobi и лишь единичные колонии ЗСБ зеленого цвета. Оба морфотипа идентифицированы как Chlorobium phaeovibrioides. В период наших исследований пурпурные серобактерии (ПСБ) не формировали бактериальную пластину в редокс зоне, но выявлялись единичные колонии ПСБ. Изолированная культура ПСБ идентифицирована как Thiocapsa rosea. Бактерии этого вида способны переключаться с фотосинтеза на аэробный хемосинтез и могут конкурировать за сульфид с сероокисляющими хемоавтотрофами. Нами выдвинуто предположение, что меромиктический желоб Бухты Биофильтров, в результате своей открытости, может быть одним из источников расселения АФБ в акватории Кандалакшского залива.
Меромиктические водоемы отличаются устойчивой стратификацией водной толщи и наличием содержащего кислород аэробного и сероводородного анаэробного слоев, разделенных редокс-зоной. В этой зоне формируются микробные сообщества, часто достигающие высокой плотности. Меромиктические водоемы, как реликтовые экосистемы, на протяжении многих лет привлекают внимание микробиологов (Gorlenko, Kuznezov, 1972; Gorlenko, 1978; Jørgensen et al., 1979; Gorlenko et al., 1983; Overmann, 1997; Garcia-Gil et al., 1999; Camacho et al., 2001; Savvichev et al., 2021).
Наиболее плотное планктонное микробное сообщество, наблюдаемое в толще меромиктических водоемов, получило название бактериальной пластины (Guerrero et al., 1985; Klepac-Ceraj et al., 2012). Установлено, что если до верхней границы распространения сероводорода достигает свет, то в бактериальной пластине преобладают аноксигенные фототрофные бактерии (АФБ) (Van Gemerdon, Mas 1995; Overmann, 1997, 1998; Tonolla et al., 2003; Rogozin et al., 2009; Gulati et al., 2017). Доминирование весьма ограниченного числа видов АФБ в микробном сообществе бактериальной пластины меромиктических водоемов, расположенных в самых разных точках земного шара, является интересным биогеографическим фактом. При этом минорная составляющая микробного сообщества хемоклина, как и нижележащего монимолимниона, отличалась значительным таксономическим разнообразием (Pjevac et al., 2015).
Среди меромиктических водоемов особое место занимают водоемы, расположенные на морском побережье и имеющие в разной степени выраженную связь с основным бассейном (marine-derived lakes) (Gorlenko et al., 1978; Boehrer, Schultze, 2008; Краснова и соавт., 2012; Krasnova et al., 2015; Gulati et al., 2018; Краснова, 2021). Солевой состав монимолимниона таких водоемов генетически связан с солевым составом морской воды, содержащей значительное количество сульфат-иона. Сульфат-ион является акцептором электронов для сульфатредуцирующих бактерий, образующих сульфид, поддерживающий анаэробные условия в монимолимнионе. На плотность и состав микробного сообщества бактериальной пластины, а также интенсивность микробных процессов циклов углерода и серы влияют мощность эпи- и монимолимниона, глубина залегания миксолимниона и редокс зоны, а также насыщенность сероводородного слоя.
Удобным объектом исследования микробных сообществ являются прибрежные меромиктические водоемы Кандалакшского залива Белого моря (Лунина и соавт., 2016; Savvichev et al., 2018, 2021). Беломорские меромиктические водоемы объединяет общность происхождения (Krasnova et al., 2015). Это бывшие морские заливы и лагуны, отделившиеся и в разной степени изолированные от основного бассейна вследствие поднятия берегов и дна со средней скоростью 0.5 см в год (Romanenko, Shilova, 2012). Поскольку Беломорские меромиктические водоемы находятся на широте полярного круга, все биогеохимические процессы, протекающие в их водной толще, подчинены строгой сезонной изменчивости. Ледовый и снежный покровы в зимний сезон отражают и поглощают более 95% солнечного света. Снежные талые воды опресняют эпилимнион, тем самым поддерживая плотностную стратификацию водной толщи.
Микробиологами исследовано семь стратифицированных водоемов, связанных с Кандалакшским заливом (Кисло-Сладкое, Трехцветное, Лагуна на Зеленом мысе, Большие Хрусломены, Еловое, Верхнее и Нижнее Ершовые) (Krasnova et al., 2015). Показано, что в этих озерах в хемоклине доминирующими микроорганизмами являются зелено- или коричнево-окрашенные морфотипы вида Chlorobium phaeovibrioides (Chlorobiaceae) в зависимости от глубины расположения бактериальной пластины. В некоторых озерах в минорных количествах присутствовали коричнево-окрашенные Prosthecochloris aestuarii (ранее Prosthecochloris phaeoasteroidea), а также пурпурные бактерии рода Thiocapsa (Лунина и соавт., 2016; Grouzdev et al., 2019).
В 2013 году в дополнение к уже известным меромиктическим водоемам Кандалакшского залива был обнаружен стратифицированный водоем нового типа – подводный меромиктический желоб в Бухте Биофильтров (66°32′20′′ N, 33°10′10′′ E). Этот меромиктический желоб дополняет ряд водоемов, в разной степени изолированных от Белого моря. Он представляет собой самую раннюю стадию изоляции, при которой меромиктический водоем занимает только локальное понижение донного рельефа.
Целью настоящего исследования было измерение гидрохимических показателей в водной толще глубоководного желоба Бухты Биофильтров в осенне-зимний период 2019–2020 гг., а также определение активности микробных процессов и состава бактериального сообщества зоны хемоклина. В задачи также входило оценить возможную роль открытого меромиктического водоема, которым является желоб Бухты Биофильтров, как источника распространения бактериальной инфекции на другие участки акватории Кандалакшского залива, пригодные для развития АФБ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
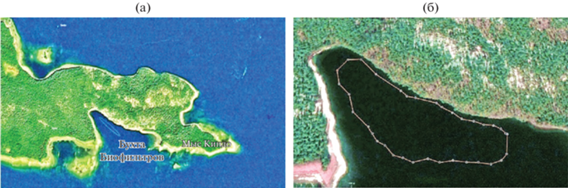
Характеристика объекта исследования. В Бухте Биофильтров обнаружен удлиненный узкий желоб глубиной 14–15 м (рис. 1а, 1б). Желоб окружен мелким широким плато до 4–5 м глубиной. Подводный желоб Бухты Биофильтров не изолирован от моря, что отличает его от ранее известных меромиктических водоемов, расположенных на побережье Кандалакшского залива.
Рис. 1.
Спутниковый снимок (отмечено место нахождения меромиктического желоба) (а) и батиметрический план с изобатой 8 м, полученный путем эхолотирования (б).
Отбор проб из водной толщи желоба Бухты Биофильтров проводили в сентябре 2019 г., сентябре 2020 г. и в марте 2021 г. в точке с наибольшей глубиной – 14.5 м. Пробы отбирали в сентябре с борта лодки, в марте – через пробуренную во льду лунку. Степень освещенности на разных горизонтах водной толщи измеряли с помощью AR813A Luxmeter (“Smart Sensor”, Китай), модифицированного для подводных исследований. Температуру и содержание растворенного кислорода измеряли с помощью портативного электротермометра и оксиметра WTW© 340iA HANNA HI8314F (“HANNA Instruments”, Германия). Общую соленость определяли с помощью кондуктометра HANNA HI8733 (“HANNA Instruments”, Германия). Пробы воды отбирали с помощью силиконовой трубки, закрепленной на калиброванном тросе, и портативного насоса (Whale Premium Submersible Pump GP1352, (“Whale” Ирландия). Содержание метана в пробах определяли по методике фазово-равновесной дегазации (McAuliffe, 1971). Концентрацию метана в газовой “head-space” фазе измеряли на газовом хроматографе Kristall-2000 M (“Хроматэк”, Россия), снабженном пламенно-ионизационным детектором. В статье использовали данные содержания сероводорода, полученные в Бухте Биофильтров при проведении совместных исследований (Лосюк и соавт., 2021).
Для учета общей численности микроорганизмов (ОЧМ) пробы воды фиксировали раствором глутаральдегида, конечная концентрация которого в пробе составляла 2% (вес/об.). 1–5 мл фиксированной пробы жидкости фильтровали через черные поликарбонатные фильтры (“Millipore”, США) с диаметром пор 0.2 мкм. Фильтры окрашивали раствором акридинового оранжевого. Препараты просматривали с помощью эпифлуоресцентного микроскопа Olympus BX 41 (“Olympus”, Япония) с системой визуализации Image Scope Color (M) при увеличении ×1000. Учет клеток проводили с экрана монитора в 20 полях зрения.
Для определения активности микробных процессов пробы воды отбирали в 30 мл стеклянные флаконы и закрывали без пузырька воздуха резиновой газонепроницаемой пробкой и обжимали алюминиевой крышкой. Интенсивности микробных процессов: световой и темновой ассимиляции углекислоты (САУ и ТАУ), сульфатредукции (СР) и окисления метана (МО) определяли радиоизотопными методами с использованием меченых соединений – NaH14CO3, Na235SO4 и 14СН4 соответственно (Pimenov, Bonch-Osmolovskaya, 2006; Savvichev et al., 2021). Радиоактивности (14С и 35S) продуктов микробных процессов измеряли на жидкостном сцинтилляционном счетчике “PackardTRI-CarbTR” (США). Для расчетов интенсивности микробных процессов ТАУ, МО и СР использовали среднюю величину, полученную из двух повторностей для каждого образца.
Для выделения и культивирования АФБ использовали среду следующего состава (г/л): NH4Cl – 0.7; KH2PO4 – 0.7; MgSO4 · 7Н2О – 0.5; NaCl – 20.0; KCl – 0.33; NaHCO3 – 1.5; CaCl2 – 0.1, ацетат Na – 0.5; Na2S · 9H2O – 0.5: Na2S2O3 · 5H2О – 1.0, раствор микроэлементов и витаминов по Пфеннигу – 1 мл/л; витамин В12 – 0.02. Na2S · 9H2O (10%), NaHCO3 и ацетат Na (10%) готовили и стерилизовали отдельно и вносили в основную среду непосредственно перед посевом. В готовой среде рН составлял 7.0 для ЗСБ и 7.5 – для ПСБ. Засеянные среды инкубировали при температуре 28°С при освещении 2000 лк. Очистку культур АФБ проводили методом разведений на агаризованной (0.5%) среде (Лунина и соавт., 2019). Эксперименты по определению оптимальной для роста АФБ температуры, концентрации NaCl и значений pH проводили путем измерения оптической плотности выросшей суспензии клеток при 726 нм на фотометре КФК-3 (Россия).
Микроскопирование. Морфологию бактерий изучали в световом микроскопе Olympus BX 41 (“Olympus”, Япония) с объективом ×100 с фазовым контрастом. Для получения негативно окрашенных препаратов целых клеток суспензию бактерий наносили на поверхность медной сеточки, покрытую формваровой подложкой и негативно окрашивали 0.2% раствором уранилацетата в воде. Препараты просматривали под электронным микроскопом JEM-100B (“Jeol”, Япония) при ускоряющем напряжении 80 или 90 кВ.
Состав пигментов определяли по спектрам поглощения на спектрофотометре Cary – 100 (“Varian”, Австралия) в диапазоне длин волн 350–950 нм. Суспензию клеток готовили в 50% глицерине. Кроме того, исследовали спектральные характеристики экстрактов пигментов клеток в ацетоне.
Выделение метагеномной ДНК, ПЦР-амплификация и высокопроизводительное секвенирование фрагментов генов 16S рРНК. Свежеотобранные пробы воды объемом 200 мл пропускали через фильтры с диаметром пор 0.22 мкм. Фильтр гомогенизировали, растирая с жидким азотом, препарат метагеномной ДНК выделяли с помощью Power Soil DNA Isolation Kit (“MO BIO Laboratories Inc.”, США). Состав сообщества прокариот определяли на основании анализа последовательностей вариабельного V3–V4 региона гена 16S рРНК, амплифицированного с помощью ПЦР с использованием праймеров PRK341F (5'‑CCTACGGGRBGCASCAG-3') и PRK806R (5'-GGACTACYVGGGTATCTAAT-3'). ПЦР фрагменты были баркодированы с помощью Nextera XT Index Kit v.2 (“Illumina”, США) и очищены с использованием Agencourt AMPure beads (“Beckman Coulter, Brea”, США). Концентрация полученных ПЦР продуктов была определена с помощью Qubit dsDNA HS Assay Kit (“Invitrogen”, США). Затем ПЦР фрагменты были смешаны в эквимолярных количествах и секвенированы на Illumina MiSeq (2 × 300 нт с обоих концов). Парноконцевые чтения были объединены с использованием FLASH v.1.2.11. Полученные последовательности были кластеризованы в операционные таксономические единицы (ОТЕ) при 97% идентичности с помощью программы Usearch (Edgar, 2010); низкокачественные чтения, химерные и единичные последовательности были удалены при кластеризации.
Таксономическая идентификация ОТЕ была выполнена по базе SILVA v.138 с использованием алгоритма VSEARCH (Rognes et al., 2016). Полученные последовательности были депонированы в базе данных NCBI Sequence Read Archive (SRA) под номером SRX14459950 в рамках проекта PRJNA697856.
Филогенетический анализ. Выделение ДНК из накопительных и чистых культур проводили с помощью набора DNeasy UltraClean Microbial Kit (“Qiagen”, Нидерланды). Для идентификации накопительных культур ЗСБ применяли праймерную группоспецифичную систему F-99-GSB–R-1369 для гена 16S рРНК (Alexander et al., 2002). Для идентификации накопительной культуры пурпурных бактерий использовали универсальные эубактериальные праймеры 27F и 1492R. Секвенирование проводили с использованием автоматического генетического анализатора DNA An-alyzer 3730 (“Applied Biosystems”, США) и набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit (“Applied Biosystems”, США), согласно инструкции производителя. Уровень сходства последовательностей гена 16S рРНК исследуемых культур с генами наиболее близких типовых штаммов рассчитывали при помощи онлайн-сервиса EzBioCloud (Yoon et al., 2017). Выравнивание последовательностей проводили с помощью программы BioEdit. Филогенетические деревья строили в программе Mega7 с использованием алгоритма maximum-likelyhood и bootstrap анализа 1000 альтернативных деревьев (Kumar et al., 2016).
РЕЗУЛЬТАТЫ
Физико-химические условия и гидрологическая характеристика подводного меромиктического желоба Бухты Биофильтров (ББФ). Температура и соленость водной толщи были весьма стабильны и сезонно изменялись в верхнем перемешиваемом слое. Во время проведения исследований в марте 2021 г. температура подледного слоя была отрицательной (‒1.3°С), постепенно увеличивалась с глубиной и переходила в положительную на глубине 9.0 м. Ниже она продолжала повышаться и возле дна достигала 1.8°С (рис. 2а). В сентябре температура поверхностного слоя до глубины 4 м составляла 10.2–10.4°С. Этот слой – миксолимнион подвержен ветровому и приливному перемешиванию. Начиная с 5.0 м, температура воды понижалась и возле дна на глубине 14.0 м соответствовала зимним значениям. Соленость в поверхностном слое сезонно варьировала от 23.7 до 25.6‰, но, начиная с глубины 7.5 м, оставалась сезонно стабильной (26.7‰). Четкий галоклин прослеживался только в сентябре (с 6.0 до 7.0 м). В этот период термоклин простирался с 4.0 до 10.0 м (рис. 2а).
Рис. 2.
Температура (t, °C) и соленость (S, ‰) (а); содержание кислорода и сероводорода (мг л–1) (б); окислительно-восстановительные условия (Eh, мВ) и проникновение света (освещенность, лк, логарифмическая шкала) (в) в водной толще желоба Бухты Биофильтров в сентябре 2020 г. и марте 2021 г. (цветом отмечено расположение бактериальной пластины).

Верхний перемешиваемый водный слой по содержанию растворенного кислорода не отличался от соответствующего слоя окружающих вод морского залива. В сентябре до глубины 4.0 м концентрация растворенного кислорода была близка к насыщению, ниже его концентрация уменьшалась. До глубины 6.5 м концентрация превышала 2 мг л–1 – порог аэробных условий. Начиная с глубины 7.0 м, наблюдалось резкое снижение его концентрации вплоть до аналитического нуля на глубине 8.5 м (рис. 2б). Зимой содержание кислорода было выше, он обнаруживался вплоть до глубины 8.5 м. Непосредственно под кислородсодержащим слоем начинался слой, содержащий сероводород. Концентрация сероводорода возрастала с глубиной и составляла в хемоклине 4–6 мг л–1, а в монимолимнионе достигала значений 25–38 мг л–1 (рис. 2б). Таким образом, в зоне металимниона на глубине от 7.5 до 8.0 м в сентябре и от 8.0 до 9.0 м в марте наблюдалось совместное присутствие кислорода и сероводорода, что является благоприятным условием для развития как аэробных, так и анаэробных микроорганизмов.
При сентябрьской съемке освещенность в поверхностном водном горизонте составляла 18 000 лк (рис. 2в). До глубины 8.5 м освещенность равномерно падала в 1.6–2.0 раза в расчете на 1 м и достигала 70 лк на верхней границе хемоклина. Глубже 8.5 м освещенность резко падала в 5–7 раз в расчете на 1 м и достигала аналитического нуля на глубине 10 м. В марте в расчищенной ледовой лунке на поверхности воды величина освещенности составляла 9500 лк, однако уже на глубине 1 м подо льдом составляла 980 лк. Глубже освещенность падала и достигала аналитического нуля на глубине 8.5 м. Величина Eh четко соответствовала распределению кислорода и сероводорода (рис. 2в).
Стабильность меромиктических условий в желобе ББФ подтверждена многолетними наблюдениями, выполненными в различные сезоны, начиная с 2013 г. (Krasnova, 2021). Стратификация водной толщи в желобе бухты поддерживается на глубине около 10 м за счет повышенной плотности водных масс монимолимниона, связанной со стоком рассолов, опускающихся в придонный водный слой во время образования морского льда, а также пониженной плотности поверхностного водного слоя, пополняемого пресными водами талого льда и снега. В летне-осенний период определенную роль в поддержании стратификации играет формирующийся сезонный температурный градиент. Вместе с тем водоем остается открытой системой, способной к обмену с водой залива.
Общая численность (ОЧМ) и биомасса микроорганизмов. Микроскопирование окрашенных препаратов на мембранных фильтрах с разных водных горизонтов показало, что в водном слое над желобом величина ОЧМ соответствовала значениям, обычным для поверхностных вод Кандалакшского залива (340–440 тыс. кл. мл–1, рис. 3). В слое металимниона (хемоклина), в сентябре и марте, величина ОЧМ достигала высоких значений – до 1.8–2.1 млн кл. мл–1. В этом слое происходит формирование бактериальной пластины, характерной для меромиктических водоемов. Под хемоклином величина ОЧМ была также высокой (2.0–2.3 млн кл. мл–1). Средние значения объема клеток бактерий в аэробной водной толще варьировали от 0.08 до 0.11 мкм3, в слое хемоклина составляли 0.16–0.16 мкм3, в анаэробной зоне монимолимниона достигали 0.18 мкм3.
Рис. 3.
Общая численность микроорганизмов (ОЧМ, кл. × 103 мл–1) на различных горизонтах водной толщи желоба Бухты Биофильтров в марте и сентябре 2020 г. (цветом отмечено расположение бактериальной пластины).

Продукция оксигенного и аноксигенного фотосинтеза в водной толще. Для обычных меромиктических водоемов характерно два типа фотосинтеза: оксигенный, осуществляемый эукариотическими водорослями и цианобактериями в поверхностном водном слое, и аноксигенный, осуществляемый аноксигенными фототрофными бактериями (АФБ) в зоне отсутствия кислорода. Световая ассимиляции углерода (САУ), является показателем продукции фотосинтеза. В сентябре в кислородсодержащем слое была зарегистрирована активность оксигенного фотосинтеза, начиная от поверхности и до 8.0 м включительно (рис. 4а). Максимальная интенсивность процесса оксигенного фотосинтеза, выраженная в продукции органического вещества, составляла 3.2 мкмоль С л–1 сут–1. На нижней границе аэробной зоны интенсивность оксигенного фотосинтеза снижалась до 1.0 мкмоль С л–1 сут–1 и, видимо, была обусловлена активностью мелких коковидных цианобактерий, морфологически сходных с цианобактериями рода Synechocystis. В сентябре 2020 г. отчетливо выраженный пик аноксигенного фотосинтеза проявлялся в верхней части сероводородсодержащего слоя, на глубине 9.25 м (19.2 мкмоль С л–1 сут–1, рис. 4а). Глубже интенсивность фотосинтеза резко падала до аналитического нуля на глубине 10.0 м. Во время подледной съемки активность оксигенного фотосинтеза была ниже по сравнению с осенним сезоном и регистрировалась в узком подледном горизонте (до 1.5 мкмоль С л–1 сут–1). Достоверных значений активности аноксигенного фотосинтеза при подледной съемке (9.0, 9.5 и 10.0 м) получено не было. Темновая ассимиляция углекислоты (ТАУ) является суммарным показателем, включающим как интенсивность гетеротрофного карбоксилирования, так и автотрофного потребления углекислоты при хемосинтезе. В сентябре в перемешиваемом водном слое величина ТАУ была низкой и составляла 0.6–0.9 мкмоль С л–1 сут–1. В слое хемоклина величина ТАУ резко возрастала до максимального значения на глубине 9.25 м (12.3 мкмоль С л–1 сут–1). Глубже величина ТАУ снижалась до значений 4.0–6.2 мкмоль С л–1 сут–1 (рис. 4а). В марте невысокая активность ТАУ была зафиксирована непосредственно в подледном слое (1.5 мкмоль С л–1 сут–1), а также в придонном слое, начиная с глубины 9.5 м и до дна (до 3.0 мкмоль С л–1 сут–1).
Рис. 4.
Световая ассимиляция углерода (САУ) и темновая ассимиляция углерода (ТАУ) (а); содержание метана (СН4, нмоль л–1), интенсивность процессов сульфатредукции (СР, нмоль л–1) и метанокисления (МО, нмоль л–1) (б) в водной толще желоба Бухты Биофильтров в сентябре 2020 г.

Процесс бактериальной сульфатредукции (СР). Проведенные радиоизотопные эксперименты показали, что в сентябре процесс сульфатредукции начинается с горизонта 9.25 м, что соответствует верхней границе редокс-зоны (рис. 4б). Интенсивность СР была максимальна на горизонте 9.5 м (109 нмоль S л–1 сут–1). Ниже 9.5 м интенсивность СР снижалась до 72 нмоль S л–1 сут–1 на горизонте 10.0 м и до 63 нмоль S л–1 сут–1 в придонном водном слое. Подледная съемка показала, что процесс сульфатредукции регистрируется во всей толще монимолимниона (60–80 нмоль S л–1 сут–1).
Содержание растворенного метана [CH4], интенсивность микробного окисления метана (MO). Распределение содержания метана по вертикальному разрезу водной толщи желоба ББФ (рис. 4б) типично для меромиктических водоемов. В поверхностной воде, непосредственно над желобом, концентрация СН4 составляла 38–44 нмоль л–1, что близко к содержанию метана в поверхностных водах залива за пределами исследуемого желоба. В слое хемоклина содержание метана повышалось до 14–112 мкмоль л–1, а в придонном слое достигало 265–1820 мкмоль СН4 л–1. Зимний и осенний профили содержания метана существенно не различались. Показано, что процесс МО, протекает во всей водной толще озера, от придонного до поверхностного горизонтов включительно (рис. 4б). В сентябре 2020 г. интенсивность МО в поверхностном слое до 5.0 м была крайне низкой и соответствовала пределу чувствительности метода (до 1 нмоль СН4 л–1 сут–1). Резкий скачок и интенсивный процесс МО (23–40 нмоль СН4 л–1 сут–1) отмечен на глубине 9.25, 9.5 и 10.0 м. В слое 10.0–14.0 м интенсивность МО составляла 13–14 нмоль СН4 л–1 сут–1.
Состав микробного сообщества в зоне хемоклина. В марте 2021 г. методом высокопроизводительного секвенирования фрагмента гена 16S рРНК был определен таксономический состав микроорганизмов, формирующих бактериальную пластину в зоне хемоклина (табл. 1). Для характеристики состава микробного сообщества в образце хемоклина было получено 48153 последовательности фрагментов гена 16S рРНК. Абсолютно доминирующим видом сообщества прокариот в хемоклине в период подледной съемки являлись облигатно анаэробные ЗСБ Chlorobium phaevibrioides (57.0%) (табл. 1, рис. 5). Эти бактерии в процессе фотосинтеза окисляют сульфид до элементной серы, которая откладывается вне клеток. Второе место в популяции занимали аэробные сероокисляющие бактерии рода Sulfurimonas (26.3%), принадлежащие к филуму Campylobacterota (табл. 1, рис. 5). Представители рода Sulfurimonas – типичные градиентные морские бактерии, микроаэробы, способные окислять элементную серу, сульфид, другие восстановленные соединения серы в процессе кислородного, а некоторые виды в процессе нитратного дыхания (Han, Perner, 2015). В заметном количестве (1.5%) были обнаружены анаэробные, сульфидогены филума Desulfobacterota (=Thermodesulfobacteriota), в который входят бактерии семейств Desulfatiglandaceae, Desulfobacteraceae, Desulfosarcinaceae, Desulfocapsaceae, Desulfuromusa, Geopsychrobacter. Бактерии филума Desulfobacterota продуцируют сероводород за счет диспропорционирования элементной серы, сульфита и тиосульфата (Murphy et al., 2021). При этом бактерии не нуждаются в органических субстратах и развиваются как хемолитоавтотрофы. Некоторые бактерии класса Thermodesulfobacteria вступают в синтрофные отношения с микроорганизмами, использующими сероводород. Примечательно присутствие значительного количества представителей порядка Campylobacterales (филум ε-Proteobacteria) и семейства Anaerolineaceae (филум Chloroflexota), функция которых заключается в преобразовании органических субстратов. Преобладание функциональных групп, участвующих в круговороте серы, позволяет определить микробное сообщество хемоклина желоба Бухты Биофильтров известным термином “сульфурета”. Особо отметим присутствие в сообществе некультивируемых ультрамикробактерий филума Gracilibacteria клады Patescibacteria (Candidate Phyla Radiation) (CPR). В состав этой группы входят хищные бактерии (Yakimov et al., 2021), возможно, выполняющие важную экологическую функцию, контролируя плотность популяции первичных продуцентов в системах с высокой плотностью биоты, характерной для бактериальной пластины меромиктических водоемов.
Таблица 1.
Состав микробного сообщества зоны хемоклина на основании анализа V3–V4 региона гена 16S рРНК (10.0 м, март 2021 г.)
| Филогенетическая группа | Доля последовательностей генов 16S рРНК, % |
|---|---|
| Chlorobium phaeovibrioides | 57.0 |
| Sulfurimonas | 26.3 |
| Anaerolineaceae | 4.4 |
| Proteobacteria | 2.9 |
| Firmicutes | 2.9 |
| Arcobacteraceae | 2.8 |
| Desulfobacterota | 1.5 |
| Bacteroidia | 1.1 |
| Patescibacteria | 0.33 |
| Other Bacteria | 0.29 |
| Other Campylobacterales | 0.16 |
| Nanoarchaeota | 0.06 |
Рис. 5.
Состав микробного сообщества зоны хемоклина на основании анализа V3–V4 региона гена 16S рРНК (10.0 м, март 2021 г.).

При микроскопировании природных образцов с глубины 9.5 м (сентябрь 2019 г.) обнаружены мелкие слегка изогнутые клетки, размером 0.3 × 0.9 мкм, внутри которых видны овальные структуры – хлоросомы, характерные для всех видов Chlorobiota (рис. 6а). Морфология клеток соответствует морфологии бактерии Chlorobium phaeovibrioides, доминирующей в сообществе хемоклина ББФ. Кроме ЗСБ часто встречались клетки мелких спирилл со жгутиком, содержащих множество включений, видимо внутриклеточной серы (рис. 6б). При окислении сульфида эти бактерии откладывают серу вне клеток, реже наблюдаются внутриклеточные капли серы (рис. 6б). Морфология этих клеток соответствует описанной для сероокисляющих бактерий рода Sulfurimonas, обнаруженных в бактериальной пластине молекулярным методом.
Рис. 6.
Зеленые серобактерии Chlorobium phaeovibrioides (а) и бактерии рода Sulfurimonas (б) обитающие в хемоклине Бухты Биофильтров. Электронный микроскоп, тотальные препараты, окрашенные уранилацетатом. Масштабная линейка ‒ 0.5 мкм. Обозначения: хл – хлоросомы; S – включения элементной серы.

Спектральные характеристики бактерий из зоны хемоклина. Из проб воды, отобранных из зоны хемоклина в марте и сентябре 2020 г., была сконцентрирована центрифугированием суммарная биомасса бактерий, для которой были получены спектры поглощения целых клеток, а также их ацетоновых экстрактов (рис. 7). Можно заключить, что как осенью, так и в марте в подледный период в хемоклине меромиктического желоба ББФ преобладали зеленые серобактерии, содержащие бактериохлорофилл e и каротиноид изорениератин. О присутствии бактериохлорофилла свидетельствуют пики 453 и 721 нм в целых клетках и 651 нм в растворе ацетона. Для каротиноида изорениератина характерно плечо при 516 нм в целых клетках и пик 445 нм в экстракте пигментов. Эти данные подтверждают доминирование в бактериальной пластине желоба ББФ коричнево-окрашенного морфотипа ЗСБ Chlorobioum phaeovibrioides.
Рис. 7.
Спектральные характеристики пигментов бактерий, сконцентрированных из проб воды зон максимального развития фототрофов в марте (1) и сентябре (2) 2020 г. Верхняя линия – пробы сентября, нижняя линия – марта; (а) – спектр целых клеток, (б) – спектр пигментов в ацетоне.

Получение накопительных и чистых культур АФБ. Из проб воды хемоклина были сделаны посевы на элективную агаризованную среду. Среди выросших АФБ преобладали коричнево-окрашенные колонии ЗСБ и лишь отдельные колонии зеленого цвета. Из проб, отобранных в сентябре 2019 г., были получены два штамма коричневого цвета (ChlKor-19a, ChlKor-19b) и три штамма ЗСБ зеленого цвета (ChlZel-19a, ChlZel-19b, ChlZel-19с), а также штамм пурпурных серобактерий ThRos-19 (рис. 8а‒8г). ЗСБ характеризовались мелкими клетками (рис. 8д‒8ж). Их форма варьировала от кокковидной до эллипсовидной и вибриодной. Такая морфология характерна для морских Chlorobiota вида Chlorobium phaeovibrioides. Штаммы ЗСБ были выделены в виде монокультуры и идентифицированы как Ch. phaeovibrioides (рис. 9). Один штамм зеленых бактерий (ChlZel-19b) имел визуально различимые газовые вакуоли, что характерно для Ch. phaeovibrioides, доминирующего в хемоклине оз. Трехцветное (Кандалакшский залив) (Лунина и соавт., 2019).
Рис. 8.
Микроколонии мелких кокковидных цианобактерий (ЦБ) (а) и элипсовидных пурпурных серобактерий (ПСБ) (б); кокковидные пурпурные серобактерии с центральной газовой вакуолью (ГВ) и мелкими каплями серы (S) на периферии клеток (в, г); те же пурпурные бактерии, но выросшие в контакте с кислородом атмосферы, клетки переполнены каплями серы (S) (г); ChKor-19а – коричневые серобактерии ЗСБ (д); зеленые серобактерии ЗСБ (е, ж): ChZel-19а (е), ChZel-19с (ж). Масштабная линейка ‒ 0.2 мкм.
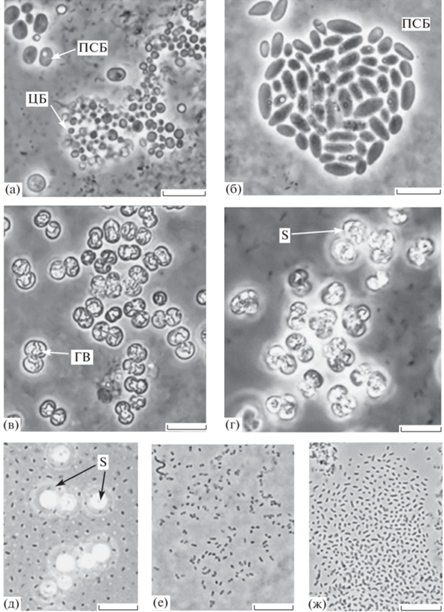
Рис. 9.
Филогенетическое положение штаммов ChlKor-19a, ChlKor-19b коричневых серобактерий и штаммов Ch-lZel‑19a, ChlZel-19b, ChlZel-19с зеленых серобактерий, выделенных из хемоклина желоба Бухты Биофильтров. Дерево построено с использованием алгоритма Maximum Likelihood. Длина последовательностей составляла 1102 нуклеотида. Достоверность ветвления рассчитана на основании 1000 альтернативных деревьев.

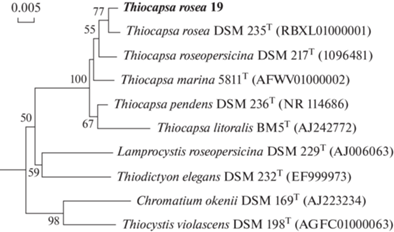
В накопительных культурах чаще вырастали колонии пурпурных серобактерий. Кокковидные клетки имели центральную газовую вакуоль. Этот морфотип (штамм ThRos-19) был выделен в чистую культуру. Было показано, что при росте у поверхности агаризованной среды (при контакте с кислородом воздуха) клетки переполнялись каплями элементной серы (рис. 8г). Последовательность гена 16S рРНК штамма ThRos-19 имела 99.25% сходства с геном типового штамма Thiocapsa roseа DSM 235T, что позволило отнести его к этому виду (рис. 10). Ранее для этого вида была показана способность к аэробному окислению тиосульфата (Горленко, 1974). Кроме кокковидного морфотипа ПСБ вырастали колонии, содержащие удлиненные клетки, подобные Chromatium (рис. 8б), но культуру этой бактерии получить не удалось. В посевах в столбики агара вырастали также колонии сине-зеленого цвета, состоящие из мелких кокковидных цианобактерий, размером около 1 мкм (рис. 8а). Эти цианобактерии, предположительно относящиеся к роду Sinechoсystis, видимо, определяют протекание кислородного фотосинтеза в металимнионе желоба ББФ.
Рис. 10.
Филогенетическое положение штамма 19 ПСБ на основе анализа последовательностей гена 16S рРНК. Длина последовательностей составляла 1322 нуклеотида. Дерево построено с использованием алгоритма Maximum Likelihood. Достоверность ветвления рассчитана на основании 1000 альтернативных деревьев.
Спектры поглощения целых клеток выделенных штаммов. Показано, что спектр коричнево-окрашенных клеток штамма ChKor-19 имеет максимумы поглощения при длинах волн 467, 516, 631, 714 и 806 нм (рис. 11а). Исходя из полученных результатов, бактерии штамма ChlKor-19a имеют бактериохлорофилл e (максимумы 464 и 714 нм), входящий в состав хлоросомы, и небольшой пик бактериохлорофилла а (806 нм). Кроме того, у них имеется каротиноид изорениератин (пик 516 нм). Спектр клеток ЗСБ штамма ChZel-19a имеет максимумы поглощения 444, 717 и 805 нм (рис. 11б), что свидетельствует о присутствии антенного бактериохлорофилла d и минорного бактериохлорофилла a. Спектр поглощения суспензии клеток штамма ThRos-19 имеет максимумы поглощения при длинах волн 521, 828 и 885 нм (рис. 11в), соответствующие бактериохлорофиллу a (основной пик при 828 нм) и каротиноиду окенону (521 нм).
Рис. 11.
Спектры поглощения целых клеток АФБ – коричнево-окрашенных серобактерий штамм Ch-Kor-19a (а); зелено-окрашенных серобактерий штамм ChlZel-19a (б) и пурпурных серобактерий штамм ThRos-19 (в), выделенных из хемоклина желоба Бухты Биофильтров.

Таким образом, подводный меромиктический желоб Бухты Биофильтров имеет ряд отличий от исследованных ранее стратифицированных водоемов, возникших в прибрежной зоне Кандалакшского залива. Бактериальная пластина в ББФ формируется на значительной глубине (9–9.5 м), что объясняет доминирование в ней коричнево-окрашенных ЗСБ вида Chlorobium phaeovibrioides, приспособленных к жизни при низкой освещенности, господствующей на больших глубинах. Коричневые морфотипы ЗСБ, содержащие каротиноиды в составе антенных структур хлоросом, эффективно используют зеленую часть спектра, проникающего на большую глубину. Зелено-окрашенный морфотип этого вида, практически лишенный каротиноидов, выявлен в исследованном водоеме лишь в небольшом количестве. Следует отметить, что зелено-окрашенные Chlorobium phaeovibrioides монопольно доминировали в меромиктическом оз. Трехцветное (Кандалакшский залив), в котором бактериальная пластина находится близко к поверхности, на глубине 1.8–2.0 м (Саввичев и соавт., 2018). Бактериальная пластина желоба ББФ содержит два морфотипа (коричневый и зеленый) Chlorobium phaeovibrioides, абсолютного доминанта во всех стратифицированных озерах, имеющих или имевших связь с Кандалакшским заливом.
Широкая зона совместного присутствия кислорода и сульфида обусловливает возможность развития как анаэробных, так и микроаэрофильных микроорганизмов, потребляющих сульфид, к которым относится хемоавтотрофная серобактерия Sulfurimonas sp. Нами было отмечено, что в определенные сезоны на верхней границе редокс-зоны ББФ происходит формирование дополнительного слоя пурпурных серобактерий, многие виды которых способны переключаться на аэробный хемосинтез и составляют конкуренцию бесцветным серобактериям (Горленко, 1974). К таковым относится выделенная нами пурпурная серобактерия Thiocapsa rosea. Нахождение ПСБ выше ЗСБ, отмечалось ранее, как для соленых, так и для пресных меромиктических озер (Gorlenko et al., 1983). Для других меромиктических озер Кандалакшской акватории подобного явления не наблюдалось. Морфометрические особенности Бухты Биофильтров позволяют предположить, что бактериальная пластина подвержена эрозии при участии разного рода течений и ветрового перемешивания; формирующие ее микроорганизмы могут разноситься на значительные расстояния и в пределах залива инфицировать экониши, благоприятные для развития привносимых видов. Эта гипотеза удовлетворительно объясняет генетическую однородность доминирования Chlorobium phaeovibrioides во всех озерах Кандалакшской акватории и в оз. Могильном, отделившемся от Баренцева моря и имеющего связь с Белым морем. Практическая значимость исследования микробных сообществ и микробных процессов в водоемах, отделенных от основного морского бассейна, связана, прежде всего, с необходимостью прогноза негативных последствий сероводородного заражения в искусственно замкнутых морских акваториях, появившихся в результате строительства дамб, плотин, приливных электростанций и т.д., а также с нарастающей актуальностью прогноза реакции морских экосистем на появление придонной бескислородной зоны – мирового тренда, наблюдаемого по всему мировому океану (Velinsky, Fogel, 1999; Middelburg, Levin, 2009; Zhang et al., 2010; Savvichev et al., 2017).
Список литературы
Горленко В.М. Окисление тиосульфата Amoebobacter roseus в темноте в микроаэрофильных условиях // Микробиология. 1974. Т. 43. С. 729–731.
Краснова Е.Д. Экология меромиктических озер России. 1. Прибрежные морские водоемы // Водные ресурсы. 2021. Т. 48. № 3. С. 322–333. https://doi.org/10.31857/S0321059621030093
Krasnova E.D. Ecology of meromictic lakes of Russia. Coastal marine waterbodies // Water Resour. 2021. V. 48. P. 427–438. https://doi.org/10.1134/S009780782103009X
Краснова Е.Д., Пантюлин А.Н., Белевич Т.А., Воронов Д.А., Демиденко Н.А., Житина Л.С., Ильяш Л.В., Кокрятская Н.М., Лунина О.Н., Мардашова М.В., Саввичев А.С., Филиппов А.С., Шевченко В.П. Комплексные исследования отделяющихся водоемов на разных стадиях изоляции от Белого моря в марте 2012 г. // Океанология. 2013. Т. 53. С. 714–717.
Krasnova E.D., Pantyulin A.N., Belevich T.A., Voronov D.A., Demidenko N.A., Zhitina L.S., Ilyash L.V., Kokryatskaya N.M., Lunina O.N., Mardashova M.V., Savvichev A.S., Filippov A.S., Shevchenko V.P. Multidisciplinary studies of the separating lakes at different stage of isolation from the White Sea performed in March 2012 // Oceanology. 2013. V. 53. P. 714–717.
Лосюк Г.Н., Кокрятская Н.М., Краснова Е.Д. Сероводородное заражение прибрежных озер на разных стадиях изоляции от Белого моря // Океанология. 2021. Т. 61. С. 401–412.
Losyuk G.N., Kokryatskaya N.M., Krasnova E.D. Hydrogen sulfide contamination of coastal lakes at different stages of isolation from the White Sea // Oceanology. 2021. V. 61. P. 351‒361.
Лунина О.Н., Саввичев А.С., Краснова Е.Д., Кокрятская Н.М., Веслополова Е.Ф., Кузнецов Б.Б., Горленко В.М. Cукцессионные процессы в сообществе аноксигенных фототрофных бактерий озера Кисло-Сладкое (Кандалакшский залив Белого моря) // Микробиология. 2016. Т. 85. С. 531–544. https://doi.org/10.7868/S0026365616050116
Lunina O.N., Savvichev A.S., Krasnova E.D., Kokryatskaya N.M., Veslopolova E.F., Kuznetsov B.B., Gorlenko V.M. Succession processes in the anoxygenic phototrophic bacterial community in lake Kislo-Sladkoe (Kandalaksha Bay, White Sea) // Microbiology (Moscow). 2016. V. 85. P. 570–582. https://doi.org/10.1134/S0026261716050118
Лунина О.Н., Саввичев А.С., Бабенко В.В., Болдырева Д.И., Колганова Т.В., Краснова Е.Ф., Кокрятская Н.М., Веслополова Е.Ф., Воронов Д.А., Кузнецов Б.Б., Демиденко Н.А., Летарова М.А., Летаров А.В., Горленко В.М. Сезонные изменения структуры сообщества аноксигенных фототрофных бактерий меромиктического озера Трехцветное (Кандалакшский залив Белого моря) // Микробиология. 2019. Т. 88. С. 100–115.
Lunina O.N., Savvichev A.S., Babenko V.V., Boldyreva D.I., Kuznetsov B.B., Kolganova T.V., Krasnova E.D., Kokryats-kaya N.M., Veslopolova E.F., Voronov D.A., Demi-denko N.A., Letarova M.A., Letarov A.V., Gorlenko V.M. Seasonal variations in the structure of an anoxygenic phototrophic bacterial community from the meromictic Lake Trekhtsvetnoe (Kandalaksha Bay, White Sea) // Microbiology, 2019. V. 88. P. 71–85.
Романенко Ф.А., Шилова О.С. Послеледниковое поднятие Карельского берега Белого моря по данным радиоуглеродного и диатомового анализов озерно-болотных отложений полуострова Киндо // Докл. Акад. Наук. 2012. Т. 442. № 4. С. 544–548.
Romanenko F.A., Shilova O.S. The postglacial uplift of the Karelian coast of the White Sea according to radiocarbon and diatom analyses of lacustrine boggy deposits of Kindo Peninsula // Doklady Earth Sci. 2012. V. 442. P. 242–246.
Alexander B., Andersen J., Cox R., Imhoff J. Phylogeny of green sulfur bacteria on the basis of gene sequences of 16S rRNA and of the Fenna-Matthews-Olson protein // Arch. Microbiol. 2002. V. 178. P. 131–140. https://doi.org/10.1007/s00203-002-0432-4
Boehrer B., Schultze M. Stratification of lakes // Rev. Geophys. 2008. V. 46. RG2005. https://doi.org/10.1029/2006RG000210
Camacho A., Erez J., Chicote A., Florin M., Squires M.M., Lehmann C., Bahofen R. Microbial microstratification, inorganic carbon photoassimilation and dark carbon fixation at the chemocline of the meromictic Lake Cadagno (Switzerland) and its relevance to the food web // Aquat. Sci. 2001. V. 63. P. 91–106.
Comeau A.M., Harding T., Galand P.E., Warwick F., Vincent W.F., Lovejoy C. Vertical distribution of microbial communities in a perennially stratified Arctic lake with saline, anoxic bottom waters // Sci. Rep. 2012. V. 2. P. 604. https://doi.org/10.1038/srep00604
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461. https://doi.org/10.1093/bioinformatics/btq461
Garcia-Gil L.J., Vicente E., Camacho A., Borrego C.M., Vila X., Cristina X.P., Rodriguez-Gonzalez J. Vertical distribution of photosynthetic sulphur bacteria linked to saline gradients in Lake ‘El Tobar’ (Cuenca, Spain) // Aquat. Microb. Ecol. 1999. V. 20. P. 299–303.
Gorlenko W.M., Kuznezov S.I. Über die photosynthesierenden Bakterien des Kononjer-Sees // Arch. Hydrobiol. 1972. V. 70. № 1. S. 1–13.
Gorlenko V.M., Vainshtein M.B., Kachalkin V.I. Microbiological characteristic of Lake Mogilnoye // Arch. Hydrobiol. 1978. V. 81. № 4. P. 475–492.
Gorlenko V.M., Dubinina G.A., Kuznetsov S.I. The Ecology of Aquatic Micro-Organisms // [Die Binnengewasser, Band XXVIII] 1983. Ohle W., ed.; Wareing, Helen, trans. Published by E. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart. P. 252.
Grouzdev D.S., Gaisin V.A., Krutkina M.S., Bryantseva I.A., Lunina O.N., Savvichev A.S., Gorlenko V.M. Genome sequence of Prosthecochloris sp. strain ZM and Prosthecochloris sp. strain ZM-2, isolated from an arctic meromictic lake // Microb. Res. Announc. 2018. V. 7. e01415-18. https://doi.org/10.1128/MRA.01415-18
Grouzdev D.S., Lunina O.N., Gaisin V.A., Krutkina M.S., Baslerov R.V., Savvichev A.S., Gorlenko V.M. Genome sequences of green- and brown-colored strains of Chlorobium phaeovibrioides with gas vesicles // Microb. Resour. Announc. 2019. V. 8. e00711-19. https://doi.org/10.1128/MRA.00711-19
Guerrero R., Montesinos E., Pedros-Alio C., Esteve I., Mas J., van Gemerden H., Hoffmann P.A.G., Bakker J.F. Phototrophic sulfur bacteria in two Spanish lakes: Vertical distribution and limiting factors // Limnol. Oceanogr. 1985. V. 30. P. 919–931.
Gulati R.D., Zadereev T.S., Degermendzhi A.G. // Ecology of meromictic lakes / Eds. Gulati R.D., Zadereev T.S., Degermendzhi A.G. Springer International Publish, 2018. Ecol. Stud. V. 228. 405 p. https://doi.org/10.1007/978-3-319-49143-1
Hamilton T.L., Bovee R.J., Thiel V., Sattin S.R., Mohr W., Schaperdoth I., Vogl K., Gilhooly 3rd W.P., Lyons T.W., Tomsho L.P., Schuster S.C., Overmann J., Bryant D.A., Pearson A., Macalady J.L. Coupled reductive and oxidative sulfur cycling in the phototrophic plate of a meromictic lake // Geobiology. 2014. V. 12. P. 451–468.
Han Y., Perner M. The globally widespread genus Sulfurimonas: versatile energy metabolisms and adaptations to redox clines // Front. Microbiol. 2015. V. 6. Art. 989. https://doi.org/10.3389/fmicb.2015.00989
Jørgensen B.B., Kuenen J.G., Cohen Y. Microbial transformations of sulfur-compounds in a stratified lake (Solar Lake, Sinai) // Limnol. Oceanogr. 1979. V. 24. P. 799–822.
Klepac-Ceraj V., Hayes C.A., Gilhooly W.P., Lyons T.W., Kolter R., Pearson A. Microbial diversity under extreme eu-xinia: Mahoney Lake, Canada // Geobiol. 2012. V. 10. P. 223–235. https://doi.org/10.1111/j.1472-4669.2012.00317.x
Krasnova E., Voronov D., Frolova N., Pantyulin A., Samsonov T. Salt lakes separated from the White Sea // EARSeL Proc. 2015. V. 14 (S.1). P. 8–22. https://doi.org/10.12760/02-2015-1-02
Kumar S., Stecher G., Tamura K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874.
Losyuk G., Kokryatskaya N., Krasnova E. Formation of hydrogen sulfide in isolated basins at the Karelian of the White Sea coast // EARSeL eProc. 2015. V. 14. P. 49–54. https://doi.org/10.12760/02-2015-1-07
McAuliffe C. Gas chromatographic determination of solutes by multiple phase equilibrium // Chem. Technol. 1971. V. 1. P. 46–51.
Middelburg J.J., Levin L.A. Coastal hypoxia and sediment biogeochemistry // Biogeosci. 2009. V. 6. P. 1273–1293. https://doi.org/10.5194/bg-6-1273-2009
Murphy C.L., Biggerstaff J., Eichhorn A., Ewing E., Shahan R., Soriano D., Stewart S., VanMol K., Walker R., Walters P., Elshahed M.S., Youssef N.H. Genomic characterization of three novel Desulfobacterota classes expand the metabolic and phylogenetic diversity of the phylum // Environ. Microb. 2021. V. 23. P. 4326–4343.
Overmann J. Mahoney Lake: a case study of the ecological significance of phototrophic sulphur bacteria // Adv. Microb. Ecol. 1997. V. 15. P. 251–288.
Pimenov N.V., Bonch-Osmolovskaya E.A. In situ activity studies in thermal environments // Methods Microbiol. 2006. V. 35. P. 29–53.
Pjevac P., Korlević M., Berg J.S., Bura-Nakić E., Ciglenečki I., Amann R., Orlić S. Community shift from phototrophic to chemotrophic sulfide oxidation following anoxic holomixis in a stratified seawater lake // Appl. Environ. Microb. 2015. V. 81. P. 298–308.
Pruesse E., Peplies J., Glöckner F.O. SINA: accurate high-throughput multiple sequence alignment of ribosomal RNA genes // Bioinformatics. 2012. V. 28 P. 1823‒1829.
Rogozin D.Y., Zykov V.V., Chernetsky M.Y., Degermendzhy A.G., Gulati R.D. Effect of winter conditions on distributions of anoxic phototrophic bacteria in two meromictic lakes in Siberia, Russia // Aquat. Ecol. 2009. V. 43. P. 661–672.
Savvichev A.S., Demidenko N.A., Krasnova E.D., Kalmatskaya O.V., Kharcheva A.N., Ivanov M.V. Microbial processes in the Kanda Bay, a meromictic water body artificially separated from the White Sea // Dokl. Biol. Sci. 2017. V. 474. P. 135–139.
Savvichev A.S., Babenko V.V., Lunina O.N., Letarova M.A., Boldyreva D.I., Veslopolova E.F., Demidenko N.A., Kokryatskaya N.M., Krasnova E.D., Gaisin V.A., Kostryukova E.S., Gorlenko V.M., Letarov A.V. Sharp water column stratification with an extremely dense microbial population in a small meromictic Lake Trekhtzvetnoe // Environ. Microbiol. 2018. V. 20. P. 3784–3797.
Savvichev A.S., Kadnikov V.V., Rusanov I.I., Beletsky A.V., Krasnova E.D., Voronov D.A., Kallistova A.Yu., Veslopolova E.F., Zakharova E.E., Kokryatskaya N.M., Losyuk G.N., Demidenko N.A., Belyaev N.A., Sigalevich P.A., Mardanov A.V., Ravin N.V., Pimenov N.V. Microbial processes and microbial communities in the water column of the polar meromictic Lake Bol’shie Khruslomeny at the White Sea coast // Front. Microbiol. 2020. V. 11. Art. 1945. P. 1–17. https://doi.org/10.3389/fmicb.2020.01945
Tonolla M., Peduzzi S., Hahn D., Peduzzi R. Spatio-temporal distribution of phototrophic sulfur bacteria in the chemocline of meromictic Lake Cadagno (Switzerland) // FEMS Microbiol. Ecol. 2003. V. 43. P. 89–98.
Van Gemerden H., Mas J. Ecology of phototrophic sulfur bacteria // Anoxygenic Photosynthetic Bacteria / Eds. Blankenship R.E., Madigan M.T., Bauer C.E. N.Y.: Kluwer Academic, 1995. P. 49–85.
Velinsky D.J., Fogel M.L. Cycling of dissolved and particulate nitrogen and carbon in the Framvaren Fjord, Norway: Stable isotopic variations // Mar. Chem. 1999. V. 67. P. 161‒180.
Yakimov M.M., Merkel A.Y., Gaisin V.A., Pilhofer M., Messina E., Hallsworth J.E., Klyukina A.A., Tikhonova E.N., Gorlenko V.M. Cultivation of a vampire: ‘Candidatus Absconditicoccus praedator’ // Environ. Microbiol. 2022. V. 24. P. 30–49. https://doi.org/10.1111/1462-2920.15823
Yoon S.H., Ha S.M., Kwon S., Lim J., Kim Y., Seo H., Chun J. Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1613–1617.
Zhang J., Gilbert D., Gooday A.J., Levin L., Naqvi S.W.A., Middelburg J.J., Scranton M., Ekau W., Peña A., Dewitte B., Oguz T., Monteiro P.M.S., Urban E., Rabalais N.N., Ittekkot V., Kemp W.M., Ulloa O., Elmgren R., Escobar-Brion E., Van der Plas A.K. Natural and human-induced hypoxia and consequences for coastal areas: synthesis and future development // Biogeosci. 2010. V. 7. P. 1443–1467.
Дополнительные материалы отсутствуют.


