Микробиология, 2022, T. 91, № 5, стр. 638-643
Влияние лантана на состав метанотрофного сообщества дерново-подзолистой почвы
И. К. Кравченко a, *, Л. Р. Сизов b, Е. Н. Тихонова a, Л. В. Лысак c
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
b Институт проблем химической физики РАН
142432 Черноголовка, Московская обл., Россия
c Московский государственный университет им. М.В. Ломоносова, факультет почвоведения
119192 Москва, Россия
* E-mail: irinakravchenko@inbox.ru
Поступила в редакцию 04.04.2022
После доработки 27.04.2022
Принята к публикации 20.05.2022
- EDN: JFVBHC
- DOI: 10.31857/S0026365622100238
Аннотация
Лантан регулирует метаболизм микроорганизмов, использующих одноуглеродные соединения, однако сведения о его воздействии на почвенные сообщества практически отсутствуют. Впервые методом высокопроизводительного секвенирования 16S рРНК в экспериментах с почвенными микрокосмами изучен ответ метанотрофных сообществ на внесение лантана. Установлено, что внесение солей лантана через один и два месяца увеличивает долю Methylobacter в общем пуле последовательностей до 9 и 15% соответственно. Одновременно наблюдается возрастание содержание метилотрофа Methylotenera до 10 и 19%. Таким образом, лантан стимулирует формирование комплексов Methylobacter‒Methylotenera в условиях повышенного содержания метана в почве, что может влиять на вклад сельскохозяйственных почв в регуляцию содержания метана в атмосфере.
Метан является важным парниковым газом, и, несмотря на содержание в атмосфере менее 0.02%, его вклад в современное глобальное потепление оценивается в 15% (Saunois et al., 2020). Единственным известным биологическим способом поглощения метана из атмосферы Земли является его окисление микробными сообществами аэробных почв, поэтому любые изменения интенсивности этого процесса могут иметь глобальные последствия. Согласно современным расчетам, интенсивность поглощения метана почвенными микроорганизмами составляет 22.4 Тг год–1, из которых половина приходится на почвы умеренной зоны (Dutaur, Verchot, 2007).
Почвы агроценозов находятся под постоянным воздействием различных соединений, поступающих с атмосферными осадками, удобрениями, выбросами предприятий и автотранспорта (Smith et al., 2016). Микробные сообщества почв отвечают за осуществление важнейших экосистемных процессов, что вызывает постоянно растущий интерес к изучению их устойчивости и восстановлению после стрессовых воздействий (Griffiths, Philippot, 2013). Сведения об изменении состава метанотрофных сообществ при внесении удобрений весьма ограничены, и наиболее часто рассматриваются азотные соединения. О влиянии на микробные сообщества почв других элементов, например лантаноидов, известно очень мало.
Лантаноиды входят в группу редкоземельных элементов (РЗЭ), которые широко используются в современных технологиях (Водяницкий, Рогова, 2016). Основная часть лантаноидов, которые поступают в почву при разложении литогенных минералов, содержится в металлоорганических комплексах и недоступна для растений и микроорганизмов (Котельникова и соавт., 2021). В то же время лантаноиды, попадающие в почву в результате антропогенной активности (минеральные и органические удобрения, микроудобрения), находятся в биологически доступной форме и могут нарушить цикл РЗЭ в окружающей среде (Ramos et al., 2016). В последнее десятилетие большое внимание лантаноидам, особенно легким, уделяется в связи с их стимулирующим воздействием на рост растений (Котельникова и соавт., 2021), в то время как сведения о влиянии на почвенные микроорганизмы весьма ограничены. Так в течение ряда лет проводились систематические исследования влияния лантаноидов на нитрифицирующие и аммонифицирующие микроорганизмы почв Бурятии (Чимитдоржиева, Абашеева, 2014).
Открытие лантаноид-зависимой метанолдегидрогеназы (XoxF-MDH) (Chistoserdova, 2016) продемонстрировало важную роль редкоземельных элементов в метаболизме метилотрофов. Легкие лантаноиды, особенно лантан (La), могут эффективно заменять кальций в метанолдегидрогеназе. Как результат, наличие лантаноидов даже в наномолярных количествах регулирует экспрессию генов синтеза альтернативной метанолдегидрогеназы и влияет на образование метанотрофами внеклеточного метанола, что может привести к изменениям в составе микроорганизмов-спутников (Krause et al., 2017). Это открывает перспективы для разработки новых подходов к регулированию состава и активности метанотрофов почвы и связанной с ними микробиоты. В то же время авторам не известны работы по оценке влияния лантана или других лантаноидов на метанотрофные сообщества почв.
Целью настоящего исследования было оценить влияние солей лантана на состав метанотрофных сообществ в экспериментах с почвенными микрокосмами.
В ноябре 2020 г. была заложена серия экспериментов c дерново-подзолистой среднесуглинистой почвой поверхностного горизонта А (0‒20 см) залежного разнотравно-злакового луга. Объект находится вблизи Пошехонской птицефабрики, Ярославская область (58°30′36′′ с.ш. и 39°08′32′′ в.д.), более 20 лет использовался в севообороте с внесением высоких доз органического удобрения. Почва умеренно кислая (pH 5.4), с высоким содержанием органического вещества (Сорг по Тюрину 21.7 г кг–1), высоким содержанием нитратов (261 мг кг–1) и низким содержанием аммонийного азота (<5 мг кг–1).
Исходная почва (вариант К) была использована для создания микрокосмов, каждый из которых представлял собой 10 г почвы естественной влажности, помещенной в стеклянный флакон объемом 100 мл. Флаконы содержали в эксикаторе с газовой смесью, состоящей из 10% метана и 90% воздуха для инкубации в течение 2 мес. при 25°С. Один раз в неделю проводили замену газовой фазы и контролировали влажность почвы гравиметрически. Были исследованы следующие варианты: М ‒ без добавок; ML1 – внесение раствора хлорида лантана (5 мкг La3+), инкубация в течение 1 мес.; ML2 ‒ внесение раствора хлорида лантана (5 мкг La3+), инкубация 2 мес. Для выделения ДНК и молекулярного анализа было использовано по два отдельных образца на вариант, итого 8 образцов.
Тотальную ДНК выделяли из 0.25 г почвы с использованием набора Power Soil DNA Isolation Kit (“Qiagen, Carlsbad”, CA, США). Оценку состава прокариотных сообществ почв с помощью высокопроизводительного секвенирования вариабельного региона V3–V4 гена 16S рРНК на секвенаторе MiSeq (“Illumina”, США) и первичную программную обработку полученных последовательностей проводили в ООО “Биоспарк”. Для каждого образца ДНК было создано две библиотеки. Анализ библиотек проводили методом парно-концевого чтения генерацией не менее 10 000 парных прочтений на каждый образец с использованием следующих реактивов: MiSeq Reagent Kit v2 nano и MiSeq v2 Reagent Kit. Полученные данные секвенирования обрабатывали в программе, написанной с использованием алгоритма QIIME 1.9.1, включающего объединение прямых и обратных прочтений, удаление технических последовательностей, фильтрации последовательностей с низкими показателями достоверности прочтения отдельных нуклеотидов (качество менее Q30), фильтрации химерных последовательностей, выравнивание прочтений на референсную последовательность 16S рРНК. При расчете индексов разнообразия проводилась нормализация данных по образцу с минимальным количеством чтений. Распределение последовательностей по ОТЕ с использованием базы данных Silva версии 132 и расчет индексов разнообразия проводили в программе QIIME 2 (Caporaso et al., 2010). Использован алгоритм классификации ОТЕ с открытым референсом, порог классификации 97%.
Проведенный анализ показал, что доля последовательностей гена 16S рРНК метанотрофов в исходной дерново-подзолистой почве составляла менее 0.1% от всех идентифицированных последовательностей. Были детектированы бактерии родов Methylosinus (0.05 ± 0.01%), Methylocystis (0.01 ± 0.006%), Methylomonas (0.004 ± 0.002%).
Инкубация микрокосмов с метаном, а также метаном и солями лантана снижала показатели разнообразия микробного сообщества (табл. 1), однако увеличивала долю метанотрофов и изменяла структуру метанотрофного сообщества. Через 30 сут инкубации с метаном количество Methylosinus возросло до 0.38 ± 0.08%. В составе сообщества были также обнаружены Methylobacter (2 ОТЕ, 0.43 ± 0.11%) и единичные последовательности Methylocella (0.03 ± 0.01%) (рис. 1), количество которых в исходной почве было ниже уровня детекции. Таким образом, количество метанотрофов через 1 мес. инкубации возросло на порядок и составило около 1% от общего числа последовательностей.
Таблица 1.
Характеристики разнообразия микробных сообществ дерново-подзолистой почвы и почв инкубационного эксперимента
| Образец | Характеристики библиотек фрагментов 16S рРНК | Количество ОТЕ | Количество родов (филумов) | Индексы разнообразия | |||||
|---|---|---|---|---|---|---|---|---|---|
| количество последовательностей | количество нуклеотидов в последовательностях | Chao 1 | Шеннон | Симпсон | Пиелу | Фейта PD | |||
| K | 10 715 ± 740 | 412 ± 12 | 1546 | 421 (21) | 1794 | 9.09 | 0.99 | 0.90 | 5.9 |
| M | 10 666 ± 486 | 417 ± 10 | 904 | 290 (16) | 1183 | 8.08 | 0.99 | 0.89 | 5.6 |
| ML1 | 5230 ± 620 | 409 ± 12 | 1046 | 203 (16) | 1213 | 7.81 | 0.98 | 0.86 | 3.8 |
| ML2 | 5966 ± 322 | 421 ± 8 | 906 | 218 (16) | 1226 | 7.66 | 0.98 | 0.91 | 3.4 |
Рис. 1.
Показатели относительного обилия доминирующих метанотрофных бактерий Methylobacter (белые столбики) и метилотрофных бактерий Methylotenera (черные столбики) в образцах почв эксперимента с микрокосмами. Обозначения вариантов опыта: 1 – M, 2 – ML1, 3 – ML2.
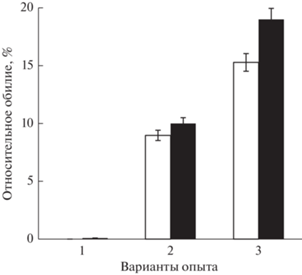
Внесение лантана принципиально изменяло количество и состав метанотрофов. Через 1 мес. доля последовательностей гена 16S рРНК метанотрофов достигала 9.2%, из них Methylobacter составил 8.97 ± 0.9% (3 ОТЕ), а Methylosinus 0.10 ± 0.08% (рис. 1). Эффект влияния лантана был пролонгированным, и через 2 мес. доля последовательностей Methylobacter возросла до 15.28 ± 3.2% (6 ОТЕ), а Methylosinus до 0.19 ± 0.1% (рис. 1). Все ОТЕ Methylobacter относились к M. tundripaludum (98.12‒99.06% сходства гена 16S рРНК с типовым штаммом), а ОТЕ Methylosinus – M. sporium (99.24% сходства) (табл. 2).
Таблица 2.
Характеристики основных ОТЕ метанотрофных и метилотрофных бактерий, полученные в результате молекулярного анализа микробных сообществ почв инкубационного эксперимента
| ОТЕ | Номер депонирования в NCBI | Представленность в сообществе, % | Ближайший родственник (NCBI номер) | Степень покрытия 16S рРНК, % | Сходство 16S РНК, % |
|---|---|---|---|---|---|
| M−инкубация с метаном, 1 мес. | |||||
| S21-25 | ON109140 | 0.23 | Uncultured Methylobacter sp. clone (JX505341, AJ414655) | 100.0 | 100.0 |
| Methylobacter tundripaludum SV96Т (NR_042107) | 100.0 | 99.05 | |||
| S21-21 | ON109141 | 0.20 | Uncultured Methylobacter sp. clone (JX505341, AJ414655) | 100.0 | 99.05 |
| Methylobacter tundripaludum SV96Т (NR_042107) | 100.0 | 98.12 | |||
| S21-41 | ON109142 | 0.38 | Uncultured bacterium clone (JF135670) | 100 | 100 |
| Methylosinus sporium (MT229167) | 100 | 99.24 | |||
| S21-979 | ON109143 | 0.03 | Uncultured Methylocella sp. clone OTU16 (MW143589) | 100 | 98.48 |
| Methylocella tundrae isolate MTUNDRAET4 | 100 | 97.49 | |||
| ML1−инкубация с метаном и лантаном, 1 мес. | |||||
| S21-278 | ON109144 | 5.31 | Uncultured Methylobacter sp. сlone (JX505341) | 100 | 100 |
| Methylobacter tundripaludum SV96Т (NR_042107) | 100 | 99.06 | |||
| S21-185 | ON109145 | 3.54 | Uncultured Methylobacter sp. сlone (JX505341) | 100 | 99.76 |
| Methylobacter tundripaludum SV96Т (NR_042107) | 100 | 98.82 | |||
| S21-299 | ON109146 | 5.71 | Uncultured Methylotenera sp. clone 11 (KX365915) | 100 | 99.77 |
| S21-173 | ON109147 | 3.31 | Uncultured Methylophilaceae bacterium clone 320 (MF042682) | 100 | 99.76 |
| S21-14 | ON109148 | 0.27 | Hyphomicrobium sp. strain TWH1 (MK124972) | 100 | 100 |
| S21-131 | ON109149 | 0.13 | Uncultured Hyphomicrobiaceae bacterium clone C (JX505000) | 100 | 100 |
| Hyphomicrobium facile (Y14312) | 100 | 99.25 | |||
| ML2−инкубация с метаном и лантаном, 2 мес. | |||||
| S21-507 | ON109150 | 8.55 | Uncultured Methylobacter sp. сlone (JX505341) | 100 | 100 |
| Methylobacter tundripaludum SV96Т (NR_042107) | 100 | 99.06 | |||
| S21-359 | ON109151 | 6.05 | Uncultured Methylobacter sp. сlone (JX505341) | 100 | 99.76 |
| Methylobacter tundripaludum SV96Т (NR_042107 | 100 | 98.82 | |||
| S21-472 | ON109152 | 12.86 | Uncultured Methylotenera sp. clone 11 (KX365915) | 100 | 99.77 |
| Methylotenera versatilis isolate (MW010428) | 100 | 98.12 | |||
| S21-121 | ON109153 | 2.04 | Methylotenera versatilis isolate (MW010428) | 100 | 98.46 |
Основную по численности группу в почве с внесением лантана составляли метилотрофы рода Methylotenera, относящиеся к классу Methylophilaceae (рис. 1), которые образуют консорциумы с метанотрофными бактериями в мелководных метановых сипах (Данилова и соавт., 2021) и осадках озер (van Grinsven et al., 2021). Через 2 мес. доля последовательностей гена 16S рРНК Methylotenera превышала 19 ± 1.30% (рис. 1). Все они относились к M. versatilis (табл. 2), проявляя 98.12‒98.46% сходства 16S рРНК с изолятом из донных осадков озера Вашингтон, США (Lapidus et al., 2011). В вариантах без внесения лантана были обнаружены также метилотрофные бактерии Hyphomicrobium facile (2 ОТЕ, 0.4 ± 0.2%).
Таким образом, впервые установлено, что в почве умеренной климатической зоны внесение лантана на фоне повышения содержания метана, что характерно для агропочв с внесением органических и минеральных удобрений, приводит к абсолютному доминированию метанотрофов рода Methylobacter и облигатных метилотрофов рода Methylotenera. Скоординированная реакция Me-thylobacter и Methylotenera на внесение соли лантана позволяет предположить их совместную деятельность в регуляции обмена метана между почвой и атмосферой, что требует дальнейшего исследования.
Список литературы
Данилова О.В., Иванова А.А., Терентьева И.Е., Глаголев М.В., Сабреков А.Ф. Разнообразие микробных сообществ, приуроченных к мелководным сипам в пойме реки Большая речка, Западная Сибирь // Микробиология. 2021. Т. 90. С. 601‒612.
Danilova O.V., Ivanova A.A., Terent’eva I.E., Glagolev M.V., Sabrekov A.F. Microbial community composition of floodplains shallow-water seeps in the Bolshaya Rechka floodplain, Western Siberia // Microbiology (Moscow). 2021. V. 90. P. 632‒642.
Водяницкий Ю.Н., Рогова О.Б. Биогеохимия лантанидов в почвах // Бюллетень Почвенного института им. Докучаева. 2016. Вып. 84. С. 101‒118.
Котельникова А.Д., Рогова О.Б., Столбова В.В. Лантаноиды в почве: поступление, содержание, влияние на растения, генотоксичность (обзор) // Почвоведение. 2021. № 2. С. 216‒223.
Kotelnikova A.D., Rogova O.B., Stolbova V.V. Lanthanides in the soil: routes of entry, content, effect on plants, and genotoxicity (a review) // Euras. Soil Sci. 2021. V. 54. C. 117‒134.
Чимитдоржиева И.Б., Абашеева Н.Е. Влияние лантана на микробиологическую активность и динамику азотного фонда почв. Монография. Улан-Удэ: Изд-во БГ-СХА им. В.Р. Филиппова, 2014. 98 с.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high throughput community sequencing data // Nature Meth. 2010. V. 7. P. 335–336.
Chistoserdova L. Lanthanides: New life metals? // World J. Microbiol. Biotechnol. 2016. V. 32. Art. 138. https://doi.org/10.1007/s11274-016-2088-2
Dutaur L., Verchot L.V. A global inventory of the soil CH4 sink // Glob. Biogeochem. Cycles. 2007. V. 21. P. 1–9.
Griffiths B.S., Philippot L. Insights into the resistance and resilience of the soil microbial community // FEMS Microbiol. Rev. 2013. V. 37. P. 112–129.
Krause S.M.B., Johnson T., Karunaratne Y.S., Fu Y., Beck D.A.C., Chistoserdova L., Lidstrom M.E. Lanthanide-dependent cross-feeding of methane-derived carbon is linked by microbial community interactions // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 358–363.
Lapidus A., Clum A., LaButti K., Kaluzhnaya M.G., Lim S., Beck D.A.C., Glavina del Rio T., Nolan M., Mavromatis K., Huntemann M., Lucas S., Lidstrom M.E., Ivanova N., Chistoserdov L. Genomes of three methylotrophs from a single niche reveal the genetic and metabolic divergence of the Methylophilaceae // J. Bacteriol. 2011. V. 193. P. 3757‒3764.
Ramos S.J., Dinali G.S., Oliveira C., Martins G.C., Moreira C.G., Siqueira J.O., Guilherme L.R. Rare earth elements in the soil environment // Curr. Pollut. Rep. 2016. V. 2. P. 28–50.
Saunois M., Bousquet P., Poulter B., Peregon A., Ciais P., Canadell J.G., Dlugokencky E.J., Etiope G., Bastviken D., Houweling S., Janssens-Maenhout G., Tubiello F.N., Castaldi S., Jackson R.B., Alexe M., Arora V.K., Beerling D.J., Bergamaschi P., Blake D.R., Brailsford G., Brovkin V., Bruhwiler L., Crevoisier C., Crill P., Covey K., Curry C., Frankenberg C., Gedney N., Höglund-Isaksson L., Ishizawa M., Ito A., Joos F., Kim H.-S., Kleinen T., Krummel P., Lamarque J.-F., Langenfelds R., Locatelli R., Machida T., Maksyutov S., McDonald K.C., Marshall J., Melton J.R., Morino I., Naik V., O’Doherty S., Parmentier F.-J.W., Patra P.K., Peng C., Peng S., Peters G.P., Pison I., Prigent C., Prinn R., Ramonet M., Riley W.J., Saito M., Santini M., Schroeder R., Simpson I.J., Spahni R., Steele P., Takizawa A., Thornton B.F., Tian H., Tohjima Y., Viovy N., Voulgarakis A., van Weele M., van der Werf G.R., Weiss R., Wiedinmyer C., Wilton D.J., Wiltshire A., Worthy D., Wunch D., Xu X., Yoshida Y., Zhang B., Zhang Z., Zhu Q. The global methane budget 2000–2012 // Earth Syst. Sci. Data. 2016. V. 8. P. 697–751.
Smith P., House J.I., Bustamante M., Sobocká J., Harper R., Pan G., West P.C., Clark J.M., Adhya T., Rumpel C., Paustian K., Kuikman P.M., Cotrufo F., Elliott J.A., McDowell R., Griffiths R.I., Asakawa S., Bondeau A., Jain A.K., Thomas M.J., Pugh A.M. Global change pressures on soils from land use and management // Global Change Biol. 2016. V. 22. P. 1008‒1028.
van Grinsven S., Damsté J.S.S., Harrison J., Polerecky L., Villanueva L. Nitrate promotes the transfer of methane-derived carbon from the methanotroph Methylobacter sp. to the methylotroph Methylotenera sp. in eutrophic lake water // Limnol. Oceanogr. 2021. V. 66. P. 878–891.
Дополнительные материалы отсутствуют.


