Микробиология, 2022, T. 91, № 5, стр. 631-637
Микробное сообщество, аккумулирующее фосфат в лабораторном биореакторе с доминированием “Candidatus Accumulibacter”
А. В. Пелевина a, *, Ю. Ю. Берестовская a, В. А. Грачёв a, А. Г. Дорофеев a, О. В. Слатинская b, Г. В. Максимов b, А. Ю. Каллистова a, Ю. А. Николаев a, Е. В. Груздев c, Н. В. Равин c, Н. В. Пименов a, А. В. Марданов c
a ФИЦ Биотехнологии РАН, Институт микробиологии им. С.Н. Виноградского
119071 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова, биологический факультет
119892 Москва, Россия
c ФИЦ Биотехнологии РАН, Институт биоинженерии им. К.Г. Скрябина
119071 Москва, Россия
* E-mail: annie.pelevina@yandex.ru
Поступила в редакцию 11.04.2022
После доработки 18.04.2022
Принята к публикации 19.04.2022
- EDN: TDNLPI
- DOI: 10.31857/S0026365622100275
Аннотация
В лабораторном биореакторе последовательно-периодического действия через 150 сут культивирования было получено микробное сообщество, обогащенное фосфат-аккумулирующими организмами (ФАО). Анализ динамики фосфатов в среде и результаты спектроскопии комбинационного рассеяния света микробных клеток свидетельствовали о типичном для ФАО цикле потребления и высвобождения фосфатов в аэробный и анаэробный периоды культивирования соответственно. Максимальное содержание внутриклеточного фосфора составило 16.5 ± 0.15% от сухой массы беззольного вещества. Молекулярно-генетическим анализом и методом FISH выявлено таксономическое разнообразие микробного сообщества, в котором основными представителями ФАО были бактерии группы “Ca. Аccumulibacter”.
Наиболее перспективные современные технологии очистки сточных вод от фосфора основаны на биологической очистке с использованием активного ила, формирующегося в биореакторах непрерывного или последовательно-периодического действия (sequencing batch reactor, SBR). Способность к удалению фосфора обусловлена функционированием фосфат-аккумулирующих организмов (ФАО) – физиологической группой микроорганизмов, способных к циклическому поглощению‒высвобождению фосфатов и накоплению фосфора в виде полифосфатов при чередовании анаэробной и аэробной фаз культивирования. Динамика формирования фосфат-аккумулирующего микробного сообщества, его состав и пространственная организация во многом определяются режимами работы реакторов (Weissbrodt et al., 2013; Gómez-Basurto et al., 2019; Zhou et al., 2019). Исследованию ФАО, разработке и оптимизации режимов работы биореакторов, обеспечивающих эффективную очистку сточных вод от фосфора, посвящено большое количество работ (Izadi et al., 2020; Roy et al., 2021; Rajesh Banu et al., 2021). В России такие исследования были начаты недавно (Пелевина и соавт., 2021).
В задачу наших исследований входило получение обогащенного ФАО микробного сообщества с высокой плотностью биомассы, исследование динамики клеточных фосфатов с использованием спектроскопии комбинационного рассеяния (КР-спектроскопия), определение таксономического состава сообщества и доминирующих представителей ФАО.
Культивирование микробного сообщества проводили в лабораторном реакторе (SBR) с рабочим объемом 2 л. Основные характеристики биореактора описаны ранее (Пелевина и соавт., 2021). В настоящей работе режим SBR включал фазу отстаивания, что обеспечило получение высокой плотности биомассы. Каждый SBR-цикл включал пять последовательных фаз: 1) подача среды в анаэробных условиях – 30 мин; 2) анаэробная фаза потребления субстрата – 2 ч 25 мин; 3) аэробная фаза роста биомассы – 2 ч 30 мин; 4) фаза отстаивания – 30 мин; 5) слив надосадочной жидкости – 5 мин. В каждом SBR-цикле проводили замену 0.8 л среды, обеспечивая гидравлическое время пребывания 15 ч. Для удаления избыточной (приросшей) биомассы, в каждом 28-ом SBR-цикле исключали фазу отстаивания, и отводили часть биомассы вместе со сливной жидкостью, поддерживая среднее время удержания биомассы 17.5 сут. Выращивание проводили при оптимальных для развития ФАО условиях: температура 18°С, рН 7.5–8.2, источник углерода и энергии – ацетат, соотношение фосфора к ацетату в среде ‒ 0.09 моль/моль (Lopez-Vazquez et al., 2010; McMahon et al., 2010).
В работе использовали синтетическую среду следующего состава (г/л): CH3COONa (3H2O) – 0.670; (NH4)2SO4 – 0.139; КH2PO4 – 0.109; дрожжевой экстракт – 0.009; MgSO4 · 7H2O – 0.150; раствор микроэлементов – 1 мл/л. Состав раствора микроэлементов (г/л): ЭДТА натрия – 10; FeCl3 · 6H2O – 1.5; H3BO3 – 0.15; CuSO4 · 5H2O – 0.03; MnCl2 · · 4H2O – 0.12; Na2MoO4 · 2H2O – 0.06; ZnSO4 · · 7H2O – 0.12; KI – 0.18; CoCl2 · 6H2O – 0.15. Для предотвращения образования нитратов и развития денитрифицирующих бактерий, конкурирующих с ФАО за субстрат, в среду добавляли тиомочевину до конечной концентрации 2.5 мг/л; рН поддерживали автоматическим титрованием 0.5 М раствором HCl.
Посевным материалом служил флоккулированный активный ил очистных сооружений г. Москвы.
Концентрацию растворенного кислорода, ацетата, фосфат-ионов (P-${\text{PO}}_{4}^{{3 - }}$) и вес сухой биомассы (СБ) проводили, как было описано ранее (Пелевина и соавт., 2021). Зольность и концентрацию фосфора в биомассе определяли в соответствии с (Rice et al., 2017).
Морфологию клеток исследовали на микроскопе Olympus CX41 с фазовым контрастом (“Olympus”, Япония).
Фосфат-аккумулирующих представителей в составе микробного сообщества биореактора определяли методом флуоресцентной in situ гибридизации (FISH) с использованием меченых цианином 3 (Cy3) 16S рРНК олигонуклеотидных зондов: PAO651, специфичных к “Ca. Accumulibacter” (Crocetti et al., 2000). Процедуру гибридизации проводили по методике, описанной ранее (Каллистова и соавт., 2014). Клетки с зондами визуализировали с помощью эпифлуоресцентного микроскопа Axio Imager M2 (“Carl Zeiss Microscopy GmbH”, Германия), оснащенного цифровой камерой 503mono и светофильтром Zeiss 43 (возбуждение 545/25 нм, эмиссия 605/70 нм). Фотографии обрабатывали с использованием программного обеспечения ZEN 2 (“Carl Zeiss Microscopy GmbH”, Германия).
Содержание и конформационное состояние молекул внутри клеток исследовали с помощью спектроскопии комбинационного рассеяния (Рамановская спектроскопия, КР) (Carey, 1999). Регистрацию сигнала КР осуществляли на конфокальном микроскоп-спектрометре NTEGRA-SPECTRA (“NT-MDT”, Россия) в диапазоне частотного сдвига 200‒3000 см–1 с шагом измерения 1 см–1, охлаждение CCD камеры ‒60°С, объектив 5× с апертурой 0.15, решетка 600, мощность лазера на образце 3 мВт, длина волны возбуждения 532 нм. Для регистрации сигнала КР 5 мкл раствора наносили на предметное стекло и накрывали вторым предметным стеклом, после чего помещали на предметный столик прибора. Через 5 мин после нанесения образца проводили регистрацию спектров с выбранных областей. Время регистрации одного спектра – 30 с. Количество повторов – не менее 10. После получения сигнала, спектр КР обрабатывали в программе Origin2017 (“Origin Lab Corporation”, США). Обработка сигнала включала в себя вычитание базовой линии и сглаживание спектра.
Выделение ДНК, амплификацию и секвенирование фрагментов генов 16S рРНК проводили по методике, описанной ранее (Пелевина и соавт., 2021).
В течение всего периода культивирования органический субстрат (ацетат) полностью потреблялся микробным сообществом в анаэробную фазу каждого цикла работы SBR. Достоверного поглощения и выброса фосфора в среду в SBR-циклах за первые 10 сут не наблюдалось (рис. 1а). Дальнейшее культивирование приводило к увеличению количества выбрасываемого фосфора в анаэробной фазе каждого цикла SBR и падению его содержания в среде при переходе в аэробную фазу, что свидетельствовало о развитии в реакторе фосфат-аккумулирующего микробного сообщества. К 150 сут культивирования максимальная концентрация фосфатов в среде в анаэробную фазу составила 100–110 мг P-PO4/л (рис. 1б). К этому моменту отношение количества выброшенного фосфора к потребленному ацетату в анаэробную фазу цикла достигло значения 0.72 ± 0.05 (Р-моль/С-моль), что свидетельствовало о том, что весь потребленный ацетат использовался фосфат-аккумулирующими микроорганизмами. Концентрация биомассы в реакторе и ее зольность составили 3.5 ± 0.3 г СБ/л и 36.0 ± 1.0% соответственно. Содержание фосфора увеличилось до 16.5 ± 0.15% от веса сухого беззольного вещества биомассы, что многократно превышало содержание фосфора в биомассе большинства микроорганизмов (1–2.5%) (Henze et al., 2002).
Рис. 1.
Динамика концентрации фосфатов и ацетата в среде в течение одного SBR-цикла: а – 10 сут работы реактора; б – 150 сут работы реактора. Концентрации ацетата и фосфатов показаны зеленой и фиолетовой линиями соответственно.

Микроскопическое исследование микробного сообщества SBR выявило большое разнообразие морфологических форм. Среди них четко выделялись овальные клетки с крупными включениями (рис. 2а), большинство из которых формировали агрегаты (рис. 2б).
Рис. 2.
Клетки с включениями в составе фосфат-аккумулирующего микробного сообщества ферментера: а – отдельные клетки; б – агрегаты клеток. Масштабная линейка ‒ 5 мкм.

Исследование этих клеток с помощью метода КР-спектроскопии позволило обнаружить полосы, характерные для колебания различных связей органических соединений и фосфора (рис. 3а, 3б; табл. 1). Были выявлены полосы колебаний, характерные для белков и жирных кислот, а также для связей О‒Р‒О, фосфатных групп РО, РО4, С‒Н деформации ${\text{РО}}_{4}^{{3 - }},$ антисимметричные растяжения РО2 и полоса колебаний растяжения связи Р‒ОН.
Рис. 3.
КР-спектроскопия клеток с включениями: а – микрофотография с обозначением места проведения анализа; б – КР-спектр исследуемых клеток на 150 сут культивирования; в – КР-спектр исследуемых клеток в конце анаэробной фазы (спектр 1) и в конце аэробной фазы SBR-цикла (спектр 2). Представленные графики нормированы на максимум интенсивности полосы стекла ‒ 916 см–1.
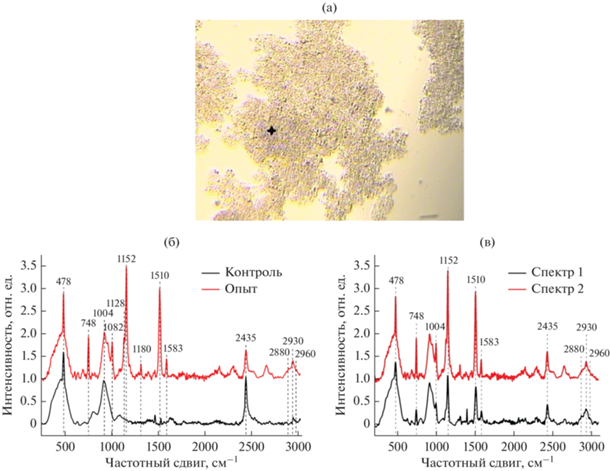
Таблица 1.
Характеристика полос КР-спектра ( Condrate, 1998; Zhang, Silva, 2010; Frost et al., 2014; Jillavenkatesa, Penkov, 2021 )
| Положение пика, см–1 | Характеристика |
|---|---|
| 478 | Колебания О‒Р‒О |
| 748 | Колебания фосфатных групп РО |
| 1004 | Карбонат ион СО3 (2‒) или СН3-колебания |
| 1082 | Колебания РО4, полоса F2 |
| 1128 | С‒Н деформации, РО$_{4}^{{3--}}$v3 колебание |
| 1152 | Колебания С‒С связи, антисимметричные растяжения РО2 |
| 1180 | С‒Н деформации |
| 1440 | N=N растяжения |
| 1510 | Колебания С=С связи |
| 1583 | Колебания амида I |
| 2435 | Колебания растяжения связи Р‒ОН |
| 2880, 2930, 2960 | Белки и липиды, С‒Н группы жирных кислот и белков или воды |
Наличие полос КР-спектра, характерных для С‒Н-, С‒С-связей органических соединений и связей РО4 (полоса 1128 см–1 ‒ С‒Н деформации, ${\text{РО}}_{4}^{{3 - }}$ v3 колебание, 1152 см–1 – колебания С‒С связи, антисимметричные растяжения РО2), указывает на существование центров связывания фосфатов с молекулами в клетке. На рис. 3в представлены КР-спектры образцов клеток, отобранных в разных фазах SBR-цикла. Сравнение интенсивности полос 478, 748 и 1152 см–1, полученных для клеток, находящихся в различных фазах SBR-цикла, показало, что содержание фосфатов в клетках в конце аэробной фазы (спектр 2) существенно выше, чем в конце анаэробной фазы SBR-цикла (спектр 1) (рис. 3в). Эти результаты полностью соответствует данным по динамике концентрации фосфатов в среде ферментера. Несмотря на то, что интенсивность полос спектра меняется, никакого их смещения не происходит, что свидетельствует об отсутствии конформационных изменений внутриклеточных фосфатов при их потреблении клетками или высвобождении в среду. Отметим, что при минимальном содержании в клетках фосфора в спектрах КР выявлена полоса 1440 см–1, характеризующая N=N растяжения в молекулах (рис. 3в, табл. 1), которой не наблюдается в клетках при максимальном содержании фосфора. Этот сопряженный с динамикой фосфора процесс требует дальнейшего исследования.
Анализ микробных агрегатов методом FISH выявил высокое содержание в нем “Ca. Accumulibacter” – типичного представителя фосфат-аккумулирующих бактерий (рис. 4).
Рис. 4.
“Ca. Accumulibacter” в составе микробного сообщества агрегатов: а – фазовый контраст; б – клетки, гибридизованные с зондом РАО651 (светофильтр Zeiss 43). Масштабная линейка ‒ 20 мкм.

Таксономический анализ исследуемых образцов показал, что в исходном активном иле доминировали представители домена Bacteria, относящиеся к четырем основным филумам: Proteobacteria, Bacteroidota, Chloroflexota и Patescibacteria, тогда как археи составляли 5.9% от общего числа представителей микроорганизмов. В процессе работы биореактора доля архей снизилась до нуля, и стали преобладать представители филума Proteobacteria. Их доля к 150 сут возросла более чем в 5 раз, достигнув 68%. Proteobacteria в основном были представлены родами “Ca. Accumulibacter”, “Ca. Competibacter”, Thiothrix, Propionivibrio, Dechloromonas, Thauera, Zoogloea, которые характерны для биореакторов по удалению фосфатов (McIlroy et al., 2014, 2015; Albertsen et al., 2016; Terashima et al., 2016). Несмотря на то, что некоторые из этих родов включают в фосфат-аккумулирующие микроорганизмы (“Ca. Accumulibacter”, Thiothrix, Dechloromonas, Thauera), доминирующим представителем этой физиологической группы бактерий был “Ca. Accumulibacter”, численность которого существенно возросла по сравнению с исходным микробным сообществом активного ила с 0.9 до 13% от всех последовательностей генов 16S рРНК.
Таким образом, в ходе работы биореактора произошла смена таксономического состава активного ила. К 150 сут культивирования в SBR было получено стабильно функционирующее фосфат-аккумулирующее микробное сообщество с высоким накоплением фосфора в биомассе (16.5% от веса сухого беззольного вещества биомассы) и типичным для ФАО-фенотипа накоплением и высвобождением фосфатов в аэробную и анаэробную фазу SBR-цикла. Основным представителем ФАО в сообществе был “Ca. Accumulibacter”.
Список литературы
Каллистова А.Ю., Пименов Н.В., Козлов М.Н., Николаев Ю.А., Дорофеев А.Г., Асеева В.Г., Грачев В.А., Менько Е.В., Берестовская Ю.Ю., Ножевникова А.Н., Кевбрина М.В. Изучение микробного состава активных илов московских очистных сооружений // Микробиология. 2014. Т. 83. С. 615–625.
Kallistova A.Y., Pimenov N.V., Kozlov M.N., Nikolaev Y.A., Dorofeev A.G., Aseeva V.G., Grachev V.A., Men’ko E.V., Berestovskaya Y.Y., Nozhevnikova A.N., Kevbrina M.V. Microbial composition of the activated sludge of Moscow wastewater treatment plants // Microbiology (Moscow). 2014. V. 83. P. 699‒708.
Пелевина А.В., Берестовская Ю.Ю., Грачёв В.А., Дорофеева И.К., Сорокин В.В., Дорофеев А.Г., Каллистова А.Ю., Николаев Ю.А., Котляров Р.Ю., Белецкий А.В., Равин Н.В., Пименов Н.В., Марданов А.В. Mикробный консорциум, осуществляющий удаление фосфатов в циклическом аэробно-анаэробном культивировании // Микробиология. 2021. Т. 90. С. 76‒89.
Pelevina A.V., Berestovskaya Y.Y., Grachev V.A., Dorofeeva I.K., Sorokin V.V., Dorofeev A.G., Kallistova A.Y., Nikolaev Y.A., Pimenov N.V., Kotlyarov R.Y., Beletskii A.V., Ravin N.V., Pimenov N.V., Mardanov A.V. A microbial consortium removing phosphates under conditions of cyclic aerobic-anaerobic cultivation // Microbiology (Mioscow). 2021. V. 90. P. 66‒77.
Albertsen M., McIlroy S.J., Stokholm-Bjerregaard M., Karst S.M., Nielsen P.H. “Candidatus Propionivibrio aalborgensis”: a novel glycogen accumulating organism abundant in full-scale enhanced biological phosphorus removal plants // Front. Microbiol. 2016. V. 7. P. 1033.
Carey P.R. Raman spectroscopy, the sleeping giant in structural biology, awakes // J. Biol. Chem. 1999. V. 274. P. 26625–26628.
Crocetti G.R., Hugenholtz P., Bond P.L., Schuler A., Keller J., Jenkins D., Blackall L.L. Identification of polyphosphate-accumulating organisms and design of 16S rRNA-directed probes for their detection and quantitation // Appl. Environ. Microbiol. 2000. V. 66. P. 1175–1182.
Crocetti G.R., Banfield J.F., Keller J., Bond P.L., Blackall L.L. Glycogen-accumulating organisms in laboratory-scale and full-scale wastewater treatment processes // Microbiology (SGM). 2002. V. 148. P. 3353‒3364.
Frost R.L., Scholz R., López A., Xi Y. A vibrational spectroscopic study of the phosphate mineral whiteite CaMn++ Mg2Al2(PO4)4(OH)2 · 8(H2O) // Spectrochim. Acta Part A: Mol. Biomol. Spectrosc. 2014. V. 124. P. 243‒248.
Gómez-Basurto F., Vital-Jácome M., Gómez-Acata E.S., Thalasso F., Luna-Guido M., Dendooven L. Microbial community dynamics during aerobic granulation in a sequencing batch reactor (SBR) // PeerJ. 2019. V. 7. P. e7152.
Henze M., Harremoes P., La Cour Jansen J., Arvin E. Wastewater Treatment: Biological and Chemical Processes. 3rd ed. Berlin: Springer. 2002. P. 383.
Izadi P., Izadi P., Eldyasti A. Design, operation and technology configurations for enhanced biological phosphorus removal (EBPR) process: a review // Rev. Environ. Sci. Bio/Technol. 2020. V. 19. P. 561–593.
Jillavenkatesa A., Condrate Sr R.A. The infrared and Raman spectra of β-and α-tricalcium phosphate (Ca3(PO4)2) // Spectr. Lett. 1998. V. 31. P. 1619‒1634.
Lopez-Vazquez C.M., Oehmen A., Hooijmans C.M., Brdja-novic D., Gijzen H.J., Yuan Z., van Loosdrecht M.C.M. Modeling the PAO GAO competition: effects of carbon source, pH and temperature // Water Res. 2009. V. 43. P. 450‒462.
McMahon K.D., He S., Oehmen A. The microbiology of phosphorus removal // Microbial Ecology of Activated Sludge / Eds. Seviour R., Nielsen P.H. London: IWA, 2010. P. 668.
McIlroy S.J., Albertsen M., Andresen E.K., Saunders A.M., Kristiansen R., Stokholm-Bjerregaard, M., Nielsen P.H. “Candidatus Competibacter”-lineage genomes retrieved from metagenomes reveal functional metabolic diversity // ISME J. 2014. V. 8. P. 613‒624.
McIlroy S.J., Saunders A.M., Albertsen M., Nierychlo M., McIlroy B., Hansen A.A., Nielsen P.H. MiDAS: the field guide to the microbes of activated sludge // Database. 2015. V. 2015. P. 1‒8.
Penkov N.V. Relationships between molecular structure of carbohydrates and their dynamic hydration shells revealed by terahertz time-domain spectroscopy // Int. J. Mol. Sci. 2021. V. 22. P. 11969.
Rajesh Banu J., Merrylin J., Kavitha S., Yukesh Kannah R., Selvakumar P., Gopikumar S., Kumar G. Trends in biological nutrient removal for the treatment of low strength organic wastewaters // Curr. Pollut. Rep. 2021. V. 7. P. 1‒30.
Roy S., Guanglei Q., Zuniga-Montanez R., Williams R.B., Wuertz S. Recent advances in understanding the ecophysiology of enhanced biological phosphorus removal // Curr. Opin. Biotechnol. 2021. V. 67. P. 166‒174.
Standard methods for the examination of water and wastewater. American Public Health Association, American Water Works Association, Water Environment Federation / Eds. Rice E.W., Baird R.B., Eaton A.D. 23rd edn. Washington, D.C.: American Public Health Association, 2017. P. 1504.
Terashima M., Yama A., Sato M., Yumoto I., Kamagata Y., Kato S. Culture-dependent and -independent identification of polyphosphate-accumulating Dechloromonas spp. predominating in a full-scale oxidation ditch wastewater treatment plant // Microb. Environ. 2016. V. 31. P. 449–455.
Weissbrodt D.G., Neu T.R., Kuhlicke U., Rappaz Y., Holliger C. Assessment of bacterial and structural dynamics in aerobic granular biofilms // Front. Microbiol. 2013. V. 4. P. 175.
Zhang W., Silva S.R.P. Raman and FT-IR studies on dye-assisted dispersion and flocculation of single walled carbon nanotubes // Spectrochim. Acta Part A: Mol. Biomol. Spectrosc. 2010. V. 77. P. 175‒178.
Zhou J.H., Zhou Y.C., Yu H.C., Zhao Y.Q., Ye K.Q., Fang J.Y., Wang H.Y. Determining the effects of aeration intensity and reactor height to diameter (H/D) ratio on granule stability based on bubble behavior analysis // Environ. Sci. Pollut. Res. 2019. V. 26. P. 784‒796.
Дополнительные материалы отсутствуют.


