Микробиология, 2023, T. 92, № 1, стр. 3-13
Азафилоновые пигменты грибов как перспективные натуральные красители
Т. В. Антипова a, *, В. П. Желифонова a, К. В. Зайцев b, М. Б. Вайнштейн a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина
Российской академии наук – обособленное подразделение ФГБУН ФИЦ
“Пущинский научный центр биологических исследований РАН”
142290 Пущино, Россия
b Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: tantipova@ibpm.pushchino.ru
Поступила в редакцию 23.05.2022
После доработки 23.06.2022
Принята к публикации 23.06.2022
- EDN: NLPLKN
- DOI: 10.31857/S0026365622600432
Аннотация
Микроскопические грибы образуют и экскретируют многочисленные и разнообразные вторичные метаболиты, в том числе пигменты различной окраски, которые могут быть использованы как альтернатива применяемым в промышленности химическим и растительным красителям. Одним из перспективных классов грибных пигментов являются азафилоновые соединения, впервые обнаруженные у грибов рода Monascus. В обзоре дан анализ публикаций по образованию пигментов азафилонового типа у грибов Monascus, а также у Talaromyces и Aspergillus сavernicola. Приведены краткие сведения об антимикробной, противоопухолевой, противовоспалительной и гиполипидемической активностях азафилоновых пигментов. Обсуждены возможные стратегии повышения производительности процесса получения, а также направленного синтеза желтых, оранжевых и красных пигментов и их производных. В целом обзор позволяет оценить важность азафилоновых пигментов, перспективы и пути расширения их производства для применения в качестве натуральных красителей в различных областях.
На протяжении десятилетий в пищевой промышленности используют синтетические красители на основе азосоединений, которые получают путем диазотирования ароматических аминов (Benkhaya et al., 2020). Однако оказалось, что применение азокрасителей может провоцировать появление ряда заболеваний, включая онкологические (Al Reza et al., 2019). Кроме того, были обнаружены доказательства связи потребления искусственных пищевых красителей с аллергическими реакциями и поведенческими проблемами у детей (Bakthavachalu et al., 2020). Эти и другие проблемы, связанные со здоровьем, поставили перед пищевой промышленностью необходимость разработки новых составов на основе натуральных красителей для сохранения и обогащения цветовой палитры продуктов (Faustino et al., 2019). В последние годы мировой спрос на безвредные красители природного происхождения быстро растет как в пищевой и косметической промышленности, так и в текстильной отрасли (Kalra et al., 2020; Pimenta et al., 2021).
В настоящее время большинство используемых в промышленности натуральных красителей получают из растительных источников. Примерами могут служить корень свеклы Beta vulgaris (бетанин) или томат Solanum lycopersicum (ликопин). Производство таких растительных красителей сильно зависит от поставки сырых ингредиентов, которая подвержена сезонным колебаниям, как в отношении количества, так и качества. Вместе с этим существует независимый от сезонных колебаний биотехнологический источник природных пигментов – биомасса микроорганизмов, выращиваемая в реакторах.
Благодаря значительному генетическому разнообразию, микроорганизмы способны обеспечить чрезвычайно широкий спектр продуцируемых пигментов (Tuli et al., 2014). Выдано более 50 патентов по использованию микробных красителей пищевых продуктов в Японии, США, Франции и Германии. В настоящее время на рынке представлены несколько микробных пищевых красителей: пигменты Monascus, астаксантин из Xanthophyllomyces dendrorhous, “Арпинк ред” из Penicillium oxalicum, рибофлавин из Ashbya gossypii и β-каротин или ликопин из Blakeslea trispora (Dufossé, 2017). Возрастающий интерес представляют новые продуценты натуральных красителей. Известно, что мицелиальные грибы образуют и экскретируют многочисленные классы вторичных метаболитов, включая пигменты различной окраски, и поэтому они могут быть использованы как новые источники безопасных и стабильных пигментов (Lagashetti et al., 2019; Morales-Oyervides et al., 2020). Преимущество грибных пигментов, по сравнению с химическими и растительными, состоит в том, что при их производстве могут быть использованы отходы агропромышленного комплекса (Faustino et al., 2019). Разнообразие пигментов грибов проявляется не только в их химической структуре, но и в цветовой гамме, которая может добавлять новые или дополнительные оттенки к цветовой палитре существующих красителей.
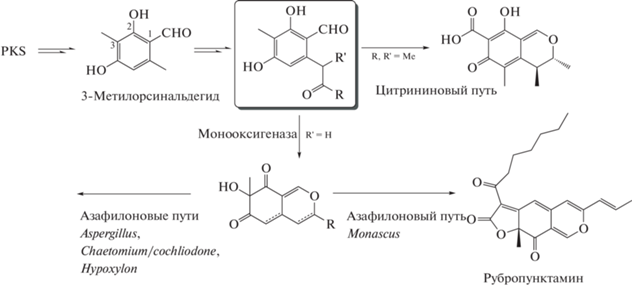
Одним из многообещающих классов грибных пигментов являются азафилоновые соединения, которые представляют собой вещества поликетидной природы, содержащие пиранохиноновое бициклическое ядро, хиральный четвертичный центр и гидроксильные группы в качестве заместителей (Chen et al., 2020; Pavesi et al., 2021; Liu, Wang, 2022). Традиционными продуцентами этих соединений являются грибы из рода Monascus (Patakova 2013; Vendruscolo et al., 2016; Chen et al., 2017). Эти грибы широко используются в странах Юго-Восточной Азии в течение почти двух тысяч лет в качестве натурального пищевого красителя, консерванта, а также в народной медицине для улучшения пищеварения и как болеутоляющее (Shiб Pan, 2011; Chen et al., 2015). Например, красный ферментированный рис (“кодзи”, “ан-ка”, “ангкак”), приобретающий свой цвет после культивирования с грибом Monascus purpureus, применяется в качестве ценного терапевтического средства (Klimek et al., 2009). К настоящему времени азафилоновые соединения описаны у 61 рода грибов. К. Павези и соавт. выделили 5 основных биосинтетических путей, приводящих к образованию азафилоновых пигментов (Pavesi et al., 2021). Четыре из них были названы по продуцентам – азафилоновые пути Monascus, Aspergillus, Chaetomium, Hypoxylon, и один по конечному продукту – цитрининовый путь. Все основные биосинтетические пути имеют общее происхождение (рис. 1). Поликетидсинтазой (PKS) синтезируется общее промежуточное соединение 3-метилорсинальдегид, который с помощью ферментативных реакций преобразуется в цитринин, либо гидроксилируется монооксигеназой с образованием пиранохинонового ядра, общего для остальных азафилоновых путей.
Рис. 1.
Схема основных биосинтетических путей образования азафилоновых пигментов (Pavesi et al., 2021).
C точки зрения получения натуральных пищевых красителей наиболее интересны и перспективны пигменты, образуемые азафилоновым путем Monascus. Термины “азафилоновый путь Monascus” и “Monascus-подобные пигменты” исторически закрепились в связи с тем, что эти пигменты впервые были обнаружены у грибов данного рода, однако впоследствии такие пигменты были обнаружены и у грибов других родов.
В настоящем обзоре приводятся современные данные о пигментах, образуемых различными грибами по азафилоновому пути Monascus (МП), биологической активности пигментов и о факторах, влияющих на процесс ферментации и цветовую палитру полученных продуктов.
АЗАФИЛОНЫ ГРИБОВ РОДА MONASCUS
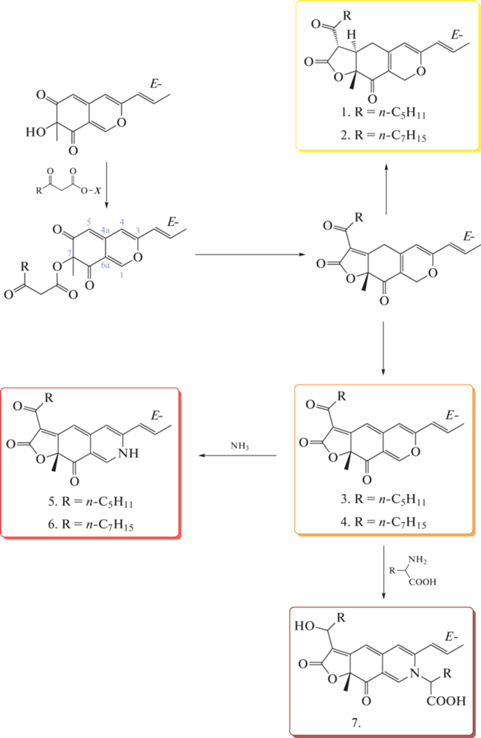
В настоящее время у Monascus идентифицировано около сотни различных азафилоновых соединений (Chen et al., 2017). Существует шесть наиболее известных МП трех цветов: желтого (анкафлавин и монаскин), оранжевого (монаскорубрин и рубропунктатин) и красного (монаскорубрамин и рубропунктамин) (Liu et al., 2018; Pavesi et al., 2021). Эти пигменты образуются с помощью азафилонового пути Monascus, при котором исходный поликетид пиранохинон в результате этерификации, восстановления и региоселективной конденсации Кнёвенагеля с последующим восстановлением преобразуется в трициклический продукт, содержащий лактон (рис. 2). Восстановление фуранонового кольца трициклического продукта приводит к образованию анкафлавина и монаскина, либо в результате окисления связи С4а‒С5 FAD-зависимой оксиредуктазой синтезируются оранжевые пигменты рубропуктатин и монаскорубрин (Сhen et al., 2017). Из этих оранжевых пигментов в результате прямой реакции с эндогенным аммонием или с основными аминокислотами, такими как аргинин, образуются красные пигменты рубропунктамин и монаскорубрамин. Из-за нуклеофильного характера непротонированной аминогруппы для замены в этой реакции O на N более благоприятны щелочные условия. Известно 42 различных красных пигмента, большинство из которых были получены в результате неферментативной реакции рубропуктатина и монаскорубрина с различными аминокислотами. Производные пигментов с аминокислотными остатками (ППА) имели более высокую растворимость в воде и термическую стабильность (Wong, Koehler, 1983; Jung et al., 2003). При этом заметно повышалась фотостабильность пигментов в условиях облучения солнечным светом и устойчивость при нейтральной кислотности среды, что делает полученные ППА потенциальными пищевыми красителями (Liu et al., 2018).
Рис. 2.
Биосинтетический путь образования пигментов у Monascus (Chen et al., 2017): 1 – монасцин, 2 – анкафлавин, 3 – рубропунктатин, 4 – монаскорубрин, 5 – рубропунктамин, 6 – монаскорубрамин, 7 – производные пигментов с аминокислотами.
Кроме указанных шести основных МП при различных условиях культивирования у Monascus были выделены минорные желтые пигменты, такие как ксантомонасины, монаскопиридины, монаскусоны, монасникатинаты, монасфлуоны, монапирпиридин А и др. Некоторые из этих минорных пигментов могут быть интермедиатами в биосинтетическом пути или продуктами разложения основных пигментов (Patakova, 2013). Продукция микотоксина цитринина также известна для Monascus (Blanc et al., 1995; Sabater-Vilar et al., 1999). Было показано, что у этих грибов продукция пигментов и цитринина регулируется общим сигнальным белком G, который играет ключевую роль в образовании вторичных метаболитов. В настоящее время в промышленности используются мутанты штаммов Monascus, которые утратили способность синтезировать микотоксин. Тем не менее, в США и ряде европейских стран использование продуктов жизнедеятельности этих грибов в качестве пищевых красителей по-прежнему не разрешено из-за возможного присутствия цитринина и другого нежелательного соединения ‒ статина мевинолина, неконтролируемый прием которого может привести к побочным эффектам.
АЗАФИЛОНЫ ГРИБОВ РОДА PENICILLIUM И TALAROMYCES
Недавно отдельные представители родов Talaromyces и Penicillium были признаны потенциально пригодными для промышленного производства природных пигментов, подобных тем, которые продуцируют виды Monascus (Mapari et al., 2009; Morales-Oyervides et al., 2020). Известно по меньшей мере несколько видов грибов Talaromyces и Penicillium, способных образовывать такие пигменты. По данным филогении виды грибов Talaromyces высоко гомологичны видам Penicillium. Гомология между видами Penicillium и Monascus намного ближе, чем между видами Talaromyces и Monascus (Liu et al., 2018). Ряд авторов объясняет появление азафилоновых пигментов Monascus у грибов других родов горизонтальным переносом генов, ответственных за биосинтез этих соединений, при этом организация и содержание генов могут различаться в зависимости от эволюционных перестроек (Chen et al., 2019).
У гриба T. marneffei были обнаружены оранжевые пигменты монаскорубрин и рубропунктатин и их аминокислотные конъюгаты красного цвета (Woo et al., 2014). Однако T. marneffei ‒ диморфный гриб, образующий дрожжеподобные клетки, может вызывать серьезные микозы у людей с нарушенным иммунитетом, в частности, у больных СПИДом. Поэтому применение этого гриба и его продуктов в пищевой промышленности запрещено.
Грибы T. purpurgenum образуют большое количество окрашенных соединений, относящихся к монаскоподобным пигментам (Ogihara et al., 2000; Mapari et al., 2006; Frisvad et al., 2013). Некоторые из этих пигментов были структурно охарактеризованы, среди них фиолетовый пигмент PP-V (10Z)-12-карбоксимонаскорубрамин и оранжевый пигмент PP-O (10Z)-12-карбоксимонаскорубрин (Arai et al., 2015). Новая серия азафилоновых пигментов, названных атророзины, недавно была выделена из гриба T. atroroseus (Isbrandt et al., 2020). Атророзины А-Y имели такое же азафилоновое ядро и карбоксильную группу при С1 как и PP-O, их изохроменовая система также может включать аминокислоты. Несмотря на то, что предшественник атророзина PP-О во время культивирования первоначально был получен в виде смеси двух изомеров (соотношение цис : транс равно 3 : 2), атророзины образовывались исключительно как цис-диастереомер (99.5%), возможно, из-за стерических взаимодействий с включенной аминокислотой.
T. purpurogenum интересен с точки зрения промышленного получения пищевых пигментов, но у этих грибов также встречаются цитотоксичные соединения рубратоксины А и В и лютеоскирин (Frisvad et al., 2013). T. atroroseus вместе с оранжевыми пигментами Monascus образует миторубрин – азафилоновое соединение, не содержащее кольцо лактона в структуре. Т. atroroseus рассматривается как потенциальный штамм для замещения Monascus sp. при производстве пигментов (Mapari et al., 2009).
Склеротиорин и ротиорин (как и монаскорубрин) являются сходными представителями класса кислородсодержащих гетероциклических соединений. При этом склеротиорин и ротиорин были выделены из культуры P. sclerotiorum, путем твердофазной ферментации, а также в жидкой культуре при стационарном культивировании (Curtin et al., 1940; Jackman et al., 1958). Склеротиорин представлял собой желтое аморфное вещество, а ротиорин был выделен в виде длинных красных игл. Ротиорин имеет трициклическую структуру с линейным лактонным кольцом, подобную пигментам Monascus. С помощью каскадных реакций ротиорина с первичными аминами, используя фосфаты как катализатор, в погруженной культуре были получены несколько производных ротиорина (Wu et al., 2021). Их рассматривают как альтернативный источник натуральных красителей вместо традиционных пигментов Monascus. Однако крупномасштабное производство минорного метаболита ротиорина при погруженном культивировании остается сложным и экономически невыгодным процессом (Liu, Wang, 2022).
АЗАФИЛОНЫ ГРИБОВ РОДА ASPERGILLUS
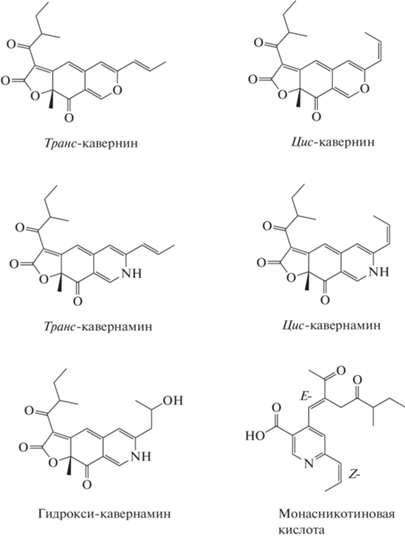
Многообещающим и безопасным источником природных красных пигментов могут быть грибы вида Aspergillus cavernicola. У них были обнаружены красные пигменты цис- и транс-кавернамины и их предшественники – оранжево-желтые пигменты кавернины (рис. 3) (Petersen et al., 2020). В экстракте A. cavernicola содержался также красный азафилоновый пигмент гидрокси-кавернамин. Эти метаболиты содержат изобутильный фрагмент в отличие от n-пентильных и n-гептильных фрагментов у пигментов Monascus. Относительно более короткая и разветвленная хвостовая часть структуры способствует лучшему растворению этих пигментов в воде по сравнению с монаскоподобными. В недавно опубликованном изобретении (Petersen et al., 2020) предлагается также способ получения отдельных азафилоновых пигментов путем ферментации A. cavernicola в жидкой среде с добавлением различных аминокислот, пептидов, аминосахаров и других первичных аминов в качестве источников азота. В результате реакции нуклеофильного замещения по RN-группе оранжевых пигментов под действием соответствующих аминов получают различные производные красного цвета. Можно предположить, что эти производные обладают лучшими характеристиками для использования в качестве пищевых красителей. Кроме того, у одного из штаммов A. cavernicola был выделен метаболит − монасникотиновая кислота (МНК) (Antipova et al., 2018; 2022). МНК по структуре близка монасникотинатам, монапирпиридину А и монаксопиридинам, ранее обнаруженных у грибов рода Monascus. При этом МНК в нейтральных условиях – бесцветное соединение, но из-за кето-енольной таутомерии в кислых условиях приобретает желтоватое окрашивание (Рысцов и соавт., 2021).
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЗАФИЛОНОВ
Азафилоновые пигменты представляют собой класс соединений, обладающих разнообразной биологической активностью. Имеются многочисленные данные об антимикробной, противовирусной, цитотоксичной активностях монаскоподобных пигментов, также они могут действовать как ингибиторы различных ферментов (Osmanova et al., 2010; Liu et al., 2018; Pimenta et al., 2021).
Оранжевые пигменты монаскорубрин и рубропунтатин, в отличие от красных пигментов монаскорубрамина и рубропунктамина обладают антимикробной активностью в отношении Bacillus subtilis, Escherichia coli, некоторых мицелиальных грибов и дрожжей (Martinkova et al., 1995). Более того, полученные производные красных пигментов с аминокислотами, имеющих фенильное кольцо (D-,L-фенилаланин и D-,L-тирозин), показали высокую антимикробную активность против бактерий (4‒8 мкг/мл); кроме того, грамположительные бактерии были более восприимчивы к ингибированию, чем грамотрицательные бактерии, а лекарственная устойчивость Lactobacillus была незначительной (Kim et al., 2006). Производные с D-,L-аспарагином и D-,L-тирозином были эффективны против Candida albicans и мицелиальных грибов A. niger и P. citrinum. Антимикробную активность ППА связывают со снижением доступности кислорода для клеток из-за адсорбции пигментов клеточными стенками бактерий. Интересно отметить, что ППА также ингибировали репликацию вируса гепатита C за счет снижения активностей вирусной РНК-полимеразы и пути биосинтеза мевалоната (Sun et al., 2012). Производное 2-амино-4-пиколина in vitro значительно ингибировало продукцию оксида азота и показало низкую цитотоксичность, что позволяет рассматривать это соединение в качестве потенциального пищевого красителя с противовоспалительным эффектом (Choe et al., 2020).
Для желтых пигментов Monascus, таких как анкафлавин (Su et al., 2005), монасцин (Akihisa et al., 2005), монаскуспилоин (Camphausen et al., 2012), монапурпиридин А (Hsu et al., 2012) и монафилоны А (Hsu et al., 2010), и для водорастворимых желтых пигментов (Tan et al., 2018) показана противоопухолевая активность по отношению к различным клеточным линиям рака. Было обнаружено, что анкафлавин в синергизме с монаколином К ингибировали пролиферацию и индуцировали апоптоз в клетках LCC рака легкого мыши (Ho, Pan, 2009). Обработка клеток HeLa рубропунктатином в темноте или при световом облучении приводила к дозозависимому апоптозу по митохондриальному пути, включая потерю потенциала митохондриальной мембраны, активацию каспазы-3, каспазы-8 и каспазы-9 и увеличение уровня внутриклеточных активных форм кислорода. Индуктивный эффект апоптоза клеток HeLa усиливался при световом излучении (Zheng et al., 2016). Изучение противоопухолевой активности монасникотиновой кислоты показало, что она снижает пролиферацию и миграцию клеток рака простаты LnCaP и ингибирует сигнальные пути AKT-mTORC1 и FAK-Src (Рысцов и соавт., 2021). МНК является перспективным соединением для получения различных производных с более высокой степенью противоопухолевой активности.
МП и ППА способны ингибировать разные ферменты и потому могут использоваться для профилактики и лечения различных заболеваний (атеросклероз, ожирение и др.). Гиполипидемический механизм МП заключается, в основном, в снижении уровня липидов в крови и в предотвращении атеросклероза за счет увеличения холестерина липопротеинов высокой плотности (ЛВП) или снижения уровня холестерина липопротеинов низкой плотности (ЛНП) (Liu et al., 2018). Mонасцин и анкафлавин снижали уровень ЛНП и сохраняли содержание ЛВП. Эти пигменты ингибировали экспрессию ацетил-коэнзима А-ацетилтрансферазы, микросомального белка-переносчика триацилглицеринов и апопротеина B-100, тем самым предотвращая сборку ЛНП (Lee et al., 2018). Эфир-холестерин-переносящий белок (CETP), ингибирование которого помогает поддерживать высокий уровень холестерина ЛВП в крови, является мишенью для лечения атеросклероза. ППА оказывали ингибирующее действие на CETP, среди которых производные L-Thr и L-Tyr проявляли самую высокую ингибирующую активность (IC50 1.0 и 2.3 мкМ соответственно) (Jang et al., 2014).
Ингибиторы протеин-тирозин фосфатазы типа 1B (РТР1В) используют для лечения метаболического синдрома и для терапии онкологических заболеваний. Скрининг потенциальных ингибиторов PTP1B из красного риса показал, что монаскорубрамин проявлял селективную ингибирующую активность в отношении РТР1В (Jin et al., 2016). Монасникотинаты действуют как агонисты PPARγ (рецепторы, активирующие пролиферацию пероксисом) и могут использоваться для профилактики и/или лечения резистентности к инсулину при сахарном диабете 2 типа (Wu et al., 2018).
БИОТЕХНОЛОГИЯ ПОЛУЧЕНИЯ МП
За последнее десятилетие многие исследования были сосредоточены на оптимизации процесса биотехнологического производства МП. Было разработано несколько методов повышения производительности и цветовой гаммы МП, включая скрининг и мутагенез штаммов, иммобилизацию микробных клеток, нокаут генов, получение рекомбинантных штаммов и оптимизацию условий культивирования. Благодаря проведенным исследованиям, были выявлены факторы, влияющие на процесс ферментации и выход продуктов: способ культивирования, состав питательных сред (источник углерода и азота, соотношение C/N, кофакторы, поверхностно-активные вещества, промежуточные соединения цикла трикарбоновых кислот), тип и возраст инокулята (споры и мицелий), температура, рН, уровень кислорода и скорость перемешивания, свет, влажность, а также экстракция и очистка пигментов (Chen et al., 2020; Karla et al., 2020; Morales-Oyervides et al., 2020; Pavesi et al., 2021). Описания основных методов, повышающих производительность процессов получения пигментов и регуляции их цвета, сосредоточены в нескольких областях.
Одним из подходов является оптимизация процесса путем подбора наиболее эффективных углеродных субстратов. Грибы Monascus выращивали в средах с разными источниками углерода: сахароза, мальтоза, глицерин, лактоза, глюкоза и т.д. При использовании глицерина M. purpureus продуцировал значительные количества желтых и красных пигментов, количество которых увеличивалось с повышением концентрации субстрата (Shi et al., 2021). На уровне экспрессии генов показано, что это связано с образованием в процессе гликолиза и метаболизма углерода большого количества предшественников, участвующих в биосинтезе пигментов. При этом биомасса грибов и биосинтез пигментов штаммами Monascus достигали максимальных значений при отношении углерода к азоту 9 : 1. Продукция пигментов и условия проведения процесса сильно зависят от того, осуществляется ли культивирование в жидкой среде или на твердом субстрате (Johns, Stuart, 1991; Embaby et al., 2018). Другим важным подходом является удешевление себестоимости конечной продукции за счет использования максимально дешевых субстратов – отходов сельского хозяйства и связанных с ним производств (Bühler et al., 2013; Liu et al., 2020; Asghari et al., 2021; Chen et al., 2021).
Производство пигментов определенной цветовой гаммы выгодно, поскольку это устраняет этапы разделения пигментов нужного цвета на стадии очистки и выделения. Поэтому еще одним подходом является получение на стадии культивирования чистых экстрактов, преимущественно одного цвета, содержащих меньшее количество ненужных веществ (Venil et al., 2020). Цвет пигментов, продуцируемых грибами, зависит от источника азота и рН среды (Shi et al., 2015). У Monascus нитратная форма азота способствовала образованию только оранжевых и желтых пигментов. Аммонийная форма азота, аминокислоты, первичные амины, аминосахара и др. были наиболее благоприятны для биосинтеза красных пигментов у Monascus, Talaromyces и Aspergillus (Pimenta et al., 2020). Показано, что цвет и продукция пигментов, продуцируемых грибами, зависит от рН среды культивирования. Наибольшая продукция красных и желтых пигментов M. purpureus была получена при исходной величине рН 5.0 (Agboyibor et al., 2019). В кислых условиях у M. ruber и M. anka были получены преимущественно оранжевые и желтые компоненты (Li et al., 2019). Пигменты с различными оттенками синтезировались T. amestolkiae DPUA 1275 в зависимости от начального значения pH среды. В нейтральных и щелочных условиях синтезировались темно-желтые пигменты, а пигменты темно-красного цвета были получены в кислых условиях (Oliveira et al., 2019).
Интересным направлением биотехнологических исследований являются работы по стимулированию образования пигментов грибами при окислительном стрессе. В качестве мягко воздействующего фактора рассматривают облучение голубой или даже ультрафиолетовой частью спектра (Chen et al., 2017). По данным (Huang et al., 2017) при окислительном стрессе, вызванным H2O2, наблюдалось увеличение накопления водорастворимого желтого пигмента. Авторы показали, что это повышение происходило за счет усиления экспрессии соответствующих генов и за счет увеличения количества предшественников биосинтеза пигмента. Сходным примером в развитии метода стимуляции образования пигментов окислителями является работа, где добавление в среду перекисных солей увеличивало продукцию каротиноидных пигментов у принципиально другой группы грибов (красных дрожжей Rhodosporidium sphaerocarpum и R. diobovatum) на 130‒140% по сравнению с контролем (Ячкула и соавт., 2021). Стратегии кофакторной метаболической инженерии, такие как добавление экзогенных кофакторов, обеспечение электролитной стимуляции во время погруженного культивирования, инактивация NADH-хиноноксидоредуктазы у M. purpureus увеличивало образование желтого пигмента (Liu et al., 2021).
ЗАКЛЮЧЕНИЕ
Азафилоновые пигменты грибов Monascus могут широко применяться в пищевой, косметической, медицинской и текстильной промышленности в качестве безвредных натуральных красителей. Более того, многие из этих соединений и их производных обладают функциональной физиологической активностью и могут стать отличным ресурсом для проектирования и разработки новых терапевтических средств в будущем. В качестве альтернативных источников монаскоподобных пигментов, помимо представителей рода Monascus, в обзоре рассмотрены грибы Talaromyces и A. сavernicola, которые не синтезируют микотоксин (цитринин) и могут безопасно использоваться в крупномасштабном производстве.
Показано, что в результате простой реакции нуклеофильного замещения в оранжевых пигментах с соответствующими аминами можно получать разнообразные красные пигменты, в том числе такие, которые обладают не только улучшенными характеристиками для использования в качестве пищевых красителей (лучшей растворимостью, фотостабильностью и др.), но и большей функциональной активностью для их возможного терапевтического применения. В связи с этим разработка и конструирование новых пигментов для новых стратегий лечения болезней, в особенности онкологических, должны быть ориентированы на детальное определение химической структуры и механизма действия, лежащего в основе фармакологической активности.
Биотехнологические исследования последних десятилетий выявили несколько факторов, влияющих на процесс получения азафилоновых пигментов грибами. Подбор подходящих условий для культивирования, например, источников азота и рН среды культивирования, позволяет задавать соотношения продуцируемых красных и желтых пигментов. Использование дешевого растительного сырья или его отходов позволяет существенно снижать себестоимость продукции. В целом, грибы, продуцирующие азафилоновые соединения, являются надежной промышленной основой для эффективного биосинтеза пигментов определенной цветовой гаммы.
Список литературы
Рысцов Г.К., Антипова Т.В., Зайцев К.В., Земскова М.Ю. Противоопухолевая активность монасникотиновой кислоты, выделенной из гриба Aspergillus cavernicola // Биоорганическая химия. 2021. Т. 47. Р. 162‒172.
Rystsov G.K., Antipova T.V., Zaitsev K.V., Zemskova M.Y. Antitumor activity of monasnicotinic acid isolated from the fungus Aspergillus cavernicola // Russ. J. Bioorg. Chem. (Moscow). 2021. V. 47. P. 307–316. https://doi.org/10.1134/S1068162021010209
Ячкула А.А., Делеган Я.А., Антипова Т.В., Вайнштейн М.Б. Действие персульфатов на накопление красных каротиноидов в культурах дрожжей: Rhodosporidium sphaerocarpum, R. diobovatum и Rhodotorula glutinis // Биотехнология. 2021. Т. 37. № 3. С. 20–28. https://doi.org/10.21519/0234-2758-2021-37-3-20-28
Agboyibor C., Kong W.-B., Zhang A.-M., Niu S.-Q. Nutrition regulation for the production of Monascus red and yellow pigment with submerged fermentation by Monascus purpureus // Biocatal. Agric. Biotechnol. 2019. V. 21. P. 101276. https://doi.org/10.1016/j.bcab.2019.101276
Akihisa T., Tokuda H., Ukiya M., Kiyota A., Yasukawa K., Sakamoto N., Kimura Y., Suzuki T., Takayasu J., Nishino H. Anti-tumor-initiating effects of monascin, an azaphilonoid pigment from the extract of Monascus pilosus fermented rice (red-mold rice) // Chem. Biodivers. 2005. V. 2. P. 1305–1309. https://doi.org/10.1002/cbdv.200590101
Al Reza M.S., Hasan M.M., Kamruzzaman M., Hossain M.I., Zubair M.A., Bari L., Abedin M.Z., Reza M.A., Khalid-Bin-Ferdaus K.M., Haque K.M.F., Islam K., Ahmed M.U., Hossain M.K. Study of a common azo food dye in mice model: Toxicity reports and its relation to carcinogenicity // Food Sci. Nutr. 2019. V. 7. P. 667–677. https://doi.org/10.1002/fsn3.906
Antipova T.V., Zaitsev K.V., Zherebker A.Ya., Tafeenko V.A., Baskunov B.P., Zhelifonova V.P., Ivanushkina N.E., Kononikhin A.S., Nikolaev E.N., Kozlovsky A.G. Monasnicotinic acid, a novel pyridine alkaloid of the fungus Aspergillus cavernicola: isolation and structure establishment // Mendeleev Commun. 2018. V. 28. № 1. P. 55‒57. https://doi.org/10.1016/j.mencom.2018.01.018
Antipova Т.V., Zhelifonova V., Zaitsev K.V., Zherebker A., Baskunov B., Oprunenko Y.F. Formation of azaphilone pigments and monasnicotinic acid by the fungus Aspergillus cavernicola // J. Agric. Food Chem. 2022. V. 70. P. 7122–7129. https://doi.org/10.1021/acs.jafc.2c01952
Arai T., Kojima R., Motegi Y., Kato J., Kasumi T., Ogihara J. PP-O and PP-V, Monascus pigment homologues, production, and phylogenetic analysis in Penicillium purpurogenum // Fungal Biol. 2015. V. 119. P. 1226‒1236. https://doi.org/10.1016/j.funbio.2015.08.020
Asghari M., Jahadi M., Hesam F., Ghasemi-Sepro N. Optimization of Monascus pigment production on date waste substrates using solid state fermentation // Appl. Food Biotechn. 2021. V. 8. P. 247‒254. https://doi.org/10.22037/afb.v8i3.34278
Bakthavachalu P., Kannan S.M., Qoronfleh M.W. Food color and autism: a meta-analysis // Personalized Food Intervention and Therapy for Autism Spectrum Disorder Management. Advances in Neurobiology / Eds. Essa M.M., Qoronfleh M.W. Berlin‒Heidelberg, Germany: Springer, 2020. V. 24. P. 481‒504. https://doi.org/10.1007/978-3-030-30402-7_15
Benkhaya S., M’rabet S., El Harfi A. Classifications, properties, recent synthesis and applications of azo dyes // Heliyon. 2020. V. 6. P. e03271. https://doi.org/10.1016/j.heliyon.2020.e03271
Blanc P.J., Loret M.O., Goma G. Production of citrinin by various species of Monascus // Biotechnol. Lett. 1995. V. 17. P. 291–294.
Bühler R.M.M., Dutra A.C., Vendruscolo F., Moritz D.E., Ninow J.L. Monascus pigment production in bioreactor using a co-product of biodiesel as substrate // Food Sci. Technol. 2013. V. 33. Suppl. 1. P. 9‒13. https://doi.org/10.1590/S0101-20612013000500002
Camphausen K., Chiu H.W., Fang W.H., Chen Y.L., Wu M.D., Yuan G.F., Ho S.Y., Wang Y.J. Monascuspiloin enhances the radiation sensitivity of human prostate cancer cells by stimulating endoplasmic reticulum stress and inducing autophagy // PLoS One. 2012. V. 7. P. e40462. https://doi.org/10.1371/journal.pone.0040462
Chaudhary V., Katyal P., Poonia A. K., Kaur J., Puniya A.K., Panwar H. Natural pigment from Monascus: the production and therapeutic significance // J. Appl. Microbiol. 2021. P. 1–21. https://doi.org/10.1111/jam.15308
Chen Ch., Tao H., Chen W., Yang B., Zhou X., Luo X., Liu Y. Recent advances in the chemistry and biology of azaphilones // RSC Adv. 2020. V. 10. P. 10197‒10220. https://doi.org/10.1039/D0RA00894J
Chen W., Chen R., Liu Q., He Yi., He K., Ding X., Kang L., Guo X., Xie N., Zhou Y., Lu Y., Cox R.J., Molnár I., Li M., Shaoa Y., Chen F. Orange, red, yellow: biosynthesis of azaphilone pigments in Monascus fungi // Chem. Sci. 2017. V. 8. P. 4917–4925.
Chen W., Feng Y., Molnár I., Chen F. Nature and nurture: confluence of pathway determinism with metabolic and chemical serendipity diversifies: Monascus azaphilone pigments // Nat. Prod. Rep. 2019. V. 36. P. 561‒572. https://doi.org/10.1039/c8np00060c
Chen W., He Y., Zhou Y., Shao Y., Feng Y., Li M., Chen F. Edible filamentous fungi from the species Monascus: early traditional fermentations, modern molecular biology, and future genomics // Compr. Rev. Food Sci. Food Saf. 2015. V. 14. P. 555–567.
Chen X., Yan J., Chen J., Gui R., Wu Y., Li N. Potato pomace: An efficient resource for Monascus pigments production through solid-state fermentation // J. Biosci. Bioeng. 2021. V. 132. P. 167‒173. https://doi.org/10.1016/j.jbiosc.2021.03.007
Choe D., Song S.M., Shin C.S., Johnston T.V., Ahn H.J., Kim D., Ku S. Production and characterization of anti-inflammatory Monascus pigment derivatives // Foods. 2020. V. 9. P. 858.https://doi.org/10.3390/foods9070858
Curtin T.P., Reilly J. Sclerotiorine, C20H20O5Cl, a chlorinecontaining metabolitic product of Penicillium sclerotiorin van Beyma // Biochem. J. 1940. V. 34. P. 1418–1421.
Dufossé L. Pigments, microbial // Encyclopedia of Microbiology (4th ed). 2019. P. 579‒594. https://doi.org/10.1016/B978-0-12-809633-8.13091-2
Embaby A.M., Hussein M.N., Hussein A. Monascus orange and red pigments production by Monascus purpureus ATCC16436 through co-solid state fermentation of corn cob and glycerol: An eco-friendly environmental low cost approach // PLoS One. 2018. V. 13. P. e0207755. https://doi.org/10.1371/journal.pone.0207755
Faustino M., Veiga M., Sousa P., Costa E. M., Silva S., Pintado M. Agro-food byproducts as a new source of natural food additives // Molecules. 2019. V. 24. P. 1056. https://doi.org/10.3390/molecules24061056
Frisvad J.C., Yilmaz N., Thrane U., Rasmussen K.B., Houbraken J., Samson R.A. Talaromyces atroroseus, a new species efficiently producing industrially relevant red pigments // PLoS One. 2013. V. 8. P. e84102. https://doi.org/10.1371/journal.pone.0084102
Ho B.Y., Pan T.M. The Monascus metabolite monacolin K reduces tumor progression and metastasis of Lewis lung carcinoma cells // J. Agric. Food Chem. 2009. V. 57. P. 8258–8265.
Hsu L.C., Hsu Y.W., Liang Y.H., Liaw C.C., Kuo Y.H., Pan T.M. Induction of apoptosis in human breast adenocarcinoma cells MCF-7 by monapurpyridine A, a new azaphilone derivative from Monascus purpureus NTU 568 // Molecules. 2012. V. 17. P. 664–673.
Hsu Y.W., Hsu L.C., Chang C.L., Liang Y.H., Kuo Y.H., Pan T.M. New anti-inflammatory and anti-proliferative constituents from fermented red mold rice Monascus purpureus NTU 568 // Molecules. 2010. V. 15. P. 7815–7824.
Huang T., Tan H.L., Lu F.J., Chen G., Wu Z.Q. Changing oxidoreduction potential to improve water-soluble yellow pigment production with Monascus ruber CGMCC 10910 // Microb. Cell Fact. 2017. V. 16. P. 208. https://doi.org/10.1186/s12934-017-0828-0
Isbrandt T., Tolborg G., Ødum A., Workman M., Larsen T.O. Atrorosins: a new subgroup of Monascus pigments from Talaromyces atroroseus // Appl. Microbiol. Biotechn. 2020. V. 104. P. 615–622.
Jackman G.B., Robertson A., Travers R.B., Whalley W.B. The chemistry of fungi. Part XXXIV. Rotiorin, a metabolite of Penicillium sclerotiorum van Beyma // J. Chem. Soc. 1958. V. 372. P. 1825–1832.
Jang H., Choe D., Shin C.S. Novel derivatives of Monascus pigment having a high CETP inhibitory activity // Nat. Prod. Res. 2014. V. 28. P. 1427‒1431. https://doi.org/10.1080/14786419.2014.905561
Jin Y., Cheng X., Jiang F., Guo Z., Xie J., Fu L. Application of the ultrafiltration-based LC-MS approach for screening PTP1B inhibitors from Chinese red yeast rice // Anal. Methods. 2016. V. 8. P. 353–361. https://doi.org/10.1039/C5AY01767J
Johns M.R., Stuart D.M. Production of pigments by Monascus purpureus in solid culture // J. Ind. Microbiol. 1991. V. 8. P. 23–28. https://doi.org/10.1007/BF01575587
Jung H., Kim C., Kim K., Shin C.S. Color characteristics of Monascus pigments derived by fermentation with various amino acids // J. Agric. Food Chem. 2003. V. 51. P. 1302–1306. https://doi.org/10.1021/jf0209387
Kalra R., Conlan X.A., Goel M. Fungi as a potential source of pigments: harnessing filamentous fungi // Front Chem. 2020. V. 8. P. 369. https://doi.org/10.3389/fchem.2020.00369
Kim C., Jung H., Kim Y.O., Shin S.C. Antimicrobial activities of amino acid derivatives of monascus pigments // FEMS Microbiol. Lett. 2006. V. 264. P. 117–124. https://doi.org/10.1111/j.1574-6968.2006.00451.x
Klimek M., Wang S., Ogunkanmi A. Safety and efficacy of red yeast rice (Monascus purpureus) as an alternative therapy for hyperlipidemia // P & T. 2009. V. 34. P. 313–327.
Lagashetti A.C., Dufossé L., Singh S.K., Singh P.N. Fungal pigments and their prospects in different industries // Microorganisms. 2019. V. 7. P. 604. https://doi.org/10.3390/microorganisms7120604
Lee C.L., Wen J.Y., Hsu Y.W., Pan T.M. The blood lipid regulation of Monascus-produced monascin and ankaflavin via the suppression of low-density lipoprotein cholesterol assembly and stimulation of apolipoprotein A1 expression in the liver // J. Microb. Immun. Infection. 2018. V. 51. P. 27‒37. https://doi.org/10.1016/j.jmii.2016.06.003
Li L., Chen S., Gao M., Ding B., Zhang J., Zhou Y., Liu Y., Yang H., Wu Q., Chen F. Acidic conditions induce the accumulation of orange Monascus pigments during liquid-state fermentation of Monascus ruber M7 // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 8393–8402.
Liu J., Luo Y., Guo T., Tang C., Chai X., Zhao W., Bai J., Lin Q. Cost-effective pigment production by Monascus purpureus using rice straw hydrolysate as substrate in submerged fermentation // J. Biosci. Bioeng. 2020. V. 129. P. 229‒236. https://doi.org/10.1016/j.jbiosc.2019.08.007
Liu J., Wu J., Cai X., Zhang C. Liang Y., Lin Q. Regulation of secondary metabolite biosynthesis in Monascus purpureus via cofactor metabolic engineering strategies // Food Microbiol. 2021. V. 95. P. 103689. https://doi.org/10.1016/j.fm.2020.103689
Liu L., Wang Z. Azaphilone alkaloids: prospective source of natural food pigments // Appl. Microbiol. Biotechnol. 2022. V. 106. P. 469–484. https://doi.org/10.1007/s00253-021-11729-6
Liu L., Zhao J., Huang Y., Xin Q., Wang Z. Diversifying of chemical structure of native Monascus pigments // Front. Microbiol. 2018. V. 9. P. 1‒12. https://doi.org/10.3389/fmicb.2018.03143
Mapari S.A., Meyer A.S., Thrane U., Frisvad J.C. Identification of potentially safe promising fungal cell factories for the production of polyketide natural food colorants using chemotaxonomic rationale // Microb. Cell Fact. 2009. V. 8. P. 24. https://doi.org/10.1186/1475-2859-8-24
Mapari S.A.S., Meyer A.S., Thrane U. Colorimetric characterization for comparative analysis of fungal pigments and natural food colorants // J. Agric. Food Chem. 2006. V. 54. P. 7028–7035. https://doi.org/10.1021/jf062094n
Martínková L., Jzlová P., Veselý D. Biological activity of polyketide pigments produced by the fungus Monascus // J. Appl. Microbiol. 2008. V. 79. № 6. P. 609 – 616.
Morales-Oyervides L., Ruiz-Sánchez J.P., Oliveira J.C., Sousa-Gallagher M.J., Méndez-Zavala A., Giuffrida D., Dufossé L., Montañez J. Biotechnological approaches for the production of natural colorants by Talaromyces/Penicillium: a review // Biotechnol. Adv. 2020. V. 43. P. 107601. https://doi.org/10.1016/j.biotechadv.2020.107601
Ogihara J., Kato J., Oishia K., Fujimoto Y. Biosynthesis of PP-V, a monascorubramine homologue, by Penicillium sp. AZ // J. Biosci. Bioeng. 2000. V. 90. P. 678‒680. https://doi.org/10.1016/S1389-1723(00)90017-3
Oliveira F., Pedrolli D.B., Teixeira M.F.S., Ebinuma V.C.S. Water-soluble fluorescent red colorant production by Talaromyces amestolkiae // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 6529‒6541.
Osmanova N., Schultze W., Ayoub N. Azaphilones: a class of fungal metabolites with diverse biological activities // Phytochem. Rev. 2010. V. 9. P. 315–342. https://doi.org/10.1007/s11101-010-9171-3
Patakova P. Monascus secondary metabolites: production and biological activity // J. Ind. Microbiol. Biotechnol. 2013. V. 40. P. 169‒181. https://doi.org/10.1007/s10295-012-1216-8
Pavesi C., Flon V., Mann S., Leleu S., Prado S., Franck X. Biosynthesis of azaphilones: a review // Nat. Prod. Rep. 2021. V. 38. P. 1058‒1071. https://doi.org/10.1039/D0NP00080A
Petersen T.I., Kroll-Moller P., Larsen T.O., Ødum A.S.R. A novel class of pigments in Aspergillus // Patent Application WO 2020/094830 A1, 2020.
Pimenta L.P.C., Gomes D.C., Cardoso P.G., Takahashi J.A. Recent findings in azaphilone pigments // J. Fungi. 2021. V. 7. P. 541. https://doi.org/10.3390/jof7070541
Sabater-Vilar M., Maas R.F.M., Fink-Gremmels J. Mutagenicity of commercial Monascus fermentation products and the role of citrinin contamination // Mutat. Res. Genet. Toxicol. Environ. Mutagen. 1999. V. 444. P. 7–16. https://doi.org/10.1016/s1383-5718(99)00095-9
Shi J., Zhao W., Lu J., Wang W., Yu X., Feng Y. Insight into Monascus pigments production promoted by glycerol based on physiological and transcriptome analyses // Proc. Biochem. 2021. V. 102. P. 141–149. https://doi.org/10.1016/j.procbio.2020.12.006
Shi K., Song D., Chen G., Pistolozzi M., Wu Z., Quan L. Controlling composition and color characteristics of Monascus pigments by pH and nitrogen sources in submerged fermentation // J. Biosci. Bioeng. 2015. V. 120. P. 145‒154. https://doi.org/10.1016/j.jbiosc.2015.01.001
Shi Y.C., Pan T.M. Beneficial effects of Monascus purpureus NTU 568-fermented products: a review // Appl. Microbiol. Biotechnol. 2011. V. 90. P. 1207–1217. https://doi.org/10.1007/s00253-011-3202-x
Su N.W., Lin Y.L., Lee M.H., Ho C.Y. Ankaflavin from Monascus-fermented red rice exhibits selective cytotoxic effect and induces cell death on Hep G2 cells // J. Agric. Food Chem. 2005. V. 53. P. 1949–1954.
Sun J.M., Kim S.J., Kim G.W., Rhee J.K., Kim N.D., Jung H., Jeun J., Lee S.H., Han S.H., Shin C.S., Oh J.W. Inhibition of hepatitis C virus replication by Monascus pigment derivatives that interfere with viral RNA polymerase activity and the mevalonate biosynthesis pathway // J. Antimicrob. Chemother. 2012. V. 67. P. 49 –58. https://doi.org/10.1093/jac/dkr432
Tan H., Xing Z., Chen G., Tian X., Wu Z. Evaluating antitumor and antioxidant activities of yellow Monascus pigments from Monascus ruber fermentation // Molecules. 2018. V. 23. P. 3242. https://doi.org/10.3390/molecules23123242
Tuli H.S., Chaudhary P., Beniwal V., Sharma A.K. Microbial pigments as natural color sources: current trends and future perspectives // J. Food Sci. Technol. 2015. V. 52. P. 4669–4678. https://doi.org/10.1007/s13197-014-1601-6
Vendruscolo F., Bühler R.M.M., Carvalho J.C., Oliveira D., Moritz D.E., Schmidell W., Ninow J.L. Monascus: a reality on the production and application of microbial pigments // Appl. Biochem. Biotechnol. 2016. V. 178. P. 211–223. https://doi.org/10.1007/s12010-015-1880-z
Venil C.K., Velmurugan P., Dufossé L., Devi P.R., Ravi A.V. Fungal pigments: potential coloring compounds for wide ranging applications in textile dyeing // J. Fungi. 2020. V. 6. P. 68. https://doi.org/10.3390/jof6020068
Wong H.C., Koehler P.E. Production of water-soluble Monascus pigments // J. Food Sci. 1983. V. 48. P. 1200–1203. https://doi.org/10.1111/j.1365-2621.1983.tb09191.x
Woo P.C., Lam C.W., Tam E.W.T., Lee K.C., Yung K.K.Y., Leung C.K.F., Sze K.H., Lau S.K.P., Yuen K.Y. The biosynthetic pathway for a thousand-year-old natural food colorant and citrinin in Penicillium marneffei // Sci. Rep. 2014. V. 4. P. 6728. https://doi.org/10.1038/srep06728
Wu M.D., Cheng M.J., Yech Y.J., Chen Y.L., Chen K.P., Chen I.Sh., Yang P.Hs., Yuan G.F. Monasnicotinates A‒D, four new pyridine alkaloids from the fungal strain Monascus pilosus BCRC 38093 // Molecules. 2011. V. 16. P. 4719‒4727. https://doi.org/10.3390/molecules16064719
Wu S., Liu L., Zhang X., Wang Z. Submerged culture of Penicillium sclerotiorum for production of rotiorin alkaloids by using biosynthetic and chemical catalytic cascade reactions // Proc. Biochem. 2021. V. 104. P. 10‒18.
Zheng Y., Zhang Y., Chen D., Chen H., Lin L., Zheng C., Guo Y. Monascus pigment rubropunctatin: a potential dual agent for cancer chemotherapy and phototherapy // J. Agric. Food Chem. 2016. V. 64. P. 2541–2548. https://doi.org/10.1021/acs.jafc.5b05343
Дополнительные материалы отсутствуют.
Инструменты
Микробиология