Микроэлектроника, 2020, T. 49, № 1, стр. 27-32
Растворимость углерода в никелевом катализаторе при росте углеродных нанотрубок
С. В. Булярский a, *, Е. П. Кицюк b, А. В. Лакалин a, А. А. Павлов a, Р. М. Рязанов b
a Институт нанотехнологий микроэлектроники Российской академии наук
119991 Москва, Ленинский проспект, 32А, Россия
b Научно-производственный комплекс “Технологический центр”
124498 Зеленоград, Москва, площадь Шокина, 1, стр. 7, Россия
* E-mail: bulyar2954@mail.ru
Поступила в редакцию 27.05.2019
После доработки 23.07.2019
Принята к публикации 16.08.2019
Аннотация
В работе изучается синтез углеродных нанотрубок методом химического парофазного осаждения с использованием тонкопленочного катализатора на основе никеля. Проведено сопоставление распределений всех наночастиц катализатора по размерам с распределением частиц, из которых наблюдался рост углеродных нанотрубок. Установлено, что в данном режиме нанотрубки растут преимущественно из частиц размерами от 7 до 19 нм, из частиц других размеров нанотрубки практически не растут. Разработана термодинамическая модель растворимости углерода в наночастице никеля и показано, что для каждого набора параметров процесса синтеза существует критический минимальный размер наночастицы катализатора, в которой углерод может раствориться.
ВВЕДЕНИЕ
Углеродные нанотрубки занимают важное место в наноэлектронике [1]. Они обладают многими уникальными свойствами, среди которых поглощение и испускание электромагнитного излучения. Это открывает перспективу создания приемно-передающих устройств на основе УНТ в широком диапазоне длин волн от радиочастотного до оптического [2, 3]. Явление автоэлектронной эмиссии из УНТ [4] используется для создания холодных катодов, СВЧ переключателей и катодов рентгеновских трубок. Для реализации указанных выше устройств необходимо выращивать вертикальные массивы углеродных нанотрубок длиной 1–4 мкм и диаметром не больше 30–40 нм. Причем, чем меньше диаметр нанотрубки, тем больше ее аспектное отношение и больше усиление электрического поля у конца нанотрубки, что ведет к увеличению плотности эмиссионных токов.
В настоящее время рост углеродных нанотрубок осуществляется методами химического парофазного осаждения [1] (СVD), в том числе в плазменном разряде (PECVD). В качестве катализатора для синтеза УНТ используют Fe, Co и Ni [5]. Механизмы роста достаточно хорошо изучены [6], в том числе с применением статистических методов [7]. Размер частиц катализатора четко коррелирует с диаметром, а соответственно, и числом стенок УНТ. Для синтеза нанотрубок малого диаметра на планарной подложке необходимо формирование массива наночастиц катализатора требуемой морфологии. На синтез УНТ оказывают влияние различные технологические факторы формирования катализатора [1, 5]: толщина пленок катализатора [8], температура формирования наночастиц катализатора [9]. Отжиг в окислительной и восстановительной атмосфере перед ростом углеродных нанотрубок также сказывается на процессе их синтеза [1, 5]. Многочисленные исследования позволили сформировать последовательность технологических операций при росте УНТ методами CVD на тонкопленочных катализаторах: нанесение на подложку тонких пленок буферного и каталитического слоя, окисление их в кислородной среде, восстановление в среде водорода и/или аммиака.
Важной задачей является снижение температуры выращивания УНТ, с тем, чтобы приблизить условия роста УНТ к условиям протекания технологических процессов при планарной технологии. Снижения этой температуры можно добиваться путем применения катализаторов, имеющих малое поверхностное натяжения, например, добавлением Ni [10], а также использованием биметаллических (Co–Fe) и триметаллических (Ni–Co–Fe) катализаторов, нанесенных на различные подложки. В качестве подложки используются оксиды, которые обладают низкой поверхностной энергией [10, 11]. Ведутся работы по нанесению монометаллических пленок катализаторов на SiO2 [12], который также уменьшает поверхностную энергию [13].
Одним из направлений снижения температуры и улучшения условий роста является влияние на поверхность катализатора окисляющей атмосферы [13]. Присутствие аммиака в составе газа носителя увеличивает размер частиц и ускоряло рост УНТ. Такое же влияние оказывает создание на поверхности медного катализатора закиси меди [14]. Имеется патент [15], в котором предлагается ускорять рост УНТ путем отжига образцов в кислородной среде в диапазоне температур от 200 до 400°С до проведения синтеза нанотрубок. Таким образом подготовка поверхности катализатора перед ростом углеродных нанотрубок является важным технологическим этапом.
В то же время растворимость углерода в наночастице катализатора исследована пока недостаточно. Оказывается, что нанотрубки растут не из каждой наночастицы катализатора. Чаще всего рост происходит из наночастиц среднего для данного распределения размера. При этом понятие “средний размер” зависит от условий формирования наночастиц катализатора, в том числе толщины слоя катализатора, который наносится на буферный слой, самого буферного слоя, температуры отжига в окислительной и восстановительной атмосферах. При толщине пленки катализатора порядка 2 нм и температуре восстановления 500°С, средний размер составляют наночастицы с диаметром 4−18 нм практически для любого времени отжига. При этом из частиц размером менее, чем 7 нм, нанотрубки не растут, а при диаметре большем, чем 20 нм, растут с много меньшей вероятностью. В настоящей работе анализируются причины таких особенностей синтеза нанотрубок. Одной из них является различная растворимость углерода в частицах разного размера. В настоящей работе построена термодинамическая модель процессов растворения углерода в никеле с учетом влияния на растворимость поверхностной энергии наночастицы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез углеродных нанотрубок проводился на установке “Nanofab 800 Agile”, разработанной на основе серии “Plasmа Lab System 100” фирмы “Oxford Instruments”. В качестве подложки использовался окисленный монокристаллический кремний. На эту подложку методом электронно-лучевого напыления были нанесены пленки титана и никеля толщиной 10 и 2 нм соответственно.
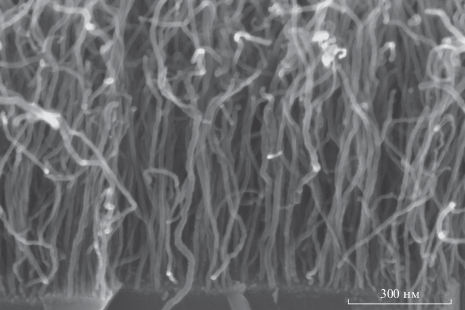
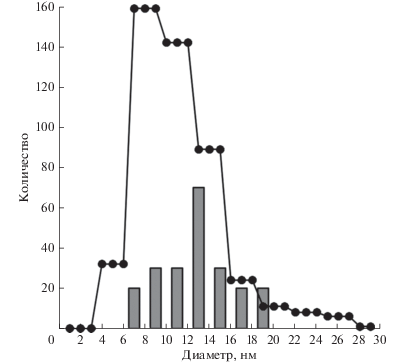
Синтез углеродных нанотрубок проводился в три стадии: окисление при температуре 280°С в течение 10 мин, восстановление в потоке аммиака при температуре 500°С в течение 1 мин и рост при этой же температуре в потоке аргона, ацетилена и аммиака. На рис. 1 представлен результат синтеза в течение 30 с, демонстрирующий синтез углеродных нанотрубок в данном процессе. Приведенные результаты показывают, что рост нанотрубок происходит преимущественно из наночастиц среднего размера среди данного распределения. Для того, чтобы убедиться в существовании этой закономерности, были построены диаграмма распределения наночастиц по размеру, а так же диаграмма распределения растущих из них нанотрубок по диаметру, которые представлены на рис. 2.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Учитывать поверхность кристаллов больших размеров нет необходимости, так как вклад поверхности в этом случае невелик, что будет показано ниже. Однако поверхностные эффекты становятся заметными для наноразмерных кристаллов, в том числе для наночастиц катализаторов.
Для решения задачи воспользуемся методом минимизации свободной энергии Гиббса, разработанным в работах [16, 17]. Рассмотрим систему из наноразмерной частицы катализатора, находящегося в равновесии с углеродом, который высвободился из углеводородов в результате каталитических процессов на поверхности катализатора. Объем системы ограничен объемом, в котором происходит выращивание углеродных нанотрубок. В такой системе нет обмена частиц с внешней средой, но есть обмен энергией, поэтому к ней можно применить метод поиска минимума свободной энергии.
Будем считать, что в первом приближении в этой системе есть только два сорта атомов: С и Ni, и рассчитаем растворимость углерода в катализаторе. При этом используются следующие обозначения: ${{N}^{{{\text{Ni}}}}}$ – число мест, на которых могут размещаться атомы, из которых состоит наночастица катализатора; $N_{{\text{С}}}^{{{\text{Ni}}}}$ – число атомов углерода, которые растворены в катализаторе; $N_{{{\text{Ni}}}}^{{{\text{Ni}}}}$ – число атомов никеля в наночастице катализатора, $N_{{{\text{Ni}}}}^{g},N_{{\text{C}}}^{g}$ – число атомов сорта Ni и C, которые находятся во внешней фазе.
Свободная энергия такой системы запишется в виде [1, 17]:
(1)
$G = {{G}^{g}}(N_{{{\text{Ni}}}}^{g},N_{{\text{C}}}^{g}) + g_{{\text{C}}}^{{{\text{Ni}}}}N_{{\text{C}}}^{{{\text{Ni}}}} + (g_{{{\text{Ni}}}}^{{{\text{Ni}}}}N_{{{\text{Ni}}}}^{{{\text{Ni}}}} - {{G}^{S}}(N_{{{\text{Ni}}}}^{{{\text{Ni}}}})) - kT\ln \frac{{{{N}^{{{\text{Ni}}}}}!}}{{N_{{\text{C}}}^{{{\text{Ni}}}}!N_{{{\text{Ni}}}}^{{{\text{Ni}}}}!}}.$При минимизации свободной энергии необходимо учитывать законы сохранения (уравнения связи) для количества частиц никеля (NNi) и углерода (NC), а также общего числа атомов в наночастице катализатора (NNi):
(2)
$\begin{gathered} {{\varphi }_{С}} \equiv {{N}_{{\text{С}}}} - N_{{\text{С}}}^{{{\text{Ni}}}} - N_{{\text{C}}}^{g} = 0; \\ {{\varphi }_{{{\text{Ni}}}}} \equiv {{N}_{{{\text{Ni}}}}} - N_{{{\text{Ni}}}}^{{{\text{Ni}}}} - N_{{{\text{Ni}}}}^{g} = 0; \\ {{\varphi }^{{{\text{Ni}}}}} \equiv {{N}^{{{\text{Ni}}}}} - N_{{\text{C}}}^{{{\text{Ni}}}} - N_{{{\text{Ni}}}}^{{{\text{Ni}}}} = 0. \\ \end{gathered} $Минимум свободной энергии (1) с дополнительными условиями (2) можно найти методом Лагранжа. Термодинамическое равновесие кристалла соответствует минимуму функционала:
(3)
$\Psi = G + {{\lambda }_{{\text{С}}}}{{\varphi }_{{\text{С}}}} + {{\lambda }_{{{\text{Ni}}}}}{{\varphi }_{{{\text{Ni}}}}} + {{\lambda }^{{{\text{Ni}}}}}{{\varphi }^{{{\text{Ni}}}}}.$Здесь ${{\lambda }_{{\text{C}}}},{{\lambda }_{{{\text{Ni}}}}},{{\lambda }^{{{\text{Ni}}}}}$ – неопределенные множители Лагранжа. Минимизация данного функционала позволяет получить следующую систему уравнений:
(4)
$\left\{ \begin{gathered} {{\mu }_{{\text{С}}}} - {{\lambda }_{{\text{C}}}} = 0; \hfill \\ {{\mu }_{{{\text{Ni}}}}} - {{\lambda }_{{{\text{Ni}}}}} = 0; \hfill \\ g_{{\text{C}}}^{{{\text{Ni}}}} + kT\ln N_{{\text{C}}}^{{{\text{Ni}}}} - {{\lambda }_{{\text{C}}}} - {{\lambda }^{{{\text{Ni}}}}} = 0; \hfill \\ g_{{{\text{Ni}}}}^{{{\text{Ni}}}} + kT\ln N_{{{\text{Ni}}}}^{{{\text{Ni}}}} - {{\lambda }_{{{\text{Ni}}}}} - {{\lambda }^{{{\text{Ni}}}}} - \frac{{\partial {{G}^{S}}}}{{\partial N_{B}^{B}}} = 0; \hfill \\ \end{gathered} \right.$Здесь использовано стандартное определение химического потенциала:
(5)
${{\mu }_{C}} = \frac{{\partial {{G}^{g}}}}{{\partial N_{{\text{C}}}^{g}}},\,\,\,\,{{\mu }_{{Ni}}} = \frac{{\partial {{G}^{g}}}}{{\partial N_{{{\text{Ni}}}}^{g}}}.$Решая систему уравнений (4) с учетом определений химических потенциалов (5), получаем растворимость углерода в наночастице никеля:
(6)
$N_{{\text{C}}}^{{{\text{Ni}}}} = N_{{{\text{Ni}}}}^{{{\text{Ni}}}}\exp \left\{ { - \frac{{(g_{{\text{C}}}^{{{\text{Ni}}}} + {{\mu }_{{{\text{Ni}}}}} - {{\mu }_{{\text{C}}}})}}{{kT}}} \right\}\exp \left\{ { - \left( {\frac{{\partial {\kern 1pt} {{G}^{S}}(N_{{{\text{Ni}}}}^{{{\text{Ni}}}})}}{{\partial {\kern 1pt} N_{{{\text{Ni}}}}^{{{\text{Ni}}}}}}} \right)\frac{1}{{kT}}} \right\};$(7)
$N_{{\text{C}}}^{{{\text{Ni}}}} = N_{{{\text{C0}}}}^{{{\text{Ni}}}}\exp \left\{ { - \left( {\frac{{\partial {\kern 1pt} {{G}^{S}}(N_{{{\text{Ni}}}}^{{{\text{Ni}}}})}}{{\partial {\kern 1pt} N_{{{\text{Ni}}}}^{{{\text{Ni}}}}}}} \right)\frac{1}{{kT}}} \right\}.$Таким образом, на количество растворенного в наночастице никеля углерода оказывает влияние поверхностная энергия. Ниже будет показано, что это влияние тем сильнее, чем меньше размеры кристалла.
Поверхностную энергию сферического кристалла можно представить в виде:
где $N_{{{\text{Ni}}}}^{S}$ – количество атомов никеля на поверхности наночастицы, $\Delta H_{{{\text{Ni}}}}^{S}$ – изменение энергии атома никеля при его переходе на поверхность.Из простых геометрических соображений, считая, что наночастица катализатора сферическая, можно получить следующее выражение:
(9)
$S = 4\pi {{R}^{2}} = {{a}^{2}}{{(4\pi )}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}{{(3N_{{{\text{Ni}}}}^{{{\text{Ni}}}})}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}},$– радиус наночастицы катализатора.
Используя формулы (8) и (9), получаем выражение для поверхностной энергии:
(10)
${{G}^{S}} = \sigma S = {{a}^{2}}\sigma {{(3N_{{{\text{Ni}}}}^{{{\text{Ni}}}})}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}{{(4\pi )}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}},$Из (10) с учетом выражения для радиуса наночастицы, получаем:
(11)
$\frac{{\partial {{G}^{S}}}}{{\partial N_{{{\text{Ni}}}}^{{{\text{Ni}}}}}} = \frac{{2{{a}^{3}}\sigma }}{R}.$Тогда с учетом (11) выражение (7) для количества растворенных в наночастице катализатора атомов углерода принимает вид:
(12)
$N_{{\text{C}}}^{{{\text{Ni}}}} = N_{{{\text{C0}}}}^{{{\text{Ni}}}}\exp \left\{ { - \frac{{2{{a}^{3}}\sigma }}{R}\frac{1}{{kT}}} \right\}.$При увеличении радиуса кристалла $R$ показатель степени экспоненты стремится к нулю, а растворимость углерода принимает равновесные значения для массивных кристаллов. Поэтому эффекты, связанные с поверхностью, исчезают.
Чем меньше радиус наночастицы катализатора, тем меньше атомов углерода в ней растворяется. Критический радиус наночастицы катализатора, при котором растворится один атом углерода, равен:
(13)
${{R}_{{\min }}} = \frac{{2{{a}^{3}}\sigma }}{{kT\ln \left( {N_{{{\text{C0}}}}^{{{\text{Ni}}}}} \right)}}.$Наночастицы катализатора меньшего размера в данных условиях растворить углерод не могут, поэтому из таких частиц нанотрубки не растут. Коэффициент поверхностного натяжения расплавленного никеля равен 2.3 × 10–3 Дж/м2 при температуре 1450°С. При таком коэффициенте поверхностного натяжения радиус минимальной наночастицы составляет порядка 10 нм. При более низких температурах коэффициент поверхностного натяжения растет и критический радиус наночастицы еще больше. Как показывают результаты, которые имеются в научной литературе [1], рост более тонких трубок наблюдается при повышении температуры синтеза.
Однако поверхностное натяжение существенно меньше в окислах. Поэтому на синтез нанотрубок может оказывать влияние наличие атомов кислорода на поверхности катализатора или использование буферного слоя на основе оксида. С другой стороны, если наночастица состоит только из оксида никеля NiO, то рост нанотрубок невозможен. Во-первых, температура плавления оксида никеля 1955°С, поэтому его наночастица при температурах синтеза находится в твердом состоянии, без жидкого слоя на поверхности, а поверхностная энергия твердой фазы в несколько раз превышает поверхностную энергию расплава, поэтому углерод в малых наночастицах оксида не растворяется. Во-вторых, коэффициент диффузии углерода в твердом теле на несколько порядков меньше, чем в расплаве, что затрудняет поступление углерода к месту роста нанотрубки и замедляет ее рост. В связи с этим отметим важность использования предваряющих синтез технологических обработок, а именно режимов окисления и восстановления катализатора.
ЗАКЛЮЧЕНИЕ
Экспериментальные результаты показывают, что рост углеродных нанотрубок в выбранных условиях с большей вероятностью проходит из наночастиц катализатора среднего для данного распределения размера, 7−19 нм. По нашему мнению, это связано с влиянием поверхностного натяжения на растворимость углерода в наночастице. При температуре 500°С приведенные выше размеры никелевых наночастиц являются оптимальными для роста углеродных нанотрубок, что доказывается совпадением распределения размеров наночастицс диаметром УНТ, синтезируемых на данном катализаторе.
Работа выполнена при финансовой поддержке Минобрнауки России (проекты № 0004-2015-0001 и № 16.9007.2017/8.9).
Список литературы
Булярский С.В. Углеродные нанотрубки: технология, управление свойствами, применение. Ульяновск: Стрежень, 2011. 432 с.
Rutherglen C., Burke P. Carbon Nanotube Radio // Nano Lett. 2007. V. 7. № 11. P. 3296–3299.
Jensen K., Weldon J., Garcia H., Zettl A. Nanotube Radio // Nano Lett. 2007. V. 7. № 11. P. 3508–3511.
Chernozatonskii L.A., Gulyaev Y.V., Kosakovskaja Z.J. et al. Electron field emission from nanofilament carbon films // Chem. Phys. Lett. 1995. V. 233. P. 63–68.
Булярский C.В., Басаев А.С. Термодинамика и кинетика адсорбции атомов и молекул углеродными нанотрубками // ЖЭТФ. 2009. Т. 134. № 4. С. 788–799.
Krasnikov D.V., Kuznetsov V.L., Romanenko A.I., Shmakov A.N. Side Reaction in Catalytic CVD Growth of Carbon Nanotubes: Surface Pyrolysis of a Hydrocarbon Precursor with the Formation of Lateral Carbon Deposits // Carbon. 2018. V. 139. P. 105–117.
Mengqi Fan, Su Wu, Chi Xu. A physical-statistical model for the growth process of carbon nanotubes // Applied Physics A. 2018.V. 124. P. 790.
Lee M.W., Haniff M.A.Sh.M., Teh A.Sh., Bien D.C.S., Chen S.K. Effect of Co and Ni nanoparticles formation on carbon nanotubes growth via PECVD // J. Experimental Nanoscience. 2015. V. 10. № 16. P. 1232–1241.
Zhang K., Lin X., Xu W., Miao Y., Hu K., Zhang Y. Effect of substrate temperature on aligned high-density carbon nanotubes deposited by RF-PECVD // Optoelectronics Letters. 2011. V. 7. № 2. P. 85–87.
Zhang H., Cao G., Wang Z., Yang Y., Gu Z. Electrochemical Capacitive Properties of Carbon Nanotube Arrays Directly Grown on Glassy Carbon and Tantalum Foils // Carbon. 2008. V. 46. P. 822–824.
Lucia K.N., Norberto S.G., Antoninho V. et al. Effect of Ni loading and reaction temperature on the formation of carbon nanotubes from methane catalytic decomposition over Ni/SiO2 // J. Mater Sci. 2007. V. 42. P. 914–922.
Terrado E., Tacchini I., Benito A.M. et al. Optimizing catalyst nanoparticle distribution to produce densely-packed carbon nanotube growth // Carbon. 2009. V. 47. P. 1989–2001.
Булярский С.В. Нуклеация кластеров катализаторов при росте углеродных нанотрубок // ЖТФ. 2011. Т. 81. С. 64–70.
Vanhaecke E., Huang F., Yu Y., Rønning M., Holmen A., Chen D. Catalytic Consequence of the Interface Between Iron Catalystsand Foils in Synthesis of Aligned Nanocarbons on Foils // Top. Catal. 2011. V. 54. P. 986–997.
Liu L., Fan S.-S. Carbon nanotube array and method for making same // US pat. 2004/0109815A1, 2004 Jun. 10. P. 5–28.
Bulyarskiy S.V., Oleynikov V.P. Thermodynamical Evaluation of Point Defect Density and Impurity Solubility in Compound Semiconductors // Phys. Stat. Sol. 1987. V. 141. P. K7–K10.
Булярский С.В., Фистуль В.И. Термодинамика и кинетика взаимодействующих дефектов в полупроводниках. М.: Наука, 1997. 352 с.
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника