Микроэлектроника, 2021, T. 50, № 3, стр. 166-174
Биосенсоры на основе КНИ-нанопроволочных транзисторов для биомедицины и вирусологии
О. В. Наумова a, *, В. М. Генералов b, Э. Г. Зайцева a, А. В. Латышев a, А. Л. Асеев a, b, С. А. Пьянков b, И. В. Колосова b, Г. Г. Ананько b, А. П. Агафонов b, Е. В. Гаврилова b, Р. А. Максютов b, А. С. Сафатов b
a Институт физики полупроводников им. А.В. Ржанова СО Российской АН
630090 Новосибирск, пр. акад. Лаврентьева, 13, Россия
b Государственный научный центр вирусологии и биотехнологий “Вектор”
630559 рабочий поселок Кольцово, Новосибирская обл., Россия
c Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: naumova@isp.nsc.ru
Поступила в редакцию 03.08.2020
После доработки 18.11.2020
Принята к публикации 18.11.2020
Аннотация
Статья содержит результаты исследований по актуальной проблеме высокочувствительной экспрессной регистрации биологических объектов с помощью полевых транзисторов с открытой для доступа аналита поверхностью, изготовленных на основе пленок кремния-на-изоляторе (КНИ). На примере индикации вирусов ядерного полиэдроза и осповакцины рассмотрены возможности диэлектрофоретических воздействий для управления концентрацией аналита в области сенсорных элементов. Показано, что использование эффекта диэлектрофореза позволяет решить: 1) ключевые задачи по созданию сенсорных систем – увеличения обнаружительной способности, выделения и верификация сигнала от целевых частиц и 2) фундаментальную задачу – определения зарядового состояния аналита в растворах без модификации поверхности сенсоров. Обсуждаются проблемы и перспективы массового применения нанопроволочных биосенсоров, в том числе с диэлектрофоретическим воздействием, в биотехнологиях, вирусологии и др.
ВВЕДЕНИЕ
Обострившаяся в последнее время проблема возникновения эпидемии или пандемии сопровождается новыми и все более высокими требованиями к процессам индикации биологических и химических аналитов (вирусов, патогенов, токсинов и др.), таких как чувствительность, специфичность, достоверность полученных результатов, скорость процедуры и производительность, отношение сигнал/шум, энергопотребление и стоимость. Эти обстоятельства требуют разработки новых более совершенных технологий по отношению к уже имеющимся, традиционным вариантам решения указанной проблемы, основанным на применении клинических, вирусологических методов контроля, таких как, полимеразная цепная реакция, иммуноферментный, гемагглютинация, анализ морфологии патогена, использование лабораторных животных и др.
В последние десятилетие конкурентоспособную альтернативу традиционным аналитическим системам индикации представляет стремительно развивающееся направление разработки детекторов на основе нанопроволочных (НП) сенсоров. Такие устройства обладают уникальными характеристиками по чувствительности к биологическим молекулам в фемтомольном и субфемтомольном диапазоне, экспрессности и возможности индикации в форме электрических сигналов, возникающих при контакте молекул аналита с поверхностью сенсорного элемента. Оцифровка сигнала позволяет широко использовать преимущества информационных технологий при обработке и передаче данных индикации через каналы связи в единый информационный центр, для неограниченно долгого хранения результатов индикации, осуществления компьютерной статистической обработки массива результатов и достижения высокой достоверности метода.
Кроме системы сбора и обработки данных, составными частями сенсорных устройств являются: система доставки аналита к сенсорному элементу; распознающий элемент – слой рецепторов, ферментов, антител, фрагментов ДНК и др. (или так называемый слой зондов) на поверхности сенсора, который селективно взаимодействует с аналитом – объектом исследований и практически не реагиреют с другими веществами, находящимися в растворе/газе; сам сенсорный элемент, который преобразует биохимическое взаимодействие аналита со слоем зондов на его поверхности в измеряемый сигнал [1]. В последние десятилетия предложены/реализованы различные решения при создании всех составных частей сенсорных систем, включая технологии формирования и материал сенсорного элемента. Среди различного вида нанопроволочных сенсоров особое место занимают сенсоры на основе кремния (в частности, пленок кремния-на-изоляторе, КНИ). В первую очередь, из-за возможности массового производства сенсоров и диагностических Lab-on-Chip систем при использовании промышленной кремниевой технологии.
Ранее в ИФП СО РАН совместно с ИБМХ им. Ореховича РАМН на основе так называемой top-down технологии, с использованием оптической и электронной литографии наноразмерных слоев КНИ были разработаны и реализованы нанопроволочные сенсоры с фемтомольной (10–15 М) чувствительностью к белкам. В работах [2–4] в качестве тестовых использовались молекулы бычьего сывороточного альбумина BSA. Чтобы обеспечить максимальный отклик к белку были использованы транзисторные характеристики КНИ-сенсоров (подложка структур КНИ использовалась в качестве управляющего затвора, скрытый диэлектрик – в качестве подзатворного). Это позволило обеспечить внутреннее усиление сигнала за счет экспоненциальной зависимости тока в подпороговом режиме КНИ нанопроволочного сенсора (транзистора). В дальнейшем КНИ-НП сенсоры были использованы при детекции HBsAg-маркеров гепатита В, онкомаркера печени α-фетопротеина (чувствительность в интервале 10–14–10–15 М) [5], онкомаркера легких D-NFATc1 с чувствительностью 2.5 × 10–15 М [6].
Фемтомольный уровень чувствительности НП-сенсоров ограничен вероятностью адсорбции аналита на его поверхность. Это ограничение частично снимается, например, за счет использования микрожидкостных ячеек с циклической прогонкой тестируемого раствора и/или за счет увеличения площади сенсорного элемента. Используемый нами подход позволил не только обеспечить внутреннее усиление считываемого сигнала, но и снять ограничение на нанометровый размер сенсорного элемента.
Принцип работы нанопроволочных сенсоров основан на полевом эффекте. Адсорбция частиц приводит к изменению потенциала на поверхности НП. Соответственно, изменяется концентрация свободных носителей в сенсоре и его проводимость (в режиме реального времени, что и обеспечивает экспрессность индикации аналита). Если при адсорбции происходит обеднение сенсорного элемента свободными носителями в локальной области и область обеднения сопоставима с размерами НП-элемента, то одна частица способна полностью блокировать его проводимость. В результате достигается максимальный отклик с предельной чувствительностью – одна частица на сенсорный элемент. Отметим, что экспериментально предельная чувствительность НП-сенсоров была достигнута при детекции вируса гриппа в работе [7]. Ширина области обеднения определяется концентрацией свободных носителей. Подпороговый режим транзистора позволяет изменять концентрацию свободных носителей в пределах нескольких порядков, т.е. “настраивать” ширину области обеднения. Соответственно, появляется возможность снять ограничение на нанометровый размер (увеличить эффективную площадь) сенсорного элемента и перейти полностью к оптической литографии при его формировании.
Фемтомольный уровень чувствительности для сенсоров с микронной шириной сенсорных элементов (полосок КНИ), изготовленных с использованием стандартной оптической литографии был получен нами при детекции коротких последовательностей РНК, соответствующим маркерам немелкоклеточного рака легкого (с динамическим диапазоном 10 порядков) [8], субфемтомольный уровень (до 10–17 М) – для микро-РНК, содержащихся в плазме крови больных раком груди [9]. В недавней работе [10] показана возможность применения таких сенсоров для индикации модельного белка VP-40 вируса Эбола и его комплексов со специфичными моноклональными антителами.
Высокая чувствительность сенсоров достигается при условии, что сигнал от аналита больше, чем сигнал от фоновых частиц. Сигнал от фоновых частиц определяется по отклику сенсоров без зондов на поверхности. То есть для верификации измерений чип с сенсорами должен иметь, как минимум, два типа элементов:
1) модифицированных зондами для селективного специфического взаимодействия с аналитом;
2) не модифицированных или модифицированных неспецифичными зондами (для сравнения). В работе [8] предложен метод модификации поверхности сенсоров, позволяющий получить его отклик на фоновые РНК (на неспецифическое взаимодействие с олигонуклеотидными зондами), не больше 2% даже при изменении их концентрации на 9 порядков (от 10–15 до 10–6 М). Для подавления фонового сигнала использовалась пассивация остаточных связей на поверхности сенсоров, не прореагировавших с зондами, молекулами глицина. Вопрос об эффективности и особенностях пассивации поверхности сенсоров исследован в работе [11].
В то же время перспективы широкого применения КНИ-биосенсоров для реализации их конкурентных преимуществ при решении практически важных задач современной биомедицины и вирусологии сдерживаются рядом проблем. Основными из них являются: 1) проблема подготовки поверхности и индикация аналита в реальных биожидкостях с высокой концентрацией фоновых частиц различного вида (например, в крови, плазме крови с концентрацией частиц на уровне 150 мM, в питательных средах для вирусов, бактерий, с высокой концентрацией белков и т.д.), 2) проблема совмещения технологии модификации поверхности сенсоров с формированием микрожидкостных ячеек, 3) проблема накопления заряда на поверхности сенсоров при их хранении [12]. Фемтомольная и субфемтомольная чувствительность сенсоров, как говорилось выше, ограничена доставкой аналита к сенсорным элементам. Перспективным решением этих проблем является диэлектрофорез (ДЭФ).
Диэлектрофорез – это электрокинетическое движение диэлектрически поляризованных материалов в неоднородном переменном электрическом поле [13]. ДЭФ-манипуляция биочастицами зависит от их поляризуемости и поляризуемости окружающей среды. Сила, действующая в неоднородном электрическом поле напряженностью Е на частицу сферической формы радиусом r, определяется как:
(1)
$\vec {F} = 2\pi {{r}^{3}}{{\varepsilon }_{m}}\operatorname{Re} [{{F}_{{CM}}}]\nabla \left| {{{E}^{2}}} \right| = 2\pi {{r}^{3}}{{\varepsilon }_{m}}\operatorname{Re} \left[ {\frac{{\varepsilon _{p}^{*} - \varepsilon _{m}^{*}}}{{\varepsilon _{p}^{*} + 2\varepsilon _{m}^{*}}}} \right]\nabla \left| {{{E}^{2}}} \right|.$Здесь εm – абсолютная диэлектрическая проницаемость среды; Re[FCM] – реальная часть фактора Клаузиуса-Массотти, знак которой определяет направление действующей силы – положительный (+) или отрицательный (–) ДЭФ, $\varepsilon _{p}^{*}$ и $\varepsilon _{m}^{*}$ – комплексные диэлектрические проницаемости частицы и среды, соответственно. При +ДЭФ ($\varepsilon _{p}^{*}$ > $\varepsilon _{m}^{*}$) частицы движутся в область высоких полей и захватываются в пространстве между электродами, к которым прикладывается переменное электрическое поле. При –ДЭФ ($\varepsilon _{p}^{*}$ < $\varepsilon _{m}^{*}$) частицы вытесняются из области между ДЭФ-электродами.
Поскольку поляризуемость биочастиц отражает их уникальность и определяется их формой/размерами (см. выражение (1)), то использование эффекта диэлектрофореза открывает широкие возможности в манипуляции местоположением аналита и фоновых частиц между ДЭФ-электродами. В настоящее время известно успешное применение ДЭФ для манипуляции наноматериалами, Si-нанопроволоками [14], биочастицами, включая их сепарацию в растворах [13], самоформирование интерфейсов между нанопроволоками и биочастицами (био/наноинтерфейсов) [15] и др.
Целью данной работы являлось использование диэлектрофореза для управляемого изменения концентрациии биочастиц в области НП-сенсорных элементов. Для этого были изготовлены КНИ-сенсоры с латеральными ДЭФ-электродами. Задачами работы являлись определение отклика сенсоров без ДЭФ и с ДЭФ-управляемой манипуляцией вирусами при воздействии ДЭФ разного знака. В качестве аналита в работе использовались вирусы ядерного полиэдроза и осповакцины. Результаты исследований показали возможность увеличения адресной доставки аналита к сенсорному элементу за счет положительного ДЭФ и возможность выделения полезного сигнала на уровне фонового при отрицательном ДЭФ без использования модификации поверхности сенсоров. В работе также обсуждаются преимущества и ограничения, связанные с применением ДЭФ для индикации биочастиц.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
КНИ-сенсоры были изготовлены на основе пленок КНИ (Smart-Cut [16]) p-типа проводимости с конструктивными параметрами: толщина отсеченного слоя кремния tsi = 30 нм, толщина скрытого диэлектрика tbox = 200 нм. Концентрация акцепторов в пленке КНИ составляла 2 × 1016 см–3. Сенсорные элементы, представляли собой полоски кремния-на-изоляторе шириной 1 мкм, длиной 10 мкм, имеющие контактные области стока-истока на концах. Часть сенсоров на чипе содержала латеральные ДЭФ-электроды, которые были изготовлены из высоколегированного CVD-поликремния. Поскольку максимальная напряженность электрического поля достигается в угловых областях прямоугольных электродов, мы использовали конструкцию со смещенными относительно друг друга (асимметричными) электродами, чтобы получить максимальное значение Е в центре сенсорного элемента. Оптическое и схематическое изображение сенсора показано на рис. 1. Изоляция поверхности чипа осуществлялась пленкой пиролитического диоксида кремния. В области сенсорных элементов (центральная часть на рис. 1а) защитный слой имел окна для открытого доступа растворов с аналитом.
Рис. 1.
Оптическое (a) и схематическое (б) изображения КНИ-сенсора: И – исток, С – сток, З-1 и З-2 – латеральные ДЭФ-электроды, РЭ – референсный электрод.
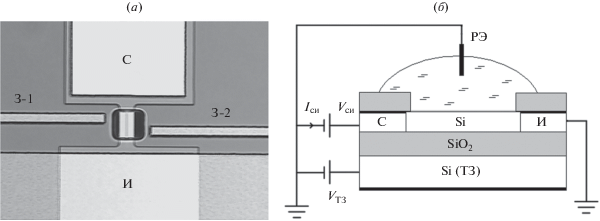
Измерялись временные зависимости тока сенсоров Iси(t) при последовательном нанесении на их поверхность водных растворов аналита разной концентрации. Регистрация тока сенсоров проводилась с использованием многоканальной системы сбора данных на основе модуля NI 6363 с пакетом графического програмирования LabView (фирма National Instrument, США). При измерениях подложка структур КНИ использовалась в качестве управляющего электрода – нижнего или тылового затвора ТЗ, позволяющего целенаправленно изменять режим проводимости сенсорного элемента (рис. 1б). Для выбора напряжения на затворе ТЗ, обеспечивающего максимальный отклик к заряду, адсорбируемому на поверхность сенсоров, был использован легко программируемый алгоритм, который детально описан в работе [17]. В качестве референсного электрода РЭ, поддерживающего постоянным потенциал раствора на поверхности сенсоров, использовался Pt-электрод. Неоднородное электрическое поле в пространстве между латеральными электродами и сенсорными элементами создавалось переменным напряжением, прикладываемым к электродам (затворам) З-1, З-2 (рис. 1а). Отклик сенсоров на адсорбцию аналита определялся как
(2)
${\text{Resp}}. = {\text{ }}{{({{I}_{{{\text{си}}}}} - I_{{{\text{си}}}}^{{\text{о}}})} \mathord{\left/ {\vphantom {{({{I}_{{{\text{си}}}}} - I_{{{\text{си}}}}^{{\text{о}}})} {I_{{{\text{си}}}}^{{\text{о}}}}}} \right. \kern-0em} {I_{{{\text{си}}}}^{{\text{о}}}}}.$Здесь $I_{{{\text{си}}}}^{{\text{о}}}$ – значение тока сенсора в деионизованной воде до добавления аналита в раствор.
В качестве аналита в работе использовались вирусы ядерного полиэдроза (ВЯП) и осповакцины (ВО). Исходные вирусные суспензии были получены в ФБУН ГНЦ вирусологии и биотехнологии “Вектор” Роспотребнадзора и представляли собой:
1) вирус ядерного полиэдроза в концентрации 1011 мл–1 (или ~2 × 10–10 М) в 0.3 М растворе сахарозы;
2) инактивированный бета-пропиолактоном вирус осповакцины, штамм ЛИВП в концентрации 109 мл–1 (или ~2 × 10–12 М). Исходные растворы также содержали остаточные белки поддерживающей жизнедеятельность вирусов среды. Для получения изотонических растворов вирусов с высоким удельным сопротивлением использовалось их разведение в деионизованной воде (ДВ). Растворы с разной концентраций вирусов (пробы) наносились на поверхность сенсоров капельным способом (пиппетированием). Объем капли составлял ~0.5 мкл.
Используемые в работе вирусы (и их комплексы) являются прозрачными в водных растворах. Чтобы определить знак ДЭФ для прозрачного в растворах аналита осуществлялась визуализация его ДЭФ-управляемого движения в оптическом микроскопе на просвет. Для этого в работе были использованы тестовые структуры, представляющие собой хромовые ДЭФ-электроды прямоугольной формы, нанесенные на стекло. Расстояние между электродами составляло 70 мкм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для качественного понимания особенностей распределения напряженности электрического поля E (без учета эффектов, связанных с диффузией подвижных ионов в электролите, адсорбцией заряда на электродах и др.) использовано масштабированное моделирование исследуемых структур в среде TCAD Sentarius. Рассмотрены асимметричная и симметричная конфигурации ДЭФ-электродов (со смещением и без смещения относительно друг друга, соответственно). При моделировании электролит принимался за среду с диэлектрической проницаемостью εm = 81, напряжение на электродах З-1 и З-2 принималось равным 8 и 0 В соответственно.
На рис. 2 приведены результаты моделирования распределения напряженности электрического поля E в структурах с ДЭФ-электродами двух конфигураций и соответствующие E 2(x) зависимости, полученные в разных сечениях структур. Как и следовало ожидать, структуры со смещенными электродами, по сравнению с симметричной конфигурацией, обеспечивают максимальные значения E и максимальный градиент E 2.
Рис. 2.
Распределение напряженности электрического поля E в структурах с (a) – асимметричными и (б) – симметричными ДЭФ-электродами, (в) – E 2(x) зависимости для структур типа (a) – 1 и (б) – 2, 3 в сечениях С1 – 1, 2 и С2 – 3. х = 0 соответствует 1/2 расстояния между электродами.
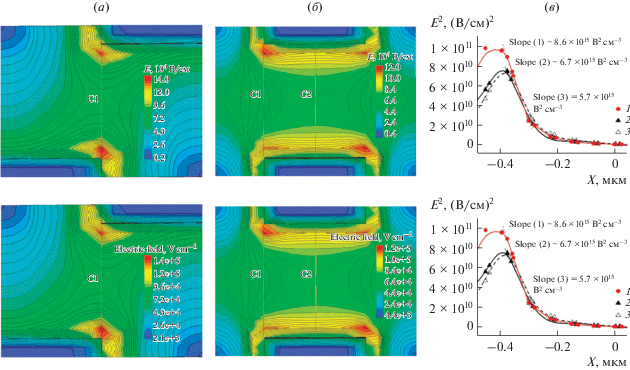
На рис. 3 показаны результаты моделирования распределения напряженности электрического поля E для КНИ-сенсоров с асимметричными ДЭФ-электродами и E 2(x) зависимости, полученные при разных напряжениях на управляющем затворе ТЗ. Значения E 2:
Рис. 3.
Распределение напряженности электрического поля E для сенсора с ДЭФ-электродами при напряжении VТЗ, B: (a) – 0 и (б) – 0.4, (в) – E2(x) зависимости при VТЗ, B: (1) – 0 и (2) – 0.4 в сечении С1. х = 0 соответствует середине сенсорного элемента.
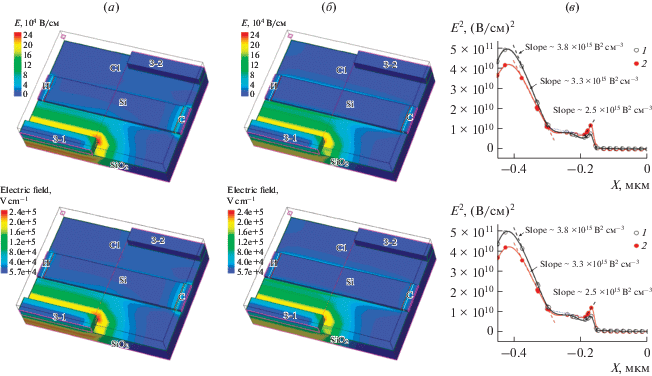
1) имеют максимумы вблизи ДЭФ-электрода и НП-сенсорного элемента;
2) зависят от напряжения VТЗ. Увеличение управляющего напряжения VТЗ ведет к увеличению градиента E 2 вблизи сенсорного элемента и его уменьшению вблизи ДЭФ-электрода.
На рис. 4 показано оптическое изображение структур с симметричными электродами при ДЭФ-манипуляции вирусами ядерного полиэдроза при частоте переменного напряжения 2 × 104 Гц. Результаты исследований показали, что в субмегагерцовом диапазоне для ВЯП наблюдается положительный ДЭФ. Увеличение концентрации вирусов, в первую очередь, происходит в угловой части электродов, т.е., в соответствие с данными рис. 2, частицы собираются в области увеличенных значений $\nabla $E 2.
Рис. 4.
Оптическое изображение распределения концентрации вирусов ядерного полиэдроза при напряжении на ДЭФ-электродах Vз, В: 0 – (a) и 8 – (б). f = 2 × 104 Гц.

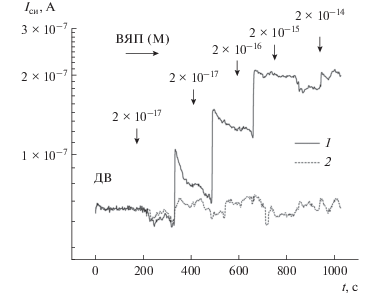
На рис. 5 показаны временные зависимости тока сенсоров с +ДЭФ-управлением и без ДЭФ-управления, измеренные при индикации ВЯП разной концентрации в пробах. Для сравнения, исходные значения тока Iси сенсоров (в деионизованной воде) приведены к одному уровню. Видно, что сенсор без ДЭФ-управления слабо реагирует на пробы с низкой концентрацией аналита. Для сенсора с ДЭФ-управлением наблюдается увеличение Iси с задержкой 100–200 с относительно момента внесения проб с ВЯП. Для проб с субаттомолярной концентрацией аналита (единицы 10–17 М) отклик сенсоров с ДЭФ- и без ДЭФ-управления составляет (23–90) и 10% соответственно. Увеличение тока сенсора характерно при адсорбции положительно заряженных частиц на его поверхность, т.е. в исследуемых растворах вирусы ядерного полиэдроза положительно заряжены.
Рис. 5.
Iси(t) зависимости сенсоров с ДЭФ-управлением (1) и без ДЭФ-управления (2) при индикации вирусов ядерного полиэдроза в пробах с разной концентрацией вирусов. f = 2 × 104 Гц.
На рис. 6 показаны оптические изображения сенсоров после индикации ВЯП, промывания в ДВ и сушки. Несмотря на то, что модификация поверхности сенсоров для ковалентного связывания с вирусами не проводилась (т.е. в экспериментах наблюдется их физическая адсорбция), из рис. 6 видно, что очистка в ДВ не полностью удаляет вирусы с поверхности кристалла. Сенсоры с ДЭФ-электродами, в отличие от сенсоров без ДЭФ-электродов, содержат вирусы на поверхности. Таким образом, использование +ДЭФ в субмегагерцовом диапазоне позволяет увеличить концентрацию ВЯП в области сенсорного элемента и, соответственно, его отклик.
Рис. 6.
Оптическое изображение сенсоров: (a) – без ДЭФ-электродов; (б) – с ДЭФ-электродами после детекции вируса ядерного полиэдроза и очистки в деионизованной воде.

На рис. 7 показаны Iси(t) зависимости сенсоров при тестировании проб с вирусом осповакцины. Видно, что при увеличении концентрации ВО, в отличие от ВЯП (ср. с рис. 5), наблюдается уменьшение тока Iси сенсоров. Причем, модуляция тока больше для сенсора с ДЭФ-управлением.
Рис. 7.
Iси(t) зависимости сенсоров с ДЭФ-управлением (1) и без ДЭФ-управления (2) при индикации вирусов осповакцины в пробах. f = 5 × 104 Гц.
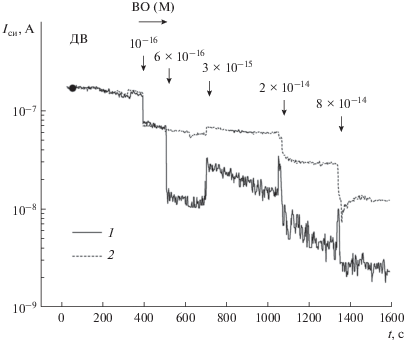
Уменьшение тока сенсора означает увеличение эффективного отрицательного заряда на его поверхности (точнее, на и вблизи поверхности сенсора в растворе в пределах длины экранирования Дебая), т.е. эффективный заряд аналита и фоновых частиц в пробах с ВО отрицательный. Эксперименты по визуализации ДЭФ-управления вирусами показали, что в диапазоне частот 104–105 Гц наблюдается отрицательный ДЭФ для ВО, т.е. вирусы вытесняются из области между электродами. Поэтому меньшие значения Iси для сенсоров с ДЭФ-управлением по сравнению с сенсорами без ДЭФ-управления означают, что при –ДЭФ происходит обеднение области вокруг сенсорного элемента положительно заряженными вирусами осповакцины.
Таким образом, ДЭФ-манипуляция аналита может быть использована не только для увеличения обнаружительной способности сенсоров, но и для верификации сигнала от аналита и его зарядового состояния в растворах. При этом, как показывают проведенные эксперименты на вирусах, не обязательна модификация поверхности сенсоров. Такой подход:
1) снимает ряд проблем по многостадийной модификации поверхности сенсоров [11], включая проблему возможного изменения свойств самого аналита при взаимодействии с зондами;
2) обеспечивает возможность создания относительно недорогих высокочувствительных тест-систем, в том числе, для лабораторной исследовательской экспресс-диагностики в области вирусологии и микробиологии, что особенно актуально, как показывает ситуация с пандемией.
Другим положительным моментом использования сенсоров с ДЭФ-управлением является то, что уже их конструктивные параметры обеспечивают некую селективность при индикации аналита. Диэлектрофоретическая сила, согласно выражению (1), зависит от геометрических размеров частиц и напряженности электрического поля (соответственно, расстояния между электродами). Для эффективного ДЭФ-управления вирусами и бактериями требуется расстояние между электродами на уровне единиц и десятков микрон, для управления белками – субмикронный диапазон. То есть, в случае сенсоров с ДЭФ-управлением вирусами и бактериями используемое переменное напряжение не влияет на концентрацию фоновых белков вблизи сенсорного элемента.
К недостаткам метода следует отнести следующее. При увеличении частоты увеличивается проводимость электролита (емкостная составляющая проводимости сенсор-электролит). Это означает ограничение частотного диапазона при индикации аналита в режиме реального времени. Например, для водных растворов исследуемых в данной работе вирусов это ограничение лежит в мегагерцовой области. Исследования показали, что для вируса осповакцины +ДЭФ наблюдается при частоте в единицы мегагерц. В этом случае, результат +ДЭФ-увеличения концентрации ВО на сенсорном элементе можно получить только:
1) при иммобилизации (закреплении) аналита на сенсоре при высоких частотах с помощью соответствующих зондов;
2) при последующем измерении Iси(t) зависимостей при допустимых, более низких частотах, т.е. процесс +ДЭФ-манипуляции и индикация (измерение Iси(t) зависимостей) должны быть разнесены по времени.
Кроме того, вирусы, бактерии и т.д. – это биочастицы, которые могут менять свои свойства. Например, при длительном воздействии переменного сигнала мы наблюдали тенденцию к комплексообразованию и уменьшению, вплоть до полной потери, подвижности вирусов. В любом случае, сенсоры с ДЭФ-управлением являются только инструментальной платформой с опцией управления концентрацией аналита в области сенсорного элемента. Тестовая система должна иметь целевое назначение и быть оптимизирована под определенный тип аналита.
ЗАКЛЮЧЕНИЕ
Полученные в работе результаты показывают, что изготовленные на основе оптической литографии КНИ-сенсоры с ДЭФ-управляющими электродами способны обеспечить:
1) экспресс индикацию вирусов с чувствительностью на уровне ~2 × 10–17 М;
2) увеличение отклика сенсоров в 2–9 раз (по сравнению с откликом сенсоров без ДЭФ-управления) при субаттомолярной концентрации аналита;
3) возможность определения зарядового состояния вирусов (в частности, положительный эффективный заряд ВЯП и ВО) в тестируемых растворах без модификации поверхности сенсоров.
Изложенные в настоящей работе результаты применения высокочувствительных КНИ-сенсоров для регистрации вирусов – переносчиков социально значимых заболеваний вместе с накопленными к этому времени данными по их применению в решении разнообразных задач биомедицины свидетельствуют о перспективности их применения в качестве инструментальной платформы для исследовательских и диагностических задач по индикации патогенов вирусной и бактериальной формы в реальном масштабе времени, что чрезвычайно важно в экстренных ситуациях (условиях эпидемии, пандемии и.т.п.).
Список литературы
Неизвестный И.Г. Полупроводниковые нанопроволочные сенсоры // Микроэлектроника. 2009. Т. 38. № 4. С. 243–259.
Naumova O.V., Popov V.P., Safronov L.N., Fomin B.I., Nasimov D.A., Latyshev A.V., Aseev A.L., Ivanov Yu.D., Archakov A.I. Ultra-Thin SOI Layer Nanostructuring and Nanowire Transistor Formation for FemtoMole Electronic Biosensors // ESC Transactions. 2009. V. 25. № 10. P. 83–87.
Наумова О.В., Фомин Б.И., Сафронов Л.Н., Насимов Д.А., Ильницкий М.А., Дудченко Н.В., Девятова С.Ф., Жанаев Э.Д., Попов В.П., Латышев А.В., Асеев А.Л. Кремниевые нанопроволочные транзисторы для электронных биосенсоров // Автометрия. 2009. Т. 45. № 4. С. 6–11.
Naumova O.V., Fomin B.I., Nasimov D.A., Dudchenko N.V., Devyatova S.F., Zhanaev E.D., Popov V.P., Latyshev A.V., Aseev A.L., Ivanov Yu.D., Archakov A.I. SOI nanowires as sensors for charge detection // Semiconductor Science and Technology. 2010. V. 25. P. 055004.
Ivanov Yu.D., Pleshakova T.O., Kozlov A.F., Malsagova K.A., Krohin N.V., Shumyantseva V.V., Shumov I.D., Popov V.P., Naumova O.V., Fomin B.I., Nasimov D.A., Aseev A.L., Archakov A.I. SOI nanowire for the high-sensitive detection of HBsAg and α-fetoprotein // Lab on a Chip. 2012. V. 12. № 23. P. 5104–5111.
Иванов Ю.Д., Плешакова Т.О., Козлов А.Ф., Мальсагова К.А., Крохин Н.В., Кайшева А.Л., Шумов И.Д., Попов В.П., Наумова О.В., Фомин Б.И., Насимов Д.А., Асеев А.Л., Арчаков А.И. КНИ-нанопроволочный транзистор для детекции молекул D-NFATc1 // Автометрия. 2013. Т. 49. № 5. С. 119–126.
Patolsky F., Zheng G.F., Hayden O., Lakadamyali M., Zhuang X.W., Lieber C.M. Electrical detection of single viruses // Proc. Natl. Acad. Sci. USA., 2004. V. 101. P. 14017–14022.
Dmitrienko E., Naumova O., Fomin B., Kupryushkin M., Volkova A., Amirkhanov N., Semenov D., Pyshnaya I., Pyshnyi D. Surface modification of SOI-FET sensors for label-free and specific detection of short RNA analyte // Nanomedicine. 2016. V. 11. № 16. P. 2073–2082.
Ivanov Yu.D., Pleshakova T.O., Malsagova K.A., Kozlov A.F., Kaysheva A.L., Shumov I.D., Gabiullin R.A., Kurbatov L.V., Popov V.P., Naumova O.V., Fomin B.I., Nasimov D.A., Aseev A.L., Alferov A.A., Kushlinsky N.E., Lisitsa A.V., Archakov A.I. Detection of marker miRNAs in plasma using SOI-NW biosensor // Sensors and Actuators B: Chemical. 2018. V. 261. P. 566–571.
Генералов В.М., Наумова О.В., Фомин Б.И., Пьянков С.А., Хлистун И.В., Сафатов А.С., Зайцев Б.Н., Зайцева Э.Г., Асеев А.Л. Индикация белка VP-40 вируса Эбола с помощью нанопроволочного КНИ-биосенсора/ / Автометрия. 2019. Т. 55. № 6. С. 102–107.
Наумова О.В., Фомин Б.И., Дмитриенко Е.В., Пышная И.А., Пышный Д.В. Модификация поверхности КНИ-сенсоров для детекции РНК-биомаркеров // ФТП. 2020. Т. 54. № 4. Р. 394–399.
Naumova O.V., Fomin B.I., Malyarenko N.F., Popov V.P. Modification and Characterization of the Surface of SOI Nanowire Sensors // J. Nano Research. 2012. V. 18–19. P. 139–147.
Qian C., Huang H., Chen Liguo, Li X., Ge Z., Chen T., Yang Z., Sun L. Dielectrophoresis for Bioparticle Manipulation. Int // J. Mol. Sci. 2014. V. 15. P. 18281–18309.
Santos M.V.P., Béron F., Pirota K.R., Diniz J.A., Moshkalev S. Electrical Manipulation of a Single Nanowire by Dielectrophoresis. In: Nanowires – New Insights, Intech Open. 2017. Ch. 3. P. 41–58. https://doi.org/10.5772/67386
Suehiro J. Fabrication and characterization of nanomaterial-based sensors using dielectrophoresis // Biomicrofluidics. 2010. V. 4. P. 022804.
Celler G.K., Cristoloveanu S. Frontiers of silicon-on-insulator // J. App. Phys. 2003. V. 93. № 9. P. 4955–4978.
Наумова О.В., Фомин Б.И. Оптимизация отклика нанопроволочных биосенсоров // Автометрия. 2016. Т. 52. № 5. С. 21–25.
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника


