Микология и фитопатология, 2019, T. 53, № 5, стр. 311-318
Роль корневых экссудатов ячменя как источника питания во взаимоотношениях между Fusarium culmorum и Pseudomonas fluorescens
А. И. Шапошников 1, *, Н. А. Вишневская 1, **, В. Ю. Шахназарова 1, 2, ***, А. А. Белимов 1, ****, О. К. Струнникова 1, *****
1 Всероссийский НИИ сельскохозяйственной микробиологии
196608 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: ai-shaposhnikov@mail.ru
** E-mail: navishnevskaya@rambler.ru
*** E-mail: shahnazarova-v@mail.ru
**** E-mail: belimov@rambler.ru
***** E-mail: olgastrunnikova@rambler.ru
Поступила в редакцию 23.10.2018
После доработки 01.12.2018
Принята к публикации 21.12.2018
Аннотация
Корневые экссудаты как источник питания играют существенную роль в формировании ризосферного бактериального сообщества. Влияние экссудатов на развитие почвообитающих фитопатогенных грибов и их взаимоотношения с антагонистической микрофлорой изучены очень слабо. Цель исследования – изучить влияние низкомолекулярных компонентов корневых экссудатов ячменя как источника питания на развитие фитопатогенного гриба Fusarium culmorum, антагонистической бактерии Pseudomonas fluorescens и взаимоотношения между ними. Полученные данные позволят прояснить роль растения в регуляции колонизационной способности факультативного фитопатогена и в его взаимоотношениях с антагонистической ризобактерией. С помощью системы ультрапроизводительной жидкостной хроматографии (UPLC) был определен количественный состав сахаров, органических кислот и аминокислот в корневых экссудатах стерильных растений ячменя. Методом UPLC по остаточным количествам компонентов в растворе экссудатов, после выращивания в них гриба и бактерии, определены трофические потребности и предпочтения этих микроорганизмов. Установлено, что гриб и бактерия использовали для своего роста, в основном, сходный набор веществ. В модельном эксперименте при совместном культивировании в растворе экссудатов отмечены конкурентные взаимоотношения между микроорганизмами: не только бактерия подавляла гриб, но и гриб снижал численность бактерии. Исходя из остаточных количеств сахаров, органических кислот и аминокислот в растворе экссудатов, можно заключить, что гриб и бактерия конкурировали между собой за источник азота. Возможность конкуренции между грибом и бактерией за корневые экссудаты в ризосфере обсуждается.
ВВЕДЕНИЕ
Fusarium culmorum (W.G. Smith) Sacc. – факультативный фитопатогенный гриб, способный поражать широкий набор культур. Особенно он вредоносен на зерновых, что проявляется в недоборе урожая и загрязнении зерна микотоксинами (McMullen et al., 1997; Tóth et al., 2004).
Штамм ризосферной бактерии Pseudomonas fluorescens 2137 активно подавлял развитие Fusarium culmorum 30 в почве без растений (Strunnikova et al., 2007). В ризосфере ячменя и на его корнях этот штамм также подавлял гриб, что приводило к снижению заболеваемости растений гнилью. Однако и численность псевдомонады в ризосферной почве и на поверхности корней в присутствии патогена также могла снижаться (Strunnikova et al., 2008, 2011, 2015). Причины описанных нами колебаний численности штамма Pseudomonas fluorescens 2137 в ризосфере ячменя и на его корнях требуют более детального изучения механизмов взаимодействия бактерии с растением и с фитопатогенным грибом. Колебания численности биоконтрольного штамма могут быть обусловлены влиянием Fusa-rium сulmorum на экссудацию или способностью фитопатогенного гриба оказывать прямое воздействие на псевдомонаду, успешно конкурируя с ней за источники углерода и азота в ризосфере.
Ризосфера является местообитанием не только полезной, но и патогенной для растений микрофлоры. Растения через корневую экссудацию поставляют в ризосферу значительные количества углерода в виде сахаров, органических кислот и аминокислот (Bais et al., 2006). Установлено, что именно эти низкомолекулярные компоненты экссудатов являются источником питания для ризобактерий и участвуют в формировании ризосферного бактериального сообщества (Whipps, 2001; Walker et al., 2003; Somers et al., 2004; Rangel-Castro et al., 2005; Hartmann et al., 2009; Compant et al., 2010). В последние годы особенное внимание уделяется роли корневых экссудатов в регуляции деятельности полезных бактерий ризосферы, способных защитить растения от болезней (Berendsen et al., 2012; Doornbos et al., 2012; Bulgarelli et al., 2013; Bakker et al., 2018). Роль корневых экссудатов во взаимоотношениях фитопатогенный гриб – растение, фитопатогенный гриб – антагонистическая бактерия – растение все еще остается малоизученной. Проведенные исследования касаются в основном оценки влияния корневых экссудатов томата и нескольких нехозяйских растений на прорастание микроконидий патогенных и непатогенных штаммов F. oxysporum (Bolwerk et al., 2005; Kamilova et al., 2006; Steinkellner et al., 2005, 2008). Вопросы о компонентах экссудатов, которые могут быть источником питания для развития фитопатогенного гриба F. culmorum в ризосфере, о влиянии этих компонентов на взаимоотношения гриба с ризобактерией Pseudomonas fluorescens, нуждаются в изучении. Полученные данные позволят прояснить роль растения в регуляции способности факультативного фитопатогенного гриба Fusarium culmorum колонизировать ризосферу и в его взаимоотношениях с антагонистической бактерией.
Целью нашей работы было изучить влияние низкомолекулярных компонентов корневых экссудатов ячменя, как источника питания, на развитие фитопатогенного гриба F. culmorum, антагонистической бактерии Pseudomonas fluorescens и взаимоотношения между ними. На начальных этапах работы необходимо было, прежде всего, установить состав низкомолекулярных органических соединений корневых экссудатов изучаемого сорта ячменя; выяснить, какие компоненты экссудатов используют гриб и бактерию для своего роста; установить характер взаимоотношений между грибом и бактерией при их выращивании в растворе экссудатов.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы микроорганизмов. Штамм Fusarium culmorum 30, выделенный из корней ячменя, выращивали на агаризованной среде Чапека в течение 14 дней. Макроконидии смыли стерильной водой, осадили центрифугированием (4000 об./мин, 10 мин), ресуспендировали и довели до нужной концентрации. Штамм Pseudomonas fluorescens 2137 был выделен из почвы Крымского п-ова и отобран как активный колонизатор корней пшеницы. Штамм P. fluorescens 2137 выращивали в течение суток на агаризованной картофельной среде (рН 7.0). Клетки суспендировали в стерильной дистиллированной воде, осадили центрифугированием (4000 об./мин, 10 мин) и вновь суспендировали.
Условия эксперимента. Семена ячменя сорта Белогорский стерилизовали за сутки до начала эксперимента, выдерживая 30 мин в 0.1%-м р-ре AgNO3, затем многократно промыли стерильной водой и поместили в стерильные чашки Петри на влажную фильтровальную бумагу на 12–14 ч. Проросшие стерильные семена ячменя разложили на подложки из нержавеющего металла, помещенные в стеклянные сосуды емкостью 250 мл, содержащие 40 мл стерильной деионизированной воды. Всего 20 сосудов, в каждый сосуд внесли по 10 семян ячменя. Растения выращивали в течение 5 суток в фитотроне A1000 (Conviron, Великобритания) при температуре 24°С день/22°С ночь и режиме освещения 16 ч день/8 ч ночь. По окончании культивирования растения извлекли и взвесили. Часть сосудов (контрольные) хранили при –20°С до определения состава и количества сахаров, органических кислот и аминокислот в корневых экссудатах.
Оценка взаимоотношений гриба и бактерии. Другая часть сосудов с экссудатами после удаления растений была использована для определения трофических потребностей гриба и бактерии, а также для оценки взаимоотношений между ними. Сразу же после удаления растений в растворы экссудатов в одном случае внесли Fusarium culmorum в количестве 103 макроконидий/мл, в другом – Pseudomonas fluorescens (105 клеток/мл), в третьем – совместно макроконидии гриба и клетки бактерии в тех же концентрациях. Каждый из вариантов был выполнен в 3-кратной повторности, при совместном внесении гриба и бактерии количество сосудов удваивали. После 5 суток выращивания микроорганизмов в растворе корневых экссудатов количество гриба и бактерии определили посевом на среду Чапека и МПА, соответственно. Образцы с внесением гриба дополнительно микроскопировали при увеличении ×400 (микроскоп Imager A 1, Carl Zeiss, Германия) для оценки наличия и интенсивности развития грибных структур.
Анализ корневых экссудатов. Состав сахаров, органических кислот и аминокислот в корневых экссудатах и в культуральных жидкостях (экссудаты после культивирования в них гриба и бактерии) определили с использованием системы ультрапроизводительной жидкостной хроматографии (UPLC) Waters Acquity UPLC H-класса (Waters, США). Растворы корневых экссудатов фильтровали под вакуумом через мембранные фильтры с порами 0.22 мкм и концентрировали при 45°С на роторном вакуумном испарителе BUCHI R-200 (BUCHI, Швейцария) до объема 10 мл. Концентраты пропустили через колонку с катионитом DOWEX 50Wx8 для разделения на две фракции: 1) органические кислоты и сахара, 2) аминокислоты. Полученные фракции выпарили досуха и растворили в 1 мл деионизированной воды. Органические кислоты разделили на колонке Acquity CSH C18 с обнаружением на УФ-детекторе при длине волны 220 нм. Определение редуцирующих сахаров проводили методом рефрактометрии с использованием входящего в UPLC-систему детектора Waters 2414. Для анализа использовали аминоколонку Supelcosil LC-NH2 (SupelcoGland, Швейцария) с обнаружением на УФ-детекторе при 487 нм. Для определения состава протеиногенных аминокислот использовали современный высокочувствительный метод AccQ-Tag (Waters, США). Полученные производные разделяли методом обращеннофазовой хроматографии на колонке C18 WatersAccQ-Tag с обнаружением на флуоресцентном детекторе. Содержание L-триптофана анализировали в тех же образцах, что и остальные аминокислоты, но без обработки реагентом ACQ, на колонке Acquity UPLC BEH RP18 Shield с обнаружением на флуоресцентном детекторе.
Статистическую обработку результатов (определение стандартных ошибок, t-тест Стьюдента, НСР) выполняли в программе Statistica 7.0 (“StatSoft Inc.”, США) и с помощью программы для дисперсионного анализа Diana.
РЕЗУЛЬТАТЫ
Низкомолекулярные компоненты корневых экссудатов растений ячменя – это сахара, органические кислоты и аминокислоты. Значительную долю в экссудатах ячменя составляли сахара – 90.1% (табл. 1).
Таблица 1.
Соотношение основных низкомолекулярных компонентов экссудатов стерильных растений ячменя
| Фракция | Количество, нМ/растение | % |
|---|---|---|
| Сахара | 5430.2 | 90.1 |
| Органические кислоты | 548.8 | 9.1 |
| Аминокислоты | 50.2 | 0.8 |
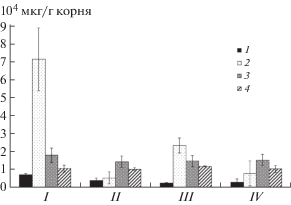
Глюкоза была основным компонентом фракции сахаров в экссудатах стерильных растений ячменя (рис. 1). Рибоза, ксилоза и арабиноза были выявлены в незначительных количествах (данные не приведены). Как показал анализ остаточных количеств сахаров в растворах экссудатов после выращивания в них микроорганизмов, гриб наиболее активно использовал именно глюкозу и в незначительных количествах фруктозу (рис. 1). Бактерия для своего роста использовала также глюкозу и фруктозу, однако, глюкозу в меньшем количестве, чем гриб. Мальтоза и мелибиоза не утилизировались микроорганизмами. Совместное культивирование в растворе экссудатов подтвердило использование грибом и бактерией глюкозы и фруктозы.
Рис. 1.
Количество и состав сахаров в корневых экссудатах стерильного ячменя (контроль) и в растворах экссудатов после выращивания в них Fusarium culmorum 30 и Pseudomonas fluorescens 2137: 1 – фруктоза, 2 – глюкоза, 3 – мальтоза, 4 – мелибиоза, I – контроль, II – Fusarium culmorum, III – Pseudomonas fluorescens, IV – Fusarium culmorum + Pseudomonas fluorescens. Вертикальные отрезки указывают стандартную ошибку средней.
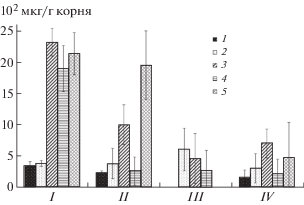
Из органических кислот в корневых экссудатах стерильного ячменя преобладали яблочная, молочная и пропионовая кислоты (рис. 2). Минорными компонентами органических кислот были: t-аконитовая, янтарная, фумаровая и пироглутамовая (на диаграмме не указаны). Яблочная и молочная кислоты были активно использованы грибом для своего роста. Бактерия утилизировала более широкий набор органических кислот, а именно лимонную, яблочную, молочную и пропионовую. Яблочная, молочная и пропионовая кислоты были использованы грибом и бактерией при их совместном культивировании в растворе экссудатов.
Рис. 2.
Количество и состав органических кислот в корневых экссудатах стерильного ячменя (контроль) и в растворах экссудатов после выращивания в них Fusarium culmorum 30 и Pseudomonas fluorescens 2137: 1 – лимонная кислота, 2 – пировиноградная кислота, 3 – яблочная кислота, 4 – молочная кислота, 5 – пропионовая кислота, I – контроль, II – Fusarium culmorum, III – Pseudomonas fluorescens, IV – Fusarium culmorum + + Pseudomonas fluorescens. Вертикальные отрезки указывают стандартную ошибку средней.
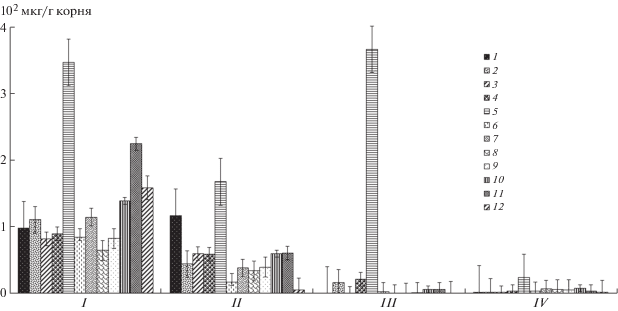
В экссудируемых стерильным ячменем аминокислотах наибольшее количество приходилось на пролин, фенилаланин и триптофан (рис. 3). Fusa-rium culmorum активнее всего утилизировал именно эти аминокислоты. Pseudomonas fluorescens для своего роста использовал почти все аминокислоты корневых экссудатов, только количество пролина не изменялось после культивирования бактериального штамма в растворе экссудатов (рис. 3). Совместно культивированные в экссудатах ячменя гриб и бактерия для своего роста использовали все выявленные аминокислоты. В корневых экссудатах стерильного ячменя были также обнаружены незначительные количества серина, глицина, аргинина, цистеина, метионина и глутаминовой аминокислоты (на диаграмме не приведены).
Рис. 3.
Количество и состав аминокислот в экссудатах стерильного ячменя (контроль) и в растворах экссудатов после выращивания в них Fusarium culmorum 30 и Pseudomonas fluorescens 2137: 1 – аспарагиновая кислота, 2 – гистидин, 3 – треонин, 4 – аланин, 5 – пролин, 6 – тирозин, 7 – валин, 8 – лизин, 9 – изолейцин, 10 – лейцин, 11 – фенилаланин, 12 – триптофан, I – контроль, II – Fusarium culmorum, III – Pseudomonas fluorescens, IV – Fusarium culmorum + Pseudomonas fluorescens. Вертикальные отрезки указывают стандартную ошибку средней.
Взаимоотношения гриба и бактерии при утилизации экссудатов. Как гриб, так и бактерия активно использовали экссудаты ячменя для своего роста. Численность Fusarium culmorum при выращивании в растворе экссудатов увеличилась с 103 до 104 КОЕ в мл, микроскопирование показало, что гриб формировал разветвленную сеть мицелия и новые макроконидии. Численность Pseudomonas fluorescens 2137 также увеличилась с 105 до 107 КОЕ/мл (табл. 2).
Таблица 2.
Показатели развития Fusarium culmorum 30 и Pseudomonas fluorescens 2137 в р-ре экссудатов ячменя
| Инокуляция | Количество P. fluorescens, КОЕ/мл | Количество F. culmorum, КОЕ/мл | Грибные структуры | ||
|---|---|---|---|---|---|
| внесено | 5-е сутки | внесено | 5-е сутки | ||
| Контроль (без инокуляции) | 0 | 0 | 0 | 0 | – |
| F. culmorum | 0 | 0 | 103 | 0.8 × 104 а | сеть мицелия, новые макроконидии |
| P. fluorescens | 1.5 × 105 | 1.4 × 107 а | 0 | 0 | – |
| F. culmorum + P. fluorescens | 1.5 × 105 | 6 × 107 а | 103 | 102 б | короткие гифы, много хламидоспор |
| 104 б | 104 а | разветвленный мицелий, мало хламидоспор | |||
Совместное культивирование Fusarium culmorum и Pseudomonas fluorescens в растворе экссудатов продемонстрировало конкурентные взаимоотношения между микроорганизмами. Из шести используемых сосудов в трех бактерия подавляла гриб, снижая его численность до 102 КОЕ/мл. Микроскопирование образцов из этого варианта показало прорастание немногих из внесенных макроконидий, в остальных были сформированы хламидоспоры. В трех сосудах, напротив, гриб снижал количество бактериального штамма до 104 КОЕ/мл (табл. 2). При этом гриб формировал разветвленный мицелий и незначительное количество хламидоспор. Формирование хламидоспор не только в сосудах, где бактерия снижала КОЕ гриба, но и в тех сосудах, где гриб подавлял бактерию, свидетельствует, что бактериальный штамм оказывал негативное влияние на гриб во всех исследуемых случаях (табл. 2).
ОБСУЖДЕНИЕ
Проведенный хроматографический анализ позволил установить количественный состав сахаров, органических кислот и аминокислот – наиболее значительных фракций экссудатов ячменя по количеству углерода. Определены компоненты корневых экссудатов, используемые Fusarium culmorum 30 и Pseudomonas fluorescens 2137 для своего роста. Установлено, что гриб и бактерия утилизируют, в основном, сходный набор веществ, однако, были выявлены и их трофические предпочтения. Из всех сахаров, содержащихся в экссудатах, гриб и бактерия предпочитали глюкозу (рис. 1). Органические кислоты и аминокислоты были активнее использованы бактерией, нежели грибом (рис. 2, 3). Способность ризобактерий использовать для своего роста органические кислоты корневых выделений была показана и другими исследователями (Lugtenberg et al., 2001; Walker et al., 2003; Rudrappa et al., 2008; Ling et al., 2011). Более того, было установлено, что именно органические кислоты являются компонентами, привлекающими ризобактерии к корням. Так, таксис Р. fluorescens WCS365 к корням томата был обусловлен наличием лимонной и яблочной кислот в экссудатах (De Weert et al., 2002; Kamilova et al., 2006). Утилизация сахаров не играла существенной роли в колонизации корней томата Р. fluorescens WCS365 (Lugtenberg et al., 1999). Яблочная кислота экссудатов наиболее активно индуцировала и хемотаксис бактерии Bacillus amyloliquefaciens к корням томата (Tan et al., 2013).
Установленный факт утилизации сходного набора веществ корневых экссудатов, свидетельствует, что за эти компоненты между Fusarium culmorum 30 и Pseudomonas fluorescens 2137 возможна конкуренция в ризосфере. В модельном эксперименте мы отметили, что не только бактерия подавляла гриб, но и гриб снижал численность бактерии (табл. 2). После совместного культивирования гриба и бактерии в растворе экссудатов еще оставались сахара и органические кислоты (рис. 1, 2). Количество же аминокислот, оставшихся после совместного культивирования микроорганизмов, приближалось к нулевым значениям (рис. 3). Исходя из полученных данных, можно заключить, что гриб и бактерия конкурировали между собой за источник азота.
Оценивая взаимодействие микроорганизмов, мы отметили, что в трех из шести сосудов гриб подавлял бактерию, а в трех – бактерия ингибировала рост гриба (табл. 2). Выявленные в эксперименте сходные пищевые потребности гриба и бактерии (рис. 1–3) частично объясняют равный эффект действия микроорганизмов друг на друга. Видимо, при таких исходных концентрациях гриба и бактерии их шансы в конкурентной борьбе за питание примерно равны.
Испытывая дефицит питательных элементов, как гриб, так и бактерия могли использовать различные приемы подавления один другого. Арсенал антагонистического действия псевдомонад против фитопатогенных грибов хорошо изучен – это продукция различных антибиотических веществ, сидерофоров, литических ферментов (Haas, Défago, 2005; Raaijmakers et al., 2006; Weller et al., 2007; Lugtenberg, Kamilova, 2009; Cornelis, 2010).
Приемы, позволяющие факультативным фитопатогенным грибам рода Fusarium активно развиваться в ризосфере и противостоять действию антагонистов, не столь хорошо изучены, как у ризобактерий. Было установлено, что фузариевая кислота, вторичный метаболит, продуцируемый грибами рода Fusarium, способна подавлять продукцию антибиотических веществ штаммами Pseudomonas fluorescens CHA0 (Notz et al., 2002) и P. chlororaphis PCL1391 (Van Rij et al., 2005), что приводило к снижению биоконтрольной активности этих бактерий. С нашей точки зрения, выживание Fusarium culmorum 30 в условиях жестких конкурентных взаимоотношений в ризосфере может быть связано не только с продукцией антибиотических веществ, но и с особенностями развития гриба, а именно с его способностью формировать разветвленную сеть мицелия и хламидоспоры. Формируя мицелий (орган питания и распространения), гриб способен уйти от непосредственного контакта с антагонистом и найти необходимые ему элементы питания. Формирование хламидоспор позволяет грибу пережить неблагоприятные условия и вновь продолжать рост в более благоприятных. Способность F. culmorum 30 формировать хламидоспоры при взаимодействии с антагонистической микрофлорой и в других неблагоприятных условиях была нами показана в нескольких экспериментах (Shakhnazarova et al., 2004). В нашем модельном эксперименте F. culmorum 30 особенно обильно формировал хламидоспоры в тех сосудах, где бактериальный штамм сильно подавлял прорастание макроконидий и рост грибных гиф (табл. 2).
Таким образом, установлено, что корневые экссудаты способны привести к конкуренции между грибом и бактерией за элементы питания. Возможно, случаи локального подавления F. culmorum 30 данного бактериального штамма происходили и в тех экспериментах, о которых мы упоминали во введении, в которых было отмечено снижение численности Pseudomonas fluorescens 2137 в присутствии гриба (Strunnikova et al., 2008, 2011, 2015). В то же время мы понимаем, что при проведении эксперимента в нестерильной почве нельзя исключить влияние и других факторов на рост интродуцированного в субстрат штамма антагонистической бактерии. Скорее всего, в естественных условиях в ризосфере растений конкуренция между Fusarium culmorum и Pseudomonas fluorescens именно за корневые экссудаты может быть ограничена микрозонами в непосредственной близости от корня и вряд ли носит массовый характер. Массовая конкуренция за экссудаты возможна лишь в случае, если эти ризодепозиты являются единственным источником углерода в ризосфере, например, в гидропонной системе. Однако, в естественных почвах источником углерода для роста микроорганизмов могут быть не только корневые экссудаты, но и растительные остатки, а также органическое вещество почвы. Почвенная биота, ее метаболиты и продукты разложения отмерших клеток также могут служить источником питания для роста микроорганизмов. По данным, полученным нами ранее, Fusarium culmorum 30 уступал Pseudomonas fluorescens 2137 в конкуренции за внесенную в нестерильную почву глюкозу, однако активно развивался при внесении в ту же почву целлюлозы, которую 2137 не утилизировал (Strunnikova et al., 2007).
Способность P. fluorescens 2137 утилизировать более широкий спектр низкомолекулярных веществ, входящих в состав экссудатов ячменя (рис. 2, 3), делает его более конкурентоспособным за эти источники углерода в ризосфере, по сравнению с грибом. Fusarium culmorum 30 утилизировал меньший набор компонентов корневых экссудатов, чем бактериальный штамм, однако, даже за оставшиеся источники питания он мог конкурировать с бактерией (табл. 2). Выживанию грибного штамма в ризосфере будет способствовать также и его способность утилизировать более сложные органические вещества, содержащие целлюлозу. Использование этих источников питания и позволяет F. culmorum развиваться даже в условиях жесткой конкуренции в ризосфере, достигать корней и колонизировать их.
Работа выполнена при поддержке РФФИ, грант № 18-016-00111 и Государственного задания, тема № АААА-А-18-118031290034-8.
Список литературы
Bais H.P., Weir T.L., Perry L.G., Gilroy S., Vivanco J.M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annu. Rev. Plant Biol. 2006. V. 57. P. 233–266.
Bakker P.A.H.M., Corne M.J., de Jonge P.R., Berendsen R.L. The Soil-borne legacy. Cell. 2018. V. 172. P. 1178–1180 https://doi.org/10.1016/j.cell.2018.02.024
Berendsen R.L., Pieterse C.M.J., Bakker P.A.H.M. The rhizosphere microbiome and plant health. Trends Plant Sci. 2012. V. 17. P. 478–486.
Bolwerk A., Lagopodi A.L., Lugtenberg B.J.J., Bloemberg G.V. Visualization of interactions between a pathogenic and a beneficial Fusarium strain during biocontrol of tomato foot and root rot. Mol. Plant Microb. Interact. 2005. V. 18. P. 710–721.
Bulgarelli D., Schlaeppi K., Spaepen S., Ver Loren van Themaat E., Schulze-Lefert P. Structure and functions of the bacterial microbiota of plants. Annu. Rev. Plant Biol. 2013. V. 64. P. 807–838.
Compant S., Clement C., Sessitsch A. Plant growth-promoting bacteria in the rhizo- and endosphere of plants: Their role, colonization, mechanisms involved and prospects for utilization. Soil Biol. Biochem. 2010. V. 42. P. 669–678.
Cornelis P. Iron uptake and metabolism in pseudomonads. Appl. Microbiol. Biotechnol. 2010. V. 86. P. 1637–1645.
De Weert S., Vermeiren H., Mulders I.H.M., Kuiper I., Hendrickx N., Bloemberg G.V., Vanderleyden J., De Mot R., Lugtenberg B.J.J. Flagella-driven chemotaxis towards exudate components is an important trait for tomato root colonization by Pseudomonas fluorescens. Mol. Plant Microb. Interact. 2002. V. 15. P. 1173–1180.
Doornbos R.F., van Loon L.C., Bakker P.A.H.M. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere. A review. Agron. Sustain. Dev. 2012. V. 32. P. 227–243. https://doi.org/10.1007/s13593-011-0028-y
Haas D., Défago G. Biological control of soil-borne pathogens by fluorescent pseudomonads. Nat. Rev. Microbiol. 2005. V. 3. P. 307–319. https://doi.org/10.1038/nrmicro1129
Hartmann A., Schmid M., Tuinen D.V., Berg G. Plant-driven selection of microbes. Plant Soil. 2009. V. 321. P. 235–257.
Kamilova F., Kravchenko L., Shaposhnikov A., Makarova N. and Lugtenberg B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365 on the composition of organic acids and sugars in tomato root exudate. Mol. Plant Microb. Interact. 2006. V. 19. P. 1121–1126. https://doi.org/10.1094/MPMI -19-1121.
Ling N., Raza W., Ma J., Huang Q., Shen Q. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. Eur. J. Soil Biol. 2011. V. 47. P. 374–379.
Lugtenberg B., Kamilova F. Plant-growth-promoting rhizobacteria. Annu. Rev. Microbiol. 2009. V. 63. P. 541–556.
Lugtenberg B.J.J., Dekkers L.C., Bloemberg G.V. Molecular determinants of rhizosphere colonization by Pseudomonas. Annu. Rev. Phytopathol. 2001. V. 39. P. 461–490.
Lugtenberg B.J.J., Kravchenko L.V., Simons M. Tomato seed and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol. 1999. V. 1. P. 439–446.
McMullen M., Jones R., Gallenberg D. Scab of wheat and barley: a re-emerging disease of devastating impact. Plant Dis. 1997. V. 81. P. 1340–1348.
Notz R., Maurhofer M., Dubach H., Haas D., Defago G. Fusaric acid-producing strains of Fusarium oxysporum alter 2,4-diacetylphloroglucinol biosynthetic gene expression in Pseudomonas fluorescens CHA0 in vitro and in the rhizosphere of wheat. Appl. Environ. Microbiol. 2002. V. 68. P. 2229–2235.
Raaijmakers J.M., de Bruijn I., de Kock M.J.D. Cyclic lipopeptide production by plant-associated Pseudomonas species: diversity, activity, biosynthesis and regulation. Mol. Plant Microb. Interact. 2006. V. 19. P. 699–710.
Rudrappa T., Czymmek K.J., Pare P.W., Bais H.P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 2008. V. 148. P. 1547–1556.
Shakhnazarova V.Y., Strunnikova O.K., Vishnevskaya N.A. Development of introduced population of Fusarium culmorum in soil: formation and lysis of fungal structures. Mikologiya i fitopatologiya. 2004. V. 38. P. 61–70 (in Russ.).
Somers E., Vanderleyden J., Srinivasan M. Rhizosphere bacterial signalling: a love parade beneath our feet. Crit. Rev. Microbiol. 2004. V. 304. P. 205–240.
Steinkellner S., Mammerler R., Vierheilig H. Microconidia germination of tomato pathogen Fusarium oxysporum in the presence of root exudates. J. Plant Interact. 2005. V. 1. P. 23–30.
Steinkellner S., Mammerler R., Vierheilig H., Germination of Fusarium oxysporum in root exudates from tomato plants challenged with different Fusarium oxysporum strains. Eur. J. Plant Pathol. 2008. V. 122. P. 395–401. https://doi.org/10.1007/s10658-008-9306-1
Strunnikova O.K., Shakhnazarova V.Yu., Vishnevskaya N.A., Chebotar V.K., Tikhonovich I.A. Development and relations of Fusarium culmorum and Pseudomonas fluorescens in soil. Microbiology. 2007. V. 76. P. 596–602. https://doi.org/10.1134/S002626170705013X
Strunnikova O.K., Shakhnazarova V.Yu., Vishnevskaya N.A., Chebotar V.K., Tikhonovich I.A. Interactions between Fusarium culmorum and Pseudomonas fluorescens in the rhizosphere and rhizoplane of barley. Mikologiya i fitopatologiya. 2008. V. 42. P. 70–77 (in Russ.).
Strunnikova O.K., Feoktistova A.S., Vishnevskaya N.A., Chebotar V.K. Role competition between Pseudomonas fluorescens 2137GUS and Fusarium culmorum for colonization of barley roots. Mikologiya i fitopatologiya. 2011. V. 45. P. 362–369 (in Russ.).
Strunnikova O.K., Vishnevskaya N.A., Ruchiy A.S., Shakhnazarova V.Yu., Vorobyov N.I., Chebotar V.K. The influence of soils with different textures on development, colonization capacity and interactions between Fusarium culmorum and Pseudomonas fluorescens in soil and on barley roots. Plant Soil. 2015. V. 389. P. 131–144. https://doi.org/10.1007/s11104-014-2351-y
Tan S., Yang C., Mei X., Shen S., Raza W., Shen Q., Xu Y. The effect of organic acids from tomato root exudates on rhizosphere colonization of Bacillus amyloliquefaciens T-5. Appl. Soil Ecol. 2013. V. 64. P. 15–22.
Tóth B., Mesterházy A., Nicholson P., Teren J., Varga J. Mycotoxin production and molecular variability of European and American isolates of Fusarium culmorum. Eur. J. Plant Pathol. 2004. V. 110. P. 587–599.
Van Rij E.T., Girard G., Lugtenberg B.J.J., Bloemberg G.V. Influence of fusaric acid on phenazine-1-carboxamide synthesis and gene expression of Pseudomonas chlororaphis strain PCL1391. Microbiology. 2005. V. 151. P. 2805–2814.
Walker T.S., Bais H.P., Grotewold E., Vivanco J.M. Root Exudation and Rhizosphere Biology. Plant Physiol. 2003. V. 132. P. 44–51.
Weller D.M., Landa B.B., Mavrodi O.V., Schroeder L.K., De la Fuente L., Blouin Bankhead S., Allende Molar R., Bonsall R.F., Mavrodi D.V., Thomashow L.S. Role of 2,4-diacetylphloroglucinol-producing fluorescent Pseudomonas spp. in the defense of plant roots. Plant Biol. 2007. V. 9. P. 4–20.
Whipps J.M. Microbial interactions and biocontrol in the rhizosphere. J. Exp. Bot. 2001. V. 52. P. 487–511.
Струнникова O.K., Шахназарова В.Ю., Вишневская Н.А., Чеботарь В.К., Тихонович И.А. (Strunnikova et al.) Взаимоотношения Fusarium culmorum и Pseudomonas fluorescens в ризосфере и ризоплане ячменя // Микология и фитопатология. 2008. Т. 42. Вып. 1. С. 68–77.
Струнникова О.К., Феоктистова А.С., Вишневская Н.А., Чеботарь В.К. (Strunnikova et al.) Роль конкуренции между Pseudomonas fluorescens 2137GUS и Fusarium culmorum за колонизацию корней ячменя // Микология и фитопатология. 2011. Т. 45. Вып. 4. С. 362–369.
Шахназарова В.Ю., Струнникова О.К., Вишневская Н.А. (Shakhnazarova et al.) Развитие интродуцированной популяции Fusarium culmorum в почве: формирование и лизис грибных структур // Микология и фитопатология. 2004. Т. 38. Вып. 1. С. 61–70.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


