Микология и фитопатология, 2020, T. 54, № 2, стр. 134-142
Влияние спор Trichoderma asperellum и метаболитов Fusarium sporotrichioides на ростовые процессы и фотосинтетический аппарат пшеницы
Т. И. Голованова 1, *, Н. А. Гаевский 1, **, А. Ф. Валиулина 1, ***, Ю. А. Литовка 1, ****
1 Сибирский федеральный университет
660041 Красноярск, Россия
* E-mail: tigolovanova@mail.ru
** E-mail: nikgna@gmail.com
*** E-mail: valiulina1988@mail.ru
**** E-mail: litovkajul@rambler.ru
Поступила в редакцию 14.02.2019
После доработки 11.06.2019
Принята к публикации 20.12.2019
Аннотация
Исследовали влияние спор Trichoderma asperellum MГ-97 и метаболитов Fusarium sporotrichioides Z3-06 на физиологические параметры молодых растений пшеницы (Triticum aestivum). Обработка спорами Trichoderma asperellum увеличивала лабораторную всхожесть семян, усиливала рост растений на 10 и 30-е сутки вегетации. Одновременно увеличилась площадь листьев, масса надземной части растений и масса корней. Влияние на содержание суммы зеленых пигментов было незначительным. Метаболиты Fusarium sporotrichioides, напротив, отрицательно влияли на большинство перечисленных показателей пшеницы. Исключение касается зеленых пигментов, содержание которых в листьях увеличилось. При совместном действии спор Trichoderma asperellum и метаболитов Fusarium sporotrichioides показатели роста были близки к контролю, однако всхожесть семян и энергия прорастания были подавлены. Флуоресценция листьев, зарегистрированная с помощью РАМ-методики в режимах “быстрая световая кривая” и “индукционная кривая” показала, что положительное действие Trichoderma asperellum на ростовые процессы молодых растений пшеницы не сопровождается активацией нециклического транспорта электронов. Сравнение фотохимического и нефотохимического тушения флуоресценции позволяет предположить: метаболиты Fusarium sporotrichioides, подавляя АТФ-синтазу, ингибируют реакцию фосфорилирования белков Lhcb2 в составе светособирающего комплекса ФСII. Trichoderma asperellum контролирует только действие метаболитов Fusarium sporotrichioides на АТФ-синтазу.
ВВЕДЕНИЕ
Микроорганизмы, заселяющие ризосферу, находятся в тесном взаимодействии с растениями и оказывают существенное влияние на их рост и развитие. Одни – продуценты разнообразных фитотоксинов – полностью подавляют и задерживают рост растений, другие обеспечивают растения необходимыми элементами питания и регуляторами роста, а также защищают от патогенных микроорганизмов и повышают устойчивость к стресс-факторам (Meera et al., 1994; Yedidia et al., 2003; Tsavkelova et al., 2006; Van Loon, 2007; Mu-kherjee et al., 2010, El Komy et al., 2015). Среди почвенных микроорганизмов особое место занимают грибы рода Trichoderma (Samuels et al., 2010). Впервые род Trichoderma был предложен Персооном в 1794 г. (Seyketov, 1982; Samuels, 2006). В настоящее время в составе рода Trichoderma известно более 200 видов. Большинство из них определены в начале XXI в. R. Weindling (1932) первым указал на потенциальную способность Trichoderma выступать эффективным агентом биоконтроля болезней растений.
Изучение антагонистических свойств и особенно избирательного действия специфических веществ, выделяемых грибами рода Trichoderma, представляет интерес в связи с выяснением характера взаимоотношений с микроорганизмами, влияния Trichoderma на отдельных представителей микрофлоры, а также для использования в борьбе с различными фитопатогенными организмами. Возможность применения различных органических субстратов с высоким выходом биомассы гриба оправдывает применение Trichoderma в биотехнологических процессах (Klein, Eveleigh, 1998).
Грибы рода Trichoderma проявляют антагонизм за счет способности 1) вытеснять медленно растущие микроорганизмы за счет быстрого освоения субстрата, 2) проявлять гиперпаразитическую активность, 3) продуцировать антибиотические вещества (Barbosa et al, 2001). Trichoderma также стимулирует процессы роста и увеличивает продуктивность культурных растений и их устойчивость к стрессорам (Meera et al., 1994; Yedidia et al., 2003; Golovanova, Loginova, 2005; Tsavkelova et al., 2006; Van Loon, 2007; Mukherjee et al., 2010).
Важным качеством определенных штаммов Trichoderma является высокая антагонистическая активность в отношении фитопатогенных грибов рода Fusarium, которые вызывают инфекционное заболевание (фузариозы) культурных растений и значительно снижают их урожайность (Gromovykh et al., 2002; Gagkaeva et al., 2011; Matarese et al., 2012, Tian et al., 2016). Представители Fusarium sporotrichioides синтезируют широкий спектр биологически активных веществ, включая группу микотоксинов (Т-2, НТ-2, диацетоксисцирпенол, зеараленон, энниатины), которые способны накапливаться в зерне и продуктах, вызывая интоксикацию у человека, сельскохозяйственных животных и птиц. Наибольшую опасность представляет Т-2 фузариотоксин из группы трихотеценов, который ингибирует синтез нуклеиновых кислот и вызывает клеточный апоптоз (D’Mello et al., 1999; Placinta et al., 1999; Burkin et al., 2008; Gagkaeva et al., 2011). Рассматривают два механизма действия грибов рода Fusarium: 1) взаимодействие спор с клетками корня, их прорастание и блокирование обменных процессов растений (Pshibytko et al., 2006) и 2) негативное влияние метаболитов F. oxysporum на накопление биомассы, фотосинтез и содержание зеленых пигментов (Wu et al., 2008). Заболевание, вызываемое Fusarium, затрагивает фотосинтетический транспорт электронов в тилакоидах, восстановительный пентозофосфатный цикл, устьичную проводимость для СО2 (Duniway, Slatyer, 1971; Lorenzini et al., 1997; Saeed et al., 1999; Santos et al., 2000). Однако данные о влиянии Fusarium на фотосинтетическую активность растений не позволяют установить, какой из перечисленных выше процессов наиболее чувствителен к этому патогену. Наиболее активным антагонистом Fusarium являются штаммы Trichoderma asperellum (Samuels et al., 1999; El Komy et al., 2015).
Стимуляция роста растений, наблюдаемая при взаимодействии с Trichoderma, не изучена с позиций концепции эндогенной регуляции (Mokronosov, 1978). Недостаточно экспериментальных данных о влиянии метаболитов Fusarium на процессы фотосинтеза. Отсутствуют данные о совместном действии Trichoderma и метаболитов Fusarium на ростовые процессы и фотосинтез.
Целью работы было исследование ростовых и фотосинтетических показателей пшеницы в условиях индивидуального и совместного влияния спор T. asperellum и метаболитов фитопатогенного гриба Fusarium sporotrichioides.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на проростках пшеницы Triticum aestivum cv. Омская-32. Поверхность семян стерилизовали 0.5%-м р-ром KMnO4 в течение 10 мин, затем 8–10 раз промывали стерильной дистиллированной водой. Избыток влаги с поверхности семян удаляли фильтровальной бумагой. Семена без видимых повреждений были разделены на группы: К (контроль) – семена, не обработанные микромицетами; TR – семена, опудренные спорами Trichoderma asperellum (штамм MG-97); FUS – семена, погруженные на 24 ч в фильтрат культуры гриба Fusarium sporotrichioides (штамм Z 3-06); FUS + TR – семена, обработанные метаболитами фузариума, высаженные в почву, обработанную спорами Trichoderma asperellum MG-97 (108 спор/мл).
Штамм Trichoderma sp. МГ-97 выделен Т.И. Громовых из почвы Маганского лесопитомника Красноярского края, депонирован в коллекции промышленных микроорганизмов под F-765. Штамм обладает высокой антагонистической активностью в отношении фитопатогенных микроорганизмов из рода Fusarium (Gromovykh et al., 2001). Fusarium sporotrichioides культивировали при 28°С в течение 14 дней на токсигенной среде Myro: глицерин – 10, сахароза – 20, KH2PO4 – 1, NaCl – 0.5, NaNO3 – 3, MgSO4 · H2O – 0.5 г л–1, на которой практически полностью подавляется споруляция и идет интенсивный биосинтез токсинов (Monastyrskiy, 1996). Иммуноферментный анализ (GOST R 52471-2005, 2006), проведенный на базе Краевой ветеринарной лаборатории г. Красноярска, подтвердил способность используемого в работе сибирского штамма F. sporotrichioides синтезировать Т-2 фузариотоксин. Семена по 50 штук каждого варианта высадили в контейнеры (18 дм3) с почвой, состоящей из верхового торфа, низового торфа, песка и доломитовой муки (pH 5.5–6.5, азота – 30%, фосфора – 30%, калия – 40%).
Растения выращивали при естественном освещении (фотопериод 16–17 ч), средний уровень облученности 300 мкмоль фотонов м–2 с–1; относительная влажность воздуха 75 ± 3%; температура воздуха 25 ± 2°C. Для полива использовали отстоянную водопроводную воду, поддерживая относительную влажность почвы на уровне 60%. На 30-й день выращивания растения сформировали 3–4 листа.
Всхожесть семян определяли по GOST 12038-84 (2011). Сырую и сухую массу целого растения, длину надземной части и главного корня определяли на 10 и 30-е сутки. Площадь листьев измеряли с помощью программы Image-J 1.43 на основе сканированного изображения. Относительные изменения физиологических показателей рассчитывали согласно формуле: (О – K)/K, где О – значения в опыте, K – значения в контроле.
Листья (в каждом варианте объединяли вторые листья) фрагментировали и тщательно перемешивали. Навеску от 80 до 100 мг переносили в пробирку, добавляли 10 мл 96%-го этилового спирта, нагревали при 70°C в течение 30 мин. Полная экстракция пигментов проходила в темноте при 4°C в течение 12–14 ч. Оптическую плотность определяли с помощью спектрофотометра Specol-1300 (Germany). Концентрацию хлорофиллов (мкг/мл) рассчитывали по (Wintermans, DeMots, 1965): Са = = 13.7 × (D665 – D720) – 5.76 × (D649 – D720); Cb = 25.8 × × (D649 – D720) – 7.6 × (D665 – D720). Содержание пигментов выражали в мг× г–1 сырой массы. Долю хлорофиллов (a + b) в составе светособирающих комплексов (ССК) рассчитывали по Lichtenthaler (1987): CCK = (1.2 × Cb + Cb)/(Ca + Cb), считая, что весь хлорофилл b входит в состав ССK и отношение хлорофиллов a/b в ССК лежит в интервале 1.1–1.3.
Фотосинтетическую активность листьев определяли на 30-е сутки на основе показателей быстрой флуоресценции хлорофилла. Использовали флуориметр JUNIOR-PAM (Walz, Effeltrich, Germany) и программу WinControl-3 в режимах записи “Световая кривая” и “Индукция”. Световую кривую регистрировали в диапазоне (66–828) × × 10–6 М фотонов м–2 с–1, индукционную кривую – при световой облученности 420 × 10–6 М фотонов м–2 с–1. Максимальный квантовый выход ФС2 [Y(II)m] рассчитывали на основе нулевого F0 и максимального Fm уровней (Kitajima, Butler, 1975): Y(II)m = (Fm – F0)/Fm.
Скорость фотосинтетического транспорта электронов (ETR, мкмоль электронов м–2 с–1) определяли по уравнению: ETR = Y(II)ETRfactorIPAR × 0.5, где Y(II) квантовый выход ФС2 равный (Fm' – F')/Fm', Fm' – максимальный уровень флуоресценции в условиях насыщающей вспышки света при заданном уровне световой энергии, F' – уровень непосредственно перед насыщающей вспышкой, ETRfactor – эффективность поглощения света листовой пластинкой, обычно принимают равным 0.84, IPAR – световой поток в области ФАР (мкмоль фотонов м–2 с–1), 0.5 – доля фотонов, поглощенных ФС2 (Ritchie, 2008). Программное обеспечение Junior-PAM позволяет определить: α – тангенс угла наклона световой кривой на линейном начальном участке (квантовый выход фотосинтеза электрон/фотон); ETRm – максимальную скорость транспорта электронов (×10–6 М электронов м–2 с–1); Ek – минимальную насыщающую IPAR (×10–6 М фотонов м–2 с–1) (Jassby, Platt, 1976).
При определении физиологических параметров использовали 20–30 растений, флуоресцентных характеристик – не менее 15 растений.
Достоверность различий средних определяли на основе критерия Тьюки–Крамера (p < 0.05). Количественные данные представлены как M ± m.
РЕЗУЛЬТАТЫ
Относительные различия физиолого-морфологических показателей контрольных и опытных растений пшеницы на 10 и 30 сутки вегетации показаны на рис. 1. Обработка семян спорами Trichoderma asperellum положительно влияла на все исследованные физиолого-морфологические параметры пшеницы. Достоверные отличия средних величин в опытных вариантах от контроля проявились в тех случаях, когда стимулирующий эффект превышал 20% (для лабораторной всхожести при 11%). Стимуляцию на уровне 20% наблюдали для длины корня, сырой биомассы (30-е сутки), площади листьев (10-е сутки); на уровне 40% – для длины корня и сырой биомассы (10-е сутки). Наибольшую стимуляцию отмечали для сухой биомассы на 10 и 30-е сутки (100 и 67%, соответственно), наименьшую (10%) – для длины надземной части. Стимулирующий эффект T. asperellum на физиолого-морфологические показатели во всех случаях был выше на 10 сутки. Полученные результаты согласуются с данными работ (Yedidia et al., 2001; Golovanova et al., 2009).
Рис. 1.
Относительные изменения физиологических показателей растений пшеницы на 10 и 30-е сутки вегетации по сравнению с контролем: А – семена, опудренные спорами Trichoderma asperellum (TR); Б – семена, погруженные на 24 ч в фильтрат культуры Fusarium sporotrichioides (FUS); В – семена, обработанные метаболитами фузариума, высаженные в почву, обработанную спорами Trichoderma asperellum (FUS + TR); ЛВ – лабораторная всхожесть; ДНЧ – длина надземной части; ДК – длина корня; Б – биомасса целого растения; ПЛ – площадь листьев.
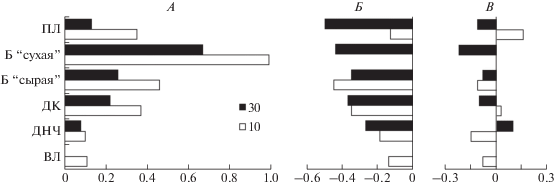
Метаболиты Fusarium sporotrichioides во всех случаях оказали негативное действие на физиолого-морфологические параметры пшеницы (рис. 1). Отклонения средних величин в опытном варианте от контроля больше, чем на 20%, были достоверны. Для большинства показателей ингибирование составляло от 35 до 50% от контроля. Максимальный эффект наблюдали на 30-е сутки.
Споры Trichoderma в почве вызывали различные эффекты (рис. 1). В большинстве случаев в варианте FUS + TR показатели уступали контролю. Различия лабораторной всхожести, сырой и сухой биомассы растения по сравнению с контролем достоверны. Trichoderma не только ослабила действие метаболитов F. sporotrichioides, но и увеличила длину надземной части и площадь листьев по отношению к контролю на 10 сутки вегетации растения.
Содержание фотосинтетических пигментов в листьях представлено в табл. 1. В варианте TR содержание хлорофиллов а и b, их сумма и доля ССК уменьшились по отношению к контролю. Влияние Trichoderma было достоверным только на 10-е сутки. Снижение содержания хлорофиллов а и b и их суммы составляло 10, 5 и 16%, соответственно.
Таблица 1.
Влияние микромицетов на содержание фотосинтетических пигментов у пшеницы
| Параметры | Время вегетации, сутки | Варианты опыта | |||
|---|---|---|---|---|---|
| К | TR | FUS | FUS + TR | ||
| Хлорофилл a, мг/г с.м. | 10 | 1.14 ± 0.01 | 1.02 ± 0.03 | 1.65 ± 0.15 | 0.98 ± 0.06 |
| 30 | 1.87 ± 0.02 | 1.84 ± 0.02 | 2.13 ± 0.04 | 1.96 ± 0.13 | |
| Хлорофилл b, мг/г с.м. | 10 | 0.44 ± 0.00 | 0.31 ± 0.02 | 0.72 ± 0.10 | 0.42 ± 0.03 |
| 30 | 0.72 ± 0.02 | 0.68 ± 0.07 | 0.99 ± 0.02 | 0.80 ± 0.07 | |
| Сумма хлорофиллов a + b, мг/г с.м. | 10 | 1.58 ± 0.02 | 1.33 ± 0.06 | 2.37 ± 0.09 | 1.40 ± 0.07 |
| 30 | 2.69 ± 0.05 | 2.52 ± 0.09 | 3.13 ± 0.07 | 2.76 ± 0.09 | |
| Светособирающий комплекс | 10 | 0.62 ± 0.01 | 0.50 ± 0.02 | 0.67 ± 0.02 | 0.66 ± 0.05 |
| 30 | 0.61 ± 0.01 | 0.59 ± 0.04 | 0.70 ± 0.00 | 0.64 ± 0.05 | |
Примечание. К – контроль; TR – семена, опудренные спорами Trichoderma asperellum; FUS – семена, погруженные на 24 ч в фильтрат культуры Fusarium sporotrichioides; FUS + TR – семена, обработанные метаболитами фузариума, высаженные в почву, обработанную спорами Trichoderma asperellum. Достоверность различий от контроля выделена подчеркиванием.
Положительные достоверные эффекты были получены в варианте FUS за весь период вегетации. Наибольшее увеличение зеленых пигментов и их суммы наблюдали на 10-е сутки (хлорофилл а – 44%, хлорофилл b – 62% и сумма – 50%). Влияние F. sporotrichioides на 30 сутки составляло 14, 38 и 16%, соответственно. В варианте FUS + TR содержание хлорофилла а и сумма хлорофиллов а и b на 10-е сутки достоверно уменьшались на 15 и 11%, соответственно, по сравнению с контролем.
Параметры световой кривой нециклического транспорта электронов у листьев пшеницы на 30-е сутки вегетации представлены в табл. 2. Тангенс угла наклона (α) световой кривой в контроле и в вариантах TR, TR + FUS изменялся от 0.249 до 0.271 (различия недостоверны). В варианте FUS величина α (α = 0.219 ± 0.006) была минимальной и достоверно отличалась от других вариантов.
Таблица 2.
Влияние микромицетов на параметры световой кривой фотосинтетического нециклического транспорта электронов у пшеницы на 30-е сутки вегетации
| Параметры | Варианты опыта | |||
|---|---|---|---|---|
| К (n = 21) | TR (n = 27) | FUS (n = 12) | FUS + TR (n = 19) | |
| α | 0.265 ± 0.006 | 0.263 ± 0.007 | 0.219 ± 0.006 | 0.261 ± 0.012 |
| ETRm | 31.2 ± 1.7 | 29.4 ± 1.6 | 26.8 ± 1.3 | 34.7 ± 1.8 |
| Ek | 119.1 ± 7.8 | 113.2 ± 6.1 | 123.3 ± 6.8 | 131.0 ± 5.0 |
Примечание. Условные обозначения – см. табл. 1; n – количество исследованных растений в вариантах.
Значения ETRm в контроле (31.2 ± 1.7 мкмоль фотонов м–2 с–1), вариантах: TR (29.4 ± 1.6 мкмоль фотонов м–2 с–1) и TR + FUS (34.7 ± 1.8 мкмоль фотонов м–2 с–1) достоверно не различались, но были достоверно выше, чем в варианте FUS (26.8 ± 1.3 мкмоль фотонов × м–2 с–1). Минимальная насыщающая интенсивность света (Ek) не показала достоверных различий между контролем и остальными вариантами. Среднее значение Ek составляло (122 ± 4) мкмоль фотонов м–2 с–1.
Максимально возможный квантовый выход [Y(II)max] фотохимической реакции с участием ФС2, регистрируемый при первой короткой (t ~ 1 с) насыщающей вспышке света с помощью РАМ флуориметра, у всех исследованных вариантов растений варьировал слабо и составлял 0.76 ± 0.01. Для большинства изученных видов с C3-типом фотосинтетического метаболизма нормой являются значения Y(II)max в интервале от 0.78 до 0.84 (Björkman et al., 1987).
Индукционные изменения квантового выхода фотохимического (Y(II)) и нефотохимического Y (NPQ) тушения флуоресценции показаны на рис. 2А и 2Б. Включение актиничного света вызывало быстрое (в пределах 12 с) падение величины Y(II) (рис. 2А). В контрольном варианте и вариантах TR и FUS минимальные значения Y(II) составляли 0.043 ± 0.002, в варианте FUS + TR – 0.073 ± ± 0.007. Следующий за спадом медленный рост Y(II) в интервале 15–300 с происходил во всех вариантах. В контроле и вариантах TR и FUS + TR кинетические кривые достоверно не различались, в варианте FUS скорость роста Y(II) существенно уступала остальным трем вариантам. Величина Y(II) в конце индукционного периода в варианте TR незначительно уступала контрольному и опытному варианту FUS + TR. Величина Y(II) в варианте FUS была ниже контрольного варианта в 1.7 раза.
Рис. 2.
Светоиндуцированные изменения квантового выхода фотохимического [Y(II)] (А) и нефотохимического [Y(NPQ)] (Б) тушения флуоресценции у растений пшеницы на 30-е сутки вегетации: 1 – семена, не обработанные микромицетами (контроль); 2 – семена, погруженные на 24 ч в фильтрат культуры Fusarium sporotrichioides (FUS); 3 – семена, обработанные метаболитами фузариума, высаженные в почву, обработанную спорами Trichoderma asperellum (FUS + TR); 4 – семена, опудренные спорами T. asperellum (TR).
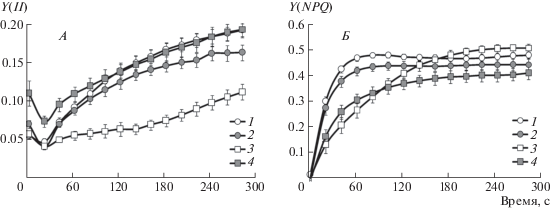
Индукционные кривые нефотохимического тушения Y(NPQ) (рис. 2Б) сравнили по тангенсу угла наклона на начальном участке и по стационарной величине. Значения тангенса угла наклона в контроле (0.020 ± 0.001) и варианте TR (0.019 ± ± 0.001) достоверно отличались от вариантов FUS (0.010 ± 0.002) и FUS + TR (0.013 ± 0.001). Наибольшее значение стационарной величины Y(NPQ) показал вариант FUS (0.501 ± 0.015), минимальное – вариант FUS + TR (0.403 ± 0.024). В контроле и варианте TR значения Y(NPQ) составляли 0.473 ± 0.012 и 0.437 ± 0.022, соответственно.
ОБСУЖДЕНИЕ
Увеличение размеров и массы у проростков пшеницы на 10 и 30 день вегетации (рис. 1) после обработки семян спорами Trichoderma asperellum штамм MГ-97 подтвердило возможность участия в регуляции ростовых процессов растений экзометаболитов гриба, которые появляются после прорастания спор и развития мицелия. Снижение стимуляции роста пшеницы на 30-е сутки вегетации под действием спор T. asperellum, вероятно, связано с ранним переходом растений к процессу образования репродуктивных органов (Golovanova, Timonina, 2004).
Ингибирующее влияние Fusarium sporotrichioides на все морфофизиологические параметры растения, включая всхожесть семян, указывает на то, что его метаболиты проникают в ткани растения уже на этапе обработки семян. Растения не способны мобилизовать свой иммунный потенциал для защиты от патогенов на ранних стадиях развития, что согласуется с данными литературы (Bioregulation.., 2010).
Trichoderma asperellum MГ-97, наряду с другими известными штаммами этого гриба (Gomes et al., 2015, Singh et al., 2018), способен снижать ингибирующее действие метаболитов Fusarium sporotrichioides на ростовые процессы растений. Нейтрализующее действие Trichoderma asperellum может быть связано с его способностью к ингибированию синтеза митотоксинов Fusarium sporotrichioides, либо с их разрушением (El-Hasan et al., 2008).
Под влиянием метаболитов F. sporotrichioides (табл. 1) достоверно возрастала сумма хлорофиллов a и b: 10-е сутки – на 50, 30-е сутки – на 16%. Подобные изменения реакции в содержании пигментов у растений на стрессовые факторы отмечали Lichtenthaler (1987), Green , Durnford (1996), Kitajima, Hogan.(2003), Xing et al. (2013), Pavlović et ai. (2014), Filimon et al. (2016), Sayyad-Amin et al. (2016), Shah et al. (2017). С увеличением времени воздействия патогена содержание зеленых пигментов уменьшилось. Влияние микромицетов на рост, морфологические и физиологические параметры растений в рамках концепции эндогенной регуляции (Mokronosov, 1978) должно затрагивать процессы фотосинтеза. Однако обработка спорами Trichoderma asperellum не оказывала влияния на скорость нециклического транспорта электронов в условиях насыщения (табл. 2). Fusarium sporotrichioides ингибировал данный процесс. Дополнительное внесение Trichoderma asperellum снижало этот ингибирующий эффект.
Дополнительную информацию о функционировании фотосинтеза в период, когда происходит настройка световых и темновых процессов, дал анализ индукции флуоресценции при переходе “темнота–свет”. Характер индукционных кривых квантового выхода ФСII [Y(II), рис. 2А] указывает на значительное снижение скорости электронного транспорта на участке после первичного акцептора ФСII на 20-й секунде индукции. Процесс происходит у всех вариантов и может быть связан с образованием электрохимического потенциала ионов Н+ на мембране тилакоида.
Следующее за этим расходование электрохимического потенциала ионов Н+ в реакции фотофосфорилирования сопровождается ростом Y(II) и, вероятно, также увеличением скорости нециклического транспорта электронов. Среди изученных вариантов только метаболиты Fusarium sporotrichioides повлияли на медленную кинетику Y(II) (рис. 2А), что, вероятно, связано со снижением активности АТФ-синтазы и сохранением электрохимического потенциала ионов Н+ на мембране тилакоида. Обработка спорами Trichoderma asperellum устраняла негативное действие метаболитов Fusarium sporotrichioides на индукцию Y(II) (рис. 2А), но не влияла на индукцию квантового выхода нефотохимического тушения флуоресценции [Y(NPQ), рис. 2Б)].
Сопоставляя результаты исследования фотохимического и нефотохимического тушения флуоресценции, можно предположить, что метаболиты F. sporotrichioides наряду с подавлением АТФ-синтазы ингибируют реакцию фосфорилирования белков Lhcb2 в составе светособирающего комплекса ФСII, которые играют ключевую роль в нефотохимическом тушении флуоресценции (Pietrzykowska et al., 2014). Trichoderma asperellum контролирует только действие метаболитов Fusarium sporotrichioides на АТФ-синтазу.
Проведенные исследования подтвердили высказанное ранее заключение (Golovanova, Loginova, 2005), что Trichoderma asperellum посредством своих метаболитов стимулирует ростовые процессы в растениях, в том числе и необходимый для накопления биомассы рост листьев (фото ассимиляционного аппарата). Однако, положительное действие T. asperellum на ростовые процессы молодых растений пшеницы не сопровождается активацией нециклического транспорта электронов.
Авторы выражают благодарность д.б.н., профессору кафедры биотехнологии ФГАОУ ВО Первого Московского государственного медицинского университета имени И.М. Сеченова, Т.И. Громовых за предоставленный споровый материал гриба Trichoderma asperellum MG-97.
Список литературы
Barbosa M.A.G., Rehn K.G., Menezes M., Mariano RdeL. Antagonism of Trichoderma species on Cladosporium herbarum and their enzymatic characterization. Brazilian J. Microbiol. 2001. V. 32 (2). P. 98–104. https://doi.org/10.1590/S1517-83822001000200005
Bioregulation of microbial-plant systems. G.A. Iutynska, S.P. Ponomarenko (eds). Kyiv, 2010 (in Russ).
Björkman O., Demming B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins. Planta. 1987. V. 170 (4). P. 489–504. https://doi.org/10.1007/BF00402983
Burkin A.A., Soboleva N.A., Kononenko G.P. Toxin production by Fusarium poae from cereal grain in East Siberia and Far East regions. Mikologiya i fitopatologiya. 2008. V. 42 (2). P. 354–358 (in Russ.).
Duniway J.M., Slatyer R.O. Gas exchange studies on the transpiration and photosynthesis of tomato leaves affected by Fusarium oxysporum f. sp. lycopersici. Phytopathology. 1971. V. 61. P. 1377–1381. https://doi.org/10.1094/Phyto-61-1377
El Komy M.H., Saleh A.A., Eranthodi A., Molan Y.Y. Characterization of novel Trichoderma asperellum isolates to select effective biocontrol agents against tomato Fusarium wilt. Plant Pathology. 2015. V. 31 (1). P. 50–60. https://doi.org/10.5423/PPJ.OA.09.2014.0087.
El-Hasan A., Walker F., Buchenauer H. Trichoderma harzianum and its metabolite 6-pentyl-alpha-pyrone suppress fusaric acid produced by Fusarium moniliforme. J. Phytopathol. 2008. V. 156 (2). P. 79–87. https://doi.org/10.1111/j.1439-0434.2007.01330
Filimon R.V., Rotaru L., Filimon R.M. Quantitative investigation of leaf photosynthetic pigments during annual biological cycle of Vitis vinifera L. table grape cultivars. S. Afr. J. Enol. Vitic. 2016. V. 37 (1). P. 1–14. https://doi.org/10.21548/37-1-753
Gagkayeva T.U., Gavrilova O.P., Levitin M.M., Novozhilov K.V. Fusarium of cereals. Zashchita i karantin rasteniy. 2011. N 5. P. 86–91 (in Russ.).
Golovanova T.I., Timonina T.V. Effect of spores of fungus of the genus Trichoderma on tomatoes. Vestnik Krasnoyarskogo gosudarstvennogo universiteta. 2004. N 7. P. 48–53 (in Russ.).
Golovanova T.I., Loginova Y.A. The reaction of the photosynthetic apparatus to the treatment of wheat plants with spores of the fungus of the genus Trichoderma. Vestnik Krasnoyarskogo gosudarstvennogo universiteta. 2005. N 5. P. 210–215 (in Russ.).
Golovanova T.I., Dolinskaya Y.V., Sichkaruk Y.A. The relationship of soil fungus Trichoderma and spring wheat. Vestnik KrasGAU. 2009. N 7. P. 102–107 (in Russ.).
Gomes E.V., Costa M.N., Paula R.G., Azevedo R.R., Silva F.L., Noronha E.F., Ulhoa C.J., Monteiro V.N., Cardoza R.E., Gutiérrez S., Silva R.N. The Cerato-Platanin protein Epl-1 from Trichoderma harzianum is involved in mycoparasitism, plant resistance induction and self cell wall protection. Sci. Rep. 2015. V. 5. P. 17998. https://doi.org/10.1038/srep17998
GOST 12038-84. Agricultural seeds. Methods for determination of germination. Moscow, Standartinform, 2011 (in Russ.).
GOST R 52471 – 2005. Feedstuffs. Immunoenzyme method of mycotoxin determination. Moscow, Standartinform, 2006 (in Russ.).
Green B.R., Durnford D.G. The chlorophyll – carotenoid proteins of oxygenic photosynthesis. Annu. Rev. Plant Physiol. Plant Mol. Biol. 1996. V. 47. P. 685–714. https://doi.org/10.1146/annurev.arplant.47.1.685
Gromovykh T.I., Shmarlovskaya S.V., Tyulpanova V.A., Gromovykh V.S. Strain of the fungus Trichoderma sp. MG-97 used to protect conifer seedlings from fusariosis. Patent. 2001. № 2171580 (in Russ.).
Gromovykh T.I., Litovka Yu.A., Gromovykh B.C., Makhova Ye.G. Effect of Trichoderma asperellum (strain MG 97) towards fusariosis of Larix sibirica seedlings. Mikologiya i fitopatologiya. 2002. V. 36 (4). P. 70–75 (in Russ.).
Jassby A.D., Platt T. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton. Limnol Oceanogr. 1976. V. 21 (4). P. 540–547. https://doi.org/10.4319/lo.1976.21.4.0540
Kitajima M., Butler W.L. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromo-thymoquinone. Biochem. Biophys. Acta. 1975. V. 376. P. 105–115. https://doi.org/10.1016/0005-2728(75)90209-1
Kitajima K., Hogan K.P. Increases of chlorophyll a/b ratios during acclimation of tropical woody seedlings to nitrogen limitation and high light. Plant, Cell and Environment. 2003. V. 26. P. 857–865. https://doi.org/10.1046/j.1365-3040.2003.01017.x
Klein D., Eveleigh D.E. Ecology of Trichoderma. In: C.P. Kubicek, G.E. Harman (eds.) Trichoderma and Gliocladium. Basic biology, taxonomy and genetics. V. 1. London, Taylor and Francis Ltd., 1998. P. 57–73.
Lichtenthaler H.K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. Methods in Enzymology. 1987. V. 148. P. 350–382. https://doi.org/10.1016/0076-6879(87)48036-1
Lorenzini G., Guidi L., Nali C., Ciompi S., Soldatini G.F. Photosynthetic response of tomato plants to vascular wilt diseases. Plant Science. 1997. V. 124. P. 143–152. https://doi.org/10.1016/S0168-9452(97)04600-1
Matarese F., Sarrocco S., Gruber S., Seidl-Seiboth V., Vannacci G. Biocontrol of Fusarium head blight: interactions between Trichoderma and mycotoxigenic Fusarium. Microbiology. 2012. V. 158. P. 98–106. https://doi.org/10.1099/mic.0.052639-0
Meera M.S., Shivanna M.B., Kageyama K., Hyakumachi M. Plant growth promoting fungi from Zoysiagrass rhizosphere as potential inducers of systemic resistance in cucumbers. Phytopathology. 1994. V. 84. P. 1399–1406. https://doi.org/10.1264/jsme2.me10176
D’Mello J.P.F., Placinta C.M., Macdonald A.M.C. Fusarium mycotoxins: a review of global implications for animal health, welfare and productivity. Animal Feed Sci. Technol. 1999. V. 80. P. 183–205. https://doi.org/10.1016/S0377-8401(99)00059-0
Mokronosov A.T. Endogenous regulation of photosynthesis in the whole plant. Fiziologiya rasteniy. 1978. V. 25 (5). P. 938–951 (in Russ.).
Monastyrskiy O.A. Toxins of phytopathogenic fungi. Zashchita i karantin rasteniy. 1996. N 3. P. 12–14 (in Russ.).
Mukherjee P.K., Kenerley Ch.M. Regulation of morphogenesis and biocontrol properties in Trichoderma virens by a Velvet Protein Vel1. Applied and environmental microbiology. 2010. V. 76 (7). P. 2345–2352. https://doi.org/10.1128/AEM.02391-09
Pavlović D., Nikolić B., Đurović S., Waisi H., Anđelković A., Marisavljević D. Chlorophyll as a measure of plant health: Agroecological aspects. Pestic. Phytomed. V. 29 (1). 2014. P. 21–34. https://doi.org/10.2298/PIF1401021P
Pietrzykowska M., Suorsa M., Semchonok D.A., Tikkanen M., Boekema E.J., Aro E.M., Jansson S. The light-harvesting chlorophyll a/b binding proteins Lhcb1 and Lhcb2 play complementary roles during state transitions in Arabidopsis. The Plant Cell. 2014. V. 26 (9). P. 3646–3660. https://doi.org/10.1105/tpc.114.127373
Placinta C.M.D’Mello J.P.F., Macdonald A.M.C. A review of worldwide contamination of cereal grains and animal feed with Fusarium mycotoxins. Animal feed science and technology. 1999. № 78. P. 21–37. https://doi.org/10.1016/S0377-8401(98)00278-8
Pshibytko N.L., Zenevich L.A., Kabashnikova L.F. Changes in the photosynthetic apparatus during fusarium wilt of tomato. Fiziologiya rasteniy. 2006. V. 53 (1). P. 31–37 (in Russ.).
Ritchie R.J. Fitting light saturation curves measured using modulated fluorometry. Photosynth Res. 2008. V. 96. P. 201–215. https://doi.org/10.1007/s11120-008-9300-7
Saeed I.A.M., MacGuidwin A.E., Rouse D.I., Sharkey T.D. Limitation to photosynthesis in Pratylenchus penetrans and Verticillium dahliae infected potato. Crop Science. 1999. V. 39. P. 1340–1346. https://doi.org/10.2135/cropsci1999.3951340x
Samuels G.J., Lieckfeldt E., Nirenberg H.I. Trichoderma asperellum, a new species with warted conidia, and redescription of T. viride. Sydowia. 1999. V. 51 (51). P. 71–88.
Samuels G.J. Trichoderma: Systematics, the sexual state, and ecology. Phytopathology. 2006. V. 96. P. 195–206. https://doi.org/10.1094/PHYTO-96-0195
Samuels G.J., Ismaiel A., Bon M.C., De Respinis S., Petrini O. Trichoderma asperellum sensu lato consists of two cryptic species. Mycologia. 2010. V. 102 (4). P. 944–966. https://doi.org/10.3852/09-243
Sayyad-Amin P., Jahansooz MR., Borzouei A., Ajili F. Changes in photosynthetic pigments and chlorophyll-a fluorescence attributes of sweet-forage and grain sorghum cultivars under salt stress. J. Biol. Phys. 2016. V. 42. P. 601–620. https://doi.org/10.1007/s10867-016-9428-1
Santos L., Lucio J., Odair J., Carneiro M.L., Alberto C. Symptomless infection of banana and maize by endophytic fungi impairs photosynthetic efficiency. New Phytol. 2000. V. 147. P. 609–615.
Seyketov G.S.H. Trichoderma fungi and their use in practice. Alma-Ata, Nauka, 1982 (in Russ.).
Shah S.H., Houborg R., McCabe M.F. Response of chlorophyll, carotenoid and SPAD-502 measurement to salinity and nutrient stress in wheat (Triticum aestivum L.). Agronomy. 2017. V. 7 (61). P. 1–20. https://doi.org/10.3390/agronomy7030061
Singh A., Shukla N., Kabadwal B.C., Tewari A.K., Kumar J. Review on plant – Trichoderma-pathogen interaction. Int. J. Current Microbiol. Appl. Sci. 2018. V. 7 (2). P. 2381–2397. https://doi.org/10.20546/ijcmas.2018.702.291
Tian Y., Tan Y., Liu N., Yan Z., Liao Y., Chen J., de Saeger S. Detoxification of deoxynivalenol via glycosylation represents novel insights on antagonistic activities of Trichoderma when confronted with Fusarium graminearum. Toxins. 2016. V. 8 (11). P. 335. https://doi.org/10.3390/toxins8110335
Tsavkelova E.A., Klimova S.Y., Cherdyntseva T.A. and Netrusov A.I. Microbial producers of plant growth stimulators and their practical use: A review. Applied Biochem. Microbiol. 2006. V. 42. P. 117–126.
Van Loon L.C. Plant responses to plant growth-promoting rhizobacteria. Plant Pathology. 2007. V. 119. P. 243–254. https://doi.org/10.1007/s10658-007-9165-1
Weindling R. Trichoderma lignorum as a parasite of other soil fungi. Phytopathology. 1932. V. 22. P. 837–845.
Wintermans I.F., Mots A. Spectrophotometric characteristics of chlorophylls a and b and their pheophytins in ethanol. Biochim Biophys Acta. 1965. V. 109. P. 448–453. https://doi.org/10.1016/0926-6585(65)90170-6
Wu H.-Sh., Bao W., Liu D.-Y., Ling N., Ying R.-R., Raza W., Shen Q.-R. Effect of fusaric acid on biomass and photosynthesis of water-melon seedlings leaves. Caryologia. 2008. V. 61 (3). P. 258–268. https://doi.org/10.1080/00087114.2008.10589638
Xing W., Wang J., Liu H., Zou D., Zhao H. Influence of natural saline-alkalistress on chlorophyll content and chloroplast ultrastructure of two contrasting rice (Oryza sativa L. japonica) cultivars. Australian journal of Crop Science. 2013. V. 7 (2). P. 289–292.
Yedidia I., Srivastva A.K., Kapulnik Y., Chet I. Effect of Trichoderma harzianum on microelement concentrations and increased growth of cucumber plants. Plant and Soil. 2001. V. 235 (2). P. 235–242.
Yedidia I., Shoresh M., Kerem Z., Benhamou N., Kapulnik Y., Chet I. Concomitant induction of systemic resistance to Pseudomonas syringae pv. lachrymans in cucumber by Trichoderma asperellum (T–203) and accumulation of phytoalexins. Applied Envir. Microbiol. 2003. V. 69 (12). P. 7343–7353. https://doi.org/10.1128/aem.69.12.7343-7353.2003
Биорегуляция микробно-растительных систем (Bioregulation). Под ред. Г.А. Иутинской, С.П. Пономаренко. Киев: Ничлава, 2010. 472 с.
Буркин А.А., Соболева Н.А., Кононенко Г.П. (Burkin et al.). Токсинообразующая способность штаммов Fusarium poae из зерна хлебных злаков Восточно-Сибирского и Дальневосточного регионов // Микология и фитопатология. 2008. Т. 42. № 2. С. 354–358.
Гагкаева Т.Ю., Гаврилова О.П., Левитин М.М., Новожилов К.В. (Gagkayeva et al.) Фузариоз зерновых культур // Защита и карантин растений. 2011. № 5. 54 с.
Голованова Т.И., Тимонина Т.В. (Golovanova, Timonina) Влияние спор гриба рода Trichoderma на томаты // Вестник Красноярского государственного университета. 2004 (7). С. 48–53.
Голованова Т.И., Логинова Е.А. (Golovanova, Loginova) Реакция фотосинтетического аппарата на обработку растений пшеницы спорами гриба рода Trichoderma // Вестник Красноярского государственного университета. 2005 (5). С. 210–215.
Голованова Т.И., Долинская Е.В., Сичкарук Е.А. (Golovanova et al.) Взаимоотношения почвенного гриба Trichoderma и яровой пшеницы // Вестник КрасГАУ. Красноярск. 2009. № 7. С. 102–107.
ГОСТ 12038-84 (GOST). Семена сельскохозяйственных культур. Методы определения всхожести. М.: Стандартинформ. 2011. 30 с.
ГОСТ Р 52471 – 2005 (GOST R). Корма. Иммуноферментный метод определения микотоксинов. М.: Стандартинформ. 2006. 12 с.
Громовых Т.И., Шмарловская С.В., Тюльпанова В.А., Громовых В.С. (Gromovykh et al) Штамм гриба Tricyoderma sp. МГ-97, используемый для зашиты сеянцев хвойных от фузариозов // Патент на изобретение № 2171580. М. 10.08.2001. 13 с.
Громовых Т.И., Литовка Ю.А., Громовых B.C., Махова Е.Г. (Gromovykh et al.) Эффективность действия Trichoderma asperellum (штамм МГ 97) на развитие фузариоза на сеянцах Larix sibirica // Микология и фитопатология. 2002. Т. 36. № 4. С. 70–75.
Мокроносов А.Т. (Mokronosov). Эндогенная регуляция фотосинтеза в целом растении // Физиология растений. 1978. Т. 25. Вып. 5. С. 938–951.
Монастырский О.А. (Monastyrskiy). Токсины фитопатогенных грибов // Защита и карантин растений. 1996. № 3. С. 12–14.
Пшибытко Н.Л., Зеневич Л.А., Кабашникова Л.Ф. (Pshibytko et al.) Состояние фотосинтетического аппарата в процессе фузариозного увядания томата // Физиология растений. 2006. Т. 54. № 4. С. 31–37.
Сейкетов Г.Ш. (Seyketov) Грибы рода триходерма и их использование в практике. Алма-Ата: Наука, 1982. 246 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


