Микология и фитопатология, 2020, T. 54, № 2, стр. 143-149
Способность к развитию в авиационном топливе штаммов “керосинового гриба” Amorphotheca resinae, выделенных из разных местообитаний
А. А. Кривушина 1, *, Т. В. Бобырева 1, **, В. Л. Мокеева 2, ***
1 Всероссийский научно-исследовательский институт авиационных материалов
105005 Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: kopengagen8@mail.ru
** E-mail: bobtana25@gmail.com
*** E-mail: veramokeeva@mail.ru
Поступила в редакцию 13.06.2019
После доработки 10.10.2019
Принята к публикации 20.12.2019
Аннотация
Среди микромицетов, повреждающих авиационное топливо, наиболее известен вид Amorphotheca resinae, который в природных условиях обитает в различных биогеоценозах и известен как компонент почвенной микобиоты. Микромицеты данного вида обладают способностью получать необходимый для жизни углерод из углеводородного топлива путем расщепления сложных углеводородов до более простых соединений. Рост A. resinae в топливе приводит к многочисленным проблемам, связанным с эксплуатацией авиационной техники, поскольку при этом происходит разрушение неметаллических материалов, усиление коррозии металлических элементов, забивка топливных фильтров мицелиальной биомассой. Согласно одним литературным источникам, далеко не все штаммы данного вида, обитающие в природных условиях, могут усваивать углеводороды нефти. По другим данным способность усваивать углеводороды становится свойственна большому количеству почвенных штаммов A. resinae. В работе исследована способность к росту в авиационном топливе 7 штаммов Amorphotheca resinae, выделенных из различных образцов авиационного топлива и 7 штаммов, выделенных из разных локалитетов и субстратов: почвы, воздуха, древесины, помещений. Среди исследованных штаммов A. resinae оказались как способные к развитию за счет углеводородов авиационного топлива, так и не обладающие этой способностью. При этом визуальный и количественный методы оценки скорости и интенсивности роста исследованных штаммов грибов не исключают друг друга и дают сопоставимые результаты. Штаммы A. resinae, выделенные из образцов топлива, имели гораздо более активное развитие по сравнению со штаммами, выделенными из природных местообитаний. Пять штаммов A. resinae, выделенные из разных по географическому положению проб топлива, проявили практически одинаковую степень развития по количеству образовавшейся в течение одного месяца биомассы.
ВВЕДЕНИЕ
Среди всех типов биоповреждений авиационных материалов и изделий наибольшую опасность представляют повреждения мицелиальными грибами и другими микроорганизмами авиационного топлива и топливных систем. Микромицеты обладают высокой скоростью роста и образовавшаяся биомасса может засорить топливные системы и стать причиной выхода из строя двигателей. Аварийная ситуация возможна и в случае образования грибами кислот и ферментов, которые усиливают коррозию металлов, разрушение неметаллических материалов, что может привести к нарушению герметичности баков (Levkina, Rebrikova, 1976; Bilay, Koval, 1980; Koval, Sidorenko, 1989; Ferrari et al., 1998; Hamme et al., 2003; Rauch et al., 2006; Semenov et al., 2008; Kablov, 2015). Среди грибов, повреждающих топливо, наиболее известен Amorphotheca resinae Parbery, который чаще всего встречается в научной литературе под названием его несовершенной стадии. За весь период его изучения их было несколько. Это Hormodendrum resinae Lindau, Cladosporium resinae (Lindau) G.A. de Vries и Hormoconis resinae (Lindau) Arx et G.A. de Vries (Seifert et al., 2007).
В природе гриб обитает в различных биогеоценозах и известен как компонент почвенной микобиоты (Sinadskiy, 1969). Amorphotheca resinae неоднократно выделяли из почв и других субстратов, загрязненных нефтью и ее производными (Crous et al., 2007). Вид обнаружен в пробах авиатоплив в Австралии, в большом количестве проб топлив в Бразилии и в Калифорнии. Об обнаружении A. resinae есть сообщения из Англии, Дании, Индии, Сирии, Нигерии, Японии, Новой Зеландии, Кубы, и др. (Pomortseva et al., 1977; Andreyuk et al., 1980; Koval, Sidorenko, 1989; McVea, Solly, 1991; Martin-Sanchez et al., 2016). Очевидно, расширение авиалиний может способствовать распространению гриба по всему земному шару (Koval, Sidorenko, 1989; Kondratyuk et al., 2007). Некоторые авторы предположили, что именно A. resinae стал причиной ряда авиакатастроф (Pomortseva et al., 1977; Andreyuk et al., 1980; Koval, Sidorenko, 1989; McVea, Solly, 1991; Martin-Sanchez et al., 2016).
Богатый ферментативный аппарат позволяет грибу расщеплять сложные углеводороды до простых и в дальнейшем использовать их для процессов метаболизма. Показано, что A. resinae активно производит две формы внеклеточной амилазы, которая гидролизует крахмал с образованием глюкозы (Vainio, 1996). При росте A. resinae на смеси n-алканов расщепление субстрата проистекает последовательно в соответствии с увеличением молекулярного веса алканов. Так как A. resinae продуцирует сравнительно небольшое количество поверхностно-активных веществ, таких как фосфолипиды и жирные кислоты, углерод вначале пассивно адсорбируется на поверхность клеток, а затем транспортируется внутрь клетки путем активного транспорта, однако точный механизм переноса n-алканов внутрь клетки данным видом гриба до сих пор не изучен (Morgan,Watkinson, 1994; Rafin, Veignie, 2018).
Согласно одним источникам, далеко не все штаммы данного вида, обитающие в природных условиях, могут усваивать углеводороды нефти (Sheridan, Troughton, 1972; Sheridan et al., 1972). По другим – способность усваивать углеводороды свойственна большому количеству почвенных штаммов A. resinae. По мнению D.G. Parbery (1971), лишь 5% всех штаммов не могут использовать углеводороды нефти, тогда как раньше эта цифра была равна 67%. Кроме того, согласно тому же источнику, штаммы A. resinae, выделенные из почвы, обладают почти такой же способностью и активностью разлагать углеводороды нефти, как и штаммы, выделенные из топливных баков самолетов (Parbery, 1971).
Целью данной работы было сравнить способность к росту в топливе штаммов A. resinae, выделенных из авиационного топлива, из природных местообитаний, а также из зоны аварии Чернобыльской АЭС.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании были использованы 7 штаммов A. resinae, выделенные нами из образцов авиационного топлива различного происхождения, и 7 штаммов из других коллекций, выделенные с различных субстратов и из разных географических зон. Штаммы K-68, Ul-1, Kr-42, Ir-12 выделены из образцов топлива, извлеченных из кессон-баков эксплуатирующихся самолетов, совершивших аварийные посадки по причине забивки фильтров. Штамм Bat-1 выделен из образца топливно-минеральной среды, проходившей экспозицию на экспериментальной площадке в районе города Батуми. Штаммы Tu-1 и Kon-1 выделены из проб топлива ТС-1, взятых на частных аэродромах: Tu-1 – из емкости, предотвращающей разлив топлива при открывании и закрывании крана устройства для оперативного хранения и раздачи топлива, Kon-1 – из отстоя топливозаправочной станции. Остальные штаммы предоставлены Всероссийской коллекцией микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН (ВКМ ИБФМ РАН) (ВКМ F-1700, ВКМ F-1701, ВКМ F-1962 и ВКМ F-1963 выделены из различных местообитаний) и сотрудником Института микробиологии и вирусологии им. Д.К. Заболотного (Киев, Украина) Н.Н. Ждановой (№ 801 из почвы Донецкой области, №№ 76 и 79 из помещения IV блока Чернобыльской АЭС).
Для выделения грибов из образцов топлива использовали методы, описанные в нашей предыдущей работе (Krivushina et al., 2016).
Методика определения способности роста микромицетов в топливе была разработана на основе ГОСТ 9.023-74 “Метод лабораторных испытаний биостойкости топлив, защищенных противомикробными присадками”. В 10 повторностях в стерильные пробирки с 3 мл топлива ТС-1 и 3 мл минеральной среды вносили по 0.3 мл споровой суспензии каждого штамма гриба по отдельности в одинаковой концентрации, согласно ГОСТ 9.023-74, не менее 106 спор. Пробирки встряхивали и помещали в термостат с температурой 28°С. Контроль за ростом грибов осуществляли через каждые 5 дней в течение 50 суток. Характер роста оценивали визуально, обращая внимание на мутность раствора, наличие хлопьевидного осадка, возможность образования сгустков на границе раздела фаз, а степень развития – по 6-балльной шкале на основе признаков, описанных в ГОСТ 9.023-74 (рис. 1).
Рис. 1.
Оценка роста грибов в топливо/водно-минеральной среде по визуальным признакам: 0 баллов – нет роста; 1 балл – мутный раствор, очень мелкие хлопья; 2 балла – хлопья средней величины, легко различимы визуально; 3 балла – крупные хлопья; 4 балла – небольшие сгустки; 5 баллов – крупные сгустки на границе раздела фаз.

После окончания эксперимента проводили микроскопическое исследование содержимого пробирок. В целях проверки чистоты и идентичности инокулята его высевали на чашки Петри со средой Чапека. Также по окончании оценивалась масса отфильтрованных через бумажные фильтры и высушенных в сушильном шкафу мицелиальных сгустков, статистическая обработка была проведена в программе Microsoft Excel.
РЕЗУЛЬТАТЫ
Процесс развития A. resinae в топливе начинается с образования мелких хлопьев в толще среды (1–2 балла), которые все увеличиваясь (3 балла), со временем и особенно на границе раздела топлива и минеральной среды превращаются в сгустки (4–5 баллов).
Результаты почти двухмесячного выращивания штаммов A. resinae в топливе представлены в табл. 1. Из таблицы видно, что активный рост (более 4 баллов) был отмечен у всех семи штаммов A. resinae (K-68, Bat-1, Kr-42, Ul-1, Ir-12, Tu-1, Kon-1), выделенных нами из образцов авиационного топлива, взятых из баков самолетов, с экспериментальных площадок и на топливозаправочных станциях, а также у штамма F-1962, выделенного из горючего (г. Батуми) и полученного из ВКМ. Из табл. 1 можно также отчетливо видеть, что штаммы А. resinae, которые были предоставлены для исследования различными коллекциями и выделены из природных источников, имели весьма незначительные показатели степени роста мицелия (0–2 балла).
Таблица 1.
Рост штаммов Amorphotheca resinae в авиационном топливе (в баллах)
| № штамма | Субстрат и место выделения | Время роста, сутки | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 7 | 14 | 21 | 28 | 35 | 42 | 50 | |||
| Штаммы, выделенные авторами | K-68 | Авиационное топливо ТС-1, самолет из Китая | 2 | 4 | 5 | 5 | 5 | 5 | 5 |
| Ul-1 | Авиационное топливо ТС-1, самолет из Ульяновска | 2 | 5 | 5 | 5 | 5 | 5 | 5 | |
| Kr-42 | Авиационное топливо ТС-1, самолет из Краснодара | 2 | 5 | 5 | 5 | 5 | 5 | 5 | |
| Bat-1 | Авиационное топливо ТС-1, площадка в Батуми | 2 | 4 | 5 | 5 | 5 | 5 | 5 | |
| Ir-12 | Авиационное топливо ТС-1, самолет из Ирана | 2 | 4 | 5 | 5 | 5 | 5 | 5 | |
| Tu-1 | Авиационное топливо ТС-1, аэродром в Тушино, г. Москва | 0 | 2 | 4 | 5 | 5 | 5 | 5 | |
| Kon-1 | Авиационное топливо ТС-1, аэродром в Конаково, Тверская обл. | 1 | 4 | 5 | 5 | 5 | 5 | 5 | |
| Коллекционные штаммы | F-1962 | Горючее, Батуми | 1 | 3 | 3 | 4 | 4 | 5 | 5 |
| F-1701 | Древесина, СССР | 0 | 1 | 1 | 2 | 2 | 2 | 2 | |
| F-1700 | Почва, СССР | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| F-1963 | Воздух, Аджария, Чаква | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 801 | Почва, п. Константиновка, Донецкая обл. | 0 | 0 | 0 | 0 | 0 | 1 | 1 | |
| 76 | Помещение IV блока ЧАЭС, 10 000 мР/час | 0 | 0 | 0 | 0 | 1 | 2 | 2 | |
| 79 | Помещение IV блока ЧАЭС, 90 000 мР/час | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
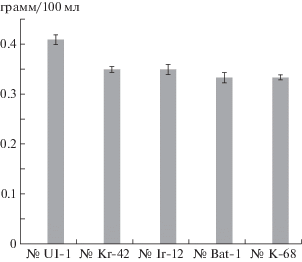
Результаты измерений, полученные после взвешивания высушенного мицелия у пяти штаммов A. resinae (K-68, Bat-1, Kr-42, Ul-1, Ir-12), показавших наибольшую степень развития (5 баллов) после месяца роста в топливе, представлены в виде диаграммы (рис. 2). Как видно из диаграммы, наибольшее значение биомассы отмечено для штамма А. resinae Ul-1, выделенного из бака самолета из Ульяновска – 0.41 грамм/100 мл. Вес мицелия и других штаммов А. resinae не сильно уступает первому. Так, у штаммов Kr-42 и Ir-12, выделенных из проб “Краснодар” и “Иран” соответственно, он был одинаковым и составил 0.35 грамм/100 мл. Наконец, вес мицелия штаммов Bat-1 и K-68 всего лишь на 0.02 грамма меньше веса предыдущих штаммов, что не выходит за рамки допустимой погрешности (величина стандартного отклонения Sd = ±0.005–0.01).
ОБСУЖДЕНИЕ
Наше исследование показало, что не все взятые штаммы А. resinae одинаково росли на авиационном топливе. Прослеживается четкое деление штаммов по этому признаку на две группы. Одни штаммы, первоначально выделенные из горючего, активно росли в топливе, другие, изолированные из различных природных местообитаний, обнаружили гораздо более слабые признаки роста. Несмотря на сообщения литературы (Parbery, 1971), для некоторых из них отмечено даже полное отсутствие роста в топливе.
В первую группу вошли штаммы, выделенные нами из топлива. Признаки роста в горючем у них начали проявляться уже на первой неделе культивирования. Как правило, вначале их хлопьевидная мицелиальная масса светлоокрашенная, которая затем начинает темнеть. Мицелиальные сгустки образовывались на 10–14-е сутки, а к 21-м достигали максимального объема. Сгустки были плотными, мешали перемешиванию и имели вид пробки на границе раздела топлива и минеральной среды. И только штамм Tu-1, также выделенный из пробы с топливозаправочной станции, показал заметно меньшую скорость роста при инокуляции топлива. Первые признаки развития были заметны только спустя 12 суток культивирования. К концу эксперимента образовались относительно небольшие по сравнению с другими штаммами сгустки серого цвета, темнеющие к центру.
Наибольшая скорость роста визуально отмечена для четырех штаммов A. resinae, выделенных из топливных баков самолетов (K-68, Kr-42, Ul-1, Ir-12), а также у штамма Bat-1, изолированного из топлива после экспозиции на экспериментальной площадке. У всех пяти штаммов на 7-е сутки роста наблюдали образование хлопьевидных включений, а на 14-е – формирование характерных темно-коричневых сгустков.
Активный рост при культивировании в топливе наблюдали и у штамма A. resinae F-1962, выделенного из авиационного топлива в Батуми и предоставленного ВКМ РАН. Первые признаки его роста появились уже через неделю, а сгустки образовались меньше, чем через месяц. Кроме того, микроскопическое исследование содержимого пробирок по окончании эксперимента показало, что мицелиальные сгустки у этого штамма состоят из ветвящегося мицелия и обильных спороношений. Однако по сравнению со штаммами, выделенными нами, скорость роста у F-1962 гораздо меньше, и крупные мицелиальные сгустки у него образовались почти на 3 недели позже. Частичная потеря активности может объясняться рядом пересевов в коллекции, а также хранением культуры на питательных средах до и после лиофилизации. Тем не менее, можно однозначно сказать, что штамм F-1962 обладает способностью к росту в авиационном топливе.
Что касается второй группы, то в нее вошли штаммы, выделенные из природных местообитаний. Так, штамм F-1701 выделен с древесины и, несмотря на слабые признаки роста по сравнению с активными штаммами (2 балла), на протяжении всего эксперимента все-таки давал небольшой прирост биомассы в топливе, различимый визуально. При микроскопировании содержимого пробирок были найдены хорошо развитые конидиеносцы с рамоконидиями и конидиями, характерными для A. resinae. Поэтому вполне возможно, что штамм F-1701 обладает способностью использовать углеводороды авиационного топлива и развиваться за их счет. Но, как и в случае со штаммом F-1962, выделенным из горючего в Батуми, после некоторого хранения в коллекции на питательных средах ему требуется более длительная лаг-фаза.
Более слабый рост в топливе отмечен у штаммов, выделенных из почвы (F-1700) и воздуха (F-1963). На протяжении первого месяца эксперимента в пробирках с этими грибами наблюдали только помутнение водного слоя и образование в нем небольших хлопьев (1 балл). Еженедельного хорошо заметного прироста биомассы, как у штаммов, выделенных с горючего, не было. Ранее мы предположили (Krivushina et al., 2016), что микромицеты, слабо растущие в топливе, способны расти некоторое время без источника углерода, поддерживая свою жизнедеятельность только за счет минеральной среды. В эксперименте это действительно было подтверждено: некоторые виды грибов в пробирках с минеральной средой давали небольшие хлопья. В предыдущих работах такие виды были отнесены нами к группе частично адаптированных и случайных видов, т.е. неспособных активно развиваться в топливе за счет углеводородов нефти (Krivushina, 2012). К грибам, способным к росту в топливе, мы относим лишь те штаммы, у которых постоянно наблюдается заметный прирост биомассы, а по истечении определенного времени – образование мицелиальных сгустков.
Как видим, подобная ситуация сложилась и в настоящем исследовании у штаммов F-1700 и F-1963. Помимо особенностей, отмеченных у этих штаммов выше, в результате микроскопического исследования содержимого пробирок в конце опыта были получены следующие данные. Во-первых, образовавшиеся мелкие мицелиальные хлопья не содержали спороношений, как в случае со штаммами, выделенными из топлива. Во-вторых, среди мицелия было найдено довольно большое количество хламидоспор, что может указывать на то, что грибы находятся в неблагоприятных условиях. Основываясь на выводах предыдущей работы (Krivushina et al., 2016), можно предположить, что штаммы F-1700 и F-1963, выделенные из почвы и воздуха, не обладают способностью к росту за счет углеводородов авиационного топлива.
Из табл. 1 видно, что штамм № 801, выделенный из почвы Донецкой обл., также не обладает способностью к росту в топливе. В течение первого месяца признаки роста у него отсутствовали вовсе, а лишь слабое помутнение водного слоя и очень мелкие хлопья отмечены только на 42-е сутки экспозиции. Микроскопическое исследование содержимого пробирок показало наличие внесенного спорового материала, фрагментов мицелия и образовавшихся хламидоспор.
Отдельный интерес представляют штаммы №№ 76 и 79, выделенные с бетонных стен IV блока Чернобыльской АЭС. Они не проявили никаких признаков роста на протяжении первого месяца эксперимента, в пробирках с минеральной средой, топливом и суспензией спор этих грибов не наблюдали даже помутнения водного слоя. Только на 35-е сутки в пробирке со штаммом № 76 было отмечено небольшое помутнение водного слоя и появились очень мелкие хлопья. Однако микроскопическое исследование содержимого показало небольшое количество слаборазвитого деформированного мицелия и множество хламидоспор, развитые конидиеносцы с конидиями отсутствовали. Таким образом, можно сказать, что штамм № 76 не проявил способности развиваться за счет углеводородов авиационного топлива. В пробирках со штаммом № 79 было отмечено лишь присутствие вносимого в начале опыта спорового материала. По данным Н.Н. Ждановой (Zhdanova et al., 2004), штаммы A. resinae, обитающие в зоне аварии Чернобыльской АЭС, обладают целым рядом особенностей, отличающих их от других штаммов этого же вида, выделенных из других районов. К примеру, показано, что у штаммов A. resinae, подвергшихся радиационному излучению, наблюдается повышенная активность ферментов полифенолоксидазы и тирозиназы, которые связаны с синтезом меланинов, повышающих радиоадаптивные свойства гриба, в частности, устойчивость к окислительному стрессу (Tugay et al., 2006; Pavlichenko, Zhdanova, 2012). Можно предположить различные причины отсутствия признаков роста у штаммов №№ 76 и 79. Во-первых, эти грибы могли изначально не обладать способностью использовать углеводороды нефтепродуктов, как было показано в нашем эксперименте для почвенных штаммов. Во-вторых, она могла быть потеряна в ходе ряда пересевов на питательных средах. И, наконец, в ходе мутационных процессов под воздействием радиоактивного излучения грибы могли утратить эту способность. Например, при возникновении мутаций в генах, ответственных за синтез ферментов, необходимых для расщепления длинных углеводородов до более простых соединений.
Визуальный метод оценки позволяет определить наличие самой способности к развитию в топливе микромицетов и активности в целом. Но для более точного сравнения активности грибов между собой нужна количественная оценка, а именно определение образовавшейся биомассы. Для этого у пяти штаммов A. resinae, выделенных нами, и по визуальной оценке наиболее активно растущих в топливе, было подсчитано количество образовавшейся за месяц роста биомассы. Довольно любопытно, что штаммы, выделенные из разных по географическому положению проб, проявили практически одинаковую степень развития. Как видно из результатов измерения, вес мицелия пяти штаммов А. resinae после месяца роста в топливе можно считать приблизительно равным. По окончании эксперимента изо всех пробирок был сделан высев на среду Чапека для подтверждения идентичности инокулята и выросшего биоматериала (биомассы). В результате было показано отсутствие какого-либо заражения, т.к. на чашках Петри выросли только штаммы A. resinae.
Таким образом, среди исследованных нами штаммов оказались как способные к развитию за счет углеводородов авиационного топлива, так и не обладающие этой способностью. При этом визуальный и количественный методы оценки скорости и интенсивности роста исследованных штаммов грибов не исключают друг друга и дают сопоставимые результаты. Штаммы A. resinae, выделенные из образцов авиационного топлива, развивались гораздо более интенсивно по сравнению со штаммами, выделенными из природных местообитаний. Можно предположить, что в природе существуют две популяции изучаемого вида: одна существует в естественных ценозах и участвует в круговороте веществ, другая – в результате длительного пребывания в топливе полностью приспособилась к ассимиляции углеводородов нефтепереработки и использует углерод из топлива в качестве основного источника питания.
Список литературы
Andreyuk E.I., Bilay V.I., Koval E.Z. Microbial corrosion and its agents. Kiev, Naukova dumka, 1980 (in Russ.).
Bilay V.I., Koval E.Z. The growth of fungi on oil hydrocarbons. Kiev, Naukova dumka, 1980 (in Russ.).
Crous P.W., Braun U., Schubert K., Groenewald J.Z. Delimiting Cladosporium from morphologically similar genera. Stud. Mycol. 2007. V. 58. P. 33–56.
Ferrari M.D., Neirotti E., Albornoz C. Occurrence of heterotrophic bacteria and fungi in an aviation fuel handling system and its relationship with fuel fouling. Rev. Argent. Microbiol. 1998. V. 30. P. 105–114.
Hamme J.D.V., Singh A., Ward O.P. Recent advances in petroleum microbiology. Microbiol. Molec. Biol. Reviews. 2003. V. 67 (4). P. 503–549.
Kablov E.N. Innovative developments of FSUE “VIAM” SSC of the Russian Federation on implementation of “Strategic directions of development of materials and technologies of their processing for the period till 2030”. Aviacionnye materialy i tekhnologii, 2015. N 1 (34). P. 3–33 (in Russ.).
Kondratyuk T.A., Harkevitch E.S., Zahartchenkova V.A., Nakonetchnaya L.T., Roy A.A., Zhdanova N.N., Paschkevitch R.E. Biodeterioration of aviation fuel TS-1 by microscopic fungi. Mikologiya i fitopatologiya. 2007. V. 41 (5). P. 442–448 (in Russ.).
Koval E.Z., Sidorenko L.P. Mycodestructors of industrial materials. Kiev, Naukova dumka, 1989 (in Russ.).
Krivushina A.A. Micromycetes in aviation fuel. Avtoref. dis. … kand. biol. nauk. Moscow, 2012 (in Russ.).
Krivushina A.A., Chekunova L.N., Mokeeva V.L., Polyakova A.V. Study of micromycetes isolated from exploiting plane fuel tanks. Mikologiya i fitopatologiya. 2016. V. 50 (2). P. 108–114 (in Russ.).
Levkina L.M., Rebrikova N.L. Physiological properties of Cladosporium resinae (Lindau) de Vries. Mikologiya i fitopatologiya. 1976. V. 10 (5). P. 374–380 (in Russ.).
Martin-Sanchez P.M., Gorbushina A.A., Kunte H.J., Toepel J. A novel QPCR protocol for the specific detection and quantification of the fuel-deteriorating fungus Hormoconis resinae. Biofouling. Taylor and Francis. 2016. V. 32 (6). P. 635–644.
McVea G.G., Solly R.K. Control of fuel microorganisms with magnetic devices: laboratory investigation with Hormoconis resinae. Aircraft Materials Technical Memorandum. 1991. N 408. P. 1–11.
Morgan P., Watkinson R.J. Biodegradation of components of petroleum. Biochemistry of microbial degradation. 1994. P. 1–31.
Parbery D.J. Biological problems in jet aviation fuel and the biology of Amorphotheca resinae. Material and Org. 1971. N 6. P. 161–208.
Pavlichenko A.K., Zhdanova N.N. Resistance of fungal conidia from indoors of the object “Ukrytie” (Chernobyl AES) to different concentrations of H2O2. Mikologiya i fitopatologiya. 2012. V. 46 (1). P. 75–80 (in Russ.).
Pomortseva N.V., Nette I.T., Liber L.I. Formation of vitamin B6 by fungus Cladosporium resinae. Prikladnaya biohimiya i mikrobiologiya. 1977. V. 13 (5). P. 718–721 (in Russ.).
Rafin C., Veignie E. Hormoconis resinae, the kerosene fungus. Handbook of hydrocarbon and lipid microbiology. Springer International Publishing AG, 2018.
Rauch M.E., Graef H.W., Rozenzhak S.M., Jones S.E., Bleckmann C.A., Kruger R.L., Naik R.R. Characterization of microbial contamination in United States air force aviation fuel tanks. J. Industrial Microbiol. Biotechnol. 2006. V. 33 (1). P. 29–36.
Seifert K.A., Hughes S.J., Boulay H., Louis-Seize G. Taxonomy, nomenclature and phylogeny of three Cladosporium-like hyphomycetes, Sorocybe resinae, Seifertia azaleae and the Hormoconis anamorph of Amorphoteca resinae. Stud. Mycol. 2007. V. 58. P. 235–245.
Semenov S.A., Gumargaliyeva K.Z., Zaikov G.E. Biodeterioration of materials and technology product. Gorenie, destruktsiya i stabilizatsiya polimerov. Nauchnye osnovy i tekhnologii, SPb., 2008. P 73–99 (in Russ.).
Sheridan J.E., Tan Y.L., Nelson J. Studies on the “kerosene fungus” Cladosporium resinae (Lindau) de Vries. Part III. Morphology, Taxonomy and Physiology. Tuatara. 1972. V. 19 (3). P. 30–165.
Sheridan J.E., Troughton J.H. Conidiophores and conidia of the kerosene fungus Cladosporium resinae in the light and scanning electron microscopes. N.Z. J. Bot. 1972. V. 11. P. 145–152.
Sinadskiy Y.V. The first international symposium on biodeterioration. Mikologiya i fitopatologiya. 1969. V. 3. P. 394–400 (in Russ.).
Tugay T.I., Zhdanova N.N., Zheltonozhskiy V.A., Sadovnikov L.V., Sadovnikova M.L., Buzarova E.I. Influence long time ionizing irradiation on polyphenoloxidase and tyrosinase activity and on melanin synthesis in Hormoconis resinae. Yaderna fizika ta energetika. 2006. V. 2 (18). P. 82–87 (in Russ.).
Vainio A.E.I. Amylolytic yeast: expression of Hormoconis resinae glucoamylase P in Saccharomyces cerevisiae. PhD Thesis. Turin, 1996.
Zhdanova N.N., Tugay T., Dighton J. Ionizing radiation attracts soil fungi. Mycol. Res. 2004. V. 108. V. 9. P. 1089–1096.
Андреюк Е.И., Билай В.И., Коваль Э.З., Козлова И.А. (Andreyuk et al.) Микробная коррозия и ее возбудители. Киев: Наукова думка, 1980. 288 с.
Билай В.И., Коваль Э.З. (Bilay, Koval) Рост грибов на углеводородах нефти. Киев: Наукова думка, 1980. 340 с.
Каблов Е.Н. (Kablov) Инновационные разработки ФГУП “ВИАМ” ГНЦ РФ по реализации “Стратегических направлений развития материалов и технологий их переработки на период до 2030 года” // Авиационные материалы и технологии. 2015. № 1 (34). С. 3–33.
Коваль Э.З., Сидоренко Л.П. (Koval, Sidorenko) Микодеструкторы промышленных материалов. Киев: Наукова думка, 1989. 187 с.
Кондратюк Т.А., Харкевич Е.С., Захарченкова В.А., Наконечная Л.Т., Рой А.А., Жданова Н.Н., Пашкевич Р.Е. (Kondratyuk et al.) Биоповреждение авиационного топлива ТС-1 микроскопическими грибами // Микология и фитопатология. 2007. Т. 41. № 5. С. 442–448.
Кривушина А.А. (Krivushina) Микромицеты в авиационном топливе: автореф. дис. … канд. биол. наук. М., 2012. 24 с.
Кривушина А.А., Чекунова Л.Н., Мокеева В.Л. Полякова А.В. (Krivushina et al.) Изучение микромицетов, обнаруженных в топливных баках эксплуатирующихся самолетов // Микология и фитопатология. 2016. Т. 50. № 2. С. 108–114.
Левкина Л.М., Ребрикова Н.Л. (Levkina, Rebrikova) Физиологические особенности Cladosporium resinae (Lindau) de Vries // Микология и фитопатология. 1976. Т. 10. № 5. С. 374–380.
Павличенко А.К., Жданова Н.Н. (Pavlichenko, Zhdanova) Устойчивость конидий микромицетов из помещений объекта “Укрытие” (Чернобыльская АЭС) к различным концентрациям перекиси водорода // Микология и фитопатология. 2012. Т. 46. № 1. С. 75–80.
Поморцева Н.В., Нетте И.Т., Либер Л.И. (Pomortseva et al.) Образование витамина В6 грибом Cladosporium resinae // Прикладная биохимия и микробиология. 1977. Т. 13. № 5. С. 718–721.
Семенов С.А., Гумаргалиева К.З., Заиков Г.Е. (Semenov et al.) Биоповреждения материалов и изделий техники // Горение, деструкция и стабилизация полимеров. СПБ.: Научные основы и технологии, 2008. С. 73–99.
Синадский Ю.В. (Sinadskiy) Первый международный симпозиум по биологическим повреждениям // Микология и фитопатология. 1969. Т. 3. С. 397–400.
Тугай Т.И., Жданова Н.Н., Желтоножский В.А., Садовников Л.В., Садовникова М.Л., Бузарова Е.И. (Tugay et al.) Влияние пролонгированного действия ионизирующего излучения на активность полифенолоксидазы и тирозиназы и на синтез меланина у Hormoconis resinae // Ядерна фiзика та енергетика. 2006. № 2 (18). С. 82–87.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология