Микология и фитопатология, 2020, T. 54, № 3, стр. 174-182
Изучение структурно-функциональной организации арбускулярной микоризы у исходной и мутантной линий люцерны хмелевидной (Medicago lupulina) при разных способах инокуляции грибом Rhizophagus irregularis
С. В. Железняков 1, *, В. К. Лебедева 1, **, Р. В. Сметанин 1, ***, Л. М. Якоби 1, ****
1 Всероссийский НИИ сельскохозяйственной микробиологии
196608 Санкт-Петербург, Россия
* E-mail: krosh15_02@mail.ru
** E-mail: vdvalerie21@mail.ru
*** E-mail: ruslan-smetanin97@mail.ru
**** E-mail: lidija-jacobi@yandex.ru
Поступила в редакцию 09.10.2019
После доработки 23.11.2019
Принята к публикации 20.12.2019
Аннотация
Арбускулярная микориза (АМ) способна улучшать состояние растений в условиях дефицита элементов минерального питания в почве, особенно фосфора (Р). В настоящее время механизм, задействованный в регуляции эффективного симбиоза АМ грибов и растений неизвестен, поэтому важно найти подходы для понимания характера взаимоотношений партнеров в микоризе. Во многом этому могут способствовать исследования с участием сильномикотрофных растений и мутантов растений с дефектами в развитии арбускул и везикул. В условиях микровегетационного опыта было изучено влияние двух способов инокуляции грибом Rhizophagus irregularis на структуру и эффективность АМ у мутантной и исходной линий сильномикотрофной люцерны хмелевидной. Мутант отличается от исходной линии тем, что в условиях дефицита фосфорного питания имеет признак полукарликовости и образует АМ со слаборазвитыми арбускулами и везикулами. В опыте с мутантом показана способность АМ гриба к колонизации коры корня межклеточными гифами при низкой встречаемости арбускул. Это указывает на способность облигатного микосимбионта усваивать углеводы из апопласта без участия арбускул. Образование АМ у мутанта не оказывало влияние на рост растений и содержание общего фосфора в соломе. Дефекты в системе регуляции симбиотической активности АМ и слабое развитие арбускул и везикул указывают на неспособность мутанта образовать полноценные арбускоциты. Образование АМ у исходной линии люцерны способствовало значительному приросту, как урожая соломы, так и содержания в ней общего фосфора по сравнению с растениями без АМ. Полученные данные свидетельствуют о возможности регуляции экологической эффективности АМ у сильномикотрофного растения путем подбора оптимальных условий инокуляции.
ВВЕДЕНИЕ
Арбускулярная микориза (АМ) – это широко распространенная в природе ассоциация корней растений с грибами отдела Glomeromycota. Около 80% видов наземных травянистых и кустарниковых растений, в том числе многие сельскохозяйственные культуры, образуют АМ (Selivanov, 1980; Smith, Read, 2008). АМ способствует адаптации растений при низкой доступности питательных элементов (особенно Р, Zn, Cu, и др.) и воды в почве, мобилизации защитных механизмов от корневых патогенов, стимуляции роста путем выработки гормонов, что приводит к увеличению жизнеспособности отдельных особей и видов в природных популяциях (Smith, Read, 2008). Полезные свойства АМ обусловливают актуальность исследований по расшифровке механизмов, обеспечивающих эффективность микоризации. Результаты этих исследований могут найти применение в селекции растений на повышение продуктивности и устойчивости к фитопатогенам, и будут способствовать разработке системы биологического земледелия.
Способность АМ улучшать рост растений в большей степени может быть обусловлена увеличением поступления фосфора (Р) из почвы в корни через сеть внекорневых гиф гриба. Принято считать, что АМ грибы не способны к гидролизу фосфорорганических соединений и мобилизации нерастворимых минеральных фосфатов. Доступной формой Р для них, также как и для растений, являются анионы ортофосфорной кислоты (Bagyaraj et al., 2015). Благодаря развитию сети вне- и внутрикорневых гиф минеральные вещества поступают из почвы в корень и освобождаются внутри клеток кортекса через арбускулы, врастающие в клетки корня сильно ветвящиеся гифы (Jakobsen et al., 1992; Javot et al., 2007).
АМ грибы – облигатные симбиотрофы и полностью зависят от растения-хозяина (Smith, Read, 2008). В кортикальной части корня они развивают сеть межклеточных гиф, арбускул и везикул (или вегетативных спор). Для роста и развития им требуется большое количество энергии и углерода, в основном в виде липидов и гликогена, которые транспортируются к растущим кончикам гиф (Bago et al., 2003). Растение жертвует грибу до 20% фотосинтатов. Долгое время считалось, что гексозы являются основной формой углерода, поставляемой растением грибу через арбускулы (Shachar-Hill et al., 1995). Таким образом, арбускулы рассматриваются как структуры, где происходит взаимообмен такими полезными ресурсами, как фосфор и углеводы. Предполагалось также, что АМ грибы используют сахара для биосинтеза липидов, которые, как известно, выполняют разнообразные функции в организме, как то сохранение энергии и формирование мембран, окружающих каждую из его клеток (Pfeffer et al., 1999). Тем не менее, было показано, что биосинтез de novo жирных кислот (ЖК), необходимых грибу для образования липидов наблюдается только внутри колонизированных корней и не наблюдается во внекорневом мицелии или спорах (Pfeffer et al., 1999; Trépanier et al., 2005). Это поставило под сомнение способность АМ грибов самостоятельно синтезировать ЖК.
Как следует из литературных источников (Keymer et al., 2017), недавно проведенные исследования на Lotus japonicus и мутантах с дефектами в образовании арбускул дают основание считать, что растение-хозяин питает АМ гриб не только сахарами, но также жирными кислотами. Keymer et al. (2017) установили, что эти растения имели мутации в некоторых генах, которые активировались только в арбускоцитах и были включены в продукцию ЖК. По определению Gaude et al. (2012) абрускоциты это кортикальные клетки корня, в которых образуются грибные арбускулы. Из литературных источников известно, что при развитии арбускул в арбускоцитах происходит ряд структурных перестроек, а именно увеличивается численность липид-продуцирующих пластид, которые вместе с другими органеллами (такими как эндоплазматический ретикулум) изменяют свои позиции и собираются по соседству с арбускулами, что свидетельствует о высокой метаболической активности (Lohse et al., 2005; Ivanov, Harrison, 2014).
Полное секвенирование генома модельных грибов Rizophagus irregularis, Gigaspora margarita и G. rosea показало, что в их геноме отсутствуют гены, ответственные за синтез ферментов участвующих в синтезе de novo 16 : 0 ЖК, типичных для животных и большинства грибов (Wewer et al., 2014; Tang et al., 2016). При этом стало известно, что несмотря на неспособность АМ гриба синтезировать достаточное количество 16 : 0 ЖК, его геном кодирует энзиматические механизмы для элонгации 16 : 0 ЖК до длинных цепей и для десатурации ЖК.
АМ грибы способны неспецифично колонизировать огромный ряд растений. При этом они значительно варьируют в своей популяционной биологии, экологической специфичности и симбиотической активности (Giovannetti, Gianinazzi-Pearson, 1994; Yurkov et al., 2017). В современной научной литературе они рассматриваются как важные почвенные микроорганизмы, с помощью которых можно и нужно решать проблему дефицита фосфорного питания сельскохозяйственных растений.
Большая часть исследований взаимодействия растений и АМ грибов ведется на мутантах растений. Первые мутанты с дефектами в развитии АМ были получены в 1989 г. (Duc et al., 1989). Эти работы продолжаются до настоящего времени. С помощью мутантов были выявлены гены растения-хозяина, задействованные на разных этапах становления микоризного симбиоза (Borisov et al., 2000; Wegel, 1998, и др.). В последнее время, благодаря полученным новым мутантам с дефектами в развитии арбускул на растениях Medicago truncatula (Luginbuehl et al., 2017) и Lotus japonicus (Keymer et al., 2017), а также благодаря разработке новых технологических приемов исследования, стало возможным глубже изучить взаимодействия растения и АМ гриба на генетическом и молекулярном уровнях. Однако, несмотря на достигнутые успехи механизм, задействованный в создании эффективного микоризного симбиоза, неизвестен. Поэтому остается актуальным изучение особенностей взаимодействия компонентов микоризного симбиоза с участием сильномикотрофных растений и мутантов растений с отклонениями в развитии микоризы и ее эффективности.
Для разработки данного направления нами была предпринята попытка получить мутанты с отклонениями в эффективности АМ на однолетней самоопыляющейся люцерне хмелевидной (Medicago lupulina L.). С этой целью из сортопопуляции ВИК32 путем индивидуального отбора была получена сильномикотрофная линия для проведения мутагенеза с применением этилметансульфоната (Yurkov et al., 2009). Потенциальный симбиотический мутант люцерны хмелевидной с признаками полукарликовости был отобран из популяции растений поколения М2, высаженных на стерилизованный почвенно-песчаный субстрат с низким содержанием доступного для питания растений фосфора (Рд) в условиях инокуляции Rhizophagus irregularis (Kurenkov et al., 2013). Первые потомки отобранного потенциального мутанта показали способность к образованию микоризы, которая в силу своей нечеткой структурной организации была названа “аморфной”. Проверки на симбиотическую эффективность микоризы у потенциальных мутантов проводились эпизодически и показали отрицательные результаты. Анализ на стабильность наследования мутантных признаков у потенциальных мутантов проводился в ряду 3–11 поколений при выращивании в одинаковых вегетационных условиях Инокуляция грибом R. irregularis осуществлялась путем нанесения микоризованных корней плектрантуса южного (Plectranthus australis R.Br.) на корни проростков люцерны при посадке.
В задачу настоящей работы входило изучить особенности структурно-функциональной организации микоризы у исходной (mleam-7) и мутантной (mlelam-6) линий люцерны хмелевидной при двух способах инокуляции грибом Rhizophagus irregularis. Первый способ – инокуляция микоризованными корнями, используется в лабораторных экспериментах с сильномикотрофными растениями, такими как люцерна хмелевидная. Второй способ – инокуляция путем подсадки микоризованной рассады, используется в лабораторных экспериментах со слабомикотрофными растениями, например, такими как горох посевной (Rosewarne et al., 1997). Выбор направления исследования был обусловлен поиском новых фенотипических проявлений в микоризе мутанта, характеризующих взаимоотношения растения-хозяина и микосимбионта, а также поиском условий влияющих на экологическую эффективность микоризного симбиоза люцерны хмелевидной.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Линия mleam-7 была получена путем индивидуального отбора из популяции примитивного сорта ВИК32 однолетней самоопыляющейся люцерны хмелевидной (M. lupulina L. subsp. vulgaris Koch), предоставленного НИИ кормов им. В.Р. Вильямса (Stepanova, 2009). Растение слабо адаптировано к низкому уровню Рд в почве, образует эффективный симбиоз с Rhizophagus irregularis в этих условиях. В ассоциации с грибом R. irregularis образует типичную микоризу arum-типа (рис. 1, а). Линия получила рабочее название mleam-7 (Medicago lupulina with effective AM). Она характеризуется среднеранним сроком созревания и высокой продуктивной способностью – до 2000 семян с растения при выращивании на хорошо окультуренной почве.
Рис. 1.
Арбускулярная микориза исходной mleam-7 (а) и мутантной mlelam-6 (б, в) линий люцерны хмелевидной (давленые препараты корней): А – арбускула, В – везикула, М – внутрикорневой межклеточный мицелий, Л – капля липидов. Линейка – 100 мкм.
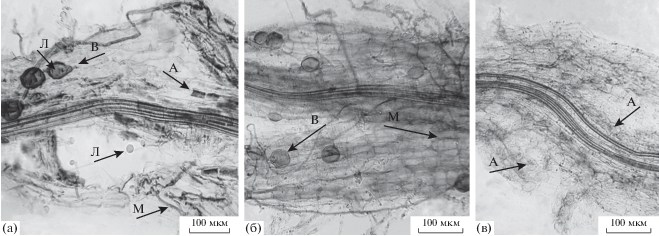
Другим объектом исследования служила мутантная линия люцерны хмелевидной c рабочим названием mlelam-6 (M. lupulina with effectless AM), являющаяся потомком в 11-м поколении потенциального симбиотического мутанта с признаками полукарликовости (Kurenkov et al., 2013). Мутант mlelam-6 образует микоризу в ассоциации с Rhizophagus irregularis, которая, в отличие от микоризы исходной линии mleam-7, имеет более мелкие и тонкие арбускулы и слаборазвитые (субтильные) везикулы (рис. 1, в, г). По показателям микоризации, отражающим рост межклеточных гиф мутант mlelam-6 мало отличается от исходной линии mleam-7 в условиях инокуляции микоризованными корнями плектрантуса. При выращивании на почве с низким Рд образование АМ у мутанта не приводило к существенному увеличению продуктивности растений и накоплению в них общего Р по сравнению с растениями без АМ. При этом мутант положительно отзывается на внесение минерального фосфорного удобрения. На хорошо окультуренной почве мутант mlelam-6 характеризуется средним сроком созревания и продуктивной способностью до 500 семян с растения. Мутант mlelam-6 и линия mleam-7 хранятся в коллекции института сельскохозяйственной микробиологии (ФГБНУ ВНИИСХМ, г. Санкт-Петербург).
Для посадки готовили 3-дневные прорости люцерны. С этой целью семена скарифицировали с помощью тонкой наждачной бумаги, затем обрабатывали концентрированной серной кислотой (в течение 8 мин) для стерилизации поверхности и промывали кипяченой и стерилизованной водой. Семена проращивали в стерильных условиях.
Грибной материал. Для микоризации растений использовали эндомикоризный гриб R. irregularis, штамм RCAM00320 из коллекции ФГБНУ ВНИИСХМ (зарегистрированный также в Европейском банке гломусовых как изолят BEG 144). Гриб был выделен в 1980 г. из корней кукурузы, выращиваемой в монокультуре на слабоокультуренной дерново-подзолистой пахотной почве Ленинградской обл. (Гатчинский р-н). Характеризуется как высокоактивный в симбиозе со многими сельскохозяйственными культурами на слабо- и среднеокультуренных почвах. В коллекции гриб поддерживается в открытой горшечной культуре на плектрантусе южном, согласно методу Boudarga-Dexheimer (1990).
Для решения поставленной задачи готовили инокуляты с R. irregularis двух типов. В первом случае инокулятом служили микоризованные и немикоризованные (в контроле) корни плектрантуса. Для получения корней плектрантус выращивали с инокуляцией R. irregularis и без инокуляции в течение 6 мес. По истечении этого времени корни извлекали, отмывали от почвы кипяченой и стерилизованной водой и измельчали. Встречаемость АМ в корнях плектрантуса на момент их использования в качестве инокулята составила 60%. Измельченный свежий корневой материал в небольшом количестве (менее спичечной головки) помещался на корни проростков люцерны при посадке.
Во втором случае для инокуляции брали микоризованную и немикоризованную (в контроле) рассаду лука-шалота (сорт Перо Жар-Птицы). Для получения рассады семена лука предварительно высевали в стерилизованный почвенно-песчаный субстрат, куда вносили микоризованные и немикоризованные (контроль) корни плектрантуса. В возрасте 4-х месяцев рассаду вынимали, корни отмывали от почвы кипяченой и стерилизованной водой и высаживали по 1 растению на сосуд при посадке проростков люцерны. Встречаемость АМ в корнях лука в этот период составила 40%.
Субстрат для выращивания растений. Для приготовления субстрата брали дерново-подзолистую легкосуглинистую залежную почву с рНKCl 4.9, содержанием органического вещества 3%, Р2О5 и К2О по Кирсанову – 3.5 и 7.0 мг/100 г почвы соответственно, гидролитической кислотностью – 3.3 мг-экв/100 г почвы, суммой подвижных оснований – 9.8 мг-экв/100 г почвы. Воздушно-сухую почву известковали до рН = 6.2 из расчета 1 мг-экв гидролитической кислотности (1.65 г СаСО3 на 1 кг почвы), смешивали с кварцевым песком в соотношении 4 : 1 и стерилизовали автоклавированием 1 ч при давлении 2 атм., дважды.
Условия выращивания растений и уборка. Растения выращивали при искусственном освещении в стандартных условиях. В пластиковые стаканы емкостью 220 г субстрата было высажено по два проростка люцерны (повторность опыта 5-кратная). Люцерну убирали на 43-е сутки от посадки на стадии вегетации. Определяли следующие показатели роста и продуктивности растений: высоту стебля, сухую массу соломы, общее содержание Р в соломе. Фосфор определяли по методу Truog – Meyer (Sokolov, 1975), после озоления растительной массы в смеси серной и хлорной кислот по Ginzburg-Shcheglova (1960). Эффективность микоризного симбиоза (Эфф.) рассчитывали по показателям урожая соломы и содержания в ней общего Р у микоризованных (М) и немикоризованных (бМ) растений по формуле: Эфф.% = (М – бМ) × × 100/бМ.
Корни растений при уборке отмывали от почвы и высушивали при температуре 34°С, чтобы избежать загнивания при хранении. Для визуализации внутрикорневых структур гриба проводили мацерацию корней, а затем окраску трипановым синим по методу Phillips-Hayman (1970). Перед мацерацией высушенные корни предварительно размачивали, помещая их в пробирки с водой, и нагревая на водяной бане в течение 1 ч.
Показатели интенсивности микоризообразования определяли по методу Trouvelot et al. (1986) с использованием световой микроскопии при 120-кратном увеличении. С этой целью готовили давленые препараты окрашенных корней (по 4 в каждом варианте), помещая образцы между двумя предметными стеклами, смоченными глицерином. Структурную организацию микориз оценивали по таким показателям, как встречаемость микоризной инфекции в конях (F, %), интенсивность роста межклеточных гиф в корнях (М, %), интенсивность роста межклеточных гиф в микоризованной части корня (m, %), интенсивность образования арбускул в корнях (А, %), обилие арбускул в микоризованной части корня (a, %), интенсивность образования везикул в корнях (B, %), обилие везикул в микоризованной части корня (b, %). Для подсчета среднестатистических показателей микоризации использовали компьютерную программу Mycorrhiza 1.0 на платформе Microsoft Excel. Программа адаптирована для работы в операционной системе Windows и в интерактивном режиме дает оценочное значение показателей микоризации и расчетное число полей зрения, необходимое для достижения заданного уровня точности (Vorobyov et al., 2016).
Достоверность различий между средними значениями исследованных показателей оценивалась с помощью t-критерия Стъюдента при 5%-м уровне значимости.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показали цитологические исследования микоризованных корней исходной линии mleam-7, проведенные с помощью световой микроскопии, инокуляция АМ грибом с использованием в качестве инокулята как микоризованных корней плектрантуса, так и микоризованной рассады (растение-няня), привела к образованию типичной АМ arum-типа (рис. 1, а). При этом различия между вариантами инокуляции по показателю F были несущественны, но тенденция положительного влияния подсадки растения-няни имела место (F в первом случае составила 42.6 ± 5.3%, а во втором 52.5 ± 6.2% (табл. 1). В то же время существенные различия были выявлены между вариантами инокуляции по показателям М, а, В и b. Так, инокуляция люцерны путем подсадки растения-няни способствовала более интенсивному росту межклеточного мицелия в корнях (М = 25.6 ± 2.8%) по сравнению с инокуляцией путем внесения микоризованных корней (М = 16.8 ± 1.7%) (табл. 1). При этом в первом случае обилие арбускул в АМ было существенно меньше (а = 25.5 ± 2.1%), а везикул больше (В = 2.9 ± 0.5%, b = 11.4 ± 1.6%), чем во втором (a = 50.6 ± 4.5%; В = 0.6 ± 0.2%, b = 4.5 ± 0.7%). Сравнительно низкие показатели a (%) в варианте с подсадкой лука могли быть следствием менее интенсивного образования арбускул или же результатом их деградации вследствие ускорения развития АМ. В пользу второй версии указывают сравнительно высокие показатели обилия везикул (b,%) в этом варианте (табл. 1). При этом установить истинную причину столь значительных различий между вариантами инокуляции по показателю а (%) можно будет только исследуя динамику развития АМ в онтогенезе. Таким образом, полученные результаты указывают на то, что использование для инокуляции исходной линии mleam-7 приема подсадки растения-няни способствовало более интенсивному росту межклеточного мицелия, существенно увеличивало долю везикул и снижало долю арбускул в АМ, по сравнению с инокуляцией микоризованными корнями.
Таблица 1.
Структурная организация микоризы у исходной (mleam–7) и мутантной (mlelam–6) линий люцерны хмелевидной при двух способах инокуляции грибом Rhizophagus irregularis
| Варианты опыта | Показатели микоризации, % | |||||||
|---|---|---|---|---|---|---|---|---|
| Линия люцерны | СпособинокуляцииАМ грибом | F | M | m | A | a | B | b |
| Исходная (mleam–7) | Корнями плектрантуса с АМ | 42.6 ± 5.3 | 16.8 ± 1.7 | 40.0 ± 4.8 | 8.6 ± 1.3 | 50.6 ± 4.5 | 0.6 ± 0.2 | 4.5 ± 0.7 |
| Подсадка лука с АМ | 52.5 ± 6.2 | 25.6 ±2.8 | 48.7 ± 5.0 | 6.5 ± 1.0 | 25.5 ± 2.1 | 2.9 ± 0.5 | 11.4 ± 1.6 | |
| Мутантная (mlelam–6) | Корнями плектрантуса с АМ | 38.5 ± 3.6 | 16.8 ± 1.8 | 43.6 ± 3.5 | 2.0 ± 0.4 | 11.6 ± 1.3 | 0.2 ± 0.1 | 1.1 ± 0.2 |
| Подсадка лука с АМ | 84.2 ± 10.0 | 66.0 ± 8.9 | 78.3 ± 10.3 | 2.9 ± 0.6 | 4.4 ± 0.7 | 2.4 ± 0.6 | 3.6 ± 0.6 | |
Инокуляция исходной линии mleam-7 АМ грибом, как с применением микоризованных корней плектрантуса, так и с использованием приема подсадки растения-няни, привела к достоверному повышению урожая соломы по сравнению с соответствующим контролем (без АМ): в первом случае прирост составил 21.8 ± 3.9%, во втором – 47.2 ± 10.6% (табл. 2). Таким образом, установлено, что способ инокуляции путем подсадки растения-няни был более эффективен по сравнению с локальным внесением микоризованных корней. Возможно, сравнительно высокий урожай соломы микоризованных растений в варианте с подсадкой растения-няни явился следствием более интенсивной колонизации корней люцерны АМ грибом за счет увеличения числа проникновений внекорневых гиф гриба микоризы лука. В целом полученные данные указывают на возможность регуляции экологической эффективности АМ у сильномикотрофной люцерны хмелевидной путем подбора оптимальных условий инокуляции.
Микоризация исходной линии mleam-7 способствовала повышению содержания общего Р в соломе, по сравнению с соответствующим контролем (без АМ) (табл. 2). При этом обращает на себя внимание то, что содержание Р в соломе микоризованных растений в вариантах с различной инокуляцией было одинаковым: 1.28 ± 0.22% Р2О5 (инокуляция корнями) и 1.26 ± 0.19% Р2О5 (инокуляция подсадкой рассады), несмотря на значительные различия между этими вариантами по урожаю соломы (41.9 ± 3.3 мг и 62.1 ± 5.8 мг, соответственно), а также по показателям интенсивности образования арбускул в микоризе (50.6 ± 4.5 % и 25.5 ± 2.1 %, соответственно) (табл. 1). У немикоризованных растений линии mleam-7 наблюдается та же тенденция: содержание общего Р в соломе было одинаковым в вариантах с внесением корней и подсадкой растения-няни, а именно 0.73 ± 0.08% Р2О5 и 0.75 ± 0.11% Р2О5, соответственно, несмотря на существенные различия по урожаю соломы (34.4 ± 1.9 мг на сосуд и 42.2 ± 3.6 мг на сосуд, соответственно). Полученные данные могут свидетельствовать о двух метаболических уровнях надземных частей сильномикотрофной люцерны, каждый из которых соответствует определенному микоризному статусу, а именно – с АМ и без АМ. Это заключение находит подтверждение и в литературных источниках. Так сообщается, что в ответ на микоризную колонизацию происходили изменения метаболома корней Medicago truncatula (Schliemann et al., 2008). Schweiger et al. (2014) пришли к заключению, что изменения в метаболических ответах на микоризацию в листьях M. truncatula являются специфичными, и обусловлены высокой симбиотической способностью данного вида; отмечено также независимое от видовой принадлежности растения увеличение содержания общего Р в листьях в ответ на образование АМ с участием Rhizophagus irregularis.
Таблица 2.
Агробиологические показатели исходной (mleam-7) и мутантной (mlelam-6) линий люцерны хмелевидной при двух способах инокуляции грибом Rhizophagus irregularis и в отсутствие инокуляции
| Варианты | Масса соломы | Содержание общего фосфора в соломе | |||
|---|---|---|---|---|---|
| Линии люцерны | Способ инокуляции АМ грибом | мг/сосуд | Прирост к соответствую-щему контролю (без АМ), % | Р2О5, % | Прирост к соответствую-щему контролю (без АМ), % |
| Исходная линия (mleam-7) | подсадка лука без АМ | 42.2 ± 3.6 | 0.75 ± 0.11 | ||
| подсадка лука с АМ | 62.1 ± 5.8* | 47.2 ± 10.6 | 1.26 ± 0.19* | 68.0 ± 12.8 | |
| корнями плектрантуса без АМ | 34.4 ± 1.9 | 0.73 ± 0.08 | |||
| корнями плектрантуса с АМ | 41.9 ± 3.3* | 21.8 ± 3.9 | 1.28 ± 0.22* | 75.3 ± 13.9 | |
| Мутантная линия (mlelam-6) | подсадка лука без АМ | 23.9 ± 2.2 | 0.56 ± 0.06 | ||
| подсадка лука с АМ | 20.0 ± 1.9 | –16.3 ± 3.9 | 0.58 ± 0.08 | 3.6 ± 0.3 | |
| корнями плектрантуса без АМ | 21.3 ± 2.2 | 0.60 ± 0.08 | |||
| корнями плектрантуса с АМ | 22.8 ± 2.2 | 7.0 ± 1.1 | 0.60 ± 0.08 | –0.0 ± 0.3 | |
Исследование микоризы мутанта mlelam-6 показало, что для нее характерно образование более мелких и тонких арбускул, по сравнению с таковыми у исходной линии (рис. 1, в). Кроме того, микориза мутанта значительно уступала микоризе исходной линии по обилию арбускул (табл. 1). Так, при инокуляции микоризованными корнями у мутанта А = 2.0 ± 0.4%, а = 11.6 ± 1.3%, тогда как у исходной линии эти показатели были существенно выше, а именно А = 8.6 ± 1.3%, а = 50.6 ± ± 4.5%. При инокуляции растений подсадкой рассады наблюдалась та же закономерность: у мутанта, А = 2.9 ± 0.6%, а = 4.4 ± 0.7, тогда как у исходной линии, А = 6.5 ± 1.0%, а = 25.5 ± 2.1%. Кроме того, установлено, что инокуляция подсадкой рассады снижала обилие арбускул в АМ мутанта, по сравнению с инокуляцией корнями. Так, в первом случае а = 4.4 ± 0.7 %, тогда как во втором а = 11.6 ± 1.3%. Таким образом, по результатам анализа микоризы у мутанта и исходной линии просматривается общая тенденция: инокуляция подсадкой рассады снижала обилие арбускул в микоризе по сравнению с инокуляцией корнями.
Для АМ мутанта было характерно образование слаборазвитых (субтильных) везикул (рис. 1, б), которые отличались от везикул в микоризе исходной линии, хорошо выполненных и имеющих внутри капли липидов (таковые хорошо просматриваются в давленых препаратах окрашенных корней) (рис. 1, а). Слабое развитие везикул в АМ мутанта, возможно, является следствием того, что АМ гриб, облигатный симбиотроф, недополучает необходимые для своего развития источники энергии в виде ЖК или липидов. Такое возможно, если мутантное растение не поставляет ЖК грибу, поскольку, как следует из литературных источников, R. irregularis неспособен самостоятельно синтезировать жирные кислоты (Wewer et al., 2014). По свидетельству Keymer et al. (2017) в растении дикого типа гриб получает этот источник энергии в норме от растения-хозяина.
Показано, что подсадка растения-няни стимулировала образование везикул в микоризе мутанта по сравнению с инокуляцией путем внесения корневого инокулята. Так, в варианте с подсадкой лука В = 2.4 ± 0.6%, b = 3.6 ± 0.6%, а в варианте с инокуляцией микоризованными корнями В = = 0.2 ± 0.1 %, b = 1.1 ± 0.2 % (табл. 1). Поскольку, подобное наблюдалось и у исходной линии mleam-7, следовательно, можно говорить об общей тенденции зависимости скорости развития АМ у люцерны хмелевидной от способа инокуляции.
При анализе структурной организации АМ у мутанта mlelam-6 были выявлены существенные различия между вариантами инокуляции по таким показателям как F, М, m, а, B и b (табл. 1). Обращает на себя внимание тот факт, что использование для инокуляции приема подсадки растения-няни привело к значительному усилению роста межклеточного мицелия в корнях мутанта, о чем свидетельствуют значения показателей F, M и m. Так, если при инокуляции микоризованными корнями F = 38.5 ± 3.6%, M = 16.8 ± 1.8%, m = 43.6 ± 3.5%, то при подсадке микоризованной рассады эти показатели были равны 84.2 ± 10.0%, 66.0 ± 8.9% и 78.3 ± 10.3%, соответственно. В вариантах с подсадкой растения-няни мутант значительно превосходил также исходную линию mleam-7 по этим показателям, где F = 52.5 ± 6.2%, M = 25.6 ± 2.8% и m = 48.7 ± 5.0% (табл. 1).
Полученные результаты косвенно свидетельствуют о том, что облигатный микосимбионт получает необходимые углеводы (фотосинтаты) для роста межклеточных гиф непосредственно из апопласта корня, без значительного участия в этом арбускул. Сделано предположение, что в растениях дикого типа, способных формировать полноценные арбускоциты, АМ гриб образует арбускулы именно с целью получения ЖК от растения-хозяина. Как следует из литературных источников, арбускоциты действительно имеют прямое отношение к продукции ЖК (Keymer et al., 2017).
Анализ мутанта по показателям продуктивности показал, что образование АМ при разных способах инокуляции не привело к существенным изменениям урожая соломы и содержания в ней общего Р, по сравнению с соответствующим контролем (без АМ) (табл. 2). Так, при использовании приема инокуляции с подсадкой микоризованного растения-няни урожай соломы составил 20.0 ± 1.9 мг на сосуд, содержание Р2О5 в соломе – 0.58 ± 0.08%, тогда как в контроле (без АМ) эти показатели были равны 23.9 ± 2.2 мг и 0.56 ± ± 0.06%, соответственно. Похожие результаты были получены и при инокуляции микоризованными корнями: урожай соломы составил 22.8 ± ± 2.2 мг на сосуд, содержание Р2О5 в соломе – 0.60 ± 0.08 %, тогда как в варианте без АМ эти показатели были 21.3 ± 2.2 мг и 0.60 ± 0.08%, соответственно.
На основании наблюдений мутанта mlelam-6 можно предположить, что отсутствие реакции на микоризацию, слабое развитие арбускул и везикул могли быть вызваны сбоем в развитии арбускоцитов и биосинтезе (или транспорте) в них ЖК, необходимых микосимбионту. Как уже упоминалось во введении, арбускоциты у растений дикого типа отличаются высокой метаболической активностью (Ivanov, Harrison, 2014; Lohse et al., 2005), при этом в них активируются ряд генов, ответственных за биосинтез липидов, необходимых для микосимбионта (Gaude et al., 2012).
ЗАКЛЮЧЕНИЕ
Наблюдения за структурно-функциональной организацией арбускулярной микоризы, образованной у мутантной (mlelam-6) линии люцерны хмелевидной в ассоциации с R. irregularis при двух способах инокуляции (микоризованными корнями и подсадкой микоризованной рассады) позволили выявить особенности внутрикорневого роста АМ гриба облигатного микросимбиотрофа, а именно роста межклеточных гиф без заметного участия арбускул.
На примере исходной линии (mleam-7) показана так же возможность регуляции экологической эффективности микоризы у сильномикотрофного растения путем подбора оптимальных условий инокуляции.
Работа выполнена при финансовой поддержке РФФИ (проекты №№ 08-04-13744-офи-ц, 19-016-00197-а).
Список литературы
Bago B., Pfeffer P.E., Abubaker J., Jun J., Allen J.W., Brouillette J., Douds D.D., Lammers P.J., Shachar-Hill Y. Carbon export from arbuscular mycorrhizal roots involves the translocation of carbohydrate as well as lipid. Plant Physiol. 2003. V. 131. P. 1496–1507. https://doi.org/10.1104/pp.102.007765
Bagyaraj D.J., Sharma M.P. and Maiti D. Phosphorus nutrition of crops through arbuscular mycorrhizal fungi. Current Science. 2015. V. 108 (7). P. 1288–1293.
Borisov A.Y., Barmicheva E.M., Jacobi L.M., Tsyganov V.E., Voroshilova V.A., Tikhonovich I.A. Pea (Pisum sativum L.) mendelian genes controlling development of nitrogen-fixing nodules and arbuscular mycorrhiza. Czech J. Genet. Plant Breed. 2000. V. 36. P. 106–110.
Boudarga K., Dexheimer J. Une méthode simple pour maintenir et multiplier les champignons des mycorhizes à vésicules et arbuscules. Agronomie. 1990. V. 10 (5). P. 417–422. https://doi.org/10.1051/agro:19900508
Duc G., Trouvelot A., Gianinazzi-Pearson V., Gianinazzi S. First report of non-mycorrhizal plant mutants (Myc-) obtained in pea (Pisum sativum L.) and fababean (Vicia faba L.). Plant Sci. 1989. V. 60. P. 215–222.
Gaude N., Bortfeld S., Duensing N., Lohse M., Krajinski F. Arbuscule-containing and non-colonized cortical cells of mycorrhizal roots undergo extensive and specific reprogramming during arbuscular mycorrhizal development. The Plant Journal. 2012. V. 69. P. 510–528. https://doi.org/10.1111/j.1365-313X.2011.04810.x
Ginzburg K.E., Shcheglova G.M. Determination of nitrogen, phosphorus and potassium in plant material from one sample. Pochvovedenie. 1960. N 5 (in Russ.).
Giovannetti M., Gianinazzi-Pearson V. Mycol. Res. 1994. V. 98. P. 705–715.
Ivanov S., Harrison M.J. A set of fluorescent protein-based markers expressed from constitutive and arbuscular mycorrhiza-inducible promoters to label organelles, membranes and cytoskeletal elements in Medicago truncatula. The Plant Journal. 2014. V. 80. P. 1151–1163. https://doi.org/10.1111/tpj.12706
Jakobsen J., Robson A. Externel hyphae of vesicular-arbuscular mycorrhizal fungi associated with Trifolium subterraneum L. Spread of hyphae and phosphorus inflow into roots. New Phytol. 1992. V. 120. P. 371–380.
Javot H., Penmetsa R.V., Terzaghi N., Cook D.R., Harrison M.J. A Medicago truncatula phosphate transporter indispensable for the arbuscular mycorrhizal symbiosis. PNAS. 2007. V. 104. P. 1720–1725. https://doi.org/10.1073/pnas.0608136104
Keymer A., Pimprikar P., Wewer V., Huber C., Brands M., Bucerius S.L., Delaux P.M., Klingl V., Roepenack-Lahaye E., Wang T.L., Eisenreich W., Dörmann P., Parniske M., Gutjahr C. Lipid transfer from plants to arbuscular mycorrhiza fungi. 2017. https://doi.org/10.7554/elife.29107
Kurenkov A.A., Polteva O.V., Jacobi L.M., Yurkov A.P. Phenotypic features ineffective arbuscular mycorrhizae of such mutant of alfalfa (Medicago lupulina L. subsp. vulgaris Koch) in association with the fungus Glomus intraradices. Estestvennye i tekhnicheskie nauki. 2013. V. 6. P. 105–110 (in Russ.).
Lohse S., Schliemann W., Ammer C., Kopka J., Strack D., Fester T. Organization and metabolism of plastids and mitochondria in arbuscular mycorrhizal roots of Medicago truncatula. Plant Physiol. 2005. V. 139. P. 329–340. https://doi.org/10.1104/pp.105.061457
Luginbuehl L.H., Menard G.N., Kurup S., Van Erp H., Radhakrishnan G.V., Breakspear A., Oldroyd G.E.D., Eastmond P.J. Fatty acids in arbuscular mycorrhizal fungi are synthesized by the host plant. Science. 2017. V. 356. P. 1175–1178. https://doi.org/10.1126/science.aan0081
Pfeffer P.E., Douds D.D., Becard G., Shachar-Hill Y. Carbon uptake and the metabolism and transport of lipids in an arbuscular mycorrhiza. Plant Physiol. 1999. V. 120. P. 587–598. https://doi.org/10.1104/pp.120.2.587
Phillips J.M., Hayman D.S. Improved procedures for cleaning roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br. Mycol. Soc. 1970. V. 55. P. 158–162.
Rosewarne G.M., Barker S.J., Smith S.E. Production of near-synchronous fungal colonization in tomato for developmental and molecular analyses of mycorrhiza. Mycol. Res. 1997. V. 101. P. 966–970.
Schliemann W., Ammer C., Strack D. Metabolite profiling of mycorrhizal roots of Medicago truncatula. Phytochemistry. 2008. V. 69. P. 112–114. https://doi.org/10.1016/j.phytochem.2007.06.032
Schweiger R., Baier M.C., Persicke M., Muller C. High specifi-city in plant leaf metabolic responses to arbuscular mycorrhiza. Nat. Commun. 2014. V. 5. P. 3886. https://doi.org/10.1038/ncomms4886
Selivanov I.A. Mycorrhiza and the systematic position of the host plant. In: Mycorrhiza and other forms of consortive relationships in nature. Perm, 1980, pp. 3–13 (in Russ.).
Shachar-Hill Y., Pfeffer P.E., Douds D., Osman S.F., Doner L.W., Ratcliffe R.G. Partitioning of intermediary carbon metabolism in vesicular-arbuscular mycorrhizal leek. Plant Physiol. 1995. V. 108. P. 7–15.
Smith S.E., Read D.J. Mycorrhizal symbiosis, 3rd ed. Maryland Heights, Elsevier, Academic Press, 2008.
Sokolov A.V. Agrochemical methods of soil research. Ed. Nauka, Moskwa, 1975. P. 656. (Chapter: “Determination of phosphorus in solution by Truog and Meyer”. P. 111–113) (in Russ.).
Stepanova G.V. Economic value of wild samples of hop black medick (Medicago lupulina L.) of different ecological and geographical origin. Trudy po prikladnoy botanike, genetike i selektsii. 2009. V. 166. P. 249–255 (in Russ.).
Tang N., San Clemente H., Roy S., Bécard G., Zhao B., Roux C. A survey of the Gene repertoire of Gigaspora rosea unravels conserved features among Glomeromycota for obligate biotrophy. Front. Microbiol. 2016. V. 7. P. 233. https://doi.org/10.3389/fmicb.2016.00233
Trépanier M., Bécard G., Moutoglis P., Willemot C., Gagné S., Avis T.J., Rioux J.A. Dependence of arbuscular-mycorrhizal fungi on their plant host for palmitic acid synthesis. Appl. Envir. Microbiol. 2005. V. 71. P. 5341–5347. https://doi.org/10.1128/AEM.71.9.5341-5347.2005
Trouvelot A., Kough J.L.,Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methodes ayant une signification fonctionnelle. In: Physiological and genetical aspects of mycorrhizae. Ed. by V. Gianinazzi-Pearson, S. Gianinazzi. Paris, 1986.
Vorobyov N.I., Yurkov A.P., Provorov N.A. Program of calculation of mycorrhization indexes of plant roots. Patent N 2016612112. 12.02.2016. Moscow, 2016 (in Russ.).
Wegel E., Schauser L., Sandal N., Stougaard J., Parniske M. Mycorrhiza mutants of Lotus japonicus define genetically independent steps during symbiotic infection. MPMI. 1998. Vol. 11. N 9. P. 933–936.
Wewer V., Brands M., Dörmann P. Fatty acid synthesis and lipid metabolism in the obligate biotrophic fungus Rhizophagus irregularis during mycorrhization of Lotus japonicus. The Plant Journal. 2014. V. 79. P. 398–412. https://doi.org/10.1111/tpj.12566
Yurkov A.P., Kryukov A.A., Yacobi L.M., Kozhemyakov A.P., Shishova M.F. Relationship of activity and efficiency indicators of arbuscular mycorrhizal fungi strains of various origins. Taurida herald of the agrarian sciences. № 4 (12). 2017. P. 31–41 (in Russ.).
Yurkov A.P., Jacobi L.M., Kozhemyakov A.P., Shishova M.F. Influence of arbuscular mycorrhiza on the growth and development of a mycorrhizal line of alfalfa hop (Medicago lupulina L.). Plant physiology. Vestnik Sankt-Peterburgskogo universiteta. 2009. V. 3. P. 138–144 (in Russ.). Агрохимические методы исследования почв (Agrochemical) М.: Наука, 1975. 656 с.
Воробьев Н.И., Юрков А.П., Проворов Н.А. (Vorobyev et al.) Программа расчета показателей микоризации корней растений. Патент № 2016612112. 12.02.2016. Москва, 2016.
Гинзбург К.Е., Щеглова Г.М. (Ginzburg, Shcheglova) Определение азота, фосфора и калия в растительном материале из одного образца // Почвоведение. 1960. № 5.
Куренков А.А., Полтева О.В., Якоби Л.М., Юрков А.П. (Kurenkov et al.) Фенотипические признаки неэффективной арбускулярной микоризы у мутанта люцерны (Medicago lupulina L. subsp. vulgaris Koch) в ассоциации с грибом Glomus intraradices // Естественные и технические науки. 2013. Т. 6. С. 105–110.
Селиванов И.А. (Selivanov) Микориза и систематическое положение растения-хозяина // Микориза и другие формы взаимоотношений в природе. Пермь, 1980. С. 3–13.
Соколов А.В. Агрохимические методы исследования почв. М.: Наука, 1975. С. 656.
Степанова Г.В. (Stepanova) Хозяйственная ценность диких образцов люцерны хмелевидной (Medicago lupulina L.) различного экологического и географического происхождения // Труды по прикладной ботанике, генетике и селекции. 2009. Т. 166. С. 249–255.
Юрков А.П., Якоби Л.М., Кожемяков А.П., Шишова М.Ф. (Yurkov et al.) Влияние арбускулярной микоризы на рост и развитие микоризной линии люцерны хмелевидной (Medicago lupulina L.) // Физиология растений. Вестник Санкт-Петербургского университета. 2009. Т. 3. С. 138–144.
Юрков А.П., Крюков А.А., Якоби Л.М., Кожемяков А.П., Шишова М.Ф. Взаимосвязь показателей активности и эффективности штаммов грибов арбускулярной микоризы различного происхождения // Таврический вестник аграрной науки. № 4(12). 2017. С. 31–41.
Юрков А.П., Крюков А.А., Якоби Л.М., Кожемяков А.П., Шишова М.Ф. Взаимосвязь показателей активности и эффективности штаммов грибов арбускулярной микоризы различного происхождения // Таврический вестник аграрной науки. № 4(12). 2017. С. 31–41.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


