Микология и фитопатология, 2020, T. 54, № 5, стр. 347-364
Разнообразие грибов рода Microdochium, выявленных на зерновых культурах в России
Т. Ю. Гагкаева 1, *, А. С. Орина 1, **, О. П. Гаврилова 1, ***
1 Всероссийский НИИ защиты растений
196608 Санкт-Петербург, Россия
* E-mail: t.gagkaeva@mail.ru
** E-mail: orina-alex@yandex.ru
*** E-mail: olgavrilova1@yandex.ru
Поступила в редакцию 15.04.2020
После доработки 01.05.2020
Принята к публикации 11.05.2020
Аннотация
Впервые на территории России проведена идентификация грибов рода Microdochium, ассоциированных с зерновыми культурами. Выявлены четыре вида Microdochium, из которых Microdochium majus, M. nivale и M. bolleyi широко распространены на территории России, а M. seminicola встречался только на территории Уральского и Западно-Сибирского регионов страны. Видовая идентификация штаммов M. bolleyi и M. seminicola подтверждена секвенированием четырех участков ДНК (LSU, ITS, BTUB и RPB2). Изучение физиолого-биохимических свойств штаммов грибов Microdochium выявило значительные отличия M. bolleyi от трех других видов, сходных по морфолого-культуральным признакам. Выявлена неспособность штаммов анализированных видов Microdochium к активному росту на агаризованной или жидкой среде Чапека, в отличие от среды на основе картофельного отвара. Штаммы M. bolleyi охарактеризованы как эндофиты, тогда как патогенные свойства M. majus, M. nivale и M. seminicola значительно варьировали. Полученные в нашем исследовании результаты вносят существенный вклад в понимание существующего разнообразия грибов Microdochium, ассоциированных с культурными злаками на территории России.
ВВЕДЕНИЕ
В недавно опубликованных работах детально описано разнообразие представителей рода Microdochium Syd. et P. Syd., и, по итогам комбинирования морфологического и молекулярного изучения, был пересмотрен таксономический статус видов этой группы грибов (Hernández-Restrepo et al., 2016; Crous et al., 2018). Представители Microdochium, ранее включенные в различные порядки отдела Ascomycota, в настоящее время сгруппированы в семейство Microdochiaceae порядка Xylariales класса Sordariomycetes. На текущий момент этот род включает более 45 видов (MycoBank, 2020), являющихся эндофитами, сапротрофами и патогенами растений. Выявленное разнообразие грибов привело к значительному увеличению внимания к точной идентификации видов Microdochium и их биоэкологическим особенностям.
По морфологическим признакам видовую идентификацию грибов рода Microdochium проводить затруднительно. Например, виды M. majus (Wollenw.) Glynn et S.G. Edwards и M. nivale (Fr.) Samuels et I.C. Hallett являются морфологическими двойниками (Glynn et al., 2005), а у вида M. seminicola Hern.-Restr., Seifert, Clear et B. Dorn очень редко в чистой культуре наблюдается спороношение (Hernández-Restrepo et al., 2016).
Применение молекулярно-генетических методов в исследованиях биоразнообразия грибов повышает точность идентификации таксонов и помогает развивать существующие представления о географическом распределении видов. Так, анализ нуклеотидной последовательности участков ITS, β-тубулина, RPB2 и EF-1α позволил дифференцировать изоляты M. nivale и M. majus разного субстратного и географического происхождения (Jewell, Hsiang, 2013). Методика разделения двух видов Microdochium с помощью количественной ПЦР позволила выявить преобладание вида M. majus в зерне всех культур, за исключением ржи, в результате анализа 374 образцов семян пшеницы, ячменя, тритикале, ржи и овса (Nielsen et al., 2013). Другими исследователями также подтверждено превалирование M. majus над M. nivale в зерне яровых пшеницы, тритикале и овса, тогда как в зерне ячменя чаще выявляли M. nivale (Jonavičienė et al., 2016). В то же время, оценка зараженности грибами сортов озимой пшеницы, выращенной в Краснодарском крае в России, показала присутствие в зерне двух видов Microdochium, а также установила превышение количества ДНК гриба M. nivale в три раза, по сравнению с ДНК M. majus (Gagkaeva et al., 2018).
Ранее на зерновых культурах, выращиваемых на территории России, согласно суммарной характеристике морфолого-культуральных признаков штаммов Microdochium, а также филогении на основе последовательностей четырех участков ДНК, были выявлены три вида Microdochium: M. majus, M. nivale и M. seminicola (Gagkaeva et al., 2020). В отличие от широко распространенных видов M. majus и M. nivale, штаммы M. seminicola были обнаружены только на территории Уральского и Западно-Сибирского регионов России.
Молекулярно-генетическая идентификация грибов Microdochium, выделенных из зерна и злаковых трав, выявила более высокое генетическое разнообразие изолятов M. nivale, чем M. majus, причем дифференциация изолятов M. nivale оказалась связана с их субстратным и географическим происхождением (Abdelhalim et al., 2020).
Для понимания взаимоотношений представителей рода Microdochium с растениями важны знания о физиологических и биохимических признаках грибов, включающих информацию о патогенности, влиянии на их рост и метаболизм условий окружающей среды или других микроорганизмов. Высокая адаптивность грибов Microdochium предполагает наличие неучтенного видового разнообразия на территории России.
Целью исследования являлось выявление видового разнообразия грибов Microdochium, встречающихся на зерновых культурах на территории России, характеристика их биоэкологических особенностей и роли в функционировании микобиоты растений.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы грибов рода Microdochium, включенные в исследование. В период с 2016 по 2019 г. авторами были выделены с зерновых культур более 30 изолятов грибов, отнесенных к роду Microdochium по морфологическим характеристикам (табл. 1). Также в исследование были включены 8 изолятов, выделенных из зерновых культур в 2007–2008 гг. и хранящихся как Microdochium spp. в коллекции лаборатории микологии и фитопатологии (MFG) Всероссийского НИИ защиты растений. Изоляты Microdochium, включенные в исследование, имели различное географическое происхождение: 5 изолятов из Северо-Западного федерального округа (ФО) России (Калининградская, Новгородская и Ленинградская области), 5 изолятов из Центрального ФО (Белгородская и Воронежская области), 3 изолята из Южного ФО (Краснодарский край), 6 изолятов из Приволжского ФО (Республика Башкортостан, Кировская и Пензенская области), 7 изолятов из Уральского ФО (Свердловская и Тюменская области) и 12 изолятов из Сибирского ФО (Алтайский край, Новосибирская, Кемеровская и Красноярская области), а также один изолят из Дальневосточного ФО (Приморский край).
Таблица 1.
Виды и штаммы грибов рода Microdochium, использованные в исследовании
| Виды Microdochium | Номер штамма в коллекции | Хозяин, субстрат | Страна, регион | Год | Номер нуклеотидной последовательности в GenBank | |||
|---|---|---|---|---|---|---|---|---|
| LSU | ITS | BTUB | RPB2 | |||||
| M. albescens | CBS 243.83* | Oriza sativa, семена | KP858930 | KP858994 | KP859057 | KP859103 | ||
| M. albescens | CBS 290.79* | Oriza sativa | Кот-д’Ивуар | KP858950 | KP859014 | KP859077 | KP859123 | |
| M. bolleyi | CBS 540.92* | Hordeum vulgare, корни | Сирия | KP858946 | KP859010 | KP859073 | KP859119 | |
| M. bolleyi | CPC 25994* | древесина | Канада | KP858954 | KP859018 | KP859081 | KP859127 | |
| M. bolleyi | MFG 60363** | Triticum aestivum, зерно | Россия, Башкортостан | 2018 | MN750189*** | MN759672 | MN817721 | MN817751 |
| M. bolleyi | MFG 60509 | Triticum aestivum, листья | Россия, Ленинградская обл. | 2019 | MN750205 | MN759685 | MN817734 | MN817764 |
| M. bolleyi | MFG 60510 | Hordeum vulgare, зерно | Россия, Новгородская обл. | 2008 | MN750206 | MN759686 | MN817735 | MN817765 |
| M. bolleyi | MFG 60511 | Avena sativa, зерно | Россия, Кировская обл. | 2007 | MN750207 | MN759687 | MN817736 | MN817766 |
| M. bolleyi | MFG 60512 | Hordeum vulgare, зерно | Россия, Калининградская обл. | 2008 | MN750208 | MN759688 | MN817737 | MN817767 |
| M. bolleyi | MFG 60513 | Avena sativa, зерно | Россия, Кировская обл. | 2008 | MN750209 | MN759689 | MN817738 | MN817768 |
| M. bolleyi | MFG 60514 | Hordeum vulgare, зерно | Россия, Ленинградская обл. | 2008 | MN750210 | MN759690 | MN817739 | MN817769 |
| M. bolleyi | MFG 60515 | Avena sativa, зерно | Россия, Приморский край | 2008 | MN750211 | MN759691 | MN817740 | MN817770 |
| M. bolleyi | MFG 60516 | Hordeum vulgare, зерно | Россия, Ленинградская обл. | 2008 | MN750212 | MN759692 | MN817741 | MN817771 |
| M. bolleyi | MFG 60517 | Avena sativa, зерно | Россия, Кировская обл. | 2007 | MN750213 | MN759693 | MN817742 | MN817772 |
| M. colombiense | CBS 624.94 T* | Musa sapientum | Колумбия | KP858935 | KP858999 | KP859062 | KP859108 | |
| M. majus | CBS 741.79* | Triticum aestivum | Германия | KP858937 | KP859001 | KP859064 | KP859110 | |
| M. majus | MFG 59102 | Hordeum vulgare, зерно | Россия, Краснодарский край | 2016 | MN750185 | – | – | – |
| M. majus | MFG 60127 | Triticum aestivum, зерно | Россия, Воронежская обл. | 2017 | MN473994 | – | – | – |
| M. majus | MFG 60128 | Triticum aestivum, зерно | Россия, Воронежская обл. | 2017 | MN473995 | – | – | – |
| M. majus | MFG 60129 | Triticum aestivum, зерно | Россия, Новосибирская обл. | 2017 | MN473996 | – | – | – |
| M. neoqueenslandicum | CBS 445.94* | Juncus effusus | Нидерланды | KP858933 | KP858997 | KP859060 | KP859106 | |
| M. nivale | CBS 166205 T* | Triticum aestivum, корни | Великобритания | KP858944 | KP859008 | KP859071 | KP859117 | |
| M. nivale | MFG 59144 | Triticum aestivum | Россия, Краснодарский край | 2016 | MN473990 | – | – | – |
| M. nivale | MFG 60116 | Triticum aestivum, зерно | Россия, Краснодарский край | 2016 | MN473991 | – | – | – |
| M. nivale | MFG 60123 | Triticum aestivum, зерно | Россия, Пензенская обл. | 2017 | MN473992 | – | – | – |
| M. nivale | MFG 60126 | Triticum aestivum, зерно | Россия, Пензенская обл. | 2017 | MN473993 | – | – | – |
| M. nivale | MFG 60144 | Triticum aestivum, зерно | Россия, Алтайский край | 2017 | MN474001 | – | – | – |
| M. nivale | MFG 60214 | Triticum aestivum | Россия, Белгородская обл. | 2018 | MN474002 | – | – | – |
| M. nivale | MFG 60216 | Triticum aestivum | Россия, Белгородская обл. | 2018 | MN474003 | – | – | – |
| M. nivale | MFG 60217 | Triticum aestivum | Россия, Белгородская обл. | 2018 | MN474005 | – | – | – |
| M. phragmitis | CBS 285.71 T* | Phragmites australis | Польша | KP858949 | KP859013 | KP859076 | KP859122 | |
| M. seminicola | CBS 122707* | зерно кукурузы | Швейцария | KP858947 | KP859011 | KP859074 | KP859120 | |
| M. seminicola | CBS 139951 T* | зерно кукурузы | Швейцария | KP858974 | KP859038 | KP859101 | KP859147 | |
| M. seminicola | DAOM 250159* | зерно кукурузы | Канада | KP858971 | KP859035 | KP859098 | KP859144 | |
| M. seminicola | DAOM 250161* | Triticum aestivum | Канада | KP858970 | KP859034 | KP859097 | KP859143 | |
| M. seminicola | MFG 60131 | Triticum aestivum, зерно | Россия, Красноярский край | 2017 | MN473997 | MN759667 | MN817716 | MN817746 |
| M. seminicola | MFG 60132 | Triticum aestivum, зерно | Россия, Красноярский край | 2017 | MN473998 | MN759668 | MN817717 | MN817747 |
| M. seminicola | MFG 60138 | Triticum aestivum, зерно | Россия, Новосибирская обл. | 2017 | MN473999 | MN759669 | MN817718 | MN817748 |
| M. seminicola | MFG 60139 | Triticum aestivum, зерно | Россия, Тюменская обл. | 2017 | MN474000 | MN759670 | MN817719 | MN817749 |
| M. seminicola | MFG 60140 | Triticum aestivum, зерно | Россия, Тюменская обл. | 2017 | MN474004 | MN759671 | MN817720 | MN817750 |
| M. seminicola | MFG 60430 | Triticum aestivum, зерно | Россия, Алтайский край | 2019 | MN750191 | MN759673 | MN817722 | MN817753 |
| M. seminicola | MFG 60431 | Triticum aestivum, зерно | Россия, Алтайский край | 2019 | MN750192 | MN759674 | MN817723 | MN817754 |
| M. seminicola | MFG 60434 | Avena sativa, зерно | Россия, Свердловская обл. | 2019 | MN750195 | MN759675 | MN817724 | MN817755 |
| M. seminicola | MFG 60435 | Avena sativa, зерно | Россия, Свердловская обл. | 2019 | MN750196 | MN759676 | MN817725 | MN817756 |
| M. seminicola | MFG 60436 | Hordeum vulgare, зерно | Россия, Свердловская обл. | 2019 | MN750197 | MN759677 | MN817726 | MN817757 |
| M. seminicola | MFG 60437 | Avena sativa, зерно | Россия, Свердловская обл. | 2019 | MN750198 | MN759678 | MN817727 | MN817758 |
| M. seminicola | MFG 60438 | Hordeum vulgare, зерно | Россия, Свердловская обл. | 2019 | MN750199 | MN759679 | MN817728 | MN817759 |
| M. seminicola | MFG 60439 | Triticum aestivum, зерно | Россия, Кемеровская обл. | 2019 | MN750200 | MN759680 | MN817729 | MN817760 |
| M. seminicola | MFG 60440 | Triticum aestivum, зерно | Россия, Кемеровская обл. | 2019 | MN750201 | MN759681 | MN817730 | MN817761 |
| M. seminicola | MFG 60441 | Triticum aestivum, зерно | Россия, Кемеровская обл. | 2019 | MN750202 | MN759682 | MN817731 | MN817762 |
| M. seminicola | MFG 60442 | Triticum aestivum, зерно | Россия, Кемеровская обл. | 2019 | MN750203 | MN759683 | MN817732 | MN817763 |
| M. seminicola | MFG 60443 | Hordeum vulgare, зерно | Россия, Кемеровская обл. | 2019 | MN750204 | MN759684 | MN817733 | MN817764 |
Примечание. *Штаммы, нуклеотидные последовательности которых использовались в филогенетическом анализе в качестве референтных. Т – типовой штамм. Информация о происхождении штаммов (Hernández-Restrepo et al., 2016). **Подчеркиванием отмечены штаммы, включенные в анализ патогенных свойств. ***Подчеркиванием отмечены нуклеотидные последовательности, полученные в данном исследовании.
Среди анализированных изолятов 24 были выделены из пшеницы (Triticum aestivum L.), 8 – из ячменя (Hordeum vulgare L.), 7 – из овса (Avena sativa L). Среди них 34 изолята были выделены из зерна, 1 – из флагового листа пшеницы с пятнистостью, 4 – из растений с симптомами “снежной плесени” в весенний период.
Для каждого изолята, формирующего спороношение, были получены моноспоровые культуры. Для изолятов, не образующих спороношение, чистые культуры получали путем пересева кончика растущей гифы с края колонии.
Изоляты грибов были отобраны без какой-либо предварительной оценки их микроморфологических структур, а только по фенотипическому сходству с грибами рода Microdochium. Сначала, для идентификации изолятов использовали молекулярные методы, поскольку формирование четких морфологических признаков занимает много времени. Далее, в соответствии с установленным видовым таксоном, были проанализированы морфолого-культуральные и другие признаки выбранных для исследований изолятов.
Генотипическая характеристика штаммов. Все культуры грибов выращивали на картофельно-сахарозной агаризованной среде (КСА) при 24°С в течение 7 суток. Выделение ДНК из 10–50 мг мицелия, собранного с поверхности колонии гриба, проводили с помощью набора Genomic DNA Purification Kit (Thermo Fisher Scientific, Литва) согласно протоколу производителя.
Принадлежность штаммов к видам M. majus и M. nivale определяли с помощью ПЦР с видоспецифичными праймерами Mnm2F/R и Y13NF/R, соответственно (Nicholson, Parry, 1996; Nicholson et al., 1996; Doohan et al., 1998). Реакции проводили в реакционной смеси объемом 25 мкл, содержащей 1×ПЦР-буфер для Taq-полимеразы с 25 мМ MgCl2, dNTP – 0.2 мM, Taq-полимераза – 0.5 ед. (все реактивы Thermo Fisher Scientific, Литва), праймеры – 0.5 мкМ (Евроген, Россия) по протоколам авторов. Электрофорез продуктов амплификации проводили в 1.5%-м агарозном геле.
Дополнительная генетическая экспертиза видовой принадлежности этих штаммов была проведена на основе анализа нуклеотидной последовательности участка ДНК, кодирующего большую субъединицу рРНК (LSU), с использованием праймеров LSU1Fd (Crous et al., 2009) и LR5 (Vilgalys, Hester, 1990) по описанным протоколам (Crous et al., 2013). Нуклеотидную последовательность фрагментов определяли на секвенаторе ABIPrism 3500 (Applied Biosystems, Hitachi, Japan) с использованием набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, USA). Процедуры выравнивания и ручного редактирования хроматограмм, а также получение консенсусных нуклеотидных последовательностей проводили с помощью программ Vector NTI Advance 10 (Thermo Fisher Scientific) и MEGA X 10.1 (Kumar et al., 2018). Полученные сиквенсы с помощью инструмента BLAST были проверены на сходство с депонированными в международной информационной базе данных NCBI GenBank (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Филогенетические отношения межу таксонами оценивали методами максимального правдоподобия (maximum likelihood; ML) с использованием программы MEGA X 10.1. Достоверность топологии филогенетических деревьев определяли посредством бутстреп-анализа (1000 повторностей).
Для штаммов, которые на филогенетическом древе кластеризовались с референсными штаммами M. majus и M. nivale, и ДНК которых давали продукт амплификации в ПЦР с видоспецифичными праймерами на предыдущем этапе, видовую принадлежность считали установленной. Для штаммов, которые кластеризовались с референсными штаммами других видов Microdochium или положение которых было неопределенным, дополнительно с помощью праймеров ITS1 и ITS4 амплифицировали участок внутреннего транскрибируемого спейсера рДНК (ITS) (White et al., 1990). Фрагмент гена β-тубулина (BTUB) был амплифицирован с использованием праймеров Btub526F и Btub1332R (Jewell, Hsiang, 2013), тогда как с помощью пары праймеров RPB150F (Jewell, Hsiang, 2013) и fRPB2-7cR (Liu et al., 1999) амплифицировали фрагмент (RPB2), кодирующий вторую большую субъединицу РНК полимеразы II. Амплификацию проводили по разработанным ранее протоколам (Crous et al., 2013; Jewell, Hsiang, 2013). Обработку последовательностей и построение филогенетических деревьев проводили методами ML и максимальной экономии (maximum parsimony; MP) с использованием программы MEGA X. Также рассчитывали байесовскую вероятность (Bayesian probability; BP) с помощью MrBayes v. 3.2.1 на платформе Armadillo 1.1 (Lord et al., 2012). Достоверность топологии филогенетических деревьев определяли посредством бутстреп-анализа (1000 повторностей). Полученные нуклеотидные последовательности были размещены в базе данных NCBI GenBank.
Фенотипическая характеристика штаммов. Фенотипические особенности штаммов грибов анализировали при их культивировании на двух питательных средах – КСА и агаре Чапека. Оценивали тип и окраску воздушного мицелия, пигментацию колонии. Для описания макро- и микроморфологических признаков штаммы грибов Microdochium выращивали на КСА в темноте при 25°С или при постоянном освещении в течение 10 суток, а затем дополнительно выдерживали еще две недели при 4°С. Анализировали размеры конидий, их форму, число септ и другие микроморфологические признаки.
Характеристики штаммов были исследованы и задокументированы с помощью микроскопа Olympus ВХ53 и стереомикроскопа Olympus SZX16 (Olympus America, США), подключенного к камере PROKYON (Jenoptik, Jena, Германия).
Характеристика роста штаммов на питательных средах. Скорость роста штаммов Microdochium оценивали при культивировании их на КСА в темноте при 25°С. Из культур грибов, предварительно выращенных на КСА (7–14 суток), микробиологическим сверлом вырезали диски диаметром 5 мм и помещали их верхней стороной на поверхность свежей КСА в центр чашки Петри диаметром 90 мм. Край выросшей колонии измеряли в двух диаметральных направлениях и рассчитывали среднюю скорость роста штамма. Диаметр колоний штаммов M. majus, M. nivale и M. seminicola измеряли на шестые сутки, штаммов M. bolleyi (R. Sprague) de Hoog et Herm.-Nijh. – на 10-е сутки.
Рост штаммов грибов также оценивали по накоплению биомассы мицелия, полученной методом глубинного культивирования. Каждый штамм выращивали параллельно в 100 мл жидкой питательной среды Чапека, содержащей 1% аспарагина, и 100 мл картофельно-сахарозной среды (КСС) в качалочных колбах Эрленмейера объемом 750 мл. В объем каждой питательной среды вносили по три диска культур грибов 5 мм диаметром, выращенных на КСА при 25°С в течение 7–10 суток.
Далее штаммы культивировали в термостатируемых орбитальных шейкерах Innova 44R (Eppendorf, Германия) при температуре 25°С и постоянном перемешивании со скоростью 100 об/мин в течение 7 суток.
Отделение биомассы грибов от культуральной жидкости проводили методом вакуум-фильтрации через бумажные фильтры Экрос “Красная лента” 90 мм с помощью насоса Millipore Vacuum Pump XF 54. Фильтры с биомассой высушивали при 50°С в шкафу Binder FD 53 в течение суток и затем взвешивали на весах AND DL-300. Вычитая из полученного значения исходную массу предварительно взвешенного бумажного фильтра, получали искомую массу мицелия гриба.
Характеристика патогенных свойств штаммов. Патогенные свойства 32 штаммов грибов рода Microdochium оценивали путем инокуляции отрезков листьев озимой пшеницы сорта Васса. Растения пшеницы выращивали в течение 10 суток в горшках с почвой при постоянном освещении. Для эксперимента использовали отрезки листьев длиной 5–7 см, которые помещали в кюветы на фильтровальную бумагу, увлажненную 0.004%-м водным раствором бензимидазола (Mikhailova, Afanasenko, 2005).
Инокуляцию отрезков листьев проводили с помощью дисков диаметром 5 мм, вырезанных из выращенных на КСА культур грибов (7–10 суток). Перед инокуляцией в центре каждого отрезка листа делали укол стерильной иглой. Далее на место укола раскладывали диск культуры гриба мицелием вниз. Дополнительно на каждый диск наносили 10 мкл стерильной воды для предотвращения высыхания. Этот метод было использован для создания равномерной инфекционной нагрузки на растительную ткань, поскольку не все штаммы Microdochium образовывали спороношение, что делало невозможным приготовление суспензии конидий для инокуляции. В каждом варианте инокулировали по 10 отрезков листьев. В контрольном варианте на отрезки листьев раскладывали диски чистой среды КСА.
Кюветы накрывали стеклом, выдерживали при 20°С, влажности 60% и переменном освещении в режиме: 16 ч свет/8 ч темнота в климатической камере MLR-352Н (Panasonic, Япония). Через пять суток после инокуляции измеряли длину образовавшегося симптома поражения (мм) каждого отрезка листьев. Штамм считали непатогенными, если размер вызываемого поражения растительной ткани был меньше размера диска (5 мм). Агрессивность патогенных штаммов ранжировали по шкале: слабоагрессивный – размер симптомов от 5 до 10 мм; среднеагрессивный – размер симптомов от 10 до 20 мм; высокоагрессивный – размер симптомов больше 20 мм.
Статистическая обработка результатов. Все лабораторные анализы выполняли как минимум двукратно. Для расчета средних значений с доверительным интервалом при уровне значимости р < 0.05 и визуализации полученных данных использовали программу Microsoft Excel 2010. Статистически значимые различия между анализируемыми параметрами определяли с помощью дисперсионного анализа в программе Statistica 10.0. Различия считали достоверными при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ
Генотипическая характеристика штаммов. Из 31 анализированного штамма ДНК четырех и восьми давали продукт амплификации в ПЦР с праймерами, специфичными для видов M. majus и M. nivale, соответственно.
Филогенетический анализ полученных последовательностей LSU участков ДНК был использован для определения родственных связей между штаммами Microdochium (рис. 1). В ML анализ была включена 51 последовательность, состоящая из 804 пар нуклеотидов (п.н.), среди которых 748 были консервативные, а 56 – вариабельные. Последовательность типового штамма CBS 285.71 M. phragmitis Syd. et P. Syd. была выбрана в качестве внешней группы. Семнадцать штаммов Microdochium формировали отдельную кладу, в которую также вошли 4 референтных штамма M. seminicola, в т.ч. типовой штамм CBS 139951, степень сходства с LSU последовательностью которого составляла 99.88–100%. Проанализированные участки ДНК четырех штаммов Microdochium оказались идентичны и имели 100%-е сходство с референтным штаммом M. majus CBS 741.79. Восемь штаммов Microdochium кластеризовались совместно с типовым штаммом M. nivale CBS 166205 и также их последовательности участка LSU были идентичны. Десять штаммов Microdochium формировали общую кладу с референтными штаммами M. bolleyi, причем один из них (MFG 60513) имел 100%-е сходство с последовательностью штамма CBS 540.92, тогда как девять других по проанализированному участку ДНК были идентичны штамму M. bolleyi CPC 25994.
Рис. 1.
Дендрограмма филогенетического сходства видов рода Microdochium, построенная на основе нуклеотидных последовательностей LSU фрагмента генома методом максимального правдоподобия. В узлах приведены значения бутстреп-поддержки >70%.
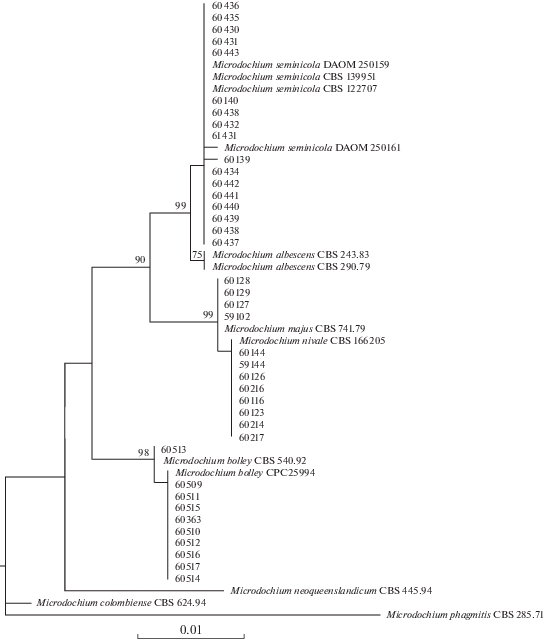
Таким образом, с помощью ПЦР с видоспецифичными праймерами и анализа нуклеотидных последовательностей участка LSU рДНК установлена принадлежность четырех штаммов к виду M. majus, а восьми – к виду M. nivale.
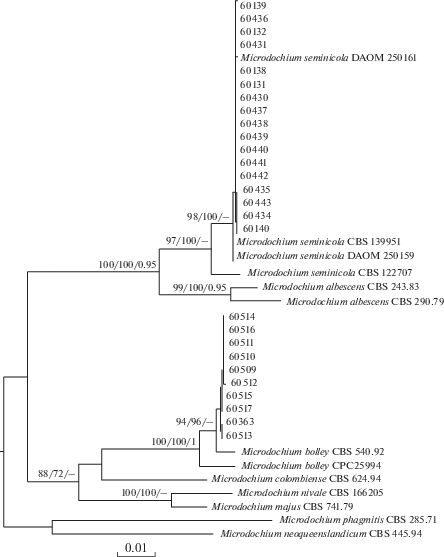
Выравнивание комбинированных последовательностей, включающих четыре участка ДНК, было проанализировано для подтверждения принадлежности 10 и 17 штаммов к видам M. bolleyi и M. seminicola, соответственно (рис. 2). В анализ были включены 40 последовательностей, состоящие из 2805 п.н. (804 п.н. LSU участка, 507 – ITS, 669 – BTUB, 824 – RPB2), среди которых 2226 были консервативные, а 579 – вариабельные. С высокой бутстреп-поддержкой ML/MP/ВP 100/100/1 десять штаммов формировали кладу с референтными штаммами M. bolleyi, что подтверждает их принадлежность к этому виду. Семнадцать штаммов кластеризовались совместно с референтными штаммами M. seminicola с бутстреп-поддержкой 98/100/–, что также позволяет точно установить их видовую принадлежность. Топология филогенетических деревьев, построенных разными методами, оказалась сходной и отражала филогенетические связи между видами, установленные ранее (Hernández-Restrepo et al., 2016).
Рис. 2.
Дендрограмма филогенетического сходства видов рода Microdochium, построенная на основе комбинированных нуклеотидных последовательностей LSU, ITS, BTUB и RPB2 фрагментов генома методом максимального правдоподобия. В узлах приведены значения бутстреп-поддержки (>70%) при анализе методами максимального правдоподобия и максимальной экономии, а также значения Байесовской апостериорной вероятности (>0.95).
Фенотипическая характеристика штаммов. Окраска культур штаммов M. bolleyi в первые сутки роста была кремово-лососевая, с возрастом темнеющая (рис. 3). Воздушный мицелий скудный, клочковатый. Многие штаммы с самого начала роста приобретали темно-коричневую, близкую к черному окраску, поверхность культуры была гладкая или морщинистая, влажная. Большинство штаммов быстро (на 3–5-е сутки) образовывали оранжевую, кирпично-коричневую слизистую массу конидий в пионнотах, слой которых покрывал большую часть поверхности культуры. Не выявлено влияние продолжительности и интенсивности освещения на образование меланиновых пигментов. С возрастом агаризованная питательная среда, на которой культивировали штаммы, окрашивалась в темные оттенки. Однако встречались штаммы (MFG 60514, MFG 60510, MFG 60517), культуры которых в течение длительного промежутка времени оставались оранжево-желтоватыми с редким клочковатым мицелием.
Рис. 3.
Культуры грибов Microdochium на КСА. M. bolleyi: а – MFG 60516, б – MFG 60363, в – MFG 60509, г – MFG 60514, д – MFG 60510, е – MFG 60517 (а–б, г–е – 10 суток при 25°С; в – 10 суток при 25°С и 20 суток при 4°С). Другие виды рода: ж – M. majus (MFG 60127); з – M. nivale (MFG 60126); и – M. seminicola (MFG 60140). Спороношение грибов Microdochium: конидиальное (к – MFG 60128, л – MFG 60216) (4 недели) и сумчатое (м – MFG 60127) (10 недель).
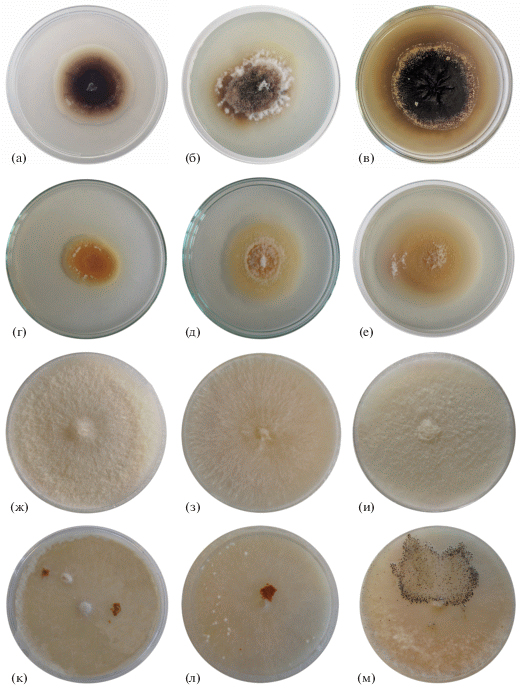
Культуры грибов M. majus, M. nivale и M. seminicola оказались высоко сходны по макроморфологическим признакам, и визуально отнести штаммы к одному из трех видов не представлялось возможным (табл. 2). В темноте и на свету эти грибы образовывали необильный воздушный мицелий различных оттенков кремового цвета. Реверс колоний обычно был светло-кремовых оттенков. Культивирование при постоянном освещении изменяло пигментацию культур грибов M. majus, M. nivale и M. seminicola от кремовых оттенков до более интенсивных оранжевых.
Таблица 2.
Сравнительные фенотипические характеристики грибов Microdochium (КСА, 25°С)
| Признак | M. majus | M. nivale | M. seminicola | M. bolleyi | |
|---|---|---|---|---|---|
| Воздушный мицелий | обильный, кремового цвета | редкий, клочковатый, неокрашенный | |||
| Пигментация колоний | светло-кремовая | темно-коричневая, редко оранжево-желтая | |||
| Спороношение | есть спородохии | отсутствует | обильное в пионнотах | ||
| Конидии | Форма | серповидная | – | серповидная | |
| Число перегородок | 1–3 | – | 0 | ||
| Размеры, в среднем | 22.9 × 3.5 | 19.6 × 5.0 | – | 6.1 × 2.4 | |
| Конидиогенные клетки | цилиндрические | – | – | ||
| Хламидоспоры | Наличие | типичных нет, меланизированные клетки гифы | обильные | ||
| Размеры, в среднем | – | 8.3 × 7.0 | |||
| Ловчие кольца | Наличие | – | обильные | – | |
| размеры в среднем | 22.8 × 24.7 | ||||
Конидии M. bolleyi быстро развивались непосредственно на гифах, на малозаметных латеральных конидиогенных клетках или на густо ветвящихся конидиеносцах (рис. 4). Конидиогенные клетки – цилиндрические, субцилиндрические и шаровидные, аннелидные, но из-за малых размеров, с плохо просматриваемыми рубчиками. Конидии серповидной формы, дорсивентрально изогнутые, с закругленными краями, одноклеточные, редко с одной перегородкой. Размеры макроконидий варьировали (4.7–8.3 × 1.6–3.0 мкм). Хламидоспоры у M. bolleyi образовывались быстро и обильно в виде цепочек или кластеров, темно-коричневые, черные, интеркалярные, в гифах. Размеры хламидоспор составляли 4.8–10.7 × 5.7–8.7 мкм.
Рис. 4.
Типичные микроструктуры грибов Microdochium. M. bolleyi: а – конидии; б – хламидоспоры; в, г– конидиеносцы. M. majus: д – конидии; е – конидиеносцы. M. nivale: ж – конидии; з – конидиеносцы. Стрелками показаны аннелиды. Масштаб – 20 мкм.
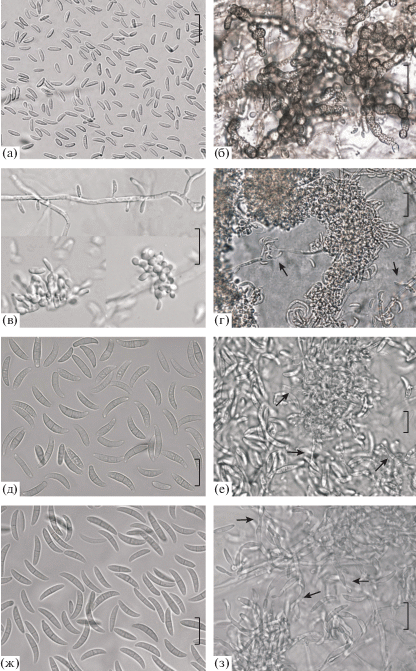
Штаммы грибов M. majus и M. nivale на КСА образовывали конидиальное спороношение, однако это часто требовало длительного периода культивирования. В воздушном мицелии с возрастом в культурах можно было наблюдать образование неоформленных единичных конидий. Типичные макроконидии образовывались на конидиеносцах, в сформированных спородохиях оранжево-кирпичного цвета. Освещение и перепады температуры культивирования от 2 до 4°С стимулировали образование типичного спороношения. Конидиогенные клетки возникали на гифах латерально, затем формируя густо ветвящиеся конидиеносцы, заканчивающиеся субцилиндрическими или цилиндрическими аннелидными клетками.
Макроконидии M. majus и M. nivale на КСА, в основном, были одноклеточные или имели три перегородки (редко 0–5 перегородок), серповидной формы, прямые или слегка искривленные, с закругленными или усеченными концевыми клетками. Максимальные размеры макроконидий у обоих видов достигали 32.6–34.5 × 4.5–5.7 мкм. У штаммов M. majus было отмечено образование немногочисленных грушевидных конидий с 1–2 перегородками, имеющих размеры 8.5–14.2 × × 5.3–6.3 мкм.
Штаммы M. seminicola не спороносили при всех предложенных условиях, образуя только стерильный мицелий, часто с ловчими кольцами. Типичных хламидоспор в культурах грибов не выявлено, но иногда в клетках гиф образовывался меланиновый пигмент, что приводит к формированию на реверсе культуры неотчетливого темно-коричневого рисунка.
Характеристика скорости роста штаммов на агаризованных средах. Средняя скорость роста штаммов M. majus и M. nivale на КСА была одинаковой и составляла 1.25 ± 0.06 и 1.35 ± 0.07 см/сутки, соответственно. Штаммы M. seminicola оказались относительно медленно растущими со средней скоростью роста 1.14 ± 0.07 см/сутки. Обычно в течение недели колонии всех штаммов M. majus и M. nivale достигали краев чашки Петри, для колоний штаммов M. seminicola в среднем для этого требовалось 10 суток. Совершенно другая ситуация наблюдалась со штаммами M. bolleyi, скорость роста которых в среднем составила 0.4 ± 0.04 см/сутки. На 7-е сутки культивирования на КСА диаметр колоний составлял 3.4–4.8 см. К 10–14 суткам он достигал 4.5 ± 0.7 см и в дальнейшем не увеличивался.
Попытка культивирования штаммов на агаре Чапека показала, что данная среда не походит для роста всех анализированных грибов Microdochium. На этой минеральной среде штаммы M. majus, M. nivale и M. seminicola образовывали поверхностный, почти бесцветный мицелий, распространяющийся от места инокуляции на 1.3–2.0 см, тогда как штаммы M. bolleyi почти не росли или в редких случаях формировали компактные клочковатые колонии диаметром не более 1 см.
Накопление биомассы штаммами при глубинном культивировании. В жидкой КСС происходил активный рост грибов. Выход сухой биомассы штаммов M. majus и M. nivale через 7 суток культивирования составил 811 ± 54 мг и 700 ± 160 мг соответственно, без достоверных различий между этими двумя видами. Величина биомассы штаммов M. seminicola была ниже, в среднем составляла 467 ± 45 мг и достоверно отличалась от показателей, выявленных для M. majus и M. nivale. Штаммы M. bolleyi демонстрировали самый активный рост на КСС и образовывали в среднем 1048 ± 36 мг сухой биомассы, что оказалось достоверно больше, чем у других видов грибов.
При выращивании в жидкой среде Чапека, даже обогащенной 1%-м аспарагином, штаммы всех четырех видов грибов Microdochium не были способны к активному росту. В среднем, выход сухой биомассы варьировал в пределах 29.5–37.7 мг, что соответствовало массе дисков агаризованной среды, использованных для инокуляции.
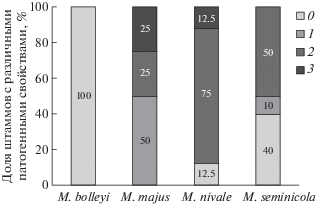
Патогенность штаммов грибов Microdochium. Инокуляция отрезков листьев пшеницы штаммами M. bolleyi практически не приводила к их поражению – отмечалась лишь небольшая некротизация растительной ткани вокруг места укола, а размеры симптомов были меньше инокуляционнных дисков – в среднем 2.2 ± 0.6 мм (диапазон значений составлял 0−4.8 мм), что достоверно отличало M. bolleyi от других видов Microdochium. Таким образом, анализируемые штаммы M. bolleyi были охарактеризованы как непатогенные.
В то же время, все изученные штаммы M. majus, большинство штаммов M. nivale и M. seminicola оказались патогенными и индуцировали симптомы поражения отрезков листьев пшеницы. Средние значения размеров поражений листьев, вызываемых штаммами M. majus, составили 15.3 ± 4.2 мм с диапазоном варьирования от 8.3 мм до 26.6 мм и не имели существенных отличий от показателей, выявленных для штаммов M. nivale. Размер симптомов, индуцируемых штаммами M. nivale, варьировал в диапазоне 1.7‒23.3 мм и в среднем составлял 15.3 ± 2.3 мм. Штаммы M. seminicola вызывали более слабое поражение листьев (0−15.6 мм), а размер симптомов – в среднем 8.5 ± 1.9 мм достоверно отличался от размеров поражений, вызываемых штаммами M. majus и M. nivale.
Высокоагрессивные штаммы были выявлены только у видов M. majus и M. nivale, причем их доля у M. majus была выше (рис. 5). Наибольшие симптомы поражения листьев пшеницы были вызваны штаммом M. majus MFG 60127, который был выделен из зерна пшеницы, выращенной в Воронежской области, а также штаммом M. nivale MFG 60217, выделенным из растений пшеницы с симптомами “снежной плесени” из Белгородской обл. Непатогенный штамм M. nivale MFG 60144 был выделен из зерна пшеницы, выращенной в Алтайском крае, и являлся в эксперименте единственным штаммом этого вида, имеющем происхождение из азиатской части России. Оценка патогенных свойств штаммов M. seminicola выявила их вариабельность. Половину проанализированных штаммов M. seminicola составили непатогенные или слабоагрессивные. Штамм M. seminicola MFG 60434, который не вызывал никаких симптомов повреждения листьев пшеницы, был выделен из зерна овса, выращенного в Свердловской обл. Наибольшие симптомы поражения листьев пшеницы, вызывал штамм M. seminicola MFG 60139, выделенный из зерна пшеницы из Тюменской обл. – 15.6 мм.
ОБСУЖДЕНИЕ
Ежегодно проводимый нами мониторинг зараженности грибами образцов зерна из различных регионов России показал повсеместную встречаемость грибов рода Microdochium на зерне пшеницы, овса и ячменя. Максимальная зараженность этими грибами (15%) была выявлена в 2016 г. в урожае зерна озимой пшеницы сорта Юка из Краснодарского края (Gagkaeva et al., 2018). Показано нарастание заболеваний, связанных с грибами Microdochium в Краснодарском и Ставропольском краях, таких как “снежная плесень”, парша колоса, пятнистость флагового листа (Ablova, 2008; Gorkovenko et al., 2009; Gagkaeva et al., 2017, 2018). Коллекция чистых культур лаборатории микологии и фитопатологии ВИЗР в течение 18 лет пополнялась штаммами Microdochium spp. различного происхождения, и выбор объектов для исследования был произведен случайным образом из штаммов, предварительно отнесенных к грибам Microdochium на основе морфологических признаков.
Анализ нуклеотидной последовательности LSU всех включенных в исследование штаммов показал, что 10.2% из них относятся к виду M. majus, а 20.5% – к M. nivale. Остальные штаммы Microdochium, на основе филогенетического анализа комбинированной нуклеотидной последовательности четырех участков генома (LSU, ITS, BTUB и RPB2), были идентифицированы как M. bolleyi и M. seminicola – 25.6 и 43.6%, соответственно. Выбранные участки генома ранее были рекомендованы для точной дифференциации видов Microdochium (Hernández-Restrepo et al., 2016; Marin-Felix et al., 2019). Высокая информативность последовательностей RPB2 и BTUB для выявления филогенетических отношений между видами Microdochium также отмечалась другими исследователями (Abdelhalim et al., 2020).
Наиболее очевидные морфологические различия, которые могли бы позволить разделить виды Microdochium, основаны на размерах конидий и количестве перегородок в них. Тем не менее, часто точность традиционной морфологической идентификации штаммов M. majus, M. nivale и M. seminicola невысока (Litschko, Burpee 1987; Lees et al. 1995; Glynn et al., 2005; Nielsen et al., 2013; Gagkaeva et al., 2020). Кроме того, многие штаммы M. majus и M. nivale также могут требовать длительного культивирования для формирования спороношения, а у большинства штаммов M. seminicola образование конидий как диагностического признака ненадежно и трудно поддается наблюдению. В исследовании, посвященном таксономии рода Microdochium, было отмечено, что штаммы M. seminicola продуцировали спородохии, но формирование спороношения прекращалось после одного или двух пассажей, когда быстрорастущие колонии оставались стерильными (Hernández-Restrepo et al., 2016). Исследованные нами штаммы M. seminicola из Западной Сибири были стерильными уже при их выделении из зерна. Таким образом, фенотипический анализ штаммов грибов Microdochium не позволяет окончательно определить их видовую принадлежность.
Установлено, что некоторые штаммы M. majus, M. nivale и M. seminicola способны в лабораторных условиях образовывать половую стадию (Hernández-Restrepo et al., 2016; Gagkaeva et al., 2020). Перитеции грибов были обнаружены на обертках стеблей пшеницы в поле (Gorkovenko et al., 2009). Ранее было показано, что M. majus и M. nivale образуют зрелые перитеции in vitro, однако у M. majus это происходит чаще, чем у M. nivale (Litschko, Burpee, 1987; Lees et al., 1995; Parry et al., 1995; Hayashi, 2016). Научная информация о половой стадии гриба M. bolleyi нами не найдена. Показано образование этим грибом микросклероциев в корнях томатов и мятлика [Poa alpigena (Blytt.) Lindm.] (Väre et al., 1992; Rasmann et al., 2009). Характерные, отдельно сформированные склероции в культурах M. bolleyi нами не выявлены, вероятно из-за плотного сплетения гиф гриба на поверхности колоний, состоящих из спрессованных темноокрашенных хламидоспор.
Среди изученных штаммов Microdochium, все выделенные из растений с признаками “снежной плесени” относились только к виду M. nivale, что согласуется с полученными ранее данными о том, что симптомы данного заболевания злаков вызывает преимущественно этот вид (Hofgaard et al., 2006). Среди грибов рода Microdochium вид M. nivale преобладал в Северо-Западном и Центральном ФО России, тогда как в Уральском и Сибирском ФО превалировал M. seminicola (Gagkaeva et al., 2020). Ранее этот гриб был найден в зерне пшеницы и кукурузы в Швейцарии и Канаде (Hernández-Restrepo et al., 2016), а также в зерне пшеницы на территории Красноярского края, Новосибирской и Тюменской областей России (Gagkaeva et al., 2020). Первые находки M. seminicola в зерне пшеницы, овса и ячменя из Алтайского края, Кемеровской и Свердловской областей подтверждают его широкое распространение на Урале и в Западной Сибири. До настоящего времени, ни один штамм вида M. seminicola не выявлен на европейской территории России. В то же время, нами идентифицированы только единичные штаммы M. majus и M. nivale в зерне пшеницы, выращенной в Алтайском крае.
Ранее грибы Microdochium также выявляли в составе семенной инфекции зерновых культур, выращенных в Сибири, или как возбудителей “снежной плесени”, однако их идентифицировали как Fusarium nivale по принятой в те времена систематике (Trofimova, Bome, 2001; Ivaschenko, Shipilova, 2004; Levitin, 2004). К сожалению, в настоящее время невозможно найти штаммы тех лет, чтобы определить точную видовую принадлежность и оценить встречаемость видов Microdochium в территориальном и временном аспектах.
Включенные в данное исследование штаммы, идентифицированные как Microdochium bolleyi, были выделены из зерна пшеницы, овса и ячменя, выращенных в Северо-Западном и Приволжском ФО, а также в Приморском крае. Кроме того, в нашей коллекции хранятся штаммы M. bolleyi, выделенные из зерна и корней различных зерновых культур широкого географического происхождения. По нашим наблюдениям, M. bolleyi широко распространен, однако анализ научной литературы не выявил упоминаний этого вида на территории России. Хотя, в отличие от M. seminicola, идентификация этого вида не представляет трудностей из-за быстрого образования штаммами M. bolleyi типичного спороношения.
Синонимика вида M. bolleyi, описанного в 1977 г., включает три эпитета: Idriella bolleyi (R. Sprague) Arx, 1981, Aureobasidium bolleyi (R. Sprague) Arx, 1957, Gloeosporium bolleyi R. Sprague, 1948. Однако, несмотря на значительные морфологические отличия Microdochium bolleyi от видов M. majus и M. nivale, молекулярные исследования (Hernández-Restrepo et al. al., 2016), в том числе и наши, подтверждают его более близкое филогенетическое родство с этими видами, чем с типовым видом рода Microdochium – M. phragmitis. Интересно, что длина генома M. bolleyi заметно больше, чем M. nivale и M. majus. В 2013 г. в результате полного секвенирования генома одного североамериканского штамма (Mb07020) было показано, что геном M. bolleyi составил 38.2 Мб, в то время как геномы штаммов M. nivale и M. majus оценивались в 36.7–37.1 Мб и 35.9 Мб, соответственно (Jewel, 2013). В 2006 г. стал доступен геном другого штамма M. bolleyi (J235TASD1), выделенного из поверхностно стерилизованных корней злака Ammophila breviligulata Fern (David et al., 2016), длина которого была еще больше и составила 40.1 Mб при 4.0% повторяющихся последовательностей.
В нашем исследовании продемонстрирована неспособность грибов Microdochium к росту на синтетической питательной среде Чапека, что предполагает ауксотрофную природу данных штаммов, утративших способность к синтезу факторов роста (витамины, аминокислоты и пр.) и, следовательно, к росту на минимальной среде. Показано, что штаммы Microdochium bolleyi (син. Idriella bolleyi) хорошо росли при глубинном культивировании на минеральной среде с добавлением глюкозы и тиамина (Lascaris, Deacon, 1994). В другой работе успешное культивирование штамма этого вида осуществляли в жидкой синтетической среде с добавлением 100 мкг/л триптофана (Rothen et al., 2018). По всей видимости, среды КСА и КСС, приготовленные из свежего отвара картофеля, содержат все необходимые факторы роста, поэтому в наших экспериментах рост грибов при культивировании на этих средах был выше в 15–28 раз, по сравнению со средой Чапека. Сходные с нашими результатами оценки скорости роста гриба Microdochium bolleyi на КСА были получены при культивировании штаммов на другой богатой питательной среде – 2%-м сусло-агаре при 20°C, которая составила 0.42–0.48 мм/сутки (Ernst et al., 2011).
Кроме общенаучного, данное наблюдение имеет важное практическое значение, поскольку при микологическом анализе растительного материала на среде Чапека без добавления факторов роста ауксотрофные организмы не учитываются. При выделении на КСА культуры грибов M. majus, M. nivale и M. seminicola, растущие из инфицированной ткани, образуют заметные кремовые колонии, с ровным бархатистым воздушным мицелием. Культуры гриба M. bolleyi, как правило, формируют на КСА отчетливые черные, иногда морщинистые колонии, с кирпичной слизистой массой конидий в центре. Однако некоторые моноспоровые штаммы гриба остаются оранжево-желтыми, не образующими пигменты темных оттенков. Ранее в научной литературе уже было отмечено два типа культур для вида M. bolleyi – светлые и темноокрашенные (De Hoog, Hermanides-Nijhof, 1977). По всей видимости, у штаммов, формирующих светлоокрашенные колонии, наблюдаются нарушения в тирозиновом пути биосинтеза темно-окрашенных меланинов, поскольку добавление в питательную среду некоторых аминокислот, вовлеченных в синтез меланинов, приводила к потемнению окраски культур (Cooper, Gadd, 1984).
Интересно, что в наших экспериментах рост штаммов M. bolleyi на агаризованной и жидкой средах на основе картофельного отвара различались принципиально. На КСА рост штаммов M. bolleyi был лимитирован и оказался достоверно ниже, по сравнению с ростом штаммов других трех видов, тогда как при глубинном культивировании в КСС накопление биомассы штаммами M. bolleyi было достоверно выше, чем у штаммов M. majus, M. nivale и M. seminicola. Предположительно данный факт объясняется различиями в активности воды в жидкой и агаризованной среде, поскольку существенное влияние данного фактора на рост M. bolleyi было продемонстрировано ранее (Douglas, Deacon, 1994). Также необходимо учитывать, что в условиях агаризованной среды происходят биохимические процессы, усиливающие образование изокумаринов, подавляющих рост мицелия гриба (Zhang et al., 2008).
Сохраняясь в зерне, грибы Microdochium не приводят к снижению жизнеспособности проростков. Они, как и другие эндофитные грибы, обычно обитают в растении бессимптомно, а патогенные свойства проявляют в определенных условиях среды, вызывающих стресс растений (Nagabhyru et al., 2013). Как правило, M. majus и M. nivale вызывают симптомы повреждений растений в случае их ослабления абиотическими факторами, особенно в ранневесенний период.
В наших экспериментах высоко агрессивные штаммы были выявлены только среди M. majus и M. nivale. Штаммы M. seminicola в среднем проявляли более слабые патогенные свойства в отношении отрезков листьев пшеницы. Выявлены внутривидовые различия между штаммами одного и того же вида Microdochium. Значительная вариабельность патогенных свойств штаммов M. majus и M. nivale при инокуляции зерновых культур отмечалась ранее (Hofgaard et al., 2006; Ren et al., 2015; Gavrilova et al., 2020). Причем штаммы M. nivale из злаковых трав демонстрировали более высокую агрессивность по сравнению со штаммами, выделенными из зерновых культур (Abdelhalim et al., 2020). В другом исследовании установлено, что штаммы M. seminicola, выделенные из зерна овса, были менее агрессивными в отношении листьев пшеницы по сравнению со штаммами, выделенными из зерна пшеницы (Gavrilova et al., 2020). Выявленные факты могут указывать на существование специализации видов Microdochium по отношению к субстрату, которую следует учитывать при изучении этой группы грибов. Более того, приуроченность штаммов одного вида M. majus или M. nivale к своему растению-хозяину закрепляется генетически, поскольку при филогенетическом анализе последовательностей нескольких участков генома, штаммы разного субстратного происхождения кластеризуются отдельно (Jewell, Hsiang, 2013; Abdelhalim et al., 2020).
Все изученные штаммы M. bolleyi оказались непатогенными и не индуцировали значимых поражений отрезков листьев, развивались только небольшие некрозы вокруг места укола, что достоверно отличало M. bolleyi от других видов Microdochium. Показано, что гриб M. bolleyi обитает в корнях злаковых и других растений, в стеблях, листьях и семенах как эндофит или сапротроф (Murray, Gadd, 1981; Hannukkala, Koponen, 1988; Dawson, Bateman 2001; Ernst et al., 2011; Vujanovic et al., 2012; Paulovska et al., 2017). Отмечено, что он чаще встречается на растительных остатках, оставленных на поверхности почвы при ее нулевой обработке, чем при вспашке (Fernandez et al., 2007; Sharma-Poudyal et al., 2017). Большинство исследователей едины во мнении, что M. bolleyi колонизирует корни растений как эндофит, не вызывая симптомов поражения (Jumpponen, Trappe, 1998; Ernst et al., 2011; Navarro Borrell et al., 2016; Rotnen et al., 2018). Также он выделяется из внешне здоровых корней ячменя, овса, пастбищных трав, а частота его выявления в более старых растениях выше (Murray, Gadd, 1981). Однако, на полевице ползучей (Agrostis stolonifera L.), растущей на полях для гольфа, были обнаружены симптомы заболевания, вызванного M. bolleyi (Hong et al., 2008) − у растений поражались в основном нижние листья, которые становились желтыми, затем красновато-коричневыми, без четкой границы между здоровой и больной тканью, однако через несколько недель растения отрастали, и признаки заболевания исчезали. Кроме культурных злаковых растений, M. bolleyi был выявлен как эндофит в корнях томатов (Rasmann et al., 2009), тростнике [Phragmites australis (Cav.) Trin. ex Steud.] (Ernst et al., 2011) и фагонии (Fagonia cretica L.) (Zhang et al., 2008).
Существует достаточно много сообщений об антагонистической активности Microdochium bolleyi в отношении других представителей микобиоты. Этот гриб рассматривается как агент биологического контроля корневых гнилей растений, вызываемых другими патогенными грибами (Allan et al., 1992; Lascaris, Deacon, 1994; Sieber, Grünig, 2013). Продемонстрирован сильный антагонизм М. bolleyi против возбудителя глазковой пятнистости стеблей Oculimacula yallundae (Wallwork et Spooner) Crous et W. Gams (Hinton, Parry, 1993) и офиоболезной корневой гнили Gaeumannomyces graminis (Sacc.) Arx et D.L. Olivier (= Ophiobolus graminis Sacc.) (Kirk, Deakon, 1987). В том числе, обработка семян штаммами Microdochium bolleyi индуцировала системную устойчивость ячменя к Bipolaris sorokiniana Shoemaker (Liljeroth, Bryngelsson, 2002). Предполагается, что снижение содержания ДНК токсинопродуцирующих видов Fusarium verticillioides (Sacc.) Nirenberg, F. proliferatum Nirenberg ex Gerlach et Nirenberg и F. graminearum Schwabe в стеблях кукурузы связано с присутствием антагонистов, среди которых выделяли Microdochium bolleyi (Köhl et al., 2015). Показано, что гриб продуцирует три производных изокумарина, обладающих фунгицидной активностью (Zhang et al., 2008), а также при культивировании на жидкой питательной среде штамм М. bolleyi образовывал индол – соединение, которое может иметь значение для установления симбиоза с растением, стимулировать рост растения и придавать ему стрессоустойчивость (Rothen et al., 2018).
ЗАКЛЮЧЕНИЕ
Впервые проведена ревизия видового состава грибов рода Microdochium, ассоциированных с зерновыми культурами на территории России. Фенотипическая и генотипическая характеристика штаммов привела к идентификации четырех видов Microdochium. Выявлены различные стратегии существования у разных видов Microdochium (конидии, стерильный мицелий, аскоспоры, хламидоспоры, склероции), которые позволяют грибам успешно существовать и взаимодействовать со злаковыми растениями. Полученные новые знания о видовом составе и биоэкологических особенностях грибов рода Microdochium, будут способствовать дальнейшим исследованиям грибного разнообразия в различных экосистемах.
Исследование выполнено при поддержке Российского научного фонда (проект № 19-76-30005).
Список литературы
Ablova I.B. The principles and the methods for breeding of disease-resistant wheat varieties (by the example of spike fusariosis), and their role in the formation of agroecosystems. Dr. Sci. Thesis. Krasnodar, 2008 (in Russ.).
Abdelhalim M., Brurberg M.B., Hofgaard I.S. et al. Pathogenicity, host specificity and genetic diversity in Norwegian isolates of Microdochium nivale and Microdochium majusю. Eur. J. Plant. Pathol. 2020. V. 156. P. 885–895. https://doi.org/10.1007/s10658-020-01939-5
Allan R.H., Thorpe C.J., Deacon J.W. Differential tropism to living and dead cereal root hairs by the biocontrol fungus Idriella bolleyi. Physiol. Mol. Plant Pathol. 1992. V. 41. P. 217–226. https://doi.org/10.1016/0885-5765(92)90012-K
Cooper L.A., Gadd G.M. Differentiation and melanin production in hyaline and pigmented strains of Microdochium bolleyi. Antonie van Leeuwenhoek. 1984. V. 50. P. 53–62. https://doi.org/10.1007/BF00404907
Crous P.W., Schoch C.L., Hyde K.D. et al. Phylogenetic lineages in the Capnodiales. Stud. Mycol. 2009. V. 64. P. 17–47. https://doi.org/10.3114/sim.2009.64.02
Crous P.W., Braun U., Hunte G.C. et al. Phylogenetic lineages in Pseudocercospora. Stud. Mycol. 2013. V. 75. P. 37–114. https://doi.org/10.3114/sim0005
Crous P.W., Schumacher R.K., Wingfield M.J. et al. New and interesting fungi. FUSE. 2018. V. 1. P. 169–215. https://doi.org/10.3114/fuse.2018.01.08
David A.S., Haridas S., LaButti K. et al. Draft genome sequence of Microdochium bolleyi, a dark septate fungal endophyte of beach grass. Genome Announc. 2016. V. 4 (2). e00270-16. https://doi.org/10.1128/genomeA.00270-16
Dawson W.A.J.M., Bateman G.L. Fungal communities on roots of wheat and barley and effects of seed treatments containing fluquinconazole applied to control take-all. Plant Pathol. 2001. V. 50. P. 75–82. https://doi.org/10.1046/j.1365-3059.2001.00538.x
De Hoog G.S., Hermanides-Nijhof E.J. Survey of the black yeasts and allied fungi. Stud. Mycol. 1977. V. 15. P. 178–222.
Doohan F.M., Parry D.W., Jenkinson P. The use of species-specific PCR-based assays to analyse Fusarium ear blight of wheat. Plant Pathol. 1998. V. 47. P. 197–205. https://doi.org/10.1046/j.1365-3059.1998.00218.x
Douglas L.I., Deacon J.W. Strain variation in tolerance of water stress by Idriella (Microdochium) bolleyi, a biocontrol agent of cereal root and stem base pathogens. Biocontrol Scie. Technol. 1994. V. 4 (2). P. 239–249. https://doi.org/10.1080/09583159409355332
Ernst M., Neubert K., Mendgen K.W. et al. Niche differentiation of two sympatric species of Microdochium colonizing the roots of common reed. BMC Microbiol. 2011. V. 11. 242. https://doi.org/10.1186/1471-2180-11-242
Fernandez M.R., Basnyat P., Zentner R.P. Response of common root rot in wheat to crop management in eastern Saskatchewan. Can. J. Plant Sci. 2007. V. 87. P. 953–963.
Gagkaeva T.Y., Gavrilova O.P., Orina A.S. Good news – Microdochium sp. of fungi do not produce mycotoxins! Zashchita i karantin rasteniy. 2017. N 5. P. 9–12 (in Russ.).
Gagkaeva T.Y., Gavrilova O.P., Orina A.S. et al. Distinctive metabolites of Alternaria, Fusarium and Microdochium fungi as a tool for assessing their relationship in micobiota of wheat grain. Biotekhnologiya i selektsiya rasteniy. 2018. V. 1 (1). P. 7–15. https://doi.org/ (in Russ.).https://doi.org/10.30901/2658-6266-2018-1-7-15
Gagkaeva T.Y., Orina A.S., Gavrilova O.P. et al. Evidence of Microdochium fungi associated with cereal grains in Russia. Microorganisms. 2020. V. 8 (3). P. 340. https://doi.org/10.3390/microorganisms8030340
Gavrilova O.P., Orina A.S., Kessenikh E.D. et al. Diversity of physiological and biochemical characters of the Microdochium fungi. Chem. Biodiv. 2020. V. 17. e2000294. https://doi.org/10.1002/cbdv.202000294
Glynn N.C., Hare M.C., Parry D.W. Phylogenetic analysis of EF-1 alpha gene sequences from isolates of Microdochium nivale leads to elevation of varieties majus and nivale to species status. Mycol. Res. 2005. V. 109. P. 872–880. https://doi.org/10.1017/S0953756205003370
Gorkovenko V.S., Oberyuhtina L.A., Kurkina E.A. The harmfulness of Microdochium nivale fungus in agrocoenosis of winter wheat. Zashchita i karantin rasteniy. 2009. N 1. P. 34–35 (in Russ.).
Hannukkala A., Koponen H. Microdochium bolleyi, a common inhabitant of barley and wheat roots in Finland. Karstenia. 1988. V. 27. P. 31–36. https://doi.org/10.29203/ka.1987.251
Hayashi Y. Studies on ecology and population genetics of Microdochium nivale and M. majus, causal agents of Fusarium head blight on wheat. Huscap, Hokkaido, 2016. https://doi.org/10.14943/doctoral.k12254
Hernandez-Restrepo M., Groenewald J.Z., Crous P.W. Taxonomic and phylogenetic re-evaluation of Microdochium, Monographella and Idriella. Persoonia. 2016. V. 36. P. 57–82. https://doi.org/10.3767/003158516X688676
Hinton M.J., Parry D.W. Screening selected fungi for antagonism towards Pseudocercosporella herpotrichoides (Fron) Deighton, the cause of eyespot disease of cereals. Biocontrol Sci. Technol. 1993. V. 3 (1). P. 13–19. https://doi.org/10.1080/09583159309355254
Hofgaard I.S., Wanner L.A., Hageskal G. et al. Isolates of Microdochium nivale and M. majus differentiated by pathogenicity on perennial ryegrass (Lolium perenne L.) and in vitro growth at low temperature. J. Phytopathol. 2006. V. 154 (5). P. 267–274. https://doi.org/10.1111/j.1439-0434.2006.01092.x
Hong S.K., Kim W.G., Choi H.W., Lee S.Y. Identification of Microdochium bolleyi associated with basal rot of creeping bent grass in Korea. Mycobiol. 2008. V. 36 (2). P. 77–80. https://doi.org/10.4489/MYCO.2008.36.2.077
Ivashchenko V.G., Shipilova N.P. Fusarium fungi on cereal seeds in the main grain regions of Russia (habitats, frequency of occurrence, ratio). VIZR, St. Petersburg, 2004 (in Russ.).
Jewel L.E. Genetic and pathogenic differences between Microdochium nivale and Microdochium majus. Guelph, Ontario, 2013.
Jewell L.E., Hsiang T. Multigene differences between Microdochium nivale and Microdochium majus. Botany. 2013. V. 91. P. 99–106. https://doi.org/10.1139/cjb-2012-0178
Jonavičienė A., Supronienė S., Semaškienė R. Microdochium nivale and M. majus as causative agents of seedling blight in spring cereals. Zemdirbyste-Agriculture. 2016. V. 103. P. 363–368. https://doi.org/10.13080/z-a.2016.103.046
Jumpponen A., Trappe J.M. Dark septate endophytes: a review of facultative biotrophic root-colonizing fungi. New Phytol. 1998. V. 140. P. 295–310. https://doi.org/10.1046/j.1469-8137.1998.00265.x
Kirk J.J., Deacon J.W. Control of the take-all fungus by Microdochium bolleyi, and interactions involving M. bolleyi, Phialophora graminicola and Periconia macrospinosa on cereal roots. Plant Soil. 1987. V. 98. P. 231–237. https://doi.org/10.1007/BF02374826
Köhl J., Lombaers C., Moretti A. et al. Analysis of microbial taxonomical groups present in maize stalks suppressive to colonization by toxigenic Fusarium spp.: a strategy for the identification of potential antagonists. Biol. Control. 2015. V. 83. P. 20–28. https://doi.org/10.1016/j.biocontrol.2014.12.007
Kumar S., Stecher G., Li M. et al. MEGA X: molecular evolutionary genetics analysis across computing platforms. Mol. Biol. Evol. 2018. V. 35 (6). P. 1547–1549. https://doi.org/10.1093/molbev/msy096
Lascaris D., Deacon J.W. In vitro growth and microcycle conidiation of Idriella bolleyi, a biocontrol agent of cereal pathogens. Mycol. Res. 1994. V. 98 (10). P. 1200–1206. https://doi.org/10.1016/S0953-7562(09)80205-0
Lees A.K., Nicholson P., Rezanoor H.N., Parry D.W. Analysis of variation within Microdochium nivale from wheat: evidence for a distinct sub-group. Mycol. Res. 1995. V. 99. P. 103–109. https://doi.org/10.1016/S0953-7562(09)80322-5
Levitin M.M. Toxigenic fungi and mycotoxins in cereals grain and food in Russia. In: An overview on toxigenic fungi and mycotoxins in Europe. Kluwer Academic Publishers, N.Y. etc. 2004. P. 195–199.
Liljeroth E., Bryngelsson T. Seed treatment of barley with Idriella bolleyi causes systemically enhanced defense against root and leaf infection by Bipolaris sorokiniana. Biocontrol Sci. Technol. 2002. V. 12 (2). P. 235–249. https://doi.org/10.1080/09583150120124496
Litschko L., Burpee L.L. Variation among isolates of Microdochium nivale collected from wheat and turfgrasses. Trans. Brit. Mycol. Soc. 1987. V. 89. P. 252–256. https://doi.org/10.1016/S0007-1536(87)80163-8
Liu Y.J., Wehlen S., Hall B.D. Phylogenetic relationships among ascomycetes: evidence from an RNA polymerase II subunit. Mol. Biol. Evol. 1999. V. 16. P. 1799–1808. https://doi.org/10.1093/oxfordjournals.molbev.a026092
Lord E., Leclercq M., Boc A. et al. Armadillo 1.1: An original workflow platform for designing and conducting phylogenetic analysis and simulations. Plos One. 2012. V. 7. e29903. https://doi.org/10.1371/journal.pone.002990
Marin-Felix Y., Hernández-Restrepo M., Wingfield M.J. et al. Genera of phytopathogenic fungi: GOPHY 2. Stud. Mycol. 2019. V. 92. P. 47–133. pmid:29997401. https://doi.org/10.1016/j.simyco.2018.04.002
Mikhailova L.A., Afanasenko O.S. Use of detached leaves for investigation of cereals resistance to diseases. Mikologiya i fitopatologiya. 2005. V. 39 (6). P. 100–106 (in Russ.).
Murray D.I.L., Gadd G.M. Preliminary studies on Microdochium bolleyi with special reference to colonization of barley. Trans. Brit. Myc. Soc. 1981. V. 76 (3). P. 397–403. https://doi.org/10.1016/S0007-1536(81)80065-4
MycoBank. A nomenclatural database. 2020. http://www.mycobank.org/. Accessed 20.03.2020.
Nagabhyru P., Dinkins R.D., Wood C.L. et al. Tall fescue endophyte effects on tolerance to water-deficit stress. BMC Plant Biol. 2013. V. 13. 127. https://doi.org/10.1186/1471-2229-13-127
NCBI GenBank. 2020. https://blast.ncbi.nlm.nih.gov/Blast.cgi. Accessed 20.05.2020.
Nicholson P., Lees A.K., Maurin N. et al. Development of a PCR assay to identify and quantify Microdochium nivale var. nivale and Microdochium nivale var. majus in wheat. Physiol. Mol. Plant Pathol. 1996. V. 48. P. 257–271. https://doi.org/10.1006/pmpp.1996.0022
Nicholson P., Parry D.W. Development and use of a PCR assay to detect Rhizoctonia cerealis, the cause of sharp eyespot in wheat. Plant Pathol. 1996. V. 45. P. 872–883. https://doi.org/10.1111/j.1365-3059.1996.tb02898.x
Nielsen L.K., Justensen A.F., Jensen J.D. et al. Microdochium nivale and Microdochium majus in seed samples of Danish small grain cereals. Crop Prot. 2013. V. 43. P. 192–200. https://doi.org/10.1016/j.cropro.2012.09.002
Parry D.W., Rezanoor H.N., Pettitt T.R. et al. Analysis of Microdochium nivale isolates from wheat in the UK during 1993. Ann. Appl. Biol. 1995. V. 126. P. 449–455. https://doi.org/10.1111/j.1744-7348.1995.tb05379.x
Paulovska L., Bankina B., Roga A. et al. The incidence of wheat crown rot depending of agronomic practices. Conference: Research for Rural Development – 2017: Annual 23rd International Scientific Conference, 2018, pp. 13–18.https://doi.org/10.22616/rrd.23.2017.043
Rasmann C., Graham J.H., Chellemi D.O. et al. Resilient populations of root fungi occur within five tomato production systems in southeast Florida. Appl. Soil Ecol. 2009. V. 43. P. 22–31. https://doi.org/10.1016/j.apsoil.2009.05.007
Ren R., Yang X., Ray R.V. Comparative aggressiveness of Microdochium nivale and M. majus and evaluation of screening methods for Fusarium seedling blight resistance in wheat cultivars. Eur. J. Plant Pathol. 2015. V. 141. P. 281–294. https://doi.org/10.1007/s10658-014-0541-3
Rothen C., Miranda V., Fracchia S. et al. Microdochium bolleyi (Ascomycota: Xylariales): physiological characterization and structural features of its association with wheat. Boletin de la Sociedad Argentina de Botanica. 2018. V. 53 (2). P. 169–182. https://doi.org/10.31055/1851.2372.v53.n2.20574
Sharma-Poudyal D., Schlatter D., Yin C. et al. Long-term no-till: a major driver of fungal communities in dryland wheat cropping systems. Plos One. 2017. V. 12 (9). e0184611. https://doi.org/10.1371/journal.pone.0184611
Sieber T., Grunig C. Fungal root endophytes. In: Eshel A., Beeckman T. (eds). The Hidden Half, Edition, 4th edn. CRC Press, Taylor et Francis Group, Boca Raton, FL, USA, 2013 P. 38.31–38.49 https://doi.org/10.1201/b14550-45
Trofimova U.B., Bome N.A. The influence of the pathogen caused snow mold (Fusarium nivale Ces.) on the productivity indicators of winter rye plants. Sovremennye naukoyemkie tekhnologii. 2004. (1). P. 71–72 (in Russ.).
Väre H., Vestberg M., Eurola S. Mycorrhiza and root associated fungi in Spitsbergen. Mycorrhiza. 1992. V. 1. P. 93–104. https://doi.org/10.1007/BF00203256
Vilgalys R., Hester M. Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species. J. Bacteriol. 1990. V. 172. P. 4238–4246. https://doi.org/10.1128/jb.172.8.4238-4246.1990
Vujanovic V., Mavragani D., Hamel C. Fungal communities associated with durum wheat production system: a characterization by growth stage, plant organ and preceding crop. Crop Protection. 2012. V. 37. P. 26–34. https://doi.org/10.1016/j.cropro.2012.02.006
White T.J., Bruns T.D., Lee S.B. et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis M.A., Gelfand D.H., Sninsky J.J., White T.J. (eds.). PCR protocols: A guide to methods and applications, Academic Press, N. Y., USA, 1990. P. 315–322. https://doi.org/10.1016/B978-0-12-372180-8.50042-1
Zhang W., Krohn K., Draeger S. et al. Bioactive isocoumarins isolated from the endophytic fungus Microdochium bolleyi. J. Nat. Prod. 2008. V. 71. P. 1078–1081. https://doi.org/10.1021/np800095g
Аблова И.Б. (Ablova) Принципы и методы создания сортов пшеницы, устойчивых к болезням (на примере фузариоза колоса), и их роль в становлении агроэкосистем. Дисс. … докт. с.-х. наук. Краснодар, 2008. 547 с.
Гагкаева Т.Ю., Гаврилова О.П., Орина А.С. (Gagkaeva et al.) Хорошая новость – грибы Микродохиум не продуцируют микотоксины! // Защита и карантин растений. 2017. № 5. С. 9–12.
Гагкаева Т.Ю., Гаврилова О.П., Орина А.С. и др. (Gagkaeva et al.) Маркерные метаболиты грибов Alternaria, Fusarium и Microdochium как инструмент оценки их взаимоотношений в микобиоте зерна пшеницы // Биотехнология и селекция растений. 2018. Т. 1. № 1. С. 7–15. https://doi.org/10.30901/2658-6266-2018-1-7-15
Горьковенко В.С., Оберюхтина Л.А., Куркина Е.А. (Gorkovenko et al.) Вредоносность гриба Microdochium nivale в агроценозе озимой пшеницы // Защита и карантин растений. 2009. № 1. С. 34–35.
Иващенко В.Г., Шипилова Н.П. (Ivaschenko, Shipilova) Грибы рода Fusarium на семенах хлебных злаков в основных зерновых регионах России (ареалы, частота встречаемости, соотношение). 2004. 20 с.
Михайлова Л.А., Афанасенко О.С. (Mikhailova, Afanasenko) Применение отсеченных листьев в исследованиях устойчивости злаков к болезням // Микология и фитопатология. 2005. Т. 39. № 6. С. 100–106.
Трофимова Ю.Б., Боме Н.А. (Trofimova, Bome) Влияние возбудителя снежной плесени (Fusarium nivale Ces.) на показатели продуктивности растений озимой ржи // Современные наукоемкие технологии. 2004. № 1. С. 71–72.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология