Микология и фитопатология, 2021, T. 55, № 1, стр. 51-58
Гибридизация между формами Pyrenophora Teres в природных популяциях России и республики Беларусь
Н. В. Мироненко 1, *, Н. М. Лашина 1, **, О. А. Баранова 1, ***, А. А. Зубкович 2, ****, О. С. Афанасенко 1, *****
1 Всероссийский НИИ защиты растений
196608 Санкт-Петербург, Россия
2 Научно-практический центр НАН РБ по земледелию
222160 Жодино, Республика Беларусь
* E-mail: nina2601mir@mail.ru
** E-mail: nlashina@mail.ru
*** E-mail: baranova_oa@mail.ru
**** E-mail: aa_zoubkovitch@mail.ru
***** E-mail: olga.s.afan@gmail.com
Поступила в редакцию 10.08.2020
После доработки 05.10.2020
Принята к публикации 19.11.2020
Аннотация
Две формы фитопатогенного гриба Pyrenophora teres – P. teres f. teres (net-форма) и P. teres f. maculata (spot-форма) – вызывают различные симптомы болезни: сетчатую, либо округлую пятнистости листьев ячменя. Net-форма P. teres распространена повсеместно в ареале возделывания ячменя, тогда как spot-форма впервые выявлена нами в 2011 г. в Краснодарском крае РФ и в 2016 г. в Брестской обл. Республики Беларусь. Обе формы патогена легко скрещиваются в лабораторных условиях, но в природе гибриды либо не образуются, либо их трудно диагностировать. Тем не менее, вопрос об образовании и сохранении в природных популяциях гибридов между net и spot формами остается актуальным и имеет большое практическое значение, поскольку устойчивость ячменя к этим двум формам P. teres контролируется различными генами. Гибридные формы патогена могут иметь непредсказуемую вирулентность к используемым в селекции донорам устойчивости. Целью данного исследования был поиск гибридных форм между P. teres f. teres и P. teres f. maculata в природных популяциях России и Республики Беларусь с помощью новых формоспецифичных маркеров Ptt и Ptm. Материалом исследования служили 138 моноконидиальных изолятов из четырех популяций P. teres f. maculatа и четырех популяций P. teres f. teres, собранных в 2013–2016 гг. с производственных посевов ячменя в Ленинградской обл. и Краснодарском крае России, а также в Брестской обл. Республики Беларусь. Все изоляты были генотипированы с помощью 10 формоспецифичных маркеров, при этом были выявлены изоляты, сочетающие маркеры обеих форм, которые условно были отнесены к гибридам между двумя формами P. teres. Предлагаются гипотезы, объясняющие существование таких гибридов в природных популяциях. Наиболее вероятной гипотезой, объясняющей обнаружение изолятов P. teres, сочетающих в своем геноме маркеры, специфичные для P. teres f. teres и P. teres f. maculata, является половая, либо соматическая гибридизация между двумя формами гриба при их совместном существовании на посевах ячменя. Не исключается также вероятность существования третьей, возможно, предковой промежуточной формы, сохранившейся в процессе дивергенции вида P. teres.
ВВЕДЕНИЕ
Две формы возбудителя сетчатой пятнистости ячменя Pyrenophora teres – P. teres f. teres Drechs. (net-форма) и P. teres f. maculata Smed.-Pet. (spot-форма) вызывают различные симптомы болезни (сетчатая и округлая пятнистости) и, несмотря на сходство морфологических признаков конидий и аскоспор, существенно различаются по молекулярным маркерам, выявляемым с помощью методов генотипирования RAPD, AFLP и SSR в популяционных исследованиях (Bakonyi, Justesen, 2007; Keiper et al., 2007; Serenius et al., 2007).
Возбудитель сетчатой пятнистости ячменя – P. teres f. teres (net-форма) распространен повсеместно в ареале возделывания ячменя, в том числе и в России. Spot-форма впервые была описана Смедегардом-Петерсеном в 1977 г. (Smedegaard-Petersen, 1977). Позже наличие в популяциях P. teres формы maculata было подтверждено в Западной Eвропе (Arabi et al., 1992; McLean et al., 2009), Канаде (Tekauz, 1990), США (Bokelman et al., 1983). В Австралии эта форма проявления болезни ячменя является преобладающей (McLean et al., 2009). Spot-форма P. teres впервые была обнаружена нами в Краснодарском крае в 2011 г. на сортах ячменя, выращенного из семян, интродуцированных из Западной Европы (Anisimova et al., 2011). Наличие spot-формы возбудителя сетчатой пятнистости в посевах озимого ячменя в Краснодарском крае, было подтверждено нами при экспедиционных поездках в 2012, 2013 и 2016 гг. В Республике Беларусь (Брестская обл., Ивановский р-н) нами была выявлена spot-форма в посевах ярового и озимого ячменя также на интродуцированных из Западной Европы сортах (Mironenko et al., 2016; Afanasenko et al., 2017).
Известно о наличии половой стадии в цикле развития, как P. teres f. teres, так и P. teres f. maculatа. В лабораторных условиях грибы обеих форм могут скрещиваться между собой с образованием аскоспорового потомства (Serenius et al., 2005), хотя при этом отмечается нарушение мейоза и выживаемости гибридных аскоспор (Mironenko, Afanasenko, 2011). Гибридные изоляты не отличаются от родительских изолятов по морфологическим признакам, но имеют рекомбинантные генотипы, что доказывается с помощью молекулярных маркеров. Считается, что в природе скрещивания между P. teres f. teres и P. teres f. maculata, если и происходят, то крайне редко (Akhavan et al., 2015; Lehmensiek et al., 2010). Доказаны единичные случаи гибридной природы полевых изолятов методом кластерного анализа изолятов по признакам RAPD- или AFLP-маркеров. Изоляты, занимающие промежуточное положение между кластерами P. teres f. teres и P. teres f. maculata, и сочетающими в себе признаки, специфичные для каждой формы, считали рекомбинантными и, следовательно, гибридами (Campbell et al., 2002; Leisova et al., 2005; McLean et al., 2014).
Следует иметь в виду, что различные генетические факторы детерминируют устойчивость ячменя к этим двум формам возбудителя сетчатой пятнистости (Manninen et al., 2006). Вследствие этого гибридные формы патогена могут иметь непредсказуемую вирулентность к используемым в селекции донорам устойчивости.
C 2001 г. для молекулярной диагностики изолятов net- и spot-форм в основном использовали набор праймеров, разработанных на основе специфичных маркеров RAPD и дающих в ПЦР один продукт амплификации для каждой формы (Williams et al., 2001). В настоящее время разработаны праймеры на 6 локусов, специфичных для изолятов net- и spot-форм, с помощью которых, как считают авторы, легко идентифицируются гибридные изоляты (Poudel et al., 2017). Специфичные локусы были выбраны в результате анализа полногеномных последовательностей австралийских изолятов гриба обеих форм. Специфичность локусов авторы оценивали на большой выборке изолятов, включая аскоспоровое потомство, полученное в лабораторных условиях при скрещивании изолятов P. teres f. teres и P. teres f. maculata.
Представляет интерес оценить изоляты P. teres из российских и белорусских популяций на наличие/отсутствие у них новых молекулярных маркеров, специфичных для spot- и net-форм гриба с целью определения возможности образования гибридных форм в природе.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор и изоляция гриба. Материалом данного исследования служили моноконидиальные изоляты, выделенные из пятен с соответствующими симптомами, характерными для net- и spot-форм P. teres. Образцы четырех популяций P. teres f. maculatа и четырех популяций P. teres f. teres были собраны нами в 2013–2016 гг. с производственных посевов ячменя в Ленинградской обл. России, а также в Брестской обл. Республики Беларусь (ранее они были охарактеризованы по вирулентности и типам спаривания (Mironenko et al., 2016)), а также из Краснодарского края России (ранее не изучались) (табл. 1).
Таблица 1.
Происхождение и характеристика изолятов Pyrenophora teres
| Район, год сбора пораженных листьев | Сорт | Обозначение образцов популяции | Число изолятов | Форма P. teres по симптомам на листьях ячменя | Состав образцов популяций по результатам молекулярной диагностики (Poudel et al., 2017) |
|---|---|---|---|---|---|
| Россия | |||||
| ОПХ “Родина” Псковской обл., 2014 | Суздалец (яровой) | Psk | 10 | Net | 10 net |
| Батецкий район Новгородской обл., 2014 | Таусень (яровой) | Nov | 10 | Net | 10 net |
| Краснодарский край, 2016 | незвестен (озимый) | Kr2016 | 35 | Spot | 0 net + 3 spot + 32 Hybrid |
| Там же, ОПХ “Колос”, 2013 | Escape (озимый) | Kr2013 | 28 | Spot | 1 net + 23 spot + 4 Hybrid |
| Республика Беларусь | |||||
| Ивановский р-н Брестской обл., 2014 | Kormoran (яровой) | Iv1 | 10 | Net | 10 net |
| ” ” | Thorgаll (яровой) | Iv4 | 5 | Net | 5 Hybrid |
| Там же, ОАО “Белсолод”, 2014 | Kangoo (яровой) | Iv2 | 20 | Spot | 20 Hybrid |
| Там же, “Агро-Мотоль”, 2014 | Isocel, Salamandra, Nectaria (озимые) | Iv3 | 20 | Spot | 8 spot + 12 Hybrid |
Изоляцию гриба из пораженных листьев проводили по общепринятым методикам, с использованием модифицированной агаровой среды Чапека (ЧЛМ) следующего состава: KCl – 0.5 г; KH2PO4 – 0.5 г; MgSO4 – 0.5 г; мочевина – 1.2 г; лактоза – 20 г; агар-агар – 20 г (на 1 л водопроводной воды). Моноспоровые изоляты были получены путем переноса отдельных конидий на свежую среду ЧЛМ.
Выделение ДНК и проведение ПЦР. ДНК изолятов грибов выделяли стандартным методом (Murray, Thompson, 1980). Идентификацию форм гриба P. teres f. teres и P. teres f. maculatа проводили как по симптомам болезни, так и с помощью ПЦР со специфичными праймерами (Poudel et al., 2017) (табл. 1). Гибридные изоляты определяли по наличию двух типов молекулярных маркеров: 1) специфичных для P. teres f. teres и 2) специфичных для P. teres f. maculatа.
Для амплификации использовали термоциклер С1000 (BIO-RAD). Условия ПЦР-анализа приведены в оригинальном источнике (Poudel et al., 2017), а праймеры, использованные в работе – в табл. 2. Разделение продуктов амплификации с данными праймерами проводили в 1.7%-м агарозном геле при напряжении 100 В в течение 2 ч в 0.5 × ТБЕ буфере. Гели окрашивали бромистым этидием. В качестве маркеров молекулярных весов использовали GeneRuler 50 п.о. (Fermentas).
Таблица 2.
Праймеры для идентификации двух форм вида Pyrenophora teres – f. teres и f. maculatа (по: Poudel et al., 2017)
| Маркер | Нуклеотидная последовательность F и R праймеров (5'→ 3') | Размер продукта (п. н.) |
|---|---|---|
| PttQ1 | F: GGA TGA TGA CCT CGC CAG AT | 70 |
| R: GCG ATG GTA TGT TCT GCG AA | ||
| PttQ2 | F: AAC ACT CTG AAC GTG GTT GC | 110 |
| R: TTC AGT TGT AAG CTG CGT GG | ||
| PttQ3 | F: CCT CGT CCT AAG TTG ACT CGA | 130 |
| R: TTA CAC GGG TTC CCT CCA TC | ||
| PttQ4 | F: CGT CCC GCC GAA ATT TTG TA | 150 |
| R: CAA GGA CTT ACG CGC TCA AA | ||
| PttQ5 | F: GCA TTG TCT AGC ACT CGT CG | 173 |
| R: CGC GGA CTC AGA AGA CAT TG | ||
| PtmQ7 | F: GTA GAG GCT GTA GGA GAT GTG ATT | 140 |
| R: CAT GGC AAA TTG TTC GTA ATC CTG | ||
| PtmQ9 | F: AAT GCT CAA TTC TGG TGG CG | 201 |
| R: TGT TCG AGT GCA AAC TTG GG | ||
| PtmQ10 | F: TGC TGT GGA CTT AGA CGA GG | 220 |
| R: TGG GGA TCC TTG ACC AAC TC | ||
| PtmQ11 | F: GAT TAG ACC ATT ACC ACA CTA GCG | 260 |
| R: ACC ACC ACA TCT TTC CTA CTA ACT | ||
| PtmQ12 | F: CTA ACC AAA GAA CTT CAC AGA CGA | 279 |
| R: CCT TAT TAG CCA ATT CCA TGT CGA |
РЕЗУЛЬТАТЫ
Молекулярная идентификация форм P. teres f. teres и P. teres f. maculatа. Результаты молекулярной диагностики не полностью совпали с предварительной диагностикой формы изолятов по симптомам на листья ячменя (табл. 1). Примеры идентификации маркеров, специфичных для net- и spot-формы, согласно Poudel et al. (2017), приведены на рис. 1, 2.
Рис. 1.
Продукты амплификации в дуплексной ПЦР с праймерами, специфичными для Ptt-маркеров (PttQ3 + PttQ5). Изоляты Pyrenophora teres: 1–8 из популяции Nov; 9–24 – из популяции Kr2016. М – маркер молекулярных весов (50 п.н.). Диагностические продукты амплификации имеют размер 130 и 173 п.н.
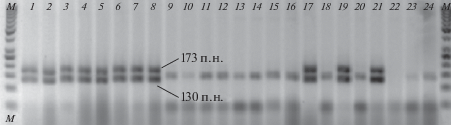
Рис. 2.
Продукты амплификации в дуплексной ПЦР с праймерами, специфичными для Ptm-маркеров (PtmQ7 + PtmQ12). Изоляты Pyrenophora teres: 1–16 из популяций Iv1 (net) и Nov (net), 17–33 – изоляты из популяции Kr2013 (spot). Слева – маркер молекулярных весов (50 п.н.). Диагностические продукты амплификации имеют размер 140 и 279 п.н.

Анализ краснодарской популяции P. teres 2013 и 2016 гг. С использованием формоспецифичных праймеров проведена молекулярная диагностика изолятов P. teres, выделенных с листьев ячменя с симптомами округлой пятнистости, собранных в Краснодарском крае в 2013 и 2016 гг. Один изолят из выборки Kr2013 г. был идентифицирован как P. teres f. teres, 23 изолята – как P. teres f. maculata и 4 изолята (Kr2013-29, -30, -32 и -46) одновременно показали диагностические продукты амплификации с праймерами Ptt и Ptm, специфичными для net- и spot-форм, что позволяет предполагать их гибридную природу (табл. 1, 3).
Таблица 3.
Генотипирование изолятов Pyrenophora teres из разных популяций по локусам, специфичным для P. teres f. teres и P. teres f. maculata
| Популяция P. teres | Наличие маркеров, специфичных для форм (по: Poudel et al., 2017) |
Число изолятов | Диагностика формы изолятов | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ptt | Ptm | |||||||||||
| Q1 | Q2 | Q3 | Q4 | Q5 | Q7 | Q9 | Q10 | Q11 | Q12 | |||
| Kr2013 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 20 | spot |
| 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 2 | гибрид | |
| 0 | 0 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | 0 | 1 | гибрид | |
| 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 2 | spot | |
| 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | spot | |
| 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | гибрид | |
| 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | net | |
| Kr2016 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 10 | гибрид |
| 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 6 | гибрид | |
| 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 12 | гибрид | |
| 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 1 | 1 | гибрид | |
| 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 2 | гибрид | |
| 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 3 | гибрид | |
| 0 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | гибрид | |
| Iv2 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 20 | гибрид |
| Iv3 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | гибрид |
| 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 10 | гибрид | |
| 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 7 | spot | |
| 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | гибрид | |
| 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | spot | |
| Iv4 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 4 | гибрид |
| 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | гибрид | |
| Psk + Nov + Iv1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 22 | net |
| 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | net | |
| 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 7 | net | |
Из 35 моноконидиальных изолятов краснодарской популяции 2016 г. (Kr2016) у шести изолятов, отнесенных по симптомам к net-форме (Kr2016-6, -11, -15, -18, -24 и -28) получены продукты амплификации с четырьмя парами праймеров Ptt (PttQ2, PttQ3, PttQ4, PttQ5) и одновременно с тремя парами праймеров Ptm (PtmQ7, PtmQ9, PtmQ12) (табл. 1, 3). На этом основании их также можно отнести к гибридам между двумя формами.
Среди 29 изолятов, идентифицированных по симптомам как spot-форма, практически все, кроме трех изолятов (Kr2016-34, -37 и -44) дали продукты амплификации с праймерами Ptm (PtmQ7, PtmQ9, PtmQ11 и PtmQ12) и одновременно с одним, редко – двумя праймерами Ptt (табл. 3). На основании этих результатов можно сделать предположение, что исследуемые изоляты являются половыми или соматическими гибридами.
С праймерами для маркера PttQ4 (специфичного для net-формы) получены диагностические продукты амплификации для большинства изолятов исследуемой популяции spot-формы Kr2016.
Анализ белорусских популяций P. teres. С праймерами, специфичными для spot-формы (PtmQ7, PtmQ9, PtmQ10, PtmQ11 и PtmQ12), получены продукты амплификации с ДНК всех изолятов образцов популяций Iv2 и Iv3, на основании чего их можно отнести к spot-форме (табл. 1, 3). Десять изолятов из популяции Iv1 были идентифицированы как net-форма. У пяти изолятов из популяции Iv4, идентифицированных по симптомам как net-форма, получены продукты амплификации с праймерами для маркеров обеих форм – Ptt и Ptm. На этом основании эти изоляты были классифицированы как гибриды, также как изоляты net-формы из популяции Kr2016. Праймеры специфичные для P. teres f. teres (PttQ1, PttQ2, PttQ3 и PttQ5) не амплифицировали ДНК изолятов P. teres f. maculata популяций spot-формы Iv2 и Iv3 за редким исключением. Маркер PttQ4, который отличался специфичностью для австралийских изолятов P. teres f. teres, был выявлен у 80% белорусских и 36% российских изолятов популяций spot-формы, что указывает на его неспецифичность в условиях России и Республики Беларусь.
Для доказательства гибридной природы изолятов, отобранных в результате генотипирования с формоспецифичными праймерами, мы проанализировали субклоны (митотическое потомство) предполагаемых трех гибридов из белорусской популяции Iv2 (Iv2-44, -32) и Iv4 (Iv4-47). К сожалению, гибридные изоляты отличались отсутствием способности к конидиальному спороношению. Все 16 субклонов, полученные из кончиков гиф, сохранили свой генотип по сравнению с родительским изолятом, что свидетельствует об их гибридной природе, либо стабильном гетерокариотичном состоянии.
Анализ популяций Pyrenophora teres f. teres Северо-западного региона России. Из популяций P. teres f. teres Psk и Nov 20 изолятов были проанализированы на наличие сайтов праймирования для маркеров Ptt и Ptm, специфичных для net- и spot-форм. В 100% случаев праймеры, специфичные для P. teres f. maculata (PtmQ7, PtmQ9, PtmQ10, PtmQ11, PtmQ12), не дали продуктов амплификации с ДНК изолятов P. teres f. teres из популяций Новгородской и Псковской областей России и Ивановской обл. Республики Беларусь (табл. 3). Среди изолятов P. teres f. teres выявлен полиморфизм по сайтам праймирования – в основном, по сайту PttQ1. Предполагаемых гибридов с диагностическими продуктами Ptt и Ptm не обнаружено.
ОБСУЖДЕНИЕ
Ранее нами было показано, что в российских и белорусских популяциях P. teres. f. teres и P. teres f. maculata присутствуют изоляты с обоими типами спаривания, что свидетельствует о возможности половых скрещиваний между изолятами (Mironenko et al., 2016). В связи с возможностью существования гибридов между net- и spot-формами P. teres возникает проблема изменчивости признака вирулентности к донорам устойчивости ячменя и появления новых высокоагрессивных рас гриба, что создает дополнительные проблемы селекционерам.
Все известные случаи обнаружения в природе изолятов P. teres, имеющих признаки гибридов между изолятами net- и spot-форм (Campbell et al., 2002; Leišova et al., 2005; Akhavan et al., 2015; Poudel et al., 2017), нельзя считать строго доказанными. Принимая во внимание тот факт, что дивергенция вида происходит на фоне большого внутривидового разнообразия с образованием промежуточных форм между видами, следует признать, что существуют объективные причины, не позволяющие найти маркеры строго специфичные для вида или формы гриба. Современные подходы к разработке универсальных критериев для различения видов организмов и “подводные камни”, с которыми сталкиваются исследователи, детально рассмотрены в соответствующем обзоре (Abramson, 2009).
Наша работа посвящена поиску гибридных форм P. teres, но необходимым условием проведения такой работы является верификация формоспецифичных маркеров, разработанных на основании результатов секвенирования полных геномов австралийских изолятов (Poudel et al., 2017).
Специфичность предложенных праймеров была проверена и подтверждена авторами на коллекции австралийских изолятов, аскоспоровом потомстве от направленных скрещиваний между двумя формами (Poudel et al., 2017), а также на большом материале конидиальных и аскоспоровых изолятов, выделенных из листьев ячменя, зараженных смесью двух изолятов P. teres. f. teres и P. teres f. maculata в полевых условиях в Австралии (Poudel et al., 2019). В результате проведения трехлетних полевых экспериментов гибридных форм выявлено не было (Poudel et al., 2019). Отметим, что все эти эксперименты проводились исключительно на изолятах австралийского происхождения и специфичность маркеров не вызывала сомнений.
Когда мы используем эти маркеры для идентификации форм P. teres в российских и белорусских популяциях, то некоторые из них (PttQ4, PttQ3) ведут себя как неспецифичные для наших объектов исследования. Вследствие этого наличие данных маркеров в изолятах spot-формы не являются доказательством их гибридной природы. С другой стороны, выявление нескольких специфичных маркеров для обеих форм у отдельных изолятов P. teres позволяет утверждать их гибридную природу.
Мы использовали в работе набор из 10 пар праймеров, амплифицирующих 5 локусов специфичных для net-формы и 5 – для spot-формы. Моноконидиальные изоляты из российских и белорусских популяций P. teres были идентифицированы праймерами на локусы Ptm и Ptt практически на 100%. Отсутствие продукта амплификации в редких случаях можно отнести к проявлению полиморфизма по данному формоспецифичному локусу. В то же время, большая часть изолятов, идентифицированных как net- или spot-форма, характеризовалась наличием дополнительных маркеров, специфичных для другой формы (табл. 1, 3).
Так, маркер PttQ4 был идентифицирован у 36 и 80% изолятов P. teres f. maculata из российских и белорусских популяций, соответственно. Маркеры PttQ2 и PttQ5 встречались с меньшей частотой (1.8–3.6%) среди российских изолятов и отсутствовали у изолятов из белорусских популяций spot-формы, тогда как по маркеру PttQ3 различия между популяциями были существенны (23.2 и 0%, соответственно). Изоляты spot-формы, у которых выявлены маркеры, специфичные для net-формы, теоретически можно считать гибридами. Однако, учитывая высокую частоту в популяциях spot-формы изолятов, имеющих маркеры PttQ3 и PttQ4, логичнее предположить, что часть локусов, идентифицированных авторами как специфичные для net-формы, не являются таковыми для изолятов P. teres из российских и белорусских популяций. Возможно, эти маркеры дифференцируют австралийские изоляты P. teres. f. teres и P. teres f. maculata по причине более глубокой дивергенции вида P. teres на формы в Австралии.
Все изоляты P. teres. f. teres из популяций (Psk + + Nov + Iv1), в которых не были обнаружены изоляты другой формы, дают диагностические продукты амплификации с праймерами, специфичными для net-формы, и не дают продуктов амплификации с праймерами, специфичными для spot-формы (табл. 3). Среди изолятов P. teres. f. teres наблюдали полиморфизм по наличию/отсутствию продукта амплификации маркеров Ptt. Фактически мы показали, что предложенная авторами (Poudel et al., 2017) система праймеров способна идентифицировать net- и spot-формы P. teres. С другой стороны, все 11 изолятов P. teres. f. teres, которые были выделены из смешанных популяций, т.е. представленных на 83–93% изолятами P. teres f. maculata, по результатам ПЦР имели локусы, специфичные для обеих форм, что может свидетельствовать об их гибридной природе. Логично предположить, что при совместном заражении растения двумя формами патогена может происходить гибридизация, как в результате половых скрещиваний, так и путем образования гетерокарионов.
В целом, согласно полученным результатам, можно предполагать гибридную природу 11 изолятов, первоначально определенных как P. teres. f. teres: шести изолятов из краснодарской популяции 2016 г. (Kr2016-6, -11, -15, -18, -24, -28) и пяти изолятов белорусской популяции (Iv4-7, -48, -49, -50, -51). Два изолята P. teres f. maculata из краснодарской популяции 2013 (Kr2013- 30 и -46), совмещающих в своем геноме маркеры Ptm и 3-5 маркеров Ptt, также можно отнести к гибридам. Эти гибридные изоляты составляют около 9.4% от общего числа изолятов изученных нами популяций P. teres f. maculata.
Таким образом, наиболее вероятной гипотезой, объясняющей обнаружение изолятов P. teres f. teres, сочетающих в своем геноме маркеры Ptt и Ptm, является половая, либо соматическая гибридизация между двумя формами гриба при их совместном существовании на посевах ячменя. Не исключается также вероятность существования третьей, возможно, предковой, формы, сочетающей генетический материал P. teres. f. teres и P. teres f. maculata. Остается открытым вопрос о реакции известных доноров устойчивости к P. teres. f. teres к изолятам P. teres f. maculata и гибридным формам гриба.
ЗАКЛЮЧЕНИЕ
Проведена верификация формоспецифичных маркеров (Poudel et al., 2017) для идентификации P. teres. f. teres и P. teres f. maculata в российских и белорусских популяциях P. teres и поиска межвидовых гибридов. Природу гибридных изолятов P. teres, сочетающих в своем геноме маркеры специфичные для каждой формы гриба, можно объяснить: 1) половой, либо соматической гибридизацией между двумя формами гриба; 2) внутривидовой генетической изменчивостью; 3) сохранением в процессе дивергенции вида P. teres промежуточных форм.
Работа выполнена при поддержке РФФИ гранта № 20-516-00007 Бел_а и БРФФИ договор № Б20Р-131.
Список литературы
Akhavan A., Turkington T.K., Kebede B. et al. Prevalence of mating type idiomorphs in Pyrenophora teres f. teres and P. teres f. maculata populations from the Canadian prairies. Can. J. Plant. Pathol. 2015. V. 37. P. 52–60. https://doi.org/10.1080/07060661.2014.995710
Arabi M.I., Barrault G., Sarrafi A. et al. Variation in the resistance of barley cultivars and in the pathogenicity of Drechslera teres f. sp. maculata and D. teres f. sp. teres isolates from France. Plant Pathol. 1992. V. 41. P. 180–186. https://doi.org/10.1111/j.1365-3059.1992.tb02336.x
Bakonyi J., Justesen A.F. Genetic relationship of Pyrenophora graminea, P. teres f. maculata and P. teres f. teres assessed by RAPD analysis. J. Phytopathol. 2007. V. 155 (2). P. 76–83. https://doi.org/10.1111/j.1439-0434.2007.01192.x
Campbell G.F., Crous P.W. Genetic stability of net × spot hybrid progeny of the barley pathogen Pyrenophora teres. Australas. Plant Pathol. 2003. V. 32. P. 283–287. https://doi.org/10.1071/AP03016
Keiper F.J., Capio E., Grcic M. et al. Development of sequence-tagged microsatellites for the barley net blotch pathogen Pyrenophora teres. Molecular Ecol. Notes. 2007. V. 7. P. 664–666. https://doi.org/10.1111/j.1471-8286.2006.01668.x
Lehmensiek A., Bester-van der Merwe A.E., Sutherland M.W. et al. Population structure of South African and Australian Pyrenophora teres isolates. Plant Pathol. 2010. V. 59. P. 504–515. https://doi.org/10.1111/j.1365-3059.2009.02231.x
Leisova L., Minarikova V., Kucera L. et al. Genetic diversity of Pyrenophora teres isolates as detected by AFLP Analysis. Journal of Phytopathology. 2005. V. 153 (10). P. 569–578. https://doi.org/10.1111/j.1439-0434.2005.01019.x
Manninen O.M., Jalli M., Kalendar R. et al. Mapping of major spot-type and net-type net blotch resistance genes in the Ethiopian barley (Hordeum vulgare) line CI 9819. Genome. 2006. V. 49. P. 1564–1571. https://doi.org/10.1139/g06-119
McLean M., Howlett B., Hollaway G. Epidemiology and control of spot form of net blotch (Pyrenophora teres f. maculata) of barley: A review. Crop Pasture Science. 2009. V. 60. P. 303–315. https://doi.org/10.1071/CP08173
McLean M.S., Martin A., Gupta S. et al. Validation of a new spot form of net blotch differential set and evidence for hybridisation between the spot and net forms of net blotch in Australia. Australas. Plant Pathol. 2014. V. 43. P. 223–233. https://doi.org/10.1007/s13313-014-0285-8
Murray H.G., Thompson W.F. Rapid isolation of high molecular weight DNA. Nucl. Acids Res. 1980. V. 8. P. 4321–4325. https://doi.org/10.1093/nar/8.19.4321
Poudel B., Ellwood S.R., Testa A.C. et al. Rare Pyrenophora teres hybridization events revealed by development of sequence-specific PCR markers. Phytopathology. 2017. V. 107 (7). P. 878–884. https://doi.org/10.1094/PHYTO-11-16-0396-R
Poudel B., McLean M.S., Platz G.J. et al. Investigating hybridisation between the forms of Pyrenophora teres based on Australian barley field experiments and cultural collections. Europ. J. Plant Pathol. 2019. V. 153. P. 465–473. https://doi.org/10.1007/s10658-018-1574-9
Serenius M., Manninen O., Walwork H. et al. Genetic differentiation in Pyrenophora teres populations measured with AFLP markers. Mycol. Res. 2007. V. 111. P. 213–223. https://doi.org/10.1016/j.mycres.2006.11.009
Serenius M., Mironenko N., Manninen O. Genetic variation, occurrence of mating types and different forms of Pyrenophora teres causing net blotch of barley in Finland. Mycol. Res. 2005. V. 109 (7). P. 809–817. https://doi.org/10.1017/S0953756205002856
Smedegaard-Petersen V. Inheritance of genetic factors for symptoms and pathogenicity in hybrid of Pyrenophora teres and Pyrenophora graminea. Phytopath. Z. 1977. V. 89. P. 193–202. https://doi.org/10.1111/j.1439-0434.1977.tb02858.x
Tekauz A. Characterization and distribution of pathogenic variation in Pyrenophora teres f. teres and P. teres f. maculata from Western Canada. Can. J. Plant Pathol. 1990. V. 12. P. 141–148. https://doi.org/10.1080/07060669009501017
Williams K.J., Smyl C., Lichon A. et al. Development and use of an assay based on the polymerase chain reaction that differentiates the pathogens causing spot form and net form of net blotch of barley. Austral. Plant Pathol. 2001. V. 30. P. 37–44. https://doi.org/10.1071/AP00063
Абрамсон Н.И. (Abramson) Молекулярные маркеры, филогеография и поиск критерия разграничения видов // А.Ф. Алимов, С.Д. Степаньянц (ред.). Вид и видообразование. Анализ новых взглядов и тенденций. Санкт-Петербург: Товарищество научных изданий КМК, 2009. С. 185–198.
Анисимова А.В., Мироненко Н.В., Левштанов С.А. (Anisimova et al.) Первая находка гриба Pyrenophora teres f. maculata в Краснодарском крае // Вестник защиты растений. 2011. № 3. С. 53–56.
Афанасенко О.С., Мироненко Н.В., Анисимова А.В. и др. (Afanasenko et al.) Изменение видового состава возбудителей листовых болезней ячменя в России и Беларуси // Современная микология в России. 2015. Т. 5. Вып. 4. С. 5–7.
Калантаевская О.Т., Муругова Г.А. (Kalantaevskaya, Murugova) Исходный материал ярового ячменя, устойчивый к сетчатому гельминтоспориозу в условиях Приморского края // Вестник защиты растений. 2014. № 2. С. 64–67.
Мироненко Н.В., Афанасенко О.С. (Mironenko, Afanasenko) Методические особенности генетического анализа признака вирулентности у Pyrenophora teres // Микология и фитопатология. 2011. Т. 45. № 1. С. 82–91.
Мироненко Н.В., Анисимова А.В., Баранова О.А. и др. (Mironenko et al.) Внутривидовой состав и структура популяций Pyrenophora teres в Северо-Западном регионе России и Беларуси по вирулентности и локусам типа спаривания // Микология и фитопатология. 2016. Т. 50. № 3. С. 185–194.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


