Микология и фитопатология, 2021, T. 55, № 3, стр. 203-218
Идентификация и токсикологическая характеристика штаммов Alternaria japonica
Д. Р. Салимова 1, *, Д. С. Кочура 2, **, С. В. Сокорнова 1, ***, А. С. Орина 1, ****, Ф. Б. Ганнибал 1, *****, А. О. Берестецкий 1, ******
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
2 Научно-исследовательский институт гигиены, профпатологии и экологии человека
188663 Санкт-Петербург, Россия
* E-mail: salimova.92@bk.ru
** E-mail: zcaryg@gmail.com
*** E-mail: svsokornova@vizr.spb.ru
**** E-mail: orina-alex@yandex.ru
***** E-mail: fgannibal@vizr.spb.ru
****** E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 25.08.2020
После доработки 15.11.2020
Принята к публикации 23.12.2020
Аннотация
Грибы рода Alternaria являются продуцентами биологически активных соединений, среди которых патоген редиса и некоторых других крестоцветных вид Alternaria japonica изучен недостаточно, а имеющиеся данные литературы о токсических метаболитах этого фитопатогена противоречивы. Возможно, они связаны с использованием узкого набора питательных субстратов для культивирования гриба, либо с неточной видовой идентификацией использованных штаммов. Цель представленной работы – провести точную идентификацию российских штаммов A. japonica и определить токсигенный потенциал этого гриба. На основе полифазного подхода – оценки комплекса морфологических признаков (диаметр и морфология недельных колоний на диагностических агаризованных средах КМА и YES, размеры конидий, наличие хламидоспор), анализа нуклеотидных последовательностей ДНК-маркеров (участков ITS и EF1α) и хемотаксономических данных (образование микотоксинов) – идентифицировано 4 российских штамма A. japonica. Выход биомассы и экстрактивных веществ из культур A. japonica существенно зависел от состава жидкой питательной среды. Анализ метаболитных профилей экстрактов при помощи ВЭЖХ/МС-УФ показал слабые различия между штаммами A. japonica. Экстракты из культур этих грибов обладали фитотоксической активностью в отношении листьев редиса и цитотоксичностью в отношении клеток инфузории-туфельки на уровне действия экстрактов гриба A. tenuissima. В экстрактах A. japonica идентифицированы известные у некоторых видов рода Alternaria брассициколин А, дигидробрассициколин А, фоменин А и фоменин Б. Микотоксины (альтернариол, его метиловый эфир, тентоксин, тенуазоновая кислота, альтенуен), характерные для космополитного вида A. tenuissima, в культурах штаммов A. japonica не обнаружены. Анализ токсичности экстрактов и выхода экстрактивных веществ у различных штаммов A. japonica показал, что штамм MFP244011 может быть использован для продукции как известных, так и предположительно новых токсинов при культивировании на синтетической среде М1Д и полусинтетических жидких питательных средах (например, среде Сабуро).
ВВЕДЕНИЕ
Грибы рода Alternaria Nees хорошо известны как продуценты биологически активных соединений, прежде всего, микотоксинов. Многие из выявленных у различных видов альтернариоидных грибов метаболиты обладают полезными свойствами, благодаря которым они могут быть использованы в медицине и защите растений (Lou et al., 2013; Dalinova et al., 2020). Скрининг экстрактов из культур различных малоизученных видов этого рода выявил, что штамм MFP181011 A. japonica Yoshii образует при культивировании в жидкой культуре фитотоксические и инсектицидные метаболиты (Berestetskiy et al., 2018, 2019). Вид A. japonica широко распространен в мире и вызывает болезни ряда крестоцветных культур (рапс, канола, редис, редька, турнепс, кресс-салат, гулявник и другие), являясь, как правило, наиболее патогенным в комплексе альтернариоидных грибов, поражающих указанные растения (Corlett, Corlett, 1999; Gilardi et al., 2014; Gannibal, 2015; Al-lami et al., 2018, 2019a, 2019b; Gilardi et al., 2018; Blagojević et al., 2020). Иногда этот вид встречают на растениях других семейств, однако высокую патогенность гриб проявляет при заражении представителей семейства Brassicaceae (Nishikawa, Nakashima, 2020). Кроме того, A. japonica предложен в качестве потенциального микогербицида против дикой редьки (Raphanus raphanistrum, Brassicaceae) в Австралии (Scott, 2012), водяного гиацинта (Eichhornia crassipes, Pontederiaceae) в Индии (Dutta et al., 2015), а также в качестве продуцента гербицидных метаболитов для борьбы с партениумом позднеплодным (Parthenium hysterophorus, Asteraceae) в Пакистане (Javaid et al., 2017).
Метаболиты Alternaria japonica и их токсигенные свойства изучены недостаточно. Проведено предварительное изучение летучих метаболитов A. japonica, среди которых выявлены хорошо известные вещества, способные проявлять биологическую активность (Javaid et al., 2019). Имеется информация, что этот вид, наряду с некоторыми другими видами рода Alternaria, образует тентоксин – хорошо известный олигопептидный фитотоксин (Suemitsu et al., 1992). Изучение образования пяти основных микотоксинов альтернариоидных грибов (тенуазоновой кислоты, альтернариола, его метилового эфира, альтенуена и тентоксина) в чистой культуре 10 штаммов A. japonica показало, что у 8 штаммов эти вещества не выявлены, у одного – обнаружены все указанные токсины, за исключением тентоксина, у одного – выявлена только тенуазоновая кислота (Siciliano et al., 2015, 2017). Таким образом, имеющиеся данные литературы о токсических метаболитах A. japonica противоречивы. Возможно, они связаны с использованием различными авторами разных питательных субстратов (либо узкого их набора) для культивирования грибов либо с неточной видовой идентификацией использованных культур. Следует отметить также, что морфолого-культуральные и физиолого-биохимические свойства российских штаммов этого гриба не изучены.
Цель представленной работы – охарактеризовать штаммы A. japonica как продуценты биологически активных соединений и определить токсигенный потенциал метаболитов этого гриба. Для этого уточнена видовая принадлежность четырех российских штаммов A. japonica при помощи микологических и молекулярно-генетических методов, оценен выход экстрактивных веществ из культур микромицетов, полученных на различных жидких и твердых питательных средах, проанализированы метаболитные профили экстрактов по их комплексности и составу, а также определена токсигенность полученных экстрактов.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследований. В работе использованы 4 штамма A. japonica из коллекции чистых культур Лаборатории микологии и фитопатологии Всероссийского института защиты растений, которые были выделены и предварительно идентифицированы Ф.Б. Ганнибалом: MFP181011 (далее 181), MFP239011 (далее 239), MFP244011 (далее 244) и MFP 259011 (далее 259). Штамм наиболее распространенного вида рода Alternaria – A. tenuissima MFP253011 (далее 253) использован для сравнения (табл. 1). Культуры сохраняли на стандартной среде КГА (картофельно-глюкозный агар) при температуре 5°С.
Таблица 1.
Происхождение штаммов Alternaria japonica и A. tenuissima, использованных в работе и номера нуклеотидных последовательностей, депонированных в базе данных NCBI
| Штамм | Вид | Происхождение | Номер в NCBI | |
|---|---|---|---|---|
| ITS | EF1α | |||
| MFP181011 | A. japonica | плод редьки, Московская обл. | MT895504 | MT904295 |
| MFP 239011 | A. japonica | семена редиса, место сбора неизвестно | MT895505 | MT904296 |
| MFP 244011 | A. japonica | семена редиса, место сбора неизвестно | MT895503 | MT904294 |
| MFP 259011 | A. japonica | семена капусты, Республика Дагестан | MT895502 | MT904293 |
| MFP253011 | A. tenuissima | плод редьки, Республика Дагестан | MT895501 | MT904292 |
Видовая идентификация. Для описания морфолого-культуральных свойств штаммы выращивали на двух стандартных агаризованных средах (КМА и YES) при температуре 24°С при постоянном освещении лампами дневного света (4 повторности) и при постоянной темноте (4 повторности). Анализировали диаметр и морфологию недельных колоний, длину и ширину конидий, наличие хламидоспор, согласно рекомендациям по определению грибов рода Alternaria (Gannibal, 2011). Экстракцию ДНК из воздушного мицелия грибов проводили с помощью набора Genomic DNA Purification Kit (Thermo Fisher Scientific, Литва) либо как описано ранее (Sokornova et al., 2018). Таксономически значимые участки гена фактора элонгации 1α (EF1α) и транскрибируемого внутреннего спейсера (ITS) были амплифицированы с помощью праймеров EF1-728f/EF1-986r (Carbone, Kohn, 1999) и ITS1/ITS4 (White et al., 1990). В состав смеси для ПЦР входили DreamTaq™ Green Master Mix (2X) (Thermo Scientific, США), по 5 пикомоль каждого праймера и 1 мкл препарата ДНК. Очистку продуктов ПЦР из агарозного геля осуществляли с помощью набора diaGene (Диаэм, Россия). Нуклеотидную последовательность определяли на секвенаторе ABIPrism 3500 (Applied Biosystems-Hitachi, США) с использованием набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit (ABI, США). Выравнивание и редактирование нуклеотидных последовательностей проводили с помощью программы Vector NTI Advance 10 (Thermo Fisher Scientific, США) или в свободной программе BioEdit. Полученные сиквенсы депонированы в базе данных NCBI (табл. 1) и сопоставлены с имеющимися в ней последовательностями нуклеотидов грибов.
Культивирование грибов. В работе использованы две синтетические и две полусинтетические стандартные жидкие питательные среды: среда Чапека с витаминами (ЧАВ) (20 г глюкозы, 2 г NaNO3, 1 г KH2PO4, 0.5 г MgSO4, 0.5 г KCl, 100 мкг тиамина, 5 мкг биотина, вода до 1 л, рН 6), М1D [0.45 г Ca(NO3)2, 0.15 г KNO3, 0.15 г KCl, 0.03 г NaH2PO4, 45 г сахарозы, 7.5 г виннокислого аммония, 0.003 г FeCl3 · 6 H2O, 0.0375 г ZnSO4 · 7 H2O, 0.003 г H3BO3, 0.015 г KJ, 0.75 г MnSO4, 5.25 г MgSO4 · 7 H2O, вода до 1 л, рН6], ДМГ (20 г глюкозы, 10 г мальтозного экстракта, 4 г дрожжевого экстракта, вода до 1 л), среда Сабуро (10 г пептона, 40 г глюкозы, вода до 1 л) в литровых конических колбах с 300 мл среды. Грибы культивировали также на твердом субстрате: 100 г перловой крупы, 60 мл воды в 500-миллилитровых конических колбах. Субстраты стерилизовали автоклавированием при температуре 121°С в течение 20 мин. В качестве посевного материала использовали блоки 5 мм в диам. из края двухнедельных колоний грибов, полученных на КМА при 24°С. Инкубацию микромицетов осуществляли при постоянной температуре 24°С в темноте в течение трех недель. Для улучшения аэрации и предотвращения комкования твердых культур колбы ежедневно тщательно встряхивали. Культивирование грибов выполнили в трех повторностях.
Получение экстрактов. Экстракцию грибных экзометаболитов из фильтрата культуральной жидкости проводили растворителями разной полярности и при разном значении рН культурального фильтрата: 300 мл фильтрата подщелачивали раствором 0.1 Н NaOH до нейтрального значения и экстрагировали в делительной воронке двумя 150-миллилитровыми порциями хлористого метилена; оставшуюся водную фазу концентрированной муравьиной кислотой доводили до рН 3, после чего грибные метаболиты извлекали двумя 150-миллилитровыми порциями этилацетата. Эндометаболиты изучаемых микромицетов экстрагировали из сухого измельченного мицелия сначала гексаном, затем этилацетатом двумя 100-мл порциями каждого растворителя. Растворители отгоняли из экстрактов при помощи ротационного испарителя при температуре водяной бани 40°С, после чего определяли массу сухого остатка.
Анализ метаболитного профиля экстрактов. Сухой остаток экстрактов растворяли в ацетонитриле до концентрации 5 мг/мл. Использована хроматографическая система Acella с трехквадрупольным масс-спектрометрическим детектором TSQ Quantum Access™ (Thermo Scientific, США). Условия хроматографирования: колонка Acquity UPLC BEH C18 2.1 × 100 мм с зернением 1.7 мкм (Waters, США). Разделение экстрактов (объем вводимой пробы – 2 мкл) осуществляли на колонке Zorbax CB-С18 150×2.1 мм с зернением 1.8 мкм (Agilent, США) при скорости подачи элюента 250 мкл/мин в градиентном режиме в системе ацетонитрил–0.1%-я муравьиная кислота в градиентном режиме: концентрация ацетонитрила повышалась от 1 до 95% в течение первых 17 минут; 95% ацетонитрила с 18-й минуты в течение трех минут; с 20-й минуты до 20.01 минуты концентрация ацетонитрила понижалась до 1% и поддерживалась еще 5 минут на этом уровне. Тип ионизации масс-детектора – термоэлектрораспыление, диапазон сканирования 100–1000 m/z c частотой 0.8 секунды в режиме положительно заряженных ионов. Хроматограммы анализировали с помощью открытой программы MZmine 2.4 (Pluskal et al., 2010). Для сравнения метаболитных профилей экстрактов на хроматограммах определяли время удерживания (tR) и значения m/z пиков основных метаболитов. Для идентификации веществ в экстрактах использовали также стандарты тенуазоновой кислоты, альтернариола и его метилового эфира.
Биологическая активность экстрактов. Фитотоксическую активность экстрактов оценивали на надколотых острой иглой листовых высечках из листьев редиса (Raphanus sativus var. sativus, сорт Заря). Цитотоксичность экстрактов оценивали на культуре инфузории-туфельки (Paramecium caudatum), предоставленной Д.О. Виноходовым (Санкт-Петербургский технический университет) и поддерживаемой на среде Лозина–Лозинского при комнатной температуре. Методики биопроб были подробно изложены ранее (Berestetskiy et al., 2020).
Статистическая обработка данных. Статистические расчеты проводили с помощью программы SigmaPlot 12.5. Однофакторный и многофакторный дисперсионный анализ проводили с помощью программы Statistica 10 (StatSoft, США) функции ANOVA. Достоверность различий между средними устанавливали на основе критерия наименьшей средней разности (Fisher’s LSD Method) на уровне значимости Р = 0.05.
РЕЗУЛЬТАТЫ
Видовая идентификация. Анализ нуклеотидных последовательностей участка ITS (табл. 1) позволил отнести изученные штаммы к роду Alternaria. Сиквенсы участка EF1α штаммов 181, 239, 244 и 259 (табл. 1) были высокогомологичны (>99.7%) сиквенсам различных штаммов A. japonica, включая типовой штамм CBS 118390 (Woudenberg et al., 2013).
Наблюдали существенную вариабельность роста штаммов Alternaria spp. на агаризованных средах (табл. 2, рис. 1). Штаммы 181 и 244 Alternaria japonica отличались относительно медленным ростом на КМА (диаметр недельных колоний около 60 мм), тогда как штаммы 239, 259, 253 A. japonica и A. tenuissima росли быстрее (диаметр недельных колоний около 70–75 мм). На среде YES рост колоний A. japonica (181, 239, 244 и 259) был более слабым (35–45 мм) по сравнению с A. tenuissima 253 (60 мм).
Таблица 2.
Морфолого-культуральные признаки исследованных штаммов Alternaria spp.
| Штамм | Диаметр недельных колоний, мм | Размеры корпуса конидий, мкм | Наличие хламидоспор | ||
|---|---|---|---|---|---|
| КМА | YES | длина | ширина | ||
| 181 | 60 ± 0.4 4 | 39 ± 0.4 | 49 ± 12.3 | 21 ± 5.4 | + |
| 239 | 67 ± 1.9 | 31 ± 0.6 | 46 ± 6.9 | 18 ± 3.4 | + |
| 244 | 59 ± 2.0 | 35 ± 1.7 | 39 ± 8.2 | 17 ± 3.6 | + |
| 259 | 74 ± 0.7 | 44 ± 0.8 | 40 ± 7.6 | 23 ± 4.5 | + |
| 253 | 78 ± 0.4 | 59 ± 0.7 | 32 ± 6.6 | 9 ± 1.2 | – |
| A. japonica1 | 58–601 | 35–702 | 18–242 | + | |
| A. tenuissima2 | 62–663 | 20–45 | 8–12 | – | |
Рис. 1.
Морфология недельных колоний Alternaria japonica (a – 181, б – 239, в – 244, г –259) и A. tenuissima (д – 253) на КМА (верхний ряд) и YES (нижний ряд).

На КМА цвет колоний изученных Alternaria spp. варьировал от беловатого до серовато-оливкового, на YES – также имел желтоватые оттенки в центре колоний. Заметных различий между изученными штаммами не обнаружено. На КМА колонии штаммов 239, 259, 253 характеризовались хорошо развитым воздушным мицелием, тогда как периферия колоний медленнорастущих штаммов 181 и 244 имела паутинистый слаборазвитый воздушный мицелий. На среде YES воздушный мицелий изученных микромицетов был хорошо развит без существенных различий между штаммами (рис. 1).
В культуре на КМА конидии A. japonica (181, 239, 244 и 259) образовывались в коротких цепочках (2–4 конидии) и были визуально крупнее (рис. 3), чем конидии A. tenuissima 253, которые образовывались в виде длинных цепочек. Длина корпуса конидий изученных Alternaria spp. варьировала в диапазоне 32–50 мм, различия между штаммами были несущественными. Ширина корпуса конидий A. japonica (181, 239, 244 и 259) была примерно в 2 раза больше ширины корпуса конидий A. tenuissima 253 (табл. 2, рис. 2). В воздушном и субстратном мицелии A. japonica (181, 239, 244 и 259) обнаружены хламидоспоры – округлые или вытянутые темноокрашенные клетки в виде цепочек (рис. 3), в культуре штамма 253 хламидоспоры не выявлены (табл. 2).
Рис. 2.
Типичные конидии Alternaria japonica (a – 181, б – 239, в – 244, г –259) и A. tenuissima (д – 253) при культивировании на КМА. Масштаб – 10 мкм.
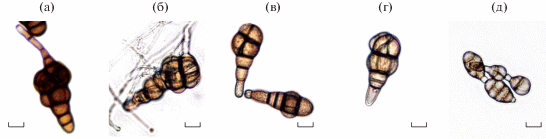
Рис. 3.
Морфология хламидоспор Alternaria japonica на КМА (a – 181, б – 239, в – 244, г –259). Масштаб – 10 мкм.

Сопоставление совокупности полученных данных с информацией из литературы (табл. 2) позволило идентифицировать штаммы 181, 239, 244 и 259 как A. japonica.
Выход биомассы и экстрактивных веществ. Состав жидкой питательной среды оказал существенное влияние (P < 0.01) на накопления биомассы изученных штаммов A. japonica и A. tenuissima. Наименее благоприятной для роста микромицетов была среда Чапека с витаминами (выход биомассы до 2 г/л). На более комплексной синтетической среде М1Д рост альтернариоидных грибов был существенно лучше (5.6–8.6 г/л). Примерно такой же уровень накопления биомассы наблюдали при культивировании грибов на полусинтетических средах ДМГ и Сабуро за исключением штамма 239 A. japonica, у которого выход биомассы на этих средах был относительно низким (2.5–3.7 г/л). В целом, поверхностный рост различных штаммов A. japonica на комплексных жидких питательных средах (М1Д, ДМГ и Сабуро) заметно варьировал, при этом уровень накопления биомассы был ниже, чем у A. tenuissima 253 (табл. 3).
Таблица 3.
Продуктивность изученных штаммов Alternaria japonica и A. tenuissima при культивировании на различных жидких питательных средах
| Среда | Штамм | Сухая биомасса, г/л | Выход экстрактивных веществ, мг/л | |||
|---|---|---|---|---|---|---|
| Культуральная жидкость | Сухой мицелий | |||||
| Хлористый метилен | Этилацетат | Гексан | Этилацетат | |||
| ЧАВ | 181 | 1.7 ± 0.2 | 11.1 ± 0.8 | 200.2 ± 29.9 | 17.3 ± 6.7 | 16.1 ± 1.0 |
| 239 | 1.7 ± 0.3 | 10.2 ± 3.0 | 266.6 ± 69.0 | 5.0 ± 1.2 | 7.2 ± 1.6 | |
| 244 | 1.9 ± 0.6 | 17.1 ± 4.7 | 226.2 ± 55.3 | 23.5 ± 8.8 | 6.8 ± 0.8 | |
| 259 | 1.8 ± 0.1 | 17.7 ± 13.7 | 242.9 ± 26.9 | 15.5 ± 7.4 | 22.0 ± 5.4 | |
| 253 | 2.0 ± 0.1 | 7.4 ± 0.5 | 208.1 ± 69.9 | 259.6 ± 6.0 | 8.1 ± 3.8 | |
| М1Д | 181 | 7.1 ± 1.3 | 14.2 ± 4.9 | 155.7 ± 4.8 | 54.2 ± 3.5 | 51.6 ± 9.5 |
| 239 | 5.6 ± 1.1 | 15.0 ± 8.1 | 180.1 ± 13.8 | 6.2 ± 2.4 | 15.3 ± 6.9 | |
| 244 | 7.3 ± 0.4 | 20.0 ± 6.3 | 159.1 ± 22.5 | 89.2 ± 28.7 | 110.3 ± 21.8 | |
| 259 | 5.9 ± 0.6 | 5.8 ± 2.8 | 202.0 ± 43.0 | 6.1 ± 1.8 | 39.7 ± 10.2 | |
| 253 | 8.6 ± 0.1 | 38.0 ± 3.2 | 595.1 ± 75.1 | 44.8 ± 4.6 | 95.8 ± 19.9 | |
| ДМГ | 181 | 4.9 ± 1.8 | 43.5 ± 7.0 | 275.2 ± 35.0 | 149.3 ± 79.6 | 268.5 ± 136.4 |
| 239 | 3.7 ± 0.1 | 46.6 ± 6.1 | 480.1 ± 75.0 | 9.0 ± 1.1 | 23.9 ± 6.8 | |
| 244 | 5.1 ± 0.6 | 67.9 ± 11.3 | 591.8 ± 90.4 | 151.6 ± 65.1 | 53.4 ± 12.1 | |
| 259 | 6.5 ± 1.4 | 47.2 ± 8.6 | 371.5 ± 75.8 | 74.9 ± 36.2 | 42.3 ± 7.9 | |
| 253 | 7.4 ± 0.5 | 35.6 ± 3.1 | 643.3 ± 165.8 | 30.1 ± 11.9 | 75.0 ± 10.0 | |
| Сабуро | 181 | 7.7 ± 0.9 | 105.1 ± 16.2 | 192.7 ± 9.3 | 221.9 ± 13.7 | 234.9 ± 28.3 |
| 239 | 2.5 ± 0.1 | 49.0 ± 10.8 | 130.9 ± 15.8 | 2.5 ± 0.5 | 8.8 ± 1.0 | |
| 244 | 5.8 ± 0.7 | 84.9 ± 8.3 | 188.3 ± 32.3 | 211.9 ± 71.8 | 82.1 ± 23.4 | |
| 259 | 6.4 ± 0.4 | 48.2 ± 9.5 | 222.4 ± 26.4 | 36.3 ± 2.2 | 71.7 ± 18.1 | |
| 253 | 8.5 ± 1.0 | 56.5 ± 17.1 | 506.9 ± 99.3 | 30.7 ± 1.5 | 111.7 ± 40.4 | |
| НСР0.05 | 1.29 | 26.4 | 106.4 | 47.0 | ||
Выход экстрактивных веществ (ВЭВ) из культуральной жидкости изученных альтернариоидных грибов существенно зависел от всех изученных факторов на уровне р < 0.01: экстрагента, состава жидкой питательной среды и штамма гриба. В зависимости от состава среды ВЭВ из культуральной жидкости A. japonica при использовании этилацетата в качестве экстрагента был в 3–20 раз выше (на уровне 130–591 мг/л), чем ВЭВ при использовании хлористого метилена (5–115 мг/л). Выход липофильных метаболитов, извлекаемых из культуральной жидкости хлористым метиленом, был наиболее высоким (40–115 мг/л) при культивировании на полусинтетических средах ДМГ и Сабуро, тогда как при росте A. japonica на синтетических средах М1Д и ЧАВ он был низким (до 20 мг/л). Максимальный выход соединений, извлекаемых этилацетатом, выявлен при культивировании A. japonica на среде ДМГ (275–590 мг/л), тогда как при культивировании грибов на остальных средах ВЭВ в среднем был примерно на одном уровне 130–260 мг/л. Максимальный ВЭВ (80–100 мг/л) неполярной природы отмечен у штаммов 181 и 244 A. japonica при культивировании на ДМГ, максимальный выход этилацетатных экстрактов из культуральной жидкости (более 500 мг/л) отмечен у A. japonica 244 при культивировании на среде Сабуро (табл. 3).
Происхождение штамма гриба и состав жидкой питательной среды оказали достоверный эффект (p < 0.01) на накопление их эндометаболитов, тогда как влияние экстрагента на ВЭВ из мицелия было несущественным. В целом, ВЭВ из мицелия Alternaria spp. был более высоким (примерно в 2 раза) при их культивировании на полусинтетических средах ДМГ и Сабуро, чем на синтетических средах ЧАВ и М1Д. Штамм 239 A. japonica отличался не только слабым ростом, но и низким уровнем накопления эндометаболитов (до 23 мг/л), тогда как штамм 181 A. japonica – максимальным ВЭВ (до 234 мг/л на среде Сабуро). Существенно меньше был ВЭВ экстрактов из мицелия A. japonica 244 и A. tenuissima 253 (табл. 3).
Метаболитные профили экстрактов. Анализ хроматограмм, полученных методом ВЭЖХ–МС, показал высокую степень схожести компонентного состава хлористометиленовых и этилацетатных экстрактов из культуральной жидкости, а также этилацетатных экстрактов из обезжиренного гексаном мицелия различных штаммов A. japonica. Примеры хроматограмм приведены на рис. 4. Гексановые экстракты имели бедный ВЭЖХ-профиль; их анализ методом нормально-фазовой ТСХ показал наличие неполярных соединений и высокое сходство компонентного состава, несмотря на штамм и вид гриба. В таблице 4 приведены некоторые физико-химические свойства компонентов экстрактов, характерных для изучаемых штаммов A. japonica.
Рис. 4.
Типичные хроматограммы некоторых экстрактов из жидких культур различных штаммов Alternaria japonica, полученные методом ВЭЖХ–МС: а – хлористометиленовые экстракты из фильтрата культур на среде М1Д; б – этилацетатные экстракты из обезжиренного мицелия из культур на среде М1Д; в – хлористометиленовые экстракты из фильтрата культур на среде Сабуро; г – этилацетатные экстракты из фильтрата культур на среде Сабуро. Над мажорными пиками указаны молекулярные массы соответствующих веществ.
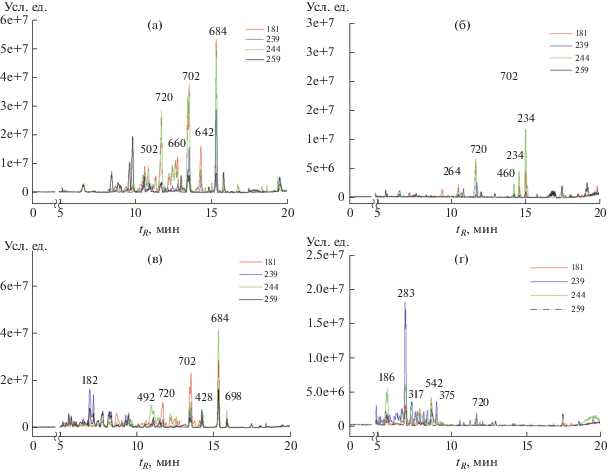
Таблица 4.
Физико-химическая характеристика компонентов экстрактов Alternaria japonica
| Характеристики хроматографического пика | Штамм | Среда: способ получения экстракта4 | ||
|---|---|---|---|---|
| tR, мин | m/z1 | УФ λ макс, нм | ||
| 5.4 | 187 | –2 | 181, 244, 259 | ДМГ и ЧАВ: КЖ/ЭА |
| 7 | 284 | 277 | 181, 239, 244, 259 | Сабуро: КЖ/ЭА |
| 7.4 | 318 | 271 | 181,239,244 | Сабуро: КЖ/ЭА |
| 7.7 | 501 | – | 181, 239, 244, 259 | ДМГ и Сабуро: КЖ/ЭА |
| 8.1 | 198 | – | 181, 239, 244, 259 | ЧАВ, М1Д и Сабуро: М/Г |
| 8.7 | 543 | – | 181, 239 | ДМГ, Сабуро: КЖ/ЭА |
| 9.1 | 269 | 273, 318 | 239, 244, 259 | ЧАВ: КЖ/ХМ |
| 9.5 | 521 | – | 181, 239, 244, 259 | ДМГ: КЖ/ХМ |
| 9.7 | 461 | – | 181, 239, 244, 259 | ДМГ: КЖ/ХМ |
| 9.8 | 223 | – | 181, 239, 244, 259 | ЧАВ: КЖ/ХМ, М1Д: М/Г |
| 10.6 | 503 | – | 181, 239, 244, 259 | М1Д, ДМГ, Сабуро: КЖ/ХМ |
| 11.7 | 721 | – | 181, 239, 244, 259 | ЧАВ, М1Д, ДМГ: КЖ/ХМ М1Д, ДМГ, Сабуро: КЖ/ЭА, ЧАВ, М1Д, ДМГ Сабуро: М/ЭА |
| 12.3 | 603 | – | 181, 239, 244, 259 | ЧАВ, М1Д, ДМГ, Сабуро: КЖ/ХМ |
| 12.7 | 661 | – | 181, 239, 244, 259 | М1Д, ДМГ: КЖ/ХМ |
| 13.6 | 5762 | – | 181, 239, 244, 259 | ЧАВ, М1Д, ДМГ, Сабуро: КЖ/ХМ, Сабуро М/ЭА |
| 14.2 | 429 | – | 181, 239, 244, 259 | Сабуро: КЖ/ХМ |
| 14.3 | 4153 | – | 181, 239, 244, 259 | ЧАВ, М1Д, ДМГ, Сабуро: КЖ/ЭА, М1Д М/ЭА |
| 14.3 | 643 | – | 181, 239, 244, 259 | ЧАВ, М1Д, ДМГ: КЖ/ХМ, |
| 14.6 | 235 | 220, 265, 323 | 239, 244, 259 | ЧАВ: КЖ/ХМ, ЧАВ: М/Г, ЧАВ, М1Д: М/ЭА |
| 15.0 | 235 | 220, 260, 348 | 181, 239, 244, 259 | ЧАВ: КЖ/ХМ, ЧАВ: М/Г, ЧАВ, М1Д: М/ЭА |
| 15.3 | 685 | – | 181, 239, 244, 259 | ЧАВ, М1Д, ДМГ, Сабуро: КЖ/ХМ |
| 15.9 | 699 | – | 181, 239, 244, 259 | ДМГ, Сабуро: КЖ/ХМ |
Основными метаболитами хлористометиленовых экстрактов из культуральной жидкости A. japonica были пики с m/z 721 [М + Н]+, 576 [М – 127]+ и 685 [М + Н]+, соответствующие молекулярной массе веществ 720, 702 и 684 Да соответственно (табл. 4, рис. 4). Два последних соединения, очевидно, отличаются от первого на одну и две гидроксильные группы, что подтверждается их хроматографической подвижностью (tR 11.7, 13.6 и 15.3 мин). При этом, все они схожи фрагментным ионом [M–127]+ и отсутствием поглощения в УФ. Соединение с молекулярной массой 684 Да может быть идентифицировано как брассициколин А, соединение с молекулярной массой 720 Да – как дигидробрассициколин А, – метаболиты гриба A. brassicicola (Schwein.) Wiltshire (Gloer et al., 1988; Pedras, Park, 2015).
В этилацетатных экстрактах из культуральной жидкости A. japonica мажорными были метаболиты с молекулярной массой 186 (tR 5.4 мин), 283 (tR 7.0 мин), 542 (tR 8.7 мин), 520 (tR 9.5 мин), 459 Да (tR 14.3 мин, m/z 415 [M – 45]+, 460 [M + H]+). В этилацетатных экстрактах обезжиренного мицелия из культуральной жидкости преобладали уже отмеченные соединения с m/z 721 и 415, а также два вещества с m/z 235 [M + H]+ (tR 14.6 и 15.0 мин), характеризующиеся в УФ-спектре несколькими полосами поглощения в диапазоне 220–225, 255–260 и 330–340 нм. Эти два соединения с молекулярной массой 234 Да могут быть идентифицированы как фоменин А (= фомапирон А) и фоменин Б, известные у A. brassicicola, A. infectoria E.G. Simmons, Phoma lingam (Tode) Desm. и Ph. tracheiphila (Petri) L.A. Kantsch. et Gikaschvili (Tringali et al., 1993; Pedras et al., 1999; Ivanova et al., 2010; Pedras, Park, 2015).
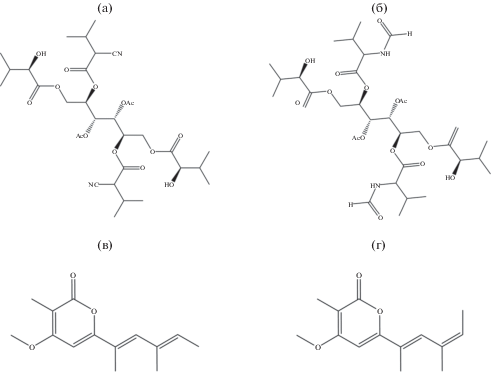
Окончательную идентификацию четырех указанных соединений (брассициколина А, дигидробрассициколина А, фоменинов А и Б) в экстрактах Alternaria japonica можно провести с использованием аналитических стандартов либо дополнительных спектральных методов после очистки (рис. 5). Другие метаболиты A. japonica нами не идентифицированы.
Рис. 5.
Структура метаболитов, идентифицированных в экстрактах A. japonica: а – брассициколин А; б – дигидробрассициколин А; в – фоменин А, г – фоменин Б.
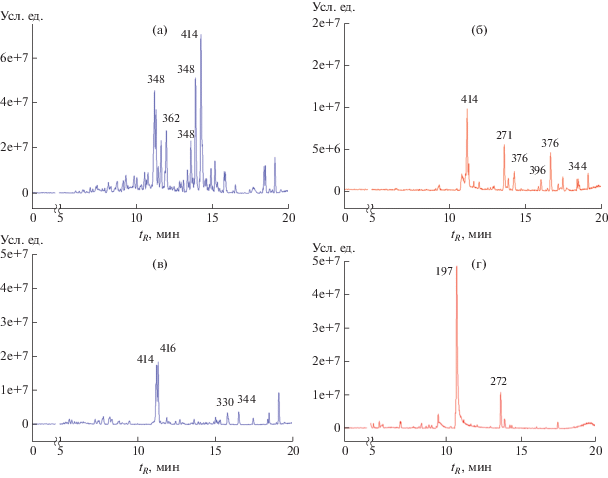
В экстрактах A. tenuissima 253 выявлены ряд известных микотоксинов – тентоксин, дигидротентоксин, тенуазоновая кислота, метиловый эфир альтернариола (соединения с молекулярной массой 414, 416, 197, 272 Да, соответственно), а также соединения, предположительно относящиеся к группе меротерпеноидов, такие как ACTG-токсины и трициклоальтенарены (пики веществ с молекулярной массой 320, 344, 348, 362, 376 Да), точная идентификация которых затруднена из-за наличия изомеров (Kono et al., 1986; Liebermann et al., 1997; Ostry, 2008; Wang et al., 2019). Эти метаболиты не были обнаружены даже в качестве минорных в экстрактах различных штаммов A. japonica.
Фитотоксическая активность. Изученные экстракты из фильтрата жидких культур, использованных в работе Alternaria spp., проявили фитотоксическую активность при тестировании на листьях редиса. В целом, независимо от состава среды и экстрагента экстракты из культуральной жидкости A. tenuissima 253 (при р = 0.05), были достоверно более фитотоксичными, чем экстракты штаммов A. japonica. По данным ВЭЖХ–МС высокотоксичные этилацетатные экстракты из культуральной жидкости A. tenuissima 253 содержали преимущественно тенуазоновую кислоту (культуры на М1Д, ДМГ), в хлористометиленовых экстрактах гриба на М1Д обнаружена сложная смесь неидентифицированных веществ (рис. 6а).
Рис. 6.
Хроматограммы некоторых экстрактов из жидких культур Alternaria tenuissima 253, полученные методом ВЭЖХ–МС: а – хлористометиленовые экстракты из фильтрата культур на среде М1Д; б – этилацетатные экстракты из обезжиренного мицелия из культур на среде М1Д; в – хлористометиленовые экстракты из фильтрата культур на среде Сабуро, г – этилацетатные экстракты из фильтрата культур на среде Сабуро.
По данным дисперсионного анализа происхождение штамма A. japonica не оказывало существенного влияния на фитотоксичность экстрактов из культуральной жидкости. Достоверный эффект (р < 0.01) на этот параметр оказывали состав среды и экстрагент. В целом фитотоксическая активность экстрактов из фильтрата культур на синтетических средах была выше (примерно в 1.2 раза), чем фитотоксичность экстрактов, полученных из культуральной жидкости грибов, выращенных на полусинтетических средах. Этилацетатные экстракты из культуральной жидкости A. japonica были в среднем на 25% более токсичными, чем хлористометиленовые. Взаимодействие факторов “среда” и “экстрагент” было несущественным (р = 0.08), тогда как остальные взаимодействия экспериментальных факторов были достоверными (р < 0.01).
Среди экстрактов A. japonica максимальную фитотоксичность (диаметр некроза около 4.7–5 мм) показали хлористометиленовые и этилацетатные экстракты из фильтрата культур соответственно штаммов 239 и 244, выращенных на синтетических средах ЧАВ и М1Д. При культивировании на полусинтетических средах (в частности, на среде Сабуро), на которых обнаружен высокий выход экстрактивных веществ, максимальную токсичность показали этилацетатные экстракты из культуральной жидкости штаммов 244 и 259 (табл. 5).
Таблица 5.
Фитотоксическая активность 0.5%-х экстрактов из культур штаммов Alternaria japonica и A. tenuissima при культивировании на различных жидких питательных средах на листьях редиса
| Среда | Штамм | Диаметр некроза, мм | |||
|---|---|---|---|---|---|
| Культуральная жидкость1 | Сухой мицелий | ||||
| хлористый метилен | этилацетат | гексан | этилацетат | ||
| ЧАВ | 181 | 3.2 ± 0.8 | 3.5 ± 0.5 | 0 | 0 |
| 239 | 4.8 ± 0.8 | 4.5 ± 0.5 | 0 | 0 | |
| 244 | 3.2 ± 1.2 | 4.7 ± 0.5 | 0 | 3.2 ± 0.8 | |
| 259 | 2.2 ± 1.2 | 4.7 ± 0.5 | 0 | 0 | |
| 253 | 5.0 ± 0.6 | 4.7 ± 0.5 | 0 | 1.8 ± 0.4 | |
| М1Д | 181 | 4.3 ± 1.0 | 3.8 ± 2.0 | 0 | 0 |
| 239 | 4.8 ± 2.5 | 3.8 ± 1.3 | 0 | 1.5 ± 1.0 | |
| 244 | 1.2 ± 1.0 | 5.0 ± 0.9 | 0 | 0 | |
| 259 | 3.3 ± 0.5 | 4.5 ± 0.5 | 0 | 0 | |
| 253 | 5.7 ± 0.8 | 5.5 ± 1.0 | 0 | 1.2 ± 0.8 | |
| ДМГ | 181 | 3.3 ± 1.5 | 2.1 ± 1.0 | 0 | 0 |
| 239 | 2.3 ± 1.9 | 3.2 ± 1.5 | 0 | 0 | |
| 244 | 1.5 ± 1.0 | 3.5 ± 1.0 | 0 | 0 | |
| 259 | 3.3 ± 1.2 | 4.2 ± 1.0 | 0 | 0 | |
| 253 | 2.3 ± 0.8 | 6.3 ± 2.2 | 0 | 0 | |
| Сабуро | 181 | 2.5 ± 0.8 | 2.5 ± 1.4 | 0 | 0 |
| 239 | 2.8 ± 1.0 | 3.3 ± 2.0 | 0 | 0 | |
| 244 | 3.3 ± 1.4 | 4.5 ± 0.8 | 0 | 0 | |
| 259 | 3.2 ± 1.0 | 4.5 ± 1.2 | 0 | 0 | |
| 253 | 4.0 ± 1.3 | 4.3 ± 0.5 | 0 | 1.3 ± 0.5 | |
Гексановые экстракты из мицелия изученных грибов были нефитотоксичными, тогда как некоторые этилацетатные экстракты проявили слабую фитотоксическую активность, среди которых преимущественно были экстракты из мицелия A. tenuissima 253 (табл. 5).
Цитотоксичность. С использованием одноклеточного организма Parametium caudatum оценили цитотоксичность метаболитных комплексов Alternaria japonica. Хлористометиленовые экстракты из культуральной жидкости изученных грибов были нетоксичными или проявили лишь слабую цитотоксичность (экстракты из фильтрата жидких культур штаммов 239 и 259 на среде М1Д). Слабую токсичность проявили также хлористометиленовые экстракты A. tenuissima 253 на М1Д, ДМГ и среде Сабуро. Этилацетатные экстракты Alternaria spp. в исследованной концентрации были нетоксичными (табл. 6).
Таблица 6.
Токсичность 0.01%-х экстрактов из культур штаммов Alternaria japonica и A. tenuissima при культивировании на различных жидких питательных средах в отношении Parametium caudatum
| Среда | Штамм | Степень токсичности экстрактов | |||
|---|---|---|---|---|---|
| Культуральная жидкость | Сухой мицелий | ||||
| хлористый метилен | этилацетат | гексан | этилацетат | ||
| ЧАВ | 181 | – | – | + | ++ |
| 239 | – | – | – | + | |
| 244 | – | – | – | + | |
| 259 | – | – | + | +++ | |
| 253 | – | – | + | +++ | |
| М1Д | 181 | – | – | – | ++ |
| 239 | + | – | – | ++ | |
| 244 | – | – | – | ++ | |
| 259 | + | – | – | +++ | |
| 253 | + | – | – | ++ | |
| ДМГ | 181 | – | – | – | ++ |
| 239 | – | – | – | ++ | |
| 244 | – | – | – | ++ | |
| 259 | – | – | – | ++ | |
| 253 | + | – | – | ++ | |
| Сабуро | 181 | – | – | – | ++ |
| 239 | – | – | ++ | +++ | |
| 244 | – | – | – | ++ | |
| 259 | – | – | – | ++ | |
| 253 | + | – | ++ | ++ | |
Экстракты, полученные гексаном из высушенного мицелия изученных грибов, не проявили цитотоксичности или проявили лишь слабую активность (из мицелия жидкой культуры штаммов 181 и 259 A. japonica на ЧАВ, 239 – на среде Сабуро). Гексановые экстракты из мицелия A. tenuissima 253 также проявили преимущественно слабую степень цитотоксичности: среднюю – при культивировании на среде Сабуро, слабую – на ЧАВ, остальные экстракты были нетоксичными (табл. 6).
Этилацетатные экстракты из мицелия Alternaria spp. были высокотоксичными в исследуемой концентрации. Некоторые из них проявили острую токсичность, вызывая немедленную гибель инфузорий, как, например, экстракты из мицелия A. japonica 259 из культур, выращенных на синтетических средах ЧАВ и М1Д, а также 239 – на среде Сабуро. Этилацетатные экстракты из мицелия A. tenuissima 253 также были высокотоксичными в отношении инфузории-туфельки (табл. 6).
ОБСУЖДЕНИЕ
Выделение, очистка и идентификация природных биологически активных веществ (БАВ) – длительный, трудоемкий и дорогостоящий процесс. Для того, чтобы избежать “бессмысленной” работы, результатом которой являются уже известные и хорошо охарактеризованные соединения, необходима точная видовая идентификация потенциальных продуцентов БАВ и анализ их метаболитного профиля. Это позволяет на основе направленного поиска данных литературы по метаболитам родственных организмов предварительно идентифицировать вещества в экстрактах продуцента-кандидата и предсказывать перспективность обнаружения новых соединений.
Несмотря на наличие у A. japonica таких отличительных признаков как замедленный рост на агаризованных питательных средах, спороношение в виде коротких неразветвленных цепочек конидий и образование хламидоспор, из-за высокого уровня изменчивости микромицетов использование только морфологических параметров может привести к ошибочной видовой идентификации. Так, диаметр и морфология недельных колоний некоторых штаммов A. japonica на среде КМА, а также длина их конидий перекрывалась с этими показателями альтернариоидных грибов секции Alternaria, в частности, A. tenuissima 253 (табл. 2). Молекулярно-генетический метод, основанный на анализе таксономически значимых последовательностей ДНК, хорошо дифференцирует A. japonica от других Alternaria spp. (Woudenberg et al., 2013; Siciliano et al., 2017; Nishikawa, Nakashima, 2020). В данной работе анализ участка гена EF1α позволил уверенно отнести изучаемые штаммы 181, 239, 244 и 259 к A. japonica.
Сравнительный анализ метаболитных профилей экстрактов из культур изучаемых культур, полученных на различных жидких питательных средах, показал, что A. japonica не образует характерные микотоксины мелкоспоровых Alternaria spp. секции Alternaria, в частности: альтернариол, его монометиловый эфир, тенуазоновую кислоту, тентоксин и альтенуен. При этом в культурах A. tenuissima 253 эти микотоксины были обнаружены. Таким образом, A. japonica и A. tenuissima различаются также и по составу образуемых метаболитов. Результаты нашего исследования подтвердили эффективность использования полифазного подхода, основанного на анализе комплекса морфологических, молекулярно-генетических и хемотаксономичеких данных, для дифференциации видов рода Alternaria (Andersen et al., 2008; Da Cruz Cabral et al., 2017; Iturrieta-González et al., 2020). Обнаружение рядом авторов указанных микотоксинов в культурах A. japonica с высокой долей вероятности связано с неправильной видовой идентификацией рабочих штаммов.
К настоящему моменту токсические свойства метаболитов A. japonica только начинают изучаться: получены первые данные по фитотоксичности, цитотоксичности, а также акарицидной и инсектицидной активности экстрактов A. japonica MFP181011, полученных из культур на среде ДМГ (Berestetskiy et al., 2018, 2019). В представленной работе показано, что экстракты из культуральной жидкости всех четырех изученных штаммов A. japonica были фитотоксичными для листьев редиса, но нетоксичными или слаботоксичными для инфузории-туфельки. Этилацетатные экстракты из мицелия различных штаммов A. japonica, напротив, проявили высокий уровень цитотоксичности – на уровне экстрактов из культур A. tenuissima 253.
Культуры одноклеточных простейших, таких как инфузории, используются как индикаторы загрязненности кормов и воды ксенобиотиками, а также как биомаркеры токсичности пестицидов, микотоксинов и метаболитов продуцентов биопестицидов (Altomare et al., 2012; Аndreev et al., 2019). Данных по действию микотоксинов грибов Alternaria на инфузории недостаточно. Известно, что мицелиальные экстракты и культуральная жидкость A. alternata (Fr.) Keissl. токсичны для клеток Paramecium caudatum (Domsch et al., 2007; Pankova et al., 2018). С другой стороны, более десяти поликетидных метаболитов, выделенных из твердой культуры A. sonchi J.J. Davis, были нетоксичными для инфузорий (Dalinova et. al., 2020).
На основании анализа ряда физико-химических характеристик (хроматографическая подвижность, УФ и масс-спектры) и данных литературы в экстрактах A. japonica идентифицированы некоторые мажорные метаболиты, характерные для A. brassicicola и A. infectoria: брассициколин А, дигидробрассициколин А, фоменин А (= фомапирон А) и фоменин Б. Известно, что брассициколин А обладает фитотоксическими свойствами в отношении горчицы Brassica juncea (Pedras et al., 2009). Данные по фитотоксичности фоменинов пока противоречивы: фоменин А вызывал увядание срезанных стеблей томатов в концентрации 200 мкг/мл, в то время как фоменины А и Б были нетоксичны для листьев крестоцветных. При этом, фоменины А и Б токсичны для рачков вида Artemia salina с ЛД50 38 и 31 мкг/мл соответственно (Tringali et al., 1993; Pedras, Yu, 2009). Смесь фоменинов А и Б в соотношении 10 : 1 обладала слабой токсичностью в отношении линии клеток человека MRC-5 (Ivanova et al., 2010); структурно близкие пироны из Xylaria hypoxylon – слабой цитотоксичностью (ЛД50 > 50 мкг/мл) в отношении ряда линий опухолевых клеток человека (Schüffler et al., 2007). Таким образом, можно предположить, что фитотоксические свойства хлористометиленовых экстрактов из культуральной жидкости Alternaria japonica могут быть частично обусловлены доминирующим в них брассициколином А, а токсичность этилацетатных экстрактов из мицелия в отношении инфузорий – за счет фоменинов А и Б.
В экстрактах гриба осталось много неидентифицированных минорных соединений, которые, обладая биологической активностью, также могут играть определенную роль в развитии их продуцента. Вполне вероятно, что они могут являться родственными структурами обнаруженных веществ из групп изоцианидов и пиронов: об этом свидетельствуют как молекулярные массы хроматографических пиков, так и УФ-спектры (табл. 4). Как уже упоминалось выше, экстракты A. japonica обладают инсектицидной и акарицидной активностью. В связи с этим, в дальнейшей работе представляется интересным выделение и очистка известных и неидентифицированных метаболитов этого гриба с последующим определением спектра их биологической активности, включая биотесты с использованием различных видов членистоногих.
Выход экстрактивных веществ из культуральной жидкости и мицелия, комплексность и состав полученных экстрактов определяют объем питательной среды, а также перспективность препаративного выделения и очистки БАВ из культур микромицетов. В данном исследовании показано, что выход хлористометиленовых экстрактов из фильтрата культур A. japonica на синтетических питательных средах (ЧАВ и М1Д) достаточно низкий (около 20 мг/л); при культивировании штаммов A. japonica на полусинтетических питательных средах ДМГ и Сабуро 2–4 раза выше (до 100 мг/л). Выход этилацетатных экстрактов, в которых содержатся неидентифицированные нами соединения, был выше – на уровне около 200 мг/л. Таким невысоким выходом экстрактивных веществ при культивировании на жидких питательных средах характеризуется и A. brassicicola. Так, для выделения минорных метаболитов этого гриба объем питательной среды достигал 50 л, мажорных – 20 л (Pedras et al., 2009; Pedras, Park, 2015; Hu et al., 2018). Поскольку гексановые экстракты из мицелия A. japonica не проявили заметной биологической активности, обработку этим растворителем можно включить как стадию его обезжиривания. Как показали данные по выходу экзометаболитов и оценке фитотоксичности экстрактов для получения брассициколина А и неизвестных более полярных соединений из культуральной жидкости, может быть использован штамм 244 A. japonica при его культивировании на среде Сабуро. Этот же штамм может быть потенциальным продуцентом фоменинов при культивировании на среде М1Д, на которой выход эндометаболитов достигал уровня 100 мг/л среды.
ЗАКЛЮЧЕНИЕ
На основе полифазного подхода – оценки комплекса морфологических признаков, анализа молекулярных и хемотаксономических данных идентифицировано 4 российских штамма A. japonica. Показано, что экстракты из культур этих грибов обладают фитотоксической активностью в отношении листьев редиса и цитотоксичностью в отношении клеток инфузории-туфельки на уровне действия экстрактов гриба A. tenuissima. В экстрактах A. japonica идентифицированы известные у некоторых видов рода Alternaria брассициколин А, дигидробрассициколин А, фоменин А и фоменин Б. Выявленные у A. tenuissima микотоксины (альтернариол, его метиловый эфир, тентоксин, тенуазоновая кислота, альтенуен) в культурах штаммов A. japonica не обнаружены. Анализ токсичности экстрактов и выхода экстрактивных веществ у различных штаммов A. japonica показал, что штамм 244 (MFP244011) может быть использован для продукции как известных, так и предположительно новых токсинов при культивировании на синтетической среде М1Д и полусинтетических жидких питательных средах (например, среде Сабуро).
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90181. Благодарим студента Санкт-Петербургского технологического института А.С. Золотухину за существенную помощь в работе.
Список литературы
Al-lami H.F.D., You, M.P., Barbetti, M.J. Incidence, pathogenicity and diversity of Alternaria spp. associated with Alternaria leaf spot of canola (Brassica napus) in Australia. Plant Pathol. 2018. V. 68 (3). P. 492–503. https://doi.org/10.1111/ppa.12955
Al-lami H.F.D., You M.P., Barbetti M.J. Role of foliage component and host age on severity of Alternaria leaf spot (caused by Alternaria japonica and A. brassicae) in canola (Brassica napus) and mustard (B. juncea) and yield loss in canola. Crop Pasture Sci. 2019a. V. 70 (11). P. 969–980. https://doi.org/10.1071/CP19262
Al-lami H.F.D., You M.P., Mohammed A.E. et al. Virulence variability across the Alternaria spp. population determines incidence and severity of Alternaria leaf spot on rapeseed. Plant Pathol. 2019b. V. 69 (3). P. 506–517. https://doi.org/10.1111/ppa.13135
Altomare C., Pernfuss B., Strasser H. Assessing potential cytotoxicity of biocontrol microorganisms using invertebrate assays beneficial microorganisms in agriculture, food and the environment. In: Sundh I., Wilcks A., Goettel M.S. (eds.). Beneficial microorganisms in agriculture, food and the environment: Safety assessment and regulation. CAB International, Wallingford, 2012, pp. 240–255.
Andersen B., Dongo A., Pryor B.M. Secondary metabolite profiling of Alternaria dauci, A. porri, A. solani, and A. tomatophila. Mycol. Res. 2008. V. 112 (2). P. 241–250.
Andreev V.A., Andreeva E.Yu., Erdniyev L.P. et al. Using the Paramecium caudatum test object to determine acute toxicity of physiologically active substances. Vestnik voenno-meditsinskoy akademii. 2019. V. 66 (2). P. 110–113. https://doi.org/ (in Russ.).https://doi.org/10.17816/brmma25929
Berestetskiy A.O., Dalinova A.A., Dubovik V.R. et al. Analysis and isolation of secondary metabolites of Bipolaris sorokiniana by different chromatography techniques and the spectrum of their biological activity. Prikladnaya biokhimiya i mikrobiologiya. 2020. V. 56 (5). P. 483–496 (in Russ.). https://doi.org/10.31857/S0555109920050050
Berestetskiy A.O., Gannibal Ph.B., Minkovich E.V. et al. Spectrum of biological activity of the Alternaria fungi isolated from the phyllosphere of herbaceous plants. Mikrobiologiya. 2018. V. 87 (6). P. 706–717. (in Russ.).https://doi.org/10.1134/S0026261718060036
Berestetskiy A.O., Inyusheva V.V., Petrova M.O. et al. Insecticidal, acaricidal, and cytotoxic activity of extracts from some phyllosphere fungi and soil hypocrealean micromycetes. Mikologiya i fitopatologiya. 2019. V. 53 (1). P. 17–25 (in Russ.). https://doi.org/10.1134/s0026364819010033
Blagojević J.D., Vukojević J.B., Ivanović Ž.S. Occurrence and characterization of Alternaria species associated with leaf spot disease in rapeseed in Serbia. Plant Pathol. 2020. V. 69 (5). P. 883–900. https://doi.org/10.1111/ppa.13168
Corlett M., Corlett M.E. Alternaria japonica. Can. J. Plant Pathol. 1999. V. 21 (3). P. 298–300.
Da Cruz Cabral L., Rodriguero M., Stenglein S. et al. Characterization of small-spored Alternaria from Argentinean crops through a polyphasic approach. Int. J. Food Microbiol. 2017. V. 257. P. 206–215. https://doi.org/10.1016/j.ijfoodmicro.2017.06.026
Dalinova A.A., Salimova D.R., Berestetskiy A.O. Alternaria fungi as producers of biologically active compounds and bioherbicides. Prikladnaya biohimiya i mikrobiologiya. 2020. V. 56 (3). P. 223–241 (in Russ.).https://doi.org/10.31857/S0555109920030022
Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi. IHW-Verlag, Eching, 2007.
Dutta W., Ray D., Ray P. Molecular characterization and host range studies of indigenous fungus as prospective mycoherbicidal agent of water hyacinth. Indian J. Weed Sci. 2015. V. 47 (1). P. 59–65.
Gannibal Ph.B. Monitoring of alternarioses of crops and identification of fungi of the genus Alternaria. VIZR, St. Petersburg, 2011 (in Russ.).
Gannibal Ph.B. Species of the genus Alternaria revealed in Russia and some neighboring territories. Mikologiya i fitopatologiya. 2015. V. 49 (6). P. 374–385 (in Russ.).
Gilardi G., Demarchi S., Ortu G. et al. Occurrence of Alternaria japonica on seeds of wild and cultivated rocket. J. Phytopathol. 2014. V. 163 (5). P. 419–422. https://doi.org/10.1111/jph.12292
Gilardi G., Gullino M.L., Garibaldi A. Emerging foliar and soil-borne pathogens of leafy vegetable crops: a possible threat to Europe. EPPO Bulletin. 2018. V. 48 (1). P. 116–127. https://doi.org/10.1111/epp.12447
Gloer J.B., Poch G.K., Short D.M. et al. Structure of brassicicolin A: a novel isocyanide antibiotic from the phylloplane fungus Alternaria brassicicola. J. Org. Chem. 1988. V. 53 (16). P. 3758–3761. https://doi.org/10.1021/jo00251a017
Hu Z., Sun W., Li F. et al. Fusicoccane-derived diterpenoids from Alternaria brassicicola: investigation of the structure-stability relationship and discovery of an IKKB inhibitor. Org. Lett. 2018. V. 20 (17). P. 5198–5202. https://doi.org/10.1021/acs.orglett.8b02137
Iturrieta-González I., Pujol I., Iftime S. et al. Polyphasic identification of three new species in Alternaria section Infectoriae causing human cutaneous infection. Mycoses. 2020. V. 63. P. 212–224.
Ivanova L., Petersen D., Uhlig S. Phomenins and fatty acids from Alternaria infectoria. Toxicon. 2010. V. 55 (6). P. 1107–1114. https://doi.org/10.1016/j.toxicon.2009.12.017
Javaid A., Khan I. H., Jabeen K. et al. Evaluation of mycochemical profile of Alternaria japonica through GC-MS analysis. Pakistan J. Phytopathol. 2019. V. 31 (2). P. 171–175. https://doi.org/10.33866/phytopathol.031.02.0537
Javaid A., Mubeen T., Bashir U. et al. Management of Parthenium weed using metabolites of Alternaria japonica. Planta Daninha. 2017. V. 35. https://doi.org/10.1590/s0100-83582017350100016
Kono Y., Gardner J. M., Takeuchi S. Structure of the host-selective toxins produced by a pathotype of Alternaria citri causing brown spot disease of mandarins. Agr. Biol. Chem. 1986.V. 50 (3). P. 801–804. https://doi.org/10.1271/bbb1961.50.801
Liebermann B., Ellinger R., Günther W. et al. Tricycloalternarenes produced by Alternaria alternata related to ACTG-toxins. Phytochemistry. 1997. V. 46 (2). P. 297–303. https://doi.org/10.1016/S0031-9422(97)00278-1
Lou J., Fu L., Peng Y. et al. Metabolites from Alternaria fungi and their bioactivities. Molecules. 2013. V. 18 (5). P. 5891–5935. https://doi.org/10.3390/molecules18055891
Nishikawa J., Nakashima C. Japanese species of Alternaria and their species boundaries based on host range. Plant Fungal. Syst. 2020. V. 5. P. 197–281. https://doi.org/10.3114/fuse.2020.05.13
Ostry V. Alternaria mycotoxins: an overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs. World Mycotoxin J. 2008. V. 1 (2). P. 175–188. https://doi.org/10.3920/WMJ2008.x013
Pankova A.V., Valiullin L.R., Afordoanyi D.V. et al. Identification of phytotoxic and phytopathogenic fungi on grains and wheat seedlings. In: International scientific and practical conference “AgroSMART – Smart solutions for agriculture”. Tyumen, 2018. P. 759–765. https://doi.org/10.2991/agrosmart-18.2018.142
Pedras M.S., Erosa-López C.C., Quail J.W. et al. Phomalairdenone: a new host-selective phytotoxin from a virulent type of the blackleg fungus Phoma lingam. Bioorg. Med. Chem. Lett. 1999. V. 9 (23). P. 3291–3294. https://doi.org/10.1016/s0960-894x(99)00602-2
Pedras M.S.C., Yu Y. Phytotoxins, elicitors and other secondary metabolites from phytopathogenic “blackleg” fungi: structure, phytotoxicity and biosynthesis. Nat. Prod. Commun. 2009. V. 4 (9). P. 1291–1304. https://doi.org/10.1177%2F1934578X0900400927
Pedras M.S.C., Park M.R. Metabolite diversity in the plant pathogen Alternaria brassicicola: factors affecting production of brassicicolin A, depudecin, phomapyrone A and other metabolites. Mycologia. 2015. V. 107 (6). P. 1138–1150. https://doi.org/10.3852/15-054
Pluskal T., Castillo S., Villar-Briones A. et al. MZmine 2: Modular framework for processing, visualizing, and analyzing mass spectrometry-based molecular profile data. BMC Bioinformatics. 2010. V. 11 (1). P. 1–11. https://doi.org/10.1186/1471-2105-11-395
Rahimloo T., Ghosta Y. The occurrence of Alternaria species on cabbage in Iran. Phytotoaxa. 2015. V. 102 (3). P. 343–350. https://doi.org/10.11646/phytotaxa.422.2.4
Schüffler A., Sterne, O., Anke H. Cytotoxic α-pyrones from Xylaria hypoxylon. Z. Naturforsch. C. J. Biosci. 2007. V. 62 (3–4). P. 169–172. https://doi.org/10.1515/znc-2007-3-403
Scott J.K. Raphanus raphanistrum L. – wild radish. In: Julien M., McFadyen R., Cullen J. (eds.). Biological control of weeds in Australia 1960 to 2010. CSIRO Publishing, Collingwood, 2012, pp. 486–492.
Siciliano I., Ortu G., Gilardi G. et al. Mycotoxin production in liquid culture and on plants infected with Alternaria spp. isolated from rocket and cabbage. Toxins. 2015. V. 7 (3). P. 743–754. https://doi.org/10.3390/toxins7030743
Siciliano I., Gilardi G., Ortu G. et al. Identification and characterization of Alternaria species causing leaf spot on cabbage, cauliflower, wild and cultivated rocket by using molecular and morphological features and mycotoxin production. Eur. J. Plant Pathol. 2017. V. 149 (2). P. 401–413. https://doi.org/10.1007/s10658-017-1190-0
Sokornova S.V., Gasich E.L., Bemova V.D. et al. Characterization and identification of naturally transgenic species Linaria vulgaris pathogenic mycromycetes. Ekologicheskaya genetika. 2018. V. 16 (1). P. 27–34. https://doi.org/10.17816/ecogen16127-34
Suemitsu R., Horiuchi K., Horiuchi M. et al. Detection of Tentoxin by Alternaria solani, A. cucumerina, A. bataticola and A. japonica. Biosci. Biotech. Bioch. 1992. V. 56 (1). P. 139–139. https://doi.org/10.1271/bbb.56.139
Tringali C., Parisi A., Piattelli M. et al. Phomenins A and B, bioactive polypropionate pyrones from culture fluids of Phoma tracheiphila. Nat. Prod. Lett. 1993. V. 3 (2). P. 101–106. https://doi.org/10.1080/10575639308043845
Wang J.T., Ma Z.H., Wang G.K. et al. Four meroterpenoids from Alternaria alternata isolated from Paeonia lactiflora. Phytochem. Lett. 2019. V. 31. P. 1–4. https://doi.org/10.1016/j.phytol.2019.03.001
Woudenberg J.H.C., Groenewald J.Z., Binder M. et al. Alternaria redefined. Stud. Mycol. 2013. V. 75. P. 171–212. https://doi.org/10.3114/sim0015
Андреев В.А., Андреева Е.Ю., Эрдниев Л.П. и др. (Andreev et al.) Использование тест-объекта Paramecium caudatum для определения острой токсичности физиологически активных веществ // Вестник Российской военно-медицинской академии. 2019. Т. 66. № 2. С. 110–113.
Берестецкий А.О., Ганнибал Ф.Б., Минкович Е.В. и др. (Berestetskiy et al.) Спектр биологической активности грибов рода Alternaria, выявленных в филлосфере травянистых растений // Микробиология. 2018. Т. 87. № 6. С. 706–717.
Берестецкий А.О., Далинова А.А., Дубовик В.Р. и др. (Berestetskiy et al.) Анализ и выделение вторичных метаболитов гриба Bipolaris sorokiniana различными методами хроматографии и спектр их биологической активности // Прикладная биохимия и микробиология. 2020. Т. 56. № 5. С. 483–496.
Берестецкий А.О., Инюшева В.В., Петрова М.О. и др. (Berestetskiy et al.) Инсектицидная, акарицидная и цитотоксическая активность экстрактов некоторых грибов филлосферы и почвенных гипокрейных микромицетов // Микология и фитопатология. 2019. Т. 53. № 1. С. 17–25.
Ганнибал Ф.Б. (Gannibal) Виды рода Alternaria, обнаруженные в России и на некоторых соседних территориях // Микология и фитопатология. 2015. Т. 49. № 6. С. 374–385.
Ганнибал Ф.Б. (Gannibal) Мониторинг альтернариозов сельскохозяйственных культур и идентификация грибов рода Alternaria. Методическое пособие. СПб.: ВИЗР, 2011. 71 с.
Далинова А.А., Салимова Д.Р., Берестецкий А.О. (Dalinova et al.) Грибы рода Alternaria как продуценты биологически активных соединений и биогербицидов (обзор) // Прикладная биохимия и микробиология. 2020. Т. 56. № 3. С. 1–19.
Сокорнова С.В., Гасич Е.Л., Бемова В.Д. и др. (Sokornova et al.) Поиск и видовая идентификация патогенов природно-трансгенного вида Linaria vulgaris // Экологическая генетика. 2018. Т. 16. № 1. С. 27–34.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


