Микология и фитопатология, 2021, T. 55, № 6, стр. 440-448
О присутствии глютенрасщепляющей активности у штаммов Sodiomyces alkalinus И S. magadiensis
Н. А. Алкин 1, *, Ю. С. Покровская 1, **, М. А. Белозерский 2, ***, А. В. Кураков 1, ****, Г. А. Белякова 1, *****, Я. Е. Дунаевский 2, ******
1 Биологический факультет, Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
2 НИИ физико-химической биологии им. А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова
119992 Москва, Россия
* E-mail: nikita9801@mail.ru
** E-mail: ofbirta@gmail.com
*** E-mail: mbeloz@belozersky.msu.ru
**** E-mail: kurakov57@mail.ru
***** E-mail: adm-ado@yandex.ru
****** E-mail: dun@belozersky.msu.ru
Поступила в редакцию 25.04.2021
После доработки 15.05.2021
Принята к публикации 22.05.2021
Аннотация
Получение безглютеновых продуктов, также как возможность использования специфических протеолитических ферментов с глютенрасщепляющей активностью для пероральной энзимотерапии целиакии, требуют специфических ферментов. Поиск, идентификация и предварительная характеристика таких пептидаз были проведены у двух штаммов алкалофильных видов микроскопических грибов Sodiomyces alkalinus и S. magadiensis. Впервые показано, что у них, наряду со специфическими пролинрасщепляющими активностями дипептидилпептидазы (DPP4) и пролинаминопептидазы (РАР), присутствует постглутаминрасщепляющая активность, что позволяет эффективно гидролизовать как богатые пролином/глутамином пептиды глютена, так и сам глютен. Определены оптимум рН и рН-стабильность исследованных пептидаз и показано, что все охарактеризованные ферменты, расщепляющие пролин/глутамин-содержащие связи, относятся к группе сериновых пептидаз и являются стабильными ферментами в умеренно кислых и щелочных условиях. Наличие такого рода активности указывает на перспективность использования этих пептидаз для получения безглютеновых продуктов и разработки диеты пациентов с непереносимостью глютена.
ВВЕДЕНИЕ
Более 50% потребляемого людьми белка приходится на долю 8 основных злаков: пшеницы, кукурузы, риса, ячменя, овса, сорго, ржи и проса (Cordain, 1999). Белок в зерновках злаков локализован преимущественно в эндосперме и на 75–80% представлен глютеном, или клейковиной. Под этим термином понимают совокупность гликозилированных белков, обогащенных аминокислотными остатками пролина и глутамина. Среди компонентов глютена выделяют две группы белков – проламины и глютелины. Каждый род злаков образует специфические проламины; так, проламины пшеницы называют глиадинами, проламины овса – авенинами, в зерновках ячменя накапливаются гордеины, а в зерновках ржи – секалины (Shewry and Tatham 1990).
Важной особенностью компонентов глютена является выраженная аллергенность некоторых продуктов их неполного гидролиза. Аллергические реакции у людей с непереносимостью глютена проявляются как в форме нарушения процессов всасывания питательных веществ и дефекации, так и в форме повышенного риска развития остеопороза и Т-клеточных лимфом. Данные симптомы и состояния описываются обобщенным диагнозом “целиакия”, называемым также глютеновой энтеропатией, болезнью Ги–Гейтера-Гейбнера или глютенчувствительным спру (Zhuchkov, Kotlyarov, 2017).
Поскольку целиакия является генетически опосредованным заболеванием, комплекс мер поддержки пациентов в первую очередь направлен на обеспечение безглютеновой диеты. Формирование подобной диеты может происходить как путем полного исключения из рациона злаковых продуктов, так и путем их предварительной обработки. Второй подход имеет ряд преимуществ по сравнению с первым, т.к. существенно расширяет разрешенный для пациентов с целиакией набор блюд.
Для очистки злаковых продуктов от аллергенных глютеновых эпитопов можно использовать секретируемые пептидазы бактерий и грибов. На сегодняшний день известны сотни штаммов-продуцентов различных секретируемых пептидаз, однако особенностью глютена является специфический аминокислотный состав с высокой долей пролина и глутамина. Получение безглютеновых продуктов, также как возможность использования специфических ферментов с подобными активностями для пероральной энзимотерапии целиакии требуют ферментов с разными свойствами. Многие пептидазы, применяющиеся в промышленности для изготовления моющих средств или для осветления соков, не могут быть использованы в качестве глютенрасщепляющих агентов. Проведенный анализ имеющихся данных показал, что наиболее вероятными кандидатами, способными эффективно расщеплять глютен и его богатые пролином/глутамином фрагменты, являются пролинспецифичные пептидазы (ПСП), расщепляющие связи, образованные пролином, а также ферменты, гидролизующие связи с участием глутамина. ПСП хорошо изучены у бактерий (Kõiv, Tenson 2021) и животных (Dunaevsky et al., 2020), тогда как у грибов подавляющая часть подобных исследований была сделана с пролилэндопептидазой Aspergillus niger (Stepniak et al., 2006), A. oryzae (Eugster et al., 2015) и Flammulina velutipes (Schulz et al., 2018). Что касается ферментов с постглутаминрасщепляющей активностью, то пока только у бактерий найдены субтилизин-подобные пептидазы (СПП), обладающие такой активностью (Wei et al., 2016; Darwish et al., 2019). Интересными для поиска новых секретируемых пептидаз, причем не только щелочеустойчивых, являются грибы щелочных местообитаний. Недавно получены сведения, что алкалофильный вид Sodiomyces alkalinus (Plectosphaerellaceae), обитающий в грунтах щелочных озер, усваивают преимущественно белковые субстраты, в том числе и трудно гидролизуемые, в то время как хитиназы и пектиназы у него оказались утрачены (Grum-Grzhimaylo et al., 2018).
Целью настоящей работы был поиск, идентификация и предварительная характеристика пептидаз с глютен-расщепляющей активностью у алкалофильных микромицетов S. alkalinus и S. magadiensis.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы. Исследовали штаммы S. alkalinus F11 и S. magadiensis B39 из коллекции кафедры микологии и альгологии МГУ.
Биоинформатическое сравнение аминокислотных последовательностей ПСП и СПП S. alkalinus F11 с гомологами в геномах других высших грибов. В секвенированных геномах, включая геном S. аlkalinus, из базы данных NCBI, включающих представителей всех 6 подотделов высших грибов, а также представителей различных морфологических групп (дрожжи, мицелиальные грибы, лихенизированные грибы) и эколого-трофических групп (гумусовые сапротрофы, ксилотрофы, фитопатогены, энтомопатогены), проведен поиск гомологов известных ПСП и СПП по аминокислотным последовательностям при помощи сервиса Protein Blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi). В качестве порога отсечения были приняты E-value 1 × × 10–20 и покрытие 75%. Для каждого гомолога были рассчитаны следующие параметры: молекулярная масса, число аминокислот и изоэлектрическая точка при помощи онлайн-ресурса Isoelectric point calculator (http://isoelectric.org/calculate.php); наличие, размер и положение сигнального пептида и трансмембранного домена (сервисы SignalP-5.0 и TMHMM Server v. 2.0, http://www.cbs.dtu.dk/services/). После этого аминокислотные последовательности обнаруженных гомологов пептидаз были выравнены при помощи сервиса Cobalt (https://www.ncbi.nlm.nih.gov/tools/cobalt/cobalt.cgi). В сервисе Batch (https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi) был проведен поиск консервативных доменов изучаемых гомологов пептидаз. В случае обнаружения последовательностей, имеющих высокую гомологию к нескольким аннотированным белкам, был использован сервис EFI-EST (https://efi.igb.illinois.edu/efi-est/), осуществляющий кластерный анализ на основе попарного сравнения всех последовательностей без предварительного выравнивания.
Питательные среды и условия культивирования. Щелочная ферментационная среда (ЩФС), pH 10.3, включала минеральный компонент щелочного мальт-агара (ЩА) и три модификации питательного компонента ЩА для изготовления жидких сред, отличающихся источником белка (200 мл солодового экстракта (15° по шкале Баллинга), 10.0 г казеина или 10.0 г пептона). Образцы культур хранили на скошенном ЩА при температуре 4°С. Для работы агаризованные блоки с поверхностным мицелием со скошенного агара пересевали в колбы Эрленмейера объемом 150 мл, содержащие 50 мл жидкой ЩФС. Колбы помещали на орбитальную качалку при 25°С, скорость вращения составляла 250 об./мин.
Получение фильтрата культуральной жидкости и определение сухой массы мицелия. После инкубации на орбитальной качалке мицелий отделяли двойной фильтрацией через предварительно взвешенную фильтровальную бумагу, после чего отфильтрованная жидкость очищалась повторно при помощи центрифугирования (6000 об./мин, 10 мин). Для предотвращения развития контаминантов в полученный фильтрат добавляли 8%-й азид натрия (2.5 мкл/мл NaN3). Фильтраты хранили при 4°С. Фильтровальную бумагу с мицелием помещали в сушильный шкаф, доводили до постоянного веса при 60°С, после чего взвешивали и рассчитывали сухую массу мицелия вычитанием исходной массы бумаги.
Измерение активности сериновых пептидаз. Для измерения активности пептидаз в тестируемом фильтрате использовали метод спектрофотометрии. В лунку 96-луночного полистиролового планшета для иммуноферментного анализа помещали 175 мкл универсального буфера (УБ) с заданным pH, затем добавляли 20 мкл исследуемого фильтрата и 5 мкл хромогенного субстрата, несущего п-нитроанилидную метку (λ = 405 нм). Общий объем реакционной смеси в каждой лунке планшета составлял 200 мкл. В контрольных лунках культуральную жидкость заменяли на 20 мкл УБ. Планшеты с реакционной смесью инкубировали в спектрофотометре ELx800 при 37°С от 45 до 120 мин в режиме кинетического анализа оптической плотности (λ = 405 нм); измерение оптической плотности реакционной смеси проводили каждые 10 минут. В работе со спектрофотометром использовали программное обеспечение Gen5 BioTek, полученные данные были обработаны в программе MO 365.
Был использован ряд специфических хромогенных субстратов, на C-конце которых расположена п-нитроанилидная метка, а именно: Ala-Pro-pNa, Pro-pNa и Glp-Phe-Gln-pNA в концентрации 10 мМ, а также флуорогенные субстраты Abz-LPYPQPQLPQ-EDDnp и Abz-QPQQPFPQ-EDDnp в концентрации 2 мМ. Все перечисленные субстраты были растворены в диметилформамиде. Измерение интенсивности флуоресценции проводили при помощи флуориметра на черных полистироловых планшетах (λ1 = 340 нм, λ2 = 400 нм); в опыте использовали аналогичный объемный состав реакционной смеси. За единицу ферментативной активности (ед.) принимали такое количество фермента в расчете на 1 мг сухой массы мицелия, которое при гидролизе субстрата в указанных условиях инкубации вызывало за 1 час увеличение оптической плотности раствора при 405 нм на 0.01.
Определение оптимума pH активности пептидаз. В лунку полистиролового планшета вносили 20 мкл раствора, содержащего исследуемую пептидазу, 175 мкл универсального буфера (УБ) (Britton, Robinson, 1931) подобранной кислотности для придания необходимого pH (pH 2.0–11.0) и 5 мкл хромогенного субстрата. Полученную реакционную смесь измеряли на спектрофотометре по описанной выше процедуре.
Определение pH-стабильности пептидаз. В лунку полистиролового планшета вносили 20 мкл раствора, содержащего исследуемую пептидазу и заданный объем 0.01 М УБ подобранной кислотности для придания необходимого pH (pH 2.0–13.0). Полученный раствор инкубировали 60 минут при постоянном перемешивании на качалке (300 об./мин), после чего вносили 0.1 М УБ с подобранным pH до объема 195 мл и получения pH инкубационной смеси 7.5 (оптимум pH работы пептидаз из предыдущего эксперимента), перемешивали, добавляли 5 мкл хромогенного субстрата и проводили кинетический анализ ферментативной реакции на спектрофотометре.
Изучение влияния ингибиторов на активность пептидаз. Были использованы специфические ингибиторы пептидаз различных классов и групп, как-то: фенилметилсульфонил фторид (PMSF), ЭДТА-Na2, йодацетамид, Ala-Pro-N-метил-2-пирролидон (АР-NMP), Ala-D-Pro-N-метилформамид (АР-MF), Ala-D-Pro-пипеколовая кислота (АР-Pip), вилдаглиптин, ситаглиптин, дипротин А, дипротин B. В одну лунку планшета вначале помещали 20 мкл исследуемого фильтрата, 170 мкл УБ (pH 7.5) и 5 мкл стокового раствора ингибитора (ЭДТА-Na2, йодацетамид – 10–2 М, все остальные 10–3 М). Полученную смесь инкубировали при комнатной температуре в течение 20 мин, после чего вносили 5 мкл хромогенного субстрата и проводили кинетический анализ ферментативной реакции.
Определение активности пептидаз в отношении глиадина. 1 мг глиадина растворяли в 1 мл 70%-го этанола, затем добавляли к раствору 500 мкл УБ с pH 8.0 и 50 мкл культуральной жидкости. В контрольном опыте к исходному раствору глиадина добавляли 480 мкл УБ, 20 мкл 1 мМ PMSF и 50 мкл культуральной жидкости. После центрифугирования 10 мкл реакционной смеси отбирали в нулевой момент времени и проводили нингидриновую реакцию, остальную часть ресуспендировали и инкубировали при 23°C в течение 12 ч на шейкере. После инкубации реакционную смесь вновь центрифугировали, отбирали 10 мкл реакционной смеси и повторяли измерение. Для определения концентрации свободных аминокислот и пептидов к 10 мкл реакционной смеси добавляли 190 мкл 0.1%-го р-ра нингидрина в этаноле, после чего инкубировали в течение получаса при температуре 80°С. Измерение оптической плотности проводили на спектрофотометре при λ = 545 нм.
Все эксперименты были проведены в 3-кратной повторности. Рассчитаны средние значения активности пептидаз и стандартные отклонения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ аннотированного генома S. alkalinus F11 указывает на присутствие 10 гомологов сериновых пролинспецифичных пептидаз (ПСП) и субтилизин-подобных пептидаз (СПП). Среди обнаруженных гомологов две последовательности принадлежат к группе дипептидилпептидаз (DPP4) (табл. 1). Первая последовательность (ROT37187.1) соответствует белку длиной 947 аминокислот, содержащему трансмембранный участок; вторая последовательность (ROT38925.1) лишена трансмембранного участка, но содержит классический сигнальный пептид. pI этих последовательностей составляют 4.80 и 4.66; молекулярные массы – 106.0 и 87.5 кДа. Оба гомолога содержат в своем составе консервативный домен DPP_IV на N-конце и домен Peptidase_S9 с пептидазной активностью на C-конце. В обоих случаях последовательности содержат консервативную триаду аминокислот, необходимую для катализа.
Таблица 1.
Гомологи сериновых ПСП и СПП Sodiomyces alkalinus F11
| Белок | Семейство | Номер в GenBank | АО | Mr, Да | pI | SP | TM | Консервативные домены | Последовательности аминокислот вокруг остатков каталитической триады | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| DPP4 | S9B | ROT37187.1 | 947 | 106 022 | 4.80 | – | +(110–132) | DPPIV_N (247–625) Peptidase_S9 (707–914) |
WGWSFGG | GVADDNV | DSDHSIY |
| DPP4 | S9B | ROT38925.1 | 782 | 87 461 | 4.66 | +(1–26) | – | DPPIV_N (110–470) Peptidase_S9 (554–759) |
FGWSYGG | GLGDDNV | DSDHSIV |
| PAP | S33 | XP_028465097.1 | 388 | 39 236 | 4.60 | – | – | Abhydrolase (73–323) | FGQSFGG | SSADWPA | MMYHNAL |
| PEP | S28 | ROT41790.1 | 399 | 44 752 | 4.62 | – | – | Abhydrolase (4–361) | MGGSYPG | GENDPWI | GGNHVPD |
| Sub | S8 | XP_028463943.1 | 476 | 53 183 | 5.64 | +(1–16) | – | Inhibitor_I9 (43–108) Peptidases_S8_PCSK9 (118–371) |
YVVDTGI | GDGHGTH | SGTSMAS |
| PrtK | S8 | XP_028467389.1 | 406 | 42 152 | 5.71 | +(1–20) | – | Inhibitor_I9 (43–121) Peptidases_S8_PCSK9 (133–383) |
YVIDTGI | TNGHGTH | SGTSMAS |
| PrtK | S8 | XP_028465997.1 | 401 | 41 747 | 6.05 | +(1–18) | – | Inhibitor_I9 (33–111) Peptidases_S8_PCSK9 (122–375) |
YVVDSGI | SLGHGTH | SGTSMAA |
| PrtK | S8 | XP_028468757.1 | 524 | 56 136 | 5.04 | +(1–20) | – | Inhibitor_I9 (44–136) Peptidases_S8_PCSK9 (154–431) |
YIIDTGT | GNGHGTH | SGTSMAS |
| Pyr | S8 | XP_028470351.1 | 908 | 97 630 | 4.72 | +(1–16) | – | Inhibitor_I9 (50–109) Peptidases_S8_5 (133–605) PA_PoS1_like (327–459) fn3_6_superfamily (601–724) |
GVVDTGI | YGGHGTH | SGTSMAC |
| Kex | S8 | XP_028467150.1 | 866 | 94 870 | 5.02 | +(1–18) | +(726–748) | Peptidases_S8_kexins (151–437) P_proprotein (522–608) |
AIVDDGL | DDRHGTR | GGTSAAA |
Примечание: АО – число аминокислотных остатков; DPP4 – дипептидилпептидаза 4, Kex – кексин, Mr – молекулярная масса, PEP – пролилэндопептидаза, pI – изоэлектрическая точка, PrtK – протеиназа K; Pyr – пиролизин; SP – сигнальный пептид, Sub – субтилизин, TM – трансмембранный участок. Жирным шрифтом выделены аминокислотные остатки консервативной триады.
Обнаруженный у S. alkalinus F11 один гомолог пролинаминопептидазы (PAP) (XP_028465097.1) длиной 388 аминокислотных остатков содержит домен суперсемейства альфа/бета-гидролаз и лишен сигнального пептида и трансмембранного участка. pI PAP составляет 4.60, молекулярная масса – 39.2 кДа.
Гомолог пролилэндопептидазы (PEP) (ROT41790.1) состоит из 399 аминокислотных остатков с молекулярной массой 44.8 кДа. Как и другие гомологи кислой эндопептидазы Aspergillus niger, у данного фермента pI в кислой области (pH 4.6). Последовательность PEP состоит из единственного домена суперсемейства альфа/бета-гидролаз и не содержит сигнального пептида и трансмембранного участка. Консервативная триада аминокислот представлена в полном объеме.
В геноме Sodiomyces alkalinus F11 обнаружен также целый ряд гомологов СПП. Среди них можно выделить 3 гомолога протеиназы K (XP_028467389.1, XP_028465997.1 и XP_028468757.1), которые содержат N-концевой сигнальный пептид и не содержат трансмембранного домена. Молекулярная масса варьирует от 41.7 до 56.1 кДа, pI – от 5.04 до 6.5. Данные последовательности содержат два консервативных домена: N-концевой ингибирующий домен Inhibitor_I9 и каталитический домен Peptidases_S8_PCSK9. Порядок консервативных аминокислотных остатков соответствует таковому у других СПП. Одна аминокислотная последовательность S. alkalinus F11 соответствует субтилизину (XP_028463943.1). Данная последовательность содержит 476 аминокислотных остатков и имеет молекулярную массу 53.2 кДа. Изоэлектрическая точка данного белка, согласно расчетам, составляет 5.64. Доменная структура субтилизина совпадает с таковой у протеиназы K. Последовательность XP_028470351.1 является гомологом пиролизина из группы СПП. Данный белок, согласно расчетам, состоит из 908 аминокислот и имеет молекулярную массу 97.6 кДа. Изоэлектрическая точка пиролизина составляет 4.72. В составе данной последовательности выделяется 4 консервативных домена: N-концевой ингибиторный домен Inhibitor_I9, крупный каталитический домен Peptidases_S8_5, расположенный внутри него специфический для грибов домен PA_PoS1_like и C-концевой домен из суперсемейства fn3_6. Наличие в составе последовательности пиролизина сигнального пептида может свидетельствовать о секреции данного фермента. И, наконец, в геноме S. alkalinus F11 среди SLP обнаружен один гомолог кексина (XP_028467150.1). В составе данного фермента 866 аминокислот, из которых 18 приходится на сигнальный пептид, а с 726 по 748 остатки образуют трансмембранный участок. Рассчитанная изоэлектрическая точка данного кексина составляет 5.02. Белок имеет двухдоменную структуру и состоит из N-концевого каталитического домена Peptidases_S8_kexins и C-концевого домена P_proprotein, характерного для пропротеиновых конвертаз.
Присутствие in vivo пролинрасщепляющей и постглутамингидролизующей активностей в культуральной жидкости S. аlkalinus F11 и S. magadiensis B39 было подтверждено использованием специфических пролин/глутаминсодержащих субстратов (табл. 2). Наличие у этих грибов активности в отношении субстрата Pro-pNA свидетельствует о присутствии в культуральной жидкости PAP, Ala-Pro-pNA является специфическим субстратом для DPP4, а субстрат Glp-Phe-Gln-pNA детектируют наличие в культуральной жидкости постглутамин-расщепляющей активности.
Таблица 2.
Ферментативная активность Sodiomyces magadiensis B39 и S. alkalinus F11 (в единицах активности)
| Штаммы/субстраты | S. magadiensis B39 | S. alkalinus F11 |
|---|---|---|
| Pro-pNA | 192 | 157 |
| Ala-Pro-pNA | 665 | 637 |
| Glp-FQ-pNA | 452 | 393 |
| Abz-QPQQPFPQ-EDDnp | 169 | 136 |
| Abz-LPYPQPQLPQ-EDDnp | 204 | 173 |
Подбор оптимальной питательной среды с точки зрения секреции сериновых пептидаз показал, что секреция DPP4 наблюдается на всех вариантах ЩФС, причем наибольшая активность фермента обнаруживается в присутствии пептона или казеина в качестве источника азота и углерода. На среде с суслом активность секретируемой DPP4 была более чем в 2–3 раза ниже (рис. 1). В дальнейшем в качестве основной среды была использована среда ЩФС с добавлением пептона.
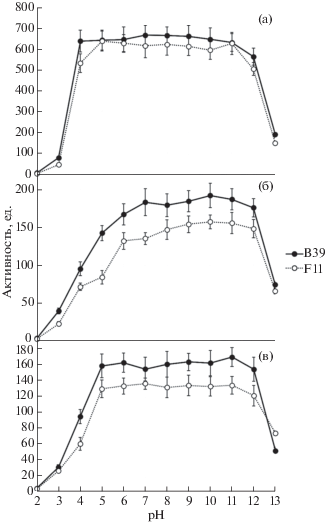
Рис. 1.
Активность DPP4 в культуральной жидкости штаммов Sodiomyces аlkalinus F11 и S. magadiensis B39, растущих на различных средах (отрезками на рисунках обозначены границы доверительного интервала средней арифметической активности DPP4 на 95%-м уровне значимости).

Изучение зависимости величины секретируемой активности от срока культивирования выявило типичную логистическую кривую динамики роста сухой массы. Лаг-фаза у S. alkalinus F11 длилась 4 дня с момента инокуляции; на 5–18 сутки наблюдался наиболее активный рост мицелия, после чего кривая роста сухой массы мицелия начинала выходить на плато. В начале роста на жидкой среде сериновые пептидазы экспрессировались в незначительном количестве, наибольший уровень секреции пептидазы DPP4 осуществлялся на 14-е сутки культивирования при переходе из фазы экспоненциального роста в стационарную фазу. Далее удельная активность DPP4 в культуральной жидкости медленно снижалась.
DPP4 и РАР S. alkalinus F11 и S. magadiensis B39 проявляют наибольшую активность в области pH 8 (рис. 2, а, б). При pH 5 DPP4 теряет больше 90% активности, зато при pH 9 сохраняет 70% от максимальной активности, а при рН 10–40%. Обнаруженный слабощелочной оптимум действия DPP4 согласуется с данными, полученными на гомологичных белках других грибов (Doumas et al., 1998; Cooper, Woods, 2009). Активность РАР менее устойчива к изменениям рН: так, при рН 6.0 сохраняется 23% максимальной активности, а при рН 9.0 – до 40%. При рН 5.0 активность РАР практически не определяется (рис. 2, б). Полученные значения ставят гомологи PAP S. alkalinus F11 в один ряд с известными PAP Aspergillus niger и Talaromyces emersonii, оптимальным условием работы которых является область pH 7.0–7.5 (Basten, Moyers, 2005; Mahon et al., 2009).
Рис. 2.
Зависимость активностей DPP4 (а), РАР (б) и РGC (в) у штаммов Sodiomyces аlkalinus F11 и S. magadiensis B39 от pH.

Постглутаминрасщепляющая (РGC, рostglutamine-cleaving) активность также достигает наибольшей величины при pH 8 (рис. 2, в). В отличие от DPP4 и PAP, эта активность сохраняет способность к гидролизу субстрата в сильнощелочных условиях, сохраняя при pH 11 до 45% активности, небольшая активность детектируется также при pH 4. Оптимум pH исследованной PGC близок к таковому у Fusarium equisetii (Juntunen et al., 2015).
рН стабильность исследуемых пептидаз заметно шире их рН оптимума. DPP4 сохраняют относительно высокую стабильность в сильнощелочных условиях и в кислых условиях до рН 4.0. Значительная инактивации DPP4 происходит в области pH 3 (свыше 90%) (рис. 3, а). Ферменты Sodiomyces magadiensis B39 и S. alkalinus F11 при инкубации при pH 12 сохраняли до 85% от максимальной активности и до 30% активности после часового воздействия при pH 13.
PAP изученных штаммов подвержены большей инактивации в области pH 4–6 по сравнению с DPP4. Однако они также устойчивы, как и DPP4, при инкубации в среде с pH 13 (рис. 3, б). Подобные закономерности наблюдаются и в случае РGC пептидаз. В то же время эти пептидазы являются наиболее кислотоустойчивыми из изученных ферментов, практически сохраняют исходную активность в диапазоне pH 5–12 и около 60% при инкубации при pH 4 и около 20% – при pH 3 (рис. 3, в). Таким образом, секретируемые специфические пептидазы изученных штаммов содариомицетов несколько различаются между собой, но демонстрируют сходные профили оптимумов рН и pH-устойчивости.
Определение эффективности подавления активности изучаемых ферментов различными специфическими ингибиторами показало, что наибольшее ингибирующее влияние на DPP4 оказывают PMSF, специфический ингибитор сериновых пептидаз, а также вилдаглиптин и дипротин А, широко используемые для ингибирования DPP4. В присутствии 5 мкл 1мМ вилдаглиптина и дипротина А активность DPP4 снижалась до активности 3–7% от контроля. Пептидаза умеренно ингибировалась дипротином B (активность составляла 50% от исходной); слабое ингибирующее действие на DPP4 также оказывал ситаглиптин (остаточная активность 90%). Йодоацетамид, ЭДТА, AP-MF, AP-NMP и AP-Pip практически не влияли на активность DPP4 (остаточная активность – 98–100%).
Анализ влияния специфических ингибиторов на активность PAP показал, что наиболее эффективно данный фермент ингибировался PMSF (остаточная активность 10%); конкурентные ингибиторы PSP (AP-MF, AP-NMP и AP-Pip) также вызывали некоторое снижение активности РАР (остаточная активность – 85–97%), тогда как йодоацетамид и ЭДТА не ингибировали активность PAP. На постглутаминрасщепляющую активность, измеряемую по специфическому субстрату Glp-FQ-pNA, наибольшее влияние оказывал необратимый ингибитор сериновых пептидаз PMSF, под действием которого активность снижалась до 8% от контроля. Конкурентные ингибиторы ПСП, а также ингибиторы несериновых пептидаз не оказывали на постглутамин-расщепляющую активность существенного влияния (максимальное снижение – 2–5% активности).
Найденные ферменты были способны гидролизовать, как пептиды Abz (п-аминобензойная кислота)-QPQQPFPQ-EDDnp и Abz-LPYPQPQLPQ-EDDnp, моделирующие иммуногенные пептиды гладинов (табл. 1), так и сами трудно гидролизуемые глиадиновые белки (рис. 4). Наибольшая активность обнаружена у ферментов S. magadiensis B39. При добавлении к реакционной смеси 20 мкл 1 мМ PMSF глиадин-расщепляющая активность изученных штаммов существенно снижалась (на 70–75%).
На долю секретируемых сериновых пептидаз у штаммов S. alkalinus F11 и S. magadiensis B39 приходится, по меньшей мере, до 2/3 общей глиадингидролизующей активности. За оставшуюся часть активности, участвующей в гидролизе белков, обогащенных глутамином и пролином, по-видимому, ответственны пептидазы других классов.
ЗАКЛЮЧЕНИЕ
Известен ограниченный спектр микробных препаратов с глютенрасщепляющей активностью. Так, для полного гидролиза иммуногенного 33-мерного пептида глиадина требуется набор пептидаз молочнокислых бактерий Lactobacillus sanfranciscensis, L. alimentarius, L. brevis, L. hilgardii (De Angelis et al. 2010). Для детоксикации глютена в пищевых продуктах используется ферментный препарат на основе аспергилопепсина Aspergillus niger и DPP 4 из A. oryzae (Ehren et al. 2009).
В проведенной работе впервые показано, что у Sodiomyces alkalinus F11 и S. magadiensis B39, наряду со специфическими пролинрасщепляющими активностями, присутствует постглутаминрасщепляющая активность, что позволяет им эффективно гидролизовать как богатые пролином/глутамином пептиды глютена, так и сам глютен. Эти ферменты относятся к группе сериновых пептидаз и являются стабильными ферментами в умеренно кислых и щелочных условиях. Наличие такого рода активности у исследованных штаммов, возможно, позволит расширить применение пептидаз грибов для производства безглютеновых продуктов и разработки диеты для пациентов с непереносимостью глютена.
Работа выполнена при поддержке гранта РФФИ № 19-04-00852_а.
Список литературы
Basten D.E.J.W., Moers A.P.H.A., van Ooyen A.J.J. et al. Characterisation of Aspergillus niger prolyl aminopeptidase. Mol. Genetics and Genomics. 2005. V. 272 (6). P. 673–679.
Britton H.T.S., Robinson R.A. Universal buffer solutions and the dissociation constant of veronal. J. Chem. Soc. 1931. P. 1456–1462.
Cooper K.G., Woods J.P. Secreted dipeptidyl peptidase IV activity in the dimorphic fungal pathogen Histoplasma capsulatum. Infection and immunity. 2009. V. 77 (6). P. 2447–2454.
Cordain L. Cereal grains: humanity’s double-edged sword. World Rev. Nutr. Diet. 1999. V. 84. P. 19–73.
Darwish G., Helmerhorst E.J., Schuppan D. et al. Pharmaceutically modified subtilisins withstand acidic conditions and effectively degrade glutenin vivo. Sci. Rep. 2019. V. 9. P. 7505.
De Angelis M., Cassone A., Rizzello C. et al. Mechanism of degradation of immunogenic gluten epitopes from Triticum turgidum L. var. durum by sourdough lactobacilli and fungal proteases. Appl. Envir. Microbiol. 2010. V. 76. P. 508–518.
Doumas A., van der Broek P., Affolter M. et al. Characterization of the prolyl dipeptidyl peptidase gene (dppIV) from the koji mold Aspergillus oryzae. Appl. Envir. Microbiol. 1998. V. 64 (12). P. 4809–4815.
Dunaevsky Y.E., Tereshchenkova V.F., Oppert B. et al. Human proline specific peptidases: A comprehensive analysis. Biochim. Biophys. Acta. 2020. V. 1864 (9). P. 129636.
Ehren J., Moron B., Martin E. et al. A food-grade enzyme preparation with modest gluten detoxification properties. PLoS One. 2009. V. 4 (7). e6313.
Eugster P.J., Salamin K., Grouzmann E. et al. Production and characterization of two major Aspergillus oryzae secreted prolyl endopeptidases able to efficiently digest proline-rich peptides of gliadin. Microbiology. 2015. V. 161 (12). P. 2277–2288.
Fujinami S., Fujisawa M. Industrial applications of alkaliphiles and their enzymes – past, present and future. Envir. Technol. 2010. V. 31. P. 845–856.
Grum-Grzhimaylo A.A., Falkoski D.L., van den Heuvel J. et al. The obligate alkalophilic soda-lake fungus Sodiomyces alkalinus has shifted to a protein diet. Molec. Ecol. 2018. V. 27 (23). P. 4808–4819.
Juntunen K., Mäkinen S., Isoniemi S. et al. A new subtilase-like protease deriving from Fusarium equiseti with high potential for industrial applications. Appl. Biochem. Biotechnol. 2015. V. 177 (2). P. 407–430.
Kõiv V., Tenson T. Gluten-degrading bacteria: availability and applications. Appl. Microbiol. Biotechnol. 2021. V. 105 (8). P. 1–15.
Mahon C.S., O’Donoghue A.J., Goetz D.H. et al. Characterization of a multimeric, eukaryotic prolyl aminopeptidase: an inducible and highly specific intracellular peptidase from the non-pathogenic fungus Talaromyces emersonii. Microbiology. 2009. V. 155 (11). P. 3673–3682.
Schulz K., Giesler L., Linke D. et al. A prolyl endopeptidase from Flammulina velutipes for the possible degradation of celiac disease provoking toxic peptides in cereal proteins. Process Biochem. 2018. V. 73. P. 47–55.
Shewry P.R., Tatham A.S. The prolamin storage proteins of cereal seeds: structure and evolution. Biochem. J. 1990. V. 267. P. 1–12.
Stepniak D., Spaenij-Dekking L., Mitea C. et al. Highly efficient gluten degradation with a newly identified prolyl endoprotease: implications for celiac disease. Am. J. Physiol. Gastrointest. Liver Physiol. 2006. V. 291 (4). P. G621–G629.
Wei G., Tian N., Siezen R. et al. Identification of food-grade subtilisins asgluten-degrading enzymes to treat celiac disease. Am. J. Physiol. Gastrointest. Liver Physiol. 2016. V. 311. P. G571–G580.
Zhuchkov M.V., Kotlyarov S.N. Cutaneous manifestations of celiac disease: what a practicing gastroenterologist needs to know? Consilium Medicum (Gastroenterology). 2017. V. 19. P. 45–51 (in Russ.).
Жучков М.В., Котляров С.Н. (Zhuchkov, Kotlyarov) Кожные проявления целиакии: что нужно знать практикующему врачу-гастроэнтерологу? // Consilium Medicum (Gastroenterology) 2017. Т. 19. С. 45–51.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология