Микология и фитопатология, 2021, T. 55, № 6, стр. 449-456
Тромболитическая активность и свойства препарата протеиназ, образуемых микромицетом Tolypocladium inflatum k1
Н. С. Фокичев 1, *, Е. И. Корниенко 1, **, Т. С. Шаркова 1, ***, В. Г. Крейер 1, ****, А. А. Осмоловский 1, *****
1 Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
* E-mail: fokichev.n@mail.ru
** E-mail: aljnka-93@mail.ru
*** E-mail: sharkova06@mail.ru
**** E-mail: vkreyer@yandex.ru
***** E-mail: aosmol@mail.ru
Поступила в редакцию 12.04.2021
После доработки 12.05.2021
Принята к публикации 22.05.2021
Аннотация
Изучены биохимические свойства и тромболитический потенциал препарата протеиназ, а также его отдельных фракций, полученных после изоэлектрофокусирования, образуемого штаммом микромицета Tolypocladium inflatum k1. Показано, что во фракциях после изоэлектрофокусирования наблюдается более выраженная фибринолитическая и активаторная к плазминогену активность, а также протеолитическая активность в отношении некоторых субстратов (субтилизин-подобная и эластазная), что может быть использовано для разработки новых тромболитических препаратов или диагностикумов на патологии системы гемостаза человека.
ВВЕДЕНИЕ
Тромболитическая терапия – неотъемлемая часть лечения и профилактики различных заболеваний, ассоциированных с патологиями сердечно-сосудистой системы и системы гемостаза человека. Она находит применение в целом комплексе состояний, ассоциированных с тромбозами, в постоперационном периоде, реанимационных мероприятиях и облегчении тяжелых тромботических осложнений, индуцированных бактериальными и вирусными инфекциями (в том числе, при лечении осложнений при COVID-19). Поиск современных, специфичных и безопасных тромболитических субстанций является важной и актуальной задачей медицины и биотехнологии (Kotb, 2014).
Протеолитические ферменты грибов, способные активировать отдельные белки системы гемостаза, а также обладающие фибринолитической активностью, перспективны в тромботерапии. Внеклеточные протеиназы разных видов микромицетов различаются по своим физико-химическим характеристикам и по специфичности к тем или иным факторам системы гемостаза, причем часто одновременно проявляют активность по отношению к нескольким из них. В связи с этим, активно проводятся исследования по скринингу микромицетов – продуцентов протеиназ, специфичных по отношению к определенным белкам системы гемостаза человека. Среди таких ферментов особый интерес представляют обладающие активаторной к плазминогену активностью (Sharkova et al., 2016а).
Ранее было показано, что энтомопатогенный штамм микромицета Tolypocladium inflatum k1 секретирует протеиназы, обладающие выраженной фибринолитической активностью и активаторным к плазминогену действием, что делает его перспективным продуцентом протеиназ-тромболитиков (Sharkova et al., 2016b).
Целью настоящего исследования было изучение тромболитических свойств препарата протеиназ, выделенного из культуральной жидкости микромицета T. inflatum k1.
МАТЕРИАЛЫ И МЕТОДЫ
Продуцент и условия культивирования. Объектом исследования служил штамм микромицета T. inflatum k1, который был ранее изучен как продуцент протеиназ, обладающих фибринолитической и активаторной к плазминогену активностью (Sharkova et al., 2015, 2016b). Посевной материал получали смывом спор с поверхности культуры, выращенной в пробирках на скошенном сусло-агаре в течение 7 сут при 25°C в питательную среду состава (%): сусло – 6.7, глюкоза – 2, пептон – 0.1 (Batomunkueva, Egorov, 2001). После 2 сут культивирования часть биомассы переносили в ферментационную среду состава (%): глицерин – 7, глюкоза – 3, гидролизат рыбной муки – 0.5, NH4NO3 – 0.25, MgSO4 · 7H2O – 0.1, KH2PO4 – 0.1 и продолжали культивирование еще в течение 3 сут. Культивирование микромицета осуществляли в колбах объемом 750 мл, содержащих 100 мл среды, на орбитальной качалке (200 об./мин) при 28°C.
Получение препарата протеиназ из культуральной жидкости и их разделение. После культивирования микромицета культуральную жидкость отделяли от биомассы фильтрованием водоструйным насосом через фильтровальную бумагу (ФС, Россия). Внеклеточные белки из полученной культуральной жидкости осаждали сульфатом аммония при 80%-й степени насыщения. Осадок белков формировался при 4°C в течение 12 ч. Затем его отделяли центрифугированием при 15 000 g (20 мин, 4°C), растворяли в минимальном объеме 0.01 М трис-HCl-буфера, рН 8.2, содержащего 0.002 М ацетат кальция, и диализовали в диализных мешках против того же буфера (12 ч, 4°C). Полученный раствор белков центрифугировали в аналогичных условиях для удаления осадка и затем лиофильно высушивали. Белки разделяли методом изоэлектрофокусирования на колонке объемом 110 мл (LKB, Швеция) в градиенте плотности сахарозы 0–40% и рН 3–10, создаваемом амфолинами (“Pharmacia”, Швеция), при напряжении 700 В в течение 36 ч (Osmolovskiy et al., 2013). Во фракциях (объемом 1 мл) после элюции с колонки определяли рН, содержание белка по оптической плотности при 280 нм и общую протеолитическую активность.
Определение общей протеолитической активности. Общую протеолитическую активность определяли модифицированным методом Ансона–Хагихары по количеству тирозина в неосаждаемых трихлоруксусной кислотой продуктах протеолиза после 10-минутного гидролиза 1%-го раствора казеина в 0.1 М Трис-HCl буфере (рН 8.0–8.2, 37°С), как описано ранее (Osmolovskiy et al., 2016). Активность выражали в мкмолях тирозина в минуту (ЕТир). Удельную активность рассчитывали на мг белка.
Определение содержания белка. Содержание белка определяли спектрофотометрически в кювете с длиной пути в 1 см при 280 нм (Gertler, Trop, 1971).
Определение pH и температурного оптимума активности и оптимума стабильности препарата. рН-оптимум активности препарата определяли в 0.4 М универсальном (натрий-ацетат-фосфат-боратном) буфере с рН от 3.0 до 11.0. К 150 мкл буфера с соответствующим значением рН добавляли 100 мкл раствора фермента и 100 мкл раствора субстрата. Для определения рН-стабильности фермента проводили инкубацию препарата в растворах буфера с разными значениями рН при 37°C в течение 2 ч, после чего определяли казеинолитическую активность. Полученные результаты выражали в % от исходной активности. Температурный оптимум для действия препарата определяли в 0.05 М трис-HCl буфере, рН 8.2, по казеинолитической активности при 25, 30, 37, 45, 55 и 65°C. Термостабильность препарата изучали при инкубации фермента при заданных температурах в течение 2 ч и выражали в % от исходной активности фермента.
Определение протеолитической активности в отношении отдельных белков системы гемостаза. Активность препарата протеиназ, образуемых T. inflatum k1, в отношении белков системы гемостаза определяли по расщеплению их специфических хромогенных пептидных субстратов: плазмина (HD-Val-Leu-Lys-pNA; For-Ala-Phe-Lys-pNA), тромбина (Tos-Gly-Pro-Arg-pNA и H-D-Phe-Pip-Arg-pNA), сериновых протеаз (Z-D-Arg-Gly-Arg-pNA), урокиназы (pGlu-Gly-Arg-pNA), фактора Ха (HD-Ile-Pro-Arg-pNA), субтилизина (Z-Ala-Ala-Leu-pNA), эластазы (Suc-Ala-Ala-Ala-pNA), трипсина (Bz-Arg-pNA). Измерение оптической плотности проводили при 405 нм на спектрофотометре Hitachi 200-20 (Япония). Реакции проводили путем добавления к препарату протеиназ 0.05%-го р-ра соответствующего субстрата (Osmolovskiy et al., 2012). Единица активности (Е) фермента – количество мкмоль п-нитроанилина, отщепившегося от хромогенного субстрата за 1 мин при 37°С.
Определение плазминоподобной и активаторной к плазминогену активности. Плазминоподобную активность (на прогретых фибриновых пластинах) и активность активаторов плазминогена (на непрогретых фибриновых пластинах) штамма определяли по модифицированному методу Аструпа–Мюллерца–Лассена и выражали в условных единицах на 1 мл культуральной жидкости (Landau et al., 2000). Для приготовления фибриновой пластины в чашке Петри смешивали 9 мл 0.76%-го р-ра фибриногена и 0.2 мл 0.4%-го р-ра тромбина, приготовленных на смеси физиологического раствора и 0.05 М трис-HCl буфера (рН 8.2) в соотношении 9 : 1. Инкубацию фибриновых пластин с нанесенными образцами фильтрата культуральной жидкости микромицета (30 мкл) проводили в течение 6 ч при 37°С. За условную единицу активности принимали зону лизиса в 10 мм2, которая образуется за 3–4 ч инкубации фибриновых пластин при 37°С.
Выявление коагулазной активности. Наличие коагулазной активности препарата выявляли по визуализации фибринового волокна в экспериментах со свертыванием фибриногена человека (Fibrinogen from Human Plasma, Sigma-Aldrich) и быка (Bovine fibrinogen 9001-32, H2B Medical). В пробирки типа эппендорф добавляли 0.1 мл препарата протеиназ и 0.2 мл 0.4%-го р-ра фибриногена. В качестве контроля использовали 0.1%-й р-р тромбина.
Определение углеводного компонента. Углеводный компонент в составе молекул протеиназ выявляли с помощью периодной кислоты и реактива Шиффа (фуксинсернистой кислоты) методом дот-блоттинга на нитроцеллюлозных мембранах (Averina, Snegivyova, 1980; Thronton et al., 1996). В качестве положительного контроля использовали раствор внеклеточной дрожжевой инвертазы (0.5 мг/мл), а в качестве отрицательного – 0.5 мг/мл БСА.
Определение тромболитического эффекта препарата. Формировали фибриновый сгусток в пробирках типа Эппендорф путем добавления в каждую пробирку 100 мкл человеческой плазмы и 20 мкл тромбина, фиксировали массу пробирки до, во время (после каждого этапа) и после эксперимента. Добавляли к каждому образцу фибринового сгустка препарат протеиназ T. inflatum k1 и фиксировали изменение массы через равные промежутки времени (30, 60 и 90 мин). По остаточной массе сгустка (выраженной в % от первоначальной массы сгустка) определяли степень протекания тромболизиса в образцах с течением времени (Kotb et al., 2015).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Микромицет T. inflatum k1 является анаморфой Elaphocordyceps subsessilis (Ophiocordycipitaceae, Hypocreales, Sordariomycetes, Ascomycota). Культуральная жидкость микромицета Tolypocladium inflatum k1, полученная по окончании срока культивирования продуцента, после удаления биомассы представляла собой прозрачную жидкость светло-коричневого цвета. После фильтрования культуральной жидкости, осаждения внеклеточных белков сульфатом аммония, диализа и лиофильной сушки был получен белковый препарат T. inflatum k1 с удельной протеолитической активностью 2.7 ЕТир/мг белка × 10–3. Протеиназы, активные в отношении белков системы гемостаза, были выделены из белкового препарата микромицета T. inflatum k1 в результате проведения изоэлектрофокусирования в колонке и соответствовали трем пиковым фракциям – 24, 28, 53 (рис. 1). Для фракции 24 (pI – 5.9) удельная протеолитическая активность составляла 0.2 Е/мг × 10–3, для фракции 28 (pI – 6.8) – 0.35 Е/мг × 10–3, а для фракции 53 (pH – 10.7) – 0.86 Е/мг × 10 –3. Гомогенность белков полученных фракций была подтверждена электрофоретически.
Рис. 1.
Изоэлектрофокусирование внеклеточного препарата протеиназ микромицета Tolypocladium inflatum k1: 1 – белок, 2 – рН, 3 – протеолитическая активность.

Далее в препарате протеиназ и в отдельных фракциях препарата, полученных после изоэлектрофокусирования (№№ 24, 28, 53), определяли фибринолитическую и активаторную к плазминогену активность. Полученные результаты (в сравнении с активностью в культуральной жидкости) представлены на рис. 2.
Рис. 2.
Тромболитическое действие протеиназ микромицета Tolypocladium inflatum k1: а – прогретая чашка; б – непрогретая чашка; Кж – культуральная жидкость; Пр – препарат (№№ 53, 24, 28 – фракции после изоэлектрофокусирования).

Белковый препарат обладал несколько более выраженной фибринолитической и активаторной к плазминогену активностью по сравнению с культуральной жидкостью, что согласуется с полученными ранее данными (Sharkova et al., 2016b). В то же время во фракциях после изоэлектрофокусирования наблюдалась значительно более высокая фибринолитическая и активаторная к плазминогену активность. Максимальные значения активности для фракции № 28 составляли 582 и 373 усл. ед/мг белка, для фракции 24 – 481 и 180 усл. ед/мг белка, а для фракции 53 – 255 и 91.5 усл. ед /мг белка, соответственно.
Способность микромицета T. inflatum k1 к образованию внеклеточных протеолитических ферментов, обладающих активностью, аналогичной некоторым факторам системы гемостаза человека, была изучена по расщеплению специфичных для протеиназ системы гемостаза хромогенных пептидных субстратов как для препарата ферментов, образуемых микромицетом, так и для отдельных фракций (№№ 24, 28, 53), полученных после изоэлектрофокусирования. Результаты определения активности внеклеточных протеиназ с хромогенными пептидными субстратами факторов системы гемостаза приведены в табл. 1.
Таблица 1.
Активность внеклеточных протеиназ Tolypocladium inflatum k1 по отношению к белкам системы гемостаза человека
| Хромогенный субстрат | Активность (по Beynon, Bond, 2001) | Удельная активность, Е/мл × 10–3* | |||
|---|---|---|---|---|---|
| препарат | фракция 53 | фракция 24 | фракция 28 | ||
| pGlu-Gly-Pro-Arg-pNA | урокиназная | 3.1 | – | – | – |
| Tos-Gly-Pro-Arg-pNA | тромбиноподобная | 3.36 | 1.6 | 6.11 | 6.43 |
| dVal-Leu-Lys-pNA | плазминоподобная | 4.46 | 3.24 | 7.25 | 10.6 |
| HD-Ile-Pro-Arg-pNA | фактор Ха-подобная | 1.2 | – | – | – |
| Z-D-Arg-Gly-Arg-pNA | сериновых протеаз | 2.3 | – | – | – |
| Z-Ala-Ala-Leu-pNA | субтилизин-подобная | 4.77 | 33.5 | 6.15 | 11.33 |
| Suc-Ala-Ala-Ala-pNA | эластазная | 18.5 | 3.3 | 10.1 | 19.3 |
| Bz-Arg-pNA | трипсиноподобная | 1.1 | 0 | 1.0 | 0 |
| For-Ala-Phe-Lys-pNA | плазминоподобная | 5.5 | – | – | – |
Полученные данные показывают, что и препарат, и белки отдельных фракций после изоэлектрофокусирования обладали протеолитической активностью и способностью расщеплять использованные субстраты. Так, ферментный препарат был активен по отношению к широкому спектру хромогенных субстратов, однако при этом его удельная активность была ниже по сравнению с удельной активностью выделенных протеиназ в отношении отдельных субстратов. Так, в случае фракции 53 наблюдалась высокая субтилизин-подобная активность – порядка 33.5 Е/мл × 10–3 при расщеплении субстрата Z-Ala-Ala-Leu-pNA. Для фракции 24 аналогично была характерна субтилизин-подобная активность, а также была отмечена выраженная тромбиноподобная, плазминоподобная и эластазная активность. В случае же фракции № 28 наблюдался схожий эффект в отношении использованных субстратов, но с несколько более выраженной тромбиноподобной, плазминоподобной и субтилизин-подобной активностью по сравнению с фракцией 24 и значительно большей эластазной активностью в отношении субстрата Suc-Ala-Ala-Ala-pNA, которая превосходила аналогичную активность препарата и составляла 19.3 Е/мл ×10–3.
Таким образом, полученные данные могут свидетельствовать о высокой специфичности протеиназ T. inflatum k1, т.к. они способны гидролизовать хромогенные пептидные субстраты факторов системы гемостаза, богатые неполярными аминокислотами, что может быть обусловлено узким кругом субстратов изучаемых ферментов.
Определение углеводного компонента методом dot-блоттинга во фракциях после изоэлектрофокусирования с помощью реакции на гликопротеины показало, что протеиназы входящие в состав фракций 24 и 28 гликозилированы, а фермент фракции 53 – не гликозилирован (рис. 3). Отсутствие подобной посттрансляционной модификации позволяет рассматривать потенциальную возможность клонирования и экспрессии гена, кодирующего целевую протеиназу, в прокариотических клетках (Popova et al., 2019).
Рис. 3.
Качественная реакция на гликопротеины (показана одна и та же нитроцеллюлозная мембрана в разных контрастностях и схема расположения пятен); стрелками обозначены: 1 – фракция 24; 2 – фракция 28; 3 – фракция 53; 4 – отрицательный контроль (БСА); 5 – положительный контроль (инвертаза).

В результате экспериментов по свертываемости фибриногена человека и быка протеиназами микромицета не наблюдали наличие фибринового волокна по сравнению с контрольным случаем (при добавлении тромбина). На основании этого можно заключить, что все три протеиназы не обладали коагулазной активностью, что является необходимым свойством для всех фибринолитических субстанций.
Определение температурного оптимума активности исследуемого препарата протеиназ T. inflatum k1 выявило, что препарат проявлял активность в интервале температур 20–65°C (рис. 4, а). Максимальную активность препарата наблюдали при 37°C, т.е. при температуре, соответствующей физиологическим условиям в кровотоке человека. При температуре 65°C активность препарата практически отсутствовала. Изучение термостабильности исследуемого препарата показало, что препарат сохранял активность в диапазоне от 25 до 37°C в течение 2 ч. При температуре 45°C активность уже значительно снижалась (на 55%) и полностью отсутствовала при 65°C (рис. 4, а).
Рис. 4.
Влияние температуры (а) и pH (б) на активность (1) и стабильность (2) препарата протеиназ, образуемых микромицетом Tolypocladium inflatum k1.
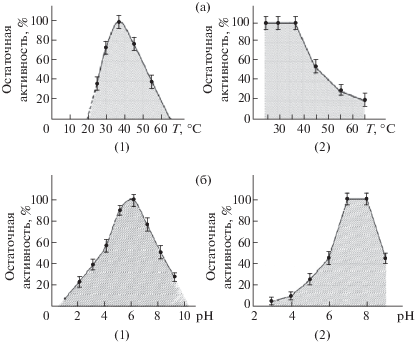
Определение зависимости активности препарата протеиназ T. inflatum k1 от pH показало, что он проявляет активность в интервале рН от 3.5 до 10.5. При более низких значениях рН – 3.0 и ниже препарат не был активен, в щелочных условиях практически полностью инактивировался при рН 11.0. Максимальное значение активности наблюдали при рН 8.0 (рис. 4, б). Препарат был стабилен в интервале рН 6.5–8.5 в течение 2 ч, сохраняя 100% активности фермента. При рН 9.0 за то же время активность сохранялась лишь на 45% (рис. 4, б).
Таким образом, согласно полученным экспериментальным данным, оптимум действия протеиназ T. inflatum k1, входящих в состав препарата, находится в пределах физиологических параметров крови человека (T – 37°C, pH ~ 7.5), что также характерно для препаратов внеклеточных протеолитических ферментов других микромицетов, например, для Aspergillus terreus (Zvonareva et al., 2018) и Sarocladium striсtum (Kornienko et al., 2020).
Тромболитический потенциал ферментного препарата, полученного из культуральной жидкости микромицета T. inflatum k1, исследовали в экспериментах по определению степени тромболизиса. В результате эксперимента через 30 мин лизис фибриного сгустка составлял 32.1% (первоначальная масса фибринового сгустка под действием препарата уменьшилась на 32.1%) через 60 мин составлял 68.6% а через 90 мин составил 91.3% (табл. 2). Данные показатели позволяют говорить в целом о высокой тромболитической активности препарата.
Таблица 2.
Определение тромболитического потенциала препарата протеиназ Tolypocladium inflatum k1 в экспериментах с лизисом фибринового сгустка
| Изначальная масса фибринового сгустка (M), г | M через 30 мин после добавления препарата, г | M через 60 мин после добавления препарата, г | M через 90 мин после добавления препарата, г | Степень тромболизиса, % |
|---|---|---|---|---|
| 0.113 ± 0.005 | 0.076 ± 0.005 | – | – | 32.1 ± 4.42 |
| 0.115 ± 0.003 | – | 0.036 ± 0.003 | – | 68.6 ± 2.60 |
| 0.117 ± 0.002 | – | – | 0.011 ± 0.002 | 91.3 ± 1.71 |
Таким образом, у препарата протеиназ, выделенного из культуральной жидкости штамма микромицета T. inflatum k1, были изучены свойства, обуславливающие его тромболитический потенциал и возможность применения этого препарата в тромботерапии. Определены температурный (37°C) и pH-оптимум (8.0), а также условия термостабильности (25–37oC) и pH-стабильности (6.5–8.5) препарата, что соответствует физиологическим показателям организма человека. Показаны тромболитический эффект в отношении фибриновых сгустков и отсутствие коагулазной активности. После изоэлектрофокусирования препарата получены три фракции внеклеточных белков, содержащие протеиназы, проявляющие фибринолитическую и активаторную к плазминогену активность (максимальная во фракции 28), а также обладающие специфичной протеолитической активностью в отношении некоторых белковых субстратов, богатых неполярными аминокислотами, что может быть использовано в сосудистой медицине для разработки тромболитических субстанций, а также для создания диагностических наборов для мониторинга и профилактики нарушений системы гемостаза человека.
Список литературы
Averina A.V., Snegiryova A.Ya. Laboratory workshop on organic chemistry. Vysshaya shkola, Moscow, 1980 (in Russ.).
Batomunkueva B.P., Egorov N.S. Isolation, purification and resolution of the extracellular proteinase complex of Aspergillus ochraceus 513 with fibrinolytic and anticoagulant activities. Microbiology. 2001. V. 70 (5). P. 519–522 (in Russ.).
Beynon E.R., Bond J.S. Proteolytic enzymes. A practical approach. Oxford Univ. Press, Oxford, 2001.
Gertler A., Trop M. The elastase-like enzymes from Streptomyces griseus (pronase). Isolation and partial characterization. Eur. J. Biochem. 1971. V. 19 (1). P. 90–96.
Holbrook I.B., Leaver A.G. A procedure to increase the sensitivity of staining by Coomassie Briliant Blue G-250 – perchloric acid solution. Anal. Biohem. 1976. V. 75 (2). P. 634–636.
Kornienko E.I., Kokaeva L.Yu., Bilanenko E.N. et al. Sarocladium strictum – a perspective producer of proteolytic enzymes with expressed fibrinolytic activity. Mikologiya i fitopatologiya. 2020. V. 54 (3). P. 206–213 (in Russ.). https://doi.org/10.31857/S0026364820030083
Kotb E. The biotechnological potential of fibrinolytic enzymes in the dissolution of endogenous blood thrombi. Biotechnol. Prog. 2014. V. 30 (3). P. 656–672. https://doi.org/10.1002/btpr.1918
Kotb E., Helal G.E.-D.A., Edries F.M. Screening for fibrinolytic filamentous fungi and enzymatic properties of the most potent producer, Aspergillus brasiliensis AUMC 9735. Biologia. 2015. Vol. 70 (12). P. 1565–1574. https://doi.org/10.1515/biolog-2015-0192
Landau N.S., Gulikova O.M., Egorov N.S. Control of the synthesis of plasmin-like and plasminogen-activating proteinases in marine bacteria. Microbiology. 2000. V. 69 (2). P. 147–151.
Osmolovskiy A.A., Kreier V.G., Baranova N.A. et al. Production of extracellular proteinases – protein C activators of blood plasma – by the micromycete Aspergillus ochraceus during submerged and solid-state fermentation. Appl. Biochem. Microbiol. 2013. V. 49 (6). P. 580–586 (in Russ.).
Osmolovskiy A.A., Kreier V.G., Kurakov A.V. et al. Aspergillus ochraceus micromycetes – producers of extracellular proteinases – protein C activators of blood plasma. Appl. Biochem. Microbiol. 2012. V. 48 (5). P. 488–492 (in Russ.).
Osmolovskiy A.A., Popova E.A., Kreyer V.G. et al. Fibrinolytic and collagenolytic activity of extracellular proteinases of the strains of micromycetes Aspergillus ochraceus L-1 and Aspergillus ustus 1. Moscow Univ. Biol. Sci. Bull. 2016. Vol. 71 (1). P. 62–66.
Popova E.A., Osmolovskiy A.A., Kreier V.G. et al. Production by Aspergillus ustus strain of proteinases highly activeagainst fibrillar proteins. Mikologiya i fitopatologiya. 2019. V. 53 (4). P. 229–235 (in Russ.). https://doi.org/10.1134/S0026364819040111
Sharkova T.S., Kornienko E.I., Osmolovskiy A.A. et al. Morphological and physiological properties of the micromycete Arthrobotrys longa, a producer of longolytin, a proteolytic complex with a thrombolytic effect. Microbiology. 2016a. V. 85 (2). P. 171–176.
Sharkova T.S., Kurakov A.V., Osmolovskiy A.A. et al. Screening of producers of proteinases with fibrinolytic and collagenolytic activities among micromycetes. Microbiology. 2015. V. 84 (3). P. 359–364.
Sharkova T.S., Matveeva E.O., Kreier V.G. et al. Production of proteinase – plasminogen activators by micromycete Tolypocladium inflatum k1. Applied Biochemistry and Microbiology. 2016b. V. 52 (1). P. 31–35.
Thronton D.J., Carlstadt I., Sheehan J.K. Identification of glycoproteins on nitrocellulose membranes and gels. Mol. Biotechnol. 1996. V. 5 (2). P. 171–176.
Zvonareva E.S., Osmolovskiy A.A., Kreier V.G. et al. Production of proteinase with plasmin-like and prekallikrein activating activity by the micromycete Aspergillus terreus. Appl. Biochem. Microbiol. 2018. V. 54 (2). P. 206–210.
Аверина А.В., Снегирева А.Я. (Averina, Snegiryova) Лабораторный практикум по органической химии. М.: Высшая школа, 1980. 184 с.
Батомункуева Б.П., Егоров Н.С. (Batomunkueva, Egorov) Выделение, очистка и разделение комплекса внеклеточных протеиназ Aspergillus ochraceus 513 с фибринолитической и антикоагулянтной активностью // Микробиология. 2001. Т. 70. № 5. С. 519–522.
Корниенко Е.И., Кокаева Л.Ю., Биланенко Е.Н. и др. (Korinenko et al.) Sarocladium strictum – перспективный продуцент протеолитических ферментов с выраженной фибринолитической активностью // Микология и фитопатология. 2020. Т. 54. № 3. С. 206–213.
Осмоловский А.А., Крейер В.Г., Баранова Н.А. и др. (Osmolovskiy) Продукция внеклеточных протеиназ – активаторов протеина С плазмы крови – микромицетом Aspergillus ochraceus в ходе глубокой и твердофазной ферментации // Прикл. биохим. микробиол. 2013. Т. 49. № 6. С. 580–586.
Осмоловский А.А., Крейер В.Г., Кураков А.В. и др. (Osmolovskiy et al.) Микромицеты Aspergillus ochraceus – продуценты внеклеточных протеиназ – активаторов протеина С плазмы крови // Прикл. биохим. микробиол. 2012. Т. 48. № 5. С. 488–492.
Попова Е.А., Осмоловский А.А., Крейер В.Г. и др. (Popova et al.) Продукция штаммом Aspergillus ustus протеиназ, активных в отношении фибриллярных белков // Микология и фитопатология. 2019. Т. 53. № 4. С. 229–235.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


