Микология и фитопатология, 2022, T. 56, № 1, стр. 52-63
Влияние фунгицида Колосаль на структуру популяции возбудителя бурой ржавчины пшеницы по признакам патогенности и чувствительности
М. С. Гвоздева 1, *, Г. В. Волкова 1, **
1 Федеральный научный центр биологической защиты растений
350039 Краснодар, Россия
* E-mail: maria-v23@mail.ru
** E-mail: galvol.bpp@yandex.ru
Поступила в редакцию 20.12.2020
После доработки 03.03.2021
Принята к публикации 22.05.2021
- EDN: ROWMIY
- DOI: 10.31857/S0026364822010044
Аннотация
Современное сельское хозяйство предусматривает применение химических средств защиты растений от фитопатогенов, что позволяет существенно снизить потери урожая. Но вредные организмы способны адаптироваться к действию пестицидов, развивая устойчивость к ним, что дальше служит серьезным препятствием для эффективного использования препаратов. Исследования проводили с целью изучения влияния химического фунгицида на основе тебуконазола на внутрипопуляционную структуру возбудителя бурой ржавчины пшеницы (Рuccinia triticina) и ее чувствительность к токсиканту. Были оценены показатели агрессивности (жизнеспособность, спорулирующая способность, длительность споруляции и латентный период), вирулентности (тип реакции на заражение) северокавказской популяции патогена, биологическая эффективность и токсикологические показатели СК50 и СК95 фунгицида Колосаль, КЭ (250 г/л тебуконазола), широко применяемого на пшенице против бурой ржавчины в различных нормах применения. Установлено, что с увеличением нормы применения фунгицида снижалась жизнеспособность спор [со 100% (контроль, без обработки) до 21.5% (норма применения 0.7 л/га)], спорулирующая способность [(с 0.07 мг спор (контроль, без обработки) до 0.02 мг спор (0.7 л/га)] и длительность споруляции [с 13 суток (контроль, без обработки) до 8 суток (0.7 л/га)]. Под воздействием повышенных норм препарата (0.7 л/га) увеличивалась длительность латентного периода с 168 ч (в контроле, без обработки) и до 233 ч. Выявлено снижение средней вирулентности популяции возбудителя P. triticina с 31.7% (контроль, без обработки) до 19.9% (норма применения 0.7 л/га). Изменялся тип реакции на заражение возбудителем болезни сортов дифференциаторов в сравнении с исходной (необработанной) популяцией. Тип поражения изогенных линий, несущих гены устойчивости Lr2с, Lr3ka в варианте с повышенной нормой применения препарата (0.7 л/га) снижался с трех до двух баллов. Под воздействием фунгицида, независимо от нормы препарата, тип поражения линии с геном устойчивости Lr24 снижался с двух баллов до одного. В результате изменения агрессивности и вирулентности популяции P. triticina под действием фунгицида Колосаль, КЭ снижалась ее чувствительность к токсиканту. При оценке чувствительности возбудителя бурой ржавчины пшеницы к фунгициду на основе тебуконазола показатели СК50 и СК95 составили 63 мг/мл и 217 мг/мл соответственно, что значительно выше рекомендованных концентраций в рабочем растворе (65 и 125 мг/мл), используемом для защиты культуры. Таким образом, популяция возбудителя бурой ржавчины, подвергавшаяся обработке химическим фунгицидом на основе тебуконазола, характеризуется изменением структуры по агрессивности и вирулентности и снижением чувствительности к токсиканту.
ВВЕДЕНИЕ
Применение фунгицидов является неотъемлемой частью в системе выращивания сельскохозяйственных культур и прямым образом влияет на объем урожая и качество продукции (Savchenko, 2007; Levshakov et al., 2015). Но необоснованное использование химических препаратов приводит к возникновению устойчивости возбудителей болезней за счет мутаций в геноме или модификации фенотипов (Kolbin et al., 2010). Такие изменения в популяции затрудняют контроль над заболеванием. Поэтому биологическая эффективность фунгицидов против возбудителей болезней всегда должна оставаться на высоком уровне, чтобы не допустить выживание и распространение устойчивых форм патогена.
Проблема снижения чувствительности становится все более актуальной и поэтому необходимо детальное изучение механизмов выработки устойчивости, разработка и внедрение мер по предотвращению снижения эффективности химических фунгицидов (Zakharenko, 2001; Batmanova, 2015).
25.09.2017 г. распоряжением правительства РФ была утверждена стратегия предупреждения распространения антимикробной резистентности, в задачи которой входит повышение уровня подготовки специалистов в соответствующих отраслях; обеспечение системного мониторинга распространения антимикробной резистентности; изучение механизмов возникновения; разработка альтернативных методов, технологий и средств профилактики; развитие международного сотрудничества в данной области (Strategy..., 2017).
В Европе проблемой снижения чувствительности фитопатогенов занимается комитет по борьбе с устойчивостью к фунгицидам Fungicide Resistance Action Committee (FRAC), специализированная техническая группа компании Crop Life International (Brent et al., 2007). Комитетом FRAC установлено, что высокий риск снижения эффективности имеют фунгициды, относящиеся к химическому классу бензимидазолов, дикарбоксимидов, фениламидов, аналоги стробилурина; средний – к классу 2-аминопиримидинов, аминов (в том числе морфолины), анилинопиримидинов, ароматических углеводородов, азолов, карбоксанилидов, карбоновых кислот, амидов, карпропамидов, цимоксанилов, фенгексамидов, касугамицинов, фенилпирролов, фосфоротиолатов, хиноксифенов; низкий – к классу хлороталонилов, дитиокарбаматов, пирохилонов, фталимидов, пробеназолов, трициклазолов, серы, меди (Volkova, 2001; Brent et al., 2007).
По данным FRAC, функционирующем при Всемирной федерации по защите растений, в мире резистентность зарегистрирована у 250 видов фитопатогенов к 30 фунгицидам из химических классов бензимидазолов, триазолов, ацилаланилов, фенилпирролов и др. (Volkova, 2001; Damicone, 2014).
Актуальные проблемы резистентности стали предметом активного обсуждения и на IV съезде по защите растений (9–11 сентября 2019 г. Санкт-Петербург), в рамках которого работал симпозиум “Резистентность вредных организмов к пестицидам”. По данным мониторинга за период с 1964 по 2019 г. случаи развития резистентности к фунгицидам из химических классов бензимидазолов, органофосфатов, триазолов, ацилаланинов и фенилпирролов были выявлены у 17 видов фитопатогенов (Sukhoruchenko, 2020).
Одним из перспективных объектов для изучения резистентности к фунгицидам является бурая (листовая) ржавчина озимой пшеницы (возбудитель Puccinia triticina Erikss.). Заболевание широко распространено (Levitin et al., 2016; Gultyaeva et al., 2017; Zeleneva et al., 2019), вредоносно (Sanin, 2018) и находится под интенсивным химическим давлением (Pasko et al., 2018).
Известно, что в структуре популяции возбудителя P. triticina существует множество рас, различающихся по вирулентности, агрессивности, жизнеспособности (Gultyaeva et al., 2015), поэтому способность преодолевать давление со стороны фунгицидов возрастает в разы (HGCA Topic Sheet, 2012).
В Великобритании получены данные, свидетельствующие о том, что в полевых условиях препараты азольной группы [ингибиторы деметилирования стерола (DMI)] эффективны, но существует умеренный сдвиг чувствительности в популяции возбудителя бурой ржавчины к фунгицидам (Fungicide performance., 2018).
Снижение чувствительности среди изолятов бурой ржавчины пшеницы встречается чаще для фунгицидов из химического класса триазолов (HGCA project, 1992). Обнаружено, что пропиконазол, действующий как ингибитор биосинтеза стерола, проявляет перекрестную резистентность к триадимефону и триадименолу. Также отмечено, что эффективность препаратов на основе флутриафола несколько снижается в полевых условиях в некоторых случаях, поэтому возможно снижение чувствительности патогена к фунгициду (HGCA project, 1992).
С момента внедрения фунгицидов на основе производных коричной кислоты (морфолины, в начале 1990-х гг.) не выявлено признаков какого-либо сдвига в чувствительности (Fungicide resistance management..., 2019).
Эффективность ингибиторов внешнего хинона (стробилурины) против возбудителя бурой ржавчины остается на высоком уровне. При проведении мониторинга в Европе не было обнаружено изолятов с пониженной чувствительностью к фунгицидам (Fungicide resistance management..., 2019). Для обеспечения максимального контроля развития бурой ржавчины пшеницы целесообразно применение смеси стробилурина с триазолом, изопиразамом и другими веществами (Bounds et al., 2012).
К седаксану [ингибитор фермента сукцинатдегидрогеназы второго поколения (SDHI)] была подтверждена устойчивость у нескольких патогенов (например, Alternaria, Botrytis). В Европе были обнаружены мутации у возбудителя сетчатой пятнистости ячменя (Pyrenophora teres), рамуляриоза ячменя (Ramularia collo-cygni) и септориоза листьев пшеницы (Septoria tritici), но эффективность в полевых условиях остается высокой, за исключением рамулярии, в определенных местах. Не выявлено мутаций, влияющих на эффективность фунгицидов против бурой ржавчины пшеницы (Fungicide resistance management.., 2019).
По данным FRAC, возбудитель мучнистой росы злаковых культур Blumeria graminis (Erysiphe graminis) является патогеном с высоким риском развития резистентности. Церкоспореллез зерновых (Oculimacula spp.), септориоз (Septoria tritici) и желтая пятнистость листьев пшеницы (Pyrenophora tritici-repentis) относятся к группе среднего риска. Также в эту группу входят некоторые виды ржавчинных грибов (Albugo candida – белая ржавчина капусты, Phakopsora pachyrhizi – азиатская ржавчина сои). Возбудители ржавчинных заболеваний зерновых (Puccinia spp.) и других культур (Uromyces spp., Puccinia sorghi – ржавчина кукурузы, Hemileia vastatrix – ржавчина кофе, Gymnosporangium sabinae – ржавчина груши), относятся к группе с низким риском развития устойчивости к фунгицидам (Pathogen risk list.., 2019).
После прекращения применения фунгицида, к которому выработалась устойчивость, длительность сохранения резистентности колеблется от 6 месяцев до 3 лет (Zakharychev, 2019).
Современные системные фунгициды узкоспецифичны, поэтому к ним более или менее быстро развивается толерантность, вследствие чего в популяциях фитопатогенных грибов встречаются штаммы, нечувствительные к ним. Обработка системными фунгицидами напоминает по защитному эффекту использование вертикальной устойчивости: полное подавление инфекции в первые годы применения; возникновение отдельных толерантных штаммов, приводящее к тому, что распространенность подавляется сильнее, чем интенсивность; наконец, полная потеря эффективности (Dyakov, 1998). Установлено, что в быстро растущих популяциях накопление резистентных клонов происходит в несколько раз быстрее, чем в медленно растущих. Поэтому для грибов, характеризующихся быстрым ростом численности в благоприятных условиях, смена генотипов при использовании фунгицидов происходит быстро. Поэтому потеря фунгицидом эффективности происходит, также, как и потеря сортом его устойчивости, и чаще всего наступает в зонах ежегодного сильного развития болезни или после чрезвычайно благоприятного для развития патогена сезона, т.е. после увеличения скорости роста и общей численности популяции (Zadoks, 1982). Под влиянием фунгицидов могут происходить изменения частот генотипов в популяциях ржавчинных грибов, обусловленные их сцеплением с чувствительностью к фунгицидам (Alekseeva et al., 1990, Volkova et al., 2006; 2012; Kolbin, 2010, 2012).
До настоящего времени в России исследования по изучению устойчивых форм патогенов к фунгицидам химического происхождения проводились в малом количестве (Klimova, 2003; Filippov, 2016; Dubrovskaya et al., 2019; Lobodina et al., 2019), а относительно ржавчин – только в Федеральном научном центре биологической защиты растений (Volkova, 1995, 1996, 2007; Volkova et al., 2009). Была доказана прямая зависимость между длительностью действия химических фунгицидов (Байлетон, СП) и уровнем устойчивости к нему возбудителя желтой ржавчины пшеницы (Volkova, 2001). Установлено влияние фунгицидов на генофонд вирулентности северокавказской популяции бурой ржавчины пшеницы (Volkova, 2006; Kolbin et al., 2010).
Ежегодно в России против болезней обрабатывается более 20 млн га, из них зерновым колосовым культурам отведено 16 млн га. Южный федеральный округ России является зоной интенсивного растениеводства, с применением большого объема пестицидов (Оverview.., 2021). По данным ФГБУ “Россельхозцентра” в Краснодарском крае обработки фунгицидами проводятся на площади 2.2 млн га. Против бурой ржавчины в 2019 г. было обработано 24.21 тыс. га (в 2018 г. – 49.07 тыс. га) (Оverview.., 2020). В число наиболее расходуемых фунгицидов вошли комбинированные препараты с содержанием тебуконазола – Фалькон, КЭ; Колосаль Про, КМЭ; Солигор, КЭ и другие (Country, 2020).
Целью нашего исследования являлось изучение влияния химического фунгицида на основе тебуконазола на внутрипопуляционную структуру возбудителя бурой ржавчины пшеницы (Рuccinia triticina) и ее чувствительность к токсиканту.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в тепличном комплексе Федерального государственного бюджетного научного учреждения “Федеральный научный центр биологической защиты растений” (ФГБНУ ФНЦБЗР) на восприимчивом к бурой ржавчине сорте Краснодарская 99. В теплице организованы оптимальные условия для развития растений озимой пшеницы и возбудителя бурой ржавчины: температура 20–22°С, продолжительность светового дня 16 часов, интенсивность освещения 13–15 тыс. люкс, относительная влажность воздуха 60–70%.
Материалом исследования являлся системный фунгицид профилактического и лечащего действия триазольного класса Колосаль, КЭ, производителем которого является АО Фирма “Август”. В соответствии с Федеральным законом от 19.07.1997 г. № 109-ФЗ “О безопасном обращении с пестицидами и агрохимикатами” препарат Колосаль, КЭ получил государственную регистрацию и допускается к обороту на территории Российской Федерации с 2010 г. Действующее вещество препарата – тебуконазол, 250 г/л, входит в состав еще 74 фунгицидов зарегистрированных для применения на посевах озимой пшеницы, из них 29 против бурой ржавчины. Токсикант распространяется по ксилеме, подавляя биосинтез эргостерина в мембранах клеток патогена и нарушая процесс метаболизма. Рекомендуемая норма применения против возбудителя бурой ржавчины пшеницы составляет 0.5 л/га (State catalogue.., 2021).
В опыте использовали северокавказскую популяцию, собранную в результате маршрутного обследования производственных и селекционных посевов озимой пшеницы на территории Краснодарского, Ставропольского края и Ростовской обл. Для проведения опыта семена озимой пшеницы высевали в 0.5 л вазоны и в фазу всходов искусственно инфицировали северокавказской популяцией возбудителя бурой ржавчины озимой пшеницы. После инокуляции растения выдерживали во влажной камере 16 ч при температуре 20–22°С (Anpilogova, Volkova, 2000).
Обработку фунгицидом проводили по первым признакам заболевания. Поскольку в агрономии существует устойчивая практика применения не рекомендованных норм фунгицида, связанная с интенсивностью развития заболевания, в схеме использовали 5 вариантов, обработанных препаратом с разной нормой применения: 0.3; 0.4; 0.5; 0.6; 0.7 л/га. Для определения биологической эффективности учеты осуществляли через 7 дней после обработки по количеству пустул патогена на листе, расчет вели по формуле Эббота (Methodological.., 1985). Для определения чувствительности патогена учитывали количество пустул на лист с типом реакции 3, 4 балла (Wolfe, 1975).
Собранные урединиоспоры гриба размножали по общепринятой методике на восприимчивом сорте Краснодарская 99 (Anpilogova, Volkova, 2000). Определяли показатели агрессивности возбудителя бурой ржавчины пшеницы (жизнеспособность, длительность латентного периода, спорулирующую способность, длительность споруляции) под влиянием действия различных норм применения фунгицида. Для определения жизнеспособности во влажной камере на предметное стекло, обработанное тонким слоем борного вазелина, препаровальной иглой помещали споры бурой ржавчины. Затем наносили росу ручным пульверизатором. Жизнеспособность проверяли через 24 ч под микроскопом марки Микмед-5, увеличении 400×, путем подсчета общего количества спор и числа проросших спор в камере Горяева. Длительность латентного периода считали с момента инокуляции до проявления первых признаков заболевания (Pyzhikova, 1972). Длительность споруляции определяли с начала раскрытия пустул до завершения споруляции (Sanin et al., 1975). Спорулирующую способность рассчитывали путем отношения количества пустул к массе собранного биоматериала (Sanin et al., 1975). Чувствительность возбудителя бурой ржавчины пшеницы к тебуконазолу определяли расчетом показателей СК50 и СК95 (Lapach et al., 2000), путем построения пробит–регрессии с использованием программного обеспечения Statgraphics 19.
Вирулентность образцов урединиоспор Р. triticina и фенотипический состав определяли по реакции 20 почти изогенных линий сорта Thatcher с известными генами устойчивости. Для этого растения озимой пшеницы выращивали в вазонах объемом 25 мл на гидропонике, инокуляцию проводили в фазу всходов (Anpilogova, Volkova, 2000). По результатам дифференциации определяли частоту генов вирулентности путем отношения числа пустул с типом реакции 3–4 балла на линиях с известными генами устойчивости к числу пустул на универсально восприимчивом сорте Michigan Amber (Wolfe, 1975). Среднюю вирулентность определяли по Мартенсу (Mikhailova et al., 2003). Различия между изолятами популяции по фенотипическому составу и частоте аллелей вирулентности определяли по индексу Нея (Nei distance.., 2007).
РЕЗУЛЬТАТЫ
Эффективный контроль развития одного из самых вредоносных заболеваний озимой пшеницы, как бурая листовая ржавчина, значительно снижается за счет возникновения устойчивых форм возбудителя к фунгицидам. Снижение чувствительности патогена обусловлено многими причинами, в том числе это несвоевременное или некачественное опрыскивание посевов, повторное применение препаратов в течение вегетации с одинаковым механизмом действия, использование не рекомендованных норм применения препарата и др. (Volkova, 2006).
В ходе исследования было установлено, что использование разных норм применения препарата влияет на биологическую эффективность и на чувствительность патогена к фунгициду (рис. 1).
Рис. 1.
Биологическая эффективность разных норм применения фунгицида Колосаль, КЭ против Рuccinia triticina.
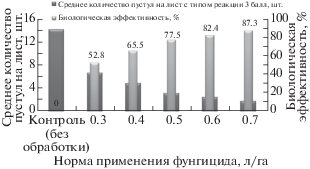
Так, в контроле (без обработки) среднее количество пустул с типом реакции 3 балла составило 14.2 шт. на лист. Биологическая эффективность фунгицида варьировала по вариантам от 52.8% (норма применения – 0.3 л/га) до 87.3% (0.7 л/га). При обработке рекомендуемой нормой применения фунгицида 0.5 л/га среднее количество пустул на лист составило 3.2 шт., а биологическая эффективность 77.5%.
При оценке чувствительности возбудителя бурой ржавчины пшеницы к тебуконазолу было установлено, что показатели СК50 и СК95 для препарата Колосаль, КЭ составили 63 мг/мл и 217 мг/мл соответственно, что говорит о высокой избирательности фунгицида в отношении патогена. Так СК95 существенно выше рекомендованной концентрации в рабочем р-ре (125 мг/мл), используемом для защиты озимой пшеницы против Р. triticina, поэтому рекомендуемая для сельскохозяйственного производства норма фунгицида не обеспечивает полного подавления развития фитопатогена и можно предположить, что в северокавказской популяции P. triticina существует сдвиг чувствительности к тебуконазолу.
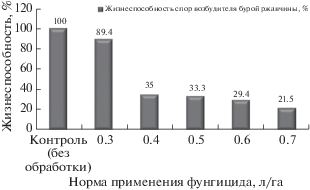
Было изучено влияние разных норм применения фунгицида Колосаль, КЭ на жизнеспособность спор бурой ржавчины (рис. 2). В контроле (без обработки) показатель составил 100%. При увеличении нормы применения фунгицида снижалось число проросших спор патогена. Показатель жизнеспособности варьировал от 89.4% (норма применения – 0.3 л/га) до 21.5% (0.7 л/га). В варианте с рекомендуемой нормой фунгицида 0.5 л/га жизнеспособность спор возбудителя составляла 33.3%.
Рис. 2.
Влияние разных норм применения фунгицида Колосаль, КЭ на жизнеспособность спор бурой ржавчины.
Установлено влияние разных норм применения фунгицида на спорулирующую способность, длительность споруляции и латентного периода P. triticina (рис. 3).
Рис. 3.
Влияние разных норм применения фунгицида Колосаль, КЭ на показатели агрессивности возбудителя бурой ржавчины пшеницы.
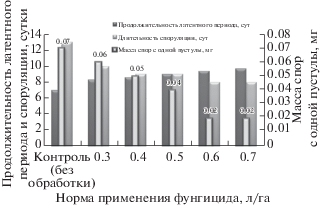
Длительность споруляции бурой ржавчины снижалась с увеличением нормы применения фунгицида и варьировала от 13 суток (контроль без обработки) до 8 суток (вариант с Колосаль при нормах применения 0.6 и 0.7 л/га).
Спорулирующая способность P. triticina также снижалась с увеличением нормы применения препарата. В контроле (без обработки) было собрано 0.07 мг спор с одной пустулы. Меньшее количество спор было собрано с вариантов, обработанных фунгицидом с нормой, превышающей рекомендованную (0.6 и 0.7 л/га), составляя по 0.02 мг соответственно.
Длительность латентного периода бурой ржавчины возрастала с увеличением нормы применения препарата. Латентный период варьировал от 168 ч (в контроле без обработки) и до 233 часов (вариант с Колосаль, КЭ при норме применения 0.7 л/га).
Таким образом, прослеживается обратная корреляция между нормой применения фунгицида и показателями агрессивности патогена: с увеличением одного показателя другой снижается.
Изучено влияние фунгицида Колосаль, КЭ на вирулентность популяции возбудителя бурой ржавчины пшеницы (табл. 1).
Таблица 1.
Частота изолятов с генами вирулентности (pp) в северокавказской популяции возбудителя бурой ржавчины пшеницы под воздействием разных норм применения фунгицида Колосаль, КЭ
| Ген Lr | Исходная (без обработки фунгицидом) выборка | Норма применения фунгицида | ||||
|---|---|---|---|---|---|---|
| 0.3 л/га | 0.4 л/га | 0.5 л/га | 0.6 л/га | 0.7 л/га | ||
| Частота изолятов в образцах урединиоспор, % | ||||||
| 1 | 49 | 9 | 57 | 49 | 11 | 20 |
| 2а | 1 | 0 | 0 | 0 | 0 | 0 |
| 2с | 19 | 11 | 9 | 7 | 6 | 0 |
| 3 | 69 | 79 | 61 | 56 | 58 | 50 |
| 9 | 0 | 0 | 0 | 0 | 0 | 0 |
| 16 | 33 | 63 | 44 | 41 | 35 | 32 |
| 24 | 0 | 0 | 0 | 0 | 0 | 0 |
| 26 | 42 | 40 | 29 | 31 | 25 | 18 |
| 3ka | 27 | 39 | 33 | 24 | 21 | 6 |
| 11 | 74 | 12 | 27 | 47 | 45 | 46 |
| 17 | 46 | 79 | 62 | 49 | 51 | 45 |
| 30 | 2 | 0 | 0 | 5 | 1 | 4 |
| В | 53 | 58 | 42 | 41 | 39 | 39 |
| 10 | 47 | 64 | 48 | 47 | 45 | 42 |
| 14а | 53 | 50 | 34 | 30 | 32 | 34 |
| 18 | 27 | 23 | 18 | 14 | 18 | 18 |
| 3bg | 39 | 18 | 23 | 12 | 19 | 10 |
| 14b | 53 | 36 | 29 | 27 | 35 | 33 |
| 20 | 0 | 0 | 0 | 0 | 0 | 0 |
| 28 | 0 | 0 | 0 | 0 | 0 | 0 |
| Средняя вирулентность, % | 31.7 | 29.1 | 25.8 | 24.0 | 22.1 | 19.9 |
Установлено, что под влиянием химического фунгицида Колосаль, КЭ существенно не изменялась частота изолятов, вирулентных к Lr2а, Lr9, Lr16, Lr24, Lr17, Lr30, Lr10, Lr18, Lr20, Lr28, оставаясь на уровне их встречаемости в популяции патогена, не обработанной препаратом. Отрицательный отбор отмечен для изолятов с генами рр: 1, 2с, 3, 26, 3kа, 11, В, 14а, 3bg, 14b. С увеличением нормы применения фунгицида произошло уменьшение количества изолятов с генами рр: 2с, 3, 26, 3kа, В, 14а; увеличилась частота p11. Средняя вирулентность популяции P. triticina в контроле (без обработки) составила 31.7%, в варианте с нормой применения фунгицида 0.3 л/га – 29.1%; 0.4 л/га – 25.8%; 0.5 л/га – 24.0%; 0.6 л/га – 22.1%. При использовании повышенной нормы 0.7 л/га, средняя вирулентность была в 1.6 раза меньше показателя в контроле и составила 19.9%.
Согласно индексу Нея, максимальные различия (N = 0.149) по частоте изолятов, вирулентных к линиям с генами Lr, получены между исходной популяцией (контроль без обработки) и вариантом с пониженной нормой применения фунгицида (0.3 л/га). С увеличением нормы применения препарата до рекомендуемой, значение индекса Нея снижается до 0.04 у.е., а при дальнейшем увеличении нормы применения варьирует незначительно (N = 0.041–0.047). Полученные результаты свидетельствуют о том, что при пониженных нормах применения фунгицида наблюдаются более значительные изменения генетической структуры популяции фитопатогена.
Была проведена оценка влияния разных норм применения фунгицида на изменение фенотипического состава возбудителя бурой ржавчины пшеницы (табл. 2).
Таблица 2.
Изменение фенотипического состава возбудителя бурой ржавчины пшеницы под влиянием различных норм применения фунгицида Колосаль, КЭ
| Ген Lr | Исходная (без обработки фунгицидом) выборка | Норма применения фунгицида | ||||
|---|---|---|---|---|---|---|
| 0.3 л/га | 0.4 л/га | 0.5 л/га | 0.6 л/га | 0.7 л/га | ||
| Тип реакции сортов на заражение, балл | ||||||
| 1 | 3 | 3 | 3 | 3 | 3 | 3 |
| 2а | 2 | 2 | 2 | 2 | 2 | 2 |
| 2с | 3 | 3 | 3 | 3 | 3 | 2 |
| 3 | 3 | 3 | 3 | 3 | 3 | 3 |
| 9 | 0 | 0 | 0 | 0 | 0 | 0 |
| 16 | 2 | 3 | 3 | 3 | 3 | 3 |
| 24 | 2 | 1 | 1 | 1 | 1 | 1 |
| 26 | 3 | 3 | 3 | 3 | 3 | 3 |
| 3ka | 3 | 3 | 3 | 3 | 3 | 2 |
| 11 | 3 | 3 | 3 | 3 | 3 | 3 |
| 17 | 3 | 3 | 3 | 3 | 3 | 3 |
| 30 | 2 | 2 | 1 | 2 | 1 | 1 |
| В | 3 | 3 | 3 | 3 | 3 | 3 |
| 10 | 3 | 3 | 3 | 3 | 3 | 3 |
| 14а | 3 | 3 | 3 | 2 | 3 | 3 |
| 18 | 3 | 3 | 2 | 3 | 3 | 3 |
| 3bg | 3 | 2 | 3 | 2 | 3 | 3 |
| 14b | 3 | 3 | 3 | 3 | 3 | 3 |
| 20 | 0 | 0 | 0 | 0 | 0 | 0 |
| 28 | 0 | 0 | 0 | 0 | 0 | 0 |
| фенотип | MHSTQ | PHSTG | PHSTQ | PHSRG | PHSTQ | MHJTQ |
Отмечены изменения в реакции на заражение изогенных линий, несущих гены устойчивости Lr2с, Lr3ka. Тип поражения этих линий в варианте с повышенной нормой применения препарата (0.7 л/га) снижался с 3 баллов до 2. Под воздействием фунгицида, независимо от нормы препарата, тип поражения сорта с геном устойчивости Lr24 снижался с 2 баллов до 1. Тип реакции изогенных линий, несущих гены устойчивости Lr1, Lr2а, Lr3, Lr9, Lr26, Lr11, Lr17, LrВ, Lr10, Lr14b, Lr20, Lr28 оставался на уровне исходной популяции, не подвергавшейся обработке фунгицидом.
В результате анализа фенотипического состава популяции возбудителя бурой ржавчины выявлено 6 различных фенотипов PHSTG (норма применения 0.3 л/га), PHSTQ (0.4 л/га), PHSRG (0.5 л/га), PHSTQ (0.6 л/га), MHJTQ (0.7 л/га), MHSTQ (без обработки фунгицидом).
Таким образом, установлено влияние химического фунгицида Колосаль, КЭ на вирулентность возбудителя бурой ржавчины (P. triticina). С увеличением нормы применения фунгицида снижалась средняя вирулентность популяции и тип реакции на заражение.
ОБСУЖДЕНИЕ
Механизм возникновения устойчивости к фунгицидам азольной группы гриба P. triticina заключается в сверхэкспрессии фермента CYP51, которая может быть вызвана изменениями в промоторной области гена, кодирующего CYP51, вставкой тандемных повторов или мобильных элементов (Price et al., 2015). Возникновение устойчивости возбудителя бурой ржавчины к эпоксиконазолу (триазол) обусловлено изменением последовательности в аминокислоте Y134F фермента CYP51 (Stammler, 2009).
Происхождение резистентности к моносайтовым фунгицидам, одним из которых является Колосаль, очень стремительно, поэтому одна мутация может способствовать полной потере чувствительности (Dyakov et al., 2007).
В результате исследований установлено, что популяция возбудителя бурой ржавчины, подвергавшаяся однократной обработке химическим фунгицидом на основе тебуконазола (триазол), характеризуется общим снижением патогенности и агрессивности.
Полученные нами результаты сопоставимы с данными других исследователей. Учеными из Великобритании доказано, что многолетнее воздействие азольных средств защиты привело к увеличению устойчивости у некоторых грибных патогенов растений. Первый случай наблюдался у возбудителя мучнистой росы (Sphaerotheca fuliginea), и с тех пор устойчивость была обнаружена у ряда других заболеваний, включая Septoria tritici (септориоз листьев пшеницы) и Puccinia triticina (бурая ржавчина пшеницы) (Price et al., 2015).
Отмечена устойчивость к триазолам (эпоксиканозол) в бразильских популяциях возбудителя бурой ржавчины пшеницы (Arduim et al., 2012) и возбудителя мучнистой росы Blumeria graminis tritici (Tonin et al., 2013). Также несколько бразильских популяций Pyricularia oryzae проявили высокую устойчивость к тебуконазолу и эпоксиконазолу со значениями EC50, которые в 35–50 раз выше рекомендованных полевых доз (Poloni, 2021).
Известно, что резистентные формы чаще имеют пониженную приспособленность, что значительно замедляет перестройку популяции у грибов с одной или несколькими генерациями. Но при быстром росте популяции скорость вытеснения чувствительного штамма резистентным уменьшается незначительно (Dyakov, 1998; Elansky et al., 2007). Это является основанием для детального изучения снижения чувствительности Puccinia triticina к фунгициду, так как патоген при благоприятных погодных условиях способен давать до 6 уредогенераций в год (Markelova, 2013).
В работах Ю.Т. Дьякова применение высоких доз фунгицида сопровождалось падением патогенности (Dyakov, 1998), что подтверждает наши результаты, но в последующие годы этот показатель возрастал или превосходил исходное значение (Derevyagina et al., 1999; Dyakov et al., 2007).
Наблюдается снижение чувствительности фитопатогена Fusarium graminearum к действующим веществам метконазол и тебуконазол после его широкого применения на посевах озимой пшеницы в США (Anderson et al., 2020).
В Китае двукратное применение препарата на основе тебуконазола способствовало более высокому селективному давлению на популяцию Aspergillus fumigatus томата, что способствовало появлению триазолрезистентных форм (Cao et al., 2020).
Сильное ингибирующее действие на ооспорообразование возбудителя фитофтороза картофеля (Phytophthora infestans) отмечено при применении фунгицидов с действующими веществами флудиоксонил (фенилпирролы) и дифеноконазол (триазолы). С увеличением концентрации фунгицида эффект подавления образования ооспор был наиболее выражен (Mita, 2015).
Под действием водного раствора бензимидазола (40 мг/л) отмечена авирулентность возбудителя листовой ржавчины ржи (Puccinia dispersa). При этом снижались и показатели агрессивности (количество пустул на единицу площади листовой поверхности, спорулирующая способность пустул) в сравнении с контролем (Tyryshkin, 2017).
Установлено влияние комбинированного фунгицида Рекс дуо, КС (310 + 87 г/л) на структуру популяции возбудителя бурой ржавчины пшеницы P. triticina (Kolbin et al., 2010). Применение препарата сопровождалось элиминацией изолятов, вирулентных к Lr15, Lr20, Lr21, Lr25, Lr29, Lr36 и снижением частоты встречаемости генов p3bg, р18, p23, p28, p33. Средняя вирулентность популяции при этом снижалась.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований установлено, что фунгицид триазолового класса Колосаль, КЭ (д.в. тебуконазол, 250 г/л) эффективен против возбудителя бурой ржавчины, но рекомендуемая для сельскохозяйственного производства против данного патогена норма применения 0.5 л/га уже не обеспечивает полного подавления развития патогена. Биологическая эффективность составила 77.5%. При повышении нормы применения до 0.6 и 0.7 л/га эффективность увеличилась и достигала 82.4 и 87.3% соответственно. Таким образом, можно предположить, что в северокавказской популяции P. triticina существует сдвиг чувствительности к фунгициду триазолового класса Колосаль, КЭ. Показатели СК50 и СК95 для препарата Колосаль, КЭ составили 63 мг/мл и 217 мг/мл соответственно, что выше рекомендованной концентрации в рабочем растворе (СК95 – 125 мг/мл).
Определено влияние повышения нормы применения фунгицида на показатели агрессивности. С увеличением нормы применения фунгицида снижалась жизнеспособность спор, она варьировала от 100% (контроль без обработки) до 21.5% (норма применения 0.7 л/га). Снижалась спорулирующая способность и длительность споруляции с 0.07 мг спор с одной пустулы и 13 суток (контроль без обработки) до 0.02 мг спор с одной пустулы и 8 суток (норма применения 0.7 л/га). Увеличивалась длительность латентного периода с 168 ч (контроль без обработки) и до 233 часов (норма применения 0.7 л/га). Установлено влияние разных норм применения фунгицида на вирулентность и изменение фенотипического состава. Средняя вирулентность популяции P. triticina снижалась от 31.7% (контроль, без обработки) до 19.9% (норма применения 0.7 л/га). Согласно индексу Нея выявлены незначительные изменения в структуре популяции возбудителя бурой ржавчины пшеницы под влиянием тебуконазола. Под влиянием разных концентраций препарата меняется фенотипический состав. Выявлены 6 различных фенотипов: PHSTG (норма применения 0.3 л/га), PHSTQ (0.4 л/га), PHSRG (0.5 л/га), PHSTQ (0.6 л/га), MHJTQ (0.7 л/га), MHSTQ (без обработки фунгицидом).
Проведенные исследования позволяют прогнозировать изменения в генофонде вирулентности популяции возбудителя бурой ржавчины пшеницы под действием фунгицида и в дальнейшем корректировать применение химических средств.
Для снижения развития резистентности необходимо проводить мониторинг посевов для контроля заболевания и применять фунгициды, когда развитие болезни достигло ЭПВ. Важно использовать фунгициды в интегрированной системе защиты с рекомендованной нормой применения, обеспечивающей эффективный контроль заболевания, а также фунгициды с различным механизмом действия (Fungicide performance..., 2018). Использование смеси препаратов из разных химических классов позволит контролировать большой спектр заболеваний, а также предотвратит распространение устойчивых рас патогена при наличии резистентности (Fungicide resistance management.., 2019; FRAC recommendations.., 2010).
Исследования выполнены согласно государственному заданию Министерства науки и высшего образования РФ в рамках НИР по теме № FGRN-2022-0004.
Список литературы
Anderson N.R., Freije A.N., Bergstrom G.C. et al. Sensitivity of Fusarium graminearum to metconazole and tebuconazole fungicides before and after widespread use in wheat in the United States. Plant Health Progress. 2020. V. 21. № 2. P. 85–90.
Anpilogova L.K., Volkova G.V. Methods for creating artificial infectious backgrounds and assessing wheat cultivars for resistance to harmful diseases (fusarium ear blight, rust, powdery mildew). Recommendations. Krasnodar, 2000 (in Russ.).
Arduim F.S., Reis E.M., Barcellos A.L. et al. In vivo sensitivity reduction of Puccinia triticina races, causal agent of wheat leaf rust, to DMI and QoI fungicides. Summa Phytopathologica. 2012. V. 38. P. 306–311.
Batmanova A.A. Induction of resistance of fungi and plants when using fungicides. Biotika. 2015. № 3. P. 3–6 (in Russ.).
Bounds P., Blake J., Fraaije B. Project Report N 488. Fungicide performance on winter wheat. 2012.
Brent K.J., Hollomon D.W. Fungicide resistance in crop pathogens: how can it be managed? Published by the Fungicide Resistance Action Committee. FRAC. Monograph N 1. Basel, 2007.
Brent K.J., Hollomon D.W. Fungicide resistance: the assessment of risk. Monograph. Basel, 2007.
Cao D., Wu R., Dong S. et al. Triazole resistance in Aspergillus fumigatus in crop plant soil after tebuconazole applications. Environmental Pollution. V. 2020. https://doi.org/10.1016/ j.envpol.2020.115124
Chekmarev V.V. Changes in the species composition of the Fusarium under the influence of disinfectants. Zashchita i karantin rasteniy. 2012. № 2. P. 27–28 (in Russ.).
Country overview of the production and use of highly hazardous pesticides in Russia. Moscow, 2020. (Country overview) https://ipen.org/sites/default/files/documents/ final_russia_hhp_country_situation_report_ru_and_ en_14_may_2020.pdf. Acessed: 17.01.2021 (in Russ.).
Damicone J.P. Fungicide resistance management. Oklahoma cooperative extension. https://shareok.org/bitstream/handle/11244/319916/oksa_epp_7663_2014-02.pdf?sequence=1
Derevyagina M.K., Elansky S.N., Dyakov Yu.T. Resistance of Phytophthora infestans to the dimethomorph fungicide. Mikologiya i fitopatologiya. 1999. V. 33 (3). P. 208–213 (in Russ.).
Dubrovskaya N.N. A new method of studying the resistance of the Fusarium fungi to fungicides. In: Russian science in the modern world Moscow, 2019. P. 5–7 (in Russ.).
Dyakov Yu.T. Population biology of phytopathogenic fungi. Moscow, 1998 (in Russ.).
Dyakov Yu.T., Elansky S.N. Population genetics of Phytophthora infestans. In: Mycology today. V. 1. Moscow, 2007. P. 107–139 (in Russ.).
Elansky S.N., Dyakov Yu.T., Milyutina D.I. Populations of the causative agent of potato late blight in Russia. In: Potato growing in Russia: topical problems of science and practice. Moscow, 2007. P. 103–111 (in Russ.).
Filippov A.V., Kuznetsova M.A., Rogozhin A.N. How to maintain the resistance of potatoes to fungicides. Kartofel i ovoshchi. 2016. V. 4. P. 26–28 (in Russ.).
FRAC recommendations for fungicide mixtures designed to delay resistance evolution. FRAC. Basel, 2010.
FRAC. Pathogen risk list. Basel, 2019.
Fungicide performance update for wheat, barley and oilseed rape. NIAB, Edgmond, 2018. ahdb.org.uk/knowledge-library/fungicide-performance
Fungicide resistance management in cereals FRAG-UK, Kenilworth, 2019.
Guidelines for state testing of fungicides, antibiotics and seed dressing for agricultural crops. Moscow, 1985.
Gultyaeva E.I., Gasich E.L., Levitin M.M. et al. Diseases of cereals and rapeseed in the northwest region in 2016. Zashchita i karantin rasteniy. 2017. № 4. P. 27–29 (in Russ.).
Gultyaeva E.I., Shaydayuk E.L., Kazartsev I.A. et al. The structure of Russian populations of the fungus Puccinia triticina Erikss. Vestnik zashchity rasteniy. 2015. № 3 (85). P. 5–10 (in Russ.).
HGCA project report N 68. Fungicide insensitivity in cereal brown rust fungi. Kenilworth, 1992.
HGCA Topic Sheet 120/Winter 2012 Wheat brown rust management. Kenilworth, 2012.
Kartashov M.I., Shcherbakova L.A., Statsyuk N.V. et al. So-application of difenoconazole with thymol results in suppression of a Parastagonospora nodorum mutant strain resistant to this triazole. Adv. Engineering Res. 2019. V. 183. P. 1–5.
Klimova E.V. Resistance of the population of the fungus Fusarium nivale to foundazol. Ekologicheskaya bezopasnost v agropromyshlennom komplekse. 2003. № 2. P. 466 (in Russ.).
Kolbin D.A., Volkova G.V. The effect of fungicides of different chemical classes on the virulence gene pool of the North Caucasian population of wheat brown rust (causative agent puccinia triticina eriks.) In the south of Russia. Elektronnyy zhurnal Kubanskogo gosudarstvennogo agrarnogo universiteta. 2010. № 62. P. 128–137 (in Russ.).
Lapach S.N., Chubenko A.V., Babich P.N. Statistical methods in biomedical research using Excel. Kiev, 2000 (in Russ.).
Levitin M.M., Mironenko N.V. The structure and areas of populations of phytopathogenic fungi. Biosfera. 2016. V. 8. № 2. P. 216–225 (in Russ.).
Levshakov L.V., Rusanova Yu.Yu. The use of fungicides on winter wheat crops and their impact on yield and grain quality on gray forest soils of the Central Chernozemye. Vestnik Kurskoy selkhozakademii. 2015. № 6. P. 45–46 (in Russ.).
Lobodina E.V., Astapchuk I.L., Nasonov A.I. The sensitivity of the population of the causative agent of apple scab Venturia inaequalis to difenoconazole. Naucnye trudy Severokavkazskogo nauchnogo tsentra sadovodstva, vinogradarstva, vinodeliya. 2019. V. 26. P. 165–169 (in Russ.).
Markelova T.S., Ivanova O.V., Naryshkina E.A. et al. Biological features of wheat brown rust. In: Problems of mycology and phytopathology in the XXI century: materials of the International scientific conference dedicated to the 150th anniversary of the birth of corresponding member of the USSR Academy of Sciences, Professor Artur Arturovich Yachevsky: collection of scientific papers. SPb., 2013. P. 177–179 (in Russ.).
Mikhaylova L.A., Gultyaeva E.I., Mironenko N.V. Methods for studying the population structure of the causative agent of wheat brown rust Puccinia recondita Rob. ex Desm. f. sp. tritici. Immunogenetic methods for creating varieties resistant to pests (Guidelines). VIZR, SPb., 2003 (in Russ.).
Mytsa E.D. Effect of some pesticides on causative agents of fungal diseases of potato (Solanum tuberosum L.) and tomato (Lycopersicon esculentum Mill.). Abstract of thesis. … Cand. Biol. MGU, Moscow, 2015 (in Russ.).
Pasko T.I. The effectiveness of fungicides on winter wheat // International Journal of Humanities and Natural Sciences. 2018. № 3. P. 1–3 (in Russ.).
Pathogen risk list. FRAC, Basel, 2019.
Poloni N.M., Carvalho G., Nunes Campos Vicentini S. et al. Widespread distribution of resistance to triazole fungicides in Brazilian populations of the wheat blast pathogen. Plant Pathol. 2021.
Price C.L., Parker J.E., Warrilow A.G. et al. Azole fungicides – understanding resistance mechanisms in agricultural fungal pathogens. Pest. Manag. Sci. 2015. V. 71. P. 1054–1058. https://doi.org// 10.1002/ps.4029
Pyzhikova G.V. Influence of temperature on infection and development of yellow rust in wheat. Mikologiya i fitopatologiya. 1972. V. 6 (3). P. 51–53 (in Russ.).
Sanin S.S. Plant disease epidemics: monitoring, prognosis, control. Zashchita i karantin rasteniy. 2018. № 1. P. 35–36 (in Russ.).
Sanin S.S., Shinkarev V.P., Kaydash A.S. Methods for determining the number of spores formed by rust and other phytopathogenic fungi. Mikologiya i fitopatologiya. 1975. V. 9 (3). P. 443–445 (in Russ.).
Savchenko A.A. Productivity and grain quality of spring wheat under the influence of fungicides and growth regulators. Vestnik Krasnodarskogo gosudarstvennogo agrarnogo universiteta. 2007. № 2. P. 324–326 (in Russ.).
Shcherbakova L.A. Development of resistance to fungicides in phytopathogenic fungi and their chemosensitization as a way to increase the protective efficacy of triazoles and strobilurins (review) // Agricultural biology. 2019. T 54. № 5. S. 875–891 (in Russ.).
Stammler G., Cordero J., Koch A. et al. Role of the Y134F mutation in cyp51 and overexpression of cyp51 in the sensitivity response of Puccinia triticina to expoxiconazole. Crop Protection. 2009. V. 28 (10). P. 891–897.
Strategy for preventing the spread of antimicrobial resistance in the Russian Federation for the period up to 2030 Order of the Government of the Russian Federation. Moscow, 2017 (in Russ.).
Sukhoruchenko G.I. (Sukhoruchenko) Pest resistance to pesticides in Russia. Zashchita i karantin rasteniy. 2020 (1). P. 14–18 (in Russ.).
Tonin R.F.B., Reis E.M., Danelli A.L.D. Etiologia e quantificação dos agentes causais demanchas foliares na cultura do trigo nas safras 2008 a 2011. Summa Phytopathologica. 2013. V. 39. P. 102–109.
Tyryshkin L.G., Sidorov A.V. Changes in virulence and aggressiveness of the causative agent of rye leaf rust under the influence of abiotic factors and the possibility of its practical application. Izvestiya Sankt-Peterburgskogo agrarnogo universiteta. 2017. № 1 (46). P. 58–63 (in Russ.).
Volkova G.V. Resistance of wheat yellow rust pathogen to bayleton. Abstract of thesis. … Cand. Biol. Krasnodar, 1996 (in Russ.).
Volkova G.V. Fungicide-resistant form of wheat yellow rust pathogen. Agrokhimiya. 1995. № 1. P. 79–83 (in Russ.).
Volkova G.V. Generation of resistance in wheat yellow rust (causative agent Puccinia striiformis) to fungicides. Vestnik zashchity rasteniy. 2001. № 2. P. 29–34 (in Russ.).
Volkova G.V. The structure and variability of populations of pathogens of brown and yellow rust of wheat in the North Caucasus and the substantiation of methods for managing intrapopulation processes. Thesis … Dr. Sci. Biol. All-Russian Research Institute for Plant Protection, SPb., 2006 (in Russ.).
Volkova G.V. Anti-resistance strategy for the use of fungicides based on triadimefon against the causative agent of wheat yellow rust in the North Caucasus. Nauka Kubani. 2007. № 2. P. 39–43 (in Russ.).
Volkova G.V., Anpilogova L.K., Alekseeva T.P. et al. Study and monitoring of patterns and mechanisms of the formation of resistance to fungicides in populations of pathogens of economically significant wheat diseases. Nauka Kubani. 2009. № 3. P. 50–53 (in Russ.).
Wolfe M.S., Schwarzbach E. The use of virulence analysis in cereal mildews. Phytopath. Ztschr. 1975. V. 82 (4). P. 297–307.
Zakharenko V.A. Pest resistance to pesticides is a global problem. Vestnik zashchity rasteniy. 2001. № 1. P. 3–17 (in Russ.).
Zakharychev V.V. Fungi and fungicides: a tutorial. Lan, SPb., 2019 (in Russ.).
Zeleneva Yu.V., Afanasenko O.S., Sudnikova V.P. Species composition of wheat disease pathogens in the Central Black Earth Region. Vestnik Michurinskogo gosudarstvennofo agrarnogo universiteta. 2019. № 3 (58). P. 58–63 (in Russ.).
Анпилогова Л.К., Волкова Г.В. (Anpilogova, Volkova) Методы создания искусственных инфекционных фонов и оценки сортообразцов пшеницы на устойчивость к вредоносным болезням (фузариозу колоса, ржавчинам, мучнистой росе). Рекомендации. Краснодар, 2000. 28 с.
Батманова А.А. (Batmanova) Индукция резистентности грибов и растений при применении фунгицидов // Биотика. 2015. № 3. С. 3–6.
Волкова Г.В. (Volkova) Фунгицидоустойчивая форма возбудителя желтой ржавчины пшеницы // Агрохимия. 1995. № 1. С. 79–83.
Волкова Г.В. (Volkova) Резистентность возбудителя желтой ржавчины пшеницы к байлетону. Автореферат дисс. … канд. биол. наук. Краснодар: ВНИИ биол. защиты растений, 1996. 21 с.
Волкова Г.В. (Volkova) Генерация резистентности у желтой ржавчины пшеницы (возбудитель Puccinia striiformis West.) к фунгицидам // Вестник защиты растений. 2001. № 2. С. 29–34.
Волкова Г.В. (Volkova) Структура и изменчивость популяций возбудителей бурой и желтой ржавчины пшеницы на Северном Кавказе и обоснование приемов управления внутрипопуляционными процессами. Дисс. … докт. биол. наук. СПб.: ВИЗР, 2006.
Волкова Г.В. (Volkova) Антирезистентная стратегия применения фунгицидов на основе триадимефона против возбудителя желтой ржавчины пшеницы на Северном Кавказе // Наука Кубани. 2007. № 2. С. 39–43.
Волкова Г.В., Анпилогова Л.К., Алексеева Т.П. и др. (Volkova et al.) Изучение и мониторинг закономерностей и механизмов формирования резистентности к фунгицидам в популяциях возбудителей экономически значимых болезней пшеницы // Наука Кубани. 2009. № 3. С. 50–53.
Гультяева Е.И., Гасич Е.Л., Левитин М.М. и др. (Gultyaeva et al.) Болезни зерновых культур и рапса в Северо-Западном регионе в 2016 г. // Защита и карантин растений. 2017. № 4. С. 27–29.
Гультяева Е.И. Шайдаюк Е.Л., Казарцев И.А. и др. (Gultyaeva et al.) Структура российских популяций гриба Puccinia triticina Erikss. // Вестник защиты растений. 2015. № 3 (85). С. 5–10.
Деревягина М.К., Еланский С.Н., Дьяков Ю.Т. (Derevyagina et al.) Резистентность Phytophthora infestans к фунгициду диметоморфу // Микология и фитопатология. 1999. Т. 33. № 3. С. 208–213.
Дубровская Н.Н. (Dubrovskaya) Новый способ изучения резистентности видов грибов рода Fusarium к фунгицидам // Российская наука в современном мире: сборник статей XX международной научно-практической конференции. Москва, 2019. С. 5–7.
Дьяков Ю.Т. (Dyakov) Популяционная биология фитопатогенных грибов. М., 1998. 377 с.
Дьяков Ю.Т., Еланский С.Н. (Dyakov et al.) Популяционная генетика Phytophthora infestans // Микология сегодня. Т. 1. М.: Национальная академия микологии, 2007. С. 107–139.
Еланский С.Н., Дьяков Ю.Т., Милютина Д.И. (Elansky et al.) Популяции возбудителя фитофтороза картофеля в России // Картофелеводство России: актуальные проблемы науки и практики. Материалы Международного конгресса “Картофель. Россия – 2007”. Министерство сельского хозяйства Российской Федерации, Российская академия сельскохозяйственных наук. Москва, 2007. С. 103–111.
Захаренко В.А. (Zakharenko) Проблема резистентности вредных организмов к пестицидам – мировая проблема // Вестник защиты расений. 2001. № 1. С. 3–17.
Захарычев В.В. (Zakharychev) Грибы и фунгициды: учебное пособие. 2-е изд., перераб. Санкт-Петербург: Лань, 2019. 272 с.
Зеленева Ю.В., Афанасенко О.С., Судникова В.П. (Zeleneva) Видовой состав возбудителей болезней пшеницы в ЦЧР // Вестник Мичуринского государственного аграрного университета. 2019. № 3 (58). С. 58–63.
Климова Е.В. (Klimova) Резистентность популяции гриба Fusarium nivale к фундазолу // Экологическая безопасность в АПК. Реферативный журнал. 2003. № 2. С. 466.
Кольбин Д.А., Волкова Г.В. (Kolbin, Volkova) Воздействие фунгицидов разных химических классов на генофонд вирулентности северокавказской популяции бурой ржавчины пшеницы (возбудитель Puccinia triticina Erikss.) на юге России // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. 2010. № 62. С. 128–137.
Лапач С.Н., Чубенко А.В., Бабич П.Н. (Lapach et al.) Статистические методы в медико-биологических исследованиях с использованием Excel. Киев: Морион, 2000. 320 с.
Левитин М.М., Мироненко Н.В. (Levitin, Mironenko) Структура и ареалы популяций фитопатогенных грибов // Биосфера. 2016. Т. 8. № 2. С. 216–225.
Левшаков Л.В., Русанова Ю.Ю. (Levshakov, Rusanova) Применение фунгицидов на посевах озимой пшеницы и их влияние на урожайность и качество зерна на серых лесных почвах ЦЧЗ // Вестник Курской государственной сельскохозяйственной академии. 2015. № 6. С. 45–46.
Лободина Е.В., Астапчук И.Л., Насонов А.И. (Lobodina et al.) Чувствительность популяции возбудителя парши яблони Venturia inaequalis к дифеноконазолу // Научные труды Северо-Кавказского федерального научного центра садоводства, виноградарства, виноделия. 2019. Т. 26. С. 165–169.
Маркелова Т.С., Иванова О.В., Нарышкина Е.А. и др. (Markelova) Биологические особенности бурой ржавчины пшеницы // Проблемы микологии и фитопатологии в XXI веке: материалы Международной научной конференции, посвященной 150-летию со дня рождения члена-корреспондента АН СССР, профессора Артура Артуровича Ячевского: сборник научных статей. СПб., 2013. С. 177–179.
Методические указания по государственным испытаниям фунгицидов, антибиотиков и протравителей семян сельскохозяйственных культур (Methodical). Под ред. К.В. Новожилова. М., 1985. 130 с.
Михайлова Л.А., Гультяева Е.И., Мироненко Н.В. (Mikhaylova et al.) Методы исследования структуры популяций возбудителя бурой ржавчины пшеницы Puccinia recondita Rob. ex Desm. f.sp. tritici // Иммуногенетические методы создания устойчивых к вредным организмам сортов (Методические рекомендации). СПб.: ВИЗР, 2003. 26 с.
Мыца Е.Д. (Mytsa) Влияние некоторых пестицидов на возбудителей грибных болезней картофеля (Solanum tuberosum L.) и томата (Lycopersicon esculentum Mill.). Автореф. дисс. … канд. биол. наук. М.: МГУ, 2015.
Обзор фитосанитарного состояния посевов сельскохозяйственных культур в Российской Федерации в 2020 году и прогноз развития вредных объектов в 2021 году (Overview of phytosanitary status) / под ред. Д.Н. Говоров 132 стр. 2021 г. Министерство сельского хозяйства РФ, ФГБУ Российский сельскохозяйственный центр.
Обзор фитосанитарного состояния посевов сельскохозяйственных культур в Российской Федерации в 2019 году и прогноз развития вредных объектов в 2020 году (Overview of phytosanitary status) / Д.Н. Говоров 897 стр. 2020 г. Министерство сельского хозяйства РФ, ФГБУ Российский сельскохозяйственный центр.
Пасько Т.И. (Pasko) Эффективность фунгицидов на озимой пшенице // Международный журнал гуманитарных и естественных наук. 2018. № 3. С. 1–3.
Пыжикова Г.В. (Pyzhikova) Влияние температуры на инфекцию и развитие желтой ржавчины пшеницы // Микология и фитопатология. 1972. Т. 6. № 3. С. 51–53.
Савченко А.А. (Savchenko) Урожайность и качество зерна яровой пшеницы под влиянием фунгицидов и регуляторов роста // Вестник КрасГАУ. 2007. № 2. С. 324–326.
Санин С.С. (Sanin) Методы определения количества спор, образуемых ржавчинными и другими фитопатогенными грибами // Микология и фитопатология. 1975. Т. 9. № 3. С. 443–445.
Санин С.С. (Sanin) Эпидемии болезней растений: мониторинг, прогноз, контроль // Защита и карантин растений. 2018. № 1. С. 35–36.
Страновой обзор производства и использования особо опасных пестицидов в России. Москва, Россия, 2020. (Country overview) https://ipen.org/sites/default/files/documents/ final_russia_hhp_country_situation_report_ru_and_en_14_may_2020.pdf (дата обращения: 17.01.2021).
Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года. Распоряжение Правительства РФ 2045-р от 25 сентября 2017 г. (Strategy). M., 2017.
Сухорученко Г.И. (Sukhoruchenko) Резистентность вредных организмов к пестицидам в России // Защита и карантин растений. 2020. № 1. С. 14–18.
Тырышкин Л.Г., Сидоров А.В. (Tyryshkin, Sidorov) Изменение вирулентности и агрессивности возбудителя листовой ржавчины ржи под действием абиотических факторов и возможность его практического применения // Известия Санкт-Петербургского государственного аграрного университета. 2017. № 1 (46). С. 58–63.
Филиппов А.В., Кузнецова М.А., Рогожин А.Н. (Filippov et al.) Как сохранить устойчивость картофеля к фунгицидам // Картофель и овощи. 2016. № 4: 26–28.
Чекмарев В.В. (Chekmarev) Изменение видового состава грибов рода Fusarium под действием протравителей // Защита и карантин растений. 2012. № 2. С. 27–28.
Щербакова Л.А. (Shcherbakova) Развитие резистентности к фунгицидам у фитопатогенных грибов и их хемосенсибилизация как способ повышения защитной эффективности триазолов и стробилуринов (обзор) // Сельскохозяйственная биология. 2019. Т. 54. № 5. С. 875–891.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


