Микология и фитопатология, 2022, T. 56, № 2, стр. 140-152
Выявление антракноза земляники и методы диагностики возбудителей заболевания
Ю. В. Цветкова 1, 2, *, А. А. Кузнецова 1, **
1 Всероссийский центр карантина растений
140150 Раменское, Россия
2 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: yutska@mail.ru
** E-mail: kyyznec@bk.ru
Поступила в редакцию 01.10.2021
После доработки 20.12.2021
Принята к публикации 23.12.2021
- EDN: QBZNGF
- DOI: 10.31857/S0026364822020118
Аннотация
Антракноз земляники, вызываемый грибами рода Colletotrichum – опасное заболевание, наносящее существенный ущерб в ягодных насаждениях. В отечественном и импортном посадочном материале растений земляники были выявлены виды Colletotrichum nymphaeae, C. lineola, C. godetiae. В работе описаны культурально-морфологические характеристики полученных изолятов, проведен анализ нуклеотидных последовательностей участков ITS1–5.8S–ITS2. Показано, что для дифференциации видов C. lineola и близкородственного С. dematium эффективными являются участки гена глицеральдегид-3-фосфатдегидрогеназы и гена актина. Проведено сравнение двух диагностических тест-систем для идентификации комплекса acutatum. Изучаемые тест-системы не показали ложноположительных результатов; готовый набор “С. acutatum complex-РВ” (ЗАО “Синтол”) показал специфичность только к видам C. nymphaeae и C. fioriniae, и оказался неспецифичен к виду C. godetiae, входящему в комплекс acutatum. Диагностическая система, разработанная Гарридо и сотрудниками, показала высокую чувствительность и специфичность по отношению к целевым видам комплекса acutatum.
ВВЕДЕНИЕ
Земляника, в силу своей питательной ценности, вкусовых качеств и высокой адаптивной способности к различным эдафоклиматическим условиям, является одной из наиболее распространенных ягодных культур во всем мире. Вместе с тем, растения земляники сильно подвержены различным болезням, в особенности микозам: в литературе описано около 80 различных заболеваний, возбудителями которых являются грибы и грибоподобные организмы (Govorova et al., 2010). Фитопатогены рода Colletotrichum вызывают антракноз земляники, проявляющийся в виде гнили плодов, ожога цветков, пятнистости листьев, язв на стеблях и черешках, загнивания рожков. Растения земляники поражает ряд видов: Colletotrichum nymphaeae, C. simmondsii, C. fioriniae, C. godetiae, C. salicis, C. cuscutae, C. miaoliense, С. acutatum s.str., относящихся к комплексу acutatum, C. aenigma, C. fructicola, C. siamense, C. theobromicola, C. gloeosporioides, C. murrayae из комплекса gloeosporioides, C. boninense, C. karstii из комплекса boninense (Damm et al., 2012; Weir et al., 2012; Zhang et al., 2015; Chen et al., 2019; Chung et al., 2020). Среди видов, вызывающих поражения растений земляники, также отмечены C. dematium и C. lineola (Damn et al., 2009).
В различных исследованиях (MacKenzie et al., 2008; Govorova et al., 2010; Petina et al., 2013; California.., 2017) упоминается вид C. fragariae. Oднако, Кулебрас и соавторы (Culebras et al., 2003) считают расхождения между C. fragariae и C. gloeosporioides недостаточным для разделения их в отдельные виды. Вейр и соавторы (Weir et al., 2012) указывают, что C. fragariae является синонимом C. theobromicola, который входит в комплекс C. gloeosporioides. В базе данных Index Fungorum (2021) С. theobromicola и C. fragariae синонимами не являются и представлены отдельными видами.
Виды комплекса Colletotrichum acutatum экономически наиболее опасны, т.к. широко распространены в насаждениях земляники и приводят к высоким потерям даже в условиях современных систем интегрированной защиты растений. Источником инфекции являются растительные остатки, а также сорные растения, которые патоген может заселять благодаря своей экологической пластичности. Гриб поражает практически все части растений, но важно отметить, что продолжительное время может не вызывать никаких симптомов. Так, в исследованиях Н.А. Холод и сотрудников (Kholod et al., 2010) было показано, что в 2009 г. в Краснодарском крае болезнь уничтожила от 30 до 50% урожая земляники различных сортов, заложенных в 2006 г., проявившись спустя три года. Таким образом, ключевым моментом в защите растений от антракнозной плодовой гнили является ранняя диагностика и выявление патогена в бессимптомном материале.
В России все большее распространение получают грибы, вызывающие антракноз как культурных, так и дикорастущих растений. Исследований, посвященных патогенным грибам рода Colletotrichum на плодово-ягодной продукции немного, а большинство проведены без использования молекулярно-генетических методов, видовая идентификация основана исключительно на морфологических признаках, которые не всегда позволяют достоверно разделить виды внутри комплекса. Вместе с тем на территории Российской Федерации антракноз земляники является фитосанитарно значимым объектом. В этой связи целью исследования, с одной стороны, было изучение видового состава видов рода Colletotrichum на растениях земляники садовой, а, с другой стороны, выявление данных патогенов с применением молекулярных методов диагностики, которые позволяют быстро и точно идентифицировать возбудителей заболеваний, что необходимо для поддержания благоприятного фитосанитарного состояния территорий, занимаемых плодово-ягодными культурами.
МАТЕРИАЛЫ И МЕТОДЫ
В данной работе были изучены грибы рода Colletotrichum, выделенные из растений земляники в период с 2017 по 2020 г. лабораторией микологии ФГБУ “Всероссийский центр карантина растений” (ВНИИКР). Образцы с симптомами болезни и без проявлений поражения были отобраны в ходе обследований насаждений земляники в различных регионах России, а также в ходе исследований посадочного материала, как отечественного, так и импортного происхождения. Для сравнения морфологических и генетических особенностей использовали близкородственные виды грибов рода Colletotrichum коллекции лаборатории микологии, в том числе виды комплекса C. acutatum, выделенные из различных растений-хозяев.
Для исследования образцов отбирали небольшие фрагменты растительного материала, которые поверхностно стерилизовали в спирте и закладывали во влажную камеру и на чашки Петри с агаризированной питательной средой (КГА 2%).
Для описания культур на седьмые и 14-е сутки учитывался характер роста колоний, строение мицелия, окраска, наличие экссудата; для описания конидий указывалась форма, наличие септ, окрашенность и проводился промер 50 конидий. Морфометрию конидий проводили с помощью микроскопов Olympus Bx43F и программного обеспечения Quick-photo Micro 3.2. После морфологического анализа выросшие целевые штаммы отсевали в чистые моноспоровые культуры. Выделение ДНК из чистых культур проводили с использованием готового набора “ФитоСорб” (ЗАО “Синтол”, Москва), основанного на сорбции нуклеиновых кислот на покрытых силикагелем магнитных частицах с последующим осаждением преципитирующим реагентом.
Для подтверждения видовой принадлежности выделенных изолятов проводили классическую ПЦР с универсальными праймерами ITS 5/ITS 4 (White et al., 1990), аплифицирующими участки ДНК ITS1–5.8S–ITS2. Дополнительно была проведена классическая ПЦР с праймерами GDF/GDR (Templeton et al., 1992) для определения последовательностей участка гена глицеральдегид-3-фосфатдегидрогеназы, ACT-512F/ACT-783R (Carbone and Kohn, 1999) – актина, CHS-79F/CHS-354R (Carbone and Kohn, 1999) – хитинсинтазы и участка гена бета-тубулина с праймерами TUB2Fd/TUB4Rd (Groenewald et al., 2013; Woudenberg et al., 2009) для уточнения видовой принадлежности одного из изолятов.
Визуализацию результатов проводили с помощью электрофореза. Далее амплифицированные участки секвенировали на генетическом анализаторе Applied Biosystems 3500 (“Thermo Scientific”, США). Полученные нуклеотидные последовательности обрабатывали в программе BioEdit, а затем сравнивали с соответствующими последовательностями базы данных NCBI. Дальнейший анализ проводили с помощью программы MEGA 10. Для построения дендрограмм использовали метод максимального правдоподобия (Maximum Likelihood).
В настоящее время в России разработана готовая тест-система для выявления и идентификации возбудителя антракноза земляники – “Colletotrichum acutatum complex-РВ” компании ЗАО “Синтол”, которая основана на выявлении фрагмента гена бета-тубулина. В мировой практике используется ряд других тест-систем, как с использованием классической ПЦР, так и ПЦР c детекцией в реальном времени.
Для сравнения эффективности систем идентификации проводили ПЦР с праймерами ACUT-F1 (CGGAGGAAACCAAACTCTATTTACA), ACUT-R1 (CCAGAACCAAGAGATCCGTTG) и зондом ACUT-PB (FAM-CGTCTCTTCTGAGTGGCACAAGCAATAATTAAA-BHQ1), комплементарными участку внутреннего транскрибируемого спейсера, разработанными Гарридо и сотрудниками (Garrido et al., 2009). Амплификацию проводили в термоциклере T1000 Touch Thermal Cycler (Bio-Rad, США). Смесь реактивов для постановки одной реакции объемом 25 мкл содержала 5 мкл 5Х ПЦР буфера Mas DDMix 2025 (ООО “Диалат Лтд”, Москва), 1 μM каждого праймера (концентрация 10 pmol), 0.5-микролитрового зонда, 1 нг целевой ДНК и стерильную воду. Условия амплификации: 5 мин – 95°С ;15 с – 95°С, 60 с – 60°С – 45 циклов.
Вторая диагностическая система “С. acutatum complex-РВ” (компания ЗАО “Синтол”, Москва), состоящая из готовой реакционной смеси “С. аcutatum-ВПК” 20 мкл, SynTaq ДНК-полимеразы Т + + 0.5 мкл и 2 мкл целевой ДНК. Режим амплификации: 5 мин – 95°С; 15 с – 95°С, 40 с – 60°С – 50 циклов.
Для анализа показателей эффективности диагностических наборов готовили базовую суспензию с концентрацией 105 клеток гриба/мл. Для этого небольшой участок культуры возбудителя суспендировали в 1000 мкл дистиллированной воды, затем готовили серию десятикратных разведений. Подсчет числа клеток гриба в заданном объеме жидкости проводили при помощи камеры Горяева.
Для определения аналитической чувствительности использовали экстракты с уровнем зараженности 100–105 клеток целевого организма на миллилитр в трехкратной повторности.
Для проверки специфичности наборов использовали изоляты близкородственных видов коллекции лаборатории микологии ФГБУ ВНИИКР, а также другие виды, паразитирующие на растениях земляники. Видовую принадлежность данных изолятов определяли по морфологическим признакам и анализу нуклеотидных последовательностей участка ITS1–5.8S–ITS2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследований было выявлено 76 изолятов, относящихся к трем видам (C. nymphaeae, C. godetiae, C. lineola) из двух видовых комплексов.
Зараженность импортного посадочного материала составила 18.7%. На образцы итальянского происхождения пришлось больше всего выявлений, что составило 35.7% от общего количества. Также антракноз земляники был диагностирован на растениях из Нидерландов, Бельгии, Польши, Молдовы и Сербии.
На территории РФ были обследованы насаждения земляники в Воронежской, Нижегородской, Пензенской, Московской областях и на территории г. Москвы. Всего за время исследования было выявлено 62 образца зараженных растений, что составило 14.5% от общего числа растений (табл. 1).
Таблица 1.
Количество выявлений грибов рода Colletotrichum на растениях земляники в импортном и отечественном посадочном материале
| Импортный посадочный материал | Отечественный посадочный материал | |||||
|---|---|---|---|---|---|---|
| год | *общее кол-во образцов | кол-во выявлений в образцах | % | общее кол-во образцов | кол-во выявлений в образцах | % |
| 2017 | 16 | 4 | 25 | 28 | 1 | 3.6 |
| 2018 | 20 | 2 | 10 | 132 | 18 | 13.6 |
| 2019 | 22 | 7 | 31.8 | 95 | 14 | 14.7 |
| 2020 | 17 | 1 | 5.9 | 172 | 29 | 16.8 |
| итого | 75 | 14 | 18.7 | 427 | 62 | 14.5 |
Вместе с зараженной рассадой земляники импортного происхождения может происходить распространение вредоносных видов грибов на территорию РФ, которые могут быть опасны не только для растений земляники, но и для других сельскохозяйственных культур.
Из всех зараженных растений отечественного происхождения, за исключением двух образцов, был выделен гриб C. nymphaeae, C. godetiae и C. lineola были обнаружены в единичных образцах.
C. nymphaeae является распространенным патогеном земляники. На большинстве растений, отобранных для исследований, присутствовали типичные симптомы заболевания: язвы на листьях и черешках, некрозы, при наличии ягод – пятна, иногда наблюдалось обильное спороношение в виде оранжевого экссудата, общее состояние растений угнетенное. Однако, на некоторых растениях, из которых был выделен гриб, зачастую присутствовали только неспецифичные симптомы, такие как некрозы, или полное их отсутствие. С одной стороны, это может быть связано с низкой инфекционной нагрузкой и распространением возбудителя в форме латентной инфекции. С другой стороны, разные сорта могут иметь разную устойчивость к данному заболеванию.
В ранее проведенных опытах (Kuznetsova et al., 2021) с искусственной инокуляцией растений земляники сорта Эльсанта симптомы проявились только к 30-му дню после первичного заражения. Инфекционная нагрузка составила 2.5 × 106 клеток гриба на одно растение в опытах с уколом и 1 × 107 клеток гриба на одно растение в опытах с опрыскиванием, где патоген не был выявлен с использованием классических биологических методов.
C. nymphaeae также встречается как патоген яблок, где вызывает горькую гниль, оливковых деревьев, перца (Damm et al., 2012; Velho et al., 2014; Materatski et al., 2018).
С. lineola – патоген женьшеня, клевера, цветочных культур, зонтичных (Henricot et al., 2010; Guarnaccia et al., 2020; Liping et al., 2020). Также был отмечен на землянике (Damm et al., 2009). С. lineola очень близок к виду С. dematium, что проявляется в морфологическом сходстве и идентичности ряда участков генов, которые широко используют для идентификации видов. Оба вида принадлежат к комплексу dematium. На данный момент имеются противоречивые данные о патогенности С. lineola для растений земляники. В наших исследованиях данный вид был выделен единично из растений земляники Московской обл. Возможно, климатические условия средней полосы России не являются оптимальными для данного вида, несмотря на высокую пластичность грибов рода Colletotrichum. Исследуемые растения не имели внешних симптомов поражения, во влажной камере гриб проявился на 21–23-й день на увядших кусочках растений.
C. godetiae – полифаг, вызывающий заболевания яблони, груши, малины, винограда, оливы, грецкого ореха, кизила, некоторых цитрусовых, мушмулы и других. Также гриб был выделен из растений земляники садовой и земляники лесной. В исследованиях Барончелли и сотрудников (Baroncelli et al., 2015) было отмечено, что изоляты, выделенные из растений земляники менее агрессивные, чем изоляты, выделенные из других растений (груша, яблоня). Разные популяции способны инфицировать широкий спектр растений-хозяев, что зависит от условий окружающей среды (Toth et al., 2017).
C. godetiae был обнаружен на растениях земляники на территории РФ впервые. Данный вид часто встречается на растениях рода Malus и рода Pyrus, где вызывает загнивание яблок, особенно в послеуборочный период. Вследствие этого C. godetiae на растениях земляники может быть распространен шире, чем известно на данный момент.
До настоящего времени в посадочном материале и в ягодных насаждениях были отмечены виды C. nymphaeae и C. acutatum. Однако, данные о распространении последнего на территории Воронежской обл., полученные в 2013 г. (Skripka et al., 2014), проводились без учета разделения комплекса на отдельные виды, близкие по морфологическим и ряду генетических признаков. С другой стороны, изолят, выделенный из растений земляники из этой же области был определен нами как C. nymphaeae (изолят 26, табл. 2). Другие исследования антракноза земляники (Kholod et al., 2010, 2013; Govorova et al., 2010; Kotova et al., 2014; Kashchits et al., 2018; Khrabrov et al., 2019; Metlickiy et al., 2007) проводились без использования молекулярно-генетических методов или без указания референтного материала. При проведении обследований в 2017–2020 гг., в том числе и Воронежской обл., вид C. acutatum обнаружен не был. В связи с этим есть основание полагать, что вид C. acutatum на территории РФ отсутствует, а обнаруженные ранее изоляты относятся к виду из комплекса acutatum – C. nymphaeae.
Таблица 2.
Сравнительная таблица размеров конидий изолятов, выделенных из растений землянки
| Вид | Растение-хозяин | Происхождение | Длина конидий, мкм | Ширина конидий, мкм |
|---|---|---|---|---|
| Colletotrichum nymphaeae | земляника садовая (Fragaria ananassa) | Италия | 12.82 ± 1.05 | 4.38 ± 0.3 |
| C. nymphaeae | земляника садовая (F. ananassa) | Нидерланды | 16.67 ± 0.34 | 4.53 ± 0.32 |
| C. nymphaeae | земляника садовая (F. ananassa) | Россия | 16.29 ± 1.46 | 4.38 ± 0.37 |
| C. godetiae | земляника садовая (F. ananassa) | ” ” | 16.26 ± 1.39 | 5.62 ± 0.31 |
| C. godetiae | яблоня (Malus domestica) | ” ” | 14.86 ± 0.88 | 5.54 ± 0.22 |
| C. godetiae | груша (Pyrus) | ” ” | 16.56 ± 1.15 | 5.21 ± 0.49 |
| C. lineola | земляника садовая (Fragaria ananassa) | ” ” | 23.99 ± 1.73 | 4.21 ± 0.39 |
Для всех культур характерно обильное спороношение и быстрый рост: на 10-e сутки колонии занимали всю чашку Петри диаметром 9 см. Все виды морфологически отличались друг от друга. Необходимо отметить, что и изоляты одного вида имели некоторые различия в морфологии колоний.
Изоляты C. nymphaeae итальянского происхождения характеризовались бархатноопушенным строением мицелия, зональной ровной поверхностью колонии, цвет колонии в начальный период роста серый со светлым краем. На 14-й день колония становится темно-серо-коричневого цвета со светло-серым ровным краем, с оранжевым экссудатом по всей поверхности. Реверзум зональный, темно-серого цвета, со светло-бежевым краем.
Споры C. nymphaeae формируются в ложе, щетинок не образуется. Конидии гиалиновые, гладкостенные, одноклеточные, продолговатые, цилиндрические большинство заостренные с обоих концов, но бывают закругленные с одного конца. Длина от 10.78 до 14.73, ширина от 3.84 до 4.95 мкм, в среднем 12.82 ± 1.05 × 4.38 ± 0.3 мкм. По литературным данным (Damm et al., 2012) размеры варьируют от 10–19.5× 3–6 мкм, в среднем – 16.1 ± ± 2.3 × 4.9 ± 0.7.
Изоляты C. nymphaeae из Польши и Нидерландов характеризовались бархатноопушенным строением, зональной поверхностью со слабоволнистым краем, цвет колонии в начальный период роста бело-серый со светло-белым слабоволнистым краем, на 14-й день колония становится серой с оранжевым экссудатом по всей поверхности. Реверзум зональный, бежево-розового цвета. На некоторых чашках образовывались колонии более схожие с изолятами Московской обл. и Сербии.
Споры формируются в ложе, щетинок не образуется. Конидии продолговатые, вытянутые, узкие, гиалиновые, гладкие, наиболее заостренные, относительно других изолятов, встречаются слегка изогнутые. Длина от 15.66 до 19.08 мкм, ширина от 3.91 до 5.02 мкм, в среднем – 16.67 ± 0.34 × 4.53 ± ± 0.32 мкм.
Среди изолятов C. nymphaeae, выделенных из отечественных образцов импортного посадочного материала земляники, встречались колонии, сходные как с нидерландскими, так и с итальянскими изолятами. Первые имели более шерстистое строение мицелия, зональную поверхность колонии, на которой присутствовал обильный экссудат споровых масс и темные склероциеподобные образования, мицелий преимущественно светлого цвета. Вторые приобретали более темную, бурую окраску (рис. 1).
Рис. 1.
Колонии Colletotricum nymphaeae, выделенные из растений земляники отечественного происхождения (верхний ряд) и импортного происхождения (слева направо): Италия, Нидерланды, Польша (нижний ряд).
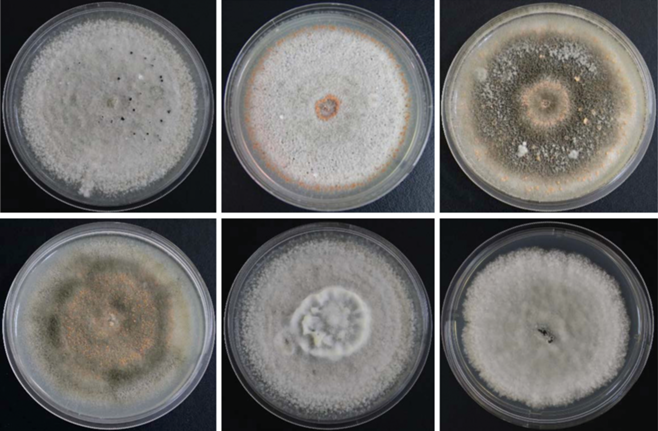
Конидии по морфологическому описанию были идентичны изолятам из Нидерландов. Длина от 12.48 до 18.22 мкм, ширина от 3.71 до 5.01 мкм, в среднем размером 16.29 ± 1.46 × 4.38 ± 0.37 мкм (рис. 2).
Рис. 2.
Конидии Colletotrichum nymphaeae, выделенные из растений земляники различного происхождения (слева направо): Италия, Нидерланды, Польша.

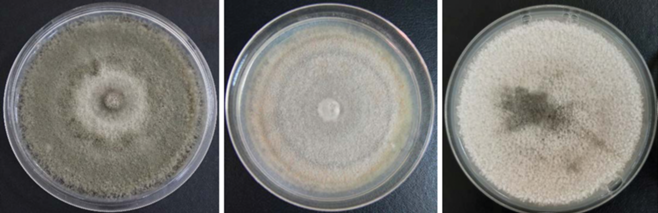
Изолят C. godetiae, выделенный из стеблей, листьев и черешков растений земляники садовой отличался насыщенно оливковым цветом, бархатисто-шерстистой поверхностью с плотным мицелиальным слоем. Как и для вида C. nymphaeae наблюдался полиморфизм.
Для сравнения исследовали колонии, выделенные из растений груши, которые характеризовались бархатисто-шерстистым строением мицелия светло- или темно-серого цвета без выраженной зональности (капли экссудата на поверхности отсутствуют, реверзум светло-лососевого цвета). Изолят, выделенный из плода яблони, имел бархатно-опушенную, зональную поверхность со слабоволнистым краем, цвет колонии в начальный период роста светло-серый. На 14-й день колония становится буро-серого цвета со светло-серым слабоволнистым краем колонии с оранжевым экссудатом по всей поверхности. Реверзум зональный, серо-бежевого цвета (рис. 3).
Рис. 3.
Колонии Colletotrichum godetiae, выделенные из растений (слева направо): земляники, яблони, груши отечественного происхождения.
Споры C. godetiae формируются в ложе, щетинок не обнаружено. Конидии гиалиновые, одноклеточные, продолговатые, иногда чуть изогнутые, встречаются округлые, большинство заостренные с обеих концов, но бывают закругленные с одного конца (рис. 4). Длина от 14.05 до 17.93 мкм, ширина от 5.11 до 5.8 мкм, в среднем – 14.86 ± 0.88 × × 5.54 ± 0.22 мкм. Конидии изолята, выделенного с груши отличаются: более длинные, утолщенные с одного края, заостренные, встречаются слегка изогнутые. Длина конидий от 15.03 до 18.99 мкм, ширина от 4.39 до 6.21 мкм, в среднем – 16.56 ± ± 1.15 × 5.21 ± 0.49 мкм (рис. 4).
Рис. 4.
Конидии Colletotrichum godetiae, выделенные из растений (слева направо): земляники, яблони, груши отечественного происхождения.

Колония C. lineola плотно покрывала поверхность агара обильными темными буро-оливковыми микросклероциями (часто сливающимися), над которыми образовывался светлый рассеянный воздушный мицелий. По краю колония зачастую имеет розовую пигментацию, что является отличительной характеристикой и позволяет разделять виды C. lineola и C. dematium (Damm et al., 2009). Ложе со щетинками прямыми или слегка изогнутыми, бурыми, темно-коричневыми с 2–4 септами, длиной от 50 до 180 мкм. При пересевах в культуре спороношение уменьшается, щетинки не образуются. Конидии прозрачные, гладкостенные, слегка изогнутые, банановидные, усеченные к краю, длина в среднем 23.99 ± 1.73, ширина 4.21 ± ± 0.39 (рис. 5).
Для ряда видов рода Colletotrichum, ассоциированных с растениями земляники, характерен внутривидовой полиморфизм. Колонии C. nymphaeae различного географического происхождения отличаются друг от друга. Конидии C. nymphaeae значительно варьируют (p < 0.01) по размеру (табл. 2). Штаммы C. godetiae, выделенные из растений груши, яблони и земляники также имеют отличия в строении колоний.
В результате амплификации участка ITS1–5.8S–ITS2 были получены последовательности длиной около 600 п.н. Все изоляты C. nymphaeae, выделенные в ходе работы, а также изоляты базы данных NCBI были идентичны и представляли единую группу (рис. 6). Различий по происхождению также не наблюдалось.
Рис. 6.
Дендрограмма, построенная на основании анализа последовательностей участка ITS1–5.8S–ITS2 методом максимального правдоподобия (ML).

Другую группу образовали изоляты вида C. godetiae, которые четко отличались от C. nymphaeae рядом нуклеотидных замен, как транзиций (7), так и трансверсий (7), а также делеций. При сравнении изолятов C. godetiae, выделенных из груши (71b), яблони (70, KR180296) и земляники, различий по данному участку отсутствовали.
Отдельный интерес вызывает изолят 84, который по морфологическим признакам был определен как C. lineola. Использование классической пары праймеров ITS4/ITS5 c последующим секвенированием не позволило разделить C. lineola и С. dematium и определить видовую принадлежность полученного изолята. Для этого были дополнительно проанализированы последовательности участков генов бета-тубулина, актина, хитин синтазы 1 и глицеральдегид-3-фосфатдегидрогеназы.
При сравнении последовательностей участка гена актина длиной 276 п.н. изоляты С. dematium отличались от изолятов C. lineola двумя транзициями. Участки гена хитин синтазы и бета-тубулина не позволяют разделить виды, отмечен внутривидовой полиморфзм по данным участкам для обеих групп изолятов. При анализе участка гена глицеральдегид-3-фосфатдегидрогеназы обнаружено 2 транзиции и 2 трансверсии, отличающие близкородственные виды, также отмечены внутривидовые различия.
Таким образом, по результатам анализа последовательностей пяти различных участков исследуемый изолят был определен как C. lineola (рис. 7).
Рис. 7.
Дендрограмма, построенная на основании последовательностей участков генов Act, CHS-1, BTub, GAPDH методом максимального правдоподобия (ML).

При сравнении наборов для диагностики грибов комплекса acutatum были определены аналитическая чувствительность и специфичность.
В результате исследований было установлено, что порогом выявления ДНК возбудителя готовой тест-системой ПЦР-РВ “С. acutatum complex-РВ” (ЗАО “Синтол”) (далее набор 1) является 100% выявление в третьем разведении ДНК, которое составило 2 × 103 клеток гриба/мл, что соответствует заявленной разработчиком чувствительностью.
Для набора с праймерами ACUT-F1, ACUT-R1 и зондом ACUT-PB (Garrido et al., 2009) (далее набор 2) этот же показатель составил 2 × 101 клеток гриба/мл (табл. 3).
Таблица 3.
Сравнительные данные определения чувствительности исследуемых диагностических систем
| Концентрация клеток гриба/мл | ACUT-F1/ACUT-R1/ACUT-PB (Garrido et al., 2008) | “Colletotrichum acutatum complex-РВ” | ||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 1 | 2 | 3 | |
| Значение порогового цикла (Ct) | ||||||
| 105 | 28.3 | 27.6 | 28.4 | 31.6 | 31.6 | 31.33 |
| 104 | 30.9 | 31.4 | 30.8 | 33.9 | 34.3 | 34.1 |
| 103 | 34.2 | 33.6 | 35.2 | 36.6 | 37.8 | 37.7 |
| 102 | 37.3 | 37.1 | 38.5 | – | – | – |
| 101 | 41.9 | 41.7 | 35.8 | – | – | – |
| 100 | 41.2 | 37.9 | – | – | – | – |
При анализе специфичности набор 1 позволил выявить следующие виды комплекса: C. nympheae и C. fioriniae, однако не позволил выявить C. godetiae, который также является патогеном земляники. Также не было обнаружено флюоресценции для C. godetiae, выделенных из других растений-хозяев – груши и яблони.
Для анализа возможной причины было проведено сравнение нуклеотидных последовательностей целевого участка, указанного разработчиками коммерческого набора 1. При сравнении последовательностей участка гена бета-тубулина C. godetiae, C. nympheae, C. fioriniae, взятых из коллекции NCBI была показана четкая дифференциация видов (рис. 8). В последовательности длиной 492 п.н. было обнаружено 13 замен, отличающих C. godetiae от двух других видов и 5 замен, которые совпадали у C. godetiae и лишь у одного из видов. Таким образом, участок гена бета-тубулина имеет большее число видоспецифичных сайтов для различия исследуемых видов.
Рис. 8.
Дендрограмма, построенная на основании анализа последовательностей участка гена BTub видов Colletotrichum godetiae, C. nympheae, C. fioriniae.

В результате апробации набора 2 не было выявлено ни одного случая ложноотрицательного результата, все диагностируемые виды комплекса показали значение порогового цикла Сq от 22 до 36 (табл. 4).
Таблица 4.
Данные по выделению изолятов Colletotrichum spp. и результаты выявления специфичности тест-систем
| Вид | Номер | Растение-хозяин | Страна происхождения | Sequence ID | Результаты ПЦР, Cq | |
|---|---|---|---|---|---|---|
| *1 | **2 | |||||
| Colletotrichum nymphaeae | 26 | Fragaria ananassa | Россия | OK036661.1 | 36.52 | 36.37 |
| C. nymphaeae | 30 | F. ananassa | Италия | OK036667.1 | 31.87 | 28.9 |
| C. nymphaeae | 31 | F. ananassa | Нидерланды | OK036666.1 | 24.93 | 22.84 |
| C. nymphaeae | 32 | F. ananassa | Италия | OK036665.1 | 27.14 | 24.87 |
| C. nymphaeae | 33 | F. ananassa | Италия | OK036663.1 | 28.93 | 26.24 |
| C. nymphaeae | 34 | F. ananassa | Нидерланды | OK036664.1 | 35.02 | 32.41 |
| C. nymphaeae | 51 | F. ananassa | Италия | OK036659.1 | 28.45 | 25.78 |
| C. nymphaeae | 52 | F. ananassa | Россия | OK036657.1 | 26.85 | 24.3 |
| C. nymphaeae | 53 | F. ananassa | Россия | OK036662.1 | 37.12 | 36.91 |
| C. nymphaeae | 54 | F. ananassa | Россия | OK036656.1 | 33.79 | 29.58 |
| C. nymphaeae | 55 | F. ananassa | Сербия | OK036655.1 | 28.55 | 25.63 |
| C. nymphaeae | 59 | F. ananassa | Россия | OK036654.1 | 35.28 | 32.78 |
| C. nymphaeae | 60 | F. ananassa | Италия | OK036660.1 | 30.25 | 29.61 |
| C. nymphaeae | 61 | F. ananassa | Нидерланды | OK036658.1 | 32.14 | 33.79 |
| C. nymphaeae | 62 | F. ananassa | Россия | OK036653.1 | 32.63 | 32.39 |
| C. nymphaeae | 63 | F. ananassa | Россия | OK036652.1 | 30.85 | 29.79 |
| C. nymphaeae | 64 | F. ananassa | Россия | OK036651.1 | 37.21 | 29.94 |
| C. nymphaeae | 69 | F. ananassa | Польша | OK036650.1 | 31.19 | 28.27 |
| C. nymphaeae | 78 | F. ananassa | Польша | OK036649.1 | 28.78 | 26.64 |
| C. nymphaeae | 79 | F. ananassa | Россия | OK036648.1 | 27.94 | 25.05 |
| C. nymphaeae | 80 | F. ananassa | Россия | OK036647.1 | 26.87 | 24.97 |
| C. nymphaeae | 81 | F. ananassa | Россия | OK036646.1 | 26.11 | 23.78 |
| C. nymphaeae | 82 | F. ananassa | Молдова | OK036645.1 | 25.95 | 23.61 |
| С. lineola | 84 | F. ananassa | Россия | OK036681.1 | N/A | N/A |
| C. godetiae | 92 | F. ananassa | Россия | OK036680.1 | N/A | 25.33 |
| C. nymphaeae | 94 | F. ananassa | Россия | OK036644.1 | 27.01 | 24.92 |
| C. nymphaeae | 95 | F. ananassa | Россия | OK036643.1 | 27.60 | 25.48 |
| C. nymphaeae | 99 | F. ananassa | Россия | OK036642.1 | 26.28 | 23.76 |
| C. godetiae | 70 | Malus domestica | Россия | OK036678.1 | N/A | 26.26 |
| C. godetiae | 71 | Pyrus sp. | Россия | OK036679.1 | N/A | 27.24 |
| C. theobromicola | 4 | Rubus idaeus | Италия | MT905224.1 | N/A | N/A |
| C. gloeosporioides | 7 | Malus sp. | Италия | OK117404.1 | N/A | N/A |
| C. fioriniae | 21 | Prunus persica | Италия | OK117403.1 | 31.77 | 32.75 |
| C. fioriniae | 23 | Pyrus sp. | Италия | OK117398.1 | 29.70 | 28.54 |
| C. godetiae | 35 | Malus sp. | Бельгия | OK036677.1 | N/A | 34.28 |
| C. godetiae | 36 | Malus sp. | Бельгия | OK036676.1 | N/A | 33.78 |
| C. fioriniae | 49 | Vaccinium subg. Oxycoccus | Россия | OK117399.1 | 30.44 | 29.90 |
| C. fioriniae | 50 | Vaccinium subg. Oxycoccus | Россия | OK117400.1 | 29.15 | 28.46 |
| C. musae | 56 | Musa sp. | – | OK117402.1 | N/A | N/A |
| С. coccodes | 44 | Solаnum tuberоsum | – | OK117401.1 | N/A | N/A |
| внутренний контроль набора 1 | – | – | – | 28.97 | – | |
| Neopestalotiopsis rosae | – | Fragaria ananassa | Россия | OK117405.1 | N/A | N/A |
| Phomopsis columnaris | – | F. ananassa | Россия | OK117406.1 | N/A | N/A |
| Fusarium avenaceum | – | F. ananassa | Россия | OK117407.1 | N/A | N/A |
| Gnomonia comari | – | F. ananassa | Россия | OK117408.1 | N/A | N/A |
| Fusarium sp. | – | F. ananassa | Россия | N/A | N/A | |
Оба набора не показали ложноположительных результатов с близкородственными видами комплекса С. gloeosporioides, а также другими видами, поражающими растения земляники.
Полученные результаты аналитической специфичности диагностической системы 2 показывают, что данную тест-систему можно использовать для идентификации C. nymphaeae, C. fioriniae, C. godetiae, в отличие от готовой тест-системы “С. acutatum complex-РВ” (ЗАО “Синтол”), которая может использоваться только для определения видов C. nymphaeae и C. fioriniae.
Следует отметить, что в комплекс acutatum, помимо C. nymphaeae, C. fioriniae, C. godetiae входит еще 28 видов, 5 из которых являются патогенами земляники: C. simmondsii, C. salicis, C. cuscutae, C. miaoliense, С. acutatum s.str. В данном исследовании тестирование этих видов с помощью изучаемых тест-систем не проводилось.
Для дополнительной проверки специфичности диагностической тест-системы 2 были проанализированы последовательности участков ITS1–5.8S–ITS2, взятые из базы данных NCBI. Были использованы виды различных комплексов (С. graminicola, C. truncatum, C. coccodes, C. gloeosporioides, C. lineola, C. dematium, C. fragarie), а также все виды комплекса С. acutatum, поражающие растения земляники. В результате был сделан вывод о том, что прямой праймер ACUT-F1 (CGGAGGAAACCAAACTCTATTTACA) является специфичным для видов комплекса С. acutatum, а обратный праймер ACUT-R1 (CCAGAACCAAGAGATCCGTTG) универсален для видов рода.
ЗАКЛЮЧЕНИЕ
На территории Российской Федерации нами были выявлены и идентифицированы следующие виды рода Colletotrichum, вызывающие антракноз земляники: С. nymphaeae, C. godetiae и C. lineola. Виды C. godetiae и C. lineola были обнаружены на растениях земляники на территории РФ впервые.
В среднем количество растений земляники, инфицированных грибами рода Colletotrichum велико: доля зараженного импортного посадочного материала составляет 18.7%, отечественного – 14.5%. Важно отметить, что речь идет о посадочном материале, который в дальнейшем, как и готовая продукция, полученная из зараженных растений, с высокой долей вероятности будут распространены в различные географические точки страны. Для предотвращения потери растений и урожая в хозяйствах применяются различные методы борьбы с болезнями: химический, агротехнический, биологический. Однако важной превентивной мерой остается карантин растений, как внешний, так и внутренний. Для осуществления карантинных мер необходимо, в свою очередь, понимание биологических, экологических, биохимических особенностей возбудителей заболеваний, а также молекулярно-генетических признаков для разработки методов, позволяющих проводить четкую дифференциацию видов.
Для изолятов С. nymphaeae различного географического происхождения показана внутривидовая изменчивость по морфологическим признакам. Виды C. nymphaeae и C. godetiae могут быть идентифицированы с использованием последовательностей участка ITS1–5.8S–ITS2. Для дифференциации видов С. lineola и C. dematium эффективно использование последовательностей участков генов глицеральдегид-3-фосфатдегидрогеназы и актина.
Диагностическая система, разработанная группой Гарридо, показала высокую чувствительность и специфичность по отношению к целевым видам комплекса acutatum: не было отмечено ни одного случая ложноположительной или ложноотрицательной реакции.
Готовая тест-система “С. acutatum complex-РВ” (ЗАО “Синтол”) показала специфичность только к видам C. nymphaeae и C. fioriniae и оказалась не специфичной к виду C. godetiae, входящему в комплекс acutatum. Данную систему можно рекомендовать только для диагностики некоторых видов комплекса С. acutatum.
Работа выполнена в рамках гостемы НИР рег. № НИОКТР AAAA-A20-120072060002-6. Авторы выражают благодарность сотрудникам ФГБУ ВНИИКР с.н.с. А.А. Лопаткину и зам. директора К.П. Корневу за конструктивную критику и замечания при работе над данной статьей.
Список литературы
Anderson V.W., Priscila B., Anthony S. et al. Optimal markers for the identification of Colletotrichum species. 2019. https://doi.org/10.1101/659177
Baroncelli R., Zapparata A., Sarrocco S. et al. Molecular diversity of anthracnose pathogen populations associated with UK strawberry production suggests multiple introductions of three different Colletotrichum species. PlosOne. 2015. V. 10 (6). e0129140. https://doi.org/10.1371/journal.pone.0129140
California strawberry commission. 2017. Issue N 14. https://ucanr.edu/blogs/strawberries_caneberries/blogfiles/47929.pdf. Accessed 12.03.2020.
Carbone I., Kohn L.M. A method for designing primer sets for speciation studies in filamentous ascomycetes. Mycologia. 1999. V. 91 (3). P. 553–556 https://doi.org/10.2307/3761358
Chen X., De-Jiang D., Zhao S. et al. Genetic diversity of Colletotrichum spp. causing strawberry anthracnose in Zhejiang, China. Plant Disease. 2019. https://doi.org/104. https://doi.org/10.1094/PDIS-09-19-2026-RE
Chung P.-C. Wu H.-Y., Wang Y.-W. et al. Diversity and pathogenicity of Colletotrichum species causing strawberry anthracnose in Taiwan and description of a new species, Colletotrichum miaoliense sp. nov. Scientific Reports. 2020. V. 10. https://doi.org/10.1038/s41598-020-70878-2
Culebras P.V., Querol A., Suarez B. et al. Phylogenetic relationships among Colletotrichum pathogens of strawberry and design of PCR Primers for their Identification. J. Phytopathol. 2003. V. 151. P. 135–143. https://doi.org/10.1046/j.1439-0434.2003.00694.x
Damm U., Cannon P.F., Woudenberg J.H.C. et al. The Colletotrichum acutatum species complex. Stud. Mycol. 2012. V. 73. P. 37–113. https://doi.org/10.3114/sim0010
Damm U., Woudenberg J.H.C., Cannon P. et al. Colletotrichum species with curved conidia from herbaceous hosts. Fungal Diversity. 2009. V. 39. P. 45–87.
Garrido C., Carbú M., Fernández-Acero F.J. et al. Development of protocols for detection of Colletotrichum acutatum and monitoring of strawberry anthracnose using real-time PCR. Plant Pathol. 2009. V. 58. P. 43–51. https://doi.org/10.1111/j.1365-3059.2008.01933.x
Govorova G.F., Govorov D.N. Fungal diseases of strawberries. Moscow, 2010 (in Russ.).
Groenewald J.Z., Nakashima C., Nishikawa J. et al. Species concepts in Cercospora: spotting the weeds among the roses. Stud. Mycol. 2013. V. 75 (1). P. 115–170. https://doi.org/10.3114/sim0012
Guarnaccia V., Martino I., Gilardi G. et al. Colletotrichum spp. causing anthracnose on ornamental plants in northern Italy. J. Plant Pathol. 2020. V. 103. P. 127–137. https://doi.org/10.1007/s42161-020-00684-2
Henricot B. New diseases of Trillium in the UK caused by Colletotrichum lineola and Urocystis trillii. New Disease Reports. 2010. V. 22. https://doi.org/10.5197/j.2044-0588.2010.022.032
Index Fungorum. CABI Bioscience, 2021. http://www.indexfungorum.org. Accessed 12.02.2021.
Kashchits Yu.P. The peculiarities of development of the Colletotrichum acutatum Simmonds in clean culture. Plodovodstvo i vinogradarstvo yuga Rossii. 2018. V. 54 (6). P. 174–182 (in Russ.). https://doi.org/10.30679/2219-5335-2018-6-54-174-182
Kholod N.A. Diseases of strawberries in the South of Russia. Zashchita i karantin rasteniy. 2013. V. 13. P. 28–30 (in Russ.).
Kholod N.A. Modern structure patocenosis of wild strawberry and ways of its optimization. Plodovodstvo i vinogradarstvo yuga Rossii. 2010. N 3. P. 15–23 (in Russ.).
Kholod N.A., Kashchits Yu.P., Dobrenkov E.A. et al. Evaluation of stability of strawberry varieties to anthracnose black rot in the southern region. Plodovodstvo i vinogradarstvo yuga Rossii. 2018. V. 51 (3). P. 140–148 (in Russ.). https://doi.org/10.30679/2219-5335-2018-3-51-137-145
Khrabrov I.E., Antonova O.Yu., Shapovalov M.I. et al. Strawberry resistance to the major fungal phytopathogens: R-genes and their DNA markers. Plant Biotechnology and Breeding. 2019. V. 2 (3). P. 30–40 (in Russ.). https://doi.org/10.30901/2658-6266-2019-3-o3
Kit “Colletotrichum acutatum Complex-PB” (electronic versions) https://www.syntol.ru/catalog/nabory-reagentov-dlya-ptsr-v-realnom-vremeni/colacut.html Accessed 15.12.2020.
Kotova V.V., Kungurtseva O.V. Anthracnose of agricultural plants. VIZR, SPb., 2014 (in Russ.).
Kuznetsova A.A., Tsvetkova Yu.V. Biological characteristics of the strawberry anthracnose pathogen Colletotrichum nymphaeae and methods of its diagnostics. Sadovodstvo i vinogradarstvo. 2021. V. 2. P. 54–59 (in Russ.).
Liu L., Zhang L., Wang Y. et al. Distribution, identification and characterization of Colletotrichum lineola and C. panacicola causing anthracnose on ginseng in northeast China. Crop Protection. 2020. V. 137. https://doi.org/10.1016/j.cropro.2020.105265
MacKenzie S., Mertely J., Seijo T. et al. Colletotrichum fragariae is a pathogen on hosts other than strawberry. Plant Disease. 2008. V. 92. P. 1432–1438. https://doi.org/10.1094/PDIS-92-10-1432.41
Materatski P., Varanda C., Carvalho T. et al. Diversity of Colletotrichum species associated with olive anthracnose and new perspectives on controlling the disease in Portugal. Agronomy. 2021. V. 8 (12). https://doi.org/10.3390/agronomy8120301
Metlickiy O.Z. Anthracnose of the garden strawberry. Agro XXI. 2007. V. 4–6. P. 51 (in Russ.).
Petina V.V., Skripka O.V. Methodic recommendations for detecting and identification the causative agent of anthracnose strawberry Colletotrichum acutatum J.H. Simmonds. Moscow. 2013 (in Russ.).
Skripka O.V., Dudchenko I.P., Nikiforov S.V. et al. Anthracnose Colletotrichum acutatum Simmonds is a dangerous disease of strawberry. Karantin rasteniyu. Nauka i praktika. 2014. V. 4 (10). P. 24–29 (in Russ.).
Templeton M.D., Erik H.A., Rikkerink Sarah L. et al. Cloning and molecular characterization of the glyceraldehyde-3-phosphate dehydrogenase-encoding gene and cDNA from the plant pathogenic fungus Glomerella cingulata. Gene. 1992. V. 122 (1). P. 225–230. https://doi.org/10.1016/0378-1119(92)90055-T
Toth A., Petróczy M., Palkovics L. First report of Colletotrichum acutatum sensu lato through the occurrence of C. godetiae on cornelian cherry (Cornus mas) in Europe. Plant Disease. 2017. https://doi.org/10.1094/PDIS-11-16-1685-PDN
Velho A., Stadnik M., Casanova L. et al. First report of Colletotrichum nymphaeae causing apple bitter rot in Southern Brazil. Plant Disease. 2014. V. 98. https://doi.org/10.1094/PDIS-06-13-0671-PDN
Weir B.S., Johnston P.R., Damm U. The Colletotrichum gloeosporioides species complex. Stud. Mycol. 2012. V. 73. P. 115–180. https://doi.org/10.3114/sim0011
Woudenberg J.H., Aveskamp M.M., de Gruyter J. et al. Multiple Didymella teleomorphs are linked to the Phoma clematidina morphotype. Persoonia. 2009. V. 22. P. 56–62. https://doi.org/10.3767/003158509X427808
Zhang X. Detection and management of Colletotrichum acutatum sensu lato on strawberry. Dr. Sci. Thesis. Iowa, 2015. https://doi.org/10.31274/etd-180810-4491
Говорова Г.Ф., Говоров Д.Н. (Govorova, Govorov) Грибные болезни земляники. М.: ВСТИСП, 2010. 88 с.
Кашиц Ю.П. (Kashits) Особенности развития гриба Colletotrichum acutatum Simmonds в чистой культуре // Плодоводство и виноградарство юга России. 2018. № 54. С. 174–182.
Котова В.В., Кунгурцева О.В. (Kotova, Kungurtseva) Антракноз сельскохозяйственных растений. СПб.: ВИЗР, 2014. 132 c. (Приложение к журналу “Вестник защиты растений”, № 11).
Кузнецова А.А., Цветкова Ю.В. (Kuznetsova, Tsvetkova) Биологические особенности возбудителя антракноза земляники Colletotrichum nymphaeae и методы его диагностики // Садоводство и виноградарство. 2021. № 2. С. 54–59.
Метлицкий О.З. (Metlitskiy) Антракноз садовой земляники. Агро ХХI. 2007. № 4–6. С. 51.
Набор реагентов “Colletotrichum acutatum Complex-РВ” (Kit) 2020. https://www.syntol.ru/catalog/nabory-reagentov-dlya-ptsr-v-realnom-vremeni/colacut.html.
Петина В.В., Скрипка О.В. (Petina, Skripka) Методические рекомендации по выявлению и идентификации возбудителя антракноза земляники Colletotrichum acutatum J.H. Simmonds. –М.: ФГБУ ВНИИКР, 2013. 22 с.
Скрипка О.В., Дудченко И.П., Никифоров С.В. и др. (Skripka et al.) Антракноз Colletotrichum acutatum Simmonds – опасное заболевание земляники // Карантин растений. Наука и практика. 2014. Т. 4. С. 24–29.
Холод Н.А. (Kholod) Современная структура патоценоза земляники и пути ее оптимизации // Плодоводство и виноградарство Юга России. 2010. № 3. С. 15–23.
Холод Н.А. (Kholod) Болезни земляники на юге России // Защита и карантин растений. 2013. № 10. С. 28–30.
Холод Н.А., Кащиц Ю.П., Добренков Е.А. и др. (Kholod et al.) Оценка устойчивости сортов земляники садовой к антракнозной черной гнили в южном регионе // Плодоводство и виноградарство юга России. 2018. № 51. С. 140–148.
Храбров И.Э., Антонова О.Ю., Шаповалов М.И. и др. (Khrabrov et al.) Устойчивость земляники к основным грибным фитопатогенам: R-гены и их ДНК-маркеры // Биотехнология и селекция растений. 2019. № 2. С. 30–40.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология



