Микология и фитопатология, 2022, T. 56, № 2, стр. 127-139
Разнообразие грибов рода Colletotrichum на некоторых дикорастущих и культурных растениях
И. А. Казарцев 1, *, М. М. Гомжина 1, **, Е. Л. Гасич 1, ***, Л. Б. Хлопунова 1, ****, Ф. Б. Ганнибал 1, *****
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
* E-mail: kazartsev@inbox.ru
** E-mail: gomzhina91@mail.ru
*** E-mail: elena_gasich@mail.ru
**** E-mail: miceliy@mail.ru
***** E-mail: fgannibal@vizr.spb.ru
Поступила в редакцию 21.11.2021
После доработки 02.12.2021
Принята к публикации 23.12.2021
- EDN: KJRLWM
- DOI: 10.31857/S0026364822020064
Аннотация
Colletotrichum – обширный род грибов, многие представители которого способны выступать в качестве патогенов растений. В последнее время таксономия этого рода претерпела существенные изменения в связи с описанием значительного количества новых видов и благодаря упразднению старых, в том числе за счет уточнения их статуса молекулярно-генетическими методами. Представления о видовом разнообразии, распространенности и специализации грибов этого рода на территории России и сопредельных государств очевидно далеки от полноты и не соответствуют современной таксономии рода, из-за чего требуют пересмотра. В данной работе проведена молекулярно-генетическая идентификация и оценка патогенности 35 изолятов, предварительно идентифицированных как Colletotrichum spp., из европейской части России, Сибири и Дальнего Востока, а также Украины. Установлено, что 12 изолятов, выделенных из дикорастущих и культурных растений, относятся к виду Colletotrichum coccodes. Остальные изоляты были причислены к двум видовым комплексам – destructivum (14 изолятов) и dematium (9 изолятов). Среди представителей комплекса destructivum удалось идентифицировать виды C. destructivum и C. lini, а в комплексе dematium – C. dematium, C. lineola и Colletotrichum cf. spinaciae. Три изолята C. destructivum, выделенные из дикорастущих растений Ленинградской обл. и Камчатского края, по имеющимся у нас сведениям, являются первой находкой данного вида для России. По результатам оценки патогенности три изолята, отнесенных к видовому комплексу destructivum, могут представлять интерес для биоконтроля галинсоги мелкоцветковой, а один изолят, идентифицированный как C. coccodes, – для биологической борьбы с амброзией полыннолистной.
ВВЕДЕНИЕ
Род Colletotrichum Corda (Sordariomycetes, Glo-merellales, Glomerellaceae) включает в себя широко распространенные фитопатогенные грибы, представляющие особое значение для сельского хозяйства (Zhang et al., 2006; Réblová et al., 2011). Болезни культурных растений, вызываемые этими грибами, главным образом антракнозы, ожоги и гнили, приводят к значительным экономическим потерям во всем мире. Вред, наносимый грибами этого рода, распространяется на злаковые, бобовые, овощные, плодово-ягодные, декоративные и другие культуры (Cannon et al., 2012). В России нередки вспышки ранее зарегистрированных заболеваний, таких как антракнозы люпина, клевера и фасоли, а также сравнительно новых: антракноза овса и земляники (Kotova, Kungurtseva, 2014). Широко распространены антракнозы пасленовых (Belov et al., 2018) и тыквенных культур (Varivoda, Maslennikova, 2019). Также известно, что данные грибы наносят существенный вред и в послеуборочный период при хранении сельскохозяйственной продукции.
Большинство видов рода Colletotrichum проявляют гемибиотрофный способ питания, последовательно совмещая биотрофную и некротрофную фазы, длительность которых варьирует в зависимости от конкретного вида патогена, хозяина и условий окружающей среды. Грибы также могут, изначально колонизировав хозяина, затем продолжительное время оставаться в латентной форме или в состоянии покоя, проявляя патогенные свойства спустя некоторое время (Jayawardena et al., 2021).
Colletotrichum spp. часто регистрируют в качестве эндофитов. Вступая в мутуалистические отношения, они способны обеспечивать растениям резистентность к болезням, засухоустойчивость и стимулировать их рост (Redman et al., 2001; Busby et al., 2016). Однако следует отметить, что такие отношения со стороны гриба могут быстро перерасти в паразитические вследствие изменения внешних факторов.
В настоящее время насчитывают около 250 актуальных видов, которые распределены между 14 видовыми комплексами (caudatum, graminicola, spaethianum, destructivum, acutatum, dematium, gigasporum, gloeosporioides, boninense, truncatum, orbiculare, dracaenophilum, magnum и orchidearum) и 13 отдельными видами на основании молекулярно-генетических данных (Damm et al., 2019; Jayawardena et al., 2021). Имеются упоминания некоторых видов Colletotrichum на дикорастущих растениях в нашей стране, но они по большей части не систематизированы и отрывочны (Gasich et al., 1999; Mel’nik et al., 2008; Gannibal et al., 2010; Gasich et al., 2015; Gasich et al., 2016). Более того, имеющиеся в литературе данные базируются на определении грибов по морфологическим признакам и их связи с питающим растением. Сейчас результаты такой идентификации с трудом поддаются проверке и интерпретации в связи с тем, что современное представление о видовом разнообразии этого рода основывается преимущественно на молекулярно-генетических данных.
Современное фитосанитарное состояние агроценозов и биологические особенности Colletotrichum spp. позволяют выделить их в топ 10 фитопатогенов, наиболее важных для науки и экономики (Dean et al., 2012). В связи с этим спектр изучаемых растений (и соответственно выделяемых из них грибов) смещен в сторону именно сельскохозяйственных культур, дикорастущие растения-хозяева реже представлены в микологических сборах, хотя и являются богатым резервуаром биоразнообразия данного таксона. Грибы рода Colletotrichum и синтезируемые ими фитотоксины рассматриваются как важные агенты биологического контроля сорных растений, некоторые штаммы Colletotrichum зарегистрированы как микогербициды (Chakraborty, Ray, 2021). Сведения относительно видового разнообразия, встречаемости и специализации грибов этого рода на территории России и сопредельных государств, в сравнении с накопленным массивом данных мирового уровня, недостаточны и требуют ревизии. Данная работа посвящена молекулярно-генетической идентификации и оценке патогенности изолятов Colletotrichum spp. (из коллекции чистых культур микромицетов лаборатории микологии и фитопатологии ФГБНУ ВИЗР), собранных на территории европейской части России, Сибири, Дальнего Востока, а также Украины.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и культивирование грибов. В работе были использованы изоляты, предварительно идентифицированные как Colletotrichum spp. и выделенные из культурных и дикорастущих растений в период с 1995 по 2019 г. преимущественно на территории России (дополнительно изучены четыре образца из Украины, Сумская обл.). Для изоляции грибов в чистую культуру небольшие фрагменты пораженной растительной ткани промывали водопроводной водой, поверхностно дезинфицировали 0.1%-м раствором нитрата серебра в течение 1 мин, затем промывали несколько раз в стерильной воде и переносили в чашки Петри с картофельно-сахарозным агаром (КСА) (Samson et al., 2000). Изоляты культивировали при 24°С, диаметр колоний измеряли на седьмые сутки, описание колоний и идентификацию видов производили на 14-е сутки. Все выделенные культуры в настоящее время хранятся в коллекции микроорганизмов ФГБНУ ВИЗР. Происхождение изолятов приведено в табл. 1.
Таблица 1.
Сведения об исследуемых изолятах Colletotrichum spp.
| Вид, видовой комплекс | Номер изолята | Растение-хозяин | Место и дата сбора; пораженный орган |
|---|---|---|---|
| Colletotrichum coccodes | MF-13.14 | Ambrosia artemisiifolia (амброзия полыннолистная) | Россия, Приморский край, д. Пуциловка; 31.08.2006; лист |
| MF-16-014 | Beta vulgaris (свекла обыкновенная) | Россия, Пермский край, г. Чайковский; 04.09.2016; лист | |
| MF-16-015 | ” ” | ” ” | |
| MF-17-014 | ” ” | Россия, Санкт-Петербург, Пушкин; 10.08.2017; лист | |
| MF-3.1 | Brassica napus (рапс) | Россия, Ленинградская обл., Гатчинский р-н, д. Белогорка; 17.06.1998; стебель | |
| MF-3.2 | ” ” | Россия, Ленинградская обл., Гатчинский р-н, с. Рождествено; 18.08.1999; стебель | |
| MF-3.3 | ” ” | Россия, Санкт-Петербург, Пушкин; 06.10.1999; стебель | |
| MF-3.4 | ” ” | Россия, Ленинградская обл., Гатчинский р-н, с. Рождествено; 15.09.2009; лист | |
| MF-13.16 | Cannabis sativa (конопля посевная) | Россия, Бурятия, окрестности Улан-Удэ; 10.07.2007; – | |
| MF-13.3 | Galinsoga parviflora (галинсога мелкоцветковая) | Украина, Сумская обл., Середино-Будский р-н, с. Голубовка; 17.08.1995; стебель | |
| MF-13.26 | ” ” | Украина, Сумская обл., г. Середина-Буда; 07.2013; стебель | |
| MF-13.17 | Portulaca oleracea (портулак огородный) | Россия, Приморский край, ОПХ ПЯОС; 01.09.2006; – | |
| Видовой комплекс destructivum | |||
| C. destructivum | MF-13.20 | Heracleum sosnowskyi (борщевик Сосновского) | Россия, Ленинградская обл., Гатчинский р-н, п. Белогорка; 07.08.2008; лист |
| MF-13.24 | Taraxacum officinale (одуванчик лекарственный) | Россия, Санкт-Петербург, Пушкин; 26.08.2011; лист | |
| MF-13.23 | Trifolium sp. (клевер) | Россия, Камчатский край, Елизовский р-н; 23.08.2010; лист | |
| C. cf. destructivum | MF-20.1 | Glycine max (соя культурная) | Россия, Амурская обл., Тамбовский р-н, с. Новоалександровка; 26.08.2019; лист |
| MF-20.2 | ” ” | Россия, Амурская обл., Ивановский р-н, с. Ивановка; 05.09.2019; лист | |
| MF-20.3 | ” ” | Россия, Амурская обл., Константиновский р-н, с. Золотоножка; 05.09.2019; лист | |
| C. lini | MF-13.10 | Lathyrus pratensis (чина луговая) | Россия, Ленинградская обл., Кировский р-н, сад-во Назия; 26.07.1998; – |
| Colletotrichum sp. | MF-3.5 | Brassica napus (рапс) | Россия, Ленинградская обл., Гатчинский р-н, с. Рождествено; 06.09.2001; лист |
| MF-13.13 | Convolvulus arvensis (вьюнок полевой) | Россия, Пензенская обл., Лунинский р-н, п. Лунино; 19.08.2003; лист | |
| MF-13.2 | Galinsoga parviflora (галинсога мелкоцветковая) | Украина, Сумская обл., Середино-Будский р-н, с. Голубовка; 17.08.1995; стебель | |
| MF-13.25 | ” ” | Украина, Сумская обл., г. Середина-Буда; 07.2013; стебель | |
| MF-13.27 | ” ” | Россия, Псковская обл., Великие Луки; 09.08.2013; – | |
| MF-13.11 | Rumex obtusifolius (щавель туполистный) | Россия, Ленинградская обл., Кировский р-н, сад-во Назия; 26.07.1998; – | |
| MF-19.5 | Taraxacum officinale (одуванчик лекарственный) | Россия, Санкт-Петербург, Пушкин; 26.08.2011; – | |
| Видовой комплекс dematium | |||
| C. dematium | MF-17-012 | Brassica napus (рапс) | Россия, Калининградская обл., Гурьевский р-н; 01.08.2017; лист |
| MF-17-013 | ” ” | ” ” | |
| MF-13.22 | Heracleum sosnowskyi (борщевик Сосновского) | Россия, Ленинградская обл., Гатчинский р-н, п. Белогорка; 27.08.2008; лист | |
| C. lineola | MF-13.21 | Heracleum sibiricum (борщевик сибирский) | Россия, Санкт-Петербург, Пушкин; 08.08.2008; лист |
| C. cf. spinaciae | MF-16-008 | Brassica sp. (капуста) | Россия, Санкт-Петербург, Пушкин; 23.07.2016; лист |
| Colletotrichum sp. | MF-13.19 | Glechoma hederacea (будра плющевидная) | Россия, Санкт-Петербург, Пушкин; 14.09.2007; – |
| MF-17-018 | Glycine max (соя культурная) | Россия, Саратовская обл., Энгельский р-н; 05.07.2017; лист | |
| MF-19.6 | Taraxacum officinale (одуванчик лекарственный) | Россия, Санкт-Петербург; 28.08.2011; – | |
| MF-19.2 | Tragopogon pratensis (козлобородник луговой) | Россия, Санкт-Петербург, Пушкин; 07.07.1995; – | |
Выделение и секвенирование ДНК. Для экстракции ДНК изолятов Colletotrichum spp. применяли стандартный CTAB-хлороформ метод (Doyle, Doyle, 1987). Последующая амплификация была проведена для внутренних транскрибируемых спейсеров рДНК (ITS), а также генов β-тубулина (Tub2) и актина (Act) с соответствующими праймерами ITS1F (Gardes, Bruns, 1993)/ITS4 (White et al., 1990); βtub2Fw/βtub4Rd (Aveskamp et al., 2009); Act-512F/Act-783R (Carbone, Kohn, 1999). Продукты амплификации разделяли электрофоретически в 1%-м агарозном геле, окрашенном бромистым этидием. Фрагменты нужной длины очищали с использованием порошка оксида кремния (Malferrari et al., 2002). Секвенирующую ПЦР осуществляли по методу Сэнгера (Sanger et al., 1977) с использованием набора BigDye Terminator v. 3.1 Cycle Sequencing Kit (ABI, США), а последовательности нуклеотидов определяли на генетическом анализаторе ABI PRISM 3500. Последовательности корректировали в программах SeqScape и VectorNTI и сравнивали с депонированными в Генбанке (GenBank) с помощью алгоритма Blast-n (Altschul et al., 1990). Секвенированные последовательности ITS были помещены в Генбанке под номерами OL647872–OL647906, последовательности Tub2 – под номерами OL676734–OL676768, а последовательности Act – под номерами OL676699–OL676733.
Биоинформатический анализ. Выравнивание последовательностей выполняли в программе MegaX c использованием алгоритма Muscle (Kumar et al., 2018; Edgar, 2004). Поиск оптимальной модели нуклеотидных замен для построения филогенетических деревьев методом максимального правдоподобия (ML) для всех локусов по отдельности осуществляли в программе ModelFinder c использованием байесовского информационного критерия (Bayesian information criterion, BIC) (Kalyaanamoorthy et al., 2017). В качестве оптимальной для локуса ITS была выбрана модель K2P + + R2 (Kimura, 1980), для Tub2 – TNe + G4 (Tamura, Nei, 1993), для ACT – K2P + I (Kimura, 1980). Объединение последовательностей трех локусов выполнили в программе SequenceMatrix 1.7.8 (Vaidya et al., 2011). Реконструкция мультилокусного ML дерева и оценка достоверности топологии UFBoot (Minh et al., 2013) с использованием 10 000 бутстрэп-итераций проведена в программе IQ-tree (Kimura, 1981; Nguyen et al., 2015).
Оценка патогенности. Для оценки патогенности изоляты выращивали при комнатной температуре на жидкой соевой среде [KH2PO4 – 2 г, (NH4)2SO4 – 1 г, MgSO4 – 1 г, глюкоза – 20 г, соевая мука – 10 г, вода – 1 л; 50 мл среды на 250 мл колбу] на орбитальной качалке (200 об./мин) в течение четырех суток. Среду инокулировали тремя мицелиальными дисками (5 мм), вырезанными при помощи бура из 2-недельных колоний, выращенных на КСА. Мицелий отделяли от культуральной жидкости, обсушивали и измельчали. Отрезки листьев растений раскладывали в чашки Петри на увлажненную стерильной водой фильтровальную бумагу. В центр листового отрезка при помощи автоматического дозатора помещали каплю (10 мкл) мицелиальной суспензии (С = 100 мг/мл). Инокулюм наносили на абаксиальную или адаксиальную поверхность интактных или надколотых в центре иглой листовых отрезков. В качестве отрицательного контроля использовали листовые отрезки, инокулированные стерильной водой. Чашки инкубировали на лабораторном столе при естественном освещении, а диаметр некрозов измеряли на четвертые, седьмые и 14-е сутки. Впоследствии для выполнения постулатов Коха из зараженных растений был выделен возбудитель и произведена его идентификация.
Изоляты, проявившие наибольшую патогенность на листовых отрезках сорных растений, были оценены на целых растениях, выращенных в вегетационных сосудах объемом 250 мл. Растения проращивали из семян по 5 штук на емкость на светоустановке при переменном освещении (12/12 ч). К моменту инокуляции галинсога мелкоцветковая, одуванчик лекарственный и портулак огородный были в стадии двух пар настоящих листьев, а амброзия полыннолистная в стадии трех пар настоящих листьев. Изоляты культивировали на соевой среде в течение четырех суток. Мицелий отделяли от культуральной жидкости и измельчали при помощи блендера. Обработку проводили суспензией с концентрацией 50 мг/мл, около 5 мл на сосуд. Растения после инокуляции помещали во влажные камеры на 24 и 48 ч для имитации росяного периода, а затем переносили на светоустановку. Площадь пораженной поверхности каждого листа определяли на вторые, третьи и седьмые сутки по 6-балльной шкале (0 – нет симптомов, 1 – 0–5%; 2 – 6–25%; 3 – 26–75%; 4 –76–95%; 5 – более 95%; 6 – гибель листа). Площадь пораженной поверхности растения определяли по формуле: (2.5xn1 + 15xn2 + 50хn3 + 85xn4 + + 97.5xn5 + 100xn6)/N, где nx – число листьев с данным баллом, N – общее число листьев (Pfirter, Defago, 1998).
РЕЗУЛЬТАТЫ
Молекулярная филогения. В результате молекулярно-генетической идентификации грибов рода Colletotrichum по трем локусам (ITS, Act, Tub2) установлено, что более трети всех изолятов (34%) относится к виду C. coccodes (Wallr.) S. Hughes (рис. 1). Этот вид встречался как на диких (галинсога мелкоцветковая, амброзия полыннолистная, конопля посевная, портулак огородный), так и культурных (рапс, свекла) растениях от Приморского края России до Украины. Остальные изученные изоляты относились к двум видовым комплексам – destructivum (40%) и dematium (26%).
Рис. 1.
Филогенетическое дерево для изолятов Colletotrichum spp., реконструированное методом максимального правдоподобия (ML) по нуклеотидным последовательностям локуса ITS, генов Tub2 и Act. Полужирным шрифтом выделены референсы, относящиеся к типовым штаммам. Для изученных изолятов приведены значения бутстреп-поддержки, превышающие 50%. В качестве внешней группы использован вид Colletotrichum phaseolorum.
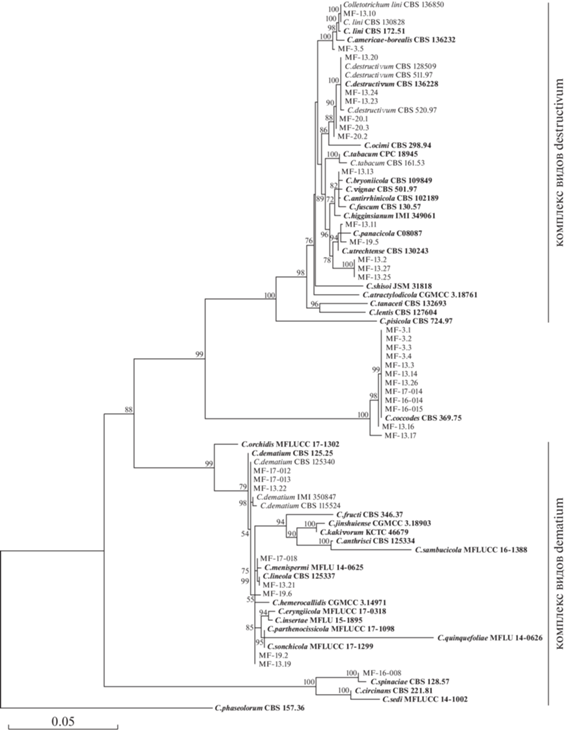
Изоляты MF-13.20, MF-13.23 и MF-13.24 из комплекса видов destructivum по исследованным локусам имели полное сходство с типовым (ex-epitype) штаммом C. destructivum O’Gara CBS 136228, что позволяет отнести их к этому виду. Изолят MF-13.10 может быть уверенно идентифицирован как C. lini (Westerd.) Tochinai. Остальные изоляты комплекса destructivum были не настолько близки к имеющимся референсам, в связи с чем их уверенная идентификация до вида была затруднена. Так, например, изоляты MF-20.1, MF-20.2, MF-20.3 из Амурской обл., выделенные из сои, не только сформировали отдельную базальную группу по отношению к виду C. destructivum, но также имели различия между собой. Поэтому в контексте данного исследования представляется возможным идентифицировать их только как Сolletotricum cf. destructivum. Изолят MF-3.5, выделенный из рапса, оказался в группе, образованной видами C. americae-borealis Damm и С. lini, и его окончательная идентификация также представляется затруднительной. Группа изолятов MF-13.2, MF-13.25, MF-13.27 из комплекса видов destructivum, выделенных из галинсоги, собранной в России (Псковская обл., Великолукский р-н) и на Украине (Сумская обл., Середино-Будский р-н), с высокой долей вероятности могут представлять новый еще не описанный вид. Изоляты MF-13.11 и MF-19.5, выделенные из щавеля туполистного и одуванчика лекарственного соответственно, оказались филогенетически близки видам C. panacicola Uyeda et S. Takim. и C. utrechtense Damm. Изолят MF-13.13 из вьюнка полевого вошел в группу, образованную видами C. antirrhinicola Damm, C. bryoniicola Damm и C. vignae Damm.
Из числа представителей комплекса видов dematium удалось уверено идентифицировать изолят MF-13.21 как C. lineola Corda, выделенный из борщевика сибирского. Близкий к нему изолят MF-17-018 из сои, вошедший в группу с С. lineola и C. menispermi Chethana, Jayaward., Bulgakov et K.D. Hyde, до вида по использованным локусам идентифицирован не был. Изоляты MF-17-012, MF-17-013, MF-13.22 отличались на одну нуклеотидную замену в гене Tub2 от типового (ex-epitype) штамма C. dematium (Pers.) Grove CBS 125.25, но имели полное сходство с другим референсным штаммом С. dematium CBS 125340, что позволяет причислить эти изоляты к данному виду. Изолят MF-16-008 из капусты был идентифицирован как Colletotrichum cf. spinaciae Ellis et Halst. Установить видовую принадлежность изолятов MF-13.19, MF-19.2, MF-19.6, вошедших в видовой комплекс dematium, не удалось.
Патогенность. Оценка патогенности 20 изолятов Colletotrichum spp., выделенных из сорных растений, выявила у 11 изолятов способность вызывать симптомы болезни на тех растениях, из которых эти изоляты были выделены (табл. 2). Наибольшую патогенность проявил изолят MF-13.17 в отношении портулака огородного, уже в первые дни после инокуляции было зарегистрировано развитие некрозов вокруг мест уколов, а на четвертые сутки крупные некрозы развились также в случае нанесения инокулюма на верхнюю неповрежденную поверхность листьев. Раннее развитие симптомов отмечено также на амброзии полыннолистной (изолят MF-13.14) и козлобороднике луговом (изолят MF-19.2). На седьмые сутки после нанесения инокулюма изолятов MF-13.2, MF-13.25, MF-13.27 отмечено развитие пятен на верхней поверхности листьев галинсоги мелкоцветковой, а на 14-е сутки ограниченные некрозы развивались также и на нижней поверхности. Изоляты MF-13.13 и MF-19.6 вызывали, соответственно, у вьюнка полевого и одуванчика лекарственного ограниченные, не распространяющиеся за область нанесенной капли некрозы. Изоляты MF-13.24 на одуванчике лекарственном, MF-13.3 и MF-13.26 на галинсоге мелкоцветковой, напротив, приводили к более позднему (на 14-е сутки) развитию симптомов. Остальные изоляты не продемонстрировали патогенность на листьях тестируемых растений.
Таблица 2.
Патогенность изолятов Colletotrichum spp. для листовых отрезков сорных растений
| Вид растения | Вид и изолят гриба | Диаметр некроза, мм (четвертые, седьмые и 14-е сутки после инокуляции) | |||
|---|---|---|---|---|---|
| адаксиальная сторона | абаксиальная сторона | ||||
| без повреждения | с уколом | без повреждения | с уколом | ||
| Ambrosia artemisiifolia | C. coccodes MF-13.14 | 3.2 ± 1.1 | 1.7 ± 0.3 | <1 | 2.1 ± 0.4 |
| 4.4 ± 1.6 | 1.9 ± 0.3 | <1 | 2.8 ± 0.7 | ||
| 7.8 ± 3.4 | 2.5 ± 0.5 | <1 | 9.2 ± 3.9 | ||
| Cannabis sativa | C. coccodes MF-13.16 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Convolvulus arvensis | Colletotrichum sp., комплекс destructivum MF-13.13 | 0 | 2.0 ± 0.5 | 0 | 0 |
| 0 | 2.4 ± 0.6 | 0 | 0 | ||
| 0 | 2.4 ± 0.6 | 0 | 0 | ||
| Galinsoga parviflora | C. coccodes MF-13.3 | 0 | 0 | 0 | 0 |
| <1 | <1 | <1 | <1 | ||
| 3.6 ± 1.1 | 2.8 ± 2.2 | 4.5 ± 2.0 | <1 | ||
| C. coccodes MF-13.26 | 0 | 0 | 0 | 0 | |
| 0 | 0 | 0 | 0 | ||
| 5.0 ± 0.3 | 7.0 ± 0.9 | 5.4 ± 0.8 | 1.6 ± 0.7 | ||
| Colletotrichum sp., комплекс destructivum MF-13.2 | 0 | 0 | 0 | 0 | |
| 4.6 ± 0.7 | 4.0 ± 0.6 | 0 | 0 | ||
| 7.2 ± 1.1 | 7.1 ± 0.4 | 1.8 ± 0.2 | 3.2 ± 0.8 | ||
| Colletotrichum sp., комплекс destructivum MF-13.25 | 0 | 0 | 0 | 0 | |
| 2.6 ± 1.2 | 5.1 ± 0.4 | 0 | 0 | ||
| 9.8 ± 0.5 | 10.1 ± 1.1 | 2.2 ± 0.6 | 2.8 ± 0.2 | ||
| Colletotrichum sp., комплекс destructivum MF-13.27 | 0 | 0 | 0 | 0 | |
| 5.3 ± 0.4 | 3.5 ± 0.4 | 0 | <1 | ||
| 11.2 ± 0.8 | 7.9 ± 1.6 | 3.5 ± 1.4 | 4.1 ± 1.7 | ||
| Glechoma hederacea | Colletotrichum sp., комплекс dematium MF-13.19 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Heracleum sosnowskiy | C. dematium MF-13.22 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| C. destructivum MF-13.20 | 0 | 0 | 0 | 0 | |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| C. lineola MF-13.21 | 0 | 0 | 0 | 0 | |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Lathyrus pratensis | C. lini MF-13.10 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Portulaca oleracea | C. coccodes MF-13.17 | 9.5 ± 3.8 | 12.8 ± 3.2 | 0 | 10.8 ± 3.1 |
| – | – | – | – | ||
| – | – | – | – | ||
| Rumex obtusifolius | Colletotrichum sp., комплекс destructivum MF-13.11 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Taraxacum officinale | C. destructivum MF-13.24 | 0 | 0 | 0 | 0 |
| 1.8 ± 1.8 | 0 | 0 | 0 | ||
| 9.2 ± 3.2 | 3.5 ± 2.0 | 5.8 ± 3.0 | 6.0 ± 3.7 | ||
| Colletotrichum sp., комплекс destructivum MF-19.5 | 0 | 0 | 0 | 0 | |
| 0 | 0 | <1 | <1 | ||
| 0 | 0 | <1 | <1 | ||
| Colletotrichum sp., комплекс dematium MF-19.6 | 0 | 0 | 0 | 0 | |
| 0 | <1 | 0 | 0 | ||
| 2.9 ± 2.0 | <1 | <1 | <1 | ||
| Tragopogon pratensis | Colletotrichum sp., комплекс dematium MF-19.2 | 1.8 ± 1.0 | 5.6 ± 1.3 | 1.4 ± 1.4 | 5.3 ± 1.1 |
| 7.1 ± 0.8 | 9.5 ± 0.7 | 6.8 ± 1.2 | 9.2 ± 0.9 | ||
| – | – | – | – | ||
| Trifolium pratense | C. destructivum MF-13.23 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
В эксперименте на целых растениях изоляты MF-13.24 (C. destructivum) и MF-13.17 (C. coccodes) проявили довольно слабую патогенность в отношении одуванчика лекарственного и портулака огородного, соответственно, развитие симптомов отмечалось только на седьмые сутки при 48-часовом росяном периоде (табл. 3). Степень поражения растений амброзии изолятом MF-13.14 (C. coccodes) составила более 50%. Изоляты MF-13.2, MF-13.25 и MF-13.27 (видовой комплекс destructivum) проявили высокую патогенность для целых растений галинсоги, степень поражения растений на вторые сутки превышала 70%, на седьмые сутки отмечалась 100% гибель растений.
Таблица 3.
Патогенность изолятов Colletotrichum spp. в вегетационных опытах с сорными растениями
| Изолят | Растение-хозяин | Степень поражения растений, % (росяной период 24/48 ч) | |
|---|---|---|---|
| на вторые сутки | на седьмые сутки | ||
| MF-13.14 | Ambrosia artemisiifolia | 52.6 ± 6.3/57.9 ± 16.7 | 56.4 ± 5.2/54.4 ± 17.8 |
| MF-13.24 | Taraxacum officinale | 0/0 | 0/18.5 ± 10.6 |
| MF-13.2 | Galinsoga parviflora | 78.2 ± 7.0/72.9 ± 7.0 | 100/100 |
| MF-13.25 | ” ” | 82.3 ± 11.8/93.5 ± 4.7 | 100/100 |
| MF-13.27 | ” ” | 62.7 ± 11.5/95.3 ± 4.6 | 100/100 |
| MF-13.17 | Portulaca oleracea | 0/0 | 0/27.6 ± 5.7 |
Оценена патогенность 15 изолятов, выделенных из свеклы, сои, рапса и капусты в отношении этих растений (табл. 4). Все изоляты, выделенные из свеклы (MF-16-014, MF-16-015, MF-17-014) проявили патогенность для свеклы огородной. Изоляты из сои (MF-20.1, MF-20.2, MF-20.3) характеризовались слабой патогенностью и приводили к развитию ограниченных некрозов на отрезках листьев сои, изолят MF-17-018 не проявил патогенности для сои. Среди изолятов, выделенных из Brassica spp., только изоляты MF-3.2 (из рапса) и MF-16-008 (из капусты) вызывали развитие некрозов на отрезках листьев рапса, остальные изоляты оказались не патогенными.
Таблица 4.
Патогенность изолятов Colletotrichum spp. для листовых отрезков культурных растений
| Вид растения | Вид и изолят гриба | Диаметр некроза, мм (четвертые, седьмые и 14-е сутки после инокуляции) | |||
|---|---|---|---|---|---|
| адаксиальная сторона | абаксиальная сторона | ||||
| без повреждения | с уколом | без повреждения | с уколом | ||
| Beta vulgaris | C. coccodes MF-16-014 | 1.1 ± 0.5 | 2.9 ± 0.1 | 1.0 ± 1.0 | 3.4 ± 0.2 |
| 3.8 ± 0.2 | 3.6 ± 0.2 | 3.8 ± 0.2 | 3.5 ± 0.2 | ||
| – | – | – | – | ||
| C. coccodes MF-16-015 | 1.2 ± 0.3 | 3.0 ± 0.7 | 3.6 ± 0.6 | 3.0 ± 0.2 | |
| 1.9 ± 0.7 | 4.5 ± 0.5 | 4.4 ± 0.5 | 4.5 ± 0.3 | ||
| – | – | – | – | ||
| C. coccodes MF-17-014 | 1.2 ± 0.1 | 2.6 ± 0.1 | 1.4 ± 0.5 | 2.6 ± 0.2 | |
| 4.1 ± 0.5 | 5.0 ± 0.7 | 4.9 ± 0.3 | 5.8 ± 0.8 | ||
| – | – | – | – | ||
| Glycine max | C. cf. destructivum MF-20.1 | 0 | 0 | 0 | 0 |
| <1 | 1.3 ± 0.2 | <1 | 1.7 ± 0.3 | ||
| <1 | 1.4 ± 0.2 | <1 | 3.8 ± 1.1 | ||
| C. cf. destructivum MF-20.2 | 0 | 0 | 0 | 0 | |
| 0 | 1.5 ± 0.2 | <1 | 1.6 ± 0.3 | ||
| 0 | 2.0 ± 0.2 | <1 | 3.6 ± 0.4 | ||
| C. cf. destructivum MF-20.3 | 0 | 0 | 0 | 0 | |
| <1 | 1.2 ± 0.1 | <1 | 1.9 ± 0.5 | ||
| <1 | 1.4 ± 0.1 | <1 | 2.3 ± 0.5 | ||
| Colletotrichum sp., комплекс dematium MF-17-018 | 0 | 0 | 0 | 0 | |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Brassica napus | C. coccodes MF-3.1 | 0 | 0 | 0 | 0 |
| 0 | <1 | 0 | <1 | ||
| 0 | <1 | 0 | <1 | ||
| C. coccodes MF-3.2 | 0 | 0 | 0 | 0 | |
| 1.8 ± 0.4 | 1.1 ± 0.1 | 1.6 ± 0.2 | 1.8 ± 0.2 | ||
| 3.1 ± 0.3 | 1.5 ± 0.1 | 2.5 ± 0.4 | 2.1 ± 0.3 | ||
| C. coccodes MF-3.3 | 0 | 0 | 0 | 0 | |
| 0 | <1 | 0 | <1 | ||
| 0 | <1 | 0 | <1 | ||
| C. coccodes MF-3.4 | 0 | 0 | 0 | 0 | |
| 0 | <1 | 0 | <1 | ||
| 0 | <1 | 0 | <1 | ||
| C. dematium MF-17-012 | 0 | 0 | 0 | 0 | |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| C. dematium MF-17-013 | 0 | 0 | 0 | 0 | |
| 0 | 0 | 0 | 0 | ||
| 0 | 0 | 0 | 0 | ||
| Colletotrichum cf. spinaciae MF-16-008 | 1.8 ± 0.8 | 3.2 ± 0.2 | <1 | 2.1 ± 0.1 | |
| 3.5 ± 0.6 | 5.0 ± 0.3 | 2.2 ± 0.3 | 2.8 ± 0.1 | ||
| – | – | – | – | ||
| Colletotrichum sp., комплекс destructivum MF-3.5 | 0 | 0 | <1 | 0 | |
| 0 | <1 | <1 | <1 | ||
| <1 | <1 | <1 | <1 | ||
ОБСУЖДЕНИЕ
Значительная доля наших изолятов, собранных на территории Восточной Европы, Сибири и Дальнего Востока, относилась к виду C. coccodes. Считается, что этот вид является космополитным фитопатогеном с широкой специализацией. Помимо традиционно упоминаемых растений из семейства пасленовых, описано значительное количество растений, которые способен поражать данный вид (Farr, Rossman, 2021). В том числе имеются отрывочные сведения, что данный вид поражает свеклу (Ginns, 1986), рапс (Nitzan et al., 2006), капусту и коноплю (McPartland et al., 2000). Большинство сообщений о выделении C. coccodes из разнообразных растений зачастую базируется исключительно на культурально-морфологических данных, и встречаемость этого вида может оказаться преувеличена (Jayawardena et al., 2021). Наши изоляты C. сoccodes были выделены также из галинсоги мелкоцветковой, амброзии полыннолистной и портулака огородного, которые ранее в качестве растений-хозяев в литературе не встречались. В отношении последних трех видов растений выделенные штаммы проявляли патогенные свойства.
Остальные изоляты относились к двум видовым комплексам – dematium и destructivum. Последний включает в себя непосредственно вид C. destructivum, а также 16 близких видов, являющихся преимущественно патогенами растений. C. destructivum (как и C. coccodes) встречается на широком круге хозяев из семейств Asteraceae, Convolvulaceae, Fabaceae, Magnoliaceae, Menispermaceae, Lamiaceae, Poaceae, Polygonaceae и Solanaceae (Damm et al., 2014). Три изолята, идентифицированные в этой работе как C. destructivum и выделенные из дикорастущих растений, собранных в Ленинградской обл. и Камчатском крае, также указывают на то, что данный вид не специализирован и имеет широкое географическое распространение, хотя по имеющимся у нас сведениям ранее его присутствие на территории России не фиксировалось. Это, по-видимому, объясняется сложностью его идентификации без привлечения молекулярно-генетических методов. В связи с этим дополнительно следует отметить группу филогенетических близких изолятов (Colletotrichum cf. destructivum), которые были выделены из сои в Амурской обл. Другой вид из комплекса destructivum C. lini, первоначально выделенный из льна, нередко поражает растения семейства бобовые (Medicago sativa, Trifolium sp.) и в нашем случае был выделен из чины.
Видовой комплекс dematium в настоящее время включает в себя 18 видов, некоторые из которых узко специализированы и ассоциированы с одним видом растений. Среди изолятов этого видового комплекса в данной работе было достоверно определено три вида – Colletotrichum dematium, C. lineola, C. spinaciae. Вид C. dematium в литературных источниках был отмечен как патоген, эндофит и сапротроф с широкой субстратной специализацией (Damm et al., 2009). В проведенных нами тестах на патогенность изоляты этого вида были не способны вызывать симптомы болезни.
Гриб C. lineola представлен на значительном круге питающих растений (в том числе Heracleum sp.) и встречается практически повсеместно в зонах с умеренным климатом (Damm et al., 2009; Jayawardena et al., 2021). В нашем случае выделенный из борщевика изолят не показал патогенности на соответствующем растении.
Первоначально вид C. spinaciae был выделен из шпината огородного, однако в последствии был также изолирован из других растений (марь белая, люцерна посевная, портулак огородный, Damm et al., 2009). В настоящем исследовании изолят этого вида был выделен из капусты и в тесте на патогенность был способен вызывать некрозы.
Некоторые изоляты (MF-3.5, MF-13.2, MF-13.11, MF-13.13, MF-13.19, MF-13.25, MF-13.27, MF-17-018, MF-19.2, MF-19.5, MF-19.6) из исследованной коллекции не удалось отнести ни к одному из существующих актуальных видов. Это с высокой степенью вероятности демонстрируют наличие еще неописанных видов внутри видовых комплексов destructivum и dematium и свидетельствует о высоком видовом разнообразии данных видовых комплексов.
Неоднократно показано, что представители Colletotrichum sp. проявляют гербицидную активность в отношении ряда сорных растений. Ранее на основе штаммов C. gloeosporioides (Penz.) Penz. et Sacc. созданы препараты BioMal, Collego, Lubao для контроля мальвы, эшиномены, повилики и сесбании; изучается возможность использования C. dematium для борьбы с партениумом позднеплодным, C. orbiculare Damm, P.F. Cannon et Crous – с дурнишником колючим, C. coccodes – с канатником Теофраста, Colletotrichum truncatum (Schwein.) Andrus et W.D. Moore – с сесбанией рослой (Chakraborty, Ray, 2021). Из культуральной жидкости C. gloeosporioides были выделены фитотоксины коллетохлорин А и тирозол, приводящие к развитию некрозов и увяданию амброзии полыннолистной (Masi et al., 2018). Коллетохлорин F из C. higginsianum Sacc. вызывал обширные некрозы на осоте полевом (Masi et al., 2017).
Среди изученных нами культур наибольший интерес в качестве агентов биоконтроля сорной растительности представляют изоляты MF-13.2, MF-13.25, MF-13.27 (видовой комплекс destructivum) в отношении галинсоги мелкоцветковой, а изолят MF-13.14 (C. coccodes) для борьбы с амброзией полыннолистной.
Авторы выражают искреннюю благодарность А.Г. Ковалю за помощь со сбором пораженных растений. Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-76-30005).
Список литературы
Altschul S.F., Gish W., Miller W. et al. Basic local alignment search tool. J. Mol. Biol. 1990. V. 215. P. 403–410. https://doi.org/10.1016/S0022-2836(05)80360-2
Aveskamp M.M., Verkley G.J.M., de Gruyter J. et al. DNA phylogeny reveals polyphyly of Phoma section Peyronellaea and multiple taxonomic novelties. Mycologia. 2009. V. 101 (3). P. 363–382. https://doi.org/10.3852/08-199
Belov G.L., Belosokhov A.F., Kutuzova I.A. et al. Colletotrichum coccodes in potato and tomato leaves in Russia. J. Plant Dis. Protect. 2018. V. 125 (3). P. 311–317. https://doi.org/10.1007/s41348-017-0138-0
Busby P.E., Ridout M., Newcombe G. Fungal endophytes: modifiers of plant disease. Plant Molecular Biol. 2016. V. 90. P. 645–655. https://doi.org/10.1007/s11103-015-0412-0
Cannon P.F., Damm U., Johnston P.R. et al. Colletotrichum – current status and future directions. Stud. Mycol. 2012. V. 73. P. 181–213. https://doi.org/10.3114/sim0014
Carbone I., Kohn L.M. A method for designing primer sets for speciation studies in filamentous ascomycetes. Mycologia. 1999. V. 91 (3). P. 553–556. https://doi.org/10.2307/3761358
Chakraborty A., Ray P. Mycoherbicides for the noxious meddlesome: can Colletotrichum be a budding candidate? Front. Microbiol. 2021. V. 12. P. 1–10. https://doi.org/10.3389/fmicb.2021.754048
Damm U., O’Connell R.J., Groenewald J.Z. et al. The Colletotrichum destructivum species complex – hemibiotrophic pathogens of forage and field crops. Stud. Mycol. 2014. V. 79. P. 49–84. https://doi.org/10.1016/j.simyco.2014.09.003
Damm U., Sato T., Alizadeh A. et al. The Colletotrichum dracaenophilum, C. magnum and C. orchidearum species complexes. Stud. Mycol. 2019. V. 92. P. 1–46. https://doi.org/10.1016/j.simyco.2018.04.001
Damm U., Woudenberg J.H.C., Cannon P.F. et al. Colletotrichum species with curved conidia from herbaceous hosts. Fungal Diversity. 2009. V. 39. P. 45–87.
Dean R., Van Kan J.A., Pretorius Z.A. et al. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol. 2012. V. 13 (4). P. 414–430. https://doi.org/10.1111/j.1364-3703.2011.00783.x
Doyle J.J., Doyle J.L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem. Bull. 1987. V. 19. P. 11–15.
Edgar R.C. Muscle: a multiple sequence alignment method with reduced time and space complexity. BMC Bioinformatics. 2004. V. 5. N 113. https://doi.org/10.1186/1471-2105-5-113
Farr D.F., Rossman A.Y. Fungal databases, U.S. National Fungus Collections, ARS, USDA. Retrieved November 3, 2021, from https://nt.ars-grin.gov/fungaldatabases/
Gannibal Ph.B., Gasich E.L., Berestetskiy A.O. et al. Materials to the study of micromycetes of weeds and wild herbaceous plants in the south of Russian Far East (Primorye and Khabarovsk Territories). Novosti sistematiki nizshikh rasteniy. 2010. V. 44. P. 105–117.
Gardes M., Bruns T.D. ITS primers with enhanced specificity for basidiomycetes - application to the identification of mycorrhizae and rusts. Molec. Ecol. 1993. V. 2. P. 113–18. https://doi.org/10.1111/j.1365-294X.1993.tb00005.x
Gasich E.L., Gannibal Ph.B., Berestetskiy A.O. et al. Micromycetes of weeds and wild herbaceous plants in the Republic of North Ossetia – Alania. Mikologiya i fitopatologiya. 2016. V. 50 (4). P. 257–265 (in Russ.).
Gasich E.L., Gannibal Ph.B., Berestetskiy A.O. et al. Species composition of micromycetes on weeds and wild herbaceous plants in Pskov Region. Plant Protection News. 2015. V. 84 (2). P. 28–35 (in Russ.).
Gasich E.L., Titova Yu.A., Berestetskiy A.O. et al. Micromycetes of weeds in European part of Russia. Research results 1993–1998. VIZR, SPb., 1999 (in Russ.).
Ginns J.H. Compendium of plant disease and decay fungi in Canada 1960–1980. Res. Br. Can. Agric. Publ. 1813. 1986.
Jayawardena R.S., Bhunjun C.S., Hyde K.D. et al. Colletotrichum: lifestyles, biology, morpho-species, species complexes and accepted species. Mycosphere. 2021. V. 12 (1). P. 519–669. https://doi.org/10.5943/mycosphere/12/1/7
Kalyaanamoorthy S., Minh B.Q., Wong T.K.F. et al. ModelFinder: fast model selection for accurate phylogenetic estimates. Nat. Methods. 2017. V. 14 (6). P. 587–589. https://doi.org/10.1038/nmeth.4285
Kimura M. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences. J. Mol. Evol. 1980. V. 16. P. 111–120. https://doi.org/10.1007/bf01731581
Kimura M. Estimation of evolutionary distances between homologous nucleotide sequences. Proc. Natl. Acad. Sci. USA. 1981. V. 78. P. 454–458. https://doi.org/10.1073/pnas.78.1.454
Kotova V.V., Kungurtseva O.V. Anthracnose of agricultural plants. Vestnik zashchity rasteniy. 2014. (Prilozhenie k zhurnalu Vestnik Zashchity rasteniy) (in Russ.).
Kumar S., Stecher G., Li M. et al. MegaX: Molecular evolutionary genetics analysis across computing platforms. Molec. Biol. Evol. 2018. V. 35. P. 1547–1549. https://doi.org/10.1093/molbev/msy096
Malferrari G., Monferini E., DeBlasio P. et al. High-quality genomic DNA from human whole blood and mononuclear cells. BioTechniques. 2002. V. 33 (6). P. 1228–1230. https://doi.org/10.2144/02336bm09
Masi M., Cimmino A., Boari A. et al. Colletochlorins E and F, new phytotoxic tetrasubstituted pyran-2-one and dihydrobenzofuran, isolated from Colletotrichum higginsianum with potential herbicidal activity. J. Agric. Food Chem. 2017. V. 65. P. 1124–1130. https://doi.org/10.1021/acs.jafc.6b05193
Masi M., Zonno M.C., Cimmino A. et al. On the metabolites produced by Colletotrichum gloeosporioides a fungus proposed for the Ambrosia artemisiifolia biocontrol; spectroscopic data and absolute configuration assignment of colletochlorin A. Nat. Prod. Res. 2018. V. 32. P. 1537–1547. https://doi.org/10/1080/14786419.2017.1385020
McPartland J.M., Clarke R.C., Watson D.P. Hemp diseases and pests: management and biological control. Cambridge: CAB International, 2000.
Mel’nik V.A., Popov E.S., Shabunin D.A. Contributions to the studies of mycobiota in Novgorod and Pskov Regions. II. Coelomycetes. Mikologiya i fitopatologiya. 2008. V. 42 (1). P. 43–52 (in Russ.).
Minh B.Q., Nguyen M.A., von Haeseler A. Ultrafast approximation for phylogenetic bootstrap. Mol. Biol. Evol. 2013. V. 30. P. 1188–1195. https://doi.org/10.1093/molbev/mst024
Nguyen L.T., Schmidt H.A., von Haeseler A. et al. IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies. Mol. Biol. Evol. 2015. V. 32 (1). P. 268–274. https://doi.org/10.1093/molbev/msu300
Nitzan N., Lucas B.S., Christ B.J. Colonization of rotation crops and weeds by the potato black dot pathogen Colletotrichum coccodes. Am. J. Pot Res. 2006. V. 83. P. 503–507. https://doi.org/10.1007/BF02883511
Pfirter H., Defago G. The potential of Stagonospora sp. as a mycoherbicide for field bindweed. Biocontrol Science and Technology. 1998. V. 8. P. 93–101.
Réblová M., Gams W., Seifert K.A. Monilochaetes and allied genera of the Glomerellales, and a reconsideration of families in the Microascales. Stud. Mycol. 2011. V. 68. P. 163–191. https://doi.org/10.3114/sim.2011.68.07
Redman R.S., Dunigan D.D., Rodriguez R.J. Fungal symbiosis from mutualism to parasitism: who controls the outcome, host or invader? New Phytol. 2001. V. 151. P. 705–716. https://doi.org/10.1046/j.0028-646x.2001.00210.x
Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. USA. 1977. V. 74 (12). P. 5463–5467. https://doi.org/10.1073/pnas.74.12.5463
Tamura K., Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol. Biol. Evol. 1993. V. 10. P. 512–526. https://doi.org/10.1093/oxfordjournals.molbev.a040023
Vaidya G., Lohman D.J., Meier R. SequenceMatrix: concatenation software for the fast assembly of multi-gene datasets with character set and codon information. Cladistics. 2011. V. 27 (2). P. 171–180. https://doi.org/10.1111/j.1096-0031.2010.00329.x
Varivoda O.P., Maslennikova E.S. Assessment and selection of source material for creating melon hybrids with integrated resistance to anthracnose and powdery mildew. Vegetable crops of Russia. 2019. V. 5. P. 20–24 (in Russ.). https://doi.org/10.18619/2072-9146-2019-5-20-24
White T.J., Bruns T., Lee S. et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA (eds.), PCR Protocols: A guide to methods and applications. Academic Press, San Diego, 1990. P. 315–322.
Zhang N., Castlebury L.A., Miller A.N. et al. An overview of the systematics of the Sordariomycetes based on a four-gene phylogeny. Mycologia. 2006. V. 98. P. 1076–1087.
Варивода О.П., Масленникова Е.С. (Varivoda, Maslennikova) Оценка и подбор исходного материала для создания гибридов дыни с комплексной устойчивостью к антракнозу и мучнистой росе // Овощи России. 2019. Т. 5. С. 20–24.
Ганнибал Ф.Б., Гасич Е.Л., Берестецкий А.О. и др. (Gannibal et al.) Материалы к изучению микромицетов сорных и дикорастущих травянистых растений юга Дальнего Востока России (Приморский и Хабаровский края) // Новости систематики низших растений. 2010. Т. 44. P. 105–118.
Гасич Е.Л., Ганнибал Ф.Б., Берестецкий А.О. и др. (Gasich et al.) Видовой состав микромицетов на сорных и дикорастущих травянистых растениях Псковской области // Вестн. защиты раст. 2015. Т. 84. № 2. P. 28–35.
Гасич Е.Л., Ганнибал Ф.Б., Берестецкий А.О. и др. (Gasich et al.) Микромицеты сорных и дикорастущих травянистых растений республики Северная Осетия–Алания // Микология и фитопатология. 2016. Т. 50. № 4. C 257–265.
Гасич Е.Л., Титова Ю.А., Берестецкий А.О. и др. (Gasich et al.) Микромицеты сорных растений европейской части России. Итоги исследований 1993–1998 гг. СПб.: ВИЗР, 1999. 88 с.
Котова В.В., Кунгурцева О.В. (Kotova, Kungurtseva) Антракноз сельскохозяйственных растений // Вестник защиты растений. 2014. 132 с. (Приложение к журналу “Вестник защиты растений”).
Мельник В.А., Попов Е.С., Шабунин Д.А. (Mel’nik et al.) Материалы к изучению микобиоты Новгородской и Псковской областей. II. Целомицеты // Микология и фитопатология. 2008. Т. 42. № 1. С. 43–52.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


