Микология и фитопатология, 2022, T. 56, № 4, стр. 264-275
Оценка активности гидролитических ферментов и изменения аминокислотного состава спиртовой барды после глубинного культивирования Pleurotus ostreatus и Agaricus bisporus
З. Р. Ахмедова 1, *, Т. Э. Шонахунов 1, **, И. Т. Гулямова 1, ***, З. Т. Хамраева 1, ****
1 Институт микробиологии АН РУз
100128 Ташкент, Республика Узбекистан
* E-mail: akhmedovazr@mail.ru
** E-mail: brus_li89@mail.ru
*** E-mail: irosh1985@mail.ru
**** E-mail: zieda_1984@mail.ru
Поступила в редакцию 15.04.2021
После доработки 21.03.2022
Принята к публикации 24.04.2022
- EDN: WGCZCD
- DOI: 10.31857/S0026364822040031
Аннотация
Изучена динамика активности гидролитических ферментов, накопления белков и состав аминокислот при культивировании штаммов Pleurotus ostreatus УзБИ 108 и Agaricus bisporus УзБИ 12 и A. bisporus УзБИ 2 на жидкой модифицированной среде Чапека со спиртовой бардой. Среди трех испытанных штаммов грибов наиболее активным и продуктивным по ферментативной активности оказался A. bisporus УзБИ 2, а по обогащению барды аминокислотами – Pleurotus ostreatus УзБИ 108. Полученные данные и анализ литературы показывают перспективность использования изученных штаммов базидиомицетов для трансформации спиртовой барды в обогащенные белком и обладающие ферментативной активностью продукты.
ВВЕДЕНИЕ
В последние десятилетия большую актуальность приобретает поиск путей производства продуктов и кормов на основе ксилотрофных съедобных грибов и дешевых, легкодоступных и нетоксичных отходов растениеводства и промышленности. Сырье широко культивируемых съедобных грибов несет полноценный состав компонентов питания: протеина, пищевых волокон, липидов, минеральных элементов. Широко культивируемыми видами являются Agaricus bisporus, Pleurotus ostreatus, Lentinula edodes, Volvariella volvacea и др. (Chang, 1999; ISMS, 2017; Royse, 2014).
Рентабельность производства съедобных грибов можно повысить, если в качестве субстрата использовать отходы крупных предприятий, имеющих многотоннажные отходы, в частности, бродильных производств. Так, производство пищевого этанола из пшеницы на четырех заводах Республики Узбекистан (ОАО “Бектемир спирт”, “Куконспирт”, “Андижон биокиме заводи”, “Янгиюл биохим”) сопровождается образованием большого количества послеспиртовой барды, объем которой во много раз превышает объем производимого этанола (135–150 м3 на 1000 дал этанола). В настоящее время барда является обременительным отходом, создающим угрозу окружающей среде (Akhmedova, 1994).
Вместе с тем барда имеет хорошие перспективы как сырье для получения белоксодержащей кормовой добавки (Ferreira et al., 2010; Kuznetsov, 2010; Kuznetsov et al., 2011; Nitayavardhana, Khanal, 2010), и ее использование может повысить рентабельность производства (Rajarathnam et al., 1992). В России полный цикл переработки барды в сухую форму DDGS реализован на некоторых заводах (Lavermicocca et al., 2000; Minakov et al., 2018). Однако сухая барда содержит медленнорасщепляемые углеводы (клетчатку) и небольшое количество сырого протеина, перевариваемость которого составляет всего 50–52%.
Кормовую ценность барды можно повысить микробиологической конверсией с применением грибов. Было показано, что размножение и рост мукоровых грибов в спиртовой барде свидетельствуют об их адаптации к широкому спектру субстратов, что позволяет осуществить биоконверсию остаточных субстратов в микробную биомассу и биологически ценные вещества. Переработка после спиртовой барды микромицетами может потенциально улучшить экономические показатели производства и уменьшить воздействие отходов на окружающую среду, поскольку богатая белком грибная биомасса может быть использована для производства высококачественных кормов для животноводства (Nitayavardhana, Khanal, 2010). Использование съедобных базидиальных грибов, которые богаты белком с высоким содержанием лейцина, изолейцина, тирозина с фенилаланином, метионина и лизина, представляется не менее перспективным (Minakov et al., 2018). В проведенных нами ранее опытах был выделен ряд штаммов грибов, которые обладали хорошими показателями содержания белков, углеводов, липидов и свободных аминокислот, а также высокой целлюлазной, ксиланазной и лигниназной активностью (Akhmedova et al., 1992; Akhmedova et al., 1993a; Akhmedova et al., 1994; Akhmedova, 1995a).
В 1965 г. впервые был использован субстрат, обогащенный белком под действием гриба Agaricus bisporus, который предлагалось использовать в качестве корма для крупного рогатого скота, так называемый “микокорм” (Mirjam et al., 2017; Geml et al., 2008).
Исходя из вышеуказанных литературных данных и множества исследований, касающихся высших базидиальных грибов (Kerrigan, 1995; Kolesnikova, Ptskialadze, 1999; Ten Have, 2001; Callac et al., 2002; Melnikova et al., 2008; Mirjam et al., 2017; Wood, 1980; Hofrichter et al., 2015) и полученных нами ранее результатов (Akhmedova et al., 1993; Akhmedova et al., 1994, Akhmedova, 1995b; Akhmedova, 1996; Akhmedova, 1999), следует отметить, что биологические, физиологические и биохимические свойства базидиальных грибов и их высокий биосинтетический потенциал позволяют считать их перспективными источниками не только в получении плодовых тел, но и для создания эффективных биотехнологий по биотрансформации и утилизации различных лигноцеллюлозных субстратов, а также в получении ценных кормовых продуктов, в том числе на отходах бродильных производств.
Целью данной работы является оценка ферментативной активности, накопления белка и аминокислотного состава при глубинном культивировании базидиальных грибов с использованием послеспиртовой зерновой барды в качестве одного из компонентов субстрата.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали штаммы базидиальных грибов Pleurotus ostreatus (Jacq.) P. Kumm. (УзБИ 108) и Agaricus bisporus (J.E. Lange) Imbach (УзБИ 2, УзБИ 12), которые культивировали на послеспиртовой зерновой барде (ОАО “Бектемирспирт”, Узбекистан). Предварительно были установлены условия культивирования и оптимальная концентрация барды. Образцы для выделения культур Pleurotus ostreatus УзБИ 108 и Agaricus bisporus УзБИ 12 были собраны на гниющем стволе тополя (Populus canadensis) в Ташкентском вилояте и на почве на опушке хвойного леса санатория “Чорток” Наманганского вилоята соответственно. Культура Agaricus bisporus УзБИ 2 была любезно предоставлена компанией “Еurofood” (г. Ташкент).
Культуры сохраняются в музее коллекции культур и в лаборатории “Природоохранная биотехнология” Института микробиологии АН РУз. Для поддержания культур использовали питательные среды сусло-агар и агар Чапека с добавлением до 1%-х пшеничных отрубей, измельченных древесных опилок и 1%-й сахарозы. Культуры хранятся на скошенной среде сусло-агар, картофельный агар с добавлением 1%-го дрожжевого экстракта, а также агаровой среде, содержащей безаммиачный конский навоз, березовые (Betula pendula) опилки и пшеничную солому в равных концентрациях (1%), которые вносили в состав среды Чапека, содержащей соответствующие минеральные элементы, но без сахарозы. Для этого конский навоз обрабатывали над паром на водяной бане до полного удаления аммиака и следов мочевины, далее автоклавировали при 1 атм в течение 45 мин, высушивали на воздухе и в дальнейшем использовали для поддержания исходных культур.
Засев штаммов для получения посевного материала проводили с косяков 10–15-суточных культур, выращенных при 22°С на вышеуказанных средах. Посевной материал готовили в конических колбах Эрленмеера (1 л) с 250 мл питательной среды, на дно которых помещали по 10 шариков стеклянных бус (диаметр 0.5–1.0 см). После стерилизации и охлаждения среды до 28°С из пробирок с чистыми культурами грибов стерильно вырезали 5 одинаковых кусочков мицелия и засевали их в питательную среду. Культивирование грибов проводили в стационарных условиях в течение 10 сут при 20–22°С до полного зарастания на поверхности пленкой мицелия. Затем мицелий измельчали путем встряхивания колб с помощью находящихся в них шариков-бус и использовали в качестве посевного материала для культивирования грибов на жидких питательных средах в глубинных условиях.
Выращивание грибов проводили глубинным способом в 300 мл среды в колбах Эрленмейера на 1 л. Посевной материал вносили в количестве 10% от объема жидкой питательной среды. В качестве контрольных вариантов для Pleurotus ostreatus УзБИ 108 использовали модифицированную среду Чапека с пшеничными отрубями (2%) и 15 мл неохмеленного пивного сусла, для двух штаммов Agaricus bisporus среда отличалась тем, что вместо пшеничных отрубей добавляли пшеничную солому (2%), измельченную до частиц 0.1–0.3 мм.
Опытные варианты ферментационных сред имели указанный выше состав, но с заменой соломы и отрубей на спиртовую барду (50%) с рН 5.6–6.0.
Культивирование штаммов проводили на круговых качалках со скоростью вращения 180 об./мин при 28°С в течение 240 ч. С периодичностью в 12 ч отмечали рост, содержание белка и активность гидролитических ферментов в отфильтрованной культуральной жидкости (КЖ).
Изучаемые грибы по физиологии относятся к мезофилам с оптимумом роста при 24–26°С. Для культивирования их в условиях Узбекистана они должны выдерживать более высокие температуры, чтобы соответствовать требованиям производства. Поэтому исследовали влияние на рост, развитие, образование белка и ферментов у указанных штаммов при температурах 25, 30, 35 и 40°С. Культивирование грибов проводили на оптимизированной нами питательной среде с добавлением послеспиртовой пшеничной барды 50%-й концентрации. Время культивирования штаммов A. bisporus составляло 24–144 ч, штамма Pleurotus ostreatus УзБИ 108 – 24–312 ч (Rabinovich et al., 2002).
Активность фермента целлюлазного комплекса – осахаривающей эндоглюканазы (эндо-1,4-β-глюкан-4-глюкангидролаза) определяли по методу Somogyi-Nelson в модификации Р.В. Фениксовой (Rabinovich et al., 2002). Определение образующихся редуцирующих сахаров (РС) осуществляли при гидролизе 1%-го р-ра Na-КМЦ фирмы “Sigma” (США). За единицу активности принимали количество фермента, которое за 1 мин образует 1 мг глюкозы. Удельную активность фермента выражали на 1 мг общего белка в КЖ и отщепляющего из субстрата 1 мкг глюкозы. Измерение проводили на ФЭК при 490 нм. Количество глюкозы, образующейся под действием целлюлазы, рассчитывали по калибровочному графику, построенному по стандартному раствору глюкозы.
Активность ксиланазы (1,4-β-ксилан ксиланогидролаза) определяли методом Somogyi-Nelson в модификации Р.В. Фениксовой с использованием реактивов 1 и 2 (Feniksova et al., 1975), субстратом служил 1%-й р-р ксилана овса “Спельт” фирмы “Sigma” (США).
Определения активности эндо-1,4-β-ксиланазы проводили вискозиметрическим методом в вискозометре Оствальда. Измеряли обратную величину относительной вязкости в инкубационной смеси, состоящей из 3 мл 1%-го р-ра КМК (карбоксаметилксилан) и 1 мл р-ра фермента в 0.1 М-м ацетатном буфере (рН = 4.2) при 40°С. Об активности эндо-1,4-β-ксиланазы судили по скорости возрастания обратной величины относительной вязкости. За единицу активности принимали количество фермента, дающее возрастание этой величины на 1 единицу за 1 мин в реакционной смеси при 40°С (Dubais et al., 1956; Nelson et al., 1982a).
Активность протеазы определяли по ГОСТ-1976 (Стандарты определения протеолитических ферментов) в модификации Ансона. Для изучения рН-зависимости протеазы использовали буферные смеси Мак-Илвейн, фосфатный буфер и Трис-HCI буфер. В качестве субстратов использовали казеин по Гаммерстен (Enzyme preparations.., 1988).
Количество белка в КЖ определяли по методу Лоури, рН – на рН-метре “Benchtop Ph meter” 210 (Lowry, et al. 1951).
Кислотность барды определяли титрованием щелочью, количественно нейтрализующей свободные кислоты и их кислые соли и выражали в градусах Тернера (°Т). В качестве индикатора использовали 1%-й спиртовой р-р фенолфталеина. Для перевода градусов в проценты использовали коэффициент пересчета 0.0065, соответствующий органическим кислотам по ГОСТ-5898-87 (Guidelines.., 1991).
Определение азота и вычисление содержания сырого протеина определяли по методу Къельдаля, рН среды и культуральной жидкости определяли потенциометрически с помощью прибора ЭВ-74.
Содержание общих углеводов в КЖ определяли по фенол-серному методу Дюбуа (Dubaiset al., 1956).
Содержание аминокислот определяли на анализаторе высокоэффективной жидкостной хроматографии (ВЭЖХ) в культуральной среде, взятой на стадии активного роста. Отобранный образец тщательно измельчали в ступке со стеклянными бусами с чередованием обработкой жидким азотом для автолиза клеточной стенки и выхода внутриклеточного содержимого. Свободные аминокислоты, содержащиеся в растворимой фракции белков, отделяли из растертой суспензии гомогената с помощью 10%-го ацетонитрила и центрифугированием при 3000 об./мин в течение 30 мин. Далее супернатант подвергали осаждению с 20%-й трихлоруксусной кислотой. Полученный осадок отделяли центрифугированием при 6000 об./мин. Супернатант обрабатывали фенилтиоизоцианатом для получения фенилтиокарбамила. Идентификацию производных аминокислот в гидролизате белков проводили методом ВЭЖХ на хроматографе Agilent Technologies 1200 cDAD с детектором, колонка 75 × 4.6 мм, Discovery HSC18, 3 мкм. Раствор А состоял из 0.14 М CH3COONa + 0.05% ТЭА, рН 6.4 в ацетонитриле, скорость потока – 12 мл/мин, детекция поглощения – 269 нм. Качественный и количественный расчет концентрации аминокислот проводили сравнением времени удерживания и расчетом площадей пиков стандартных и исследуемых ФТК-производных аминокислот (Steven et al., 1988).
Все выполненные эксперименты проведены в трех повторностях, для расчета среднего значения и стандартной ошибки (SЕ) трех репликаций использована программа Microsoft Excel (Корпорация Microsoft, США). Все результаты, представленные в виде значений, проанализированы с помощью программы ANOVA с контрольным значением при P ≤ 0.05. Для статистической обработки достоверности различий в сравниваемых показателях использовали критерий Стьюдента, компьютерные программы Origin 6.1 (OriginLab Corporation, США), Graph Pad Prism 8 (GraphPad Software, США) (Kalinin, 2015).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение химического состава послеспиртовой пшеничной барды (табл. 1) показало, что в ней содержится 3.6% клетчатки, 3.4% безазотистых экстрактивных веществ и 2.04% белков, 6.8% других органических веществ. С учетом указанных показателей для культивирования грибов была использована модифицированная среда Чапека, где в качестве единственного источника углерода взамен сахарозы вносили зерновую барду в концентрации 50 и 1% пшеничной соломы, измельченной до частиц 0.1–0.3 мм.
Таблица 1.
Химический состав жидкой послеспиртовой зерновой барды ОАО “Бектемир спирт” (Узбекистан)
| Показатели | Содержание веществ, % |
|---|---|
| Сухие вещества | 23.5 |
| Влажность | 76–78 |
| Зольные вещества | 0.92 |
| Кислотность (титруемая) | 1.3 |
| рН (потенциометрический) | 2.3–2.5 |
| Органические вещества | 9.78 |
| Клетчатка | 3.58 |
| Безазотистые экстрактивные вещества | 3.42 |
| Несброженные углеводы | 4.21 |
| Белки | 2.04 |
В процессе роста Pleurotus ostreatus УзБИ 108 и Agaricus bisporus УзБИ 12 и УзБИ 2 на питательных средах разного состава каждые 24 ч в течение 5 сут (120 ч) проводили измерение содержания белков и ферментов. На рис. 1 представлена динамика содержания белков на модифицированной среде Чапека и на среде со спиртовой бардой. Было показано, что у всех исследованных штаммов большее содержание белка было зафиксировано на среде с бардой, причем в первые 72 ч белка в среде было больше, чем в последующие часы культивирования. Наибольшее количество белка было обнаружено в культуральной среде Pleurotus ostreatus УзБИ 108 к 48 ч: в среде с отрубями было 7.3 мг/мл, тогда как в среде с зерновой бардой – 8.2 мг/мл. После 72 ч культивирования количество белка в среде снижалось у всех исследованных штаммов. Среди штаммов Agaricus bisporus наибольшее количество белка в среде было выявлено у штамма A. bisporus 2 в первые же сутки культивирования – к 24 ч роста.
Рис. 1.
Динамика накопления белков базидиомицетами Agaricus bisporus УзБИ 2, A. bisporus УзБИ 12 и Pleurotus ostreatus УзБИ 108 на модифицированной среде Чапека (контроль) и на среде со спиртовой бардой (опыт).

На рис. 2–4 представлены данные по изучению ферментативной активности ксиланазы и целлюлазы у исследованных штаммов. У A. bisporus УзБИ 2 на среде с бардой наивысшая активность целлюлазы (5.1 ед./мл) и ксиланазы (5.9 ед./мл) была зафиксирована к 96 ч, причем активность этих ферментов была выше, чем в среде с соломой в 4 и 5 раза соответственно.
Рис. 2.
Ферментативная активность гриба Agaricus bisporus УзБИ 2 на модифицированной среде Чапека с соломой и на среде с бардой.

Рис. 3.
Ферментативная активность гриба Agaricus bisporus УзБИ 12 на модифицированной среде Чапека с соломой и на среде с бардой.
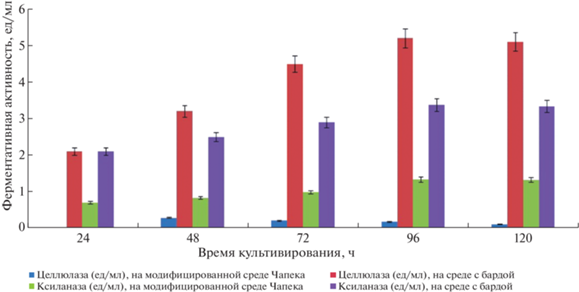
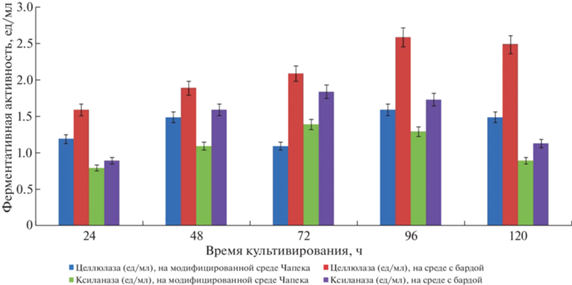
Рис. 4.
Ферментативная активность гриба Pleurotus ostreatus УзБИ 108 на модифицированной среде Чапека (контроль) и на среде с бардой (опыт).
У A. bisporus УзБИ 12 к 96 ч культивирования целлюлолитическая активность на среде с бардой достигала 5.2 ед/мл, а на среде с соломой – 0.14 ед/мл. Ксиланазная активность на среде с бардой составила 3.39 ед/мл, а на среде с соломой – 1.14 ед/мл (рис. 3).
Полученные нами данные согласуются с данными литературы, свидетельствующими о том, что ксиланазы и деполимеризованные структуры ксилана в субстрате имеют значение в питании грибов от начала и до конца процесса ферментации (Jurak et al., 2015).
У Pleurotus ostreatus УзБИ 108 целлюлолитическая активность на модифицированной среде с бардой была также выше (2.6 ед./мл на 96 ч), чем на среде Чапека с отрубями (1.6 ед/мл). Также ксиланазная активность на среде с бардой достигала больших значений, чем контрольной среде (1.78 ед./мл к 72 ч роста гриба и 1.41 ед./мл, т.е. почти на 20% меньше, в контроле) (рис. 4).
Изученные штаммы базидиальных грибов проявили протеолитическую активность в обоих вариантах питательной среды (рис. 5). Относительно высокая протеолитическая активность обнаружена в фильтрате КЖ Agaricus bisporius УзБИ 12 на модифицированной среде с бардой к 96 ч роста гриба, которая составила 0.14 ед./мл (рис. 5).
Рис. 5.
Протеазная активность грибов Agaricus bisporius УзБИ 2, A. bisporius УзБИ 12 и Pleurotus ostreatus УзБИ 108 на модифицированной среде Чапека (контроль) и на среде с бардой (опыт).

Для проявления высокой активности ферментов и продуктивности грибов, помимо питательной среды, большое значение имеют физико-химические факторы роста, способы и условия культивирования.
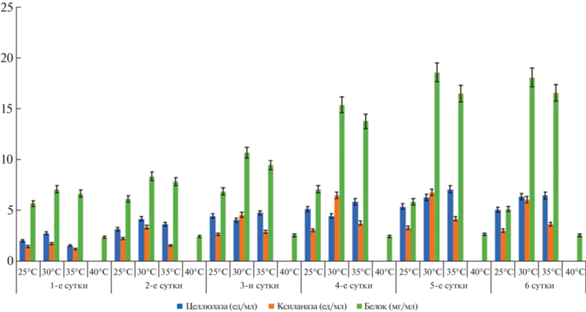
Изучение активности ферментов A. bisporius УзБИ 2 показало, что при 30°С наблюдали наибольшее накопление белка в культуральной среде к 96 и 120 ч роста. Активность ферментов наблюдали также при 30°С, особенно к 120–144 ч роста гриба. Ксиланазная активность была выше при всех температурах и сроках роста A. bisporius УзБИ 2 по сравнению с целлюлазной активностью (рис. 6).
Рис. 6.
Влияние температуры культивирования на биосинтез ферментов и образование белков грибом Agaricus bisporius УзБИ 2 на среде с послеспиртовой бардой.

Аналогичную картину по накоплению белков и активности ферментов в зависимости от температуры культивирования наблюдали для A. bisporius УзБИ 12 (рис. 7). Активность ферментов у этого штамма была ниже, чем у A. bisporius УзБИ 2.
Рис. 7.
Влияние температуры роста на образование ферментов и белка грибом Agaricus bisporius УзБИ 12 на среде с после- спиртовой бардой.
Изучение накопления белка и активности ферментов штамма Pleurotus ostreatus УзБИ 108 при его культивировании при разных температурах проводили в течение 13 сут (312 ч). Наибольшее количество белка и более высокая ферментативная активность были выявлены при температурах 25–30°С. Максимальная концентрация белка (38.2 мг/мл) была зафиксирована на 10-е сутки роста. Было также показано, что ксиланазная активность у этого штамма была несколько выше, чем целлюлазная, однако в динамике роста штамма активность ферментов менялась незначительно. Максимальные значения ксиланазной активности достигали 3.7 ед./мл на 11-е сутки роста при 25°С, тогда как целлюлазная – 3.5 ед./мл на девятые сутки при 25°С (рис. 8, а, б). Для P. ostreatus УзБИ 108 отмечали накопление белка в КЖ до 240-часового роста при 25°С.
Рис. 8.
Влияние температуры культивирования на биосинтез ферментов и белка грибом Pleurotus ostreatus УЗБИ-108 на 1–7-е (а) и 8–13-е (б) сутки роста на среде с послеспиртовой бардой.

Анализ белков в гидролизатах грибов показал, что все исследованные штаммы имели полноценный аминокислотный состав (табл. 2). Преобладающим являлся глутамин, причем если в составе зерновой барды концентрация глутамина составляла 0.036051 мг/мл, то после ферментации на данном субстрате Agaricus bisporius УзБИ 12 его содержание достигло 4.112774 мг/г, A. bisporius УзБИ 2 – 4.69535 мг/г, а Pleurotus ostreatus УзБИ 108 – 10.68413 мг/г. Следующим по высокому содержанию являлся цистеин: его концентрация в исходной барде составляла 0.036051 мг/г, после ферментации A. bisporius УзБИ 12 – 1.650142 мг/г, Agaricus bisporius УзБИ 2 – 2.358357 мг/г, Pleurotus ostreatus УзБИ 108 – 3.371105 мг/г.
Таблица 2.
Аминокислотный состав четырехсуточной ферментационной среды после глубинного культивирования штаммов Agaricus bisporus и Pleurotus ostreatus на модифицированной среде Чапека с 50% барды
| Аминокислоты | В составе исходной барды, мг/г | Agaricus bisporus УзБИ 12 | Agaricus bisporus УзБИ 2 | Pleurotus ostreatus УЗБИ-108 |
|---|---|---|---|---|
| концентрация аминокислот, мг/мл | ||||
| Аспарагиновая кислота | 0.094583 | 0.159781 | 0.162201 | 0.233215 |
| Глутаминовая кислота | 0.113038 | 0.838567 | 1.48174 | 0.760642 |
| Серин | 0.062453 | 0.545504 | 0.714961 | 1.147043 |
| Глицин | 0.0822 | 0.302205 | 0.477302 | 0.766537 |
| Аспарагин | 0.082145 | 0.303423 | 0.479123 | 0.770877 |
| Глутамин | 0.070264 | 4.112774 | 4.69535 | 10.68413 |
| Цистеин | 0.036051 | 1.650142 | 2.358357 | 3.371105 |
| Треонин | 0.037273 | 0.476066 | 0.666492 | 1.552236 |
| Аргинин | 0.096297 | 0.561726 | 0.701623 | 2.015164 |
| Аланин | 0.087764 | 1.398889 | 2.481276 | 1.79512 |
| Пролин | 0.213914 | 1.665445 | 1.700257 | 2.385489 |
| Тирозин | 0.072814 | 1.376225 | 1.870098 | 0.680147 |
| Валин | 0.073361 | 0.680108 | 1.136774 | 1.908667 |
| Метионин | 0.024012 | 0.157219 | 0.318866 | 0.10186 |
| Изолейцин | 0.054824 | 0.910451 | 0.944982 | 1.953269 |
| Лейцин | 0.083094 | 1.26455 | 0.948854 | 2.214286 |
| Гистидин | 0 | 0 | 0 | 0 |
| Триптофан | 0.094143 | 1.081648 | 1.024418 | 2.247234 |
| Фенилаланин | 0.011858 | 0.254677 | 0.281722 | 0.223124 |
| Лизин HCl | 0.007209 | 0.084624 | 0.184552 | 1.236046 |
| Всего | 1.397052 | 17.82402 | 22.62895 | 36.04619 |
Общая сумма аминокислот в ферментированных грибами по сравнению с исходной бардой (1.397052 мг/г) существенно возросла: Agaricus bisporius УзБИ 12 – 36.04619 мг, A. bisporius УзБИ 2 – 22.62895 мг и Pleurotus ostreatus УзБИ 108 – 17.82402 мг/г.
Таким образом, нами показана возможность успешного проведения биоконверсии зерновой барды с применением штаммов P. ostreatus УзБИ 108, Agaricus bisporus УзБИ 2 и A. bisporus УзБИ 12 и получением продуктов, обогащенных белком с полноценным аминокислотным составом, а также обладающих высокой активностью гидролитических ферментов.
Среди трех испытанных культур базидиомицетов наибольшую активность и продуктивность по ферментативной активности показал Agaricus bisporus УзБИ 2, по аминокислотному составу – Pleurotus ostreatus УзБИ 108.
Аналогичные данные были получены в работах с базидиальными грибами, которые могут внести значительный вклад в устранение белкового дефицита и получение целого ряда ценных белковых препаратов медицинского назначения (Biryukov et al., 2002; Bitteeva et al., 2002). Так, был предложен запатентованный способ получения белковой биомассы путем глубинного культивирования гриба P. pulmonarius РР-3.2 на крахмал-аммонийной среде в условиях аэрации при рН 5.5–6.0 и 23–25°C. Авторы предлагали получать белковые пищевые добавки для использования в хлебопекарной, мясоперерабатывающей и других отраслях пищевой промышленности с целью обогащения пищевых продуктов высококачественным грибным белком, содержание которого составляло 31.2% (Patyshakuliyeva, et al. 2015). М.Б. Биттеевой и соавт. (Bitteeva, 2002) также отмечалось, что базидиомицеты могут быть использованы для получения биомассы с высоким содержанием белка, ненасыщенных жирных кислот (линолевой, линоленовой), витаминов, минеральных веществ, что может рассматриваться не только как белковая пищевая добавка, но и как комплексный источник биологически активных соединений. Получение биомассы мицелия базидиальных грибов методом глубинного культивирования на молочной сыворотке было рассмотрено в работах В.Ф. Колесниковой и Д.А. Пцкиаладзе и Е.А. Мельниковой и соавт. (Morin et al. 2012). Авторы успешно применили отъемно-доливной метод культивирования и показали перспективность использования грибов для получения белкового продукта.
Оценка ферментативной активности и аминокислотного состава биомассы грибов Р. ostreatus УзБИ 108 Agaricus bisporus УзБИ 2 и A. bisporus УзБИ 12, выращенных на отходах бродильной промышленности, показала, что зерновая барда является полноценным субстратом для выращивания базидиомицетов с целью ее обогащения белком и дальнейшего использования, в частности, в кормопроизводстве.
Список литературы
Akhmedova Z.R. Biodegradation of plant wastes by fungus P. ostreatus 1. Formation of biologically valuable pro-ducts. Biotechnology. 1992. № 5. P. 65–68.
Akhmedova Z.R., Beletskaya O.P. Cellulases and ligninases of basidiomycetes. Prikladnaya biokhimiya i mikrobio-logiya. 1993. № 6. P. 823–828 (in Russ.).
Akhmedova Z.R., Kulaev I.S., Davranov K. Component composition of cellulosolytic basidiomycete enzymes. Mikologiya i fitopatologiya. 1993. V. 28 (2). P. 39–44.
Akhmedova Z.R., Kulaev I.S., Davrnov K.D. Xylanases and phenol oxidases of basidiomycetes. Mikologiya i fitopatologiya. 1993. V. 28 (1). P. 49–53 (in Russ.).
Akhmedova Z.R., Beletskaya O.P., Dalimova G.N. et al. Selection and cultivation of lignin and cellulose-destroying fungi. Microbiology. 1994. V. 63 (5). P. 929–936.
Akhmedova Z.R. Cellulolytic, xylanolytic and lignolytic enzymes of the fungus P. ostreatus. Appl. Biochem. Microbiol. 1994. V. 30. P. 42–48.
Akhmedova Z.R. Bioconversion of cotton waste by wood-destroying basidiomycetes. Microbiology. 1995. V. 64 (3). P. 381–386.
Akhmedova Z.R. Study of the conditions of enzyme formation and the secretion of extracellular ligninases by the fungus Pleurotus ostreatus UzBI-1108. Chem. Nat. Comp. 1995. V. 31. P. 619–625. https://doi.org/10.1007/BF01164893
Akhmedova Z.R. Isolation, purification and study of some properties of extracellular lignin-peroxidases of the wood-destroying fungus Pleurotus ostreatus. Chem. Nat. Comm. 1996. V. 32 (3). P. 374–380. https://doi.org/10.1007/BF01372344
Akhmedova Z.R. Ligninolytic, xylanolytic and cellulolytic enzymes of basidiomycetes and their relationship in the decomposition of lignocellulose: Doct. Biol. Thesis abstract. Tashkent, 1999.
Biryukov V.V., Bitteeva M.B., Cherkezov A.A. A method for obtaining protein biomass of basidiomycete Pleurotus pulmonarius. Patent RU 2186851 c12p 21/00, c12n 1/14, c12n 1/14, c12r1: 645 dated 10.08.2002 (in Russ.).
Bitteeva M.B., Biryukov V.V., Cherkezov A.A. et al. Method for obtaining protein biomass of the fungus. Patent RU 2189395 C12P 21/00, C12N 1/14, C12N 1/14, C12R1: 645 dated 09.20.2002. (in Russ.).
Callac P., Theochari I., Kerrigan R.W. The germplasm of Agaricus bisporus: main results after ten years of collecting in France, in Greece, and in North America. Acta Hortic. 2002. V. 579. P. 49–55. https://doi.org/10.17660/ActaHortic.2002.579.4
Chang S.T. World production of cultivated edible and medicinal mushrooms in 1997 with emphasis on Lentinus edodes (Berk.) Sing. in China. Int. J. Med. Mushrooms. 1999. V. 1. P. 291–300. https://doi.org/10.1615/IntJMedMushr.v1.i4.10
Determination of the mass fraction of nitrogen and calculation of the mass fraction of crude protein. Kjeldahl Method, Reissue, (2002) as amended (IUS 4-2002), ISO 5983:1997 GOST R 51417-99. Moscow, 2002 (in Russ.).
Dubais M., Yilles R.A., Amilton G.K. et al. Calorimetrec method for determination of sugars and related substances. Anal. Chem. 1956. V. 28 (3). P. 350–356.
Enzyme preparations, methods for determining proteolytic activity, GOST 20264.2-88. USSR State Committee for Standards, Moscow, 1988 (in Russ.).
Feniksova R.V., Tiunova N.A., Rodionova N.A. et al. Methods of modern biochemistry. Nauka, Moscow, 1975 (in Russ.).
Ferreira L.F., Aguiar M., Pompeu G. et al. Selection of vinase degrading microorganisms. World J. Microbiol. Biotechnol. 2010. V. 26. P. 1613–1621. https://doi.org/10.1007/s11274-010-0337-3
Geml J., Laursen G.A., Taylor D.L. Molecular diversity assessment of arctic and boreal Agaricus taxa. Mycologia. 2008. V. 100. P. 577–589. https://doi.org/10.3852/07-042R1
Guidelines for the determination of titratable acidity (approved by the Ministry of Health of the USSR on 23.10.1991 № 122-5/72, recommended by the Ministry of Trade of the USSR of 11.11.1991 № 1-40/3805) (in Russ.).
Hofrichter M., Kellner H., Pecyna M.J. et al. Fungal unspecific peroxygenases: heme-thiolate proteins that combine peroxidase and cytochrome P450 properties. Adv. Exp. Med. Biol. 2015. V. 851. P. 341–368. https://doi.org/10.1007/978-3-319-16009-2_13
Jurak E., Patyshakuliyeva A., de Vries R.P. et al. Compost grown Agaricus bisporus lacks the ability to degrade and consume highly substituted xylan fragments. PLoS One. 2015. V. 10. https://doi.org/10.1371/journal.pone.0134169
Kalinin A.G. Data processing by methods of mathematical statistics: Chita, 2015 (in Russ.).
Kerrigan R.W. Global genetic resources for Agaricus breeding and cultivation. Can. J. Bot. 1995. V. 73. P. 973–979. https://doi.org/10.1139/b95-347
Kolesnikova V.F., Ptskialadze D.A. Method for obtaining protein biomass. Patent RU 2126835 C12P 21/00, C12N 1/14, C12N 1/14, C12R1: 645 dated 02.27.1999.
Kuznetsov I.N. Analysis of world experience in processing technology after distillery stillage. Proceedings of BSTU. Ser. IV, Chemistry, technology of organic substances and biotechnology. 2010. Issue. 18. P. 204–301.
Kuznetsov I.N., Ruchai N.S., Lembovich A.I. et al. Changes in the composition of post-alcohol stillage during anaerobic and enzymatic treatment. Proceedings of BSTU. Ser. 4, Chemistry, technology of organic substances and biotechnology. 2011. Issue 19. P. 289–295.
Lavermicocca P., Valerio F., Evidente A. et al. Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B. Appl. Environ. Microbiol. 2000. V. 66 (9). P. 4084–4090.
Lowry O.H., Rosebrough N.J., Farral A.L. et al. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 1951. V. 193. P. 265–275.
Melnikova E.A., Mironov P.V., Litovka Yu.A. Morphological features of the basidiomycete Pleurotus pulmonarius in surface and merged culture. Bioresour. Technol. 2008. V. 99 (12). P. 5165–5176.
Minakov L.V., Sevodina K.B., Shchadrintseva A.I. et al. Comparative evaluation of amino acid and protein compositions of mycelium and fruiting bodies of some basidiomycetes. Prikladnaya khimiya i biotekhnologiya. 2018. V. 6 (3). P. 50–58 (in Russ.).
Mirjam A., Kabel I., Jurak E. et al. Occurrence and function of enzymes for lignocellulose degradation in commercial Agaricus bisporus cultivation. Appl. Microbiol. Biotechnol. 2017. V. 101 (11). P. 433–436.
Morin E., Kohler A., Baker A.R. et al. Genome sequence of the button mushroom Agaricus bisporus reveals mechanisms governing adaptation to a humic-rich ecological niche. PNAS USA. 2012. V. 109. P. 17501–17506. https://doi.org/10.1073/pnas.1206847109
Nelson M.I., Kelsey R.G., Shafizaden F. Anhancement enzymatic hydrolyses by simultaneous attrition of cellulosed substrates. Biotechnol. Bioeng. 1982. V. 25. P. 172–175.
Nelson M.I., Kelsey R.G., Shafizaden F. Announcement of enzymatic hydrolyses by simultaneous attrition of cellulosed substrates. Biotechnol. Bioeng. 1982. V. 24. P. 293–294.
Nitayavardhana S., Khanal S.K. Innovative biorefinery concept for sugar-based ethanol industries: production of protein-rich fungal biomass on vinasse as an aquaculture feed ingredient. Biores. Technol. 2010. V. 101. P. 9078–9085. https://doi.org/10.1016/J.Biortechology.2010.07.048
Patyshakuliyeva A., Post H., Zhou M. et al. Uncovering the abilities of Agaricus bisporus to degrade plant biomass throughout its life cycle. Envir. Microbiol. 2015. V. 17. P. 3098–3109. https://doi.org/10.1111/1462-2920.12967
Rabinovich M.L., Melnik M.S., Bolobova A.V. Wood-destroying fungi. Biokhimiya. 2002. V. 67 (8). P. 1026–1050 (in Russ.).
Rajarathnam S., Shashireka M.N., Bano Z. Biopotentialities of the basidiomacromycetes. Adv. Appl. Microbiol. 1992. V. 37. P. 233–361. https://doi.org/10.1016/S0065-2164(08)70256-9
Royse D.J. A global perspective on the high five: Agaricus, Pleurotus, Lentinula, Auricularia and Flammulina. Proceedings ICMBM. 2014. P. 8. http://wsmbmp.org/1/01.pdf.
Steven A., Cohen D.J. Amino acid analysis utilizing phenylisothiocyanata derivatives Analyt. Biochem. 1988. V. 17 (1). P. 1–19.
Ten Have R., Teunissen P.J. Oxidative mechanisms involved in lignin degradation by white-rot fungi. Chem. Rev. 2001. V. 101. P. 3397–3413. https://doi.org/10.1021/cr000115l
Wood D.A. Production, purification and properties of extracellular laccase of Agaricus bisporus. J. General Microbiol. 1980. V. 117. P. 327–328.
Ахмедова З.Р., Белецкая О.П. (Akhmedova, Beletskaya) Целлюлазы и лигниназы базидиомицетов // Прикладная бихимия и микробиология. 1993. № 6. С. 823–828.
Ахмедова З.Р., Кулаев И.С., Даврнов К.Д. (Akhmedova et al.) Ксиланазы и фенолоксидазы базидиомицетов // Микология и фитопатология. 1993. Т. 28, № 1. С. 49–53.
Ахмедова З.Р., Кулаев И.С., Давранов К. (Akhmedova et al.) Компонентный состав целлюлозолитических ферментов базидиомицетов // Микология и фитопатология. 1993. Т. 28. № 2. С. 39–44.
Бирюков В.В., Биттеева М.Б., Черкезов А.А. и др. (Вiryukov et al.) способ получения белковой биомассы базидиального гриба Pleurotus pulmonarius. Патент RU 2186851 с12р 21/00, c12n 1/14, c12n 1/14, c12r1: 645 от 10.08.2002.
Биттеева М.Б., Бирюков В.В., Черкезов А.А. и др. (Bitteeva et al.) Способ получения белковой биомассы гриба. Патент RU 2189395 С12Р 21/00, C12N 1/14, C12N 1/14, C12R1: 645 от 20.09.2002.
Калинин А.Г. (Kalinin) Обработка данных методами математической статистики: Чита, 2015. 106 с.
Колесникова В.Ф., Пцкиаладзе Д.А. (Kolesnikova, Ptskialadze) Способ получения белковой биомассы. Патент RU 2126835 С12Р 21/00, C12N 1/14, C12N 1/14, C12R1: 645 от 27.02.1999.
Методические указания по определению титруемой кислотности (утверждены Минздравом СССР 23.10.1991 № 122-5/72, рекомендованы Минторгом СССР 11.11.1991 № 1-40/3805) (Guidelines) М., 1991.
Минаков Л.В., Севодина К.Б., Щадринцева А.И. и др. (Minakov et al.) Сравнительная оценка аминокислотного и белкового состава мицелия и плодовых тел некоторых базидиомицетов // Прикладная химия и биотехнология. 2018. Т. 6. № 3. С. 50–58.
Определение массовой доли азота и расчет массовой доли сырого протеина. Метод Кьельдаля, переиздание, (2002 г.) с поправками (ИУС 4-2002), ИСО 5983: 1997. ГОСТ Р 51417-99. (Determination) М., 2002.
Рабинович М.Л., Мельник М.С., Болобова А.В. (Rabinovich et al.) Дереворазрушающие грибы // Биохимия. 2002. Т. 67. № 8. С. 1026–1050.
Фениксова Р.В., Тиунова Н.А., Родионова Н.А. и др. (Feniksova et al.) Методы современной биохимии. М.: Наука, 1975. 23 с.
Ферментные препараты, методы определения протеолитической активности, ГОСТ 20264.2-88. Госстандарт СССР. (Enzyme preparations) Москва, 1988.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


