Микология и фитопатология, 2022, T. 56, № 4, стр. 294-297
Вторичное поровое соединение между коллатеральными гифами у Epichloe sp.
О. В. Воронко 1, *, Е. Г. Попкова 1, **, Е. Ю. Благовещенская 1, ***
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: sht-oks@yandex.ru
** E-mail: kattyworld@yandex.ru
*** E-mail: kathryn@yandex.ru
Поступила в редакцию 14.04.2022
После доработки 30.04.2022
Принята к публикации 07.05.2022
- EDN: JJQBPU
- DOI: 10.31857/S0026364822040110
Аннотация
Для многих грибов характерно слияние вегетативных гиф путем формирования анастомозов, представляющих собой соединение двух ответвлений мицелия, срастающихся своими апикальными концами. При изучении эндофитного гриба (Epichloe sp.), выделенного из овсяницы луговой (Festuca pratensis), была выявлена возможность формирования вторичного порового контакта непосредственно между коллатеральными вегетативными гифами без образования анастомозных соединений. В месте обнаруженного порового контакта присутствовали типичные тельца Воронина, так же как и в местах септирования вегетативного мицелия. Подобное явление ранее не отмечалось для аскомицетов и, возможно, является характерной особенностью эпихлоидных эндофитов, т.к. именно для этой группы грибов показана способность к интеркалярному росту мицелия, что подразумевает лабильность структуры клеточной стенки.
Важной особенностью мицелиальных грибов является способность к формированию анастамозов между гифами, что позволяет поддерживать целостность и скоординированность роста и развития мицелия (Köhler, 1930; Glass, Fleißner, 2006). Исследования формирования анастомозов проводятся у представителей различных таксономических групп грибов (Glass et al., 2000; Horton et al., 2005; Craven et al., 2008; Chagnon, 2014), в том числе и у эндофитных грибов злаков (Shoji et al., 2015). Эндофиты злаков (эпихлоидные, или клавиципитальные эндофиты) представляют собой монофилетичную группу, входящую в семейство Clavicipitaceae (Hypocreales, Sordariomycetes, Ascomycota) и могут бессимптомно присутствовать в тканях многих видов растений семейства Poaceae (Zabalgogeazcoa et al., 2003; Iannone et al., 2011; Kirkby et al., 2011; Semmartin et al., 2015; Blagoveshchenskaya, Popkova, 2016; Song et al., 2016). Анастомозы между вегетативными гифами эндофитов – достаточно обычное явление (Shoji et al., 2015), благодаря которому именно на эндофитах впервые была показана возможность интеркалярного роста у аскомицетов (Christensen et al., 2008), ранее постулированная теоретически (Hesse et al., 2004). Но анастомозы предполагают предварительное формирование боковых ответвлений и последующее слияние двух апикальных концов этих боковых гиф (Glass, Fleißner, 2006). После слияния гиф рядом с местом контакта может формироваться септа (Hickey et al., 2002). Типичная септа сумчатых грибов представляет собой неполную перегородку с центральной порой, т.е. все “клетки” гриба представляют собой сообщающиеся компартменты. В непосредственной близости от поры располагаются т.н. тельца Воронина (Markham, Collinge, 1987), движение которых, как недавно было показано, может быть как пассивным, так и активным, т.е. регулироваться клеткой (Steinberg et al., 2017).
В настоящей статье мы хотим представить неожиданное наблюдение, сделанное при изучении ультраструктуры клеток эндофитных грибов, которое показывает, что, по крайней мере у эндофитов, возможно образование поровых контактов между коллатеральными гифами без формирования типичных анастомозов.
В работе использовали стерильный штамм эндофитного гриба 6FP13ST, выделенный из семян дикорастущей овсяницы луговой (Festuca pratensis) и идентифицированный по результатам анализа ITS как Epichloe sp. Мицелий выращивали на чашках Петри на среде КГА (картофельно-глюкозный агар) при температуре 24°С в темноте в течение 60 дней.
Фиксация мицелия проводилась последовательно глютаровым альдегидом и тетраоксидом осмия при комнатной температуре: 1 ч в 2.5%-м глютаровом альдегиде, разведенном в фосфатном буфере (рН 7.2), двукратное отмывание в фосфатном буфере по 10 мин, 1 ч постфиксация 1%-м OsO4, разведенном в буфере; двукратное отмывание в фосфатном буфере по 10 мин, двукратное отмывание в дистиллированной воде. Далее образец обезвоживали в восходящей серии спиртов (30, 50, 70 и 96%, по 10 мин каждая смена) и помещали в ацетон (две смены по 15 мин). Обезвоженные образцы перемещали в смесь ацетона и смолы эпон (1 : 1) и выдерживали трое суток при комнатной температуре. Далее образцы помещали в ячейки со смолой и катализатором сначала на 37°С (одни сутки) и далее на 60°С (двое суток) до полной полимеризации блоков. Ультратонкие срезы 80–100 нм толщ. на сеточках дополнительно контрастировали раствором цитрата свинца (по Рейнольдсу). Просмотр материала проводили на просвечивающем электронном микроскопе JEM-1011 (JEOL, 2005 г.) с цифровой фотокамерой GATAN ES500W, работающей под управлением программы Digital Micrograph фирмы GATAN.
Строение гиф исследуемого эндофитного гриба демонстрирует типичную для аскомицетов септу с центральной порой, рядом с которой расположены тельца Воронина (рис. 1, а). Причем в некоторых случаях видно, что одно из телец Воронина полностью перекрывает пору в септе (рис. 1, б). Подобного рода пробки, формируемые тельцами Воронина, обычно связывают с защитным механизмом, препятствующим вытеканию цитоплазмы при повреждении клетки гифы (Markham, Collinge, 1987; Steinberg et al., 2017), или же со старением мицелия (Stepanova, Sinitskaya, 2009). Тем не менее возможно также, что подобного рода пробки могут быть временным явлением, связанным с теми или иными физиологическими процессами, протекающими в грибной клетке. Во всяком случае, в пользу подобной возможности говорит тот факт, что в описываемом случае ни одна из клеток гифы не имеет видимых признаков повреждения.
Рис. 1.
Поровые контакты между клетками Epichloe sp. (штамм 6FP13ST): а – фрагмент гифы; б – септа с центральной порой, закрытой тельцем Воронина; в – две коллатеральные гифы с поровым контактом; г – схема порового контакта между коллатеральными гифами; 1 – тельца Воронина; 2 – митохондрии; 3 – поздняя эндосома; 4 – активный эндоцитоз (инвагинация плазмалеммы); 5 – вакуоли; 6 – ядро; 7 – липидные капли; 8 – микротрубочки.
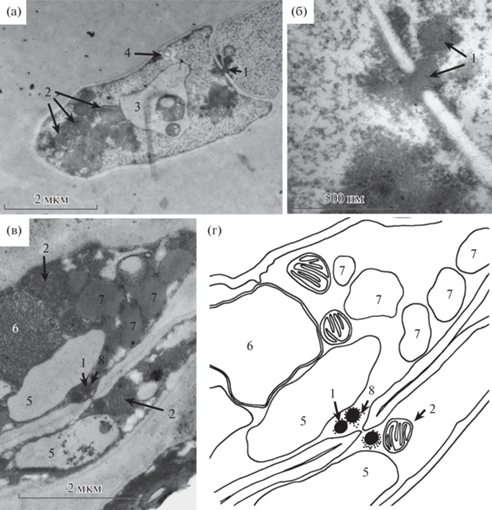
Однако, кроме обычных поровых контактов между клетками одной гифы, было обнаружено поровое соединение между коллатерально расположенными гифами (рис. 1, в). На фотографии видны две гифы разного диаметра, что достаточно характерно для штаммов эндофитных грибов при росте в культуре. Несмотря на то что их клеточные стенки непосредственно контактируют, здесь мы не видим формирования анастомоза, представляющего собой результат соединения апикальных участков гиф. Для эндофитов характерно формирование тяжей, включающих от трех до десяти и более гиф, часто соединенных внеклеточным слизистым материалом, так что подобное расположение нитей мицелия достаточно обычно. При этом срез прошел через участок, на котором видно резкое соединение двух клеточных стенок в одну, вплоть до образования поры. То, что это именно поровый контакт, подтверждается наличием трех телец Воронина в этом месте. Таким образом, параллельно расположенные гифы имеют единое цитоплазматическое пространство, что изображено на схеме (рис. 1, г). Возможно, что подобные вторичные поровые контакты могут образовываться и у других грибов, особенно у видов, формирующих мицелиальные тяжи. Но также возможно, что подобного рода вторичное поровое соединение характерно именно для эндофитных грибов, так как эндофиты пока что являются единственной группой, для которой подтверждена возможность интеркалярного роста гиф (Christensen et al., 2008), в противоположность строго апикальному росту, характерному для прочих мицелиальных грибов (Tegelaar et al., 2020). Поскольку способность к интеркалярному росту подразумевает способность к временному изменению структуры уже сформированной клеточной стенки, то можно предположить, что у грибов с подобной способностью при плотном контакте двух гиф будет возможно формирование поры между ними.
Таким образом, нами было обнаружено, что аскомицеты способны формировать поровый контакт между рядом расположенными гифами вегетативного мицелия без образования специальных анастомозов. Данное явление является новым для мицелиальных грибов и может быть характерной особенностью узкой таксономической группы эпихлоидных эндофитов. С другой стороны, возможно, что это явление встречается у гораздо большего числа таксонов, и не было описано ранее из-за того, что изучение строения грибных гиф является сложным и трудоемким процессом, занимающим длительное время, а прохождение среза через подобный поровый контакт, даже если он присутствует в образце, имеет крайне низкую вероятность.
Работа выполнена в рамках темы государственного задания МГУ №121032300081-7.
Список литературы
Blagoveshchenskaya E.Yu., Popkova E.G. New findings of endophytic fungi: brief note. Moscow Univ. Biol. Sci. Bull. 2016. V. 71 (2). P. 80–81. https://doi.org/10.3103/S0096392516020024
Chagnon P.L. Ecological and evolutionary implications of hyphal anastomosis in arbuscular mycorrhizal fungi. FEMS Microbiol. Ecol. 2014. V. 88 (3). P. 437–444. https://doi.org/10.1111/1574-6941.12321
Christensen M.J., Bennett R.J., Ansari H.A. et al. Epichloë endophytes grow by intercalary hyphal extension in elongating grass leaves. Fungal Genet. Biol. 2008. V. 45 (2). P. 84–93. https://doi.org/10.1016/j.fgb.2007.07.013
Craven K.D., Vélëz H., Cho Y. et al. Anastomosis is required for virulence of the fungal necrotroph Alternaria brassicicola. Eukaryot. Cell. 2008. V. 7 (4). P. 675–683. https://doi.org/10.1128/EC.00423-07
Glass N.L., Fleißner A. Re-wiring the network: understanding the mechanism and function of hyphal fusion in filamentous fungi. In: U. Kües, R. Fischer (eds). The Mycota I. Springer-Verlag, Berlin, Heidelberg, 2006, pp. 123–139. https://doi.org/10.1007/3-540-28135-5_7
Glass N.L., Jacobson D.J., Shiu P.K.T. The genetics of hyphal fusion and vegetative incompatibility in filamentous ascomycete fungi. Annu. Rev. Genet. 2000. V. 34. P. 165–186. https://doi.org/10.1146/annurev.genet.34.1.165
Hesse U., Christensen M.J., Schardl C.L. Tissue specificity of endophyte development in Epichloë/Neotyphodium symbioses with grasses. In: Proc. XI Molecular plant-microbe interactions interaction congr., vol. 4, 2004, pp. 448–452.
Hickey P.C., Jacobson D.J., Read N.D. et al. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genet. Biol. 2002. V. 37. P. 109–119. https://doi.org/10.1016/S1087-1845(02)00035-X
Horton J.S., Bakkeren G., Klosterman S.J. et al. Genetics of morphogenesis in Basidiomycetes. Appl. Mycol. Biotech. 2005. V. 5. P. 353–422. https://doi.org/10.1016/S1874-5334(05)80017-6
Iannone L.J., White J.F., Jr., Giussani L.M. et al. Diversity and distribution of Neotyphodium-infected grasses in Argentina. Mycol. Progress. 2011. V. 10. P. 9–19. https://doi.org/10.1007/s11557-010-0669-2
Kirkby K.A., Pratley J.E., Hume D.E. et al. Incidence of endophyte Neotyphodium occultans in Lolium rigidum from Australia. Weed Res. 2011. V. 51. P. 261–272. https://doi.org/10.1111/j.1365-3180.2011.00846.x
Köhler E. Zur Kenntnis der vegetativen Anastomosen der Pilze. Planta. 1930. V. 10. P. 495–522. https://doi.org/10.1007/BF01911420
Markham P., Collinge A.J. Woronin bodies of filamentous fungi. FEMS Microbiol. Lett. 1987. V. 46. P. 1–11. https://doi.org/10.1016/0378-1097(87)90182-0
Semmartin M., Omacini M., Gundel P.E. et al. Broad-scale variation of fungal-endophyte incidence in temperate grasses. J. Ecol. 2015. V. 103. P. 184–190. https://doi.org/10.1111/1365-2745.12343
Shoji J., Charlton N.D., Yi M. et al. Vegetative hyphal fusion and subsequent nuclear behavior in Epichloë grass endophytes. PLOS One. 2015. V. 10 (4). e0121875. https://doi.org/10.1371/journal.pone.0121875
Song H., Nan Z., Song Q. et al. Advances in research on Epichloë endophytes in chinese native grasses. Front. Microbiol. 2016. V. 7: 1399. https://doi.org/10.3389/fmicb.2016.01399
Steinberg G., Harmer N.J., Schuster M. et al. Woronin body-based sealing of septal pores. Fungal Genet. Biol. 2017. V. 109. P. 53–55. https://doi.org/10.1016/j.fgb.2017.10.006
Stepanova A.A., Sinitskaya I.A. Ultrastructural aspects of cells senescence of some Aspergillus spp. Problemy me-ditsinskoy mikologii. 2009. V. 11. P. 24–29 (in Russ).
Tegelaar M., van der Lans G.P.A., Wösten H.A.B. Apical but not sub-apical hyphal compartments are self-sustaining in growth. Antonie van Leeuwenhoek. 2020. V. 113. P. 697–706. https://doi.org/10.1007/s10482-020-01383-9
Zabalgogeazcoa I., Vázquez de Aldana B.R., García Ciudad A. et al. Fungal endophytes in grasses from semi-arid permanent grasslands of western Spain. Grass Forage Sci. 2003. V. 58. P. 94–97. https://doi.org/10.1046/j.1365-2494.2003.00352.x
Степанова А.А., Синицкая И.А. (Stepanova, Sinitskaya) Ультраструктурные аспекты старения клеток некоторых видов рода Aspergillus // Проблемы медицинской микологии. 2009. Т. 11. № 4. С. 24–29.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


