Микология и фитопатология, 2022, T. 56, № 6, стр. 441-447
Видовой состав возбудителей септориозов пшеницы в европейской части России и идентификация генов-эффекторов SNTOXA, SNTOX1 и SNTOX3
Ю. В. Зеленева 1, *, И. Б. Аблова 2, **, В. П. Судникова 3, ***, Л. М. Мохова 2, ****, Э. А. Конькова 4, *****
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
2 Национальный центр зерна им. П.П. Лукьяненко
350012 Краснодар, Россия
3 Среднерусский филиал Федерального научного центра им. И.В. Мичурина
392553 Тамбов, Россия
4 ФАНЦ Юго-Востока
410010 Саратов, Россия
* E-mail: zelenewa@mail.ru
** E-mail: ablova@mail.ru
*** E-mail: sudnikowa@mail.ru
**** E-mail: mohovalubov@mail.ru
***** E-mail: baukenowaea@mail.ru
Поступила в редакцию 15.03.2022
После доработки 05.06.2022
Принята к публикации 07.06.2022
- EDN: AEZUGR
- DOI: 10.31857/S0026364822060113
Аннотация
Проводимый ежегодный мониторинг показывает, что в последние годы во многих регионах России в патогенном комплексе септориозных пятнистостей пшеницы доминирует вид Zymoseptoria tritici. В статье представлены результаты изучения видового состава возбудителей септориоза зерновых культур в 2021 г. Инфекционный материал был собран на озимой и яровой пшенице из Тамбовской (два района), Ленинградской (три района), Саратовской (один район), Липецкой (один район), Воронежской (один район) областей, Республик Дагестана и Калмыкии, а также Краснодарского края (четыре района). Всего изучено 120 сортообразцов пшеницы. По нашим наблюдениям, Z. tritici образует некротические пятна с пикнидами на озимой пшенице, начиная с фазы всходов (26–29 по шкале Цадокс). Встречаемость вида Z. tritici на сортах озимой пшеницы из изученных регионов и областей изменялась от 100 до 64%, на сортах яровой пшеницы – от 100 до 57.9%. Виды Parastagonospora nodorum и P. avenae f.sp. triticea образуют некротические пятна с пикнидами на листьях, побегах, колосе, как правило, начиная с фазы колошения (51 по шкале Цадокс). Среди изученных сортообразцов вид P. nodorum занимал второе место в патогенном комплексе, уступая виду Zymoseptoria tritici. C использованием молекулярных маркеров проведена идентификация генов, кодирующих NEs у 145 моноконидиальных изолятов Parastagonospora nodorum и 122 P. avenae f.sp. triticea, полученных из образцов 2021 г. У моноконидиальных изолятов отмечались как единичные гены SnTox1, SnTox3 и SnToxА, так и сочетания по два гена в одном генотипе. По наличию характерного продукта амплификации можно предположить наличие трех NEs генов у моноконидиальных изолятов P. nodorum Ленинградской и Тамбовской обл. Присутствие генов SnTox1, SnTox3 можно предположить в генотипе изолятов P. nodorum из Саратовской обл. и изолятов P. avenae f.sp. triticea из Тамбовской и Воронежской областей. Кроме того, отмечено наличие продукта амплификации характерного для гена SnTox3 среди образцов P. avenae f.sp. triticea из Краснодарского края.
ВВЕДЕНИЕ
Септориозы – опасные заболевания зерновых культур. Они характеризуются образованием некротических пятен на листьях, поражением колоса и самой зерновки. В годы эпифитотий, вызванных септориозами в разных регионах России, потери урожая могут превышать 40% (Sanin et al., 2012, 2015).
В качестве возбудителей выступают несколько видов грибов, относящихся к разным родам и семействам. Самый распространенный вид – Zymoseptoria tritici (Desm.) Quaedvl. et Crous (Myco-sphaerellaceae), возбудитель септориоза листьев пшеницы, тритикале, ячменя, ржи.
Вид Parastagonospora nodorum (Berk.) Quaedvl., Verkley et Crous паразитирует на листьях, стеблях, колосовых чешуях и остях пшеницы (Shah et al., 1995; Pakholkova, 2003; Bennett et al., 2007; Sanin et al., 2018; Zeleneva et al., 2021). Также он нередко поражает семена. Зерновка становится щуплой, неполноценной, снижается ее скорость прорастания. При сильном заражении происходит поражение и отмирание колеоптилей.
Еще один вид рода Parastagonospora представлен двумя формами в зависимости от специализации к хозяину: P. avenae (A.B. Frank) Quaedvl., Verkley et Crous f.sp. triticea (пшеничная форма) и P. avenae (A.B. Frank) Quaedvl., Verkley et Crous f. sp. avenaria (овсяная форма).
P. avenae f.sp. triticea, наряду с P. nodorum, является одним из наиболее вредоносных патогенов пшеницы во всем мире (McDonald et al., 2012).
На территории Краснодарского края пшеницу также поражает вид Septoria triticicola Lobik (Mokhova, 2008). Данный патоген встречается реже и его распространение, экологические особенности и вредоносность почти не изучены.
Грибы рода Parastagonospora известны своей способностью синтезировать некротрофные эффекторы (necrotrophic effectors – NEs), в том числе специфичные к хозяину токсины (host selective toxins – HSTs) преимущественно белковой природы. Эти эффекторы действуют как факторы вирулентности и вызывают некроз на листьях сортообразцов пшеницы, имеющих в своем геноме комплементарные гены восприимчивости (= чувствительности) (Friesen et al., 2007).
У вида P. nodorum идентифицировано восемь генов, кодирующих NEs, комплементарных девяти генам чувствительности пшеницы (Snn): SnToxA/Tsn1, SnTox1/Snn1, SnTox2/Snn2, SnTox3/Snn3-B1/Snn3-D1, SnTox4/Snn4, SnTox5/Snn5, SnTox6/Snn6 и SnTox7/Snn7 (Duba et al., 2018). В настоящий момент клонированы только три эффекторных гена P. nodorum: SnToxA, SnTox1 и SnTox3 (Hafez et al., 2020).
Ген SnToxA кодирует белок, идентичный белку, кодируемому геном PtrToxA, который первоначально был клонирован у Pyrenophora tritici-repentis (Ballance et al., 1996). Этот белковый токсин вызывает обширный некроз ассимиляционной ткани образцов пшениц, несущих ген восприимчивости Tsn1 (Faris et al., 2013). ToxA-гомологи были обнаружены и у других патогенных грибов растений, включая вид P. avenae (Lu et al., 2015; McDonald et al., 2018; Navathe et al., 2020).
SnTox1 был первым идентифицированным геном, кодирующим селективный токсин у Parastagonospora nodorum. Этот токсин вызывает некроз тканей у восприимчивых сортов пшеницы, несущих ген чувствительности Snn1 (Liu et al., 2004). Данный ген также характерен и для вида P. avenae (McDonald et al., 2013).
Токсин, кодируемый геном SnTox3 может взаимодействовать с продуктами двух гомологичных генов (Snn3-B1 и Snn3-D1) пшеницы, расположенными на хромосомах 5B и 5D соответственно (Zhang et al., 2011). В литературе отмечается, что взаимодействие продуктов генов SnTox3/Snn3-D1 может вызывать более тяжелый некроз растительной ткани (Zhang et al., 2011). Показано, что ген Snn3-D1 так же присутствует в геноме P. avenae (Hafez et al., 2020).
Представляло интерес изучить видовой состав возбудителей септориоза пшеницы в различных регионах России. А также оценить изоляты рода Parastagonospora из российских популяций на наличие/отсутствие у них генов SnTox1, SnTox3 и SnToxA с помощью связанных с ними молекулярных маркеров.
МАТЕРИАЛЫ И МЕТОДЫ
Всего в 2021 г. было собрано и проанализировано 120 инфекционных образцов озимой и яровой пшеницы с симптомами септориозов из 5 областей Европейской части России, из Краснодарского края и из Республик Дагестан и Калмыкии (табл. 1). Под инфекционным образцом понимали листья, стебли, колосья или перезимовавшие части растений с хорошо выраженными симптомами септориоза, собранные на обследуемом поле по его диагонали через равные расстояния в определенное время (например, во время учета). Растения очищали от почвы, просматривали под бинокулярной лупой, отбирали участки с обильным спороношением (пикнидами) и регистрировали в журнале. Собранный материал гербаризировали, складывали в пакеты, снабжали этикеткой с указанием места, даты сбора, фазы развития, сорта и сохраняли в холодильнике для последующего анализа в лабораторных условиях (Zeleneva et al., 2021). Количество инфицированных листьев и колосьев, собранных с поля, было не менее 30 при хорошо выраженных признаках болезни и не менее 50 при затрудненной идентификации.
Таблица 1.
Происхождение использованных в работе образцов зерновых культур
| Происхождение | Всего образцов | Озимая пшеница | Яровая пшеница | |
|---|---|---|---|---|
| Тамбовская обл. | Тамбовский р-н | 55 | 29 | 26 |
| Чакинский р-н | 9 | 4 | 5 | |
| Ленинградская обл. | Гатчинский р-н | 11 | 11 | 0 |
| Ломоносовский р-н | 4 | 4 | 0 | |
| Волосовский р-н | 2 | 2 | 0 | |
| Краснодарский край | Тихорецкий р-н | 5 | 1 | 4 |
| Северский р-н | 4 | 2 | 2 | |
| Новопокровский р-н | 3 | 1 | 2 | |
| Выселковский р-н | 2 | 2 | 0 | |
| Республика Дагестан | Дербентский р-н | 6 | 4 | 2 |
| Саратовская обл. | г. Саратов | 4 | 3 | 1 |
| Липецкая обл. | Липецкий р-н | 6 | 5 | 1 |
| Республика Калмыкия | 5 | 5 | 0 | |
| Воронежская обл. | Каменский р-н | 4 | 4 | 0 |
| Итого | 120 | 77 | 43 | |
Для определения видов грибов использовали микроскопический анализ фрагментов пораженной ткани. Видовую принадлежность определяли по форме и размеру спор, вышедших из пикнид в капле воды (Pyzhikova et al., 1989). Микроскопическая идентификация видов септориоза была подтверждена методом секвенирования с использованием оборудования ЦКП “Геномные технологии, протеомика и клеточная биология” ФГБНУ ВНИИСХМ.
После идентификации видов септориоза проводили выделение моноконидиальных изолятов в чистую культуру на агаризованную среду картофельно-глюкозного состава (КГА) (Pyzhikova et al., 1989).
Моноспоровые изоляты гриба выделяли методом “штрихов”. Осматривая гербарный материал, вырезали кусочки ткани с типичными поражениями. Отобранные кусочки промывали водопроводной водой, затем многократно в стерильной воде и подсушивали фильтровальной бумагой. Поверхностно стерилизовали путем погружения в 50%-й этанол на 20 с, после чего промывали в стерильной воде. С помощью микроскопа или лупы на пораженной ткани находили участок с пикнидами, препаровальной иглой извлекали одну пикниду, помещали на предметное стекло в каплю стерильной воды и через некоторое время, после того как из нее выделялись споры, полученную споровую суспензию с помощью бактериологической петли высевали штрихом на питательную среду. Через 7–8 сут единичные колонии, произошедшие из одной конидии, пересевали в отдельные чашки Петри и помещали в термостат при 20–24°C (Pyzhikova et al., 1989).
Геномная ДНК грибов Parastagonospora spp. была выделена из чистой культуры моноконидиальных изолятов стандартным методом СТАВ/хлороформ (Doyle, Doyle, 1990). Изоляты выращивали в чашках Петри на КГА в течение 7–10 cут в термостате при 21–22°C.
Амплификацию геномной ДНК проводили в 25 мкл реакционной смеси (67 мМ Трис-HCl рН 8.8; 3 мМ MgCl2; по 200 мкМ каждого dNTP; 10 рМ/мл праймера; 25 (от 2 до 50) нг геномной ДНК и 0.5 ед. Taq-полимеразы). ПЦР проводили с использованием праймеров, представленных в табл. 2.
Таблица 2.
Список праймеров, использованных для выявления маркеров генов SnTox1, SnTox3 и SnToxA
| Название праймера | Последовательность 5'–3' | Ссылка на литературный источник | Размер диагностического фрагмента, п.н. |
|---|---|---|---|
| SnTox1-c | F: ATGAAGCTTACTATGGTCTTGT | Gao et al. (2015) | 500 |
| R: TGTGGCAGCTAACTAGCACA | |||
| SnTox3-c | F: CTCGAACCACGTGGACCCGGA | “ ” | 600 |
| R: CTCCCCTCGTGGGATTGCCCCATATG | |||
| TA51/52 | F: GCGTTCTATCCTCGTACTTC | Andrie et al. (2007) | 591 |
| R: GCATTCTCCAATTTTCACG |
Амплифицированные фрагменты разделяли методом электрофореза в 2%-м агарозном геле, в 1× ТВЕ буфере (pH 8.2), гель окрашивали бромистым этидием. Для оценки размера фрагментов использовали ДНК маркер Step50 plus (Биолабмикс).
Скрининг изолятов на присутствие генов SnTox1 и SnTox3 проводили по методике Gao et al. (2015) с использованием ПЦР с парами праймеров SnTox1-cF/SnTox1-cR и SnTox3-cF/SnTox3-cR соответственно. Условия ПЦР: 94°С в течение 4 мин, затем 30 циклов: 94°С в течение 30 с, 60°С – 30 с, 72°С – 3 мин, последний этап элонгации – 10 мин при 72°С.
Ген SnToxA детектировали с помощью ПЦР с использованием праймеров TA51F и TA52R (Andrie et al., 2007). Условия ПЦР: 94°С в течение 3 мин, затем 30 циклов: 94°С в течение 30 с, 58°С – 30 с, 72°С – 30 с; последний этап элонгации – 7 мин при 72°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На изученных сортообразцах пшеницы доминировал вид Zymoseptoria tritici. Данный вид образует некротические пятна с пикнидами на озимой пшенице с фазы всходов (26–29 по шкале Цадокс). В дальнейшем идет распространение гриба на верхние листья озимых сортов пшеницы и на всходы яровых. Встречаемость вида Z. tritici на озимой пшенице достигала 100% в Республиках Дагестан, Калмыкия; на сортах яровой пшеницы – из Республики Дагестан и Липецкой обл. (табл. 3).
Таблица 3.
Распространенность видов грибов – возбудителей септориоза озимой пшеницы, %
| Происхождение | Zymoseptoria tritici | Parastagonospora nodorum | Parastagonospora. avenae f.sp. triticea |
|---|---|---|---|
| Озимая пшеница | |||
| Воронежская обл. | 60 | 20 | 20 |
| Краснодарский край | 66.7 | 33.3 | 0 |
| Ленинградская обл. | 64 | 24 | 12 |
| Липецкая обл. | 83.3 | 16.7 | 0 |
| Республика Дагестан | 100 | 0 | 0 |
| Республика Калмыкия | 100 | 0 | 0 |
| Саратовская обл. | 75 | 25 | 0 |
| Тамбовская обл. | 84.6 | 2.6 | 12.8 |
| Среднее значение | 79.2 ± 5.49 | 15.2 ± 4.53 | 5.6 ± 2.86 |
| Яровая пшеница | |||
| Краснодарский край | 70 | 20 | 10 |
| Липецкая обл. | 100 | 0 | 0 |
| Республика Дагестан | 100 | 0 | 0 |
| Саратовская обл. | 70 | 30 | 0 |
| Тамбовская обл. | 57.9 | 0 | 42.1 |
| Среднее значение | 79.58 ± 8.62 | 10 ± 6.32 | 10.42 ± 8.15 |
По нашим наблюдениям, виды Parastagonospora nodorum и P. avenae f.sp. triticea образуют некротические пятна с пикнидами на листьях, побегах, колосе, как правило, начиная с фазы колошения (51 по шкале Цадокс). На изученных образцах данные виды встречались значительно реже, чем вид Zymoseptoria tritici. Так, вид Parastagonospora nodorum не был отмечен на озимых сортообразцах из Республик Дагестан и Калмыкии; на яровых – из Республики Дагестан, Липецкой и Тамбовской областей. Вид P. avenae f.sp. triticea не зарегистрирован на инфекционном материале озимых сортов из Краснодарского края, Республик Дагестан и Калмыкии, Липецкой и Саратовской областей. Среди яровых он не отмечен среди образцов из Республики Дагестан, Липецкой и Саратовской областей.
В среднем, вид P. nodorum имел второе место в патогенном комплексе септориозных пятнистостей пшеницы, уступая виду Zymoseptoria tritici (табл. 3).
Проведено выделение возбудителей септориоза в чистую культуру на КГА. В результате с 67 зарегистрированных сортообразцов пшеницы с признаками септориозной инфекции выделены моноконидиальные изоляты видов грибов (табл. 4). Изучение морфолого-культуральных свойств подтвердило видовую идентификацию фитопатогенов. С каждого пораженного сортообразца было получено не менее 30 моноконидиальных изолятов гриба. Изоляты видов Parastagonospora nodorum и P. avenae f.sp. triticea изучены на присутствие генов SnToxА, SnTox1 и SnTox3.
Таблица 4.
Происхождение и количество проанализированных моноконидиальных изолятов септориозов пшеницы
| Место сбора инфекционного образца | Количество сортообразцов пшеницы с идентифицированным видом септориоза | Количество моноконидиальных изолятов | ||
|---|---|---|---|---|
| Zymoseptoria tritici | Parastagonospora nodorum | Parastagonospora avenae f.sp. triticea | ||
| Тамбовская обл. | 36 | 600 | 90 | 390 |
| Ленинградская обл. | 17 | 480 | 51 | 30 |
| Краснодарский край | 14 | 360 | 30 | 60 |
| Липецкая обл. | 6 | 180 | 0 | 0 |
| Саратовская обл. | 4 | 90 | 30 | 60 |
| Республика Калмыкия | 5 | 150 | 0 | 0 |
| Воронежская обл. | 4 | 90 | 0 | 30 |
| Республика Дагестан | 3 | 90 | 0 | 0 |
| Итого | 89 | 2040 | 201 | 570 |
В результате молекулярного скрининга у изучаемого материала (267 ДНК-проб, полученных от 145 моноконидиальных изолятов вида P. nodorum и 122 – P. avenae) выявлены как единичные гены, кодирующие NEs, так и их сочетания в одном генотипе (рис. 1, 2, табл. 5).
Рис. 1.
Продукты амплификации с праймерами SnTox1-cF/SnTox1-cR, специфичными для гена SnTox 1 (номера изолятов слева: 2–21-P.n.–1; 2–21-P.n.–2; 2–21–P.n.–3; 32–21–P.n.; 108–21–P.n.; 67–21–P.av.t.; 74–21–P.av.t.; 77–21–P.av.t.; 78–21–P.av.t.; 84–21–P.av.t.; 101–21–P.av.t.). Последняя дорожка – негативный контроль без ДНК.
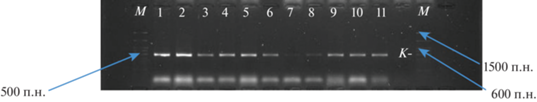
Рис. 2.
Продукты амплификации с праймерами TA51 F/TA52 R, специфичными для гена SnToxА (номера изолятов слева: 2–21–P.n.–1; 2–21–P.n.–2; 2–21–P.n.–3; 29–21–P.n.; 82–21–P.av.t). Продукты амплификации ПЦР с праймерами SnTox3-cF/SnTox3-cR, специфичными для гена SnTox3 (номера изолятов: 26–21–P.n.; 29–21–P.n.; 32–21–P.n.; 108–21–P.n.; 126–21–P.n.; 155–21–P.n. 82–21–P.av.t.).
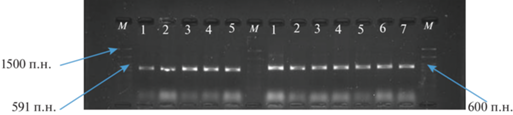
Таблица 5.
Происхождение моноконидиальных изолятов Parastagonospora spp. из коллекции лаборатории микологии и фитопатологии ВИЗР с идентифицированными генами SnToxА, SnTox1 и SnTox3
| Вид гриба | Происхождение | Общее число протестированных методом ПЦР изолятов гриба | Встречаемость генов, % | ||
|---|---|---|---|---|---|
| SnToxА | SnTox1 | SnTox3 | |||
| Parastagonospora nodorum | Ленинградская обл. | 85 | 23.5 | 17.6 | 11.8 |
| Саратовская обл. | 30 | 0 | 100 | 100 | |
| Тамбовская обл. | 30 | 33.3 | 33.3 | 33.3 | |
| P. avenae f.sp. triticea | Тамбовская обл. | 52 | 0 | 38.5 | 7.7 |
| Воронежская обл. | 30 | 0 | 100 | 0 | |
| Краснодарский край | 40 | 0 | 0 | 50 | |
Ген SnTox1 был выявлен среди изолятов, полученных с 11 сортов пшеницы. Наличие гена отмечено у изолятов P. nodorum с сортообразцов озимой пшеницы (трех – из Ленинградской обл., одного – из Саратовской обл., одного – из Тамбовской обл.). Наличие гена SnTox1 отмечено у моноконидиальных изолятов P. avenae f.sp. triticea, выделенных с инфекционного материала озимой мягкой, яровой мягкой и твердой пшеницы (пяти сортообразцов из Тамбовской, одного – из Воронежской областей) (рис. 1, табл. 5).
В результате молекулярного скрининга ген SnToxА выявлен среди моноконидиальных изолятов вида P. nodorum, полученных из листьев сорта озимой мягкой пшеницы Скипетр из Ленинградской области и изолятов вида P. avenae f.sp. triticea из листьев сорта яровой мягкой пшеницы Воронежская 20 из Тамбовской обл. (рис. 2, табл. 5).
Наличие гена SnTox3 выявлено среди изолятов вида P. nodorum, полученных из растительных образцов озимой мягкой пшеницы: двух – из Ленинградской и Тамбовской областей, одного – из Саратовской обл. и одного – из образцов яровой пшеницы, собранной в Краснодарском крае. Присутствие гена SnTox3 отмечено у изолятов, полученных с озимой мягкой пшеницы сорта Проза из Тамбовской обл. (рис. 2, табл. 5).
ЗАКЛЮЧЕНИЕ
Таким образом, с использованием молекулярных маркеров проведена идентификация генов, кодирующих NEs у двух видов Parastagonospora spp. различного географического происхождения. На основании изучения видового состава септориозного комплекса в 2021 г. показано, что в условиях года вид Zymoseptoria tritici имел наибольшую встречаемость в Тамбовской, Ленинградской, Саратовской, Липецкой, Воронежской областях, в Республиках Дагестан и Калмыкия, а также в Краснодарском крае. Виды Parastagonospora nodorum и P. avenae f.sp. triticea фиксировались, но имели меньшую частоту. Эту информацию необходимо учитывать при составлении селекционных программ и защитных мероприятий сельскохозяйственных растений.
Работа выполнена при поддержке Российского научного фонда, проект № 19-76-30005.
Список литературы
Andrie R.M., Pandelova I., Ciuffetti L.M. A combination of phenotypic and genotypic characterization strengthens Pyrenophora tritici-repentis race identification. Phytopathology. 2007. V. 97. P. 694–701. https://doi.org/10.1094/PHYTO-97-6-0694
Ballance G., Lamari L., Kowatsch R. et al. Cloning, expression and occurrence of the gene encoding the Ptr necrosis toxin from Pyrenophora tritici-repentis. Mol. Plant Pathol. 1996. P. 1209. http://wwvv.bspp.org.uk/mppol/1996/1209ballance
Bennett R.S., Milgroom M.G., Sainudiin R. et al. Relative contribution of seed-transmitted inoculum to foliar populations of Phaeosphaeria nodorum. Phytopathology. 2007. V. 97. P. 584–591. https://doi.org/10.1094/PHYTO-97-5-0584
Doyle J.J., Doyle J.L. Isolation of plant DNA from fresh tissue. Focus. 1990. V. 12. P. 13–15.
Duba A., Goriewa-Duba K., Wachowska U. A review of the interactions between wheat and wheat pathogens: Zymoseptoria tritici, Fusarium spp. and Parastagonospora nodorum. Int. J. Mol. Sci. 2018. V. 19. P. 1138. https://doi.org/10.3390/ijms19041138
Faris J.D., Zhang Z., Lu H. et al. A unique wheat disease resistance-like gene governs effector-triggered susceptibility to necrotrophic pathogens. Proc. Natl. Acad Sci. 2010. V. 107. P. 13544–13549. https://doi.org/10.1073/pnas.1004090107
Friesen T.L., Meinhardt S.W., Faris J.D. The Stagonospora nodorum – wheat pathosystem involves multiple proteinaceous host-selective toxins and corresponding host sensitivity genes that interact in an inverse gene-for-gene manner. Plant J. 2007. V. 51. P. 681–692. https://doi.org/10.1111/j.1365-313X.2007.03166.x
Gao Y., Faris J.D., Liu Z. et al. Identification and characterization of the SnTox6-Snn6 interaction in the Parastagonospora nodorum–wheat pathosystem. Mol. Plant Microbe Interact. 2015. V. 28. P. 615–625. https://doi.org/10.1094/MPMI-12-14-0396-R
Hafez M., Gourlie R., Despins T. et al. Parastagonospora nodorum and Related Species in Western Canada: Genetic Variability and Effector Genes. Phytopathology. 2020. V. 110. P. 1946–1958 https://doi.org/10.1094/PHYTO-05-20-0207-R
Liu Z., Faris J., Meinhardt S. et al. Genetic and physical mapping of a gene conditioning sensitivity in wheat to a partially purified host-selective toxin produced by Stagonospora nodorum. Phytopathology. 2004. V. 94. P. 1056–1060. https://doi.org/10.1094/PHYTO.2004.94.10.1056
Lu S., Turgeon B.G., Edwards M.C. A ToxA-like protein from Cochliobolus heterostrophus induces light-dependent leaf necrosis and acts as a virulence factor with host selectivity on maize. Fungal Genet. Biol. 2015. V. 81. P. 12–24. https://doi.org/10.1016/j.fgb.2015.05.013
McDonald M.C., Razavi M., Friesen T.L. et al. Phylogenetic and population genetic analyses of Phaeosphaeria nodorum and its close relatives indicate cryptic species and an origin in the Fertile Crescent. Fungal Genet. Biol. 2012. V. 49. P. 882–895. https://doi.org/10.1016/j.fgb.2012.08.001
McDonald M.C., Oliver R.P., Friesen T.L. et al. Global diversity and distribution of three necrotrophic effectors in Phaeosphaeria nodorum and related species. New Phytol. 2013. V. 199. P. 241–251. https://doi.org/10.1111/nph.12257
McDonald M.C., Ahren D., Simpfendorfer S. et al. The discovery of the virulence gene ToxA in the wheat and barley pathogen Bipolaris sorokiniana. Mol. Plant Pathol. 2018. V. 19. P. 432–439. https://doi.org/10.1111/mpp.12535
Mokhova L.M. Selection-immunological aspects of wheat and triticale resistance to Septoria triitici Rob. et Desm. Cand. Agric. Thesis. Krasnodar, 2008 (in Russ.).
Navathe S., Yadav P.S., Chand R. et al. ToxA – Tsn1 interaction for spot blotch susceptibility in Indian wheat: an example of inverse gene-for-gene relationship. Plant Dis. 2020. V. 104. P. 71–81. https://doi.org/10.1094/PDIS-05-19-1066-RE
Pakholkova E.V. Septoriosis of grain cultures in various regions of Russian Federation. Cand. Biol. Thesis. Bolshie Vyazemy, 2003 (in Russ.).
Pyzhikova G.V., Sanina A.A., Suprun L.M. et al. Metods of estimation of selection material and wheat varieties to the septoriosis. Moscow, 1989 (in Russ.).
Sanin S.S., Korneva L.G., Zhokhova T.P. et al. Determination of yield losses of wheat grain from leaves and ears septoriosis. Zashchita i karantin rasteniy. 2012. № 8. P. 47–49 (in Russ.).
Sanin S.S., Korneva L.G., Polyakova T.M. Forecast of the risk of development of epiphytoties of wheat leaf and ear septoriosis. Zashchita i karantin rasteniy. 2015. № 3. P. 33–36 (in Russ.).
Sanin S.S., Ibragimov T.Z., Strizhekozin Yu.A. Method for calculating wheat yield losses due to diseases. Zashchita i karantin rasteniy. 2018. № 1. P. 11–15 (in Russ.).
Shah D., Bergstrom G., Ueng P. Initiation of Septoria nodorum blotch epidemics in winter wheat by seedborne Stagonospora nodorum. Phytopathology. 1995. V. 85. P. 452–457.
Zeleneva Yu.V., Sudnikova V.P., Plahotnik V.V. Methodology for the use of morphological, physiological and genetic properties of the population of pathogens of epiphytotic and especially harmful diseases of wheat and barley in breeding for resistance (A methodological guide). Derzhavinsky Publishing House, Tambov, 2021 (in Russ.).
Zhang Z., Friesen T.L., Xu S.S. et al. Two putatively homoeologous wheat genes mediate recognition of SnTox3 to confer effector-triggered susceptibility to Stagonospora nodorum. Plant J. 2011. V. 65. P. 27–38. https://doi.org/10.1111/j.1365-313X.2010.04407.x
Зеленева Ю.В., Судникова В.П., Плахотник В.В. (Zeleneva et al.) Методология использования морфолого-физиологических и генетических свойств популяций возбудителей эпифитотийно и особо вредоносных болезней пшеницы и ячменя в селекции на устойчивость (Методическое пособие). Тамбов: Издательский дом “Державинский”, 2021. 44 с.
Мохова Л.М. (Mokhova) Селекционно-иммунологичес-кие аспекты устойчивости пшеницы и тритикале к возбудителю Septoria tritici Rob. et Desm. Дисс. … канд. сельскохоз. наук. Краснодар, 2008. 185 с.
Пахолкова Е.В. (Pakholkova) Септориоз зерновых культур в различных регионах Российской Федерации. Дисс. … канд. биол. наук. Большие Вяземы, 2003. 171 с.
Пыжикова Г.В., Санина А.А., Супрун Л.М. и др. (Pyzhikova et al.) Методы оценки селекционного материала и сортов пшеницы к септориозу. Москва, 1989. 43 с.
Санин С.С., Корнева Л.Г., Жохова Т.П. и др. (Sanin et al.) Определение потерь урожая зерна пшеницы от септориоза листьев и колоса // Защита и карантин растений. 2012. № 8. С. 47–49.
Санин С.С., Корнева Л.Г., Полякова Т.М. (Sanin et al.) Прогноз риска развития эпифитотий септориоза листьев и колоса пшеницы // Защита и карантин растений. 2015. № 3. С. 33–36.
Санин С.С., Ибрагимов Т.З., Стрижекозин Ю.А. (Sanin et al.) Метод расчета потерь урожая пшеницы от болезней // Защита и карантин растений. 2018. № 1. С. 11–15.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


