Молекулярная биология, 2019, T. 53, № 1, стр. 3-15
Три важнейших открытия в области функционирования белков цитоскелета, сделанные на модели Drosophila melanogaster
Ю. Е. Воронцова a, Е. Л. Заволока a, Р. О. Черезов a, О. Б. Симонова a, *
a Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
* E-mail: osimonova@hotmail.com
Поступила в редакцию 24.05.2018
После доработки 24.05.2018
Принята к публикации 18.06.2018
Аннотация
В обзоре рассмотрены три выполненных на дрозофиле исследования, результатом которых стали открытия, сделать которые на других объектах было бы невозможно. Благодаря этим открытиям детально описаны события, сопровождающие процесс слияния миобластов, поляризацию ооцита и функционирование надклеточных линейных актомиозиновых кабелеподобных структур, координирующих поляризацию цитоскелета клетки.
В течение последних 100 лет Drosophila melanogaster была незаменимым объектом экспериментов по исследованию механизмов наследственности, процессов развития и поведения животных. Достижения в области визуализации и усовершенствования генетических методик привели к тому, что дрозофила стала также одной из наиболее эффективных систем для изучения сложных функций регуляторных белков цитоскелета in vivo. Мы рассмотрим три примера открытий в области функционирования цитоскелета, которые привели к пониманию того, как регулируется активность комплекса Arp2/3 во время слияния миобластов; как взаимодействуют нуклеаторы актиновых филаментов Spire и Cappuccino во время поляризации ооцита; и формируются надклеточные миозиновые кабелеподобные структуры. На этих примерах показана уникальность дрозофилы для выявления новых структур и функций цитоскелета в условиях in vivo, обнаружить которые в культуре клеток ex vivo или в экспериментах in vitro невозможно. Аналоги многих структур цитоскелета, идентифицированных у дрозофилы, найдены в клетках и тканях млекопитающих, поэтому выяснение деталей их функционирования на этом модельном объекте применимо и к другим организмам.
ВЗАИМОДЕЙСТВИЕ ФАКТОРОВ СБОРКИ АКТИНА В ПРОЦЕССЕ СЛИЯНИЯ МИОБЛАСТОВ
Слияние клеток – ключевое событие в формировании многих синцитиальных тканей и их регенерации. В этом процессе участвуют разные типы клеток и сигнальные молекулы, поведение которых трудно всесторонне описать, используя культивируемые клетки [1, 2]. Исследования на модели дрозофилы позволили детально охарактеризовать связанные с актиновым цитоскелетом события, происходящие во время слияния клеток in vivo.
Формирование синцития мышечных волокон у эмбриона дрозофилы происходит в результате слияния коммитированных к этому процессу миобластов (fusion-competent myoblasts – FCM) с главным миобластом, так называемой клеткой-основательницей (founder cell – FC) или с растущей миотубой (рис. 1) [1, 2]. Процесс слияния миобластов начинается с миграции и адгезии гетеротипичных клеток и заканчивается формированием “синапса слияния” (“fusogenic synapse”) [3–6]. В это время у FCM появляются F-актиновые структуры, называемые “фокусами схождения пучков актина”. Они обогащаются молекулами клеточной адгезии и формируют вырост размером ~2 мкм с динамичными пальцевидными отростками, которые внедряются в FC или в растущую миотубу (рис. 1) [4–8]. Эти выросты из-за их структурного и функционального сходства с подосомами и инвадоподиями названы подосома-подобными структурами (podosome like structures – PLS) [6]. Наблюдать такие структуры можно в культивируемых клетках по характерному стержню, окруженному кольцом молекул клеточной адгезии, который формируется из разветвленного F-актина [9]. У FC в области слияния вокруг PLS создается оболочка из тонкого слоя актина, необходимая для увеличения механического напряжения на стыке между клетками [10]. Затем в течение 5–30 мин актиновые фокусы исчезают, поры расширяются и сливаются, процесс полного слияния клеток завершается [5, 6]. Последовательность этих событий описана во многом благодаря генетическому скринингу партнеров-участников этого процесса [1, 2], получению прижизненных и фиксированных образцов, позволяющих найти отличия в организации и динамике накопления актина в FC по сравнению с FCM [5–7, 11], и ультраструктурному анализу сливающихся клеток [3, 6, 12]. Чтобы показать возможности дрозофилы в такого рода исследованиях, мы остановимся на механизмах, лежащих в основе формирования фокусов актина в готовых к слиянию миобластах.
Рис. 1.
Слияние миобластов и схема подосома-подобной структуры. а – Схема регуляторного механизма активации Arp2/3 факторами нуклеации актина WASp и SCAR/WAVE. GBD: домен, связывающий GTPазу; VCA: Verprolin-Central-Acidic – домен, активирующий Arp2/3. б – Схема формирования подосома-подобной структуры у компетентного к слиянию миобласта. На увеличенной области показана схема локализации различных нуклеаторов актина и белков адгезии, расположенных вблизи фокуса актина. Sns локализуется в компетентном к слиянию миобласте, Kirre – в клетке-основательнице/миотубе.
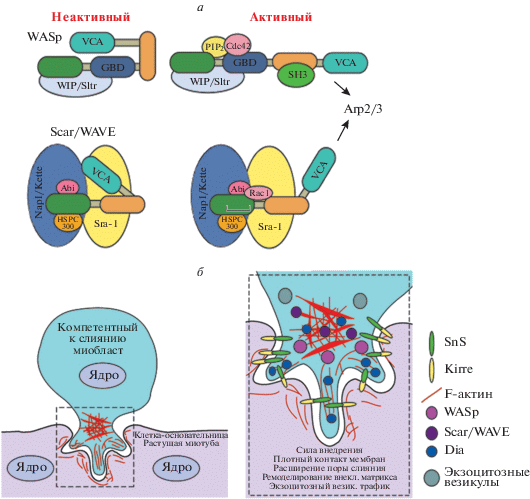
В результате обширного генетического скрининга мутантов, дефектных по синтезу миобластов, были выявлены мутанты с нарушением процесса нуклеации актина, контролируемого белковым комплексом Arp2/3 (Actin-related protein 2/3) [5, 13, 14]. Комплекс Arp2/3 необходим для создания разветвленной сети актиновых филаментов, хотя сам Arp2/3 неактивен. Для стимуляции его активности требуются факторы нуклеации (Nucleation Promoting Factors – NPF) (рис. 1a) [15]. Для функционирования PLS необходимы два различных NPF: белки WASP (Wiskott-Aldrich Syndrome Protein) и WAVE (Wiskott-Aldrich Verprolin Protein – гомолог верпролина из семейства белков WASP). Мутации гена WASp и его регулятора dWIP/Solitary/Sltr (кодирует гомолог WASp-interacting protein (WIP)) [12–14, 16, 17] приводят к дефектам, похожим на дефекты слияния миобластов, вызванные мутациями гена SCAR (кодирует гомолог WAVE) и его регулятора kette (кодирует гомолог NAP1 – Nucleosome Assembly Protein 1) [5, 14, 17, 18].
Несколько фактов свидетельствуют о том, что совместно гены WASp и SCAR экспрессируются исключительно в FCM. Во-первых, dWIP детектируется в FCM, а не в FC [12]. Во-вторых, в опытах по спасению фенотипа с применением специфических FC- и FCM-драйверных GAL4-линий показано, что для нормального слияния миобластов в первую очередь необходимо присутствие dWIP и WASP в FCM [6, 13, 16], тогда как SCAR необходим и в FC, и в FCM. WASP и SCAR являются активаторами комплекса Arp2/3, но активирующая сила и регуляторные механизмы у них разные (рис. 1a) [15]. Обнаружение совместного участия WASP и SCAR в формировании фокусов F-актина во время слияния миобластов поднимает важный вопрос о том, каким образом они координируют свою работу. Также в слиянии миобластов участвует формин Diaphanous (Dia), который локализуется в области пальцеобразных выростов PLS и стимулирует образование разветвленных актиновых филаментов [7]. Эта система представляет собой уникальную модель для изучения взаимосвязи между регуляторами сборки актина во время формирования новой ультраструктуры цитоскелета, характерной для PLS, но отличной от хорошо изученных структур, возникающих на переднем (лидирующем) крае мигрирующих клеток. Далее мы опишем различные функции SCAR и WASP.
Оба модуля SCAR/Kette и WASP/WIP локализуются в центрах скопления актина и стимулируют его сборку, взаимодействуя с комплексом Arp2/3. Однако сам процесс сборки у мутантов WASp и SCAR не нарушен. Кроме того, мутации в каждом из генов имеют разный фенотип: нехватка SCAR/Kette приводит к увеличению размера актинового фокуса, а потеря функции белка WASP не влияет на размер центра скопления актина [5, 6, 17, 19]. Отсюда решили, что WASP и SCAR участвуют не в самой сборке актинового центра, а в регуляции его функционирования. Изучение двойных мутантов по этим факторам нуклеации показало, что они могут работать как по отдельности, так и вместе. Двойные мутанты dWIP SCAR и SCAR WASp усиливают дефекты слияния и нарушают формирование фокусов актина, что говорит об аддитивном влиянии модулей WASP и SCAR на процесс функционирования актиновых центров [6, 14, 17, 20]. Тем не менее, анализ актинсодержащих ультраструктур у одиночных мутантов по факторам нуклеации выявил различия в их функциях. Электронно-микроскопическое изучение процесса слияния PLS с FC показало, что PLS мутантов по WASp или dWIP не могут эффективно проникать в FC из-за коротких или свернутых пальцеобразных выростов. При этом мутанты dWIP накапливают некие секреторные везикулы [12]. Формирование ультраструктуры PLS у мутантов kette, в отличие от dWIP, протекает нормально, однако последний этап слияния блокирован, вероятно, из-за нехватки комплекса SCAR в мышечной FC [6]. Прояснить роль WASP в центрах накопления актина помогло изучение мутантов по гену blown fuse (blow) [11]. Мутанты blow были обнаружены в результате скрининга генов, нарушающих слияние миобластов [3], однако функция Blow, белка с доменом, гомологичным плекстрину (PH – pleckstrin homology), долгое время оставалась неизвестной, пока не было выявлено непрямое взаимодействие Blow со специфической молекулой клеточной адгезии Sticks and Stones (Sns) [11], и показан прямой контакт Blow с dWIP. Сам dWIP связывается с WASP и регулирует его стабильность и направленность на структуры клетки [21]. Оказалось, что Blow конкурирует с WASP за связывание с dWIP. Это приводит к временной дестабилизации комплекса WASP-WIP. Тем не менее, мутации blow не просто вызывают накопление стабильного комплекса WASP-WIP и F-актина. В результате изящного сочетания тканеспецифических генетических экспериментов по спасению мутантного фенотипа с анализом локализации WASP, dWIP и F-актина в PLS методом FRAP (Fluorescence Recovery After Photobleaching), используемым для визуализации перемещения молекул внутри клетки, показано, что у мутантов blow значительно снижена динамика цикла взаимодействий всех трех компонентов [11]. Этот неожиданный результат свидетельствует о том, что простой сборки актина недостаточно для поддержания протрузивной функции PLS – необходимо быстрое циклическое взаимодействие между комплексом WASP/dWIP и актиновыми структурами. Полагают, что циклическое (пульсирующее) взаимодействие с WASP необходимо для инициации дополнительных раундов активации комплекса Arp2/3 или для торможения роста нити актина вблизи плазматической мембраны за счет кепирования колючего конца актиновых филаментов [22, 23].
Дополнительные сведения о роли SCAR в этом процессе были получены после открытия способа индукции слияния клеток культуры Drosophila S2R+, не способных к этому в нормальных условиях [24]. Оказалось, что эффективное слияние клеток S2R+ можно индуцировать с помощью коэкспрессии белка Eff-1 нематоды Caenorhabditis elegans с FCM-специфической молекулой клеточной адгезии Sns или с интегрином α-PS2, который, как полагали, не участвует в слиянии миобластов. Sns обеспечивает эффективное слияние клеток S2 и, как в случае с миобластами, его присутствие необходимо только в одной из двух сливающихся клеток. Структуру сливающихся клеток анализировали с помощью техники STORM (STochastic Optical Reconstruction Microscopy – микроскопия стохастической оптической реконструкции). Оказалось, что скопления F-актина, генерируемые Sns, состоят из Sns-содержащих инвазивных “пальцев”, простирающихся от клетки до ее партнера по слиянию, тогда как α-PS2-зависимое слияние генерирует вдоль широкой контактной зоны многочисленные отдельные волосоподобные выросты, со стороны базальной поверхности связанные между собой интегрином α-PS2. Интересно, что подавление WASP, SCAR или WIP с помощью РНК-интерференции нарушает Sns-зависимое слияние клеток, тогда как α-PS2-зависимое слияние нарушается только при подавлении SCAR, что дополнительно говорит о различных функциях факторов нуклеации. Для формирования выступов и их слияния на участках адгезии необходим только SCAR. Активность же комплекса WASP/WIP позволяет создать широкую контактную зону и обеспечивает формирование большого актинового фокуса.
Таким образом, исследования на Drosophila выявили асимметричность процесса слияния миобластов, для старта которого у компетентных к слиянию миобластов должна сформироваться особая протрузивная структура – PLS. Для сборки сильной динамичной сети F-актина необходим активный белок SCAR и комплекс WASP/WIP, причем для создания функционального актинового фокуса SCAR должен действовать вместе с WASP/WIP (и, возможно, с другими NPF), а для поддержания цикла быстрых повторяющихся взаимодействий между WASP, dWIP и F-актином, нужного для формирования подвижной структуры PLS, способной эффективно внедряться в FC, необходим динамичный комплекс WASP/WIP, регулируемый Blow. Растущим PLS нужна также активность форминов, таких как Dia. Предполагается, что SCAR может участвовать и на заключительных этапах формирования поры слияния. Таким образом, эти исследования охарактеризовали новые функции регуляторов актина в процессе слияния клеток: обеспечение надежного внедрения в FC, увеличение площади поверхности для образования поры, экзоцитозный везикулярный транспорт, ремоделирование внеклеточного матрикса, и, возможно, формирование самой поры слияния (рис. 1б).
Приведенные примеры иллюстрируют применение Drosophila в качестве модели для выяснения того, каким образом согласованные действия функционально разных регуляторов формируют уникальную структуру цитоскелета, обеспечивая в конечном итоге упорядоченный ход событий в развивающейся ткани. Прежде всего, эти исследования стали возможными благодаря использованию таких методов, как тканеспецифический анализ функции генов в FC и FCM, ультраструктурный анализ и, самое главное, прижизненная визуализация PLS в мухах дикого типа и у мутантов. Более того, проведенные на Drosophila эксперименты, показали, что есть смысл начать подобные исследования и на млекопитающих [1, 2]. Эти эксперименты могли бы улучшить наше понимание аналогичных инвазивных структур, таких как подосомы и инвадоподии, сходных с синапсом слияния, и для формирования которых также необходим функционально активный WASP [25]. Таким образом, слияние миобластов можно использовать в качестве удобной доступной модельной системы для изучения in vivo как нормальных структур, важных для физиологии здорового человека, так и аномальных, которые сопровождают патологические процессы.
ПОЛЯРИЗАЦИЯ КЛЕТОК
Поляризация клеток – фундаментальный процесс, в результате которого клетки приобретают позиционную информацию, заложенную в цитоплазме и кортексе. У Drosophila мРНК генов, кодирующих факторы, устанавливающие дорсо-вентральные (D-V) и антерио-пастериорные (A-P) оси будущего эмбриона, полярно распределяются в кортексе ооцита (рис. 2a). Например, формирование заднего отдела будущего эмбриона и закладка герминативных клеток взрослого насекомого определяется локализацией мРНК генов oskar и nanos на заднем полюсе ооцита [26, 27]. Длина ооцита Drosophila составляет более 100 мкм, поэтому его полярность не может устанавливаться простыми диффузионными механизмами. Для эффективной локализации мРНК генов oskar и nanos на заднем полюсе ооцита необходима динамичная перегруппировка цитоскелетных микротрубочек (MT) [28]. В середине оогенеза на заднем полюсе ооцита локализуется мРНК гена oskar, транспорт которой вдоль А-Р-оси происходит в результате направленного переноса, осуществляемого МТ, растущие (+) концы которых устремлены к заднему полюсу [29]. Затем на поздних стадиях оогенеза МТ-цитоскелет реорганизуется, формируются субкортикальные пучки, которые способствуют течению цитоплазмы трофоцитов в ооцит, где она смешивается с желтком ооцита [30]. Течение цитоплазмы облегчает доставку мРНК гена oskar из цитоплазмы трофоцитов на задний полюс ооцита, где она надежно заякоривается [31]. Время реорганизации MT-цитоскелета критично для поляризации ооцита, поскольку преждевременная индукция течения цитоплазмы нарушает передне-задний градиент MT и локализацию мРНК гена oskar [32]. Оказалось, что время реорганизации MT определяется актиновым цитоскелетом. Далее мы рассмотрим как это происходит.
Рис. 2.
Взаимодействие компонентов актинового и микротрубочкового цитоскелета регулирует полярность ооцита. a – Локализация мРНК в созревающем ооците. мРНК из питающих клеток транспортируется в ооцит (стрелки) и закрепляется в определенных регионах, устанавливая полярность эмбриона. Локализация мРНК гена oskar у заднего полюса зависит от микротрубочек (не показано). Транспорт мРНК других генов, внесенных в ооцит на поздних стадиях (например, nanos), зависит от течения цитоплазмы (смешивания цитоплазмы питающих клеток и желтка ооцита, красные стрелки). б – Цитоплазматическая сеть актиновых филаментов формируется в ооците до течения цитоплазмы. Изображение слева – яйцевая камера дикого типа, окрашенная фаллоидином (звездочкой (*) обозначен ооцит). Изображение справа – яйцевая камера мутанта по гену spir, окрашенная фаллоидином, в которой отсутствует актиновая сеть и происходит преждевременное течение цитоплазмы. в – Доменная организация и взаимодействие белков Capu и Spir (вверху). Домен KIND (kinase inactive domain) белка Spir связывается с С-концевым доменом белка Capu и ингибирует его нуклеирующую активность и элонгацию актина. Это взаимодействие стимулирует нуклеирующую активность белка Spir через домены WH2 (WASp homology 2). У Capu тоже есть N-концевой ингибирующий домен CID (Capu inhibitory domain), который связывается с его С-концевым доменом (перекрывая сайт связывания со Spir) и ингибирует активность Capu. Модель фунционирования Capu и Spir во время сборки актина (внизу). Сначала Capu связан со Spir для стимуляции его нуклеирующей активности, в результате чего формируется затравка актинового филамента. Далее Spir высвобождает Capu, Capu ингибируется и соединяется с “колючим” (+) концом актина, что способствует полимеризации актинового филамента. Впоследствии состояние “колючего” конца колеблется: он связан то со Spir (приостановленное состояние), то с Capu (состояние элонгации).
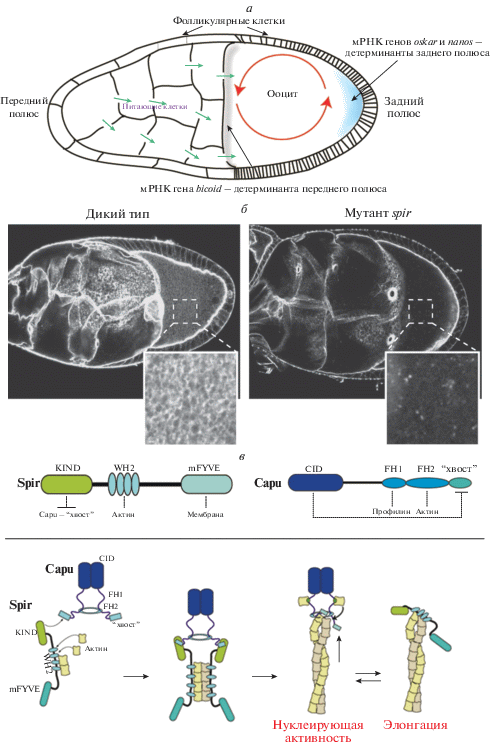
Важные гены, ответственные за формирование осей полярности ооцита, были выявлены с использованием генетических экспериментов на дрозофиле. Эти гены обнаружили среди генов с материнским эффектом, мутации которых, нарушая полярность ооцита, приводили к появлению легко различимых морфологических дефектов у эмбриона [33]. С помощью генетических скринингов были идентифицированы два гена, cappuccino (capu) и spire (spir), кодирующих белки, необходимые для сборки актиновых филаментов в ооците [34]. У Drosophila Capu является единственным представителем белков-форминов семейства FMN, которые нуклеируют (зарождают) неразветвленные актиновые микрофиламенты, оставаясь связанными с их “колючим” (+) концом, и увеличивают скорость удлинения микрофиламента в присутствии избытка профилина – белка, связывающего мономеры актина [35]. Кроме того, формин Capu может связываться с тубулиновыми МТ с образованием поперечных сшивок между ними и актиновыми микрофиламентами [36, 37]. За сборку актиновых микрофиламентов у белка Spir отвечают его тандемные актинсвязывающие домены WH2 [37–39]. Нехватка Capu или Spir приводит к преждевременному течению цитоплазмы и нарушению локализации мРНК на заднем полюсе ооцита [32]. Изучая этот процесс, исследователи обратили внимание на появление цитоплазматической ячеистой актиновой сети и пучков кортикального актина [40, 41]. Их исчезновение у мутантов приводит к формированию аномальных узловых структур, образуемых кортикальными МТ, появление которых совпадает по времени с началом течения цитоплазмы (рис. 2б) [40, 41]. Оказалось, что для создания ячеистой актиновой структуры необходимы белки Capu и Spir (рис. 2б) [40]. Цитоплазматическая актиновая сеть вместе с кортикальными пучками фиксирует, по-видимому, МТ, минус-концы которых встроены в кортекс [41], и таким образом выполняет роль сита, пассивно предотвращая MT от завязывания в узлы. У мутантов capu узловые структуры МТ пропадают на фоне мутации тяжелой цепи моторного белка кинезина, обеспечивающего течение цитоплазмы. Это говорит о том, что формирование Spir-Capu-зависимой актиновой сети необходимо, чтобы обеспечить правильное положение MT, защитив их от влияния потока цитоплазмы, контролируемого моторными белками [40].
Изучение ключевых механизмов образования сети актиновых филаментов in vivo и in vitro позволило ответить на вопросы о том, как происходит сборка цитоплазматической сети актина, и зачем для этого необходимы два нуклеатора? Нужны ли этим регуляторам актина особые условия для выполнения разных функций (т.е. нуклеации и удлинения)? В экспериментах in vitro показано, что в норме Spir сильно подавляет Capu, зависимую от него нуклеацию актина и формирование поперечных сшивок актиновых филаментов с MT (рис. 2в) [36, 37], однако мутанты с потерей функции Spir и Capu имеют одинаковый фенотип. In vitro показано, что через свой домен KIND Spir с высокой (наномолярной) аффинностью взаимодействует непосредственно с хвостовым доменом Capu и ингибирует его нуклеирующую активность, связывание с MT и формирование узлов F‑актина [37, 42]. При этом нуклеирующая активность самого Spir усиливается [37]. Кроме того, Capu может подвергаться автоингибированию, поскольку его N-концевой домен способен взаимодействовать со своим C-концевым хвостовым доменом, перекрывая расположенный там сайт связывания Spir [43]. В итоге, Spir, связываясь с Capu, предотвращает его автоингибирование и регулирует его процессивность на “колючем” (+) конце актиновой нити (рис. 2в) [42]. Таким образом, комплекс Spir-Capu можно считать стартовым механизмом сборки нового актинового филамента, “колючий” конец которого затем передается Capu для его удлинения (рис. 2в). Однако сигнал к запуску такой передачи пока не идентифицирован.
Систематический фенотипический анализ серии конгенных аллельных мутантов capu и spir позволил понять, каким образом взаимодействия между этими белками могут регулировать сборку сети актиновых филаментов и контролировать течение цитоплазмы из трофоцитов в ооцит. Показано, что дополнительная экспрессия мутантных белков Spir или Capu, несущих испорченные сайты их контакта (рис. 2в), не восстанавливает фертильность нулевых мутантов spir или capu, соответственно, подтверждая факт их взаимодействия in vivo [37]. Кроме того, получены и секвенированы точковые мутации capu, биохимический анализ белковых продуктов которых показал отсутствие прямой корреляции между фенотипом мутантов и нуклеирующей активностью Capu. У мутантов capu с относительно нормальной нуклеирующей активностью, но с уменьшенной скоростью удлинения “колючего” конца актинового филамента и низкой процессивностью, обнаружены дефекты развития ооцитов [44]. Опираясь на эти результаты, была предложена модель, согласно которой Spir и Capu сначала физически взаимодействуют, но, чтобы произошло эффективное Capu-зависимое удлинение нити актина и формирование цитоплазматической актиновой сети, Spir и Capu должны разделиться [37, 43]. Эта модель была подтверждена в экспериментах in vitro с гомологичными белками млекопитающих Spire и Formin 2. Эти два белка взаимодействуют друг с другом для нуклеирования большого количества коротких затравок через предложенный механизм последовательного “переключения”. Этот механизм заключается в том, что “колючий” конец актиновой нити находится то в фазе удлинения (когда он связан с формином), то в фазе приостановленного роста (когда он связан со Spire) [45] (рис. 2в). Показано, что Spire и Formin 2 необходимы для создания в ооцитах мыши актиновой сети, которая отвечает за асимметричное позиционирование нитей веретена деления и формирование полярного тельца [46]. Таким образом, в экспериментах на дрозофиле установлена консервативность функций белка Spire и форминов, которые сохранились в эволюции многоклеточных животных.
Интересно, что к началу течения цитоплазмы Spir, локализованный в кортикальном отделе, исчезает, а если он не исчезнет (например, при индукции его сверхэкспрессии), то течение цитоплазмы прекращается. Таким образом, начало реорганизации актинового цитоскелета зависит от временной и пространственной активности Spir [37, 40]. Что же регулирует время активации и уровень экспрессии Capu и Spir в ооците? Ответ на этот важный вопрос пока не получен. Однако предполагается, что различные функции комплекса Capu/Spir могут контролироваться малой GTPазой RhoA, способной контактировать с белками этого комплекса [36]. Поэтому важно установить, где и когда в ооцитах активируется RhoA, и как эта GTPаза модулирует активность комплекса Capu/Spir. Возможно, в этот процесс вовлечен эффекторный белок RhoA – WASH (Wiskott-Aldrich Syndrome Protein and SCAR Homolog) – активатор комплекса Arp2/3, который взаимодействует с Capu, Spir и RhoA и предотвращает преждевременное течение цитоплазмы [47]. Белки семейства WASH отвечают за сборку актина в процессе формирования эндосом в соответствующих компартментах клетки. Однако они, по-видимому, могут играть роль и в сборке актиновой цитоплазматической сети или передавать сигнал в кортикальный слой клетки с помощью везикулярного транспорта. В любом случае в архитектурную перестройку сети актиновых микрофиламентов вовлечен механизм перехода актина от неразветвленного состояния к полимеризации и ветвлению.
Рассмотренный пример показал, как исследования на Drosophila помогли открыть новую консервативную структуру цитоскелета и заложить фундамент для выяснения механизма ее сборки и функционирования, реализованный методами молекулярно-биологического и генетического анализа. Это открытие вдохновило исследователей на эксперименты in vitro и in vivo с белками млекопитающих и способствовало описанию актиновых структур, которые формируются в процессе созревания ооцитов не только у дрозофилы, но и у млекопитающих.
НАДКЛЕТОЧНЫЕ АКТОМИОЗИНОВЫЕ КАБЕЛЕПОДОБНЫЕ ТЯЖИ И АКТОМИОЗИНОВЫЕ БАРЬЕРЫ
Сортировка эпителия разных типов клеток – естественный процесс, сопровождающий развитие, в результате которого эпителиальная ткань разделяется на отдельные компартменты. Несмотря на непрерывное деление и перегруппировку, клетки разных компартментов растущих тканей никогда не смешиваются. Границы компартментов можно обнаружить по прямой гладкой структуре, которая возникает от того, что пограничные клетки изменяют обычную, свойственную эпителию гексагональную форму. В результате формируется прямая гладкая структура (интерфейс), которая минимизирует площадь контакта между клетками разного типа на границе компартментов (рис. 3а,б). Пограничные клетки компартментов, благодаря их плотному и точному контакту, часто служат источниками морфогенов, которые определяют сценарий развития разных эпителиальных структур [48].
Рис. 3.
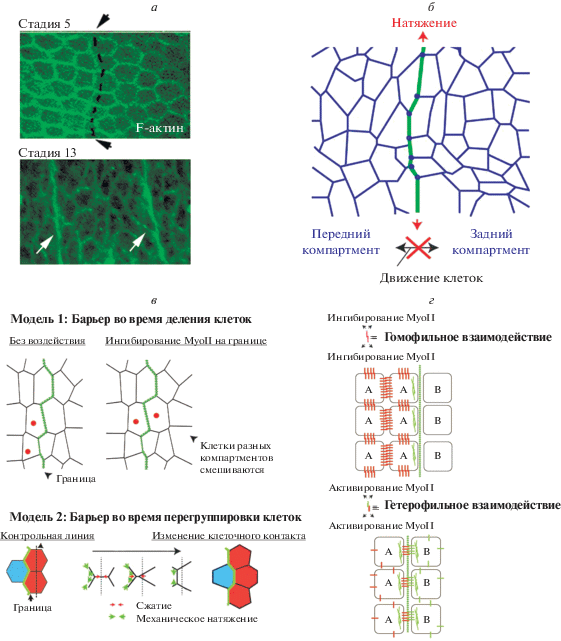
Актомиозиновый кабель – основа формирования тканевых компартментов. а – Начало формирования границы компартмента и актомиозинового кабеля у эмбриона дрозофилы ранней стадии развития (вверху) и сформированные границы компартментов у эмбриона поздней стадии развития (внизу). Стрелками и пунктиром указана граница компартмента. б – Форма клеток вдоль границы компартментов. Сформированный актомиозиновый кабель предотвращает смешивание клеток разных типов. в – Модели, объясняющие, почему клетки разных компартментов не смешиваются. Модель 1 показывает как происходит деление клетки (точки указывают на дочерние клетки) у эмбриона с нормально функционирующей границей (слева) и у эмбриона с регионспецифичным ингибированием миозина вдоль границы (метод CALI) (справа). Модель 2 показывает как натяжение вдоль границы может влиять на перегруппировку клеток. г – Гомофильные и гетерофильные взаимодействия могут запустить сборку актомиозина на стыке клеток разного типа. Гомофильные взаимодействия способствуют полярному накоплению актомиозина (а, соответственно, и сократимости клеток) в пограничной области двух компартментов путем ингибирования актомиозина в остальных клетках компартмента. Гетерофильные взаимодействия, наоборот, активируя актомиозин, могут способствовать формированию кабеля на границе компартментов.
Гладкие структуры, подобные тем, что формируются на границах компартментов, обнаружены также вокруг зачатков различных органов. Они выполняют защитную барьерную роль, изолируя зачатки органов от механического воздействия окружающих их тканей во время бурного морфогенеза [49–52].
Причиной сортировки клеток и формирования границ считают адгезивные связи различной силы у клеток разного типа [53]. Однако исследования на Drosophila выявили линейные кабелеподобные тяжи актомиозина, разделяющие разные типы тканей в пограничных районах компартментов (рис. 3а) [49, 50, 54–56]. Таким образом, на стыке тканей различного типа возможна не только дифференциальная адгезия, но и сборка специализированной структуры цитоскелета, которая играет важную роль, разделяя два типа клеток. Использование методик, применимых только на дрозофиле, позволило идентифицировать тяжи актомиозина в пограничных районах, проанализировать их функции и изучить механизмы их формирования. Комбинация биофизических подходов в сочетании с генетическими экспериментами, индукция тканеспецифической экспрессии генов и прижизненная визуализация клеток в сочетании с количественным анализом изображения способствовали созданию физических моделей, описывающих функции актомиозиновых тяжей, формирующихся на границах компартментов, подтверждая универсальность Drosophila как биологической и биофизической клеточной системы. Пограничные районы между компартментами являются прекрасной физиологической системой для изучения связи клеточной адгезии с цитоскелетом и того, как эти взаимодействия способствуют поляризации цитоскелета клетки у Drosophila. Кроме того, сами актомиозиновые тяжи представляют собой уникальную систему для изучения координированной сборки и динамики цитоскелета пограничных клеток, в результате которой формируется надклеточная цитоскелетная структура.
В течение многих лет сортировку клеток, образование границ и компартментализацию объясняли гипотезой дифференциальной адгезии (adhesion hypothesis – DAH), согласно которой различия в содержании молекул клеточной адгезии, способных определять сродство клеток, приводят к сортировке клеток подобно тому, как это происходит при разделении несмешиваемых жидкостей [57]. Однако в большинстве случаев генетики, работающие с Drosophila, не выявляли четких различий в уровнях экспрессии молекул адгезии, которые функционируют во время формирования границ компартментов in vivo. Чтобы решить эту проблему воспользовались методами клеточной биологии и биофизическими подходами. Было установлено, что границы компартментов в ходе развития накапливают актин и немышечный миозин II (MyoII) (рис. 3а), подавление активности которого приводит к смешиванию клеток разных компартментов (рис. 3в) [56, 58, 59]. Кроме того, с применением УФ-лазера для резки структур цитоскелета показано, что тяж актомиозина напрямую влияет на механические свойства барьеров. При этом учитывали, что сила отдачи окружающей ткани пропорциональна исходному натяжению кабелеподобной структуры [60]. Показано, что натяжение на границе компартмента выше, чем внутри, и в создании этого натяжения участвует MyoII [59, 61]. Таким образом было получено одно из первых экспериментальных доказательств того, что после дифференциальной адгезии ключевым механизмом сортировки клеток и образования границ является кортикальное напряжение. Сократимость миозина играет важную роль в процессе клеточной сортировки также у шпорцевой лягушки (Xenopus laevis) и полосатого данио (Danio rerio), что указывает на эволюционный консерватизм механизма компартментализации с участием кортикального напряжения [62–64].
Каким образом натяжение барьерных структур, общих для двух разных типов клеток, предотвращает смешивание клеток разных компартментов? Одна модель предполагает, что тяж служит барьером, который препятствует проникновению делящихся клеток в соседний компартмент (рис. 3в, модель 1) [58]. При этом основная роль в натяжении на границе компартмента, как уже сказано, отводилась MyoII. Специфическую роль MyoII изучали с помощью хромофорной лазерной инактивации [58]. Этот подход в научной литературе назван CALI (Chromophore-Assisted Laser Inactivation). Метод CALI основан на использовании химически сшитого комплекса, состоящего из хромофора и моноклонального антитела, способного специфически связываться с целевым белком. Дальнейшее облучение лазером индуцирует фотохимическую реакцию, в результате которой целевой белок инактивируется. Ингибирование MyoII на границах парасегментов эмбрионов Drosophila привело к смешиванию делящихся клеток из соседних компартментов. Этот результат показал, что для предотвращения смешивания клеток, делящихся в разных компартментах, необходимо поляризованное натяжение на границе компартмента (рис. 3в, модель 1). Другая модель была предложена при изучении поведения клеток во время их миграций и интеркаляций, т.е. когда перегруппировка клеток происходит в отсутствие их деления. Исследовали динамику клеток пограничных районов компартментов в абдоминальном эпидермисе. Чтобы определить, каким образом происходят перегруппировки клеток этих районов, прижизненную визуализацию комбинировали с автоматизированным анализом изображений и последующим моделированием (рис. 3в, модель 2). В результате показали, что повышенное натяжение вдоль границы компартмента смещает направление перегруппировок, не давая смешиваться клеткам разных компартментов [65]. В зависимости от вида ткани эти два механизма могут работать вместе или порознь.
Возникает вопрос, какой сигнал запускает поляризованную сборку актомиозина вдоль барьерных структур? В отличие от молекул адгезии, устанавливающих различное сродство (аффинность) клеток (гипотеза DAH), непосредственный вклад в сортировку клеток во время морфогенеза и компартментализации у Drosophila вносит дифференциальная экспрессия других молекул клеточной адгезии, так называемых CAM (Сell Adhesion Molecules), которые, как выяснилось, регулируют образование тяжей актомиозина. Оказалось, что пограничные клетки, расположенные с одной стороны от актомиозинового тяжа, синтезируют особые молекулы гомофильной адгезии, тогда как пограничные клетки, расположенные с другой стороны тяжа, их не продуцируют (рис. 3г). Обнаружены две такие гомофильные CAM. Первая молекула – белок Echinoid (Ed), является гомологом нектина и содержит иммуноглобулиновый домен [49, 66]. Вторая – апикальный полярный белок Crumbs (Crbs) [52]. Благодаря гомофильному связыванию белков Ed и Crbs на границе между клетками Ed+ (или Crbs+) и клетками Ed– (или Crbs–) создается некая полярность (рис. 3г). При этом эктопический синтез белка Ed в клетках, в норме не содержащих Ed, предотвращает формирование актомиозинового тяжа [49]. Внутри компартмента внутриклеточные домены гомофильных CAM (Ed и Crbs) могут рекрутировать негативные регуляторы MyoII, поэтому поляризованная сборка MyoII наблюдается только на границе между разными компартментами. Интересно, что на границе между разными типами клеток наблюдается не только дифференциальная экспрессия молекул гомофильной адгезии, но также экспрессия различных рецепторов семейства Toll, которые, как недавно показано на ранних эмбрионах дрозофилы, собирают актомиозиновые кабели и активируют сократимость MyoII через гетерофильные взаимодействия (рис. 3г) [67]. Таким образом, дифференциальная экспрессия либо гомофильных, либо гетерофильных трансмембранных рецепторов может инициировать поляризованную сборку актомиозинового кабеля на границах между различными типами клеток. Кроме того, образованию барьера между передним и задним компартментами имагинального диска Drosophila, как и формированию границы между сегментами заднего мозга у позвоночных, способствуют гетерофильные взаимодействия эфринов (Eph) со своими рецепторами, принадлежащими к семейству рецепторных тирозинкиназ [68–70]. В частности, недавно показано, что формирование барьера в заднем мозге происходит с образованием надклеточного актомиозинового тяжа по механизму, выясненному на Drosophila [71].
Особое свойство барьерных тяжей актомиозина двух пограничных компартментов – способность объединяться и формировать непрерывную надклеточную структуру. Таким образом, исходный сигнал для сборки тяжа миозина могут обеспечить CAM, но усиление этого сигнала и координация сборки миозина между компартментами должны осуществляться другим способом. Недавно показали важную роль натяжения в модуляции динамики формирования миозинового тяжа у Drosophila и в координации его сборки между компартментами. Удлинение зародышевой (герминативной) полоски приводит к формированию множественных сегментарных единиц, которые упорядочиваются, формируя на границах будущих сегментов эмбриона надклеточные миозиновые тяжи (рис. 3а). Надклеточные тяжи, объединяющие пять или более клеток, сжимаются, способствуя формированию розеточной структуры, которую сравнивают с разрезанной на кусочки круглой пиццей. Клетки розетки контактируют друг с другом в центральной точке. Далее клетки устанавливают новые контакты, идет разборка розетки, в результате чего происходит удлинение ткани зародыша [72, 73]. Комбинация прижизненных изображений и биофизических воздействий убедительно доказала, что рекрутирование миозина координируется натяжением: с использованием лазерной абляции (т.е. удаления вещества с поверхности лазерным импульсом) показано, что в надклеточных тяжах механическое напряжение выше, чем в изолированных миозинсодержащих структурах [74]. Кроме того, с использованием методики FRAP и гибридного белка миозин::GFP показано, что в надклеточных тяжах миозин менее подвижен, чем в изолированных структурах, указывая на важную роль натяжения в модулировании динамических свойств миозина [74]. В соответствии с этим лазерная абляция снимает натяжение миозина, а микроаспирация ткани его увеличивает. Динамические свойства миозина зависят от механических свойств и структуры конкретного миозинового моторного белка. Например, при клеточном стрессе MyoII кортикального слоя может стабилизироваться, проявляя свойства механосенсора, защищая и корректируя поверхность клетки при угрозе ее повреждения [75]. Для детального анализа механизма обратной связи этого процесса необходимы дополнительные эксперименты с применением молекулярного воздействия на данный миозиновый мотор. С другой стороны, поляризованная сборка миозина может контролироваться с участием и других процессов. Выполненный недавно структурно-функциональный анализ активатора миозина – Rho-ассоциированной киназы (ROCK), содержащей мотив coiled-coil, идентифицировал в ее составе Shroom-связывающий домен, от которого зависит полярное распределение ROCK в клетках [76]. Shroom – это актинсвязывающий белок, необходимый для закрытия нервной трубки. В комплексе с RhoA Shroom функционирует как ключевой регулятор ROCK [77]. Во время сборки актомиозина Shroom связывается с F-актином и привлекает туда ROCK, усиливая тем самым его поляризованную сборку.
В отличие от предыдущих открытий, сделанных при помощи генетического скрининга, роль механического напряжения как физичееского препятствия против смешивания клеток удалось выявить в результате наблюдений за поведением актомиозиновых кабелей в развивающихся тканях. Сочетание точных генетических манипуляций, механических вмешательств и количественного анализа прижизненных изображений показывает, что образование границ между тканями зависит от увеличения межфазного натяжения, опосредованного надклеточным актомиозиновым кабелем. Диапазон процессов развития, доступных для экспериментального исследования, делает Drosophila привлекательной модельной системой для изучения механизмов, которые координируют адгезию, сборку цитоскелета и биомеханическую обратную связь при развитии органо-тканевых структур. Появление новых сведений о существовании физических механизмов формирования пограничных барьеров, сходных у дрозофилы и позвоночных, позволяет предполагать, что открытия, сделанные на дрозофиле, будут важны для понимания механизмов развития и физиологии более сложных организмов [64, 71, 78].
ЗАКЛЮЧЕНИЕ
Три исследования, описанные в этом обзоре, иллюстрируют эффективность использования дрозофилы в качестве модельной системы для изучения функционирования цитоскелета. На клеточных культурах выявлены важные механизмы поляризации клеток, их подвижности и субклеточной компартментализации, однако эти феномены отражают лишь небольшую долю многообразия функций цитоскелета, необходимых для формирования уникальных и разнообразных тканей живого организма. Достижения в области визуализации и генетических манипуляций позволили использовать дрозофилу для выявления глобальной роли цитоскелета в многочисленных сценариях развития разнообразных внутриклеточных и надклеточных структур, возникших в ходе эволюции эукариот.
Работа выполнена при поддержке Российского фонда фундаментальных исследований в рамках научных проектов (16-04-00829-a, 18-34-00162 мол-а) и раздела Государственного задания ИБР РАН (№ 0108-2019-0001).
Список литературы
Abmayr S.M., Pavlath G.K. (2012) Myoblast fusion: lessons from flies and mice. Development. 139, 641–656.
Kim J.H., Jin P., Duan R., Chen E.H. (2015) Mechanisms of myoblast fusion during muscle development. Curr. Opin. Genet. Dev. 32, 162–170.
Doberstein S.K., Fetter R.D., Mehta A.Y., Goodman C.S. (1997) Genetic analysis of myoblast fusion: blown fuse is required for progression beyond the prefusion complex. J. Cell Biol. 136, 1249–1261.
Kesper D.A., Stute C., Buttgereit D. Kreiskother N.,Vishnu S., Fischbach K.F., Pohl R.R. (2007) Myoblast fusion in Drosophila melanogaster is mediated through a fusion-restricted myogenic-adhesive structure (FuRMAS). Dev. Dyn. 236, 404–415.
Richardson B.E., Beckett K., Nowak S.J., Baylies M.K. (2007) SCAR/WAVE and Arp2/3 are crucial for cytoskeletal remodeling at the site of myoblast fusion. Development. 134, 4357–4367.
Sens K.L., Zhang S., Jin P., Duan R., Zhang G., Luo F., Parachini L., Chen E.H. (2010) An invasive podosome-like structure promotes fusion pore formation during myoblast fusion. J. Cell Biol. 191, 1013–1027.
Haralalka S., Shelton C., Cartwright H.N. Guo F., Trimble R., Kumar R.P., Abmayr S.M. (2014) Live imaging provides new insights on dynamic F-actin filopodia and differential endocytosis during myoblast fusion in Drosophila. PLoS One. 9, e114126.
Haralalka S., Shelton C., Cartwright H.N., Katzfey E., Janzen E., Abmayr S.M. (2011) Asymmetric Mbc, active Rac1 and F-actin foci in the fusion-competent myoblasts during myoblast fusion in Drosophila. Development. 138, 1551–1562
Schachtner H., Calaminus S.D., Thomas S.G., Machesky L.M. (2013) Podosomes in adhesion, migration, mechanosensing and matrix remodeling. Cytoskeleton (Hoboken). 70, 572–589.
Kim J.H., Ren Y., Ng W.P., Li S., Son S., Kee Y.S., Zhang S., Zhang G., Fletcher D.A., Robinson D.N., Chen E.H. (2015) Mechanical tension drives cell membrane fusion. Dev. Cell. 32, 561–573.
Jin P., Duan R., Luo F., Zhang G., Hong S.N., Chen E.H. (2011) Competition between Blown fuse and WASP for WIP binding regulates the dynamics of WASP-dependent actin polymerization in vivo. Dev. Cell. 20, 623–638.
Kim S., Shilagardi K., Zhang S., Hong S.N., Sens K.L., Bo J., Gonzalez G.A., Chen E.H. (2007) A critical function for the actin cytoskeleton in targeted exocytosis of prefusion vesicles during myoblast fusion. Dev. Cell. 12, 571–586.
Massarwa R., Carmon S., Shilo B.Z., Schejter E.D. (2007) WIP/WASp-based actin polymerization machinery is essential for myoblast fusion in Drosophila. Dev. Cell. 12, 557–569.
Berger S., Schafer G., Kesper D.A., Holz A., Eriksson T., Palmer R.H., Beck L., Klambt C., Pohl R.R., Önel S.F. (2008) WASP and SCAR have distinct roles in activating the Arp2/3 complex during myoblast fusion. J. Cell Sci. 121, 1303–1313.
Rotty J.D., Wu C., Bear J.E. (2013) New insights into the regulation and cellular functions of the ARP2/3 complex. Nat. Rev. Mol. Cell Biol. 14, 7–12.
Schafer G., Weber S., Holz A., Bogdan S., Schumacher S., Muller A., .Pohl R.R., Onel S.F. (2007) The Wiskott-Aldrich syndrome protein (WASP) is essential for myoblast fusion in Drosophila. Dev. Biol. 304, 664–674.
Gildor B., Massarwa R., Shilo B.Z., Schejter E.D. (2009) The SCAR and WASp nucleation-promoting factors act sequentially to mediate Drosophila myoblast fusion. EMBO Rep. 10, 1043–1050.
Schroter RH, Lier S, Holz A., Bogdan S., Klambt C., Beck L., Pohl R.R. (2004) Kette and blown fuse interact genetically during the second fusion step of myogenesis in Drosophila. Development. 131, 4501–4509.
Mukherjee P., Gildor B., Shilo B.Z. VijayRaghavan K., Schejter E.D. (2011) The actin nucleator WASp is required for myoblast fusion during adult Drosophila myogenesis. Development. 138, 2347–2357.
Bothe I., Deng S., Baylies M. (2014) PI(4,5)P2 regulates myoblast fusion through Arp2/3 regulator localization at the fusion site. Development. 141, 2289–2301.
Anton I.M., Jones G.E., Wandosell F., Geha R., Ramesh N. (2007) WASP-interacting protein (WIP): working in polymerisation and much more. Trends Cell. Biol. 17, 555–562.
Co C., Wong D.T., Gierke S., Chang V., Taunton J. (2007) Mechanism of actin network attachment to moving membranes: barbed end capture by N-WASP WH2 domains. Cell. 128, 901–913.
Khanduja N., Kuhn J.R. (2014) Processive acceleration of actin barbed-end assembly by N-WASP. Mol. Biol. Cell. 25, 55–65.
Shilagardi K., Li S., Luo F., Marikar F., Duan R., Jin P., Kim J.H., Murnen K., Chen E.H. (2013) Actin-propelled invasive membrane protrusions promote fusogenic protein engagement during cell-cell fusion. Science. 340, 359–363.
Linder S., Wiesner C., Himmel M. (2011) Degrading devices: invadosomes in proteolytic cell invasion. Annu. Rev. Cell Dev. Biol. 27, 185–211.
Ephrussi A., Dickinson L.K., Lehmann R. (1991) Oskar organizes the germ plasm and directs localization of the posterior determinant nanos. Cell. 66, 37–50.
Rodal A.A., Del Signore S.J., Martin A.C. (2015) Drosophila comes of age as a model system for understanding the function of cytoskeletal proteins in cells, tissues, and organisms. Cytoskeleton. 72, 207–224.
Riechmann V., Ephrussi A. (2001) Axis formation during Drosophila oogenesis. Curr. Opin. Genet. Dev. 11, 374–383.
Parton R.M., Hamilton R.S., Ball G. Yang L., Cullen C.F., LumW., Ohkura H., Davis I. (2011) A PAR-1-dependent orientation gradient of dynamic microtubules directs posterior cargo transport in the Drosophila oocyte. J. Cell. Biol. 194, 121–135.
Theurkauf W.E., Smiley S., Wong M.L., Alberts B.M. (1992) Reorganization of the cytoskeleton during Drosophila oogenesis: implications for axis specification and intercellular transport. Development. 115, 923–936.
Forrest K.M., Gavis E.R. (2003) Live imaging of endogenous RNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila. Curr. Biol. 13, 1159–1168.
Theurkauf W.E. (1994) Premature microtubule-dependent cytoplasmic streaming in cappuccino and spire mutant oocytes. Science. 265, 2093–2096.
Schupbach T., Wieschaus E. (1989) Female sterile mutations on the second chromosome of Drosophila melanogaster. I. Maternal effect mutations. Genetics. 121, 101–117.
Manseau L.J., Schupbach T. (1989) cappuccino and spire: two unique maternal-effect loci required for both the anteroposterior and dorsoventral patterns of the Drosophila embryo. Genes Dev. 3, 1437–1452.
Goode B.L., Eck M.J. (2007) Mechanism and function of formins in the control of actin assembly. Annu. Rev. Biochem. 76, 593–627.
Rosales-Nieves A.E., Johndrow J.E., Keller L.C., Magie C.R., Pinto-Santini D.M., Parkhurst S.M. (2006) Coordination of microtubule and microfilament dynamics by Drosophila Rho1, Spire and Cappuccino. Nat. Cell Biol. 8, 367–376.
Quinlan M.E., Hilgert S., Bedrossian A., Mullins R.D., Kerkhoff E. (2007) Regulatory interactions between two actin nucleators, Spire and Cappuccino. J. Cell Biol. 179, 117–128.
Bosch M., Le K.H., Bugyi B., Correia J.J., Renault L., Carlier M.F. (2007) Analysis of the function of Spire in actin assembly and its synergy with formin and profiling. Mol. Cell. 28, 555–568.
Rasson A.S., Bois J.S., Pham D.S., Yoo H., Quinlan M.E. (2015) Filament assembly by Spire: key residues and concerted actin binding. J. Mol. Biol. 427, 824–839.
Dahlgaard K., Raposo A.A., Niccoli T., St Johnston D. (2007) Capu and Spire assemble a cytoplasmic actin mesh that maintains microtubule organization in the Drosophila oocyte. Dev. Cell. 13, 539–553.
Wang Y., Riechmann V. (2008) Microtubule anchoring by cortical actin bundles prevents streaming of the oocyte cytoplasm. Mech. Dev. 125, 142–152.
Vizcarra C.L., Kreutz B., Rodal A.A., Toms A.V., Lu J., Zheng W., Quinlan M.E., Eck M.J. (2011) Structure and function of the interacting domains of Spire and Fmn-family formins. Proc. Natl. Acad. Sci. USA. 128, 11884–11889.
Bor B., Bois J.S., Quinlan M.E. (2014) Regulation of the formin Cappuccino is critical for polarity of Drosophila oocytes. Cytoskeleton. 72, 1–15.
Yoo H., Roth-Johnson E.A., Bor B., Quinlan M.E. (2015) Drosophila Cappuccino alleles provide insight into formin mechanism and role in oogenesis. Mol. Biol. Cell. 26, 1875–1886.
Montaville P., Jegou A., Pernier J., Compper C., Guichard B., Mogessie B., Schuh M., Lemonne G.R., Carlier M.F. (2014) Spire and Formin 2 synergize and antagonize in regulating actin assembly in meiosis by a ping-pong mechanism. PLoS Biol. 12, e1001795.
Pfender S., Kuznetsov V., Pleiser S., Kerkhoff E., Schuh M. (2011) Spire-type actin nucleators cooperate with Formin-2 to drive asymmetric oocyte division. Curr. Biol. 21, 955–960.
Liu R., Abreu-Blanco M.T., Barry K.C., Linardopoulou E.V., Osborn G.E. (2009) Wash functions downstream of Rho and links linear and branched actin nucleation factors. Development. 136, 2849–2860.
Dahmann C., Oates A.C., Brand M. (2011) Boundary formation and maintenance in tissue development. Nat. Rev. Genet. 12, 43–55.
Laplante C., Nilson L.A. (2006) Differential expression of the adhesion molecule Echinoid drives epithelial morphogenesis in Drosophila. Development. 133, 3255–3264.
Nishimura M., Inoue Y., Hayashi S. (2007) A wave of EGFR signaling determines cell alignment and intercalation in the Drosophila tracheal placode. Development. 134, 4273–4282.
Osterfield M., Du X., Schupbach T., Wieschaus E., Shvartsman S.Y. (2013) Three-dimensional epithelial morphogenesis in the developing Drosophila egg. Dev. Cell. 24, 400–410.
Roper K. (2012) Anisotropy of Crumbs and aPKC drives myosin cable assembly during tube formation. Dev. Cell. 23, 939–953.
Fagotto F. (2014) The cellular basis of tissue separation. Development. 141, 3303–3318.
Kiehart D.P., Galbraith C.G., Edwards K.A., Rickoll W.L., Montague R.A. (2000) Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J. Cell Biol. 149, 471–490.
Jacinto A., Wood W., Woolner S., Hiley C., Turner L., Wilson C., Martinez-Arias A., Martin P. (2002) Dynamic analysis of actin cable function during Drosophila dorsal closure. Curr. Biol. 12, 1245–1250.
Major R.J., Irvine K.D. (2006) Localization and requirement for myosin II at the dorsal ventral compartment boundary of the Drosophila wing. Dev. Dyn. 235, 3051–3058.
Steinberg M.S. (1963) Reconstruction of tissues by dissociated cells. Some morphogenetic tissue movements and the sorting out of embryonic cells may have a common explanation. Science. 141, 401–408.
Monier B., Pelissier-Monier A., Brand A.H., Sanson B. (2010) An actomyosin-based barrier inhibits cell mixing at compartmental boundaries in Drosophila embryos. Nat. Cell Biol. 12, 60–65.
Hutson M.S., Tokutake Y., Chang M.S., Bloor J.W., Venakides S., Kiehart D.P., Edwards G.S. (2003) Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300, 145–149.
Landsberg K.P., Farhadifar R., Ranft J., Umetsu D., Widmann T.J., Bittig T., Said A., Jülicher F., Dahmann C. (2009) Increased cell bond tension governs cell sorting at the Drosophila anteroposterior compartment boundary. Curr. Biol. 19, 1950–1955.
Aliee M., Roper J.C., Landsberg K.P., Pentzold C., Widmann T.J., Jülicher F., Dahmann C. (2012) Physical mechanisms shaping the Drosophila dorsoventral compartment boundary. Curr. Biol. 22, 967–976.
Krieg M., Arboleda-Estudillo Y., Puech P.H., Kafer J., Graner F., Muller D.J., Heisenberg C.P. (2008) Tensile forces govern germ-layer organization in zebrafish. Nat. Cell Biol. 10, 429–436.
Rohani N., Canty L., Luu O., Fagotto F., Winklbauer R. (2011) EphrinB/EphB signaling controls embryonic germ layer separation by contact-induced cell detachment. PLoS Biol. 9, e1000597.
Fagotto F., Rohani N., Touret A.S., Li R. (2013) A molecular base for cell sorting at embryonic boundaries: contact inhibition of cadherin adhesion by ephrin/Eph-dependent contractility. Dev. Cell. 27, 72–87.
Umetsu D., Dunst S., Dahmann C. (2014) An RNA interference screen for genes required to shape the anteroposterior compartment boundary in Drosophila identifies the Eph receptor. PLoS One. 9, e114340.
Wei S.Y., Escudero L.M., Yu F., Chang L.H., Chen L.Y., Ho Y.H., Lin C.M., Chou C.S., Chia W., Modolell J., Hsu J.C. (2005) Echinoid is a component of adherens junctions that cooperates with DE-Cadherin to mediate cell adhesion. Dev. Cell. 8, 493–504.
Pare A.C., Vichas A., Fincher C.T., Mirman Z., Farrell D.L., Mainieri A., Zallen J.A. (2014) A positional Toll receptor code directs convergent extension in Drosophila. Nature. 515, 523–527.
Cooke J.E., Moens C.B. (2002) Boundary formation in the hindbrain: Eph only it were simple. Trends Neurosci. 25, 260–267.
Umetsu D., Aigouy B., Aliee M., Sui L., Eaton S., Jülicher F., Dahmann C. (2014) Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr. Biol. 24, 1798–1805.
Cayuso J., Xu Q., Wilkinson D. (2015) Mechanisms of boundary formation by Eph receptor and ephrin signaling. Dev. Biol. 401, 122–131.
Calzolari S., Terriente J., Pujades C. (2014) Cell segregation in the vertebrate hindbrain relies on actomyosin cables located at the interhombomeric boundaries. EMBO J. 33, 686–701.
Blankenship J.T., Backovic S.T., Sanny J.S., Weitz O., Zallen J.A. (2006) Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev. Cell. 11, 459–470.
Симонова О.Б., Бурдина Н.В. (2009) Морфогенетическое движение клеток в эмбриогенезе Drosophila: механизмы и генетический контроль. Онтогенез. 40, 355–372.
Fernandez-Gonzalez R., Simoes S., Roper J.C., Eaton S., Zallen J.A. (2009) Myosin II dynamics are regulated by tension in intercalating cells. Dev. Cell. 17, 736–743.
Ren Y., Effler J.C., Norstrom M., Luo T., Firtel R.A., Iglesias P.A., Rock R.S., Robinson D.N. (2009) Mechanosensing through cooperative interactions between myosin II and the actin crosslinker cortexillin I. Curr. Biol. 19, 1421–1428.
Simoes S., Mainieri A., Zallen J.A. (2014) Rho GTPase and Shroom direct planar polarized actomyosin contractility during convergent extension. J. Cell Biol. 204, 575–589.
Nishimura T., Takeichi M. (2008) Shroom3-mediated recruitment of Rho kinases to the apical cell junctions regulates epithelial and neuroepithelial planar remodeling. Development. 135, 1493–1502.
Mamon L.A., Ginanova V.R., Kliver S.F., Yakimova A.O., Atsapkina A.A., Golubkova E.V. (2017) RNA-binding proteins of the NXF (nuclear export factor) family and their connection with the cytoskeleton. Cytoskeleton. 74, 161–169.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


