Молекулярная биология, 2019, T. 53, № 1, стр. 16-27
Идентификация двух GLOBOSA-подобных генов с MADS-боксом в растениях чая (Camellia sinensis [L.] O. Kuntze)
K. Zhou a, Q.-X. Cao a, C.-M. Jin a, Y.-Y. Niu a, G.-L. Li a, J.-J. Zhang a, *
a Key Laboratory of the Ministry of Education for Medicinal Resources and Natural Pharmaceutical Chemistry,
National Engineering Laboratory for Resource Development of Endangered Crude Drugs in Northwest of China,
College of Life Sciences, Shaanxi Normal University
710119 Shaanxi, Xi’an, People’s Republic of China
* E-mail: zhangjinjin@snnu.edu.cn
Поступила в редакцию 22.03.2018
После доработки 04.06.2018
Принята к публикации 25.06.2018
Аннотация
Растения чая (Camellia sinensis [L.] O. Kuntze) – культура, имеющая большое экономическое значение. Однако молекулярные механизмы регуляции развития цветков изучены недостаточно. Из C. sinensis Ziyangzhong нами выделены два GLOBOSA (GLO)-подобных гена, кодирующих белки CsGLO1 и CsGLO2 с MADS-боксом, которые были охарактеризованы с целью выяснения их роли в развитии цветков. Обнаружено, что CsGLO1 и CsGLO2 – это локализованные в ядре факторы транскрипции, неспособные к трансактивации, но хорошо взаимодействующие друг с другом. Эти факторы имеют сходные паттерны экспрессии, ограниченной преимущественно лепестками и тычинками. Более того, эктопическая экспрессия CsGLO1 или CsGLO2 в Arabidopsis thaliana приводит к частичному превращению чашелистиков в лепестки, что свидетельствует о функциональной активности GLOBOSA. Нами впервые описана роль этих генов в развитии цветков у растений чая и показано, что паралоги CsGLO1 и CsGLO2 вносят существенный вклад в развитие лепестков и тычинок.
ВВЕДЕНИЕ
Цветки большинства покрытосеменных, включая растения чая (Camellia sinensis [L.] O. Kuntze), состоят из четырех типов органов, организованных в виде концентрических мутовок от периферии к центру: чашелистиков, лепестков, тычинок и плодолистиков [1]. На основе анализа гомеотических флоральных мутантов Arabidopsis thaliana и Antirrhinum majus предложена модель ABC развития цветка, согласно которой для установления идентичности органов цветка требуется кооперативное взаимодействие генов трех классов [2, 3]. Гены класса A определяют чашелистики, A и B – лепестки; B и C – тычинки, а C – плодолистики [3]. Модель ABC была расширена до варианта ABC(DE), в котором гены класса D контролируют развитие семяпочки, а гены класса E кодируют кофакторы белков-продуктов генов A, B и C [4]. Предполагается, что функции генов класса А могут быть специфичными для семейства Brassicaceae, тогда как функции генов других классов консервативны у цветковых растений [5].
В модели ABC(DE) все белки идентичности цветков, за исключением APETALA2 (AP2), представляют собой типичные факторы транскрипции с MADS-боксом типа MIKCc [5]. Факторы транскрипции с MADS-боксом, представленные двумя типами – I и II, участвуют в регуляции разнообразных процессов развития. У растений факторы транскрипции с MADS-боксом типа II обычно называют белками MIKCc-типа в соответствии со структурой их консервативного домена [6]. Наиболее консервативный домен MADS способен связываться с CArG-боксами. Домен типа I характеризуется большей вариабельностью последовательности и структуры, чем домен K (кератин). Эти два домена участвуют в белок-белковых взаимодействиях [7]. Кроме того, наименее консервативный С-концевой домен участвует, вероятно, в трансактивации генов-мишеней и формировании мультимерных комплексов.
Гены класса В играют важную роль в детерминации идентичности лепестков и тычинок. Для однозначного определения этих двух органов у An. majus и A. thaliana белки GLOBOSA (GLO)/PISTILLATA (PI) и DEFICIENS (DEF)/APETALA3 (AP3) должны формировать oблигатные гетеродимеры [8–11]. Функциональные мутации в этих генах приводят к появлению гомеотических мутантов, у которых лепестки превратились в чашелистики, а тычинки в плодолистики [8–11]. Филогения генов класса В показывает, что и Antirrhinum, и Arabidopsis имеют сходную, но не одинаковую B-систему, в которой, по-видимому, отсутствует ген TOMATO MADS6 (TM6), а ген PI представлен единственной копией [12]. Действительно, хорошо изучены несколько событий дупликации двух генов класса B в ходе эволюции покрытосеменных. Главное событие дупликации у истинных эудикот привело к появлению клады euAP3 и клады TM6 в линии AP3 [13, 14]. В линии PI дупликации происходили и у Ericales, и у Астерид. Однако эти дупликации не коррелировали с дупликациями AP3-подобных генов. У Астерид дупликации PI, которые сохранялись преимущественно у значительного числа вымерших видов [12], привели к появлению взаимозаменяемых функций PI в ходе процессов субфункционализации у Petunia hybrida, Nicotiana benthamiana и Solanum lycopersicum, что внесло вклад в морфологическое разнообразие и адаптивную эволюцию околоцветника у представителей семейства Solanaceae [15–17]. Например, FLORAL BINDING PROTEIN1 (FBP1) и PETUNIA MADS BOX GENE2 (PMADS2) – два PI-паралога P. hybrida действуют совместно при развитии лепестков и тычинок, причем FBP1 важен для слияния тычиночных нитей со сростнолепестным венчиком [18]. Напротив, PfGLO2 утратил свою роль в детерминации органов у Physalis floridana, но сохранил свои функции в созревании пыльцы, благодаря процессам дивергенции дуплицированных гетеродимеров GLO-DEF [19, 20].
Растения чая (C. sinensis [L.] O. Kuntze), принадлежащие к семейству Theaceae, являются экономически важной культурой [21]. Описаны молекулярные механизмы контроля физиологических, биохимических и метаболических процессов в растениях чая [22, 23], но данные о развитии цветков до сих пор ограничены. Прогресс в селекции чая сдерживается самонесовместимостью и низкой завязываемостью семян, прямо или опосредованно связанными с развитием цветков [24, 25]. В настоящей работе из растений C. sinensis Ziyangzhong выделены два GLO-подобных гена с MADS-боксом (CsGLO1 и CsGLO2), изучена их филогения, паттерны экспрессии, субклеточная локализация и трансактиваторная активность их продуктов. Кроме того, взаимодействие между CsGLO1 и CsGLO2 показано и в двухгибридной дрожжевой системе, и методом бимолекулярной комплементации флуоресценции (BiFC). Более того, для изучения и сравнения функций CsGLO1 и CsGLO2 в детерминации лепестков и тычинок мы проанализировали эктопическую экспрессию в трансгенных растениях A. thaliana. В целом, нами впервые получены данные о роли CsGLO1 и CsGLO2 в развитии цветков у C. sinensis.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал. В работе использовали 10-летние растения C. sinensis Ziyangzhong, выращенные в Институте чая Цзыяна (Tea Plant Institute Ziyang Ankang (Ankang, Shaanxi, China)) из культуры зародышей (germplasm nursery) при естественном освещении. Цветочные и листовые почки собирали в мае–июне, тогда как чашелистики, лепестки, тычинки и плодолистики брали с распустившихся цветков в октябре. Все образцы замораживали и жидком азоте и хранили при –80°C до проведения анализа. Растения дикого типа и трансгенные растения A. thaliana экотипа Columbia растили в комнатных условиях при 22°C в режиме 16 ч свет и 8 ч темнота.
Синтез кДНК CsGLO1 и CsGLO2. Суммарную РНК экстрагировали из цветочных почек с использованием набора Wolact® Plant RNA Isolation Kit (“Klink”, Китай). Первую цепь кДНК синтезировали с помощью обратной транскриптазы MMLV (“TaКaRa”, Япония), следуя инструкциям изготовителя. Консервативные фрагменты CsGLO1 и CsGLO2 амплифицировали на кДНК из цветочных почек с праймерами, сконструированными на основе консервативных участков ортологов GLO из других видов растений, используя программу Primer Premier 5.0 (табл. S1 , см. Приложение на сайте http://www.molecbio.ru/downloads/2019/1/supp_Zhou_rus.pdf). Использовали следующие условия ПЦР: денатурация – 94°C, 5 мин; 35 циклов – 94°C, 30 с; 49°C, 30 с; 72°C, 1 мин; конечная достройка – 72°C, 10 мин. Полученные ампликоны очищали и клонировали в векторе pGEM®-T Easy (“Promega”, США), а затем секвенировали в BGI. Для быстрой амплификации концов кДНК (RACE) очищенную суммарную РНК подвергали обратной транскрипции с адапторными праймерами в соответствии с рекомендациями производителя (“Clontech”, США). Опираясь на частичные последовательности CsGLO1 и CsGLO2, сконструировали генспецифичные праймеры для 3'RACE и 5'RACE (табл. S1 ). Реконструировали последовательности, полные кодирующие последовательности подтверждали с помощью ПЦР-амплификации и секвенирования.
Анализ последовательностей и филогенетический анализ. Поиск консервативных доменов проводили с помощью программы Prosite (http:// prosite.expasy.org/). Для поиска гомологичных последовательностей использовали программу BLAST сайта NCBI (http://www.ncbi.nlm.nih.gov/). Информация обо всех последовательностях, выявленных в базе данных NCBI, представлена в табл. S2 . Выведенные аминокислотные последовательности, кодируемые CsGLO1 и CsGLO2, выравнивали с последовательностями белков GLO, кодируемых ортологичными генами, используя программу DNAMAN 5.0. На основе последовательностей выровненных белков (табл. S2 ), сконструировали филогенетическое дерево, используя метод ближайших соседей и программу MEGA 5.1 (http://www.megasoftware.net/).
Количественная обратная транскрипция-ПЦР (ОТ-кПЦР). Суммарную РНК выделяли из разных органов и тканей, используя набор Wolact® Plant RNA Isolation Kit (“Klink”). Целостность и количество РНК в образцах оценивали с помощью электрофореза в 1.2%-ном агарозном геле и спектрофотометрически (NanoDrop 2000C, “Thermo Fisher Scientific”, США) соответственно. Первую цепь кДНК синтезировали с помощью PrimeScript®RT Master (“TaКaRa”). Праймеры для ОТ-кПЦР подбирали с помощью программы Primer Premier 5.0 (табл. S1 ) и проверяли на специфичность перед проведением количественного анализа; ген CsCLATHRIN1 (KA291473.1) использовали в качестве внутреннего контроля [26]. Реакции проводили в приборе Bio-Rad CFX96TM Real-Time (“Bio-Rad”, США), используя смеси Maxima SYBR Green/Fluorescein qPCR Master Mix (“Thermo Fisher Scientific”). Каждый образец анализировали в трех повторностях. Относительный уровень экспрессии каждого гена рассчитывали согласно методу 2–ΔΔCt [27].
Анализ временной экспрессии белка. Субклеточная локализация CsGLO1 и CsGLO2 была предсказана с использованием программы WoLF PSORT Prediction (http://wolfpsort.org). Полные кодирующие последовательности CsGLO1 или CsGLO2 без стоп-кодонов встраивали в экспрессионный вектор pCAMBIA1302 по сайтам рестрикции NcoI–SpeI (“TaKaRa”). Получили последовательности, кодирующие слитые белки CsGLO1 или CsGLO2 с присоединенным к С-концу зеленым флуоресцентным белком (GFP) соответственно (табл. S1 ). Рекомбинантные GFP-конструкции трансформировали в штамм GV3101 Agrobacterium tumefaciens и с помощью агроинфильтрации вводили в клетки эпидермиса лука. Клетки, несущие пустой вектор pCAMBIA1302-GFP, использовали в качестве контроля. Флуоресцентный сигнал GFP детектировали через 48 ч после трансфекции, используя сканирующий лазерный конфокальный микроскоп (Leica TCS SP5; “Leica”, ФРГ).
Определение транскрипционной активности. Полную кодирующую последовательность CsGLO1 или CsGLO2 встраивали по NcoI—BamHI-сайтам в pGBKT7 в рамке считывания с ДНК-связывающим доменом GAL (табл. S1 ). Рекомбинантные конструкции вводили последовательно в штамм AH109 Saccharomyces cerevisiae в соответствии с рекомендациями производителя (“Clontech”), трансформированные клетки высевали на чашки с синтетической декстрозной средой, лишенной лейцина и/или триптофана (SD/-Leu-Trp или /-Trp). Выжившие клетки переносили на чашки с селективной средой, лишенной гистидина и аденина (SD/-His-Ade), и чашки со средой YPDA (Yeast Extract Peptone Dextrose Adenine Medium) и инкубировали при 28°C в течение 2–5 дней. Трансактивационные активности оценивали по росту выживших клеток. Пустым вектором pGBKT7 и pGBKT7-53+pGADT7-T (“Clontech”) трансформировали клетки дрожжей, полученные трансформанты использовали как отрицательный и положительный контроль соответственно.
Скрининг в дрожжевой двухгибридной системе. Полные кодирующие последовательности CsGLO1 или CsGLO2 встраивали по сайтам EcoRI–BamHI в вектор pGADT7 (табл. S1 ). Рекомбинантные конструкции вводили в штамм АН109 S. cerevisiae и высевали на чашки с SD/-Leu-Trp. Выжившие клетки переносили на чашки с селективной средой, лишенной лейцина, триптофана, гистидина и аденина (SD/-Leu-Trp-His-Ade), а также на чашки YPDA и инкубировали при 28°C в течение 2–5 дней. Трансактивационную активность определяли по росту выживших клеток. Пустыми векторами pGBKT7-lam+pGADT7-T и pGBKT7-53+pGADT7-T (“Clontech”) котрансформировали клетки дрожжей, и трансформанты использовали в качестве отрицательного и положительного контроля.
BiFC-анализ. Для проведения BiFC-анализа сконструировали векторы pSPYNE и pSPPYCE. Полные кодирующие последовательности CsGLO1 или CsGLO2 клонировали в два вектора – pSPYNE-35S и pSPYCE-35S, соответственно, по сайтам рестрикции BamHI–KpnI (табл. S1 ). Эти два вектора предназначены для экспрессии N- или C-концевых половин желтого флуоресцентного белка (YFP). Рекомбинантными векторами трансформировали бактерии A. tumefaciens GV3101, которые затем вводили в клетки эпидермиса листьев N. benthamiana [28]. Флуоресцентный сигнал YFP детектировали через 72 ч после инъекции с использованием конфокального лазерного сканирующего микроскопа (Leica TCS SP5).
Трансформация и анализ A. thaliana. Амплифицировали полные кодирующие последовательности CsGLO1 или CsGLO2 и клонировали их по BamHI—KpnI-сайтам в бинарный вектор pCAMBIA2300 (табл. S1 ). Получили конструкции 35S::CsGLO1 и 35S::CsGLO2, которые вводили в клетки A. tumefaciens GV3101 и использовали для трансформации A. thaliana методом погружения цветка с небольшими модификациями [29]. Трансформанты, выросшие на половинной среде Мурасиге-Скуга, содержащей канамицин (50 мг/л), проверяли с помощью ПЦР и ОТ-кПЦР [29, 30].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выделение и анализ нуклеотидных последовательностей двух GLO-подобных генов
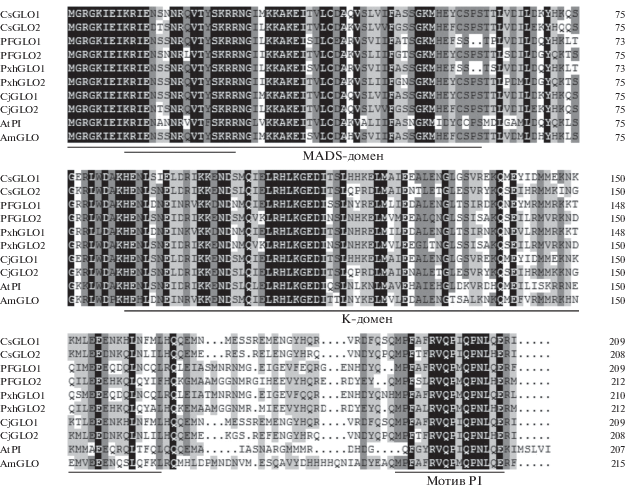
Из дифференцированных цветочных почек с использованием ОТ-кПЦР и RACE были выделены два GLO-подобных гена с MADS-боксом. Филогенетический анализ и анализ последовательностей показал, что два GLO-подобных гена относятся к кладе генов GLO класса В. Они были названы CsGLO1 (GenBank аcc. no. KJ630568) и CsGLO2 (GenBank аcc. no. KJ630569) (рис. 1). Ген CsGLO1 кодирует белок из 209 аминокислотных остатков, на 64% сходный с AtPI (A. thaliana), 68% – с AmGLO (An. majus) и 99% – CjGLO1 (C. japonica), а ген CsGLO2 кодирует белок из 208 аминокислотных остатков, сходный на 60% с AtPI (A. thaliana), 62% с AmGLO (An. majus) и 96% – с CjGLO2 (C. japonica). Анализ последовательностей выявил MADS- и K-домены, и мотив PI с консенсусной кор-последовательностью MPFxFRVQPxQPNLQE в C-концевой области, высококонсервативные у CsGLO1 и CsGLO2 (рис. 1). Более того, аминокислотные последовательности CsGLO1 и CsGLO2 идентичны на 80.38%, что указывает на возможное сходство их функций.
Рис. 1.
Выравнивание выведенных аминокислотных последовательностей CsGLO1, CsGLO2 и других последовательностей GLOBOSA покрытосеменных. Подчеркнуты высококонсервативные области, включая MADS- и К-домены, а также мотив PI; двойной чертой показана двухчастная последовательность ядерной локализации (NLS); черным выделены участки 100%-ного сходства аминокислотных последовательностей, темно-серым – участки 75–100% сходства; светло-серым – 50–75% сходства.
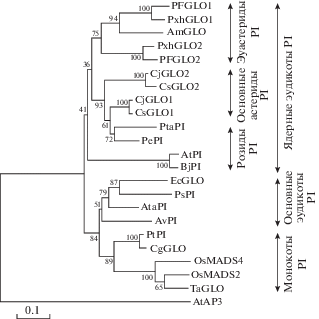
Для дальнейшего изучения филогенетических связей CsGLO1 и CsGLO2 с использованием 19 ортологичных последовательностей и AtAP3 в качестве внешней группы было сконструировано филогенетическое дерево (табл. S2 , см. Приложение на сайте http://www.molecbio.ru/downloads/2019/1/ supp_Zhou_rus.pdf). Показано, что CsGLO1 и CsGLO2 характеризуются близким родством с CjGLO1 и CjGLO2 соответственно. Подтверждена консервативность CsGLO1 и CsGLO2, что свидетельствует о существовании общего предка GLO у этих паралогов (рис. 2).
Паттерны пространственной экспрессии CsGLO1 и CsGLO2
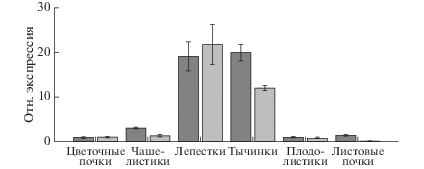
Для выяснения роли CsGLO1 и CsGLO2 в репродуктивном росте растений чая методом ОТ-кПЦР проанализировали паттерны их экспрессии и обнаружили их сходство. Экспрессию обоих генов выявили во всех изученных тканях, однако максимальным уровень был в лепестках и тычинках (рис. 3).
Субклеточная локализация CsGLO1 и CsGLO2
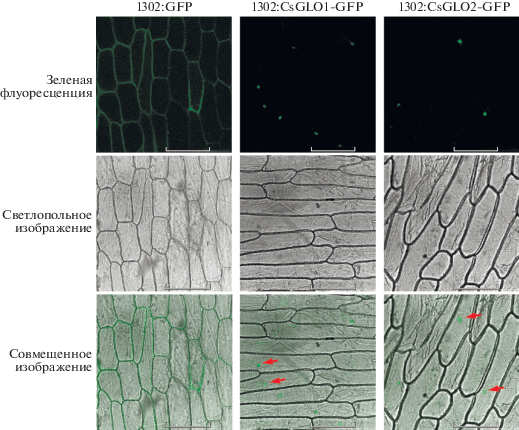
CsGLO1 и CsGLO2 содержат предполагаемый консервативный двухчастный NLS с консенсусом “PP(N)10(P3N2)” (рис. 1). Поэтому мы предсказали, что CsGLO1 и CsGLO2 локализуются в ядре. Действительно, анализ субклеточной локализации показал, что оба белка находятся исключительно в ядрах клеток эпидермиса лука, тогда как контрольный белок (GFP) распределен по всей клетке (рис. 4).
Aнализ трансактивационной активности и взаимодействий
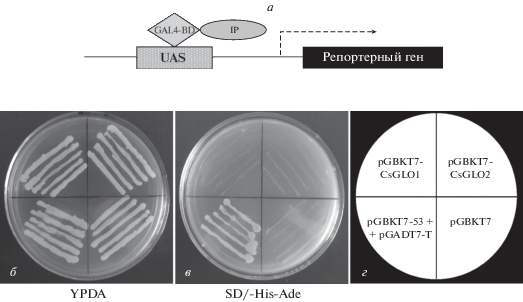
Транскрипционную активность CsGLOs определяли, используя двухгибридную дрожжевую систему. Показано, что клетки дрожжей, несущие pGBKT7-CsGLO1, pGBKT7-CsGLO2 или pGBKT7, за исключением положительного контроля, не обладали способностью к хорошему росту на среде SD/-His-Ade (рис. 5), что указывает на отсутствие у CsGLO1 или CsGLO2 трансактивационнной активности.
Рис. 5.
Aнализ трансактивационной активности CsGLO1 и CsGLO2. а – Схема активируемой экспрессии репортерного гена в клетках дрожжей. UAS – вышележащая активирующая последовательность; GAL4-BD – ДНК-связывающий домен GAL4; IP – целевой белок. Стрелка показывает направление транскрипции репортерного гена. б и в – Рост трансформированных клеток дрожжей AH109 на чашке с YPDA и на чашке с селективной средой без гистидина и аденина (SD/-His-Ade). г – Панель, показывающая положение каждого штамма дрожжей.
Взаимодействие CsGLO1 и CsGLO2
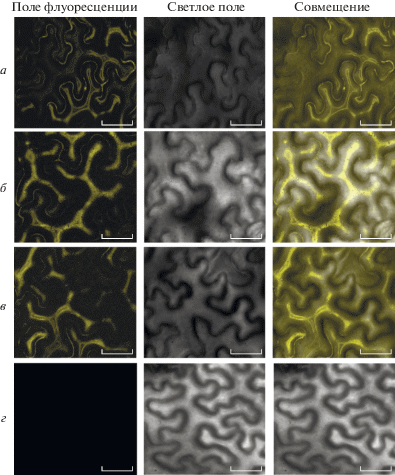
Белок-белковые взаимодействия важны для осуществления функций белков с MADS-боксом. Для выявления потенциального взаимодействия между CsGLO1 и CsGLO2 использовали дрожжевую двухгибридную систему. Как показано на рис. 6, клетки дрожжей, несущие pGBKT7-CsGLO1+pGADT7-CsGLO2, pGBKT7-CsGLO2+pGADT7-CsGLO1 или pGBKT7-53+pGADT7-T, хорошо растут на среде SD/-Trp-Leu-His-Ade (рис. 6), что указывает на сильное позитивное взаимодействие между CsGLO1 и CsGLO2. Для подтверждения этих данных проведен анализ BiFC (рис. 7). В цитоплазме клеток эпидермиса экспериментальных групп pSPYNE-CsGLO1 и pSPYCE-CsGLO2, pSPYNE-CsGLO1 и pSPYCE-CsGLO1, pSPYNE-CsGLO2 и pSPYCE-CsGLO2 наблюдали равномерную желтую флуоресценцию (рис. 7а–в), тогда как в отрицательном контроле (пустые векторы pSPYNE и pSPYCE) отсутствовал желтый флуоресцентный сигнал (рис. 7г). Эти результаты указывают на сильное взаимодействие между CsGLO1 и CsGLO2, CsGLO1 и CsGLO1, а также CsGLO2 и CsGLO2.
Рис. 6.
Анализ взаимодействия CsGLO1 и CsGLO2 в двухгибридной дрожжевой системе. а – Схема активируемой экспрессии репртерного гена в клетках дрожжей. GAL4-BD и GAL4-AD – ДНК-связывающий и активаторный домены GAL4 соответственно; X и Y – исследуемые белки. б и в – Рост трансформированных клеток дрожжей AH109 на среде YPDA и селективной среде без лейцина, триптофана, гистидина и аденина и аденина (SD/-Trp-Leu-His-Ade). г – Панель, показывающая расположение каждого штамма дрожжей.
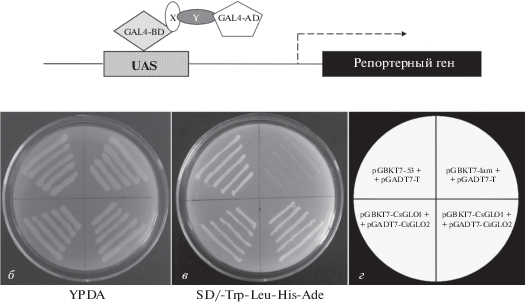
Рис. 7.
Анализ взаимодействия CsGLO1 и CsGLO2 в клетках эпидермиса листьев N. benthamiana методом бимолекулярной комплементации флуоресценции (BiFC). а – pSPYNE-CsGLO1 и pSPYCE-CsGLO1; б – pSPYNE-CsGLO2 и pSPYCE-CsGLO2; в – pSPYNE-CsGLO1 и pSPYCE-CsGLO2; г – pSPYNE и pSPYCE. Масштабная линейка 25 мкм.
Эктопическая экспрессия CsGLO1 или CsGLO2 в трансгенных растениях A. thaliana превращает чашелистики в лепестки
Система трансформации растений чая до сих пор не разработана из-за сложного культивирования тканей и системы регенерации. С целью изучения функций CsGLO1 или CsGLO2 получены трансгенные растения A. thaliana, эктопически экспрессирующие эти гены. Трансгенные растения T1, несущие 35S::CsGLO1 или 35S::CsGLO2 идентифицировали, используя ПЦР на геномной ДНК и ОТ-кПЦР с праймерами, специфичными к этим конструкциям (рис. 8), и сравнивали их развитие с развитием растений A. thaliana дикого типа. Как показано на рис. 9, первый мутовчатый орган у трансгенных растений T1 был мозаичным, состоящим из белой ткани, сходной с лепестками по краям, зеленой ткани, сходной с чашелистиками в середине и заметно раскрытым. Однако другие органы цветка развивались нормально. Отсутствовали видимые изменения роста и развития растений. Эти результаты подтверждают высокую консервативность функций CsGLO, CsGLO2 и GLO/PI в развитии цветка.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ABC-модель развития – одно из достижений молекулярной генетики растений – является прекрасной основой для сравнительного изучения развития цветка. К настоящему времени у разных видов растений идентифицировано и охарактеризовано большое число генов классов A, B и C. Однако отсутствует информация о нуклеотидных последовательностях и функциях их ортологов у растений чая. В настоящей работе, используя основанную на гомологии стратегию клонирования, мы выделили два новых GLO-подобных гена с MADS-боксом – CsGLO1 и CsGLO2. Продукты этих генов, белки CsGLO1 и CsGLO2, обладают высоким уровнем сходства с ранее охарактеризованными белками GLO/PI (рис. 1). Хорошо известно, что С-концевые домены белков с MADS-боксом вариабельны, но мотив PI с консенсусом кор-последовательности MPFxFRVQPxQPNLQE высококонсервативен у GLO/PI-подобных белков покрытосеменных [31]. В CsGLO1 и CsGLO2 нами идентифицированы также два консервативных PI-мотива – MPFAFRVQPIQPNLQE и MPFTFRVQPIQPNLHE соответственно. Кроме того, филогенетический анализ подтвердил происхождение обоих паралогов CsGLO от общего предка GLO. Все эти данные свидетельствуют о том, что CsGLO1 и CsGLO2 принадлежат к GLO-кладе генов с MADS-боксом класса B.
И CsGLO1, и CsGLO2 экспрессируются преимущественно во второй и третьей мутовках органов зрелых цветков (рис. 3), что согласуется с результатами работ, в которых показано, что GLO/PI и DEF/AP3 экспрессируются только или преимущественно в процессе развития второй и третьей мутовки [10, 11]. У видов Solanaceae, таких как P. hybrida, N. benthamiana и S. lycopersicum, два GLO-подобных паралогичных гена активно экспрессируются в примордиях лепестков и тычинок даже после их разделения [17, 18]. У видов Clermontia (Campanulaceae) гомологи PI экспрессируются во флоральных примордиях, а также во внешних мутовках органов цветка поздних стадий. Более того, гетеротопическая экспрессия двух гомологов PI в первой цветочной мутовке видов C. parviflora с двумя венчиками подтверждает функцию двух паралогов PI как полной единицы, поддерживающей гомеотическую идентичность лепестков [32].
У всех трансгенных растений A. thaliana, эктопически экспрессирующих полученные в нашей работе CsGLO1 или CsGLO2, наблюдалось частичное превращение чашелистиков в лепестки в первой мутовке (рис. 9). Эти результаты согласуются с данными, пролученными ранее при сверхэкспрессии AtPI in A. thaliana [33]. Таким образом, функции CsGLO1, CsGLO2 и PI, по-видимому, высококонсервативны и как у CsGLO1, так и у CsGLO2 зависят от AP3, который экспрессируется на низком уровне в чашелистиках. В цветках A. thaliana дикого типа AP3 экспрессируется в основаниях органов первой мутовки, и в органах второй и третьей мутовки, тогда как PI изначально экспрессируется в органах второй, третьей и четвертой мутовки. Таким образом, функция В является результатом перекрывающейся экспрессии AP3 и PI [33]. Поскольку или CsGLO1, или CsGLO2 конститутивно экспрессируются в цветках, функции B в первой мутовке ассоциированы с AP3, тогда как комбинация функций A и B ведет к развитию лепестков в органах первой мутовки. В целом, эти результаты свидетельствуют о том, что паралоги CsGLO способны выполнять функции B в ассоциации с генами DEF-клады.
Изучение временной динамики функций AP3/PI показало, что гетеродимеры AP3/PI связываются преимущественно с определенными наборами генов и регулируют их функции на разных стадиях развития цветка [34]. В настоящей работе показана ядерная локализация обоих паралогичных факторов транскрипции CsGLO (рис. 4), как и у PfGLO2 (P. floridana). Более того, анализ транскрипционной активности в клетках дрожжей показал, что два CsGLOs не обладают трансактивационной способностью (рис. 5), что предполагает необходимость формирования димерных или тетрамерных комплексов для регуляции генов-мишеней [35–37]. Анализ с использованием дрожжевой двухгибридной системы и BiFC выявил сильное взаимодействие между CsGLO1 и CsGLO2 (рис. 6 и 7). Тогда как AtAP3 и AtPI не локализуются в ядре, но образуют гетеродимеры AP3-PI в цитоплазме, которые могут входить в ядро и регулировать гены-мишени A. thaliana [38]. Кроме того, PfGLO2 P. floridana обладает способностью к ядерной локализации и может формировать гомодимеры [19, 20]. Наконец, SlGLO1 и SlGLO2 (S. lycopersicum) подобно TePI и TeAP3 (Tagetes erecta) различаются способностью к ядерной локализации и взаимодействиям, что указывает на видоспецифичность этих свойств у белков B-класса с MADS-боксом [39, 40]. Мы предполагаем, что CsGLO1 и CsGLO2 способны формировать гетеродимеры в цитоплазме, а затем поступать в ядро для регуляции экспрессии генов-мишеней, связываясь с промоторными участками. Таким образом, способность CsGLOs растений чая к специфической ядерной локализации и взаимодействиям указывает на то, что они могут играть важную роль в развитии цветка.
Дупликации генов класса В считаются важным эволюционным событием, которое привело к образованию линий DEF и GLO и высокому разнообразию цветков [17, 41]. Предполагается, что после дупликации паралоги GLO быстро приобрели адаптивные изменения в паттернах экспрессии и аминокислотных последовательностей, которые ведут к субфункционализации развития лепестков и тычинок [13]. Однако CsGLO1 и CsGLO2 имеют почти идентичные паттерны экспрессии (рис. 3). Необходим детальный анализ паттернов экспрессии в ходе развития цветков с использованием гибридизации in situ. Субфункционализацию двух копий GLO у Camellia japonica предположили на основании данных, полученных с использованием двухгибридной дрожжевой системы. CjGLO1 и CjGLO2 обладают большим сходством с CsGLO1 и CsGLO2 соответственно (рис. 1 и 2). Различия в аминокислотных последовательностях CsGLO1 и CsGLO2 намекают на субфункционализацию, однако трансгенные растения A. thaliana, сверхэкспрессирующие эти белки, имеют практически идентичный фенотип (рис. 9). Напротив, эктопическая экспрессия CjGLO1 или CjGLO2 приводит к разным фенотипам A. thaliana [42]. Наблюдаемые вариации аминокислотных последовательностей и взаимодействий белков часто не полностью объясняют паттерны функционализации. Так что дупликации GLO у Ericales (включая Camellia), по-видимому, приобрели разные и стабильные функции [13]. Тем не менее, функционально дивергентные паттерны дуплицированных генов класса B подтверждают надежность и способность к эволюции функций генов класса B в процессе развития цветков. Более того, устойчивое взаимодействие CsGLO1 и CsGLO2 (рис. 6) показывает, что 19.62% различий в последовательностях CsGLO1 и CsGLO2 недостаточно для возникновения абсолютной субфункционализации, и что два паралога могут выполнять свою роль в развитии лепестков и тычинок путем формирования гетеродимеров [15–17]. Таким образом, необходимо дальнейшее тщательное изучение субфункционализации и взаимодействий CsGLO1 и CsGLO2.
ЗАКЛЮЧЕНИЕ
Нами выделены и охарактеризованы два GLO-подобных гена, CsGLO1 и CsGLO2. Получены первые данные об их роли в развитии цветков у растений чая. Оба белка – и CsGLO1, и CsGLO2 – являются ядерными факторами транскрипции, но не обладают способностью к трансактивации. Различия в аминокислотных последовательностях этих белков недостаточны для их абсолютной субфункционализации, и оба белка могут вносить вклад в развитие лепестков и тычинок путем формирования гетеродимера. Дальнейшее изучение взаимодействия белков и их функций может помочь лучше понять функциональную дивергенцию CsGLO1 и CsGLO2 в развитии цветков у растений чая.
Авторы благодарят Dr. Ya-zhou Yang (College of Horticulture, Northwest A&F University) за доказательство эктопической экспрессии и векторы для экспрессии в дрожжах.
Выполнение работы поддержано National Natural Science Foundation of China (31770333), Natural Basic Research Projects in Shaanxi Province (2014JM3075) и Fundamental Research Funds for the Central Universities (GK201503048).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Meyerowitz E.M., Smyth D.R., Bowman J.L. (1989) Abnormal flowers and pattern formation in floral development. Development. 106, 209–217.
Coen E.S. (1991) The role of homeotic genes in floral development and evolution. Plant Mol. Biol. 42, 241–279.
Weigel D., Meyerowitz E.M. (1994) The ABCs of floral homeotic genes. Cell. 78, 203–209.
Ó’Maoiléidigh D.S., Graciet E., Wellmer F. (2014) Gene networks controlling Arabidopsis thaliana flower development. New Phytol. 201, 16–30.
Wellmer F., Graciet E., Riechmann J.L. (2014) Specification of floral organs in Arabidopsis. J. Exp. Bot. 65, 1–9.
Gramzow L., Theissen G. (2010) A hitchhiker’s guide to the MADS world of plants. Genome Biol. 11, 214.
Yang Y., Fanning L., Jack T. (2003) The K domain mediates heterodimerization of the Arabidopsis floral organ identity proteins, APETALA3 and PISTILLATA. Plant J. 33, 47–59.
Sommer H., Beltran J.P., Huijser P., Pape H., Lönnig W.E., Saedler H., Schwarz-Sommer Z. (1990) DEFICIENS, a homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus: the protein shows homology to transcription factors. EMBO J. 9, 605–613.
Jack T., Brockman L.L., Meyerowitz E.M. (1992) The homeotic gene APETALA3 of Arabidopsis thaliana encodes a MADS box and is expressed in petals and stamens. Cell. 68, 683–697.
Tröbner W., Ramirez L., Motte P., Hue I., Huijser P., Lönnig W.E., Saedler H., Sommer H., Schwarz-Sommer Z. (1992) GLOBOSA: a homeotic gene which interacts with DEFICIENS in the control of Antirrhinum floral organogenesis. EMBO J. 11, 4693–4704.
Goto K., Meyerowitz E.M. (1994) Function and regulation of the Arabidopsis floral homeotic gene PISTILLATA. Genes Dev. 8, 1548–1560.
Viaene T., Vekemans D., Irish V.F., Geeraerts A., Huysmans S., Janssens S., Smets E., Geuten K. (2009) Pistillata–duplications as a mode for floral diversification in (Basal) asterids. Mol. Biol. Evol. 26, 2627–2645.
Winter K.U., Weiser C., Kaufmann K., Bohne A., Kirchner C., Kanno A., Saedler H., Theissen G. (2002) Evolution of class B floral homeotic proteins: obligate heterodimerization originated from homodimerization. Mol. Biol. Evol. 19, 587–596.
Hernández-Hernández T., Martinez-Castilla L.P., Alvarez-Buylla E.R. (2007) Functional diversification of B MADS-box homeotic regulators of flower development: adaptive evolution in protein-protein interaction domains after major gene duplication events. Mol. Biol. Evol. 24, 465–481.
De Martino G., Pan I., Emmanuel E., Levy A., Irish V.F. (2006) Functional analyses of two tomato APETALA3 genes demonstrate diversification in their roles in regulating floral development. Plant Cell. 18, 1833–1845.
Rijpkema A.S., Royaert S., Zethof J., van der Weer-den G., Gerats T., Vandenbusscheet M. (2006) Analysis of the petunia TM6 MADS box gene reveals functional divergence within the DEF/AP3 lineage. Plant Cell. 18, 1819–1832.
Geuten K., Irish V. (2010) Hidden variability of floral homeotic B genes in Solanaceae provides a molecular basis for the evolution of novel functions. Plant Cell. 22, 2562–2578.
Vandenbussche M., Zethof J., Royaert S., Weterings K., Gerats T. (2004) The duplicated B-class heterodimer model: whorl-specific effects and complex genetic interactions in Petunia hybrida flower development. Plant Cell. 16, 741–754.
Zhang J.S., Li Z., Zhao J., Zhang.S., Quan H., Zhao M., He C. (2014) Deciphering the Physalis floridana Double-Layered-Lantern1 mutant provides insights into functional divergence of the GLOBOSA duplicates within the Solanaceae. Plant Physiol. 164, 748–764.
Zhang S., Zhang J.S., Zhao J., He C. (2015) Distinct subfunctionalization and neofunctionalization of the B-class MADS-box genes in Physalis floridana. Planta. 241, 387–402.
Yang C.S., Landau J.M. (2000) Effects of tea consumption on nutrition and health. J. Nutr. 130, 2409–2412.
Basu A., Sanchez K., Leyva M.J., Wu M., Betts N.M., Aston C.E., Lyons T.J. (2010) Green tea supplementation affects body weight, lipids, and lipid peroxidation in obese subjects with metabolic syndrome. J. Am. Coll. Nutr. 29, 31–40.
Mondal T.K., Bhattacharya A., Laxmikumaran M., Ahuja P.S. (2004) Recent advances of tea (Camellia sinensis) biotechnology. Plant Cell Tissue Organ Cult. 76, 195—254.
Takeda Y. (1990) Cross compatibility of tea (Camellia sinensis) and its allied species in the genus Camellia. Jpn. Agric. Resour. Q. 24, 111–116.
Tan L.Q., Wang L.Y., Wei K., Zhang C.-C., Wu L.-Y., Qi G.-N., Cheng H., Zhang Q., Cui Q.-M., Liang J.-B. (2013) Floral transcriptome sequencing for SSR marker development and linkage map construction in the tea plant (Camellia sinensis). PLoS One. 8, e81611.
Hao X., Horvath D.P., Chao W.S., Yang Y., Wang X., Xiao B. (2014) Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant (Camellia sinensis (L.) O. Kuntze). Int. J. Mol. Sci. 15, 22155–22172.
Livak K.J., Schmittgen T.D. (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCt method. Methods. 25, 402–408.
Walter M., Chaban C., Schütze K., Batistic O., Weckermann K., Näke C., Blazevic D., Grefen C., Schumacher K., Oecking C., Harter K., Kudla J. (2004) Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant J. 40, 428–438.
Clough S.J., Bent A.F. (1998) Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16, 735–743.
Davis A.M., Hall A., Millar A.J., Darrah C., Davis S.J. (2009) Protocol: Streamlined sub-protocols for floral-dip transformation and selection of transformants in Arabidopsis thaliana. Plant Methods. 5, 3–10.
Kramer E.M., Dorit R.L., Irish V.F. (1998) Molecular evolution of genes controlling petal and stamen development: duplication and divergence within the APETALA3 and PISTILLATA MADS-box gene lineages. Genetics. 149, 765–783.
Hofer K.A., Albert V.A. (2012) The double-corolla phenotype in the Hawaiian lobelioid genus Clermontia involves ectopic expression of PISTILLATA B-function MADS box gene homologs. EvoDevo. 3, 26.
Krizek B.A., Meyerowitz E.M. (1996) The Arabidopsis homeotic genes APETALA3 and PISTILLATA are sufficient to provide the B class organ identity function. Development. 122, 11–22.
Wuest S.E., O’Maoileidigh D.S., Rae L., Kwasniewska K., Raganelli A., Hanczaryk K., Lohan A.J., Loftus B., Graciet E., Wellmer F. (2012) Molecular basis for the specification of floral organs by APETALA3 and PISTILLATA. Proc. Natl. Acad. Sci. USA. 33, 13452–13457.
Prunet N., Jack T.P. (2014) Flower development in Arabidopsis: there is more to it than learning your ABCs. Methods Mol. Biol. 1110, 3–33.
Theissen G. (2001) Development of floral organ identity: stories from the MADS house. Curr. Opin. Plant Biol. 4, 75–85.
Immink R.G., Kaufmann K., Angenent G.C. (2010) The ‘ABC’ of MADS domain protein behaviour and interactions. Semin. Cell Dev. Biol. 21, 87–93.
Theissen G., Saedler H. (2001) Plant biology. Floral quartets. Nature. 409, 469–471.
Leseberg C.H., Eissler C.L., Wang X., Johns M.A., Duvall M.R., Mao L. (2008) Interaction study of MADS-domain proteins in tomato. J. Exp. Botany. 59, 2253–2265.
Ai Y., Zhang C., Sun Y., Wang W., He Y., Bao M. (2017) Characterization and functional analysis of five MADS-box B class genes related to floral organ identification in Tagetes erecta. PLoS One. 12, e0169777.
Geuten K., Viaene T., Irish V.F. (2011) Robustness and evolvability in the B-system of flower development. Ann. Bot. 107, 1545–1556.
Zhu G. (2011) Isolation of B-function MADS-box gene in Camellia japonica and its potential role in double flower formation. Chinese Acad. Forestry. 1–102.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология