Молекулярная биология, 2019, T. 53, № 1, стр. 44-52
MiR-222-3p, действующая на BTG2, регулирует пролиферацию и дифференцировку миобластов С2С12
D. L. Yang a, M. L. Gan a, Y. Tan a, G. H. Ge a, Q. Li b, Y. Z. Jiang c, G. Q. Tang a, M. Z. Li a, J. Y. Wang d, X. W. Li a, S. H. Zhang a, *, L. Zhu a, **
a Farm Animal Genetics Resources Exploration and Innovation Key Laboratory of Sichuan Province,
Sichuan Agricultural University
611130 Chengdu, China
b Sichuan Province General Station of Animal Husbandry
611130 Chengdu, China
c College of Life and Science, Sichuan Agricultural University
611130 Chengdu, China
d Chongqing Academy of Animal Sciences
402460 Chengdu, China
* E-mail: zhangsh1919@163.com
** E-mail: zhuli7508@163.com
Поступила в редакцию 21.01.2018
После доработки 30.04.2018
Принята к публикации 08.05.2018
Аннотация
MiR-222-3p участвует в пролиферации опухолевых клеток, а также играет важную роль в дифференцировке и созревании мышечных клеток. Однако роль этой микроРНК в пролиферации миобластов скелетных мышц не установлена. Нами показано, что в ходе пролиферации миобластов C2C12 уровень miR-222-3p сначала возрастает, а затем снижается. С использованием синтетических аналогов и ингибиторов микроРНК в экспериментах типа приобретения или потери функции показано, что сверхпродукция miR-222-3p в клетках С2С12 ускоряет пролиферацию миобластов и репрессирует образование мышечных волокон, в то время как снижение уровня miR-222-3p приводит к противоположному эффекту. С помощью программы предсказания мишеней микроРНК обнаружено, что потенциальной мишенью miR-222-3p может быть ген BTG2. В процессе формирования мышц синтетические аналоги miR-222-3p снижают уровень мРНК BTG2, в то время как ингибиторы miR-222-3p увеличивают содержание этого транскрипта. С использованием репортерной системы на основе генов двух разных люцифераз показано, что miR-222-3p является специфическим регулятором гена BTG2. Более того, установлено, что опосредованное малыми интерферирующими РНК снижение количества мРНК BTG2 в миобластах С2С12 ускоряет пролиферацию и супрессирует дифференцировку. Предложен новый механизм, согласно которому miR-222-3p регулирует пролиферацию и дифференцировку миобластов С2С12, влияя на уровень мРНК, кодируемой геном BTG2. Эти данные расширяют наши представления о роли микроРНК в развитии скелетных мышц.
ВВЕДЕНИЕ
Миогенез – это многостадийный процесс, включающий пролиферацию миобластов, а также их дифференцировку в мышечные трубочки, в ходе которой происходит специфическое слияние одноядерных миоцитов, образуется многоядерный синцитий, формируются и созревают мышечные волокна. В этом строго контролируемом процессе задействованы множественные регуляторы [1]. Ключевой процесс миогенеза – пролиферация миобластов – регулируется такими генами клеточного цикла, как гены циклинов D1 и E и циклинзависимой киназы 4 (CDK4) [2]. Выход из клеточного цикла и дифференцировка в мышечные трубочки управляется четырьмя миогенными регуляторными факторами: антигеном миогенной дифференцировки (MyoD), миогенным фактором 5 (Myf5), миогенином (MyoG) и миогенным регуляторным фактором 4 (Myf4) [3]. Именно MyoD и Myf5 считаются факторами, детерминирующими миогенез, хотя MyoG и Myf4 присутствуют в больших количествах на терминальной стадии дифференцировки и вызывают слияние миобластов с образованием мышечных трубочек [3]. Миогенез регулируется многими генами, однако регуляторы пролиферации и дифференцировки миобластов пока не идентифицированы.
Ген белка 2 транслокации клеток (BTG2) исходно был описан как опухолевый супрессор. Этот ген кодирует белок, принадлежащий к семейству белков BTG/TOB, члены которого регулируют клеточный цикл в различных типах клеток [4, 5]. Белок BTG2 проявляет антипролиферативную, антиапоптотическую и продифференцировочную активность [6]. Последние данные указывают на то, что ген BTG2 активно экспрессируется в сердечных и скелетных мышцах, причем его экспрессия возрастает при дифференцировке миобластов С2C12 [7]. Более того, снижение экспрессии BTG2 блокирует дифференцировку миобластов C2C12 [8]. Однако роль BTG2 в пролиферации и дифференцировке миобластов неясна. В частности непонятно, обладает ли BTG2 антипролиферативной активностью при дифференцировке миобластов.
МикроРНК – это малые некодирующие РНК (длиной примерно 22 н.), которые угнетают экспрессию генов на посттранскрипционном уровне, специфически связывая 3'-нетранслируемые участки (3'-UTR) для контроля стабильности мРНК и их трансляционной эффективности [9]. МикроРНК играют важную роль в развитии скелетных мышц, равно как и в регуляции пролиферации и дифференцировки мышечных клеток [10]. Более того, miR-133 ускоряет пролиферацию миобластов С2С12 и ингибирует их дифференцировку, действуя на фактор ответа на сыворотку (SRF) [11]. MiR-1 и miR-206 играют противоположные роли, регулируя гены-мишени, кодирующие гистондеацетилазу 4 (HDAC 4) и белок Pax7 соответственно [11, 12]. Кроме того, пролиферацию и дифференцировку миобластов регулирует множество микроРНК.
Согласно новым данным, уровень miR-222-3p, которой приписывали участие в пролиферации опухолевых клеток, снижен в ходе дифференцировки. Эта микроРНК может индуцировать замедление дифференцировки и созревания клеток в процессе гистогенеза мышц [13, 14]. Кроме того, установлено, что синтропин β1 (Sntb1) – ингибитор циклинзависимой киназы 1b (Cdkn1), факторы транскрипции MyoG и MyoD, нуклеопротеин AHNAK и белок, содержащий РНК-связывающий мотив 24 (Rbm24), играют важные роли на многих стадиях миогенеза, и одновременно служат мишенями miR-222-3p в мышечных клетках [13, 15, 16]. Несмотря на сообщения о множестве мишеней, функция miR-222-3p в пролиферации миобластов плохо охарактеризована, и ген BTG2, к настоящему времени не входит в список мишеней miR-222-3p.
Нами установлено, что сверхпродукция miR-222-3p ускоряет пролиферацию миобластов С2С12 и супрессирует пролиферацию, в то время как снижение уровня miR-222-3p оказывает противоположный эффект. По данным биоинформатического анализа BTG2 является потенциальной мишенью miR-222-3p. Более того, снижение уровня экспрессии BTG2 ускоряет пролиферацию и супрессирует дифференцировку миобластов С2С12. Эти результаты доказывают, что miR-222-3p регулирует пролиферацию и дифференцировку миобластов С2С12, воздействуя на функции гена BTG2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культура клеток. Миобласты С2С12 культивировали в среде DMEM (“Hyclone”, США), содержащей 10% фетальной сыворотки крупного рогатого скота, в атмосфере 5% CO2 при 37°С. Для индукции дифференцировки среду роста миобластов C2C12 по достижении 80% монослоя заменяли на дифференцировочную среду, состоящую из DMEM c 2% лошадиной сыворотки (“Gibco”, США).
РНК-олигонуклеотиды и трансфекция. Миобласты С2С12 рассевали по 12-луночным планшетам и культивировали до достижения 20–30% монослоя (в тестах по пролиферации) или до 80–90% (в опытах по дифференцировке) перед трансфекцией аналогами и ингибиторами miR-222-3p, контрольными РНК или малыми интерферирующими РНК (миРНК) к BTG2 (синтезированы “RiboBio”, Китай) с использованием реагента Lipofectamine 3000 (“Invitrogen”, Китай). При измерении скорости пролиферации и дифференцировки среду заменяли свежей каждые 24 ч, клетки собирали через 96 ч (в опытах по пролиферации) или через 8 дней (в случае дифференцировки).
Количественная ПЦР в реальном времени. Суммарную РНК экстрагировали реагентом TRIzol (“TaKaRa”, Китай) в соответствии с рекомендациями производителя. Реакцию обратной транскрипции на мРНК проводили с помощью набора SYBR PrimeScriptTM RT (“TaKaRa”) по инструкции производителя. В случае микроРНК реакцию обратной транскрипции проводили с помощью набора Mir-XTM miRNA для синтеза первой цепи (“TaKaRa”) по инструкции производителя. Количественную ПЦР в реальном времени мРНК и микроРНК проводили с помощью прибора CFX96 Real-Time PCR detection system (“Bio-Rad”, США) и красителя Power SYBR Green (“TaKaRa”) по инструкции производителей. В качестве нормировочного контроля при определении уровня мРНК и микроРНК использовали β-актин и U6 соответственно. Дифференциальную экспрессию мРНК и микроРНК анализировали с помощью метода ΔΔ2Ct [17]. Нуклеотидные последовательности праймеров представлены в табл. 1.
Таблица 1.
Последовательности праймеров, использованных в количественной ОТ-ПЦР, и синтетических РНК-олигонуклеотидов
| Ген | Праймер (5'–3') | Тпл, °С |
|---|---|---|
| Циклин D1 | F-TAGGCCCTCAGCCTCACTC | 60 |
| R-CCACCCCTGGGATAAAGCAC | ||
| Циклин E | F-GCTTGCTCCGGGGATGAAAT | 62 |
| R-GCGAGGACACCATAAGGAAATCTG | ||
| CDK4 | F-AGTTTCTAAGCGGCCTGGAT | 60 |
| R-AACTTCAGGAGCTCGGTACC | ||
| BTG2 | F- ACAGAAAAGACAAAGGTT | 60 |
| R- TTCACAAGGACAGAAGTAT | ||
| MRF4 | F-ATTCTTGAGGGTGCGGATTTCCTG | 60 |
| R-AAGACTGCTGGAGGCTGAGGCATC | ||
| MyoG | F-GCCCAGTGAATGCAACTCCCACA | 58 |
| R-CAGCCGCGAGCAAATGATCTCCT | ||
| MyoD | F-AGACTTCTATGATGACCCGTGTT | 57 |
| R-TCAGCGTTGGTGGTCTTGC | ||
| Myf5 | F-GAGCTGCTGAGGGAACAGGTGGAGA | 57 |
| R-GTTCTTTCGGGACCAGACAGGGCTG | ||
| MyHC | F-AGCAGCGACACTGAAATGGA | 60 |
| R-GTTGTCGTTCCTCACGGTCT | ||
| β-актин | F-TGGAATCCTGTGGCATC CATGAAAC | 60 |
| R-TAAAACGCAGCTCAG TAACAGTCCG | ||
| miR-222-3p | F-AGCUACAUCUGGCUACUGGGU | 60 |
| R- Uni-miR qPCR Primer, в составе набора (TaKaRa) | ||
| U6 | F-CTCGCTTCGGCAGCACA | 60 |
| R-AACGCTTCACGAATTTGCGT | ||
| si-BTG2 | GCAAGAACCAGATGATGCT | |
| wt-BTG2 3′-UTR | CAGCTTTATGGACAAATGTAAACTTTCTTTTTTGTTTTTA- ATAAAAATGTAGCAGATCGTGTAATGTGTAGAGAAGGT- GGAATTCCATAGC | |
| mut-BTG2 3′-UTR | CAGCTTTATGGACAAATGTAAACTTTCTTTTTTGTTTTTAA- TAAAATACATCGAGATCGTGTAATGTGTAGAGAAGGTGG- AATTCCATAGC |
Определение скорости пролиферации. Миобласты С2С12 растили в 96-луночных планшетах и трансфицировали аналогами или ингибиторами miR-222-3p, контрольными РНК и миРНК к BTG2. Пролиферацию клеток определяли через 0, 24, 48, 72 и 96 ч после трансфекции с помощью набора Cell Counting Kit 8 (ССК-8, “Beyotime”, Китай) в соответствии с инструкциями производителя. Скорость пролиферации клеток оценивали также с использованием EdU. Через 24 ч после трансфекции миобласты C2C12 культивировали в свежей среде DMEM, содержащей 10% фетальной сыворотки крупного рогатого скота и 10 мкМ EdU (“RiboBio”), в течение 2 ч. Затем клетки фиксировали, пермеабилизировали и окрашивали в соответствии с инструкцией. Клетки, содержащие EdU, визуализовали с помощью микроскопа Nikon TE2000 (“Nikon”, Япония).
Определение люциферазной активности с помощью двухлюциферазной репортерной системы. Клетки HeLa выращивали в 48-луночных планшетах до достижения 80–90% монослоя. Затем клетки котрансфицировали 13 нM аналога miR-222-3p или контрольной РНК и 0.25 мг плазмиды, содержащей кДНК люциферазы и 3'-UTR гена BTG2 дикого типа или 3'-UTR с мутацией в участке связывания miR-222-3p. Клетки собирали через 48 ч после трансфекции, активность люцифераз определяли, используя Dual-Glo Luciferase Assay System (“Promega“, США) в соответствии с инструкциями производителя. Относительную интенсивность флуоресценции рассчитывали, определяя соотношение сигналов люциферазы полипа Renilla и люциферазы светлячка.
Иммунофлуоресценция. Миогенную дифференцировку клеток C2C12 подтверждали путем иммунофлуоресцентного окрашивания на тяжелую цепь миозина скелетных мышц. Дифференцировку индуцировали в клетках, растущих в 12-луночных планшетах. Затем клетки трансфицировали аналогами и ингибиторами miR-222-3p, контрольными РНК, миРНК к BTG2 или контролем без РНК. Через 6 дней клетки дважды промывали фосфатно-солевым буфером (PBS), фиксировали 4%-ным параформальдегидом в течение 20 мин, а затем обрабатывали в течение 10 мин 0.2%-ным Тритоном X-100 в PBS при комнатной температуре. После инкубации в растворе 5%-ной нормальной козьей сыворотки в течение 1 ч клетки инкубировали в течение ночи при 4°С с антителами к тяжелым цепям миозина (“Bioss”, Китай), а затем с конъюгатом вторичных IgG (“Bioss”, Китай) при 37°C в течение 1 ч. Ядра клеток окрашивали с помощью DAPI (“Invitrogen”, США) в темноте. Изображения клеток получали с помощью оборудованного цифровой камерой флуоресцентного микроскопа (“Olympus”, Япония). Индекс слияния клеток рассчитывали в программе ImageJ с использованием трех изображений каждого образца.
Статистический анализ. Все количественные результаты представлены в виде средних значений ± стандартная ошибка (SEM). Различия между группами анализировали с помощью t-теста Стьюдента. Статистическую обработку проводили в программе SPSS 20.0. P < 0.05 считали показателем статистической значимости, а P < 0.01 – показателем высокой статистической значимости.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
MiR-222-3p ускоряет пролиферацию миобластов C2C12
Чтобы понять роль miR-222-3p в пролиферации миобластов C2C12, мы сначала определили уровни экспрессии этой микроРНК при различной плотности пролиферирующих клеток. Экспрессия miR-222-3p увеличивалась при достижении клетками 20–40% монослоя, однако при увеличении плотности клеток с 40 до 100% уровень miR-222-3p снижался (рис. 1а). Эти различия в уровне микроРНК в пролиферирующих клетках послужили основанием для изучения способности miR-222-3p модулировать пролиферацию миобластов. С целью выяснения роли miR-222-3p в пролиферации миобластов клетки С2С12 трансфицировали синтетическими аналогами miR-222-3p, ее ингибиторами, а также РНК-негативным контролем. Как показано на рис. 1б, уровень miR-222-3p возрастал при трансфекции аналогами микроРНК, тогда как ингибиторы этой РНК снижали ее уровень.
Рис. 1.
MiR-222-3p усиливает пролиферацию миобластов С2С12. а – Уровень miR-222-3p в пролиферирующих миобластах С2С12; б – уровень miR-222-3p в миобластах С2С12 после трансфекции аналогами или ингибиторами miR-222-3p; в – число клеток, измеренное с помощью Cell Count Kit 8 (CCK8); г, д – через 24 ч после трансфекции аналогами или ингибиторами miR-222-3p клетки фиксировали и окрашивали на EdU (красный), ядра окрашивали DAPI (синий). Масштаб: 20 мкм. е – Экспрессия генов белков-регуляторов клеточного цикла по результатам анализа уровня мРНК методом количественной ПЦР. Данные представлены как средние значения ± SEM, n = 3, *P < 0.05; **P < 0.01.
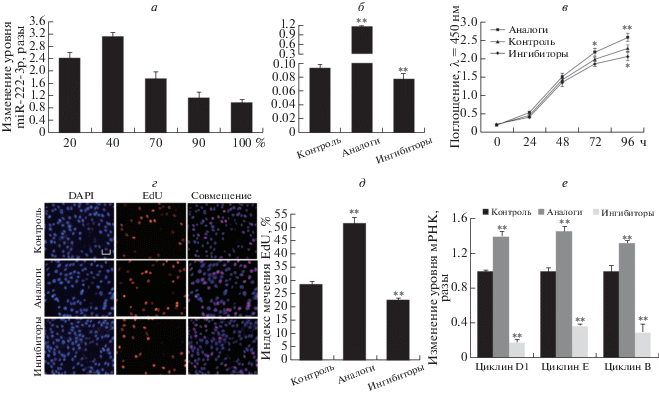
В опытах с использованием CCK8 подтверждено, что miR-222-3p усиливает пролиферацию миобластов (рис. 1в). Эти результаты были подтверждены в экспериментах по включению EdU, которые показали, что трансфекция клеток C2C12 синтетическими аналогами miR-222-3p повышает соотношение EdU-позитивных клеток (рис. 1г, д). Более того, уровень транскрипции генов регуляторов клеточного цикла [18], таких как циклин E, циклин D и Сdk4, которые вызывают задержку клеток C2C12 на стадии G0/G1, в группе, сверхпродуцирующей miR-222-3p, был заметно выше, чем в контрольной группе. В то же время, репрессия miR-222-3p вызывала противоположный эффект (рис. 1е). Следовательно, наши результаты указывают на то, что miR-222-3p усиливает пролиферацию миобластов C2C12.
MiR-222-3p супрессирует дифференцировку миобластов C2C12
Дифференцировка миобластов – это еще один критический для миогенеза процесс. Для дальнейшего подтверждения участия miR-222-3p в дифференцировке миобластов, клетки С2С12 успешно трансфицировали аналогами и ингибиторами miR-222-3p, а также контрольными малыми РНК. При этом в зависимости от того, аналоги или ингибиторы использовали для трансфекции, удалось достичь сверхпродукции или снижения уровня miR-222-3p (рис. 2а). Трансфекция С2С12 аналогами miR-222-3p угнетала образование миотрубочек клетками С2С12 по сравнению с негативным контролем. Напротив, ингибиторы miR-222-3p индуцировали формирование более многочисленных и длинных миотрубочек миобластами (рис. 2б, в). Более того, мы проанализировали уровень мРНК тяжелой цепи миозина (MyHC), MyoG, Mrf4, MyoD и Myf5 – маркеров дифференцировки миобластов, в трех группах трансфицированных клеток С2С12 [19]. Уровень мРНК маркеров дифференцировки значительно снижался в клетках, трансфицированных аналогами miR-222-3p, и очень сильно увеличивался после трансфекции клеток С2С12 ингибиторами, по сравнению с уровнем мРНК соответствующих маркеров в негативном контроле (рис. 2г). В целом, это убедительно показывает, что miR-222-3p супрессирует дифференцировку клеток С2С12, что согласуется с результатами предшествующих исследований [13].
Рис. 2.
MiR-222-3p супрессирует дифференцировку миобластов С2С12. а – Изменение уровня miR-222-3p (разы) после трансфекции клеток аналогами и ингибиторами miR-222-3p по сравнению с негативным контролем; б, в – влияние miR-222-3p на образование миотрубочек клетками C2C12. Окрашивание антителами к MyHC (красный) миобластов С2С12, трансфицированных аналогами, ингибиторами miR-222-3p и контрольными РНК, через 7 дней с момента начала дифференцировки. Масштаб – 20 мкм. г – Относительный уровень транскриптов генов маркеров дифференцировки миобластов (MyHC, MyoG, MRF4, MyoD и Myf5), определенный с помощью количественной ПЦР. Данные представлены как средние значения ± SEM. n = 3. *P < 0.05; **P < 0.01.
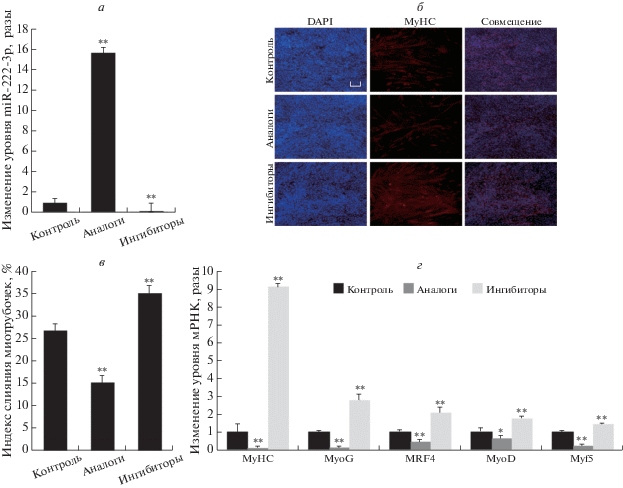
MiR-222-3p влияет на пролиферацию и дифференцировку миобластов С2С12, регулируя BTG2
MiR-222-3p может способствовать пролиферации миобластов С2С12 и супрессировать их дифференцировку в ходе миогенеза скелетных мышц, однако механизм, лежащий в основе этого влияния, пока не установлен. Чтобы изучить молекулярный механизм, с помощью которого miR-222-3p влияет на пролиферацию и дифференцировку миобластов С2С12, для поиска генов, регулируемых miR-222-3p, мы использовали программы TargetScan и miRanda. Объединив результаты поиска с помощью разных программ, мы получили огромное число потенциальных мишеней miR-222-3p, включая ген BTG2, негативный регулятор пролиферации клеток. Как и ранее, мы трансфицировали клетки С2С12 аналогами, ингибиторами miR-222-3p и контрольными РНК во время пролиферации и дифференцировки миобластов. Оказалось, что уровень мРНК гена BTG2 существенно снижался при трансфекции клеток аналогами miR-222-3p, в то время как ингибиторы miR-222-3p, наоборот, увеличивали ее уровень по сравнению с негативным контролем (рис. 3а). Поэтому мы предположили, что miR-222-3p может влиять на дифференцировку и пролиферацию миобластов С2С12, действуя на ген-мишень BTG2. Чтобы проверить, является ли ген BTG2 “прямой” мишенью miR-222-3p, мы использовали два разных репортерных гена люциферазы. Клетки HeLa котрансфицировали конструкциями, которые содержали мутированный или немодифицированный 3'-UTR BTG2 и люциферазный репортер, и аналогами miR-222-3p и соответствующими контрольными РНК. Оказалось, что сверхпродукция miR-222-3p эффективно репрессирует относительную люциферазную активность, в то время как при использовании мутантного 3'-UTR BTG2 такой эффект не был выявлен (рис. 3б). Эти результаты поддерживают предположение, что ген BTG2 – это мишень miR-222-3p.
Рис. 3.
MiR-222-3p влияет на дифференцировку и пролиферацию миобластов С2С12, регулируя уровень мРНК BTG2. а – Изменение уровня miR-222-3p (разы) после трансфекции клеток аналогами и ингибиторами miR-222-3p, по сравнению с негативным контролем. б – Относительная активность люциферазы в клетках HeLa, трансфицированных одновременно аналогами miR-222-3p или контрольной РНК, и репортерными конструкциями, несущими 3'-UTR BTG2 дикого типа или контрольный 3'-UTR с мутацией. в – Изменения в уровне мРНК BTG2 (разы), миРНК к мРНК BTG2 в пролиферирующих миобластах С2С12 по сравнению с негативным контролем (неспецифическим дуплексом). г – Число клеток, измеренное с помощью Cell Count Kit 8 (CCK8). д, е – EdU-тест на пролиферацию. ж – Количественная оценка экспрессии генов белков-регуляторов клеточного цикла. з – Изменение количества мРНК BTG2 после трансфекции пролиферирующих миобластов С2С12 миРНК к BTG2. и – Изменение количества мРНК маркеров дифференцировки миобластов (Myf5, MyoD, MRF4, MyoG и MyHC; разы) в трансфицированных клетках. к, л – Влияние миРНК к мРНК BTG2 на формирование миотрубочек миобластами С2С12. Масштаб 20 мкм. При проведении экспериментов по определению активности люциферазы использовали трипликаты биологических образцов. Данные представлены как среднее ± SEM. n = 3. *P < 0.05; **P < 0.01.
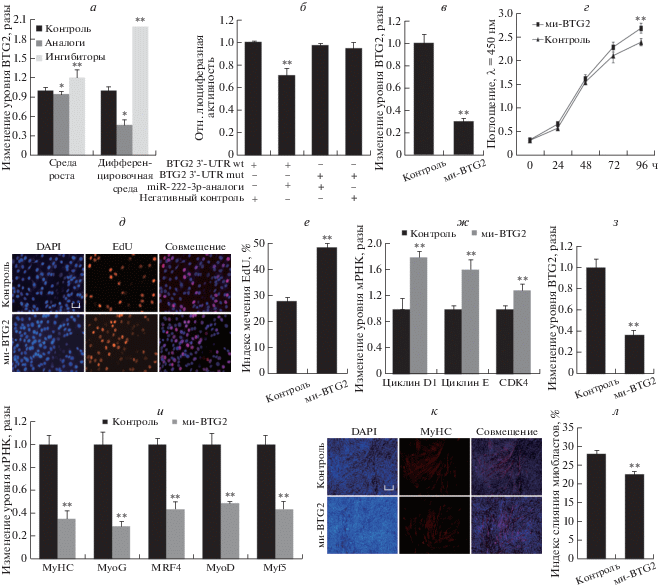
Затем мы определили роль miR-222-3p в регуляции BTG2 в ходе пролиферации и дифференцировки миобластов. Во-первых, чтобы уменьшить уровень мРНК BTG2 и понять его непосредственную функцию в пролиферации и дифференцировке миобластов, мы использовали миРНК. Обнаружено, что миРНК к BTG2 эффективно снижает уровень мРНК BTG2 при пролиферации миобластов (рис. 3в). Тесты ССК-8 и EdU показали, что группа образцов, в которой использовали миРНК, уровень пролиферации был выше, чем в негативном контроле (рис. 3г–е). Более того, уровень мРНК генов-регуляторов клеточного цикла (циклина Е, CDK4, циклина D1) также был снижен (рис. 3ж). Кроме того, трансфекция миРНК к BTG2 дифференцирующихся клеток С2С12 также значительно снижала уровень мРНК BTG2 (рис. 3з). Уровень мРНК генов маркеров мышечной дифференцировки (MyHC, MyoG, MRF4, MyoD и Myf5) также был снижен через 6 дней (рис. 3и). Более того, при ингибировании BTG2 очевидным было снижение числа мышечных миотрубочек (рис. 3к, л). Эти результаты указывают на то, что, воздействуя на ген BTG2, miR-222-3p может влиять на пролиферацию и дифференцировку миобластов С2С12.
ЗАКЛЮЧЕНИЕ
В настоящей работе выявлена важная роль miR-222-3p как в пролиферации миобластов, так и в их дифференцировке. Сверхэкспрессия miR-222-3p способствует пролиферации и репрессирует дифференцировку миобластов С2С12, а снижение уровня этой микроРНК оказывает противоположный эффект. Более того, снижение уровня мРНК BTG2 ускоряет пролиферацию и супрессирует дифференцировку клеток С2С12. Кроме того, miR-222-3p специфически регулирует уровень мРНК BTG2 во время пролиферации и дифференцировки клеток С2С12.
Исследование поддержано National Natural Science Foundation of China (31530073), Sichuan Science & Technology Support Program (16ZC2838; 2016NZ0089), Chinese National Science & Technology Support Program (2015BAD03B01-11) и целевым грантом China Agriculture Research System (CARS-36-05B).
Список литературы
Ambros V. (2004) The functions of animal microRNAs. Nature. 7006, 350‒355.
Berkes C.A., Tapscott S.J. (2005) MyoD and the transcriptional control of myogenesis. Semin. Cell. Dev. Biol. 16, 585‒595.
Cardinali B., Cappella M., Provenzano C., Garcia-Manteiga J.M., Lazarevic D., Cittaro D., Martelli F., Falcone G. (2016) MicroRNA-222 regulates muscle alternative splicing through Rbm24 during differentiation of skeletal muscle cells. Cell Death Dis. 7, e2086.
Cardinali B., Castellani L., Fasanaro P., Basso A., Alemà S., Martelli F., Falcone G. (2009) Microrna-221 and microrna-222 modulate differentiation and maturation of skeletal muscle cells. PLoS One. 4, e7607.
Chen J.F., Mandel E.M., Thomson J.M., Wu Q.L., Callis T.E., Hammond S.M., Conlon F.L., Wang D.Z. (2006) The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation. Nat. Genetics. 38, 228‒233.
Chen J.F., Tao Y., Li J., Deng Z.L., Yan Z., Xiao X., Wang D.Z. (2010) microRNA-1 and microRNA-206 regulate skeletal muscle satellite cell proliferation and differentiation by repressing Pax7. J. Cell Biol. 190, 867‒879.
De F.M., De L.A. (2006) Involvement of CDKs and cyclins in muscle differentiation. Eur. J. Histochem. 62, 19‒23.
Elghissassi F., Valsesiawittmann S., Falette N., Duriez C., Walden P. D., Puisieux A. (2002) BTG2(TIS21/PC3) induces neuronal differentiation and prevents apoptosis of terminally differentiated PC12 cells. Oncogene. 21, 6772.
Evangelisti C., Astolfi A., Gaboardi G.C., Tazzari P., Pession A., Goto K., Alberto M. (2009) TIS21/BTG2/ PC3 and cyclin D1 are key determinants of nuclear diacylglycerol kinase-zeta-dependent cell cycle arrest. Cell. Signal. 21, 801‒809.
Feng Z., Tang Z. L., Li K., Liu B., Yu M., Zhao S.H. (2007) Molecular characterization of the BTG2 and BTG3 genes in fetal muscle development of pigs. Gene. 403, 170‒177.
Galardi S., Mercatelli N., Giorda E., Massalini S., Frajese G.V., Ciafrè S.A. (2007) miR-221 and miR-222 expression affects the proliferation potential of human prostate carcinoma cell lines by targeting p27Kip1. J. Biol. Chem. 282, 23716‒23724.
Ge Y., Chen J. (2011) MicroRNAs in skeletal myogenesis. Cell Cycle. 10, 441‒448.
Huang W.W., Yang J.S., Pai S.J., Wu P.P, Chang S.J., Chu F.S., Fan M.J., Chiou S.M., Kuo H.M., Yeh C.C., Chen P.Y., Tsuzuki M., Chung J.G. (2012) Bufalin induces G0/G1 phase arrest through inhibiting the levels of cyclin D, cyclin E, CDK2 and CDK4, and triggers apoptosis via mitochondrial signaling pathway in T24 human bladder cancer cells. Mutat. Res. 732, 26‒33.
Livak K.J., Schmittgen T.D. (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402‒408.
Montarras D., Chelly J., Bober E., Arnold H., Ott M.O., Gros F., Pinset C. (1991) Developmental patterns in the expression of Myf5, MyoD, myogenin, and MRF4 during myogenesis. New Biologist. 3, 592‒600.
Reiter R.J., Tan D.X., Galano A. (2014) Melatonin reduces lipid peroxidation and membrane viscosity. Front. Physiol. 5, 377.
Roy R., Taourit S., Zaragoza P., Eggen A., Rodellar C. (2005) Genomic structure and alternative transcript of bovine fatty acid synthase gene (FASN): comparative analysis of the FASN gene between monogastric and ruminant species. Cytogenet. Genome Res. 111, 65‒73.
Sabourin L.A., Rudnicki M.A. (2000) The molecular regulation of myogenesis. Clin. Genetics. 57, 16‒25.
Tan S.B., Li J.B., Chen X., Zhang W., Zhang D., Zhang C., Li D., Zhang Y. (2014) Small molecule inhibitor of myogenic microRNAs leads to a discovery of miR-221/222-myoD-myomiRs regulatory pathway. Chem. Biol. 21, 1265‒1270.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


