Молекулярная биология, 2019, T. 53, № 1, стр. 53-63
Терминация репликации и механизмы гетероплазмии митохондриальных ДНК у осетровых рыб
И. В. Корниенко a, b, *, Д. А. Чеботарев a, М. А. Махоткин a, В. А. Григорьев a, Е. Н. Пономарева a, Г. Г. Матишов a, c
a Южный научный центр Российской академии наук
344006 Ростов-на-Дону, Россия
b Южный федеральный университет
344090 Ростов-на-Дону, Россия
c Донской государственный технический университет
344000 Ростов-на-Дону, Россия
* E-mail: ikornienko@yandex.ru
Поступила в редакцию 27.02.2018
После доработки 17.05.2018
Принята к публикации 04.06.2018
Аннотация
Проведено сравнение элементов D-петли, связанных с терминацией репликации мтДНК у рыб. Выявлены консервативные последовательности, определяющие терминацию репликации (TAS). Рассмотрен феномен образования гетероплазмии по длине мтДНК, связанной с различиями в количестве повторяющихся единиц тандемных последовательностей в D-петле у осетровых. В качестве возможного механизма гетероплазмии мтДНК рассмотрено формирование при репликации устойчивых пространственных структур с пространственной осевой поворотной симметрией в области тандемных повторов. Показано, что у большинства осетровых с выраженной гетероплазмией мтДНК значения энергии фолдинга тандемных повторов, содержащих разное количество копий повторяющихся единиц, имеют минимальные отличия.
ВВЕДЕНИЕ
Секвенированию мтДНК у большого числа позвоночных способствовали ее небольшие размеры [1]. Чрезвычайно компактный митохондриальный геном позвоночных представлен 37 генами, 22 из которых кодируют тРНК, два – рРНК (12S и 16S рРНК), 13 – ферменты, вовлеченные в электронно-транспортную цепь окислительного фосфорилирования и синтеза АТР [2].
Все секвенированные к настоящему времени молекулы мтДНК позвоночных содержат не только кодирующие области, но и небольшой участок (не более 5–10% всего митохондриального генома) ‒ некодирующий контрольный регион (D-петля), в котором локализованы промоторы и локус начала репликации тяжелой H-цепи oriH (OH). Несмотря на то, что с начала 1970-х были проведены исследования, раскрывшие связь D-петли с репликацией мтДНК [3], этот механизм остается не до конца ясным. Надежно установлено, что в репликации мтДНК участвуют такие белки, как состоящая из двух субъединиц РНК-зависимая ДНК-полимераза γ, митохондриальная РНК-полимераза, хеликаза, белки, взаимодействующие с одноцепочечной мтДНК [4, 5]. Репликация мтДНК начинается в области OH с РНК-праймера, транскрибируемого с промотора легкой цепи (LSP). Праймер образуется при участии мтРНК-полимеразы и митохондриального фактора транскрипции. В результате синтеза короткого РНК-транскрипта образуется R-петля – стабильный гибрид ДНК-РНК, состоящий из родительских цепей ДНК и новосинтезированного РНК-транскрипта. Транскрипт процессируется с образованием праймера, который далее удлиняется мтДНК-полимеразой. Процессинг РНК-транскриптов L-цепи осуществляет сайт-специфическая эндонуклеаза, процессирующая мтРНК [6].
В молекуле мтДНК точка начала репликации L-цепи (OL) расположена в области кластера из пяти тРНК (тРНКTrp, тРНКAla, тРНКAsn, тРНКCys, тРНКTyr) приблизительно на две трети геномного расстояния дальше от OH. В OL родительская H-цепь вытесняется возникающей H-цепью и, будучи одноцепочечной, принимает конфигурацию, которая служит сайтом инициации синтеза L-цепи мтДНК-праймазой. На заключительных стадиях репликации мтДНК происходит разделение двух дочерних молекул, удаление РНК-праймеров с обоих концов, достройка и лигирование промежутков в молекуле, внесение суперспиральных витков в ковалентно замкнутую кольцевую мтДНК [7].
Несмотря на кажущуюся простоту процесса репликации, терминация синтеза мтДНК (в том числе 7S ДНК) в области высококонсервативных последовательностей, ассоциированных с терминацией репликации (TAS), слабо изучена [7]. После почти 40 лет исследований появились неопровержимые доказательства участия хеликазы TWINKLE в процессах терминации синтеза 7S ДНК в области TAS мтДНК человека [5].
В области контрольного региона осетровых рыб, где происходит терминация репликации H-цепи, расположено от одной до семи тандемных нуклеотидных последовательностей (VNTR) с размером повторяющихся единиц от 78 до 83 п.н. [8–10]. D-петля мтДНК осетровых рыб структурно отличается от D-петли человека и содержит более одного TAS-элемента, поэтому участием лишь одной хеликазы нельзя объяснить механизм терминации репликации мтДНК. Кроме того, не понятно, почему осетры отличаются широким диапазоном гаплотипов, различающихся длиной VNTR-участков и, соответственно, количеством TAS-элементов.
В тканях различных видов осетровых часто наблюдается так называемый эффект гетероплазмии, т.е. присутствие молекул мтДНК нескольких типов. Показано, что осетры представлены видами либо гомоплазмичными по длине D-петли (Acipenser nudiventris, A. oxyrinchus, A. sturio), либо со слабо выраженной гетероплазмией (A. fulvescens, Huso huso) [10]. С другой стороны, имеются виды, у представителей которых гетероплазмия ярко выражена (частота гетероплазмиков превышает 0.3, а частота особей, клетки которых содержат по три различных типа мтДНК, превышает 0.1). К таким видам относятся A. brevirostrum, A. medirostris, A. mikadoi, A. naccarii и A. transmontanus [10]. Несмотря на то, что гетероплазмия в контрольном регионе мтДНК осетров была открыта более четверти века назад [8], до сих пор нет четкого понимания механизма ее возникновения.
Цель настоящей работы состояла в теоретическом исследовании взаимосвязи между нуклеотидным составом повторяющихся единиц D-петли и возникновением гетероплазмии у различных видов осетровых рыб.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
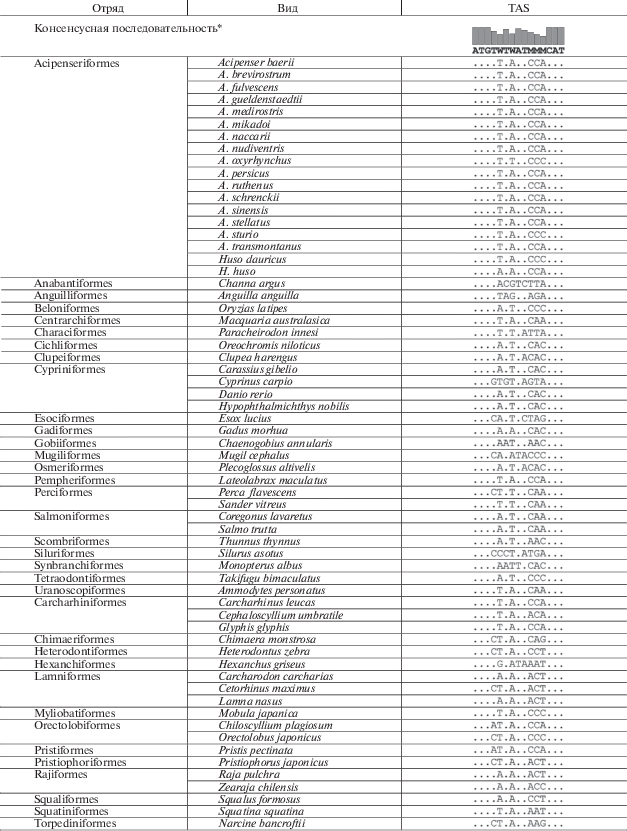
С целью определения нуклеотидных последовательностей TAS-элементов с помощью программ Clustal X v. 2.1 [11] и UGENE v. 1.27 [12] проведены множественные сравнения последовательностей D-петель мтДНК у различных видов рыб. Все митохондриальные последовательности были получены из GenBank (табл. 1). При нахождении консенсусной последовательности TAS за пороговое значение частот принимали 70%.
Таблица 1.
Анализируемые нуклеотидные последовательности мтДНК рыб
| Класс | Отряд | Вид | GenBank acc. no. |
|---|---|---|---|
| Actinopterygii | Acipenseriformes | Acipenser baerii | JQ045341.1 |
| A. brevirostrum | AJ275195.1 | ||
| A. fulvescens | KU985082.2 | ||
| A. gueldenstaedtii | NC_012576.1 | ||
| A. medirostris | NC_028405.1 | ||
| A. mikadoi | NC_031188.1 | ||
| A. ruthenus | NC_022453.1 | ||
| A. schrenckii | KC820796.1 | ||
| A. sinensis | EU719645.1 | ||
| A. stellatus | AJ585050.1 | ||
| A. transmontanus | AB042837.1 | ||
| A. naccarii | AJ275214.1 | ||
| A. nudiventris | AJ275203.1 | ||
| A. oxyrhynchus | U32308.1 | ||
| A. persicus | EU714033.1 | ||
| A. sturio | NC_027417.1 | ||
| Huso dauricus | NC_023837.1 | ||
| H. huso | NC_005252.1 | ||
| Anabantiformes | Channa argus | KM077026.1 | |
| Anguilliformes | Anguilla anguilla | AP007233.1 | |
| Beloniformes | Oryzias latipes | AP008948.1 | |
| Centrarchiformes | Macquaria australasica | KR152256.1 | |
| Characiformes | Paracheirodon innesi | KT783482.1 | |
| Cichliformes | Oreochromis niloticus | GU477628.1 | |
| Clupeiformes | Clupea harengus | KC193777.1 | |
| Cypriniformes | Carassius gibelio | KU896992.1 | |
| Cyprinus carpio | AP017364.1 | ||
| Danio rerio | KM244705.1 | ||
| Hypophthalmichthys nobilis | HM162839.1 | ||
| Esociformes | Esox lucius | AP004103.1 | |
| Gadiformes | Gadus morhua | AM489716.1 | |
| Gobiiformes | Chaenogobius annularis | AP014799.1 | |
| Mugiliformes | Mugil cephalus | KP018403.1 | |
| Osmeriformes | Plecoglossus altivelis | EU124683.1 | |
| Pempheriformes | Lateolabrax maculatus | KR780683.1 | |
| Perciformes | Perca flavescens | NC_019572.1 | |
| Sander vitreus | KT211476.1 | ||
| Salmoniformes | Coregonus lavaretus | AB034824.1 | |
| Salmo trutta | AM910409.1 | ||
| Scombriformes | Thunnus thynnus | AP006034.1 | |
| Siluriformes | Silurus asotus | AP012022.1 | |
| Synbranchiformes | Monopterus albus | NC_003192.1 | |
| Tetraodontiformes | Takifugu bimaculatus | KP973944.1 | |
| Uranoscopiformes | Ammodytes personatus | AP006023.1 | |
| Chondrichthyes | Carcharhiniformes | Carcharhinus leucas | NC_023522.1 |
| Cephaloscyllium umbratile | KX354996.1 | ||
| Glyphis glyphis | KY039268.1 | ||
| Chimaeriformes | Chimaera monstrosa | AJ310140.1 | |
| Heterodontiformes | Heterodontus zebra | NC_021615.1 | |
| Hexanchiformes | Hexanchus griseus | KF894491.1 | |
| Lamniformes | Carcharodon carcharias | NC_022415.1 | |
| Cetorhinus maximus | KM096989.1 | ||
| Lamna nasus | NC_033911.1 | ||
| Myliobatiformes | Mobula japanica | NC_018784.1 | |
| Orectolobiformes | Chiloscyllium plagiosum | NC_012570.1 | |
| Orectolobus japonicus | NC_022148.1 | ||
| Pristiformes | Pristis pectinata | NC_027182.1 | |
| Pristiophoriformes | Pristiophorus japonicus | NC_024110.1 | |
| Rajiformes | Raja pulchra | KR676448.1 | |
| Zearaja chilensis | KJ913073.2 | ||
| Squaliformes | Squalus formosus | NC_031818.1 | |
| Squatiniformes | Squatina squatina | NC_035057.1 | |
| Torpediniformes | Narcine bancroftii | NC_034772.1 |
Поиск участков, содержащих тандемные повторы в контрольном регионе мтДНК осетровых (табл. 1) осуществляли с помощью программы Tandem repeats finder [13].
Пространственные структуры тандемных повторов и их свободную энергию Гиббса (ΔG) рассчитывали с помощью Mfold web server, в котором реализован алгоритм расчета ΔG пространственных одноцепочечных структур ДНК с учетом внутримолекулярных водородных связей между комплементарными основаниями [14, 15]. Стоит отметить, что рассчитанные с помощью Mfold web server энергетически выгодные пространственные вторичные структуры коровых единиц VNTR являются приблизительными.
Термодинамическую характеристику ΔG процессов образования пространственных структур тандемными повторами разной длины сравнивали с ΔG фолдинга коровых единиц, из которых состоят эти тандемные повторы. Для термодинамической оценки самопроизвольности протекания процесса фолдинга тандемного повтора, состоящего из i повторяющихся единиц, рассчитывали разность между ΔG фолдинга этого одноцепочечного VNTR и суммы ΔG фолдингов, рассчитанных отдельно для каждой повторяющейся единицы:
Учитывая, что фолдинг тандемных повторов осетров напрямую зависит от тепловых колебаний элементов цепи (нуклеотидов), крайне важно определить диапазон температур при расчетах ∆Gфолд..
Мы исходили из того, что формирование гетероплазмии начинается уже на ранних эмбриональных стадиях, сопровождающихся массивной репликацией не только ядерной, но и мтДНК. Учитывая, что процесс эмбриогенеза у осетровых происходит в диапазоне температур от +7 до +22°С [16, 17], при расчете ΔG фолдинга одноцепочечных тандемных повторов использовали значение температуры, равное +15°С.
Корреляцию по Пирсону между параметром ∆Gфолд. и числом повторяющихся единиц у осетровых с последующей корректировкой на множественность сравнений по Бенджамини и Хохбергу [18] рассчитывали в среде R.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работы были определены нуклеотидные последовательности, ассоциированные с терминацией репликации мтДНК у рыб. У всех исследованных видов в области VNTR выявлены высококонсервативные последовательности размером 15 п.н., начинающиеся с триплета ATG и заканчивающиеся триплетом CAT (5'-ATGTWTWATMMMCAT-3') (табл. 2). У осетровых этот участок представлен последовательностью 5'-ATGTTTAATCCACAT-3'. Ранее после процедуры параллельного выравнивания участков D-петель, содержащих регионы расширенных TAS, у некоторых видов позвоночных, включая костных и хрящевых рыб (Latimeria chalumnae, Danio rerio, Rachycentron canadum, Lycothrissa crocodilus, Petrocephalus microphthalmus, Xiphophorus maculatus, Amblyraja radiata, Okamejei kenojei), также были выявлены высококонсервативные мотивы TAS с пограничными триплетами ATG и CAT [5]. Кроме того, изучение изменчивости последовательностей TAS у человека позволило предположить, что триплеты CAT в контрольном регионе могут быть местом связывания белков, вовлеченных в репликацию мтДНК, и прямо участвовать в транскрипции и репликации мтДНК [19].
Стоит отметить, что нуклеотидные последовательности TAS у осетров, выявленные в настоящем исследовании, отличаются от последовательностей TAS1, TAS2 и TAS3, обнаруженных ранее [8]. Так, в области гена тРНКPro осетровых рыб мы не обнаружили нуклеотидную последовательность, характерную для TAS и ограниченную триплетами ATG и CAT. Это указывает на отсутствие в гене этой тРНК локусов, ассоциированных с терминацией репликации мтДНК, что противоречит данным, согласно которым у осетров этот ген содержит TAS-элемент [8]. Кроме того, в области D-петли мтДНК осетров нами выявлено присутствие TAS, представленной в основном структурой 5'-ATGTTTAATCCTCAT-3' и локализованной в повторяющихся единицах, составляющих VNTR.
Как показано ранее, контрольный регион мтДНК осетровых рыб содержит тандемные повторы с размером повторяющихся единиц от 78 до 83 п.н. [8–10]. При этом количество этих коровых единиц в VNTR гомоплазмичных и гетероплазмичных осетровых рыб варьирует от одного до семи [10].
Предложен механизм, объясняющий присутствие тандемных повторов различной длины в D‑петле мтДНК осетров, согласно которому увеличение числа повторяющихся единиц коррелирует с увеличением их термодинамической стабильности [8]. Однако поскольку энергия Гиббса, как и другие термодинамические функции, обладает свойством аддитивности, то очевидно, что с увеличением или уменьшением числа коровых единиц, составляющих VNTR, величины их свободных энергий (ΔG) также будут изменяться. Следовательно, представляется некорректным оценивать термодинамические характеристики повторов, состоящих из разного числа повторяющихся единиц. Поэтому мы исходили из того, что значения ΔG можно сравнивать только у изомеров, т.е. фрагментов ДНК с одинаковой химической формулой. Более того, в отличие от прямого сравнения величин ΔG коровых элементов VNTR у разных видов осетровых [10] нами дана сравнительная оценка именно свободных энергий процессов образования пространственных структур тандемными повторами осетровых (∆Gфолд.).
Согласно нашим данным, значения ΔG фолдинга одноцепочечных тандемных повторов коррелирует с количеством повторяющихся единиц, при этом, как правило, чем большим числом коровых элементов представлен VNTR, тем более энергетически выгоден его фолдинг (табл. 3).
Таблица 3.
Свободная энергия Гиббса образования вторичной структуры одноцепочечных VNTR (ΔGфолд.) D-петли мтДНК осетровых, ккал/моль
| Вид | Размер коровых единиц, п.н. | Число коровых единиц в тандемном повторе | r | ||||
|---|---|---|---|---|---|---|---|
| 2 | 3 | 4 | 5 | 6 | |||
| Acipenser baerii | 82 | –1.04 | –1.04 | –2.08 | –2.08 | –3.12 | –0.9449 |
| A. brevirostrum | 83 | 0 | 0 | 0 | 0 | 0 | – |
| A. fulvescens | 82 | –3.05 | –4.89 | –7.34 | –9.81 | –12.66 | –0.9973 |
| A. gueldenstaedtii | 82 | –1.40 | –2.05 | –2.80 | –3.59 | –4.24 | –0.9994 |
| A. medirostris | 78 | –2.77 | –2.77 | –5.54 | –5.54 | –8.31 | –0.9449 |
| A. mikadoi | 78 | –0.29 | –2.02 | –2.02 | –3.50 | –4.04 | –0.9663 |
| A. naccarii | 82 | –1.40 | –2.05 | –2.80 | –3.59 | –4.24 | –0.9994 |
| A. nudiventris | 82 | –3.07 | –4.38 | –7.35 | –8.66 | –11.63 | –0.9911 |
| A. oxyrinchus | 79 | –4.78 | –7.17 | –10.67 | –13.66 | –16.85 | –0.9987 |
| A. persicus | 82 | –1.04 | –1.04 | –2.08 | –2.08 | –3.12 | –0.9449 |
| A. ruthenus | 80 | –5.29 | –8.12 | –13.41 | –14.96 | –20.25 | –0.9893 |
| A. stellatus | 82 | –4.86 | –7.82 | –12.68 | –13.82 | –18.68 | –0.9880 |
| A. sturio | 80 | –2.03 | –4.91 | –6.94 | –9.82 | –11.85 | –0.9880 |
| A. transmontanus | 82 | –0.06 | –1.30 | –1.36 | –2.60 | –2.66 | –0.9540 |
| Huso huso | 82 | –3.15 | –5.96 | –9.11 | –11.92 | –15.07 | –0.9998 |
Примечания. Жирным выделены виды осетров с выраженной гетероплазмией мтДНК и частотой встречаемости особей с тремя различными типами VNTR равной 0.1 или более (по [10]). r – Коэффициент корреляции между числом повторов в VNTR и энергией Гиббса ΔGфолд. (FDR < 0.05).
Из табл. 3 видно, что у большинства осетровых с выраженной гетероплазмией мтДНК значения энергий фолдинга тандемных повторов имеют минимальные отличия в ряду VNTR, содержащих разное число копий повторяющихся единиц. Высокие частоты гетероплазмии сахалинского (A. mikadoi), коротконосого (A. brevirostrum), зеленого (A. medirostris), адриатического (A. naccarii) и белого (A. transmontanus) осетров можно объяснить малыми различиями между значениями ∆Gфолд. одноцепочечных повторов различной длины при репликации мтДНК. Так, у A. medirostris и A. naccarii энергетические различия ΔGфолд. тандемных повторов, состоящих из двух, трех или четырех повторяющихся единиц, либо отсутствуют, либо не превышают 2.8 ккал/моль. У A. mikadoi и A. transmontanus ΔGфолд. повторов из двух, трех, четырех или пяти единиц не превышают 1.8 ккал/моль. У A. brevirostrum энергия образования пространственных структур тандемных повторов из разного числа копий практически одинакова. Таким образом, отсутствие заметного энергетического выигрыша при формировании пространственных структур тандемных повторов различной длины во время процесса репликации мтДНК может рассматриваться как основная причина гетероплазмии осетровых рыб.
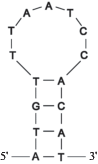
Общепринятая модель появления гетероплазмичных форм мтДНК через образование в процессе репликации локальных гетеродуплексов [8] не объясняет, почему вновь образующиеся повторы в D-петле осетров не кратны 15 п.н., ассоциированным с терминацией репликации мтДНК. Действительно, как уже сказано, все копии повторяющихся единиц тандемных повторов осетровых рыб содержат высококонсервативные последовательности из 15 п.н. с комплементарными 5'- и 3'‑концевыми последовательностями (рис. 1).
Учитывая, что повторяющиеся единицы тандемных повторов в D-петле осетров на 5'- и 3'-концах лишены комплементарных участков (рис. 2), только лишь формированием гетеродуплексов нельзя объяснить механизм возникновения гетероплазмии по длине мтДНК.
Рис. 2.
Пространственная структура повторяющихся единиц тандемных повторов некоторых осетровых рыб. а ‒ A. mikadoi, размер повторяющейся единицы 78 п.н.; б ‒ A. oxyrhynchus, размер повторяющейся единицы 79 п.н.; в ‒ A. baerii JQ045341.1, размер повторяющейся единицы 82 п.н.; г ‒ A. naccarii, размер повторяющейся единицы 82 п.н.; д ‒ A. stellatus, размер повторяющейся единицы 82 п.н.; е ‒ A. brevirostrum, размер повторяющейся единицы 83 п.н. Жирным выделены нуклеотидные последовательности TAS в повторяющейся единице тандемного повтора.
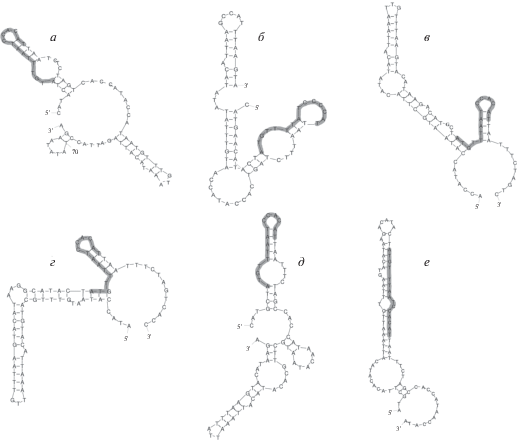
Мы предлагаем иной механизм образования гетероплазмии мтДНК осетров, показанный на примере коротконосого осетра A. brevirostrum. В контрольном регионе мтДНК этого вида выявлены VNTR разной длины, состоящие из трех, четырех или пяти повторов [10]. При репликации мтДНК эти повторы могут формировать энергетически выгодные пространственные структуры, энергии которых (ΔGVNTR), рассчитанные с помощью Mfold web server, составляют –41.07, –54.76 и –68.45 ккал/моль для структур из трех, четырех и пяти тандемных повторов соответственно (рис. 3). При этом три, четыре и пять повторяющихся единиц тандемных повторов A. brevirostrum образуют при репликации мтДНК структуры, обладающие пространственной поворотной симметрией третьего, четвертого и пятого порядков соответственно (рис. 3). Иными словами, если повернуть эти пространственные структуры на 120°, 90° или 72° вокруг оси, перпендикулярной к плоскости этих повторов и проходящей через их центр, то повторы в пространстве совместятся сами с собой.
Рис. 3.
Энергетически выгодные пространственные структуры, которые могут образовывать повторы различной длины в контрольном регионе при репликации мтДНК A. brevirostrum. а – Три повтора, обладающих осевой симметрией третьего порядка (120°), ΔGVNTR = 41.07 ккал/моль; б – четыре повтора, обладающих осевой симметрией четвертого порядка (90°), ΔGVNTR = –54.76 ккал/моль; в – пять повторов, обладающих осевой симметрией пятого порядка (72°), ΔGVNTR = –68.45 ккал/моль.
Ввиду того, что значения энергий фолдинга одноцепочечных тандемных повторов, содержащих по три, четыре или пять повторяющихся единиц, практически не различаются, существует предпосылка для возникновения гетероплазмии в процессе репликации мтДНК коротконосого осетра. А учитывая, что 5'- и 3'-концы повторяющихся единиц A. brevirostrum не содержат комплементарных нуклеотидов, механизм возникновения гетероплазмии может быть связан с участием некоего фермента с эндонуклеазной активностью.
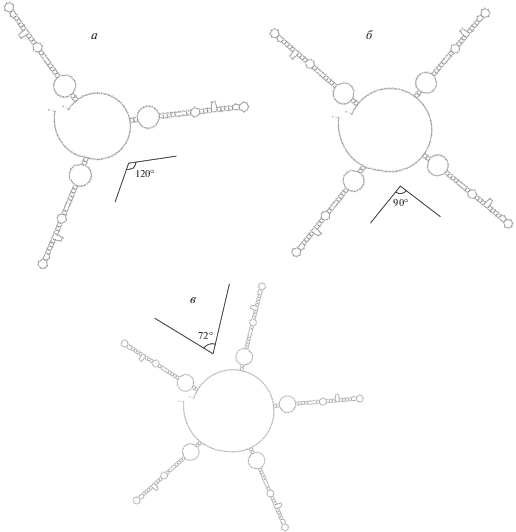
Несмотря на вариабельность числа повторов в мтДНК осетров, нуклеотиды коровых последовательностей проявляют относительно высокую степень внутривидовой консервативности [20], что косвенно указывает на вовлечение этого локуса в процесс репликации мтДНК. При репликации мтДНК повторяющиеся мотивы могут образовывать энергетически выгодные вторичные структуры (рис. 4).
Рис. 4.
Энергетически выгодные пространственные структуры, которые могут образовывать различной длины повторы в контрольном регионе при репликации мтДНК осетровых. а – Пространственная структура VNTR, состоящего из четырех повторяющихся единиц по 82 н., и наиболее часто встречающегося в популяции A. naccarii. Пространственная структура четырех повторяющихся единиц обладает осевой симметрией второго порядка (180°). ΔGVNTR = –81.52 ккал/моль. б – Пространственная структура VNTR, состоящего из трех повторяющихся единиц по 82 н. и наиболее часто встречающегося в популяции H. huso. Пространственная структура трех повторяющихся единиц содержит два участка, каждый из которых имеет осевую симметрию второго порядка (180°). ΔGVNTR = –46.67 ккал/моль. в – Пространственная структура VNTR, состоящего из четырех повторяющихся единиц по 78 н., встречающегося в популяции A. medirostris у 40% особей. Пространственная структура четырех повторяющихся единиц обладает осевой симметрией второго порядка (180°). ΔGVNTR = –73.06 ккал/моль. г – Пространственная структура VNTR, состоящего из двух повторяющихся единиц по 79 н., наиболее часто встречающегося в популяции A. oxyrinchus. Пространственная структура двух повторяющихся единиц обладает осевой симметрией второго порядка (180°). ΔGVNTR = –27.74 ккал/моль. Прямыми линиями показаны оси симметрии.
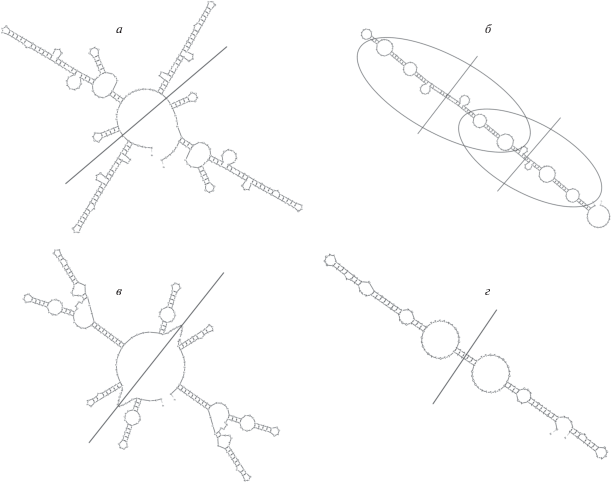
На рис. 4 видно, что повторяющиеся единицы в составе VNTR A. naccarii, H. huso, A. medirostris, A. oxyrinchus при репликации мтДНК могут образовывать энергетически выгодные пространственные структуры, обладающие поворотной симметрией второго порядка. То есть, если повернуть эти пространственные структуры на 180° вокруг оси, перпендикулярной к плоскости этих повторов и проходящей через их центр, то повторяющиеся структуры совместятся в пространстве сами с собой.
Таким образом, именно тандемные повторы, содержащие TAS-элементы в контрольном регионе, вероятно, играют важную роль в терминации репликации мтДНК осетровых рыб. В процессе репликации мтДНК формируются пространственные структуры с тандемными повторами, энергия фолдинга которых практически не зависит от количества повторяющихся единиц. Этот процесс может лежать в основе возникновения гетероплазмии по длине в результате ошибки мтДНК-полимеразы, возможно, при участии неизвестного фермента, обладающего эндонуклеазной активностью. Механизм этого процесса можно представить следующим образом. При репликации мтДНК осетров одноцепочечные участки, содержащие VNTR и TAS, принимают определенные пространственно-симметричные конформации, образуя своеобразный барьер для мтДНК-полимеразы, на котором она “спотыкается”, и происходит собственно терминация процесса репликации. То есть мтДНК-полимераза осетров узнает не саму нуклеотидную последовательность TAS, а симметричную пространственную структуру, образуемую одноцепочечными тандемными повторами, содержащими TAS. Такого рода сбои в процессе репликации мтДНК осетров могут происходить в разных участках VNTR, при этом мтДНК-полимераза до того как “споткнется” может проскочить сразу несколько повторяющихся единиц (рис. 5а, б). В результате этого могут возникнуть вновь синтезированные мтДНК, размеры которых будут отличаться в меньшую сторону на величину, кратную размеру коровых единиц тандемного повтора. Выпетливание энергетически выгодных одноцепочечных участков ДНК, кратных коровой единице данного повтора, также может происходить во вновь синтезируемой цепи (рис. 5г), что приводит к увеличению количества повторяющихся единиц в тандемном повторе.
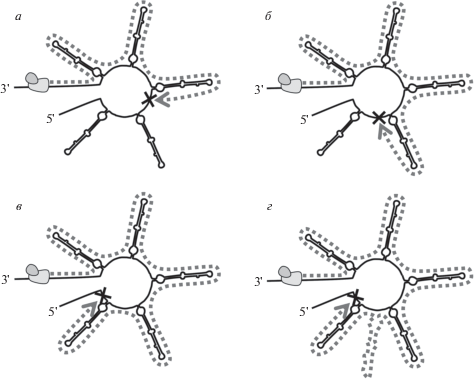
Рис. 5.
Предполагаемый механизм гетероплазмии мтДНК осетровых рыб на примере A. brevirostrum. Пунктирная линия со стрелкой показывает направление синтеза новой цепи мтДНК; × ‒ остановка репликации мтДНК. Вновь синтезированная мтДНК A. brevirostrum содержит VNTR с тремя (а), четырьмя (б), пятью (в) и шестью (г) повторяющимися единицами.
Работа выполнена в рамках реализации государственного задания Южного научного центра РАН № 00-18-07 (гос. рег. проекта 01201354245), с использованием Уникальной модульной установки-комплекса № 73602 и Биоресурсной коллекции редких и исчезающих видов рыб ЮНЦ РАН.
Список литературы
Smith D.R. (2016) The past, present and future of mitochondrial genomics: have we sequenced enough mtDNAs? Brief Funct. Genomics. 15, 47‒54.
Anderson S., Bankier A.T., Barrell B.G., de Bruijn M.H., Coulson A.R., Drouin J., Eperon I.C., Nierlich D.P., Roe B.A., Sanger F., Schreier P.H., Smith A.J., Staden R., Young I.G. (1981) Sequence and organization of the human mitochondrial genome. Nature. 290, 457–465.
Kasamatsu H., Robberson D.L., Vinograd J. (1971) A novel closed-circular mitochondrial DNA with properties of a replicating intermediate. Proc. Natl. Acad. Sci. USA. 68, 2252–2257.
Kaguni L.S. (2004) DNA polymerase γ, the mitochondrial replicase. Annu. Rev. Biochem. 73, 293–320.
Jemt E., Persson Ö., Shi Y., Mehmedovic M., Uhler J.P., Dávila López M., Freyer C., Gustafsson C.M., Samuelsson T., Falkenberg M. (2015) Regulation of DNA replication at the end of the mitochondrial D-loop involves the helicase TWINKLE and a conserved sequence element. Nucl. Acids Res. 43, 9262–9275.
Shadel G.S., Clayton D.A. (1997) Mitochondrial DNA maintenance in vertebrates. Annu. Rev. Biochem. 66, 409–435.
Nicholls T.J, Minczuk M. (2014) In D-loop: 40 years of mitochondrial 7S DNA. Exp. Gerontol. 56, 175–181.
Buroker N.E., Brown J.R., Gilbert T.A., O’Hara P.J., Beckenbach A.T., Thomas W.K., Smith M.J. (1990) Length heteroplasmy of sturgeon mitochondrial DNA: an illegitimate elongation model. Genetics. 124, 157–163.
Brown J.R., Beckenbach K., Beckenbach A.T., Smith M.J. (1996) Length variation, heteroplasmy and sequence divergence in the mitochondrial DNA of four species of sturgeon (Acipenser). Genetics. 142, 525–535.
Ludwig A., May B., Debus L., Jenneckens I. (2000) Heteroplasmy in the mtDNA control region of sturgeon (Acipenser, Huso and Scaphirhynchus). Genetics. 156, 1933–1947.
Larkin M.A., Blackshields G., Brown N.P., Chenna R., McGettigan P.A., McWilliam H., Valentin F., Wallace I.M., Wilm A., Lopez R., Thompson J.D., Gibson T.J., Higgins D.G. (2007) Clustal W and Clustal X version 2.0. Bioinformatics. 23, 2947–2948.
Okonechnikov K., Golosova O., Fursov M., the UGENE team. (2012) Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics. 28, 1166–1167.
Benson G. (1999) Tandem repeats finder: a program to analyze DNA sequences. Nucl. Acids Res. 27, 573–580.
Zuker M. (1989) On finding all suboptimal foldings of an RNA molecule. Science. 244, 48–52.
Zuker M. (2003) Mfold web server for nucleic acid folding and hybridization prediction. Nucl. Acids Res. 31, 3406–3415.
Dettlaff T.A., Ginsburg A.S., Schmalhausen O.I. (1993) Sturgeon Fishes: Developmental Biology and Aquaculture. Berlin: Springer-Verlag, p. 200–203.
Doroshov S.I., Moberg G.P., Van Eenennaam J.P. (1997) Observations on the reproductive cycle of cultured white sturgeon, Acipenser transmontanus. Environ. Biol. Fishes. 48, 265–278.
Benjamini Y., Hochberg Y. (1995) Controlling the false discovery rate: a practical and powerful approach to multiple testing. J. Roy. Statist. Soc. Ser. B (Methodological). 57, 289–300.
Tzur S., Rosset S. (2017) Strictly conserved tri-nucleotide motif “CAT” is associated with TAS DNA protein-binding sites in human mitochondrial DNA control region. Mitochondrial. DNA A DNA Mapp. Seq. Anal. 28, 250–253.
Водолажский Д.И., Корниенко И.В., Войнова Н.В. (2008) К вопросу о гипервариабельности региона D-петли митохондриальной ДНК русского осетра Acipenser gueldenstaedtii (Acipenseriformes; Acipenseridae). Вопросы ихтиологии. 48, 266–275.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология