Молекулярная биология, 2019, T. 53, № 2, стр. 324-329
Донор сероводорода NaHS защищает мезенхимальные стволовые и меланомные клетки от негативного воздействия инфракрасного лазерного излучения
Н. В. Андреева a, К. В. Зотов b, В. И. Юсупов b, А. В. Белявский a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Институт фотонных технологий Федерального научно-исследовательского центра
“Кристаллография и фотоника” Российской академии наук
108840 Троицк, Москва, Россия
* E-mail: abelyavs@yahoo.com
Поступила в редакцию 17.09.2018
После доработки 13.11.2018
Принята к публикации 14.11.2018
Аннотация
Ранее мы установили, что инфракрасное лазерное излучение с длиной волны 835 нм вызывает дозозависимое торможение роста мезенхимальных стволовых и меланомных клеток человека и способно вызвать гибель меланомных клеток. В настоящей работе показано, что донор сероводорода NaHS способен защищать клетки обоих типов от негативного воздействия лазерного излучения, при этом величина защитного эффекта зависит от концентрации NaHS. Механизм защиты клеток обусловлен, главным образом, воздействием NaHS на внутриклеточные процессы, происходящие после облучения, поскольку защитный эффект не зависит от времени добавления NaHS – до или после облучения. Более того, защитное действие наблюдается даже при добавлении NaHS через 6 ч после облучения.
ВВЕДЕНИЕ
Сероводород (H2S), роль которого в биологических системах ранее сводили к токсическим эффектам, в настоящее время рассматривается как один из трех важнейших вторичных посредников газообразной природы наряду с NO и CO [1, 2]. На протекторную функцию H2S в различных физиологических процессах указывает значительное число публикаций. В частности, Н2S проявляет противовоспалительную активность [3], защищает кровеносные сосуды и уменьшает повреждения миокарда при ишемической болезни [4], причем последнее достигается за счет воздействия на митохондрии [5].
Недавно мы показали, что инфракрасное лазерное излучение с длиной волны 835 нм влияет на рост меланомных клеток человека [6, 7]. При малых дозах облучения наблюдается стимуляция роста, в то время как высокие дозы приводят к прогрессирующему подавлению роста и даже гибели клеток. Сходные эффекты наблюдаются и при лазерном облучении мезенхимальных стволовых клеток (МСК) человека, однако эти клетки значительно более устойчивы к негативному действию излучения. Согласно опубликованным данным, инфракрасное излучение действует главным образом через митохондриальную цитохром-с-оксидазу [8, 9]. Поскольку митохондрии также могут служить мишенью H2S [10], высокие концентрации которого способны ингибировать цитохром-с-оксидазу [11], интересно было понять, может ли H2S модифицировать негативные эффекты инфракрасного излучения на клетки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культура клеток. Культивирование клеток метастатической меланомы кожи Mel IL и МСК описано ранее [7]. Клетки Mel IL культивировали до 50–60% монослоя в условиях нормоксии в среде RPMI-1640 (“ПанЭко”, Россия), содержащей 10%-ную эмбриональную телячью сыворотку (ЭТС), 2 мМ глутамин, пенициллин (100 ед./мл) и стрептомицин (100 мкг/мл). Препарат МСК из костного мозга эмбриона человека (FetMSC, из коллекции клеточных культур Института цитологии РАН) культивировали в среде DMEM (“ПанЭко”) с низкой концентрацией глюкозы (1000 мг/л), содержащей 10% ЭТС, 2 мМ глутамина, пенициллин (100 ед./мл) и стрептомицин (100 мкг/мл). МСК культивировали в мультигазовом СО2 инкубаторе в условиях гипоксии (5% О2) до 50–60% монослоя. Для пассирования клетки снимали с пластика в 0.25% растворе трипсина (“Sigma-Aldrich”, США) в 1× фосфатно-солевом буфере (ФСБ) с 0.02% EDТА при 37°С в течение 2–3 мин (меланомные клетки) и 7–10 мин (МСК человека), промывали 1 раз, центрифугируя в течение 7 мин при 367 g в среде RPMI и DMEM соответственно. Далее меланомные клетки рассевали в соотношении 1 : 8, а МСК – 1 : 4.
Облучение клеток. Клетки снимали трипсином, как описано выше, подсчитывали в камере Горяева и рассевали по 30 000 клеток на культуральные чашки Петри диаметром 3.5 см. Клетки облучали при комнатной температуре с помощью описанной ранее [6, 7] инфракрасной лазерной установки с длиной волны излучения 835 нм без термостатирования. Использовали среднедозовый (90 кДж/м2) и высокодозовый (540 кДж/м2) режимы облучения меланомных клеток и МСК соответственно. Повышение температуры среды за время облучения не превышало 2 и 5°С при использовании среднедозового и высокодозового режимов соответственно.
После облучения клетки культивировали в течение 1 суток, снимали трипсином, после чего окрашивали 0.2%-ным трипановым синим и подсчитывали число живых клеток в камере Горяева. Каждый экспериментальный вариант выполняли в трех повторностях. Для повышения точности анализа число меланомных клеток в каждой повторности подсчитывали 3 раза, число МСК – 4 раза, и вычисляли среднее значение.
Интегральный показатель числа удвоений популяции, пройденных культурой, и нормированный на 24 ч культивирования (ЧПУ/24), подсчитывали согласно формуле:
Обработка клеток NaHS. Препарат NaHS (“Sigma-Aldrich”) для предотвращения гидролиза растворяли в абсолютном этаноле до концентрации 250 мМ и хранили при –70°С не более 2 недель. Перед экспериментом готовили рабочие 50 и 100 мМ растворы NaHS в абсолютном этаноле. Непосредственно перед облучением клеток готовили двукратные растворы NaHS в полной среде, которые добавляли к равному объему клеточной культуры, после чего сразу же облучали. В некоторых опытах растворы NaHS добавляли сразу или через некоторое время после облучения клеток. В контрольные образцы клеток добавляли этанол до той же концентрации (0.02%), как и в экспериментальных образцах с NaHS.
Статистический анализ. При проведении статистического анализа (вычисление стандартных отклонений и статистической значимости по t‑критерию Стьюдента) использовали статистические функции программы Excel (Microsoft).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
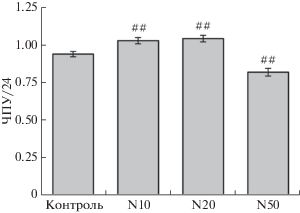
Возможные эффекты H2S при облучении клеток изучали с использованием NaHS в качестве донора сероводорода. В первую очередь анализировали влияние NaHS на рост линии меланомных клеток Mel IL. С этой целью определяли скорость роста клеток в течение 24 ч в среде, содержащей NaHS в концентрации 10, 20 и 50 мкМ. Данные, приведенные на рис. 1, показывают, что добавление 10 и 20 мкМ NaHS приводит к небольшому, но статистически значимому ускорению роста клеток Mel IL. В то же время присутствие 50 мкМ NaHS оказывало небольшой, но значимый негативный эффект на рост клеток Mel IL.
Рис. 1.
Влияние NaHS на рост клеток меланомы Mel IL. Контроль – клетки, к которым не добавляли NaHS. N10, N20 и N50 – клетки, к которым добавляли 10, 20 и 50 мкМ NaHS соответственно. Клетки культивировали в течение 1 суток при нормоксии. По оси ординат – интегральный показатель числа популяционных удвоений, пройденных культурой за 24 ч (ЧПУ/24); значение 1.0 соответствует одному удвоению в течение 1 суток. Показаны средние значения (три повтора) и квадратичные отклонения. р < 0.01 (##) по сравнению с контролем.
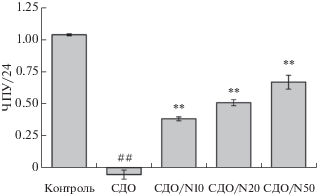
Далее было изучено влияние NaHS на меланомные клетки, подвергнутые воздействию инфракрасного лазерного излучения с длиной волны 835 нм. Суспензию клеток, снятых с подложки помощью трипсина, облучали инфракрасным излучением (средняя доза, 90 кДж/м2). Затем клетки культивировали в течение 1 суток и подсчитывали количество живых клеток в камере Горяева. Приведенные на рис. 2 результаты этих экспериментов показывают, что в соответствии с полученными нами ранее данными [7] средние дозы лазерного излучения вызывают резкую остановку роста клеток, а также относительно небольшой уровень интегральной гибели клеток. В то же время, добавление NaHS в среду до концентрации 10, 20 и 50 мкМ перед облучением существенно ослабляло негативный эффект, что выражалось в существенном и статистически значимом увеличении числа клеток после культивирования по сравнению с облученным образцом, не содержащим NaHS. Ослабление эффекта облучения носило дозозависимый характер. Наиболее значительная нейтрализация наблюдалась при 50 мкМ NaHS, хотя те же концентрации NaHS, наоборот, негативно действовали на необлученные клетки. Таким образом, NaHS оказывает именно протективный эффект, поскольку связан с частичной нейтрализацией негативных эффектов облучения, а не с общей стимуляцией клеточного роста.
Рис. 2.
Присутствие NaHS защищает клетки Mel IL от негативного действия инфракрасного лазерного излучения с длиной волны 835 нм. Контроль – клетки без облучения и без добавления NaHS. СДО – клетки, подвергнутые среднедозовому лазерному облучению (интенсивность 1500 Вт/м2, длительность 1 мин, доза 90 кДж/м2). СДО/N10, СДО/N20 и СДО/N50 – клетки, облученные в присутствии 10, 20 и 50 мкМ NaHS соответственно. Клетки культивировали в течение 1 суток в условиях нормоксии. Показаны средние значения (три повтора) и квадратичные отклонения. р < 0.05 (#) и p < 0.01 (##) по сравнению с контролем; p < 0.05 (*) и p < 0.01 (**) по сравнению с СДО. Прочие обозначения, как на рис. 1. Отрицательные значения ЧПУ/24 соответствуют абсолютному уменьшению числа живых клеток после культивирования.
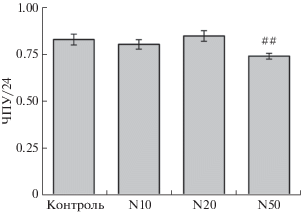
Далее мы оценили возможность протективного действия NaHS при инфракрасном облучении не только клеточных линий, но и первичных клеток, в качестве которых использовали МСК человека. Сначала, как и в случае Mel IL, изучили действие NaHS на рост МСК в течение 24 ч при гипоксии (5% О2). Данные, приведенные на рис. 3, показывают, что возможные эффекты NaHS в концентрации 10 и 20 мкМ на рост МСК статистически незначимы, в то время как 50 мкМ NaHS вызывал небольшое, но статистически значимое подавление роста МСК, как это показано и на меланомных клетках Mel IL.
Рис. 3.
Влияние NaHS на рост МСК человека. Контроль – клетки, к которым не добавляли NaHS. N10, N20 и N50 – клетки, к которым добавляли NaHS в концентрации 10, 20 и 50 мкМ соответственно. Клетки культивировали в течение 1 суток в условиях гипоксии. По оси ординат – интегральный показатель числа удвоений популяции, пройденных культурой за 24 ч (ЧПУ/24). Показаны средние значения (три повтора) и квадратичные отклонения. р < 0.01 (##) по сравнению с контролем.
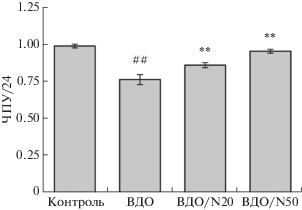
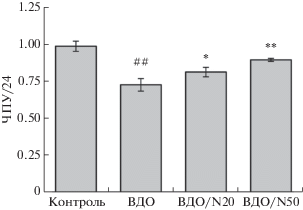
На рис. 4 приведены результаты изучения эффектов NaHS при облучении МСК. Поскольку, как показано нами ранее, МСК значительно более устойчивы к действию облучения, чем меланомные клетки [7], снижение числа МСК по сравнению с контролем было менее значительным, даже несмотря на высокую дозу облучения (540 кДж/м2). Тем не менее, при добавлении NaHS, как и в случае с меланомными клетками, наблюдалось статистически значимое снижение негативного эффекта облучения на МСК. Таким образом, NaHS оказывает дозозависимое протективное действие и при облучении МСК высокими дозами инфракрасного лазерного излучения. Наблюдаемый эффект, как и в случае Mel, не может быть объяснен простой стимуляцией роста МСК, поскольку в концентрации 50 мкМ, вызывающей наибольший эффект, NaHS приводит к значимому подавлению роста.
Рис. 4.
Присутствие NaHS защищает МСК человека от негативного действия инфракрасного лазерного излучения. Контроль – клетки без облучения и добавления NaHS. ВДО – клетки, подвергнутые высокодозовому лазерному облучению (интенсивность 1500 Вт/м2, длительность 6 мин, доза 540 кДж/м2). ВДО/N20 и ВДО/N50 – клетки, подвергнутые высокодозовому облучению в присутствии 20 и 50 мкМ NaHS соответственно. Клетки культивировали в течение 1 суток в условиях гипоксии. Показаны средние значения (три повтора) и квадратичные отклонения. Прочие обозначения, как на рис. 2.
Существует вероятность того, что протективное действие NaHS сводится к нейтрализации его влияния непосредственно при облучении (в частности, за счет нейтрализации короткоживущих свободных радикалов, которые, предположительно, могли образоваться в среде в момент облучения). Для проверки этой гипотезы мы провели эксперимент, в котором NaHS добавляли к клеткам МСК не до, а после облучения. Полученные данные (рис. 5) показывают, что в этом случае характер воздействия NaHS на клеточный рост не изменился и, более того, даже количественные показатели эффектов NaHS (изменения ЧПУ/24 по сравнению с облученным контролем) остались такими же (в пределах вариаций между экспериментами). Таким образом, протективные эффекты NaHS связаны, главным образом, с воздействием на процессы, происходящие в клетках после облучения, а не с непосредственной нейтрализацией действия самого излучения.
Рис. 5.
NaHS способен защищать МСК человека от негативного действия инфракрасного лазерного излучения и при добавлении после облучения. Клетки культивировали в течение 1 суток в условиях гипоксии (5% О2). Показаны средние значения (три повтора) и квадратичные отклонения. Эксперимент проводили, как на рис. 4, но NaHS добавляли сразу после облучения. Прочие обозначения, как на рис. 1.
Далее мы определяли продолжительность негативных процессов в облученных клетках, действие которых нейтрализует NaHS. В качестве клеточной модели использовали клетки Mel IL, которые характеризуются более выраженным ответом на облучение. Клетки подвергали воздействию средней дозы облучения, при этом NaHS добавляли в наиболее эффективной концентрации 50 мкМ до, сразу после, или через 1, 2 или 6 ч после облучения. Из рис. 6а видно, что хотя эффект NaHS при отложенном добавлении постепенно снижается, тем не менее он способен оказывать значительное защитное воздействие даже через 6 ч после облучения.
Рис. 6.
NaHS способен защищать клетки Mel IL от негативного действия инфракрасного лазерного излучения даже через несколько часов после облучения. а – Облучение клеток в суспензии; б – облучение прикрепленных клеток. Клетки подвергали лазерному облучению в средней дозе (СДО) (интенсивность 1500 Вт/м2, длительность 1 мин, доза 90 кДж/м2 и 1 мин 45 с, доза 157.5 кДж/м2 для суспензионных и прикрепленных клеток соответственно) и культивировали в течение 1 суток в условиях нормоксии. NaHS добавляли до концентрации 50 мкМ до облучения (СДО/N-до), сразу после (СДО/N-сп) или через 1, 2 и 6 ч после облучения (СДО/N-1 ч, СДО/N-2 ч и СДО/N-6 ч соответственно). Контроль – клетки без облучения и без добавления NaHS. Показаны средние значения (три повтора) и квадратичные отклонения. р < 0.01 (##) по сравнению с контролем, p < 0.01 (**) по сравнению с СДО. Прочие обозначения, как на рис. 1.
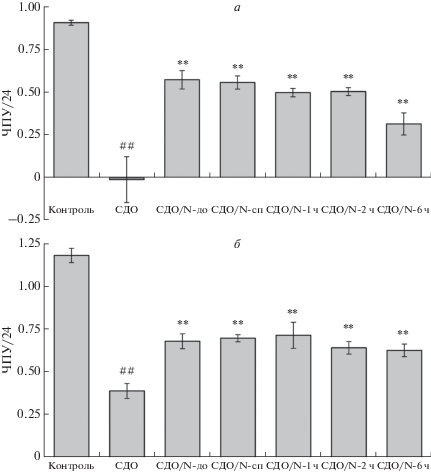
Проведенный эксперимент, хотя и дал ценную информацию, оставил определенные неясности в том, что касается защитного действия NaHS непосредственно на рост клеток. Это связано с тем, что в данном опыте, как и во всех предыдущих, облучали клетки, находящиеся в суспензии, а не в прикрепленном к пластику состоянии. В то же время, ранее мы показали, что облучение негативно воздействует не только на рост меланомных клеток, но и на предшествующую стадию прикрепления клеток к субстрату, что вносит существенный вклад во влияние облучения на интегральный рост клеток [7]. Прикрепление меланомных клеток происходит преимущественно в первые 2 ч и в основном заканчивается за 4 ч, вследствие чего добавление NaHS через 2–6 ч после облучения вряд ли может эффективно нейтрализовать его негативное действие. На основании этих соображений мы повторили эксперимент в варианте, когда облучали прикрепленные к пластику клетки. Показано (рис. 6б), что в прикрепленном состоянии клетки Mel IL существенно более устойчивы к действию излучения, что подтверждает полученные нами ранее данные [7]. Таким образом, значительная часть негативных эффектов облучения на состояние клеток Mel IL в суспензии связана либо с предположительно более высокой чувствительностью неприкрепленных к субстрату клеток к облучению, либо с торможением их прикрепления к субстрату, что может приводить к гибели клеток по механизму анойкиса [12]. Из рис. 6б видно, что NaHS нейтрализует, хотя и не полностью, негативные эффекты облучения на рост прикрепленных клеток. Хотя при задержанном добавлении NaHS (через 2 и 6 ч) наблюдается небольшое снижение защитного эффекта, однако это снижение не является статистически значимым. Поэтому можно предположить, что защитный эффект NaHS сохраняется и при более позднем, чем 6 ч, добавлении к облученным клеткам.
Механизм протективного действия NaHS при облучении остается неясным, однако можно предполагать, что NaHS ингибирует процессы апоптоза и некроза, вызванные действием высоких доз инфракрасного излучения [7]. Стоит отметить, что антиоксидантное действие сероводорода описано в ряде публикаций. Так, H2S защищает эндотелиальные клетки от вызванного пероксидом водорода окислительного стресса и митохондриальной дисфункции [13]. Н2S также способен снижать образование пероксида водорода и супероксидного аниона в гладкомышечных клетках сосудов, вызванное обработкой гомоцистеином [14].
Согласно некоторым данным, инфракрасное излучение с более короткой длиной волны (635 нм), чем использованное нами, действует через цитохром-с-оксидазу митохондрий, поглощающую в этой области. Высокие дозы облучения приводят к всплеску продукции супероксидного аниона в митохондриях и, в свою очередь, к проявлению цитототоксических эффектов [9]. Поэтому можно предположить, что H2S, высвобождаемый при культивировании клеток в присутствии NaHS, может действовать как антиоксидант, блокируя негативные эффекты активных форм кислорода, образующихся при облучении.
Работа выполнена при поддержке Российского научного фонда (грант № 17-74-30030).
Список литературы
Olas B. Hydrogen sulfide in signaling pathways. (2015) Clin. Chim. Acta. 439, 212–218.
Cuevasanta E., Möller M.N., Alvarez B. (2017) Biological chemistry of hydrogen sulfide and persulfides. Arch. Biochem. Biophys. 617, 9–25.
Wallace J.L., Blackler R.W., Chan M.V., Da Silva G.J., Elsheikh W., Flannigan K.L., Gamaniek I., Manko A., Wang L., Motta J.P., Buret A.G. (2015) Anti-inflammatory and cytoprotective actions of hydrogen sulfide: translation to therapeutics. Antioxid. Redox Signal. 22, 398–410.
Polhemus D.J., Lefer D.J. (2014) Emergence of hydrogen sulfide as an endogenous gaseous signaling molecule in cardiovascular disease. Circ. Res. 114, 730–737.
Xie Y.H., Zhang N., Li L.F., Zhang Q.Z., Xie L.J., Jiang H., Li L.P., Hao N., Zhang J.X. (2014) Hydrogen sulfide reduces regional myocardial ischemia injury through protection of mitochondrial function. Mol. Med. Rep. 10, 1907–1914.
Андреева Н.В., Зотов К.В., Егоров Е.Е., Калашникова М.В., Юсупов В.И., Баграташвили В.Н., Белявский А.В. (2016) Воздействие инфракрасного лазерного облучения на размножение клеток меланомы человека в культуре. Биофизика. 61, 1182‒1189.
Андреева Н.В., Зотов К.В., Егоров Е.Е., Кандараков О.Ф., Юсупов В.И., Белявский А.В. (2018) Цитотоксическое действие низкоинтенсивного инфракрасного лазерного облучения на клетки меланомы человека. Молекуляр. биология. 52, 1014–1028.
Passarella S., Karu T. (2014) Absorption of monochromatic and narrow band radiation in the visible and near IR by both mitochondrial and non-mitochondrial photoacceptors results in photobiomodulation. J. Photochem. Photobiol. B. 140, 344‒358.
Wu S., Zhou F., Wei Y., Chen W.R., Chen Q., Xing D. (2014) Cancer phototherapy via selective photoinactivation of respiratory chain oxidase to trigger a fatal superoxide anion burst. Antioxid. Redox Signal. 20, 733‒746.
Szabo C., Ransy C., Módis K., Andriamihaja M., Murghes B., Coletta C., Olah G., Yanagi K., Bouillaud F. (2014) Regulation of mitochondrial bioenergetic function by hydrogen sulfide. Part I. Biochemical and physiological mechanisms. Br. J. Pharmacol. 171, 2099–2122.
Nicholson R.A., Roth S.H., Zhang A., Zheng J., Brookes J., Skrajny B., Bennington R. (1998) Inhibition of respiratory and bioenergetic mechanisms by hydrogen sulfide in mammalian brain. J. Toxicol. Environ. Hlth A. 54, 491–507.
Paoli P., Giannoni E., Chiarugi P. (2013) Anoikis molecular pathways and its role in cancer progression. Biochim. Biophys. Acta. 1833, 3481–3498.
Wen Y.D., Wang H., Kho S.H., Rinkiko S., Sheng X., Shen H.M., Zhu Y.Z. (2013) Hydrogen sulfide protects HUVECs against hydrogen peroxide induced mitochondrial dysfunction and oxidative stress. PLoS One. 8, e53147.
Yan S.K., Chang T., Wang H., Wu L., Wang R., Meng Q.H. (2006) Effects of hydrogen sulfide on homocysteine-induced oxidative stress in vascular smooth muscle cells. Biochem. Biophys. Res. Commun. 351, 485–491.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


