Молекулярная биология, 2019, T. 53, № 2, стр. 200-217
Основной стрессовый белок человека (Hsp70) как фактор белкового гомеостаза и цитокин-подобный регулятор
Д. Г. Гарбуз a, *, О. Г. Зацепина a, М. Б. Евгеньев a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: dgarbuz@yandex.ru
Поступила в редакцию 07.09.2018
После доработки 10.10.2018
Принята к публикации 22.10.2018
Аннотация
Белки теплового шока (Hsp от Heat shock proteins) являются факторами белкового гомеостаза клетки. Обеспечивая фолдинг и внутриклеточный транспорт белков, а также восстановление или утилизацию белков, частично денатурированных под действием различных стрессовых факторов, Hsp проявляют шаперонные свойства. Белки семейства Hsp70, наиболее универсальные из молекулярных шаперонов, взаимодействуют с наибольшим количеством белков-субстратов. Ряд белков семейства Hsp70 способны секретироваться в межклеточное пространство, играя важную роль в межклеточных взаимодействиях и выступая как алармины, или сигналы опасности, модулирующие иммунный ответ. Кроме того, секретируемые Hsp70 могут выступать в роли эффективного нейропротектора, повышая выживаемость нейронов при различных протеинопатиях, что было продемонстрировано на моделях болезни Альцгеймера и Паркинсона. Использование рекомбинантного Hsp70, а также индукторов синтеза эндогенного Hsp70, в качестве иммуномодуляторов и нейропротекторов имеет перспективы для клинической практики.
ВВЕДЕНИЕ
Действие любых стрессовых факторов (тепловой шок (ТШ), гипоксия, окислительный стресс, отравления соединениями тяжелых металлов и др.) приводит к повышению в клетке концентрации частично денатурированных белков, которые впоследствии образуют агрегаты, что приводит к нарушению структуры цитоплазмы и гибели клетки. Белки, препятствующие агрегации и способствующие рефолдингу денатурированных белков или фолдингу белков, синтезируемых de novo, объединяют под общим названием молекулярные шапероны [1, 2]. Уровень некоторых из них значительно повышается под действием стресса (например, ТШ). Такие белки получили название белков теплового шока (Hsp), или стрессовых белков. Белки Hsp ‒ универсальная, наиболее древняя защитная система, способствующая выживанию клеток и организма в целом при повышении температуры и действии других видов стресса [3‒7]. Согласно общепринятой классификации Hsp делятся на группы по значениям молекулярной массы: низкомолекулярные Hsp (sHsp, 10‒30 кДа); Hsp40 (40 кДа); Hsp60 (шаперонины); Hsp70 (68–78 кДа); Hsp90 (82–96 кДа) и Hsp110 (группа белков с широким разбросом значений молекулярной массы от 80 до 170 кДа). Каждая группа может включать до нескольких десятков индивидуальных белков, близких по структуре и выполняющих сходные функции [8]. Кроме того, по характеру экспрессии все Hsp могут быть поделены на две большие группы: индуцируемые, уровень синтеза которых значительно повышается при действии стресса, и конститутивные (Hsc), экспрессия которых находится на высоком уровне в нормальных условиях и не возрастает (либо слабо возрастает) при стрессе [4, 9].
Ключевым компонентом системы фолдинга белков, синтезируемых de novo, и рефолдинга частично денатурированных белков при стрессовых воздействиях считается белок Hsp70 в силу его способности взаимодействовать с наибольшим спектром белков-субстратов по сравнению с другими шаперонами [10]. Способность Hsp70 препятствовать агрегации белков при действии стрессовых факторов в значительной степени определяет возможность организмов адаптироваться к неблагоприятным условиям окружающей среды, таким как частые перепады температуры, обезвоживание, гипоксия, действие многих токсинов и др. [4, 7]. Показано, что у видов, адаптированных к обитанию в экстремальных биотопах, уровень внутриклеточного Hsp70 значительно выше, чем у близкородственных видов, обитающих в более благоприятных условиях [5, 7, 11].
Помимо выполнения функций молекулярного шаперона в цитоплазме клеток, Hsp70 может секретироваться в межклеточную среду, поступает в кровь и выполняет функции, подобные функциям цитокинов, т.е. участвует в межклеточной сигнализации. Идентифицирован ряд рецепторов, узнающих секретируемые Hsp70, описаны некоторые специфические эффекты, вызываемые повышением уровня внеклеточного Hsp70. Так, внеклеточный (экзогенный) Hsp70 влияет на активность ряда клеток иммунной системы (в первую очередь, макрофагов и нейтрофилов), связываясь с некоторыми Toll-подобными рецепторами (TLR2 и TLR4) [12‒14]. Кроме того, секретируемый Hsp70 обладает высокой нейропротекторной активностью, повышает выживаемость нейронов при действии ряда стрессовых факторов, а также снижает уровень апоптоза нейронов в моделях некоторых нейродегенеративных заболеваний [15‒19]. В связи с этим индукторы синтеза Hsp70, а также рекомбинантный Hsp70 активно изучают в качестве перспективных иммуномодуляторов и цитопротекторов.
ВНУТРИКЛЕТОЧНЫЙ Hsp70 КАК ОСНОВНОЙ МОЛЕКУЛЯРНЫЙ ШАПЕРОН
В геноме человека охарактеризованы 13 генов, кодирующих белки группы Hsp70, обозначаемые как HSPA. Наиболее выраженной была индукция белков HSPA1A, HSPA1B и HSPA6 при ТШ. Тканеспецифичные белки HSPA1L и HSPA2 конститутивно синтезируются на высоком уровне в семенниках и некоторых других тканях. HSPA5 (обозначаемый ранее как GRP78, или BiP – Binding Immunoglobulin Protein) локализуется в эндоплазматической сети. Этот белок необходим для фолдинга практически всех белков, поступающих в эндоплазматическую сеть, в том числе иммуноглобулинов. Ген HSPA7 долгое время считали псевдогеном. Однако, данные свидетельствуют о том, что это полноценный ген, обладающий высокой гомологией с геном HSPA6 [8]. Белок HSPA8, ранее описанный под названиями HSC70 и HSP73, локализуется в цитозоле, где участвует в фолдинге белков, происходящем параллельно с процессом трансляции, а также в транспорте белков через внутриклеточные мембраны. HSPA9 является митохондриальным белком, а HSPA13 (или Stch) локализуется в микросомах. HSPA12A, HSPA12B и HSPA14 – эволюционно более удаленные представители семейства Hsp70, достоверная информация о функциях которых на сегодня отсутствует [8]. Гены HSPA1A, HSPA1B и HSPA1L образуют в геноме человека и др. млекопитающих тесный кластер, а остальные гены этой группы рассеяны по геному [20‒24].
По данным рентгеноструктурного анализа молекула HSPА1А состоит из N-концевого консервативного домена длиной около 450 аминокислотных остатков и С-концевого вариабельного домена, состоящего примерно из 200 аминокислот. N-концевой домен этой молекулы обладает АТР-связывающей и, в присутствии определенных белков-кофакторов, АТРазной активностью. Данный домен напоминает по характеру третичной структуры АТР-связывающий домен актина и гексокиназ. С-концевой домен образует субстратсвязывающий участок, взаимодействующий с белками-мишенями [25, 26]. Высокое сродство к АТР позволяет легко очищать Hsp70 с помощью аффинной хроматографии на АТР-сефарозе, что широко используется в лабораторной практике [27].
Белки семейства Hsp70 выполняют в клетке различные функции, большинство из которых связано с их шаперонной активностью. В основе действия Hsp70 лежит его способность взаимодействовать с другими клеточными белками, предотвращая их агрегацию и способствуя восстановлению нативной структуры белков, частично денатурированных в условиях различных стрессовых воздействий [10, 28, 29]. Также Hsp70 связывается с белками, синтезируемыми de novo, в процессе роста полипептидной цепи, способствуя их фолдингу (рис. 1а). Взаимодействие с частично денатурированными белками определяется особенностями строения C-концевого домена Hsp70, содержащего гидрофобный карман, напоминающий по структуре пептидсвязывающий участок молекул главного комплекса гистосовместимости, особенно MHC типа II. При этом пептидсвязывающий карман Hsp70 имеет более открытую структуру, чем у молекул МНС, что позволяет ему взаимодействовать не только с пептидами, но и с полноразмерными белками [26]. Hsp70 узнает последовательности, богатые гидрофобными аминокислотами. В норме такие участки, имеющие гидрофобную природу, локализуются преимущественно внутри белковых глобул, и, как правило, их появление на поверхности белка указывает на нарушение его структуры. Показано, что гидрофобные последовательности, узнаваемые Hsp70, встречаются в среднем через каждые 40 аминокислотных остатков [30]. Взаимодействие шаперонов семейства Hsp70 с белками-субстратами требует участия ряда белков-кофакторов, регулирующих АТРазную активность Hsp70, обмен АDP на АТP и перенос белка-субстрата с Hsp70 на другие шапероны. Для взаимодействия с Hsp70 белок-субстрат должен образовать комплекс с белком Hsp40 (DnaJ), который является одновременно молекулярным шапероном, способным узнавать белки, потерявшие нативную конформацию, и кофактором Hsp70. Далее Hsp70, находящийся в АТР-связанной форме, взаимодействует с комплексом DnaJ/белок-субстрат. После этого DnaJ стимулирует гидролиз АТР до АDP и стабилизирует взаимодействие Hsp70 с белком-субстратом. Сродство DnaK к АDP выше, чем к АТP, поэтому для обмена АDP на АТP требуется еще один вспомогательный белок – фактор обмена нуклеотидов. Известно несколько кофакторов, стимулирующих диссоциацию эукариотического комплекса Hsp70 с АDP, основной из которых ‒ Hsp110. После диссоциации Hsp70 и АDP происходит высвобождение белка-субстрата и присоединение новой молекулы АТР. Как правило, фолдинг белков с участием Hsp70 требует нескольких циклов ассоциации‒диссоциации, сопровождающихся гидролизом АТР. Энергия гидролиза АТР используется для стабилизации промежуточной конформации белка в ходе восстановления его нативной структуры [31]. Кроме того, шапероны снижают энтропию молекулы белка-клиента, уменьшая число возможных внутримолекулярных взаимодействий [32]. Многие белки с массой до 60 кДа для завершения формирования нативной структуры после диссоциации с Hsp70 взаимодействуют с другими шаперонами: Hsp60 (шаперонины) или Hsp90. Необратимо денатурированные белки, неспособные к восстановлению нативной конформации, после взаимодействия с Hsp70 убиквитинируются и подвергаются деградации в протеасомах [33]. Ключевыми факторами при выборе пути между рефолдингом или деградацией белка-субстрата являются убиквитинлигаза CHIP и белки семейства Bag (альтернативные факторы обмена нуклеотидов для Hsp70). Hsp70 участвует в убиквитин-зависимой деградации многих клеточных белков: актина, α-кристаллинов, глицеральдегид-3-фосфат-дегидрогеназы и гистона 2А [34].
Рис. 1.
а ‒ Механизм действия шаперонов как внутриклеточных белков. 1 – Частично денатурированные белки; 2 – промежуточная конформация (переходное состояние); 3 – нативная конформация; 4 – агрегаты. Шапероны (в том числе Hsp70) препятствуют агрегации частично денатурированных белков и способствуют приобретению ими нативной структуры за счет стабилизации переходного состояния с использованием энергии АТР. б ‒ Экзогенный Hsp70 в качестве цитокина. Предполагаемый механизм блокирования действия ЛПС при введении экзогенного Hsp70 путем конкуренции за рецептор TLR4.
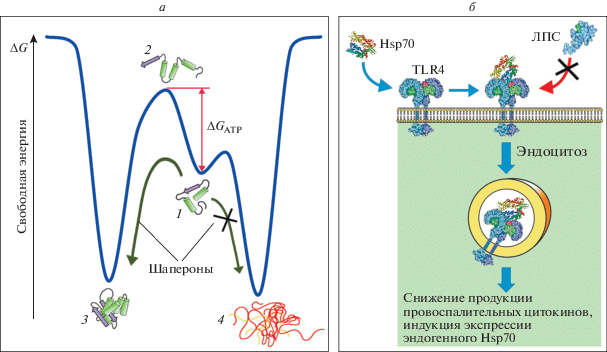
Помимо ренатурации клеточных белков после стрессового воздействия, белки семейства Hsp70 необходимы для фолдинга белков параллельно с процессом трансляции в ходе нормальной жизнедеятельности клетки [30, 35, 36]. Практически все клеточные белки хотя бы временно взаимодействуют с HSPA8 (конститутивно экспрессируемый член семейства Hsp70) в ходе трансляции. Hsp70 принимают участие в деградации внутриклеточных белков в лизосомах, участвуя в их транспорте через мембрану в комплексе с белком LAMP2 (Lysosomal-associated membrane protein 2) [37]. Белки семейства Hsp70 необходимы также для транспорта белков в эндоплазматическую сеть и митохондрии. В цитозоле синтезируемые белки связываются с HSPA1L и HSPA2. В ходе транспорта белков через митохондриальную мембрану происходит их диссоциация, сопровождаемая гидролизом АТР. В цитозоле HSPA1L и HSPA2 поддерживают полипептидную цепь в развернутом состоянии, предупреждая образование третичной структуры, которая будет препятствовать прохождению белка через транслокон [38]. АТР не требуется для транспорта белков, предварительно денатурированных мочевиной. В ходе переноса через мембрану и отщепления N-концевой сигнальной последовательности полипептидная цепь связывается с митохондриальным Hsp70, от которого затем также освобождается после гидролиза АТР. В случае взаимодействия митохондриального Hsp70 с транспортируемым белком именно гидролиз АТР служит источником энергии для переноса белка через внутреннюю митохондриальную мембрану [39‒41].
Белки, секретируемые в межклеточную среду или экспрессируемые на клеточной мембране, не способны без участия шаперонов сформировать нативные структуры в эндоплазматической сети. Белок HSPA5 связывается с люменальной частью трансмембранной поры, способствуя переносу синтезируемых белков с полисом в эндоплазматическую сеть [42, 43]. В просвете эндоплазматической сети HSPA5 необходим для фолдинга рецепторов инсулина, иммуноглобулинов и других секретируемых белков [44, 45]. Кроме того, HSPA5 участвует в деградации поврежденных белков в эндоплазматической сети при стрессе (endoplasmic reticulum-associated degradation, ERAD) [46, 47].
Белок Hsp70 ‒ важное звено антиокислительной системы, которая защищает клетки от свободных радикалов. Экспрессия Hsp70 усиливается при окислительном стрессе. Hsp70 участвует в деградации окисленных белков и повышает активность супероксиддисмутазы и каталазы, опосредованно способствуя инактивации супероксидных антионов и пероксида водорода [33].
В настоящее время накоплен большой материал, позволяющий сделать вывод о том, что Hsp70 и низкомолекулярные Hsp являются эффективными ингибиторами апоптоза [48‒55]. Hsp70 способен блокировать р53-зависимый апоптоз, а также апоптоз, вызываемый TNF-α, но не влияет на Fas-опосредованный апоптоз [56]. При этом Hsp70 может вмешиваться в каскад запуска апоптоза на разных его стадиях. Во-первых, экспрессия Hsp70 в значительной степени ингибирует активацию стрессовых киназ семейства SAPK/JNK, одного из основных ранних триггеров апоптоза [57‒60]. Hsp70 препятствует выходу цитохрома с из митохондрий, подавляя транслокацию белка Bax [61]. Сообщается о взаимодействии Hsp70 с белком Apaf-1, которое препятствует образованию комплекса Apaf-1 с цитохромом c и активации каспазы 9 [62]. Белки семейства Hsp70 также способны влиять на протекание апоптоза, взаимодействуя с белком Bag1 ‒ активатором антиапоптотического белка Вcl-2 [57].
Некоторые факты позволяют предположить, что Hsp70 участвует в регуляции апоптоза и на более поздних стадиях. Так, при конститутивной экспрессии Hsp70 уменьшается интенсивность протеолиза субстратов каспазы-3, хотя Hsp70 не влияет непосредственно на каталитическую активность уже активированной каспазы-3 in vitro [57]. Возможно, Hsp70 связывается с субстратами каспаз и препятствует их протеолизу. Эта гипотеза подтверждается способностью Hsp70 предохранять клетки от гибели при экспрессии исходно активной генно-инженерной формы каспазы-3 [63]. Hsp70 может взаимодействовать с белками семейства NF-kB, препятствуя их транспорту в ядро, что приводит к замедлению индуцированного TNF апоптоза в клетках U-937. Этот эффект не зависит от ингибитора NF-kB (IkB), так как IkB не обнаруживается в комплексах Hsp70 с р65 и c-Rel [64].
Защитный эффект внутриклеточного Hsp70 может иметь как положительные, так и отрицательные стороны. С одной стороны, возможность подавления апоптоза в клетках головного мозга и сердца при ишемии позволяет отнести Hsp к защитным факторам организма. Так, индукция экспрессии Hsp70 в сердечной мышце снижает уровень гибели кардиомиоцитов от ишемии при инфаркте миокарда и хирургических вмешательствах. Ряд химических соединений, например, такие индукторы синтеза Hsp, как бимокломол и геранилгеранилацетон, предложено применять для снижения риска послеоперационных осложнений [65]. В тканях головного мозга Hsp70 ингибирует образование агрегатов α-синуклеина и тау-белка, оказывая нейропротективный эффект и препятствуя развитию таких нейродегенеративных заболеваний, как паркинсонизм и болезнь Альцгеймера [60, 67]. С другой стороны, высокая антиапоптозная активность позволяет рассматривать Hsp70 как промотор онкогенеза. Большинство опухолей характеризуется конститутивно высоким уровнем Hsp70 (по сравнению с окружающими тканями), который придает им устойчивость ко многим цитотоксическим факторам, в том числе к химиотерапевтическим препаратам, индуцирующим апоптоз, а также к гипоксии при недостаточной васкуляризации опухоли [53, 54, 68, 69]. Высокий уровень Hsp70 в опухоли считается плохим прогностическим признаком при некоторых видах рака [70]. В связи с этим в настоящее время проводится скрининг химических соединений, способных ингибировать активность Hsp70, в качестве потенциальных противоопухолевых препаратов, потенцирующих действие химиотерапевтических средств, например цисплатина [71].
МЕХАНИЗМЫ СЕКРЕЦИИ ЭКЗОГЕННОГО Hsp70
В течение некоторого времени с момента открытия Hsр рассматривали как исключительно внутриклеточные белки, функции которых ограничены поддержанием белкового гомеостаза клетки. Однако впоследствии начали появляться данные о том, что многие Hsp (наряду с некоторыми белками, ранее считавшимися внутриклеточными) в некоторых ситуациях способны выходить в межклеточное пространство. Например, после ТШ эмбриональные клетки крысы в первичной культуре выделяют в культуральную среду ряд Hsp (Hsp110, Hsp70 и Hsc70) [72]. В дальнейшем обнаружили, что Hsp70 человека циркулирует в сыворотке крови всех исследованных индивидов, не страдающих какими-либо выраженными заболеваниями [73]. Выяснилось, что представители большинства семейств Hsp способны секретироваться в межклеточное пространство и обнаруживаются в кровотоке. Показана секреция в межклеточную среду Hsp27, Hsp60, Hsp70, Hsc70, Hsp90 и Hsp110 in vitro и in vivo. Выяснилось, что способность секретировать Hsps не является специфичной для какого-либо определенного типа клеток: в независимых работах нескольких авторских коллективов показана секреция Hsp нейронами, моноцитами, макрофагами, В-клетками, эндотелиальными клетками, а также опухолевыми клетками эпителиального происхождения [13, 74–77]. Секреция Hsp70 и его кофактора Hsp40 выявлена не только в клетках млекопитающих, но и в клетках беспозвоночных (Drosophila melanogaster) [78, 79]. Механизм секреции Hsp70 в течение некоторого времени не был известен. Будучи классическими белками домашнего хозяйства, Hsp лишены N‑концевой сигнальной последовательности, необходимой для секреции через эндоплазматическую сеть и комплекс Гольджи. На сегодня обнаружены несколько механизмов секреции, с помощью которых Hsp70 и ряд других белков, не имеющих N-концевой лидерной последовательности, высвобождаются из клетки: разрушение клеток при некрозе под действием различных повреждающих факторов (неспецифический механизм); секреция в составе отпочковывающихся мембранных пузырьков (эктосом) или классических экзосом, а также экзоцитоз с участием эндолизосом [74, 80, 81]. В последнем случае для секреции Hsp70 необходимо участие механизма переноса белков через мембрану. Показано, что переносчиком Hsp70, по-видимому, служит белок ABCA1, относящийся к семейству ABC (ATP-binding cassette), в который входит также белок TAP1, осуществляющий перенос антигенных пептидов через мембрану эндоплазматической сети. Ингибиторы белков семейства ABС эффективно блокируют выход Hsp70 из клеток [81]. Этот механизм транспорта показан для ряда белков, не имеющих, как и Hsp70, N-концевой сигнальной последовательности, необходимой для классической секреции, выполняющих основные функции вне клетки в качестве цитокинов (IL-1α и -β, IL-18, FGF1 и некоторых других) [81–83]. Для трансмембранного переноса белков, не имеющих соответствующего N-концевого лидера, необходима частичная дестабилизация их третичной структуры до состояния расплавленной глобулы [82]. В таком виде некоторые белки могут транспортироваться через липидный бислой с участием АВС-переносчиков или путем взаимодействия с фосфатидилсерином в составе внутреннего липидного слоя мембраны с последующим переходом вместе с молекулой фосфатидилсерина во внешний слой и высвобождением в межклеточную среду [81]. ТШ, приводящий к частичной денатурации клеточных белков, повышает секрецию не только Hsp70, но также FGF1 и IL-1α [81]. Показано, что при сверхэкспрессии Hsp при стрессовых воздействиях до 10–15% вновь синтезированного Hsp70 встраивается в плазматическую мембрану, экспонируя на ее внешней поверхности фрагмент С-концевого домена из 14 аминокислотных остатков [84, 85]. Ассоциированный с мембраной Hsp70 секретируется в таком виде некоторыми опухолевыми клетками в составе экзосом. Таким образом, Hsp70 высвобождается в межклеточную среду в виде двух фракций: мембраносвязанной и в виде свободного белка [71, 80, 86, 87].
Секреция Hsp70 клетками стимулируется различными стрессовыми факторами [72, 74], а также неспецифичными бактериальными антигенами (такими, как GroEL) и липополисахаридами (ЛПС, основной эндотоксин грамотрицательных бактерий) как in vitro, так и in vivo. Введение очищенного GroEL и ЛПС в культуральную среду усиливает секрецию Hsp70 культивируемыми моноцитами в 10 и 3 раза соответственно [76]. Внутривенное введение ЛПС приводит к повышению уровня Hsp70 в сыворотке крови крыс [88]. Еще одним индуктором секреции Hsp70 может быть повышение уровня внеклеточного АТР [80]. Те же стимулы (внеклеточный АТР и ЛПС) приводят к повышению секреции макрофагами IL-1α, высвобождающегося по тому же механизму, что и Hsp70 [13]. Таким образом, секреция Hsp70 может индуцироваться неспецифическими агентами, свидетельствующими об инфекционном процессе или массовой гибели клеток. Кроме того, уровень экзогенного Hsp70 (далее еHsp70) может повышаться и при некрозе непосредственно за счет выхода из разрушающихся клеток.
ИММУНОРЕГУЛЯТОРНЫЕ ФУНКЦИИ eHsp70
Внеклеточные Hsp, в частности Hsp70, не способны выполнять шаперонные функции в отсутствие высокой концентрации АТР и набора специфических белков-кофакторов. Известно, что секретируемые Hsp, включая Hsp70 и Hsp60, узнаются рядом так называемых паттернраспознающих рецепторов (pattern recognition receptors – PRR), важнейшего звена системы врожденного иммунитета. PRR отвечают за распознавание широкого спектра консервативных молекулярных структур, не имеющих аналогов в организме, но представленных у возбудителей большинства бактериальных, грибковых и вирусных инфекций (ЛПС, формилпептиды, тейхоевые и липотейхоевые кислоты, зимозан, дцРНК и другие патоген-ассоциированные молекулярные структуры – pathogen-associated molecular patterns, РАМР) [89]. В первую очередь Hsp70 и Hsp60 узнаются рецепторами TLR2 и TLR4, а также LOX-1, SREC-1 и CLEVER-1 (группа Scavanger receptors, SR). Кроме того, по некоторым данным в распознавании eHsp могут участвовать CD40 (семейство рецепторов TNF), CD91 (рецептор липопротеинов низкой плотности) и CCR5 (рецептор хемокинов) [13, 90, 91]. Показано, что некоторые рецепторы могут узнавать как собственные внеклеточные Hsp, так и Hsp бактериального происхождения (например, CD40 распознает Hsp70 микобактерий) [92]. Таким образом, для eHsp70 предложен термин “шаперокин”, подчеркивающий дихотомию функций Hsp70 как молекулярного шаперона (внутриклеточная форма), так и трансмиттера межклеточных сигналов, реализующихся через специфическое взаимодействие лиганд‒рецептор, наподобие классических цитокинов (рис. 1б) [93].
Взаимодействуя с рядом рецепторов на клеточной поверхности, eHsp70 способен подвергаться интернализации клетками-мишенями. По-видимому, за фагоцитоз eHsp70 отвечают TLR2/4, CD91 и SR [13, 91, 94].
В ряде работ, посвященных влиянию Hsp70 на активность клеток иммунной системы, установлено, что повышение уровня внеклеточного Hsp70 вызывает продукцию провоспалительных цитокинов (TNF-α, IL-1β, IL-6), активных форм кислорода (АФК) и оксида азота (NO) макрофагами и нейтрофилами посредством активации рецепторов TLR2 и TLR4. eHsp70 при этом описан как неспецифический маркер, свидетельствующий о стрессе либо о развитии различных патологических процессов и способствующий активации клеток иммунной системы, наподобие PAMP. Таким образом, предполагалось, что взаимодействие Hsp70 c TLR4 направлено на стимуляцию неспецифического иммунного ответа (активацию врожденного звена иммунитета) [95‒97]. Известно, что аналогичный эффект оказывают эндотоксины грамотрицательных бактерий (ЛПС) посредством активации той же группы TLR ‒ TLR2/4. Взаимодействие ЛПС с TLR4 вызывает активацию NF-κB, MAPK/JNK и IRF3 (interferon regulatory factor 3), что приводит к избыточной продукции ряда провоспалительных цитокинов, АФК и NO [98]. В связи с этим предположили, что описанные эффекты объясняются контаминацией использованного в данных работах рекомбинантного Hsp70, синтезированного в культуре E. coli, ЛПС, способным даже в следовых количествах индуцировать реакцию макрофагов и нейтрофилов [99, 100]. Впоследствии с использованием Hsp70, синтезированного в эукариотических системах экспрессии (например, бакуловирусной), и свободного от загрязнений ЛПС и бактериальными белками, были получены данные о том, что, подавляя активацию неспецифического иммунитета, eHsp70 оказывает скорее обратный эффект [14, 101]. В модели культивируемых моноцитов eHsp70 вызывал толерантность к ЛПС [102]. Показано, что действие еHsp70 in vitro и in vivo подавляет внутриядерную транслокацию фактора транскрипции NF-κB (р65), индуцируемую действием ЛПС, активность протеинкиназ MAPK/JNK, а также продукцию АФК [103‒105]. Очищенный от примесей эндотоксинов Hsp70 подавляет воспаление дыхательных путей аллергической этиологии у мышей [106]. Таким образом, во многих экспериментах еHsp70 оказывался скорее антагонистом ЛПС, блокирующим активацию NF-κB через TLR2 и TLR4. С другой стороны, в некоторых работах еHsp70, продуцируемый культурами эукариотических клеток, и поэтому свободный от ЛПС, тем не менее вызывал повышение продукции ряда провоспалительных цитокинов и активацию воспалительного ответа [97]. Показано, что две фракции eHsp70, свободная и мембраносвязанная, оказывают принципиально разное воздействие на клетки иммунной системы. Мембраносвязанный eHsp70, секретируемый в составе экзосом, вызывает активацию макрофагов и действует как провоспалительный агент, тогда как свободный eHsp70 оказывает противоположный эффект и является антагонистом ЛПС, конкурируя с ним за TLR4 [14, 71]. Следует учитывать, что Hsp70 и другие шапероны (в том числе рекомбинантные, используемые в экспериментах по иммуномодуляции) могут выделяться из клеток в разных формах: в комплексе с АТР или АDP, а также с пептидами-мишенями. Разные формы Hsp могут узнаваться разными рецепторами и по-разному влиять на активность клеток иммунной системы.
Взаимодействие еHsp70 с TLR4 было в дальнейшем подтверждено [107]. Установлено, что связывание свободного Hsp70 с TLR4 не вызывает, в отличие от ЛПС, активацию каскадов NF-κB, MAPK/JNK и IRF3, приводящих к продукции провоспалительных цитокинов [97, 98]. Известно, что различные лиганды по-разному взаимодействуют с TLR4, и только некоторые из них вызывают гиперактивацию сигнального пути TLR4-NF-κB [108]. Таким образом, подтверждается гипотеза о том, что Hsp70, конкурируя с ЛПС за TLR4, является антагонистом ЛПС.
Действие ЛПС в высоких концентрациях (при сепсисе, т.е. при массированном проникновении в кровоток грамотрицательных бактерий) приводит к развитию симптомокомплекса, получившего название эндотоксинового, или септического шока, ключевой этап развития которого ‒ образование комплекса ЛПС с TLR2/4, которые экспрессируются нейтрофилами и макрофагами [109]. В результате избыточная продукция АФК, NO, ряда провоспалительных цитокинов, гистамина и серотонина приводит к развитию симптомов эндотоксинового (септического) шока: резкому падению артериального давления, повышению свертываемости крови и, как следствие, к недостаточной оксигенации тканей и развитию полиорганной недостаточности. Септический шок при генерализованных инфекциях, особенно вызываемых внутрибольничными штаммами возбудителей, устойчивыми к действию антибиотиков, остается важной медицинской проблемой. Известно, что сепсис является одной из ведущих причин смерти больных, поступающих в палаты интенсивной терапии [110, 111].
За последнее время получен ряд свидетельств участия как внутриклеточного, так и секретируемого Hsp70 в регуляции ответа организма на действие ЛПС. Показано, что внутрибрюшинное введение ЛПС вызывает индукцию Hsp70 в макрофагах мыши [112]. Агонисты TLR4 (ЛПС), TLR2 (Pam3Cys) и TLR3 (poly(IC)) индуцировали Hsp70 in vitro, проявляя в этом синергический эффект [113]. У детей, находящихся в палатах интенсивной терапии после проведения хирургических операций, уровень секретируемого Hsp70 в сыворотке крови при развитии септического шока повышался в 6 раз по сравнению с пациентами без сепсиса [114]. При этом повышение концентрации как внутриклеточного, так и секретируемого Hsp70 снижало уровень ответа на ЛПС. Показано, что еHsp70 подавляет активацию опосредованного NF-κB ответа моноцитов и секрецию TNF-α в ответ на введение ЛПС [102]. Индукция синтеза Hsp70 путем перорального введения геранилгеранилацетона снижала уровень NO, TNF-α и IL-6, индуцируемых ЛПС, а также гибель подопытных животных [115]. Ранее показали, что однократное внутривенное введение смеси индуцируемой и конститутивной форм Hsp70, выделенных из мышечной ткани быка, перед инъекцией ЛПС из E. coli и Salmonella typhimurium эффективно снижает смертность крыс линии Wistar от эндотоксинового шока [116]. Превентивное введение экзогенного Hsp70/Hsc70 нормализует ряд физиологических параметров, изменение которых приводит к таким фатальным последствиям при развитии септического шока, как снижение артериального давления и повышение скорости свертывания крови [116]. Также введение Hsp70 способствовало восстановлению ряда биохимических параметров крови (концентрации билирубина, креатинина, сывороточного альбумина, общего белка и др.). Профилактическое введение рекомбинантного Hsc70 перед инъекцией ЛПС предотвращало развитие сердечной и печеночной недостаточности [104]. При этом инъекция Hsp70 после введения ЛПС, хотя и приводила к нормализации некоторых физиологических и биохимических параметров, но не повышала выживаемость животных. Ранее показали, что экзогенный рекомбинантный Hsp70 человека (HSPA1A) снижает продукцию АФК, NO и TNF-α нейтрофилами, экспрессию рецепторов CD11b/CD18, а также восстанавливает нормальный уровень апоптоза нейтрофилов и ряд биохимических параметров крови при действии как ЛПС, так и липотейхоевой кислоты (основного эндотоксина грамположительных бактерий) [101, 117]. Эти результаты независимо подтверждаются данными работы [88], в которой показано, что у крыс с экспериментально индуцированным эндотоксиновым шоком уровень секретируемого Hsp70 возрастает более чем в 10 раз, при этом выживаемость животных с высоким уровнем Hsp70 в крови была выше, чем с низким уровнем Hsp70.
Анализ кинетики ингибирующего воздействия Hsp70 на индуцированную ЛПС продукцию АФК нейтрофилами показал, что эффект от введения Hsp70 развивается в течение 4–5 мин [101, 118, 119]. Взаимодействие ЛПС с рецепторами CD14/TLR4 также характеризуется быстрой кинетикой (порядка нескольких минут), что соответствует времени ингибирования эффекта ЛПС при введении Hsp70 [120]. Таким образом, гипотетический механизм действия Hsp70 при подавлении эндотоксинового шока может заключаться в конкуренции с ЛПС за рецепторы TLR4 и блокирование взаимодействия ЛПС с нейтрофилами и другими клетками иммунной системы (рис. 1б).
Показано, что рецептор TLR4 может опосредовать эндоцитоз еHsp70 [13, 94], что подтверждается данными о более интенсивной интернализации Hsp70, добавленного в культуральную среду, клетками, экспонирующими на поверхности TLR4, по сравнению с линиями клеток, не имеющих TLR [107]. Таким образом, фагоцитоз комплекса TLR4/Hsp70 также может способствовать блокированию взаимодействия TLR4 с ЛПС. Эту гипотезу подтверждает тот факт, что эффективное действие Hsp70 наблюдается только при его превентивном введении за 10 мин до инъекции ЛПС. Геранилгеранилацетон ‒ индуктор синтеза Hsp70, также был наиболее эффективным при профилактическом введении (за 16 ч до инъекции ЛПС) [115].
Протективное действие еHsp70 при эндотоксиновом шоке может быть обусловлено не только конкуренцией с ЛПС за TLR, но и феноменом индукции синтеза в клетках-мишенях эндогенных Hsp в ответ на введение еHsp70 [97]. Механизм этого эффекта также опосредуется взаимодействием eHsp70 с TLR4, которое не приводит к активации NF-κB, в отличие от ЛПС, а вызывает активацию альтернативного TLR4-зависимого сигнального каскада с участием PI3K и Akt. В свою очередь, Akt ингибирует активность киназы гликоген-3β-синтазы (GSK-3β), одного из негативных регуляторов HSF1, главного фактора транскрипции, отвечающего за транскрипцию генов Hsp [97]. Интересно, что внутриклеточный Hsp70 опосредует убиквитинирование TLR4, а также выступает в качестве ингибитора сигнального каскада NF-κB, индуцируемого активацией TLR4, и, соответственно, подобно eHsp70, снижает сверхпродукцию цитокинов под действием ЛПС [121]. Таким образом, препараты рекомбинантного Hsp70 и/или индукторы синтеза Hsp70, такие как геранилгеранилацетон и интерферон-γ в низких дозах, могут быть рекомендованы к клиническим испытаниям в качестве препаратов для профилактики септических осложнений.
eHsp70 в большом количестве секретируется различными опухолями. Характерной особенностью многих опухолевых клеток является высокий уровень мембраносвязанного Hsp70, экспонируемого на поверхности клетки [122‒124]. Искусственное повышение уровня поверхностного Hsp70, связанного с плазматической мембраной опухолевых клеток, способно вызывать активацию натуральных киллеров, некоторых типов эффекторных Т-клеток и последующий лизис опухоли. Такой эффект может быть вызван введением низких доз γ-интерферона или экзогенного Hsp70 [123, 125‒127].
О роли секреции опухолевыми клетками Hsp70 в составе экзосом получены противоречивые данные. С одной стороны, такие экзосомы способны вызывать активацию дендритных клеток, повышение эффективности распознавания опухолевых антигенов и увеличение секреции ряда цитокинов [127]. С другой стороны, секреция экзосом, несущих на поверхности Hsp70, рассматривается многими авторами как один из механизмов подавления опухолевыми клетками иммунного ответа. По некоторым данным такие экзосомы узнаются TLR2 миелоидных супрессорных клеток, блокирующих активацию опухолеспецифичных Т-клеток [71, 128, 129].
Наконец, предложен метод стимуляции противоопухолевого адаптивного иммунного ответа с помощью Hsp70, выделяемого непосредственно из опухолевой ткани. Показано, что Hsp70 и Hsp90, выделенные из клеток опухоли, а затем вводимые в кровь пациенту, способны индуцировать иммунный ответ путем активации антигенпредставляющих клеток и цитотоксических T-лимфоцитов [94]. Это явление объясняется тем, что Hsp70 и Hsp90 выделяются из опухолей в комплексе с олигопептидами, способными выступать в качестве антигенов – инициаторов иммунного ответа [47, 94, 130]. Далее происходит фагоцитоз комплексов Hsp и опухолевых пептидов антигенпредставляющими макрофагами посредством узнавания Hsp рецепторами CD91. После этого опухолеспецифичные антигенные пептиды презентируются с участием как MHCI, так и MHCII с участием TAP1-зависимого и эндосомного пути [47, 94]. В результате происходит активация эффекторных Т-клеток, распознающих и атакующих опухолевые клетки. Соответственно, Hsp70 и Hsp90 в комплексе с антигенными пептидами, очищенные из опухолей пациентов, могут рассматриваться как персонализированные вакцины, применяемые в комплексе со стандартными методами лечения онкологических больных [131].
Hsp70 КАК НЕЙРОПРОТЕКТИВНЫЙ ФАКТОР
Большой медицинской и социальной проблемой становится распространение нейродегенеративных заболеваний, в первую очередь, болезни Альцгеймера (далее БА). Частота сенильной (старческой) формы БА постоянно повышается, прежде всего в развитых странах, в результате увеличения продолжительности жизни населения, что приводит к значительной нагрузке на экономику [132, 133]. Считается, что развитие БА обусловлено накоплением патологически агрегированного β-амилоидного пептида (продукта процессинга белка АРР) с последующей агрегацией тау-белка и нейровоспалением [134‒136]. Основными симптомами БА являются потеря долговременной памяти, нарушения речи и другие когнитивные расстройства. Постепенная потеря функций центральной нервной системы в результате массовой гибели нейронов неизбежно приводит к смерти пациентов [134, 137, 138]. Однако средств адекватной профилактики и терапии БА не существует. Предприняты попытки симптоматического лечения БА с помощью ряда препаратов, эффективность большинства из которых либо не доказана, либо очень слаба [139‒142].
Поскольку развитие нейродегенеративных заболеваний напрямую связано с нарушением фолдинга белков, например, тау-белка при БА, логично предположить участие Hsp в процессе развития нейропатологий. Постулируется снижение внутриклеточного уровня Hsp70 в ходе нейродегенерации. Согласно [143], агрегация тау-белка при развитии БА в значительной степени связана со снижением шаперонной активности Hsp70 и других Hsp. Показано также уменьшение концентрации Hsp90 в сыворотке крови и фронтальной коре головного мозга при БА. С другой стороны, выявлено повышение уровня Hsp70 на ранних стадиях БА, при этом Hsp70 колокализуется с агрегатами тау-белка [144]. Hsp70 участвует в деградации гиперфосфорилированного тау посредством его убиквитинирования с участием убиквитинлигазы CHIP [144, 145]. Комплекс Hsp110/Hsp70/Hsp40 способен разрушать α-синуклеиновые амилоидные фибриллы с образованием мономеров α-синуклеина в условиях in vitro [66, 67]. В последние годы с использованием специфического индуктора синтеза Hsp70 (геранилгеранилацетона) показано, что индукция Hsp70 подавляет многие когнитивные нарушения у трансгенных мышей, представляющих собой валидную модель БА [146].
В течение двух последних десятилетий большое внимание стало уделяться воспалительным процессам в ЦНС, развитие которых, как независимо показано многими авторами, связано с патогенезом БА и других протеинопатий [137, 147‒149]. Оказалось, что БА сопровождается развитием хронической воспалительной реакции в тканях головного мозга в виде активации микроглии и астроцитов, а также секреции ряда провоспалительных цитокинов, NO и АФК, оказывающих цитотоксический эффект на нейроны. Также при БА в мозгу повышается уровень рецепторов, участвующих в развитии воспалительного ответа, возрастает продукция TNF-α, IL-1, IL-6 и компонентов системы комплемента как в мозгу, так и на периферии (в составе плазмы крови) больных. Кроме того, в мозгу повышается уровень TLR4 и активность NF-κB [147, 150‒153]. Сходные данные получены также на трансгенных мышах (моделях БА), экспрессирующих мутантные формы АРР и пресенилинов, склонных к накоплению Аβ-агрегатов и развитию когнитивных нарушений [154]. Известно также, что вероятность развития спорадической формы БА коррелирует с некоторыми аллельными вариантами генов, кодирующих TLR4, CD14 (корецептор TLR4), CD33, TREM2 (Triggering receptor expressed on myeloid cells 2), CR1 (рецептор комплемента) и IL-6, которые участвуют в иммунном ответе и развитии воспаления [152, 155, 156]. Олигомерная форма Аβ является одним из лигандов TLR4, причем их взаимодействие может противоположным образом влиять на клетки микроглии и астроциты. С одной стороны, взаимодействие TLR4 и Аβ способствует фагоцитозу и деградации последнего [157]; с другой стороны, активация TLR4 β-амилоидом при развитии БА приводит к сверхпродукции провоспалительных цитокинов и АФК с последующим повреждением нейронов [158, 159].
еHsp70, как описано в предыдущей главе, является эффективным ингибитором сверхпродукции провоспалительных факторов, индуцируемой активацией TLR4. Поэтому еHsp70 может представлять интерес как потенциальный нейропротектор при БА, а в качестве неспецифического адаптогена и при других нейродегенеративных заболеваниях. В настоящее время нейропротективная роль Hsp70 показана на нескольких моделях in vitro, а в некоторых случаях in vivo [15, 17, 19, 160, 161]. Сверхэкспрессия Hsp70 в первичной культуре кортикальной нервной ткани снижает уровень апоптоза нейронов, индуцированного высокой концентрацией β-амилоида. Кроме того, эндогенный Hsp70 препятствует развитию окислительного стресса в ходе воспалительных реакций [162, 163]. eHsp70, секретируемый астроцитами и другими клетками глии, как и очищенный рекомбинантный Hsp70, добавляемый в культуральную среду, повышает выживаемость мотонейронов в культуре (при депривации факторов роста) и устойчивость клеток нейробластомы к ТШ и действию стауроспорина [75]. Показано, что Hsp, секретируемые клетками глии, интернализуются аксонами в области синапсов. Таким образом может восполняться дефицит Hsp в аксоплазме, обусловленный значительным расстоянием от тела нейрона [13]. Добавление рекомбинантного Hsp70 и Hsp90 вызывает активацию микроглии и способствует фагоцитозу β-амилоида в моделях развития БА in vitro [15].
Кроме участия в регуляции фолдинга тау, Hsp70 способствует фагоцитозу и расщеплению Аβ клетками глии и блокирует олигомеризацию Аβ-пептидов, проникающих в клетки [145, 164‒166].
За последние годы получены трансгенные мыши и мухи-дрозофилы, секретирующие Hsp70 в межклеточную среду. Показано, что внеклеточный Hsp70 оказывает выраженный нейропротективный эффект в линиях, полученных путем скрещивания продуцентов внеклеточного Hsp70 с трансгенными линиями, экспрессирующими Аβ-пептид, и склонными к развитию нейродегенеративных процессов [19].
В нашей лаборатории проведена серия работ по изучению возможности использования еHsp70 в терапии БА. Использовали рекомбинантный Hsp70 человека (основной индуцируемый стрессом белок HSPA1A), получаемый в разных экспрессионных системах, свободный от примесей ЛПС. Нейропротективное действие рекомбинантного Hsp70 изучали на двух моделях БА: бульбэктомированных мышах линии NMRI (дикий тип) и трансгенной линии 5XFAD (экспрессирует мутантные АРР и PS1 человека).
Удаление обонятельных луковиц (бульбэктомия) вызывает у мышей развитие симптомов, характерных для БА: повышение уровня β-амилоида (Аβ), массовую гибель нейронов в области височной коры и гиппокампа, дефицит серотонин-, ацетилхолин- и глутаматергической систем, а также различные когнитивные нарушения [167, 168]. Трансгенные мыши линии 5XFAD характеризуются быстрым накоплением β-амилоида, образованием амилоидных бляшек в тканях головного мозга (что позволяет считать эту модель наиболее адекватной для изучения БА человека), массовой гибелью нейронов и прогрессирующей потерей когнитивных функций [169].
В ситуации in vivo, особенно при использовании любых нейротропных препаратов (в данном случае рекомбинантного Hsp70) встает вопрос доставки терапевтического средства в мозг. Наличие гематоэнцефалического барьера накладывает серьезные ограничения на традиционные способы доставки лекарственных веществ, особенно препаратов на базе макромолекул [170]. Еще в 2005 г была исследована кинетика проникновения и распределение по органам и тканям меченного йодом Hsp70 при внутривенном введении [91]. В этих экспериментах выявлена роль рецептора CD91 в интернализации Hsp70, показано, что Hsp70 быстро элиминируется из крови и накапливается в печени. Аналогичные результаты получены и нами при изучении протективной роли Hsp70 на модели ЛПС-индуцированного сепсиса у крыс [116]. Позднее установили, что многие препараты, в том числе хроматографически очищенные белки с большой молекулярной массой, хорошо проникают в мозг при интраназальном введении путем транспорта по обонятельному и тройничному нервам [171]. Эффективность доставки белков в мозг при таком способе составляет 5–8% от вводимой дозы, тогда как пероральный или внутривенный способы были значительно менее эффективными. С использованием классического транспортного белка альбумина, меченного радиоактивным йодом, показано, что интраназально введенный альбумин быстро (в течение 5 мин) проникает во все области мозга лабораторных животных и попадает в кровь [172].
Изучение срезов различных отделов мозга, выполненное нами методом конфокальной микроскопии, показало, что через 3 ч после интраназального введения флуоресцентно меченного рекомбинантного Hsp70 флуоресцентная метка обнаруживается в различных отделах мозга подопытных мышей, включая обонятельные луковицы, неокортекс, гиппокамп, дорсальное ядро шва, голубоватое пятно и мозжечок. В большинстве случаев метка имела внутриклеточную локализацию, располагаясь в перинуклеарной области. Таким образом, при интраназальном введении eHsp70 эффективно преодолевает гематоэнцефалический барьер. Для ответа на вопрос, сохраняется ли eHsp70 после проникновения в мозг в интактном виде или подвергается протеолизу, был поставлен эксперимент по электрофоретическому разделению белков, выделенных из коры и гиппокампа мышей NMRI через различные промежутки времени после интраназального введения нативного Hsp70, меченного 125I. Оказалось, что полноразмерный eHsp70 выявляется в мозгу через 30 мин после введения, но перестает обнаруживаться уже через 1 ч. Таким же образом ведет себя после интраназального введения меченный 125I бычий сывороточный альбумин, имеющий сходную с Hsp70 молекулярную массу (66 кДа). Соответственно, оба белка быстро (в течение минут) после введения проникают в мозг, после чего подвергаются быстрому протеолизу [17, 107].
В дальнейшем было показано, что субхроническое интраназальное введение рекомбинантного Hsp70 значительно снижало как концентрацию растворимой формы Аβ у бульбэктомированных и трансгенных мышей, так и количество и размер амилоидных бляшек у трансгенных мышей 5XFAD по сравнению с мышами, получавшими вместо Hsp70 физиологический раствор или Hsp70, инактивированный нагреванием. При этом у животных, получавших нативный Hsp70, наблюдалось восстановление когнитивных функций (способности к обучению в лабиринте Морриса). Гистологический анализ показал существенное увеличение количества (%) неповрежденных нейронов и повышение их плотности у животных, которым в течение 3 недель интраназально вводили Hsp70, по сравнению с контрольными животными. Таким образом, еHsp70 предотвращает гибель нейронов и поддерживает их нормальное функционирование в изученных моделях БА [17].
Путем секвенирования транскриптомов гиппокампа трансгенных мышей 5XFAD показали, что интраназальное введение Hsp70 приводит к существенному изменению профиля экспрессии ряда генов в тканях мозга. В частности, увеличивается транскрипция генов, отвечающих за метаболизм дофамина, транспорт аминов, продукцию нейропептидов и другие процессы, повышающие проводимость нервного импульса. Кроме того, значительно снижается экспрессия ряда генов, продукты которых отвечают за развитие воспалительного ответа, что подтверждает действие рекомбинантного eHsp70 как неспецифичного противовоспалительного агента [18].
Таким образом, нейропротективные свойства еHsp70, описанные на двух моделях БА in vivo, подтверждены на молекулярном уровне. Механизм действия Hsp70 в данном случае, как и в экспериментах, моделирующих эндотоксиновый шок, по-видимому, обусловлен взаимодействием Hsp70 в качестве лиганда с определенными рецепторами и последующим запуском сигнальных каскадов, приводящих к наблюдаемым биохимическим и физиологическим эффектам. Это предположение основано на очень малой эффективной дозе Hsp70 (4 мкг ежедневно) и коротком времени существования полноразмерного белка в мозгу после введения. Показано, что одной из возможных мишеней Hsp70 могут быть NMDA-рецепторы (активируемые N-метил-D-аспартатом) [161]. Гиперактивация NMDA-рецепторов способствует гибели нервных клеток в ходе нейровоспалительной реакции и накоплению прионоподобных агрегатов. Антагонисты NMDA-рецепторов способствуют выживаемости клеток при накоплении агрегатов PrP [173]. Другим возможным кандидатом на роль рецептора Hsp70 в мозгу может быть CD91, выступающий в качестве рецептора аполипопротеина Е и способный узнавать множество лигандов различной природы [174, 175 ] . Показано, что еHsp70 эффективно узнается макрофагальным CD91 [90], который, как и TLR4, опосредует фагоцитоз Hsp70 и других экзогенных Hsp [13, 91, 94]. CD91 экспонируется некоторыми типами нейронов и астроцитов и вовлечен в патогенез БА [176 ] . Наконец, важную роль в развитии воспалительной реакции при БА играет рецептор TLR4, тоже узнающий еHsp70 [13]. Нами и другими авторами показано, что еHsp70 подавляет секрецию провоспалительных цитокинов при действии ЛПС на клетки иммунной системы in vitro [101–106, 116, 117]. Кроме того, еHsp70 вызывает активацию микроглии, обеспечивающей растворение белковых агрегатов и таким образом способствует фагоцитозу β-амилоида in vitro [15, 135]. Возможно, в моделях бульбэктомии и 5XFAD еHsp70 “переключает” TLR4 с продукции цитокинов на фагоцитоз Аβ с его последующей деградацией (поскольку снижение уровня Аβ показано нами на обеих моделях).
Нами обнаружена также отрицательная корреляция между уровнем растворимых Аβ-пептидов и содержанием эндогенного Hsp70 в мозгу мышей с нейродегенерацией, вызванной бульбэктомией. Так, уровень Аβ значительно повышается через 1.5 мес. после удаления обонятельных луковиц, что совпадает со снижением когнитивных способностей. Через 6 мес. после бульбэктомии уровень Аβ снижается, происходит временное восстановление способности к запоминанию и обучению. Этот период ремиссии совпадает со значительным повышением уровня внутриклеточного Hsp70 после операции. Далее уровень Hsp70 вновь снижается, в то время как концентрация Аβ достигает максимума, а когнитивные способности необратимо нарушаются. Полученные результаты позволяют предположить, что именно повышение уровня эндогенного Hsp70 может быть компенсаторным механизмом при нейродегенеративных процессах и/или восстановлении после травмы мозга [177 ] .
Полученные результаты позволяют предположить, что как рекомбинантный Hsp70 (и/или вещества-миметики, оказывающие подобный эффект), так и индукторы синтеза эндогенного Hsp70 могут рассматриваться как перспективные препараты для терапии БА и некоторых других протеинопатий.
ЗАКЛЮЧЕНИЕ
Исходя из данных, независимо полученных разными коллективами авторов, можно сделать вывод о том, что и внутриклеточный, и секретируемый Hsp70 являются мощными неспецифическими адаптогенами, повышающими способность организма переносить действие различных стрессовых факторов и обладающими выраженной нейропротективной и иммунорегуляторной активностью. Ясно, однако, что протективное действие эндогенного и экзогенного, в том числе рекомбинантного, Hsp70 осуществляется с помощью различных механизмов. Индукция синтеза внутриклеточного Hsp70 может способствовать выживанию клеток и организма при различных формах стресса, препятствуя накоплению денатурированных и поврежденных белков и блокируя сигнальные каскады, приводящие к апоптозу. С другой стороны, экзогенный Hsp70 даже в следовой концентрации может служить алармином, или “сигналом опасности”, запуская различные сигнальные пути, участвующие в регуляции неспецифического иммунного ответа и индукции воспалительных реакций. Возможно, именно этот эффект обусловливает нейропротективные свойства рекомбинантного Hsp70, показанные на ряде животных моделей, имитирующих развитие БА. В этом качестве рекомбинантный Hsp70 привлекает внимание как перспективный терапевтический агент, учитывая простоту его получения в стандартных системах экспрессии и доставку в мозг путем интраназального введения.
Работа поддержана Российским фондом фундаментальных исследований (18-04-00895 и 18-04-00865), Российским научным фондом (17-74-30030) и Программой фундаментальных исследований государственных академий наук на 2013–2020 годы (тема № 01201363817).
Список литературы
Laskey R.A., Honda B.M., Mills A.D., Finch J.T. (1978) Nucleosomes are assembled by an acidic protein which binds histones and transfers them to DNA. Nature. 275, 416–420.
Mayer M.P. (2010) Gymnastics of molecular chaperones. Mol. Cell. 39, 321–331.
Craig E.A., Jacobsen K. (1984) Mutations of the heat inducible 70 kilodalton genes of yeast confer temperature sensitive growth. Cell. 38, 841–849.
Feder M.E., Hofmann G.E. (1999) Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology. Annu. Rev. Physiol. 61, 243–282.
Barua D., Heckathorn S.A. (2004) Acclimation of the temperature set-points of the heat-shock response. J. Therm. Biol. 29, 185–193.
Gong W.J., Golic K.G. (2006) Loss of Hsp70 in Drosophila is pleiotropic, with effects on thermotolerance, recovery from heat shock and neurodegeneration. Genetics. 172, 275–286.
Evgen’ev M.B., Garbuz D.G., Zatsepina O.G. (2014) Heat Shock Proteins and whole body adaptation to extreme environments. Dordrecht, Netherlands: Springer, 218.
Kampinga H.H., Hageman J., Vos M.J., Kubota H., Tanguay R.M., Bruford E.A., Cheetham M.E., Chen B., Hightower L.E. (2009) Guidelines for the nomenclature of the human heat shock proteins. Cell Stress Chaperones. 14, 105–111.
Евгеньев М.Б., Гарбуз Д.Г., Зацепина О.Г. (2005) Белки теплового шока: функции и роль в адаптации к гипертермии. Онтогенез. 36, 265–273.
Hartl F.U., Bracher A., Hayer-Hartl M. (2011) Molecular chaperones in protein folding and proteostasis. Nature. 475, 324–332.
Zatsepina O.G., Przhiboro A.A., Yushenova I.A., Shilova V., Zelentsova E.S., Shostak N.G., Evgen’ev M.B., Garbuz D.G. (2016) A Drosophila heat shock response represents an exception rather than a rule among Diptera species. Insect. Mol. Biol. 25, 431–449.
Asea A., Rehli M., Kabingu E., Boch A., Bare O., Auron P.E., Stevenson M.A., Calderwood S.K. (2002) Novel signal transduction pathway utilized by extracellular HSP70: role of toll-like receptor (TLR) 2 and TLR4. J. Biol. Chem. 277, 15028‒15034.
Calderwood S.K., Mambula S.S., Gray P.J.Jr., The-riault J.R. (2007) Extracellular heat shock proteins in cell signaling. FEBS Lett. 581, 3689–3694.
Ghosh A.K., Sinha D., Mukherjee S., Biswas R., Biswas T. (2015) LPS stimulates and Hsp70 down-regulates TLR4 to orchestrate differential cytokine response of culture-differentiated innate memory CD8+ T cells. Cytokine. 73, 44‒52.
Kakimura J., Kitamura Y., Takata K., Umeki M., Suzuki S., Shibagaki K., Taniguchi T., Nomura Y., Gebicke-Haerter P.J., Smith M.A., Perry G., Shimohama S. (2002) Microglial activation and amyloid-beta clearance induced by exogenous heat-shock proteins. FASEB J. 16, 601–603.
Guzhova I., Kislyakova K., Moskaliova O., Fridlanskaya I., Tytell M., Cheetham M., Margulis B. (2001) In vitro studies show that Hsp70 can be released by glia and that exogenous Hsp70 can enhance neuronal stresstolerance. Brain Res. 914, 66–73.
Bobkova N.V., Garbuz D.G., Nesterova I., Medvinskaya N., Samokhin A., Alexandrova I., Yashin V., Karpov V., Kukharsky M.S., Ninkina N.N., Smir-nov A.A., Nudler E., Evgen’ev M. (2014) Therapeutic effect of exogenous Hsp70 in mouse models of Alzheimer’s Disease. J. Alzheimers Dis. 38, 425–435.
Evgen’ev M.B., Krasnov G.S., Nesterova I.V., Gar buz D.G., Karpov V.L., Morozov A.V., Snezh-kina A.V., Samokhin A.N., Sergeev A., Kulikov A.M., Bobkova N.V. (2017) Molecular mechanisms underlying neuroprotective effect of intranasal administration of human Hsp70 in mouse model of Alzheimer’s Disease. J. Alzheimers Dis. 59, 1415‒1426.
De Mena L., Chhangani D., Fernandez-Funez P., Rincon-Limas D.E. (2017) secHsp70 as a tool to approach amyloid-β42 and other extracellular amyloids. Fly. 11, 179‒184.
Milner C.M., Campbell R.D. (1990) Structure and expression of the three MHC-linked HSP70 genes. Immunogenetics. 32, 242–251.
Milner C.M., Campbell R.D. (1992) Polymorphic analysis of three MHC-linked HSP70 genes. Immunogenetics. 36, 357–362.
Walter L., Rauh F., Gunther E. (1994) Comparative analysis of the three major histocompatibility complex-linked heat shock protein 70 (hsp70) genes of the rat. Immunogenetics. 40, 325–330.
Garbuz D.G., Astakhova L.N., Zatsepina O.G., Arkhipova I.R., Nudler E., Evgen’ev M.B. (2011) Functional organization of hsp70 cluster in camel (Camelus dromedarius) and other mammals. PLoS One. 6, e27205.
Hess K., Oliverio R., Nguyen P., Le D., Ellis J., Kdeiss B., Ord S., Chalkia D., Nikolaidis N. (2018) Concurrent action of purifying selection and gene conversion results in extreme conservation of the major stress-inducible Hsp70 genes in mammals. Sci. Rep. 8, 5082.
Flaherty K.M., DeLuca-Flaherty C., McKay D.B. (1990) Three-dimensional structure of the ATPase fragment of a 70K heat-shock cognate protein. Nature. 346, 623–628.
Flajnik M.F., Canel C., Kramer J., Kasahara M. (1991) Which came first, MHC class I or class II? Immunogenetics. 33, 295–300.
Welch W.J., Feramisco J.R. (1985) Rapid purification of mammalian 70.000-dalton stress proteins: affinity of the proteins for nucleotides. Mol. Cell. Biol. 5, 1229–1237.
Nollen E.A., Morimoto R.I. (2002) Chaperoning signaling pathways: molecular chaperones as stress-sensing ‘heat shock’ proteins. J. Cell Sci. 115, 2809–2816.
Guzhova I., Margulis B. (2006) Hsp70 chaperone as a survival factor in cell pathology. Int. Rev. Cytol. 254, 101‒149.
Frydman J. (2001) Folding of newly translated proteins in vivo: the role of molecular chaperones. Annu. Rev. Biochem. 70, 603–647.
Goloubinoff P., Sassi A.S., Fauvet B., Barducci A., De Los Rios P. (2018) Chaperones convert the energy from ATP into the nonequilibrium stabilization of native proteins. Nature Chem. Biol. 14, 388–395.
Chakraborty K., Chatila M., Sinha J., Shi Q., Posch-ner B.C., Sikor M., Jiang G., Lamb D.C., Hartl F.U., Hayer-Hartl M. (2010) Chaperonin-catalyzed rescue of kinetically trapped states in protein folding. Cell. 142, 112‒122.
Reeg S., Jung T., Castro J.P., Davies K.J.A., Henze A., Grune T. (2016) The molecular chaperone Hsp70 promotes the proteolytic removal of oxidatively damaged proteins by the proteasome. Free Radic. Biol. Med. 99, 153‒166.
Bercovich B., Stancovski I., Mayer A., Blumenfeld N., Laszlo A., Schwartz A.L., Ciechanover A. (1997) Ubiquitin-dependent degradation of certain protein substrates in vitro requires the molecular chaperone Hsc70. J. Biol. Chem. 272, 9002–9010.
Nelson R.J., Ziegelhoffer T., Nicolet C., Werner-Washburne M., Craig E.A. (1992) The translation machinery and 70 kD heat shock protein cooperate in protein synthesis. Cell. 71, 97–105.
Ku Z., Yang J., Menon V., Thomason D.B. (1995) Decreased polysomal HSP70 may slow polypeptide elongation during skeletal muscle atrophy. Am. J. Physiol. 268, 1369–1374.
Arias E., Cuervo A.M. (2011) Chaperone-mediated autophagy in protein quality control. Curr. Opin. Cell Biol. 23, 184–189.
Fan A.C., Young J.C. (2011) Function of cytosolic chaperones in Tom70-mediated mitochondrial import. Protein Pept. Lett. 18, 122‒131.
Sousa R., Lafer E.M. (2006) Keep the traffic moving: mechanism of the Hsp70 motor. Traffic. 7, 1596‒1603.
Kutik S., Guiard B., Meyer H.E., Wiedemann N., Pfanner N. (2007) Cooperation of translocase complexes in mitochondrial protein import. J. Cell Biol. 179, 585‒591.
van der Laan M., Hutu D.P., Rehling P. (2010) On the mechanism of preprotein import by the mitochondrial presequence translocase. Biochim. Biophys. Acta. 1803, 732‒739.
Hamman B.D., Hendershot L.M., Johnson A.E. (1998) BiP maintains the permeability barrier of the ER membrane by sealing the lumenal end of the translocon pore befor and early in translocation. Cell. 92, 747–758.
Dudek J., Pfeffer S., Lee P.H., Jung M., Cavalié A., Helms V., Förster F., Zimmermann R. (2015) Protein transport into the human endoplasmic reticulum. J. Mol. Biol. 427, 1159‒1175.
Melnick J., Argon Y. (1995) Molecular chaperones and the biosintesis of antigen receptors. Immunol. Today. 16, 243–250.
Sawa T., Imamura T., Haruta T., Sasaoka T., Ishiki M., Takata Y., Takada Y., Morioka H., Ishihara H., Usui I., Kobayashi M. (1996) Hsp70 family molecular chaperones and mutant insulin receptor: differential binding specificities of BiP and Hsp70/Hsc70 determines accumulation or degradation of insulin receptor. Biochem. Biophys. Res. Commun. 218, 449–453.
Plemper R.K., Böhmler S., Bordallo J., Sommer T., Wolf D.H. (1997) Mutant analysis links the translocon and BiP to retrograde protein transport for ER degradation. Nature. 388, 891–895.
Nishikawa S., Brodsky J.L., Nakatsukasa K. (2005) Roles of molecular chaperones in endoplasmic reticulum (ER) quality control and ER-associated degradation (ERAD). J. Biochem. 137, 551–555.
Lasunskaia E.B., Fridlianskaia I.I., Guzhova I.V., Bozhkov V.M., Margulis B.A. (1997) Accumulation of major stress protein 70 kDa protects myeloid and lymphoid cells from death by apoptosis. Apoptosis. 2, 156–163.
Takano M., Arai T., Mokuno Y., Nishimura H., Nimura Y., Yoshikai Y. (1998) Dibutyryl cyclic adenosine monophosphate protects mice against tumor necrosis factor-alpha-induced hepatocyte apoptosis accompanied by increased heat shock protein 70 expression. Cell Stress Chaperones. 3, 109–117.
Ahn J.H., Ko Y.G., Park W.Y., Kang Y.S., Chung H.Y., Seo J.S. (1999) Suppression of ceramide-mediated apoptosis by HSP70. Mol. Cells. 9, 200–206.
Brar B.K., Stephanou A., Wagstaff M.J., Coffin R.S., Marber M.S., Engelmann G., Latchman D.S. (1999) Heat Shock Proteins delivered with a virus vector can protect cardiac cells against apoptotic as well as against thermal or hypoxic stress. J. Mol. Cell. Cardiol. 31, 135–146.
Wagstaff M.J., Collaço-Moraes Y., Smith J., de Belleroche J.S., Coffin R.S., Latchman D.S. (1999) Protection of neuronal cells from apoptosis by HSP27 delivered with a herpes simplex virus-based vector. J. Biol. Chem. 274, 5061–5069.
Kumar S., Stokes J. 3rd, Singh U.P., Scissum Gunn K., Acharya A., Manne U., Mishra M. (2016) Targeting Hsp70: A possible therapy for cancer. Cancer Lett. 374, 156–166.
Pandey M.K., Prasad S., Tyagi A.K., Deb L., Huang J., Karelia D.N., Amin S.G., Aggarwal B.B. (2016) Targeting cell survival proteins for cancer cell death. Pharmaceuticals. 9, e11.
Sharp F.R., Zhan X., Liu D.Z. (2013) Heat shock proteins in the brain: role of Hsp70, Hsp 27, and HO-1 (Hsp32) and their therapeutic potential. Transl. Stroke Res. 4, 685‒692.
Schett G., Steiner C.W., Gröger M., Winkler S., Graninger W., Smolen J., Xu Q., Steiner G. (1999) Activation of Fas inhibits heat-induced activation of HSF1 and up-regulation of HSP70. FASEB J. 13, 833–842.
Mosser D.D., Caron A.W., Bourged L., Denis-Laro-se C., Massie B. (1997) Role of the human Heat Shock Protein HSP70 in protection against stress-induced apoptosis. Mol. Cell. Biol. 17, 5317–5327.
Gabai V.L., Meriin A.B., Yaglom J.A., Volloch V., Sherman M.Y. (1998) Role of HSP70 in regulation of stress-kinase JNK: Implications in apoptosis and aging. FEBS Lett. 438, 1–4.
Kumar Y., Tatu U. (2003) Stress protein flux during recovery from simulated ischemia: Induced heat shock protein 70 confers cytoprotection by suppressing JNK activation and inhibiting apoptotic cell death. Proteomics. 3, 513–526.
Stankiewicz A.R., Lachapelle G., Foo C.P., Radicioni S.M., Mosser D.D. (2005) Hsp70 inhibits heat-induced apoptosis upstream of mitochondria by preventing Bax translocation. J. Biol. Chem. 280, 38729–38739.
Garrido C., Galluzzi L., Brunet M., Puig P.E., Didelot C., Kroemer G. (2006) Mechanisms of cytochrome c release from mitochondria. Cell Death Differ. 13, 1423–1433.
Mosser D.D., Caron A.W., Bourget L., Meriin A.B., Sherman M.Y., Morimoto R.I., Massie B. (2000) The chaperone function of hsp70 is required for protection against stress-induced apoptosis. Mol. Cell. Biol. 20, 7146–7159.
Jaattela M., Wissing D., Kokholm K., Kallunki T., Egeblad M. (1998) HSP70 exerts its anti-apoptosic function downstream of caspase-3-like proteases. EMBO J. 17, 6124–6134.
Гужова И.В., Маргулис Б.А. (2000) Индукция и накопление Hsp70 приводят к формированию его комплексов с другими клеточными белками. Цитология. 42, 647–652.
Hargitai J., Lewis H., Boros I., Rácz T., Fiser A., Kurucz I., Benjamin I., Vígh L., Pénzes Z., Csermely P., Latchman D.S. (2003) Bimoclomol, a heat shock protein co-inducer, acts by the prolonged activation of heat shock factor-1. Biochem. Biophys. Res. Commun. 307, 689‒695.
Finka A., Sharma S.K., Goloubinoff P. (2015) Multi-layered molecular mechanisms of polypeptide holding, unfolding and disaggregation by HSP70/HSP110 chaperones. Front. Mol. Biosci. 2, article 29.
Gao X., Carroni M., Nussbaum-Krammer C., Mogk A., Nillegoda N.B., Szlachcic A., Guilbride D.L., Sai-bil H.R., Mayer M.P., Bukau B. (2015) Human Hsp70 disaggregase reverses Parkinson’s-linked α-synuclein amyloid fibrils. Mol. Cell. 59, 781–793.
Jaattela M. (1999) Escaping cell death: survival proteins in cancer. Exp. Cell Res. 248, 30‒43.
Multhoff G., Hightower L.E. (2011) Distinguishing integral and receptor-bound heat shock protein 70 (Hsp70) on the cell surface by Hsp70-specific antibodies. Cell Stress Chaperones. 16, 251‒255.
Zhai L.L., Xie Q., Zhou C.H., Huang D.W., Tang Z.G., Ju T.F. (2017) Overexpressed HSPA2 correlates with tumor angiogenesis and unfavorable prognosis in pancreatic carcinoma. Pancreatology. 17, 457‒463.
Boudesco C., Cause S., Jego G., Garrido C. (2018) Hsp70: A cancer target inside and outside the cell. In: Chaperones: Methods and Protocols, Methods in Molecular Biology. Eds Calderwood S.K., Prince T.L. 1709, 371‒396.
Hightower L.E., Guidon P.T., Jr. (1989) Selective release from cultured mammalian cells of heat-shock (stress) proteins that resemble glia-axon transfer proteins. J. Cell. Physiol. 138, 257–266.
Pockley A.G., Shepherd J., Corton J.M. (1998) Detection of heat shock protein 70 (Hsp70) and anti-Hsp70 antibodies in the serum of normal individuals. Immunol. Invest. 27, 367–377.
Clayton A., Turkes A., Navabi H., Mason M.D., Tabi Z. (2005) Induction of heat shock proteins in B-cell exosomes. J. Cell. Sci. 118, 3631–3638.
Robinson M.B., Tidwell J.L., Gould T., Taylor A.R., Newbern J.M., Graves J., Tytell M., Milligan C.E. (2005) Extracellular heat shock protein 70: a critical component for motoneuron survival. J. Neurosci. 25, 9735–9745.
Davies E.L., Bacelar M.M., Marshall M.J., Johnson E., Wardle T.D., Andrew S.M., Williams J.H. (2006) Heat shock proteins form part of a danger signal cascade in response to lipopolysaccharide and GroEL. Clin. Exp. Immunol. 145, 183–189.
Zhan R., Leng X., Liu X., Wang X., Gong J., Yan L., Wang L., Wang Y., Wang X., Qian L.J. (2009) Heat shock protein 70 is secreted from endothelial cells by a non-classical pathway involving exosomes. Biochem. Biophys. Res. Commun. 387, 229–233.
Beckett K., Monier S., Palmer L., Alexandre C., Green H., Bonneil E., Raposo G., Thibault P., Le Borgne R., Vincent J.P. (2013) Drosophila S2 cells secrete wingless on exosome-like vesicles but the wingless gradient forms independently of exosomes. Traffic. 14, 82–96.
Takeuchi T., Suzuki M., Fujikake N., Popiel H.A., Kikuchi H., Futaki S., Wada K., Nagai Y. (2015) Intercellular chaperone transmission via exosomes contributes to maintenance of protein homeostasis at the organismal level. Proc. Natl. Acad. Sci. USA. 112, E2497‒E2506.
Mambula S.S., Calderwood S.K. (2006) Heat shock protein 70 is secreted from tumor cells by nonclassical pathway involving lysosomal endosomes. J. Immunol. 177, 7849–7857.
Mambula S.S., Stevenson M.A., Ogawa K., Calderwood S.K. (2007) Mechanisms for Hsp70 secretion: crossing membranes without a leader. Methods. 43, 168–175.
Prudovsky I., Mandinova A., Soldi R., Bagala C., Graziani I., Landriscina M., Tarantini F., Duarte M., Bellum S., Doherty H., Maciag T. (2003) The non-classical export routes: FGF1 and IL-1alpha point the way. J. Cell. Sci. 116, 4871–4881.
Ferrari D., Pizzirani C., Adinolfi E., Lemoli R.M., Curti A., Idzko M., Panther E., Di Virgilio F. (2006) The P2X7 receptor: a key player in IL-1 processing and release. J. Immunol. 176, 3877–3883.
Arispe N., Doh M., Simakova O., Kurganov B., De Maio A. (2004) Hsc70 and Hsp70 interact with phosphatidylserine on the surface of PC12 cells resulting in a decrease of viability. FASEB J. 18, 1636–1645.
Schilling D., Gehrmann M., Steinem C., De Maio A., Pockley A.G., Abend M., Molls M., Multhoff G. (2009) Binding of heat shock protein 70 to extracellular phosphatidylserine promotes killing of normoxic and hypoxic tumor cells. FASEB J. 23, 2467–2477.
Asea A. (2007) Mechanisms of HSP72 release. J. Biosci. 32, 579–584.
Vega V.L., Rodríguez-Silva M., Frey T., Gehrmann M., Diaz J.C., Steinem C., Multhoff G., Arispe N., De Maio A. (2008) Hsp70 translocates into the plasma membrane after stress and is released into the extracellular environment in a membrane-associated form that activates macrophages. J. Immunol. 180, 4299–4307.
Tsai T.N., Lee T.Y., Liu M.S., Chuang I.C., Lu M.C., Dong H.P., Lue S.I., Yang R.C. (2015) Release of endogenous heat shock protein 72 on the survival of sepsis in rats. J. Surg. Res. 198, 165–174.
Macleod C., Bryant C.E. (2017) Visualising pattern recognition receptor signalling. Biochem. Soc. Trans. 45, 1077‒1085.
Basu S., Binder R.J., Ramalingam T., Srivastava P.K. (2001) CD91 is a common receptor for heat shock proteins gp96, Hsp90, Hsp70, and calreticulin. Immunity. 14, 303–313.
Takemoto S., Nishikawa M., Takakura Y. (2005) Pharmacokinetic and tissue distribution mechanism of mouse recombinant heat shock protein 70 in mice. Pharm. Res. 22, 419‒426.
Wang Y., Kelly C.G., Karttunen J.T., Whittall T., Lehner P.J., Duncan L., MacAry P., Younson J.S., Singh M., Oehlmann W., Cheng G., Bergmeier L., Lehner T. (2001) CD40 is a cellular receptor mediating mycobacterial heat shock protein 70 stimulation of CC-chemokines. Immunity. 15, 971–983.
Asea A. (2008) Hsp70: a chaperokine. Novartis Found Symp. 291, 173–179.
Srivastava P. (2002) Interaction of heat shock proteins with peptides and antigen presenting cells: chaperoning of the innate and adaptive immune responses. Annu. Rev. Immunol. 20, 395–425.
Asea A., Kraeft S.K., Kurt-Jones E.A., Stevenson M.A., Chen L.B., Finberg R.W., Koo G.C., Calderwood S.K. (2000) HSP70 stimulates cytokine production through a CD14-dependant pathway, demonstrating its dual role as a chaperone and cytokine. Nat. Med. 6, 435–442.
Fleshner M., Johnson J.D. (2005) Endogenous extra-cellular heat shock protein 72: Releasing signal(s) and function. Int. J. Hyperthermia. 21, 457–471.
Lee K.H., Jeong J., Yoo C.G. (2013) Positive feedback regulation of heat shock protein 70 (Hsp70) is mediated through Toll-like receptor 4-PI3K/Akt-glycogen synthase kinase-3β pathway. Exp. Cell Res. 319, 88–95.
Ko R., Lee S.Y. (2016) Glycogen synthase kinase 3β in Toll-like receptor signaling. BMB Rep. 49, 305–310.
Bausinger H., Lipsker D., Ziylan U., Manié S., Briand J.P., Cazenave J.P., Muller S., Haeuw J.F., Ravanat C., de la Salle H., Hanau D. (2002) Endotoxin-free heat-shock protein 70 fails to induce APC activation. Eur. J. Immunol. 32, 3708–3713.
Gao B., Tsan M. F. (2003) Endotoxin contamination in recombinant human heat shock protein 70 (Hsp70) preparation is responsible for the induction of tumor necrosis factor alpha release by murine macrophages. J. Biol. Chem. 278, 174‒179.
Rozhkova E., Yurinskaya M., Zatsepina O., Garbuz D., Karpov V., Surkov S., Murashev A., Ostrov V., Margulis B., Evgen’ev M., Vinokurov M. (2010) Exogenous mammalian extracellular HSP70 reduces endotoxin manifestations at the cellular and organism levels. Ann. N.Y. Acad. Sci. 1197, 94–107.
Aneja R., Odoms K., Dunsmore K., Shanley T.P., Wong H.R. (2006) Extracellular heat shock protein-70 induces endotoxin tolerance in THP-1 cells. J. Immunol. 177, 7184–7192.
Borges T.J., Lopes R.L., Pinho N.G., Machado F.D., Souza A.P., Bonorino C. (2013) Extracellular Hsp70 inhibits pro-inflammatory cytokine production by IL-10 driven down-regulation of C/EBPβ and C/EBPδ. Int. J. Hyperthermia. 29, 455–463.
Hsu J.H., Yang R.C., Lin S.J., Liou S.F., Dai Z.K., Yeh J.L., Wu J.R. (2014) Exogenous heat shock cognate protein 70 pretreatment attenuates cardiac and hepatic dysfunction with associated anti-inflammatory responses in experimental septic shock. Shock. 42, 540–547.
Троянова Н.И., Шевченко М.А., Бойко А.А., Мирзоев Р.Р., Перцева М.А., Коваленко Е.И., Сапожников А.М. (2015) Модулирующий эффект внеклеточного пула БТШ70 на продукцию активных форм кислорода в популяциях фагоцитов. Биоорган. химия. 41, 271‒279
Шевченко М.А., Троянова Н.И., Сервули Е.А., Болховитина Е.Л., Федорина А.С., Сапожников А.М. (2016) Анализ иммуномодулирующих эффектов внеклеточной формы Hsp70 в мышиной модели аллергического воспаления дыхательных путей. Биохимия. 81, 1643–1657.
Yurinskaya M., Zatsepina O.G., Vinokurov M.G., Bobkova N.V., Garbuz D.G., Morozov A.V., Kulikova D.A., Mitkevich V.A., Makarov A.A., Funikov S.Y., Evgen’ev M.B. (2015) The fate of exogenous human HSP70 introduced into animal cells by different means. Curr. Drug Deliv. 12, 524–532.
Peri F., Calabrese V. (2014) Toll-like receptor 4 (TLR4) modulation by synthetic and natural compounds: an update. J. Med. Chem. 57, 3612–3622.
Ofengeim D., Yuan J. (2013) Regulation of RIP1 kinase signalling at the crossroads of inflammation and cell death. Nat. Rev. Mol. Cell Biol. 14, 727–736.
Angus D.C., Wax R.S. (2001) Epidemiology of sepsis: an update. Crit. Care Med. 29, S109–S116.
van Zanten A.R., Brinkman S., Arbous M.S., Abu-Hanna A., Levy M.M., de Keizer N.F.; Netherlands Patient Safety Agency Sepsis Expert Group. (2014) Guideline bundles adherence and mortality in severe sepsis and septic shock. Crit. Care Med. 42, 1890‒1898.
Zhang Y.H., Takahashi K., Jiang G.Z., Zhang X.M., Kawai M., Fukada M., Yokochi T. (1994) In vivo production of heat shock protein in mouse peritoneal macrophages by administration of lipopolysaccharide. Infect. Immun. 62, 4140–4144.
Gupta A., Cooper Z.A., Tulapurkar M.E., Potla R., Maity T., Hasday J.D., Singh I.S. (2013) Toll-like receptor agonists and febrile range hyperthermia synergize to induce heat shock protein 70 expression and extracellular release. J. Biol. Chem. 288, 2756‒2766.
Wheeler D.S., Fisher L.E.Jr., Catravas J.D., Jacobs B.R., Carcillo J.A., Wong H.R. (2005) Extracellular hsp70 levels in children with septic shock. Pediatr. Crit. Care Med. 6, 308–311.
Nakada J., Matsura T., Okazaki N., Nishida T., Togawa A., Minami Y., Inagaki Y., Ito H., Yamada K., Ishibe Y. (2005) Oral administration of geranylgeranylacetone improves survival rate in a rat endotoxin shock model: administration timing and heat shock protein 70 induction. Shock. 24, 482–487.
Kustanova G., Murashev A., Karpov V.L., Margulis B.A., Guzhova I.V., Prokhorenko I.R., Grachev S.V., Evgen’ev M.B. (2006) Exogenous heat shock protein 70 mediates sepsis manifestations and decreases the mortality rate in rats. Cell Stress Chaperones. 11, 276–286.
Vinokurov M., Ostrov V., Yurinskaya M., Garbuz D., Murashev A., Antonova O., Evgen’ev M. (2012) Recombinant human Hsp70 protects against lipoteichoic acid-induced inflammation manifestations at the cellular and organismal levels. Cell Stress Chaperones. 17, 89–101.
Юринская М.М., Винокуров М.Г., Зацепина О.Г., Гарбуз Д.Г., Гужова И.В., Рожкова Е.А., Сусли-ков А.В., Карпов В.Л., Евгеньев М.Б. (2009) Экзогенные белки теплового шока БТШ70 подавляют эндотоксин-индуцированную активацию нейтрофилов человека. Докл. Акад. Наук. 426, 406–409.
Остров В.Ф., Слащева Г.А., Жармухамедова Т.Ю., Гарбуз Д.Г., Евгеньев М.Б., Мурашев А.Н. (2010) Влияние рекомбинантного человеческого белка теплового шока Hsp70 на биохимические параметры крови при моделировании эндотоксинового шока у крыс. Биоорган. химия. 36, 337–342.
Shin H.J., Lee H., Park J.D., Hyun H.C., Sohn H.O., Lee D.W., Kim Y.S. (2007) Kinetics of binding of LPS to recombinant CD14, TLR4, and MD-2 proteins. Mol. Cells. 24, 119–124.
Afrazi A., Sodhi C.P., Good M., Jia H., Siggers R., Yazji I., Ma C., Neal M.D., Prindle T., Grant Z.S., Branca M.F., Ozolek J., Chang E.B., Hackam D.J. (2012) Intracellular heat shock protein-70 negatively regulates TLR4 signaling in the newborn intestinal epithelium. J. Immunol. 188, 4543–4557.
Multhoff G., Botzler C., Wiesnet M., Müller E., Meier T., Wilmanns W., Issels R.D. (1995) A stress-inducible 72-kDa heat-shock protein (HSP72) is expressed on the surface of human tumor cells, but not on normal cells. Int. J. Cancer. 61, 272‒279.
Multhoff G., Botzler C., Jennen L., Schmidt J., Ellwart J., Issels R. (1997) Heat shock protein 72 on tumor cells: a recognition structure for natural killer cells. J. Immunol. 158, 4341‒4350.
Jun Ho Jang, Hanash S. (2003) Profiling of the cell surface proteome. Proteomics. 3, 1947–1954.
Roigas J., Wallen E.S., Loening S.A., Moseley P.L. (1998) Heat shock protein (HSP72) surface expression enhances the lysis of a human renal cell carcinoma by IL-2 stimulated NK cells. Adv. Exp. Med. Biol. 451, 225‒229.
Ponomarev E.D., Tarasenko T.N., Sapozhnikov A.M. (2000) Splenic cytotoxic cells recognize surface HSP70 on culture-adapted EL-4 mouse lymphoma cells. Immunol. Lett. 74, 133‒139.
Bausero M.A., Gastpar R., Multhoff G., Asea A. (2005) Alternative mechanism by which IFN-gamma enhances tumor recognition: active release of heat shock protein 72. J. Immunol. 175, 2900‒2912.
Chalmin F., Ladoire S., Mignot G., Vincent J., Bruchard M., Remy-Martin J.P., Boireau W., Rouleau A., Simon B., Lanneau D., De Thonel A., Multhoff G., Hamman A., Martin F., Chauffert B., Solary E., Zitvogel L., Garrido C., Ryffel B., Borg C., Apetoh L., Rébé C., Ghiringhelli F. (2010) Membrane-associated Hsp72 from tumorderived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells. J. Clin. Invest. 120, 457–471.
Rérole A.L., Gobbo J., De Thonel A., Schmitt E., Pais de Barros J.P., Hammann A., Lanneau D., Fourmaux E., Demidov O.N., Micheau O., Lagrost L., Colas P., Kroemer G., Garrido C. (2011) Peptides and aptamers targeting HSP70: a novel approach for anticancer chemotherapy. Cancer Res. 71, 484–495.
Zihai Li. (2003) Role of heat shock protein in chaperoning tumor antigens and modulating anti-tumor immunity. In: Tumor Antigens Recognized by T Cells and Antibodies. Eds Hans J. Stauss, Kawakami Y., Parmiani G. New York: Taylor & Francis Inc., pp. 20–33.
Shevtsov M., Multhoff G. (2016) Heat shock protein-peptide and HSP-based immunotherapies for the treatment of cancer. Front. Immunol. 7, Article 171.
Galvin J.E., Howard D.H., Denny S.S., Dickinson S., Tatton N. (2017) The social and economic burden of frontotemporal degeneration. Neurology. 89, 2049‒2056.
Marešová P., Dolejš J., Kuca K. (2018) Call for a uniform strategy of collecting Alzheimer’s disease costs: a review and meta-analysis. J. Alzheimers Dis. 63, 227–238.
Reisberg B., Saeed M.U. (2004) Alzheimer’s disease. In: Comprehensive Textbook of Geriatric Psychiatry, 3rd ed. Eds Sadavoy J., Jarvik L.F., Grossberg G.T., Meyers B.S. New York: W.W. Norton, pp. 449–509.
Clayton K.A., Van Enoo A.A., Ikezu T. (2017) Alzheimer’s disease: The role of microglia in brain homeostasis and proteopathy. Front. Neurosci. 11, Article 680.
Шварцман А.Л., Саранцева С.В. (2017) Трансмиссия патогенного белка при болезни Альцгеймера. Молекуляр. биология. 51, 418–422.
Grimm A., Friedland K., Eckert A. (2016) Mitochondrial dysfunction: the missing link between aging and sporadic Alzheimer’s disease. Biogerontology. 17, 281‒296.
Ahmad K., Baig M.H., Mushtaq G., Kamal M.A., Greig N.H., Choi I. (2017) Commonalities in biological pathways, genetics, and cellular mechanism between Alzheimer disease and other neurodegenerative diseases: An in silico-updated overview. Curr. Alzheimer Res. 14, 1190‒1197.
Yang G., Wang Y., Tian J., Liu J.P. (2013) Huperzine A for Alzheimer’s disease: A systematic review and meta-analysis of randomized clinical trials. PLoS One. 8, e74916.
Ehret M.J., Chamberlin K.W. (2015) Current practices in the treatment of Alzheimer disease: Where is the evidence after the Phase III trials? Clin. Ther. 37, 1604‒1616.
Татарникова О.Г., Орлов М.А., Бобкова Н.В. (2015) Бета-амилоид и Тау-белок: структура, взаимодействие и прионоподобные свойства. Успехи биол. химии. 55, 351–390.
Kumar D., Ganeshpurkar A., Kumar D., Modi G., Gupta S.K., Singh S.K. (2018) Secretase inhibitors for the treatment of Alzheimer’s disease: Long road ahead. Eur. J. Med. Chem. 148, 436–452.
Franklin T.B., Krueger-Naug A.M., Clarke D.B., Arrigo A.P., Currie R.W. (2005) The role of heat shock proteins Hsp70 and Hsp27 in cellular protection of the central nervous system. Int. J. Hyperthermia. 21, 379–392.
Leak R.K. (2014) Heat shock proteins in neurodegenerative disorders and aging. J. Cell Commun. Signal. 8, 293–310.
Sulistio Y.A., Heese K. (2016) The ubiquitin-proteasome system and molecular chaperone deregulation in Alzheimer’s disease. Mol. Neurobiol. 53, 905–931.
Sun Y., Zhang J.R., Chen S. (2017) Suppression of Alzheimer’s disease-related phenotypes by the heat shock protein 70 inducer, geranylgeranylacetone, in APP/PS1 transgenic mice via the ERK/p38 MAPK signaling pathway. Exp. Ther. Med. 14, 5267‒5274.
Dursun E., Gezen-Ak D., Hanağası H., Bilgiç B., Lohmann E., Ertan S., Atasoy İ.L., Alaylıoğlu M., Araz Ö.S., Önal B., Gündüz A., Apaydın H., Kızıl-tan G., Ulutin T., Gürvit H., Yılmazer S. (2015) The interleukin 1 alpha, interleukin 1 beta, interleukin 6 and alpha-2-macroglobulin serum levels in patients with early or late onset Alzheimer’s disease, mild cognitive impairment or Parkinson’s disease. J. Neuroimmunol. 283, 50–57.
Taipa R., Sousa A.L., Melo Pires M., Sousa N. (2016) Does the interplay between aging and neuroinflammation modulate Alzheimer’s disease clinical phenotypes? A clinico-pathological perspective. J. Alzheimers Dis. 53, 403–417.
Pugazhenthi S., Qin L., Reddy P.H. (2017) Common neurodegenerative pathways in obesity, diabetes, and Alzheimer’s disease. Biochim. Biophys. Acta. 1863, 1037‒1045.
Heppner F.L., Ransohoff R.M., Becher B. (2015) Immune attack: the role of inflammation in Alzheimer disease. Nat. Rev. Neurosci. 16, 358–372.
Zhang F., Jiang L. (2015) Neuroinflammation in Alzheimer’s disease. Neuropsychiatri. Dis. Treat. 11, 243–256.
Heneka M.T., Carson M.J., Khoury J.E., Landreth G.E., Brosseron F., Feinstein D.L., Jacobs A.H., Wyss-Coray T., Vitorica J., Ransohoff R.M., Herrup K., Frautschy S.A., Finsen B., Brown G.C., Verkhrats-ky A., Yamanaka K., Koistinaho J., Latz E., Halle A., Petzold G.C., Town T., Morgan D., Shinohara M.L., Perry V.H., Holmes C., Bazan N.G., Brooks D.J., Hunot S., Joseph B., Deigendesch N., Garaschuk O., Boddeke E., Dinarello C.A., Breitner J.C., Cole G.M., Golenbock D.T., Kummer M.P. (2015) Neuroinflammation in Alzheimer’s disease. Lancet Neurol. 14, 388–405.
Bolós M., Perea J.R., Avila J. (2017) Alzheimer’s disease as an inflammatory disease. Biomol. Concepts. 8, 37–43.
Nazem A., Sankowski R., Bacher M., Al-Abed Y. (2015) Rodent models of neuroinflammation for Alzheimer’s disease. J. Neuroinflammation. 12, 74.
Balistreri C.R., Grimaldi M.P., Chiappelli M., Licastro F., Castiglia L., Listì F., Vasto S., Lio D., Caruso C., Candore G. (2008) Association between the polymorphisms of TLR4 and CD14 genes and Alzheimer’s disease. Curr. Pharm. Des. 14, 2672–2677.
Chen Y., Yip P., Huang Y., Sun Y., Wen L.L., Chu Y.M., Chen T.F. (2012) Sequence variants of Toll Like receptor 4 and late-onset Alzheimer’s disease. PLoS One. 7, e50771.
Tahara K., Kim H.D., Jin J.J., Maxwell J.A., Li L., Fukuchi K. (2006) Role of Toll-like receptor signalling in Aв uptake and clearance. Brain. 129, 3006–3019.
Jin J.J., Kim H.D., Maxwell J.A., Li L., Fukuchi K. (2008) Toll-like receptor 4-dependent upregulation of cytokines in a transgenic mouse model of Alzheimer’s disease. J. Neuroinflammation. 5, 23.
Tang S.C., Lathia J.D., Selvaraj P.K., Jo D.G., Mughala M.R., Cheng A., Siler D.A., Markesbery W.R., Arumugam T.V., Mattson M.P. (2008) Toll-Like receptor-4 mediates neuronal apoptosis induced by amyloid β-peptide and the membrane lipid peroxidation product 4-hydroxynonenal. Exp. Neurol. 213, 114–121.
Meriin A.B., Sherman M.Y. (2005) Role of molecular chaperones in neurodegenerative disorders. Int. J. Hyperthermia. 21, 403–419.
Ekimova I.V., Nitsinskaya L.E., Romanova I.V., Pastukhov Y.F., Margulis B.A., Guzhova I.V. (2010) Exogenous protein Hsp70/Hsc70 can penetrate into brain structures and attenuate the severity of chemically-induced seizures. J. Neurochem. 115, 1035–1044.
Magrané J., Smith R.C., Walsh K., Querfurth H.W. (2004) Heat shock protein 70 participates in the neuroprotective response to intracellularly expressed beta-amyloid in neurons. J. Neurosci. 24, 1700–1706.
Calabrese V., Stella A.M., Butterfield D.A., Scapagnini G. (2004) Redox regulation in neurodegeneration and longvity: role of the heme oxygenase and HSP70 systems in brain stress tolerance. Antioxid. Redox Signal. 6, 895‒913.
Lu R., Tan M., Wang H., Xie A.M., Yu J.T., Tan L. (2014) Heat Shock Protein 70 in Alzheimer’s disease. Biomed. Res. Int. 2014, 435203.
Lazarev V.F., Mikhaylova E.R., Guzhova I.V., Margulis B.A. (2017) Possible function of molecular chaperones in diseases caused by propagating amyloid aggregates. Front. Neurosci. 11, 277.
Rivera I., Capone R., Cauvi D.M., Arispe N., De Maio A. (2018) Modulation of Alzheimer’s amyloid β peptide oligomerization and toxicity by extracellular Hsp70. Cell Stress Chaperones. 23, 269–279.
Bobkova N.V., Nesterova I.V., Medvinskaya N.I., Aleksandrova I.Y., Samokhin A.N., Gershovich Y.G., Gershovich P.M., Yashin V.A. (2005) Possible role of olfactory system in Alzheimer’s disease genesis. In: Alzheimer’s and Parkinson’s Disease. Eds Hanin L., Fisher A., Monduzzi M. Internat. Proc. Division. Medimond, pp. 91–95.
Holland D., Brewer J.B., Hagler D.J., Fennema-Notestine C., Dale A.D., and the Alzheimer’s Disease Neuroimaging Initiative. (2009) Subregional neuroanatomical change as a biomarker for Alzheimer’s disease. Proc. Natl. Acad. Sci. USA. 106, 20954–20959.
Oakley H., Cole S.L., Logan S., Maus E., Shao P., Craft J., Guillozet-Bongaarts A., Ohno M., Disterhoft J., Van Eldik L., Berry R., Vassar R. (2006) Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: Potential factors in amyloid plaque formation. J. Neurosci. 26, 10129–10140.
Jogani V., Jinturkar K., Vyas T., Misra A. (2008) Recent patents review on intranasal administration for CNS drug delivery. Recent. Pat. Drug. Deliv. Formul. 2, 25–40.
Ying W. (2008) The nose may help the brain: intranasal drug delivery for treating neurological diseases. Future Neurol. 3, 1–4.
Falcone J.A., Salameh T.S., Yi X., Cordy B.J., Mor-tell W.G., Kabanov A.V., Banks W.A. (2014) Intranasal administration as a route for drug delivery to the brain: evidence for a unique pathway for albumin. J. Pharmacol. Exp. Ther. 351, 54–60.
Black S.A., Stys P.K., Zamponi G.W., Tsutsui S. (2014) Cellular prion protein and NMDA receptor modulation: protecting against excitotoxicity. Front. Cell. Dev. Biol. 2, 45.
Rebeck G.W., Reiter J.S., Strickland D.K., Hyman B.T. (1993) Apolipoprotein E in sporadic Alzheimer’s disease: allelic variation and receptor interactions. Neuron. 11, 575–580.
Xiao H., Gao Y., Liu L., Li Y. (2017) Association between polymorphisms in the promoter region of the apolipoprotein E (APOE) gene and Alzheimer’s disease: A meta-analysis. EXCLI J. 16, 921–938.
Strickland D.K., Kounnas M.Z., Argraves W.S. (1995) LDL receptor-related protein: a multiligand receptor for lipoprotein and proteinase catabolism. FASEB J. 9, 890–898.
Bobkova N., Guzhova I., Margulis B., Nesterova I., Medvinskaya N., Samokhin A., Alexandrova I., Garbuz D., Nudler E., Evgen’ev M. (2013) Dynamics of endogenous Hsp70 synthesis in the brain of olfactory bulbectomized mice. Cell Stress Chaperones. 18, 109–118.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


