Молекулярная биология, 2019, T. 53, № 2, стр. 218-224
Линейные геномы прокариот и митохондрий: происхождение, механизмы репликации концов и адаптивное значение
a Институт проблем передачи информации им. А.А. Харкевича Российской академии наук
127051 Москва, Россия
b Факультет биоинженерии и биоинформатики Московского государственного университета
им. М.В. Ломоносова
119991 Москва, Россия
c Сколковский институт науки и технологий
121205 Москва, Россия
Поступила в редакцию 29.10.2018
После доработки 29.10.2018
Принята к публикации 29.10.2018
Аннотация
Несмотря на часто встречающееся представление о бактериальной хромосоме как о молекуле ДНК, замкнутой в кольцо, нередко наблюдается такое эволюционное событие как линеаризация кольцевой хромосомы бактерий, а также хромосом митохондрий и пластид. В числе причин линеаризации называют дефекты системы репарации, встраивание плазмид и рекомбинацию – все это приводит к разрыву кольцевой структуры. Некоторые геномы могут претерпевать многочисленные акты линеаризации–закольцовывания, в результате чего достигается большая вариативность генного состава на концах линейной хромосомы. Как и эукариоты, бактерии с линейными геномами сталкиваются с проблемой репликации концов, которая решается по-разному у разных видов. Отдельный интерес представляет вопрос об адаптивности линеаризации. В обзоре приведены современные гипотезы относительно значения этого процесса для эволюции бактериальных геномов, а также эксперименты, подтверждающие некоторые из них. Рассматриваются наиболее изученные механизмы репликации линейных геномов бактерий и возможные пути их возникновения.
ВВЕДЕНИЕ
До восьмидесятых годов прошлого века считалось, что геномы прокариот и эукариот фундаментально различаются топологически: хромосомы эукариот имеют линейную структуру, а прокариот – кольцевую [1]. То, что геномы прокариот кольцевые, было установлено путем составления карт сцепления генов в модельных организмах: Escherichia coli и Bacillus subtilis, а позже подтверждено в классических экспериментах Кэйрнса по изучению репликации [2]. В ходе этих экспериментов были получены микрофотографии кольцевых хромосом кишечной палочки в покое и во время деления.
Примерно в то же время было показано, что и некоторые органеллы эукариот: пластиды и митохондрии – имеют кольцевые хромосомы и собственный аппарат трансляции [3].
Несколько позже, с развитием технологий секвенирования, группа Карла Везе установила, что пластиды и митохондрии произошли от бактерий [4, 5], подтвердив гипотезу Линн Саган о прокариотическом происхождении некоторых клеточных органелл [4–6]. Это открытие объяснило одинаковую топологию хромосом прокариот и ДНК, которую находили в эукариотических органеллах.
При исследовании других бактерий показано, что чаще всего бактериальный геном представлен кольцевой хромосомой, которую может сопровождать одна или более кольцевых плазмид [7]. На основании широкой распространенности такой архитектуры был сделан вывод о ее древнем происхождении и о том, что общий предок клеток мог иметь именно кольцевые хромосомы.
С развитием новых методологий электрофореза, использование которых позволяет разделять большие фрагменты ДНК, перед исследователями предстала более сложная картина, и представления о кольцевой структуре абсолютно всех бактериальных геномов оказались опровергнуты. В 1989 году установили линейность генома возбудителя болезни Лайма – бактерии Borrelia burgdorferi [8]. Вслед за этим разные группы исследователей обнаружили, что бактерии-продуценты антибиотиков из рода Streptomyces [9] также обладают линейными хромосомами, а Agrobacterium tumefaciens [10], один из возбудителей галловой болезни, содержит в клетке как кольцевую хромосому, так и большой фрагмент линейной ДНК.
Как выяснилось, геномы митохондрий и хлоропластов в процессе эволюции претерпевали неоднократные акты линеаризации [11]. Линейные плазмиды имеются как у бактерий с линейными геномами – представителях родов Borrelia и Streptomyces, так и у бактерий с кольцевыми геномами [12].
В связи с этими наблюдениями интересно получить ответы на некоторые вопросы [1]:
1. Как образуются линейные прокариотические геномы?
2. Имеет ли их образование какое-либо адаптивное значение?
3. Как происходит репликация концов линейного прокариотического генома?
4. Какие последствия для генома имеет его линеаризация?
Ответы на эти вопросы получены в ходе исследований, обзор которых приведен ниже.
РАСПРОСТРАНЕННОСТЬ ЛИНЕЙНЫХ БАКТЕРИАЛЬНЫХ ГЕНОМОВ
Бактерии с линейными геномами не образуют на общем дереве видов какой-либо клады, монофилетичной или парафилетичной [1]. Полифилия этих бактерий может быть следствием множественных независимых актов линеаризации и закольцовывания в ходе эволюции [13].
Косвенным доказательством независимости актов линеаризации в близкородственных видах служит тот факт, что в некоторых видах бактерий линейность хромосомы или некоторых плазмид обратима. Так, в бактерии Streptomyces lividans линейные хромосомы могут спонтанно закольцовываться в лабораторных условиях, причем с высокой частотой [14]. В плазмидах линейность также обратима: многие линейные плазмиды, встречающиеся в представителях рода Streptomyces, реплицируются в закольцованной форме [15, 18], а в бактериях рода Borrelia обнаружены кольцевые гомологи известных линейных плазмид [1]. На основании этих данных можно предположить, что переход кольцевой хромосомы к линейности не обязательно сопровождается серьезными и многочисленными изменениями в геноме. В противном случае – необходимости в большом числе мутаций – такой переход не происходил бы спонтанно и столь часто.
Escherichia coli С ЛИНЕЙНОЙ ХРОМОСОМОЙ
Еще одно доказательство слабого влияния линеаризации хромосомы на бактериальный фенотип получено в 2007 году Cui и соавт. [16]. Используя процесс, аналогичный линеаризации фага N15, авторам удалось создать стабильный штамм кишечной палочки с линейным геномом. Полученный штамм не отличался от исходного ни по характеру роста, ни по морфологии клеток и нуклеоида, ни по экспрессии генов. Однако при дефекте сайта dif – мишени специфической рекомбиназы резольвазы – фенотип клеток с кольцевой хромосомой изменялся, в то время как фенотип клеток с линеаризованным геномом при удалении этого сайта оставался неизменным.
Недавно Sinha и др. [17] показали, что топология кольцевой хромосомы Escherichia coli может нарушаться в некоторых мутантах, например, в мутанте по recBC, в котором нарушен процесс репарации двухцепочечных разрывов.
МЕХАНИЗМЫ РЕПЛИКАЦИИ БАКТЕРИАЛЬНЫХ ЛИНЕЙНЫХ ХРОМОСОМ
При репликации линейных хромосом основная проблема – репликация концов. Эукариотические клетки решают это с помощью теломер – обновляемых повторов на концах хромосом, а бактерии используют два механизма, заимствованные, скорее всего, у вирусов и плазмид [1].
Первый механизм, который встречается у бактерий рода Streptomyces, заключается в присоединении специальных терминальных белков к 5'-концам двухцепочечных теломер. Структуры, похожие на теломеры стрептомицетов, обнаружены как в некоторых бактериофагах, так и в линейных плазмидах митохондрий растений и грибов [12]. Терминальные повторы стрептомицетов различаются по длине – от 500 до 1000 нуклеотидов – и состоят из семи палиндромных последовательностей, которые, находясь в одноцепочечном состоянии, привлекают терминальные белки. Репликация начинается с внутреннего сайта начала репликации (origin of replication) и продолжается до конца хромосомы, оставляя висячие 5'-концы [18].
Эти концы далее реплицируются через синтез ДНК, опосредованный терминальными белками. Стрептомицеты обладают пятью видами ДНК-полимераз. В то время как синтезом основной цепи занимается полимераза I (PolI), синтез концов осуществляется двумя изоформами PolIV [12]. Похожим образом реплицируются линейные плазмиды стрептомицетов [19].
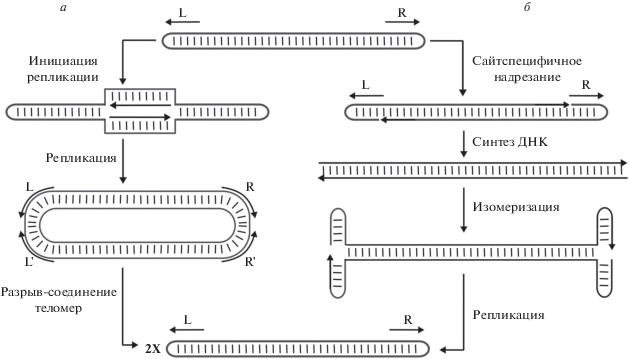
Другой способ репликации концов реализуют бактерии рода Borrelia. Хромосомы этих бактерий несут на концах теломеры с ковалентно замкнутыми шпилечными структурами (рис. 1). Теоретически существует два механизма репликации таких хромосом [20]. Первый подразумевает образование внутренних репликативных вилок и дальнейшую репликацию, приводящую к формированию конкатената из двух идентичных хромосом, в который потом вносится два двухцепочечных разрыва в районе теломерных областей. На последней стадии ковалентная связь между цепями восстанавливается (рис. 1). Репликация по второму механизму начинается с внесения двух одноцепочечных разрывов на концах хромосом, после чего следует двухстадийная репликация – сначала концов, а затем и всего генома. Завершается этот процесс репарацией одноцепочечных разрывов. Второй способ чаще встречается при репликации вирусов, в то время как первый способ, и это показано экспериментально, используется боррелиями [20].
На основании сходства механизмов репликации вирусов и плазмид с линейными геномами с механизмами репликации линейных геномов бактерий, а также экспериментальных данных по линеаризации генома Escherichia coli с помощью вирусной системы Cui и соавт. [16] предполагают, что линейные геномы прокариот возникли в результате приобретения репликативных систем вирусов и плазмид.
АДАПТИВНОЕ ЗНАЧЕНИЕ ЛИНЕЙНОЙ ТОПОЛОГИИ ХРОМОСОМ
Как сказано выше, линейность хромосом и плазмид стрептомицетов обратима в лабораторных условиях, и мутанты с кольцевыми хромосомами практически не отличаются по жизнеспособности от бактерий дикого типа. В целом, хромосомы стрептомицетов относятся к одним из самых нестабильных среди всех прокариот [21]. Примерно 0.5% спор содержат делеции, составляющие до 25% генома, что соответствует примерно 2 млн пар оснований. Интересно, что значительная часть таких спор жизнеспособна, и большинство крупных делеций, дающих жизнеспособные фенотипы, располагается по концам хромосом, что связано с процессами их обратимого закольцовывания. Само закольцовывание хромосом считалось процессом, при котором геном становится более стабильным, но эта гипотеза была экспериментально опровергнута [21]. Особо уязвима к делециям предполагаемая область терминации репликации, которая соответствует концам линейной хромосомы. Геном стрептомицетов приспособлен к частым делециям в районе концов линейной хромосомы: почти все важные для жизнедеятельности гены расположены вдали от концов, в то время как гены синтеза антибиотиков и резистентности к ним расположены на концах хромосомы, что вполне согласуется с их непостоянной ролью в жизни микроорганизма [21]. Открытие линейности хромосом некоторых бактерий, а также изучение стрептомицетов навело на мысли об адаптивном значении линеаризации хромосом. Высказанные идеи насчет адаптивного преимущества линейных хромосом могут быть сведены к нескольким положениям [1]:
1. Линейность хромосом бактерий, как и в случае эукариот, способствует их разделению при рекомбинации. Действительно, если между двумя кольцевыми хромосомами проходит нечетное число актов рекомбинации, получившийся конкатенат в процессе деления клетки разорвется или достанется только одной дочерней клетке. Это особенно важно для стрептомицетов, которые обладают полиплоидным мицелием, способным продуцировать споры. Если бы хромосомы стрептомицетов были кольцевыми, значительная часть спор оказалась бы нежизнеспособной.
2. Линейные хромосомы легче обмениваются информацией. Если кольцевым хромосомам необходимо два акта рекомбинации для получения двух стабильных рекомбинантов, то линейным достаточно одного [21]. Это может приводить к увеличению потенциального генетического разнообразия популяции, в особенности в присутствии плазмид [22]. В тяжелых условиях постоянной химической войны с использованием антибиотиков, в которых живут, например, стрептомицеты, наличие у вида большого стратегического резерва в виде пула плазмид с генами антибиотиков и резистентности к ним просто необходимо, а рекомбинация между такой плазмидой и хромосомой в этом случае выполняет роль системы, гарантирующей передачу полезной плазмиды потомкам. Высокая вариабельность концов хромосом у стрептомицетов служит косвенным подтверждением использования ими этого преимущества. Недавно, используя популяционно-генетический анализ стрептомицетов, Cheng и др. [23] подтвердили важность интеграции плазмид и гомологичной рекомбинации в эволюции этих микроорганизмов. В другой бактерии с линейной хромосомой – Borrelia, обнаружен высокопластичный участок генома, связанный с одной из теломер, а также большое число плазмид, линейных и кольцевых, способных к рекомбинации с этим участком. Плазмиды, как и терминальный участок генома, несут различные вариации генов, связанных с синтезом липопротеинов. Такой генетический конструктор позволяет этой бактерии быть более изменчивой, лучше подстраиваться под конкретного хозяина и его иммунную систему [22].
3. Дупликация генов на концах хромосом также может происходить достаточно легко, если хромосома линейна; при этом дуплицировавшийся ген может приобрести новую функцию в ходе эволюции. В этом случае, правда, польза от рекомбинации становится очевидной не сразу, а только после накопления мутаций, которые в конечном счете и приведут к “улучшению” фенотипа бактерии как долгосрочного эффекта дупликации.
С целью проверить, дает ли линейность хромосомы адаптивное преимущество клетке, исследователи выбрали уникальный объект – Agrobacterium biovar 1. Геном этой бактерии состоит из кольцевой и линейной хромосом. Сравнение хромосом внутри одного вида позволяет избавиться от нежелательных эффектов, которые дают различные биотопы, эволюционная история и генетическое окружение штамма [24]. Как оказалось, рекомбинация между генами происходит чаще в линейной хромосоме, но не чаще, чем в дистальной (дальней от начала репликации) части кольцевой хромосомы. Основываясь на этом заключении, а также на результатах анализа других параметров (например, сходных значениях Ka/Ks между двумя хромосомами), авторы пришли к выводу, что линейная топология не влияет на скорость обмена информацией и, следовательно, должны существовать другие причины линеаризации бактериальных хромосом.
Таким образом, причиной линеаризации хромосом может быть либо облегченное разделение хромосом при рекомбинации, либо облегченная дупликация отдельных генов. Но тут следует заметить, что эти рассуждения основаны на результатах, полученных в единственном исследовании, выполненном на единственном объекте, поэтому вопрос об ускоренном обмене информацией у бактерий с линейными хромосомами и получаемых при этом преимуществах не стоит “класть под сукно”.
ЛИНЕЙНЫЕ ГЕНОМЫ МИТОХОНДРИЙ
Хромосомы, содержащиеся в митохондриях, были открыты в начале шестидесятых годов прошлого века [25]. Как и в случае с бактериями, изначально считалось, что митохондрии могут обладать исключительно кольцевыми геномами, но уже через пять лет после открытия митохондриальной ДНК (мтДНК), оказалось, что митохондриальные хромосомы могут быть и линейными. Впервые это было показано для инфузории Tetrahymena pyriformis [26]. За этим последовал ряд публикаций по линейным хромосомам митохондрий в самых разных эукариотах: жгутиковых протистах, апикомплексах, водорослях, слизевиках, оомицетах, дрожжах и даже в многоклеточных книдариях. Аналогично линеаризации хромосом в бактериях, эукариотическая линеаризация митохондриальных хромосом, будучи достаточно распространенной в отдельных группах, не имеет четкого филетического сигнала. Так, почти треть видов дрожжей несет линейную мтДНК; при этом даже разные штаммы одного вида Williopsis saturnus различаются по этому признаку [11]. Как и для бактерий, для мтДНК кукурузы обнаружили легкий переход из кольцевой формы в линейную через встраивание линейных митохондриальных плазмид в митохондриальную хромосому [27]. Позднее такой же механизм линеаризации хромосом – через встраивание плазмид в изначально кольцевую мтДНК – выявлен для дрожжей, книдарий и некоторых других организмов [28, 29].
Очевидно, что для репликации линейной мтДНК необходимо решить проблему репликации концов. Установлено, что эта проблема решается с помощью теломер и особой белковой машинерии, которая удлиняет теломеры и состоит из полимеразы и белка, связывающего одноцепочечную ДНК (оцДНК) [28]. Однако, помимо теломер, проблема репликации концов может быть решена и ковалентным замыканием оцДНК в кольцо. Такую стратегию использует, например, инфузория Paramecium. Репликация митохондриальной хромосомы протекает так же, как и в случае боррелии (рис. 1а) [11, 30]. Репликация мтДНК дрожжей происходит по механизму катящегося кольца: хромосома замыкается в кольцо, после чего кольцо надрезается и происходит синтез мтДНК. Получающийся конкатенат далее нарезается на единичные геномы [31].
Интересно, что в случае мтДНК книдарий линеаризация стала возможной исключительно благодаря встроившейся плазмиде с двумя рамками считывания, которые кодируют белок, связывающий оцДНК и специальную полимеразу [28].
Наряду с четко определенным механизмом репликации линейной мтДНК известны организмы, у которых репликация происходит иначе. Например, для митохондриальной хромосомы дрожжей рода Candida известно три механизма репликации [29, 30]. Часто репликация хромосом кандид начинается с рекомбинации, запускающей весь процесс.
На тему адаптивности перехода митохондриального генома из кольцевой формы в линейную выдвигались принципиально те же гипотезы, что и в случае линеаризации генома бактерий: облегчение рекомбинации и обмена информацией при слиянии митохондрий, содействие в разделении рекомбинантных хромосом при делении и ускорение эволюции генов на концах линейной хромосомы [11, 28, 29]. Однако, учитывая легкость перехода в линейную форму и полифилетичность организмов с линейной мтДНК, можно скорее говорить о том, что этот процесс эволюционно нейтрален [11].
ДРОЖЖИ С КОЛЬЦЕВЫМИ ХРОМОСОМАМИ
Не только бактерии могут изменять топологию своих хромосом. Некоторые эукариоты способны закольцовывать свои хромосомы при определенных условиях. Так, при удалении каталитической субъединицы теломеразы большинство клеток в колонии дрожжей гибнет. Оставшиеся либо закольцовывают свои хромосомы, либо удлиняют свои теломеры – в основном за счет учащенной рекомбинации [32].
ЗАКЛЮЧЕНИЕ
Из вышеизложенного следует, что вопрос об адаптивной причине линеаризации хромосом остается пока открытым, несмотря на большой интерес к нему многих исследователей. Благодаря колоссальному скачку в развитии и распространении технологий секвенирования сегодня возможен крупномасштабный эволюционный анализ, который позволит приблизиться к пониманию механизмов и причин возникновения линейных геномов. А знание механизмов линеаризации геномов и их репликации, в свою очередь, будет востребовано при разработке новых методов генной инженерии. Так, свойства различных топологий матрицы ДНК уже учитывают при разработке, например, методов амплификации нуклеиновых кислот [33]. При репликации кольцевых молекул ДНК in vitro неизбежно возникают топологические проблемы, которые можно будет решить путем их временной линеаризации.
Автор благодарен М.С. Гельфанду за внимательное прочтение манускрипта и критические замечания.
Работа поддержана грантом Российского научного фонда №18-14-00358.
Список литературы
Volff J.N., Altenbuchner J. (2000) A new beginning with new ends: linearisation of circular chromosomes during bacterial evolution. FEMS Microbiol. Lett. 186(2), 143–150.
Cairns J. (1963) The bacterial chromosome and its manner of replication as seen by autoradiography. J. Mol. Biol. 6, 208–213.
Gray M.W. (2012) Mitochondrial evolution. Cold Spring Harb. Perspect. Biol. 4, a011403.
Woese C.R., Stackebrandt E., Macke T.J., Fox G.E. (1985) A phylogenetic definition of the major eubacterial taxa. Syst. Appl. Microbiol. 6, 143–151.
Woese C.R. (1987) Bacterial evolution. Microbiol. Rev. 51, 221–271.
Sagan L. (1967) On the origin of mitosing cells. J. Theor. Biol. 14(3), 255–274.
Casjens S. (1998) The diverse and dynamic structure of bacterial genomes. Annu. Rev. Genet. 32, 339–377.
Ferdows M.S., Barbour A.G. (1989) Megabase-sized linear DNA in the bacterium Borrelia burgdorferi, the Lyme disease agent. Proc. Natl. Acad. Sci. USA. 86, 5969–5973.
Lin Y.S., Kieser H.M., Hopwood D.A., Chen C.W. (1993) The chromosomal DNA of Streptomyces lividans 66 is linear. Mol. Microbiol. 10, 923–933.
Goodner B.W., Markelz B.P., Flanagan M.C., Crowell C.B., Racette J.L., Schilling B.A., Halfon L.M., Mellors J.S., Grabowski G. (1999) Combined genetic and physical map of the complex genome of Agrobacterium tumefaciens. J. Bacteriol. 181, 5160–5166.
Nosek J., Tomaska L., Fukuhara H., Suyama Y., Kovac L. (1998) Linear mitochondrial genomes: 30 years down the line. Trends Genet. 14, 184–188.
Hinnebush J., Tilly K. (1993) Linear plasmids and chromosomes in bacteria. Mol. Microbiol. 10, 917–922.
McLeod M.P., Warren R.L., Hsiao W.W., Araki N., Myhre M., Fernandes C., Miyazawa D., Wong W., Lillquist A.L., Wang D., Dosanjh M., Hara H., Petrescu A., Morin R.D., Yang G., Stott J.M., Schein J.E., Shin H., Smailus D., Siddiqui A.S., Marra M.A., Jones S.J., Holt R., Brinkman F.S., Miyauchi K., Fukuda M., Davies J.E., Mohn W.W., Eltis L.D. (2006) The complete genome of Rhodococcus sp. RHA1 provides insights into a catabolic powerhouse. Proc. Natl. Acad. Sci. USA. 103(42), 15582–15587.
Seshadri R., Paulsen I.T., Eisen J.A., Read T.D., Nelson K.E., Nelson W.C., Ward N.L., Tettelin H., Davidsen T.M., Beanan M.J., Deboy R.T., Daugherty S.C., Brinkac L.M., Madupu R., Dodson R.J., Khouri H.M., Lee K.H., Carty H.A., Scanlan D., Heinzen R.A., Thompson H.A., Samuel J.E., Fraser C.M., Heidelberg J.F. (2003) Complete genome sequence of the Q-fever pathogen Coxiellaburnetii. Proc. Natl. Acad. Sci. USA. 100(9), 5455–5460.
Shiman D., Cohen S.N. (1992) Reconstruction of a Streptomyces linear replicon from separately cloned DNA fragments: existence of a cryptic origin of circular replication within the linear plasmid. Proc. Natl. Acad. Sci. USA. 89, 6129–6133.
Cui T., Morooka N., Ohsumi K., Kodama K., Ohshima T., Ogasawara N., Mori H., Wanner B., Niki H., Horiuchi T. (2007) Escherichia coli with a linear genome. EMBO Rep. 8(2), 181–187.
Sinha A.K., Possoz C., Durand A., Desfontaines J.M., Barre F.X., Leach D. R.F., Michel B. (2018) Broken replication forks trigger heritable DNA breaks in the terminus of a circular chromosome. PLoS Genet. 14(3), e1007256.
Tsai H., Shu H., Yang C., Chen C.W. (2012) Translesion-synthesis DNA polymerases participate in replication of the telomeres in Streptomyces. Nucleic Acids Res. 40(3), 1118–1130.
Bao K., Cohen S.N. (2003) Recruitment of terminal protein to the ends of Streptomyces linear plasmids and chromosomes by a novel telomere-binding protein essential for linear DNA replication. Genes Dev. 17(6), 774–785.
Chaconas G., Stewart P.E., Tilly K., Bono J.L., Rosa P. (2001) Telomere resolution in the Lyme disease spirochete. EMBO J. 20(12), 3229–3237.
Volff J.N., Altenbuchner J. (1998) Genetic instability of the Streptomyces chromosome. Mol. Microbiol. 27, 239–246.
Casjens S., Palmer N., Van Vugt R., Mun Huang W., Stevenson B., Rosa P., Lathigra R., Sutton G., Peterson J., Dodson R.J., Haft D., Hickey E., Gwinn M., White O., Fraser C.M. (2000) A bacterial genome in flux: the twelve linear and nine circular extrachromosomal DNAs in an infectious isolate of the Lyme disease spirochete Borrelia burgdorferi. Mol. Microbiol. 35, 490–516.
Cheng K., Rong X., Pinto-Tomás A.A., Fernández-Villalobos M., Murillo-Cruz C., Huang Y. (2015) Population genetic analysis of Streptomyces albidoflavus reveals habitat barriers to homologous recombination in the diversification of streptomycetes. Appl. Environ. Microbiol. 81(3), 966–975.
Marri P.R., Harris L.K., Houmiel K., Slater S.C., Ochman H. (2008) The effect of chromosome geometry on genetic diversity. Genetics. 179(1), 511–516.
Nass S., Nass M.M.K. (1963) Intramitochondrial fibers with DNA characteristics. J. Cell Biol. 19, 593–629.
Suyama Y., Miura K. (1968) Size and structural variation of mitochondrial DNA. Proc. Natl. Acad. Sci. USA. 60, 235–242.
Schardl C.L., Lonsdale D.M., Pring D.R., Rose K.R. (1984) Linearization of maize mitochondrial chromosomes by recombination with linear episomes. Nature. 310, 292–296.
Kayal E., Bentlage B., Collins A.G., Kayal M., Pirro S., Lavrov D.V. (2012) Evolution of linear mitochondrial genomes in medusozoan cnidarians. Genome Biol. Evol. 4(1), 1–12.
Gerhold J.M., Sedman T., Visacka K., Slezakova J., Tomaska L., Nosek J., Sedman J. (2014) Replication intermediates of the linear mitochondrial DNA of Candida parapsilosis suggest a common recombination based mechanism for yeast mitochondria. J. Biol. Chem. 289(33), 22659–22670.
Goddard J.M., Cummings D.J. (1975) Structure and replication of mitochondrial DNA from Paramecium aurelia. J. Mol. Biol. 97, 593–609.
Maleszka R., Skelly P.J., Clark-Walker G.D. (1991) Rolling circle replication of DNA in yeast mitochondria. EMBO J. 10, 3923–3929.
Nakamura T.M., Cooper J.P., CechT.R. (1998) Two modes of survival of fission yeast without telomerase. Science. 282, 493–496.
Сахабутдинова А.Р., Максимова М.А., Гарафутдинов Р.Р. (2017) Получение ДНК-матриц с помощью Т4 РНК-лигазы для амплификации катящимся кольцом. Молекуляр. биология. 51, 724–733.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология