Молекулярная биология, 2019, T. 53, № 3, стр. 446-455
Индукция экспрессии Ran1, а также миметиков GDP- и GTP-связанного Ran1 приводит к аномальной сборке цитоплазматических микротрубочек и нарушению амитоза и цитокинеза
H. X. Liang a, b, *, H. W. Liu b, c
a School of Biomedical Engineering, Taiyuan University of Technology
030024 Taiyuan, Shanxi, China
b MicroNano System Research Center, Key Laboratory of Advanced Transducers and Intelligent Control System
of Ministry of Education and Shanxi Province College of Information & Computer Engineering,
Taiyuan University of Technology
030024 Taiyuan, Shanxi, China
c College of Chemistry and Chemical Engineering, Taiyuan University of Technology
030024 Taiyuan, Shanxi, China
* E-mail: lianghaixia456@hotmail.com
Поступила в редакцию 06.06.2018
После доработки 16.10.2018
Принята к публикации 16.10.2018
Аннотация
Ran – эволюционно консервативная GTPаза, крайне важная для регуляции разных типов клеточного деления, включая митоз и мейоз. Ранее показано, что в результате нокдауна гена RAN1 у Tetrahymena thermophila угнетается амитотическое деление макронуклеуса с аномальной организацией макронуклеарных микротрубочек. Нами исследовано влияние индукции экспрессии белка Ran1 дикого типа (Ran1WT), а также миметиков GTP-связанного Ran1 (Ran1Q70L) и GDP-связывающего Ran1 (Ran1T25N) на сборку цитоплазматических микротрубочек во время амитотического деления клеток T. thermophila. Сконструированы мутантные штаммы T. thermophila для экспрессии Ran1WT/T25N/Q70L, индуцируемой с помощью Cd2+. В процессе амитоза индуцибельно экспрессируемые HA-Ran1Q70L/T25N распределяются асимметрично относительно оболочки макронуклеуса. При низком уровне экспрессии значимое снижение влияния на репродукцию T. thermophila, амитоз макронуклеуса и цитокинез выявлено только для Ran1T25N. При более высоком уровне экспрессии белки Ran1WT/Q70L/T25N подавляют репродукцию T. thermophila, амитоз макронуклеуса и цитокинез, причем самым значимым было ингибирующее действие Ran1T25N. Индукция экспрессии Ran1WT/Q70L/T25N приводила к нарушениям амитоза и цитокинеза с аномальной сборкой микротрубочек в цитоплазме. Эти результаты подтверждают регуляторную функцию Ran1 в амитозе и дают основания предполагать новые функции Ran1 в цитокинезе и выстраивании цитоплазматических микротрубочек у T. thermophila.
Амитоз, прямой и простой способ деления клеток, часто наблюдают у низших организмов, таких как ресничные простейшие и грибы. Он происходит и в высших организмах, таких как некоторые клетки растений и животных, лейкозные клетки, раковые клетки полости рта и асцитные раковые клетки [1–3]. В отличие от митоза, амитотическое деление ядра характеризуется отсутствием микротрубочек веретена и неодинаковым распределением хромосом в дочерних ядрах [4]. У инфузорий Tetrahymena thermophila организация микротрубочек внутри макронуклеуса функционально похожа на веретено и контролирует разделение хромосом в макронуклеусе во время амитоза [5, 6]. В то же время перестройка микротрубочек в цитоплазме способствует завершению амитоза [7].
GTPаза Ran играет важную роль в жизнедеятельности клетки: регулирует пролиферацию клеток и координирует разные виды клеточной активности. Ran существует в двух нуклеотидсвязанных формах: либо с GDP, либо с GTP. Функции Ran обусловлены пространственным градиентом ядерного RanGTP против цитоплазматического RanGDP, который поддерживается разделением активностей фактора обмена гуаниновых нуклеотидов и активирующего GTPазу белка, которые регулируют активность Ran в ядерном и цитоплазматическом компартментах во время интерфазы или в хроматинсвязанных и отдаленных хроматиновых компартментах во время митоза [8, 9]. При открытом митозе эукариотических клеток вокруг хромосом формируется градиент белка RanGTP, который рекрутирует важные компоненты центросом и кинетохоров и индуцирует высвобождение факторов сборки веретена [9–12]. Ran также регулирует сборку микротрубочек во время мейоза [13] и апоптоза [14]. Механизм зависимой от градиента RanGTP, опосредованной хромосомами бесцентросомной сборки веретена, был обнаружен в экстракте Xenopus [15], но оказался менее выраженным в живых ооцитах [16]. Во время апоптоза высвобождение RanGTP, который активирует фактор сборки веретена TPX2 в цитоплазме при апоптозе, служит триггером для апоптотической нуклеации микротрубочеке. Кроме того, Ran участвует в сборке цитоплазматических микротрубочек, что важно для закрытого митоза делящихся дрожжей [17, 18]. Ранее показано, что у T. thermophila Ran1 участвует в сборке сети микротрубочек внутри макронуклеуса при апоптозе [19]. При анализе пространственного распределения Ran1GTP/GDP оказалось, что по локализации эндогенные Ran1WT (дикого типа), Ran1Q70L (миметик GTP-связанного Ran1) и Ran1T25N (миметик GDP-связанного Ran1) существенно не отличались друг от друга, если анализ не проводился методом измерения коэффициента интенсивности флуоресценции. Распределение Ran1Q70L/T25N не отражало функцию и активность Ran1 у T. thermophila. Кроме того, хотя нокдаун экспрессии Ran1T25N, индуцированной RAN1 и 0.1 мкг/мл Cd2+, приводил к аномальной организации микротрубочек внутри макронуклеуса при амитозе, авторы не исследовали организацию цитоплазматических микротрубочек.
Индуцибельная экспрессия генов дикого и мутантного типов считается мощным инструментом для исследования клеточной локализации и идентификации биохимической активности кодируемого белка, которые сложно обнаружить при традиционном анализе “lose-of-function” – потери функции [20]. Для дальнейшей оценки внутриклеточного распределения Ran1GTP/GDP и участия пути Ran1 в сборке цитоплазматических микротрубочек нами созданы мутантные штаммы T. thermophila, способные к индуцибельной экспрессии Ran1WT/T25N/Q70L. Кроме того, исследована субклеточная локализация индуцибельно экспрессируемых белков Ran1WT/T25N/Q70L, а также фенотипические варианты индуцибельной экспрессии и их влияние на сборку цитоплазматических микротрубочек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Штаммы и условия культивирования. Штамм CU428 T. thermophila любезно предоставил д-р Wei Wang (Shanxi University). Клетки T. thermophila культивировали в среде Super Proteose Peptone (SPP), содержащей 2% протеозопептона, при 30°C. Для проведения трансформации клетки в фазе логарифмического роста отмывали и выдерживали при 30°C в 10 мМ Трис-HCl, pH 7.4, в течение 16–24 ч. Для получения синхронно делящихся клеток в логарифмической фазе роста их суспендировали в свежей среде SPP при плотности 2 × 105 клеток/мл в течение 2 ч.
Конструирование штаммов, способных к индуцибельной экспрессии HA-Ran1WT/T25N/Q70L. Кодирующую последовательность Ran1WT/T25N/ Q70L амплифицировали и клонировали в виде BglII/AscI-фрагментов в векторе pXS75, как описано ранее [19]. Вектор pXS75 содержит кассету NEO2 в качестве селектируемого маркера и 5'- и 3'-фланкирующие последовательности гена MTT1 как плечи для гомологичной рекомбинации. Эти конструкты трансформировали в вегетативно растущие клетки T. thermophila с использованием биолистической бомбардировки. Трансформанты сортировали путем увеличения концентрации паромомицина и идентифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров MHR-U⁄L. Индуцированную эндогенным Ran1 и Cd2+ экспрессию HA-Ran1WT/ T25N/Q70L анализировали методом иммуно-блотинга, как описано ранее [19].
Непрямой иммунофлуоресцентный анализ. Перед отбором клеток через 1 ч после индукции синхронизации их обрабатывали раствором соли кадмия в концентрации 0.1 и 0.2 мкг/мл Cd2+ в течение 1 ч. Клетки собирали и фиксировали в фиксаторе Лавдовского (этанол : формалин : уксусная кислота : вода = 50 : 10 : 1 : 39) [21] в течение ночи при 4°С. Затем фиксированные клетки промывали, ресуспендировали в фосфатно-солевом буфере (PBS) и иммобилизировали на покровных стеклах, покрытых поли-L-лизином (“Sigma”, США). Образцы инкубировали в блокирующем буфере, содержащем 3% BSA, 10% нормальной козьей сывороткии 0.1% Tween-20 в PBS, в течение 2 ч при комнатной температуре. Для иммуноокрашивания эндогенного Ran1 и α-тубулина образцы инкубировали в течение ночи при 4°C с разведенными в блокирующем буфере в соотношении 1 : 150 мышиными антителами против Ran1 (“California Bioscience”, США) и мышиными антителами против α-тубулина (“Boster”, США) соответственно, а затем с TRITC-конъюгированными антителами против IgG мыши (“Zymed Laboratories”, США), разведенными в соотношении 1 : 150 блокирующим раствором, в течение 1 ч при комнатной температуре. Для иммуноокрашивания белков HA-Ran1, экспрессируемых после индукции, клетки инкубировали с мышиными анти-HA-антителами (“California Bioscience”), взятыми в разведении 1 : 500, в течение ночи при 4°C, а затем с TRITC-конъюгированными антителами (разведение 1 : 1000) против мышиного IgG в течение 1 ч при комнатной температуре. Наконец, клетки инкубировали с DAPI (“Roche”, Германия), в концентрации 1 мкг/мл в PBS, в течение 10 мин, фиксировали и наблюдали с помощью конфокального микроскопа Olympus FV1000 (“Olympus”, Япония).
Фенотипический анализ индуцибельной экспрессии. Клетки в фазе логарифмического роста переносили в SPP без паромомицина в начальной концентрации 1 × 104 клеток/мл и статически культивировали с 0, 0.1 и 0.2 мкг/мл CdCl2 для определения скорости роста штаммов, способных к индуцибельной экспрессии Ran1. Эти клетки отбирали и подсчитывали. Для наблюдения за морфологией деления ядра и цитоплазмы клетки в логарифмической фазе роста обрабатывали 0, 0.1 и 0.2 мкг/мл CdCl2 в течение 1 ч – через 1 ч после индукции синхронизации. Клетки собирали, окрашивали DAPI, как описано выше, и наблюдали с использованием конфокального микроскопа Olympus FV1000.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Молекулярная характеристика клеток T. thermophila с индуцибельной экспрессией
Для более глубокого понимания функции компонентов пути Ran1 при амитозе T. thermophila гены RAN1WT/Q70L/T25N в части, кодирующей N‑конец соответствующего белка, были фланкированы геном гемагглютинина (HA) вируса гриппа, клонированы в эндогенный локус MTT1 посредством гомологичной рекомбинации и помещены под контроль Cd2+-индуцибельного промотора MTT1 (рис. 1а). Клетки-мишени, в которых аллели MTT1 были не полностью заменены на HA-RAN1WT/Q70L/T25N, идентифицировали с помощью ПЦР после селекции с помощью повышающихся концентраций паромомицина (рис. 1б). После индукции ионами Cd2+ в концентрациях 0, 0.1 и 0.2 мкг/мл эндогенную и экзогенную экспрессию Ran1 определяли методом иммуноблотинга с использованием антител против Ran. Выявлено, что исходная экспрессия Ran1 (26 кДа) не изменялась при обработке Cd2+ и генетической манипуляции, индуцибельная экспрессия HA-Ran1WT/Q70L/T25N (28 кДа) увеличивалась с ростом концентрации Cd2+ от 0 до 0.2 мкг/мл и не различалась между мутантами при одинаковойых концентрациях Cd2+ (рис. 1в). При анализе индуцибельной экспрессии HA-Ran1WT/Q70L/T25N с антителами против HA зарегистрированы те же паттерны экспрессии, что и описанные выше (рис. 1в). Показано, что Ran1WT/Q70L/T25N подвергаются индуцибельной экспрессии в клетках T. thermophila, из чего можно сделать вывод о том, что клетки IERan1WT/Q70L/T25N были сконструированы успешно.
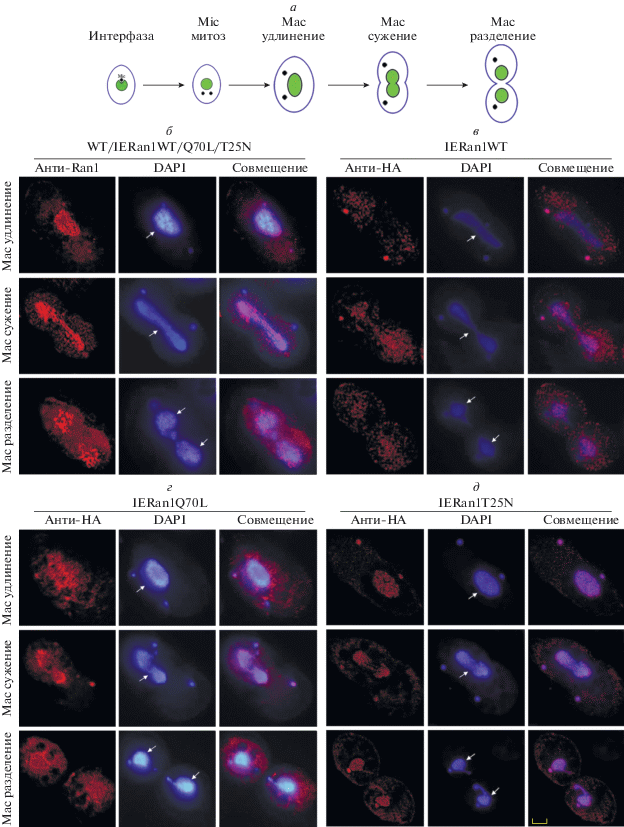
Рис. 1.
Конструирование штаммов, способных к индуцибельной экспрессии Ran1WT/Q70L/T25N. а – Схематичное представление конструкта с индуцибельной экспрессией RAN1. RAN1WT/Q70L/T25N, с двумя последовательностями, кодирующими белок HA, встроенный в N-концевую часть RAN1, использовали для замены в макронуклеусе кодирующей последовательности Cd2+-индуцибельного гена металлотионеина (MTT1), что позволяет HA-фланкированным генам RAN1 оставаться под контролем нативного промотора MTT1. б – Для подтверждения гомологичной рекомбинации конструктов и встраивания в сайты-мишени проводили ПЦР. При амплификации образца мутантной геномной ДНК получены две полосы: полоса 1.7 тыс.н., отражающая замену генов MTT1 на HA-RAN1WT/Q70L/T25N, и полоса 0.7 тыс. н., отражающая присутствие WT-аллеля MTT1. В ПЦР-продуктах ДНК дикого типа (WT) отсутствовала полоса 1.7 тыс. н. в – Анализ вестерн-блот Cd2+-индуцированной (0, 0.1 и 0.2 мкг/мл) эндогенной экспрессии Ran1 и экзогенной экспрессии вариантов HA-Ran1 с антителами против Ran и индуцибельной экспрессии вариантов HA-Ran1 с использованием антител против HA, а также α-тубулина в качестве внутреннего стандарта и общего белка из WT-клеток в качестве отрицательного контроля. Клетки обрабатывали 0, 0.1 и 0.2 мкг/мл Cd2+ в течение 1 ч, а затем отбирали пробы.

Субклеточная локализация HA-Ran1WT/Q70L/T25N во время вегетативного клеточного цикла у T. thermophila
В этом исследовании проанализирована локализация индуцибельно экспрессируемых белков: Ran1 и двух его миметиков – в течение всего процесса амитоза макронуклеуса (рис. 2а). При анализе с помощью анти-Ran-антител обнаружено, что Ran1 и его варианты в основном сконцентрированы в макронуклеусе во время амитоза с рассеянным сигналом в цитоплазме клеток WT и IERan1WT/Q70L/T25N Tetrahymena (рис. 2б). Локализация индуцибельно экспрессируемых HA-Ran1WT/Q70L, проанализированная с использованием антител против HA, была совершенно иной. HA-Ran1WT был диспергирован по всей клетке – без сильного сигнала в макронуклеусе (рис. 2в). HA-Ran1Q70L был распределен по всей клетке с концентрированным сигналом вдоль оболочки макронуклеуса (рис. 2г). HA-Ran1T25N был четко сконцентрирован в макронуклеусе – при слабом цитоплазматическом сигнале (рис. 2д).
Рис. 2.
Субклеточная локализация эндогенного Ran1 и индуцибельно экспрессируемых HA-Ran1WT/Q70L/T25N в процессе амитотического деления макронуклеуса. а – Схематичное представление клеточного цикла T. thermophila во время вегетативного роста. Mic означает микронуклеус, а Mac – макронуклеус. б – Типичные флуоресцентные изображения локализации эндогенного Ran1 и экзогенных вариантов Ran1, проанализированных с использованием антител против Ran1 в синхронизированных делящихся клетках WT и IERan1WT/Q70L/T25N на стадиях удлинения, сужения и разделения макронуклеуса. в–д – Типичные флуоресцентные изображения локализации индуцибельно экспрессируемых HA-Ran1WT/Q70L/T25N, проанализированной с использованием антител против HA на разных стадиях амитоза после обработки 0.1 мкг/мл Cd2+ в течение 1 ч. Белая стрелка указывает на макронуклеус. Масштабная линейка: 5 мкм.
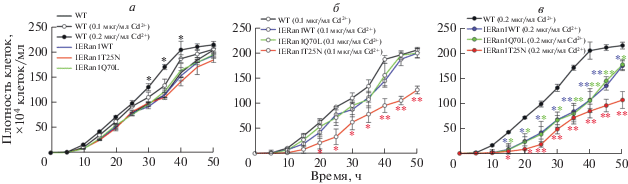
Влияние индуцибельной экспрессии Ran1WT/Q70L/T25N на репродукцию T. thermophila
Для программируемого прерывания цикла Ran1-GDP/GTP провели индуцибельную экспрессию Ran1 и его мутантных белков и обнаружили влияние индуцибельно экспрессируемого Ran1 и его мутантных вариантов на репродукцию T. thermophila. Индуцибельную экспрессию HA-Ran1WT/Q70L/T25N запускали добавлением Cd2+ в концентрации 0.1 и 0.2 мкг/мл. Чтобы исключить возможность влияния Cd2+ на рост T. thermophila, измеряли скорость пролиферации клеток WT, обработанных Cd2+ в дозе 0, 0.1 и 0.2 мкг/мл. Вместе с тем, чтобы исключить возможность влияния генетического вмешательства на рост T. thermophila, измеряли скорость пролиферации клеток IERan1WT/Q70L/T25N без Cd2+. Обработка WT-клеток раствором соли Cd2+ в концентрации 0.2 мкг/мл несколько увеличивала скорость роста, тогда как скорость роста клеток, обработанных 0.1 мкг/мл Cd2+, и клеток IERan1WT/Q70L/T25N была почти такой же, как и у WT-клеток (рис. 3а). Обработка 0.2 мкг/мл Cd2+ стимулировала репродукцию T. thermophila, тогда как при концентрации Cd2+ 0.1 мкг/мл и генетической манипуляции не обнаружено влияния на размножение T. thermophila. После обработки 0.1 мкг/мл Cd2+ пролиферация IERan1WT/Q70L существенно не изменялась, тогда как пролиферация IERan1T25N была явно подавлена (рис. 3б). Cd2+ в концентрации 0.2 мкг/мл сильно подавлял все клетки IERan1WT/Q70L/T25N (рис. 3в). Кроме того, индуцибельная экспрессия Ran1T25N в значительной степени ингибировала пролиферацию T. thermophila по сравнению с экспрессией Ran1WT/Q70L (рис. 3в). Таким образом, пролиферация T. thermophila оказалась более чувствительна к индуцибельной экспрессии Ran1T25N, чем Ran1WT/ Ran1Q70L.
Рис. 3.
Влияние экспрессии Ran1WT/Q70L/T25N, индуцируемой ионами Cd2+ в концентрации 0.1 и 0.2 мкг/мл, на репродукцию клеток T. thermophila. а – Кривая роста клеток WT, обработанных ионами Cd2+ в концентрации 0.1 и 0.2 мкг/мл, и клеток IERan1WT/Q70L/T25N. Данные представлены как среднее ± стандартное отклонение по трем независимым экспериментам. Определение статистической значимости полученных результатов проведено с использованием критерия Стьюдента в сравнении с необработанными клетками WT (*P < 0.05). б и в – Кривая роста клеток WT и IERan1WT/Q70L/T25N, обработанных ионами Cd2+ в концентрации 0.1 и 0.2 мкг/мл. Определение статистической значимости полученных результатов проведено с использованием критерия Стьюдента в сравнении с WT-клетками, обработанными 0.1 и 0.2 мкг/мл Cd2+ *P < 0.05, **P < 0.01).
Индуцибельная экспрессия Ran1WT/Q70L/T25N приводит к аномальной сборке цитоплазматических микротрубочек и к нарушению амитоза и цитокинеза
Индуцибельная экспрессия Ran1WT/Q70L/ T25N влияет на пролиферацию клеток, поэтому вполне вероятно, что возникающие нарушения затрагивают деление клеток. Для проверки этой гипотезы и для изучения морфологии ядерного и цитоплазматического деления было использовано окрашивание DAPI. Мутанты IERan1WT/ Q70L/T25N нарушали амитотическое деление макронуклеуса, что проявлялось в его неспособности к удлинению и сужению, а также образованием дочерних клеток без макронуклеуса (рис. 4а, панель I), также был подавлен цитокинез, что приводило к нарушению деления цитоплазмы на две части и образованию клеток с двумя макронуклеусами (бимакронуклеарных) (рис. 4а, панель II). При обработке клеток IERan1WT/T25N/ Q70L Cd2+ в концентрации 0.1 в клетках IERan1WT/ Q70L не обнаружено никаких отклонений. Напротив, в значительной доле мутантов IERan1T25N наблюдали аномальный амитоз и цитокинез. При 0.2 мкг/мл Cd2+ доля клеток с аномальным амитозом и цитокинезом была выше в мутантах IERan1T25N, чем в IERan1WT/Q70L.
Рис. 4.
Индуцибельная экспрессия Ran1WT/Q70L/T25N приводит к аномальной сборке цитоплазматических микротрубочек и к нарушению амитоза и цитокинеза. а – Типичные примеры флуоресцентных изображений аномальной морфологии деления ядера (панель I) и цитоплазмы (панель II) в клетках IERan1WT/Q70L/T25N, обработанных 0.2 мкг/мл Cd2+. Масштабная линейка: 5 мкм. б – Процентное содержание клеток с нарушениями в амитозе и цитокинезе от общего числа делящихся клеток WT и IERan1WT/T25N/Q70L, обработанных 0.1 или 0.2 мкг/мл Cd2+. Брали не менее 100 делящихся клеток. Данные представлены в виде среднее ± стандартное отклонение для трех независимых экспериментов. Указаны статистически значимые различия *P < 0.05, **P < 0.01). в – Типичные примеры флуоресцентных снимков и схематическое представление организации цитоплазматических микротрубочек в клетках WT и IERan1WT/Q70L/T25N (панель I и II), обработанных 0.2 мкг/мл Cd2+, на стадиях удлинения и разделения макронуклеуса. Масштабная линейка: 5 мкм. г – Процент клеток с аномальной сборкой цитоплазматических микротрубочек от общего числа делящихся клеток WT и IERan1WT/T25N/Q70L, обработанных 0.1 и 0.2 мкг/мл Cd2+. Данные представлены в виде среднее ± стандартное отклонение для трех независимых экспериментов. Указаны статистически значимые различия (**P < 0.01, *P < 0.05).
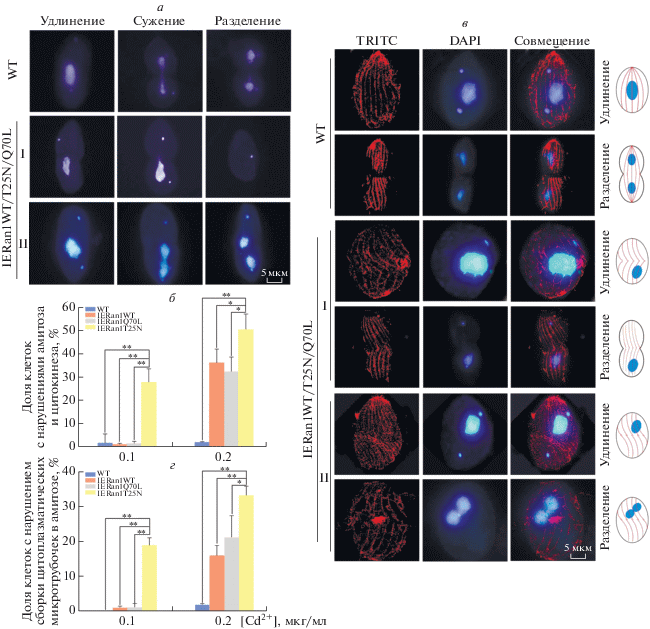
При изучении организации микротрубочек использовали иммунофлуоресцентные методы (рис. 4в). В клетках WT цитоплазматические микротрубочки в форме биполярного веретена находились вдоль длинной оси клетки, а амитотически делящийся макронуклеус располагался в ее центре. По завершении амитоза макронуклеуса цитоплазма оказывалась разделенной между двумя дочерними клетками. В отличие от клеток WT, в мутантах IERan1WT/Q70L/T25N наблюдалось аберрантное распределение цитоплазматических микротрубочек и смещение макронуклеуса от центра на периферию клетки. Аномалии цитоплазматических микротрубочек можно разделить на два типа: (1) расхождение из центральной области цитоплазматического сужения, при этом амитотическое деление макронуклеуса не происходит (рис. 4в, панель I), и (2) расхождение в противоположных направлениях, при этом не происходит деления цитоплазмы, а начавшийся амитоз макронуклеуса остается незавершенным (рис. 4в панель II). Обработка Cd2+ в дозах 0.1 и 0.2 мкг/мл влияла на сборку цитоплазматических микротрубочек в клетках IERan1WT/T25N/Q70L по-разному, почти всегда совпадая с ингибирующим действием на амитоз и цитокинез (рис. 4г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами изучена локализация компонентов пути Ran1 и влияние их индуцибельной экспрессии на пролиферацию и деление клеток T. thermophila. Индуцибельно экспрессированные белки Ran1WT/Q70L/T25N отличались друг от друга по локализации, что указывало на асимметричное распределение Ran1GTP и Ran1GDP относительно оболочки макронуклеуса во время амитоза (рис. 5). Очевидно, локализованный в мембране макронуклеуса Ran1Q70L, который “замкнут” в GTP-связанном состоянии, связывается с RanGTPаза-активирующим белком RanGAP в ядерной оболочке и с цитоплазматическим RanGTP-связывающим белком RanBP1, окружающим оболочку макронуклеуса, но не гидролизуется ими [22–27] и представляет собой сайт генерации Ran1GDP. В то же время локализованный в макронуклеусе Ran1T25N, который имеет пониженное сродство к нуклеотидам и образует стабильный комплекс с RCC1 – главным фактором обмена нуклеотидами Ran [23, 28, 29], служит сайтом генерации Ran1GTP. По сравнению с эндогенными мутантами RAN1 распределение индуцибельно экспрессируемого гена RAN1 и исследованных нами мутантных вариантов значительно отличается, что важно при исследовании функции и активности компонентов пути Ran1. В одном из ранее проведенных исследований эндогенный ген RAN1 в геноме T. thermophila был мутирован с использованием гомологичной рекомбинации [19]. Во-первых, эндогенный ген RAN1 был только частично заменен и мутирован из-за биологических особенностей роста T. thermophila. Во-вторых, эндогенные Ran1GTP и Ran1GDP могут быстро конвертировать друг в друга для выполнения соответствующих физиологических функций. Теперь нами сконструированы мутантные штаммы T. thermophila с экзогенно индуцибельной экспрессией RAN1, в которых экспрессии хорошо выражена и зависит от концентрации Cd2+. Кроме того, локализация экзогенного Ran1 и его мутантов согласуется с аксессорными факторами Ran1 – RCC1, RanGAP и RanBP1, – которые регулируют конверсию между активным RanGTP и неактивным RanGDP.
Рис. 5.
Схема, иллюстрирующая асимметричное распределение Ran1GTP и Ran1GDP относительно оболочки макронуклеуса и то, как индуцибельная экспрессия Ran1WT/Q70L/T25N блокирует цикл Ran1GTP/GDP.
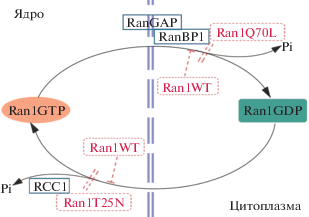
Локализация индуцибельно экспрессированных Ran1WT/Q70L/T25N позволила объяснить различия в степени их воздействия на пролиферацию и деление клеток (рис. 5). Индуцибельная экспрессия Ran1WT приводила к равномерному распределению его по клеткам, но аномальному распределению Ran1 внутри клетки: большая часть находилась в ядре и лишь незначительная часть была в цитоплазме, что нарушало цикл Ran1. Возможно, что индуцибельно экспрессированный Ran1Q70L взаимодействовал с RanGAP и RanBP1, а Ran1T25N взаимодействовал с RCC1, что блокировало эндогенное переключение нуклеотидов Ran1 в любом направлении. При низкой концентрации индуктора (обработка Cd2+ в дозе 0.1 мкг/мл) экспрессия Ran1T25N ингибировала пролиферацию клеток, макроядерный амитоз и цитокинез, тогда как клетки, индуцибельно экспрессирующие Ran1WT/Q70L, размножались и делились нормально – что сходно с результатами по нарушению Ran-цикла в апоптотических клетках [14]. При повышенной концентрации индуктора (обработка 0.2 мкг/мл Cd2+) экспресия всех Ran1WT/Q70L/T25N ингибировала размножение клеток, амитотическое и цитоплазматическое деление, что сопровождалось многополярной сборкой веретена, вызванной блокировкой переключения нуклеотидов Ran в любом направлении в клетках млекопитающих [28, 30]. Кроме того, индуцибельно экспрессированный Ran1T25N стабильно взаимодействовал с RCC1 и ингибировал активность RCC1 по обмену нуклеотидов гуанина [31], тем самым предотвращая выработку активного ядерного RanGTP. Таким образом, Ran1T25N оказывал наиболее сильное ингибирующее действие на пролиферацию и деление клеток.
В этом исследовании клетки фиксировали в фиксаторе Лавдовского [21], который больше подходит для визуализации цитоплазматических микротрубочек, чем 1.8%-ный параформальдегид, использованный в предыдущих исследованиях [6, 19]. Фиксация 1.8%-ным параформальдегидом обеспечивает максимальную защиту расположения и структуры внутриядерных микротрубочек и сохранности цитоплазматических структур. Помимо дефектной сборки микротрубочек внутри макронуклеуса индуцибельная экспрессия Ran1WT/Q70L/T25N приводила к двум различным типам аномальной перегруппировки цитоплазматических микротрубочек, оба из которых были связаны с отклонением от длинной оси делящейся клетки и сопровождались нарушениями амитоза и цитокинеза. Амитоз макронуклеуса и цитокинез не зависели друг от друга, что согласуется с предыдущими результатами, полученными на клетках Saccharomyces pombe, мутантных по тубулину, которые не формировали митотическое веретено, но формировали нормальное кольцо актомиозина, тогда как мутанты, дефектные по сборке актомиозинового кольца, формировали нормальные митотические веретена [32]. С одной стороны, роль цитоплазматических микротрубочек в цитокинезе такая же, как и у основанной на микротрубочках структуры фрагмопласта растительной клетки, которая способствует формированию пластинки клеточного деления [33], в частности, рекрутированию мембранных белков, необходимых для цитокинеза, в клеточную пластинку [34]. С другой стороны, при митозе клетки S. pombe пространственная организация цитоплазматических микротрубочек определяла ориентацию веретена и позиционировала разделенные сестринские хромосомы в точке цитокинеза таким образом, чтобы каждая дочерняя клетка гарантированно получала разделенные сестринские хромосомы [35, 36]. В связи с этим была выдвинута гипотеза, что неправильно организованные цитоплазматические микротрубочки T. thermophila, формирующиеся при индуцибельной экспрессии Ran1WT/Q70L/T25N, могут приводить, во-первых, к аномальной организации микротрубочек внутри макронуклеуса и к его смещению, а, следовательно, и к нарушениям в разделении хромосом макронуклеуса; и, во-вторых, к неспособности сформировать пластинку деления клетки и, следовательно, к неполноценному цитокинезу. Кроме того, система Ran GTPазы может выступать в качестве регулятора динамики цитоскелета, удаленного от ядра [12, 18], что также можно считать аргументом в пользу этой гипотезы.
Таким образом, используя индуцибельно экспрессированные Ran1 и его мутанты, имитирующие GDP- и GTP-связанную форму, мы получили биологически значимые результаты по их участию в амитозе макронуклеуса T. thermophila. Кроме того, показано, что Ran1 вовлечен в сборку цитоплазматических микротрубочек, которая скоординирована с внутриядерными микротрубочками для обеспечения сегрегации хромосом макронуклеуса и облегчения цитокинеза. Исследование способствует пониманию роли консервативного пути GTPазы Ran в амитозе.
Работа выполнена при финансовой поддержке грантов Национального фонда естественных наук Китая (National Natural Scientific Foundation of China, # 31501124].
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Osgood E.E., Chu I.T. (1948) The effect of urethane on the nuclear morphology of cells of the granulocyte series as observed in marrow cultures and leukemic blood. Blood. 3, 911–917.
Stevens D., Schwenk E. (1959) Amitosis in a new ascites tumor. Experientia. 15, 470–471.
Reshmi S.C., Gollin S.M. (2005) Chromosomal instability in oral cancer cells. J. Dent. Res. 84, 107–117
Wong L., Klionsky L., Wickert S., Merriam V., Orias E., Hamilton E.P. (2000) Autonomously replicating macronuclear DNA pieces are the physical basis of genetic coassortment groups in Tetrahymena thermophila. Genetics. 155, 1119–1125.
Numata O., Fujiu K., Gonda K. (1999) Macronuclear division and cytokinesis in Tetrahymena. Cell Biol. Int. 23, 849–857.
Fujiu K., Numata O. (2000) Reorganization of microtubules in the amitotically dividing macronucleus of tetrahymena. Cell Motil. Cytoskeleton. 46,17–27.
Cervantes M.D., Coyne R.S., Xi X., Yao M.C. (2006) The condensin complex is essential for amitotic segregation of bulk chromosomes, but not nucleoli, in the ciliate Tetrahymena thermophila. Mol. Cell Biol. 26, 4690–4700.
Rensen W.M., Mangiacasale R., Ciciarello M., Lavia P. (2008) The GTPase Ran: regulation of cell life and potential roles in cell transformation. Front. Biosci. 13, 4097–4121.
Kalab P., Heald R. (2008) The RanGTP gradient – a GPS for the mitotic spindle. J. Cell Sci. 121, 1577–1586.
Gruss O.J., Carazo-Salas R.E., Schatz C.A., Guarguaglini G., Kast J., Wilm M., Le Bot N., Vernos I., Karsenti E., Mattaj I.W. (2001) Ran induces spindle assembly by reversing the inhibitory effect of importin alpha on TPX2 activity. Cell. 104, 83–93.
Hetzer M., Gruss O.J., Mattaj I.W. (2002) The Ran GTPase as a marker of chromosome position in spindle formation and nuclear envelope assembly. Nat. Cell Biol. 4, E177–E184.
Oh D., Yu C.H., Needleman D.J. (2016) Spatial organization of the Ran pathway by microtubules in mitosis. Proc. Natl. Acad. Sci. USA. 113, 8729–8734.
Cesario J., McKim K.S. (2011) RanGTP is required for meiotic spindle organization and the initiation of embryonic development in Drosophila. J. Cell Sci. 124, 3797–3810.
Moss D.K., Wilde A., Lane J.D. (2009) Dynamic release of nuclear RanGTP triggers TPX2-dependent microtubule assembly during the apoptotic execution phase. J. Cell Sci. 122, 644–655.
Carazo-Salas R.E., Guarguaglini G., Gruss O.J., Segref A., Karsenti E., Mattaj I.W. (1999) Generation of GTP-bound Ran by RCC1 is required for chromatin-induced mitotic spindle formation. Nature. 400, 178–181.
Ohkura H. (2015) Meiosis: an overview of key differences from mitosis. Cold Spring Harb. Perspect. Biol. 7, pii: a015859.
Fleig U., Salus S.S, Karig I. Sazer S. (2000) The fission yeast ran GTPase is required for microtubule integrity. J. Cell Biol. 151, 1101–1111.
Yudin D., Fainzilber M. (2009) Ran on tracks-cytoplasmic roles for a nuclear regulator. J. Cell Sci. 122, 587–593.
Liang H., Xu J., Zhao D., Tian H., Yang X., Liang A. Wang W. (2012) Subcellular localization and role of Ran1 in Tetrahymena thermophila amitotic macronucleus. FEBS. J. 279, 2520–2533.
Prelich G. (2012) Gene overexpression: uses, mechanisms, and interpretation. Genetics. 190, 841–854.
Mochizuki K., Fine N.A., Fujisawa T., Gorovsky M.A. (2002) Analysis of a piwi-related gene implicates small RNAs in genome rearrangement in tetrahymena. Cell. 110, 689–699.
Bischoff F.R., Klebe C., Kretschmer J., Wittinghofer A., Ponstingl H. (1994) RanGAP1 induces GTPase activity of nuclear Ras-related Ran. Proc. Natl. Acad. Sci. USA. 91, 2587–2591.
Klebe C., Bischoff F.R., Ponstingl H., Wittinghofer A. (1995) Interaction of the nuclear GTP-binding protein Ran with its regulatory proteins RCC1 and RanGAP1. Biochemistry. 34, 639–647.
Mahajan R., Delphin C., Guan T., Gerace L., Melchior F. (1997) A small ubiquitin-related polypeptide involved in targeting RanGAP1 to nuclear pore complex protein RanBP2. Cell. 88, 97–107.
Rose A., Meier I. (2001) A domain unique to plant RanGAP is responsible for its targeting to the plant nuclear rim. Proc. Natl. Acad. Sci. USA. 98,15377–15382.
Zhao D., Liang H., Xu J., Wang W. (2013) Ran Binding Protein 1 affects macronuclear and micronuclear division in Tetrahymena thermophila. Chin. J. Bio. Mol. Biol. 29, 330–337.
Ren X., Xu J., Wang W. (2015) Localization and function of RanGTPase activating protein (RanGAP) from Tetrahymena thermophila. Chin. J. Bio. Mol. Biol. 31, 264–273.
Moore W., Zhang C., Clarke P.R. (2002) Targeting of RCC1 to chromosomes is required for proper mitotic spindle assembly in human cells. Curr. Biol. 12, 1442–1447.
Duan W., Xu J., Liang A. (2014) Localization and function of regulator of chromosome condensation 1 from Tetrahymena thermophila. Chin. J. Bio. Mol. Biol. 30, 255–263.
Silverman-Gavrila R.V. (2006) Ran is required before metaphase for spindle assembly and chromosome alignment and after metaphase for chromosome segregation and spindle midbody organization. Mol. Biol. Cell. 17, 2069–2080
Riddick G., Macara I.G. (2005) A systems analysis of importin-{alpha}-{beta} mediated nuclear protein import. J. Cell Biol. 168, 1027–1038.
Arai R., Mabuchi I. (2002) F-actin ring formation and the role of F-actin cables in the fission yeast Schizosaccharomyces pombe. J. Cell Sci. 115, 887–898.
Smith L.G. (2002) Plant cytokinesis: motoring to the finish. Curr. Biol. 12, R206–R208.
Steiner A., Rybak K., Altmann M., McFarlane H.E., Klaeger S., Nguyen N., Facher E., Ivakov A., Wanner G., Kuster B., Persson S., Braun P., Hauser M.T., Assaad F.F. (2016) Cell cycle-regulated PLEIADE/ AtMAP65-3 links membrane and microtubule dynamics during plant cytokinesis. Plant J. 88, 531–541.
Wang H., Oliferenko S., Balasubramanian M.K. (2003) Cytokinesis: relative alignment of the cell division apparatus and the mitotic spindle. Curr. Opin. Cell Biol. 15, 82–87.
Thery M., Bornens M. (2006) Cell shape and cell division. Curr. Opin. Cell Biol. 18, 648–657.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


