Молекулярная биология, 2019, T. 53, № 3, стр. 436-445
Регуляция m6A-метилирования РНК и его эффект на миогенную дифференцировку миобластов мыши
J. N. Chen a, Y. Chen a, Y. Y. Wei a, M. A. Raza b, Q. Zou a, X. Y. Xi a, L. Zhu c, G. Q. Tang c, Y. Z. Jiang a, *, X. W. Li c, **
a Department of Zoology, College of Life Science, Sichuan Agricultural University
625014 Ya’an, Sichuan, China
b Department of Crop Cultivation and Farming System, College of Agronomy, Sichuan Agricultural University
611130 Chengdu, Sichuan, China
c Farm Animal Genetic Resources Exploration and Innovation Key Laboratory of Sichuan Province,
Sichuan Agricultural University
611130 Chengdu, Sichuan, China
* E-mail: jiangyz04@163.com
** E-mail: xuewei.li@sicau.edu.cn
Поступила в редакцию 31.08.2018
После доработки 03.11.2018
Принята к публикации 10.11.2018
Аннотация
N6-метиладенозин (m6A), идентифицированый в качестве консервативной эпитранскриптомной модификации эукариотических мРНК, играет важную роль в регуляции метаболических процессов в клетке. Однако функция m6A в миогенной дифференцировке не установлена. Нами изучено влияние m6A-метилирования РНК на миогенную дифференцировку миобластов мыши in vitro. С этой целью путем сверхэкспрессии гена METTL3 был изменен уровень m6A-метилирования. Уровень m6A-метилирования РНК регулируется также ингибитором метилирования циклолейцином (Cyc) либо бетаином (Bet) – донором метильной группы. Эти реагенты использованы нами для изучения регуляторного эффекта m6A-метилирования РНК на миогенную дифференцировку. Подтверждено, что сверхэкспрессия METTL3 и бетаин увеличивают уровень m6A-метилирования, а циклолейцин снижает его. Увеличение уровня метилирования стимулировало миогенную дифференцировку миобластов мыши. Эти данные могут помочь прояснить механизмы, определяющие связь между метилированием РНК и миогенезом.
N6-метилирование аденозина – самая распространенная внутриклеточная модификация полиаденилированных мРНК у высших эукариот [1]. За последнее время установлено, что m6A-метилирование РНК играет важную роль в регуляции некоторых метаболических процессов в клетке, например, оно участвует в контроле дифференцировки эмбриональных стволовых клеток млекопитающих [2], регулирует плюрипотентность стволовых клеток мыши [3], а также судьбу стволовых клеток у Arabidopsis [4]. На примере эмбриональных фибробластов мыши показано, что метилзависимый процессинг РНК контролирует скорость циркадных часов млекопитающих [5]. Ранее мы построили исчерпывающую карту m6A-метилирования РНК, которая послужила основой для определения потенциальных функций этой модификации в накоплении жировой ткани и росте мышечной ткани [6]. Тем не менее, роль метилирования РНК в процессе миогенной дифференцировки миобластов почти не изучена.
Известно, что m6A-метилирование – это динамическая и обратимая модификация РНК в клетках млекопитающих, которая регулируется метилтрансферазоподобным белком 3 (METTL3) [7, 8]. Инактивация METTL3 приводит к снижению уровня m6A-метилирования примерно на 30% в клетках линии HeLa и на 20% в клетках линии 293FT [9]. Мы воздействовали на уровень m6A-метилирования путем сверхэкспрессии METTL3 и изучали влияние метилирования на миогенную дифференцировку клеток линии C2C12. При изучении эффекта m6A-метилирования на миогенную дифференцировку мы использовали ингибитор метилирования циклолейцин (Cyc) и донор метильной группы бетаин (Bet).
Развитие скелетных мышц – сложный многоступенчатый процесс, включающий дифференцировку миобластов из миогенных клеток-предшественников, их пролиферацию, задержку клеточного цикла и, наконец, слияние миоцитов в многоядерные мышечные волокна [10, 11]. Известно, что процессы миогенеза и дифференцировки миоцитов управляются комплексом факторов транскрипции, в состав которого входят фактор миогенной дифференцировки MyoD и фактор миогенеза 5 (Myf5), участвующие в контроле пролиферации миобластов и ранней дифференцировки. В этот процесс вовлечены миогенин (MyoG) и фактор миогенеза 6 (Myf6), которые инициируют главным образом терминальные стадии дифференцировки [12–14]. Наконец, маркером поздней стадии дифференцировки миобластов считается экспрессия тяжелых цепей миозина, одного из главных компонентов мышечного волокна [15, 16]. Ранее обнаружили, что скелетные мышцы млекопитающих по большей части состоят из волокон трех типов, обозначенных 1, 2А и 2B, и различающихся содержанием тяжелых цепей миозина [17]. Эти волокна входят в состав моторных единиц с разными функциональными характеристиками: волокна типа 1 соответствуют “медленным” моторным единицам, волокна типа 2A входят в состав “быстрых неутомляемых” моторных единиц, а волокна типа 2B – в состав “быстрых утомляемых” моторных единиц [18, 19]. В дальнейшем идентифицирован еще один тип волокон, обозначенный 2X, который содержит специфическую изоформу тяжелых цепей миозина.
В представленной работе мы изменяли уровень m6A-метилирования РНК путем сверхэкспрессии METTL3 и проверяли эффект метилирования на экспрессию маркеров разных стадий дифференцировки в клетках линии C2C12. Кроме того, чтобы отделить эффект модификации РНК от возможного косвенного воздействия METTL3 на миогенную дифференцировку, мы изменяли уровень метилирования при помощи химических агентов – ингибитора метилирования Cyc и донора метильных групп Bet. Таким образом, наша работы посвящена поиску механизмов, посредством которых m6A-метилирование РНК регулирует процессы миогенеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные культуры. Миобласты C2C12 получены из клеточного банка Китайской академии наук (Шанхай, Китай). Клетки линии C2C12 культивировали при 5% CO2 и 37°C в ростовой среде DMEM (Dulbecco’s modified Eagle’s medium, “Gibco”, США) с добавлением 10% эмбриональной телячьей сыворотки (“Gibco”). При достижении 80%-ной плотности клетки снимали с подложки 0.25%-ным раствором трипсина (“Gibco”) и рассевали. Для индукции дифференцировки по достижении плотности клеточной культуры более 80% ростовую среду заменяли дифференцировочной (DMEM с добавлением 2% лошадиной сыворотки (“Gibco”).
Конструирование эукариотической экспрессионной плазмиды и трансфекция клеток. Полноразмерные кДНК гена METTL3 мыши амплифицировали при помощи обратной транскрипции с последующей полимеразной цепной реакцией (ОТ-ПЦР) с использованием праймеров, перечисленных в таблице. Детали сборки генетической конструкции pEGFP/N1-METTL3 подробно описаны в Приложении (см. Приложение на сайте http://www.molecbio.ru/downloads/2019/3/supp_ Chen_rus.pdf). Клетки линии C2C12 рассевали в 6-луночные планшеты, по достижению 80%-ной плотности трансфицировали плазмидами pEGFP/ N1-METTL3 с Lipofectamine™ 3000 (“Invitrogen Life Technologies”, США), следуя рекомендациям производителя. Исходный вектор pEGFP/N1-NC использовали в качестве отрицательного контроля, а “пустым” контролем служили нетрансфицированные клетки (con).
Таблица.
Нуклеотидные последовательности праймеров, использованных в работе
| Ген | Праймер (5' → 3') | Идентификатор | Tm, °C |
|---|---|---|---|
| Фрагмент METTL3 | F:CCCAAGCTATGTCGGACACGTGGAGCTC | NO | 61 |
| R:CGGGATCCCGTAAATTCTTAGGTTTAGAG | NO | 61 | |
| mmu-METTL3 | F:ATGTCGGACACGTGGAGCTC | NM_019721.2 | 54 |
| R:TAAATTCTTAGGTTTAGAG | |||
| mmu-MyHCI | F:GCCTGGGCTTACCTCTCTATCAC | NM_080728.2 | 59 |
| R:CTTCTCAGACTTCCGCAGGAA | |||
| mmu-MyHCIIa | F:CAGCTGCACCTTCTCGTTTG | NM_001039545.2 | 59 |
| R:CCCGAAAACGGCCATCT | |||
| mmu-MyHCIIx | F:GGACCCACGGTCGAAGTTG | NM_030679.1 | 59 |
| R:CCCGAAAACGGCCATCT | |||
| mmu-MyHCIIb | F:CAATCAGGAACCTTCGGAACAC | NM_010855.3 | 59 |
| R:GTCCTGGCCTCTGAGAGCAT | |||
| mmu-MyoG | F:GCCCAGTGAATGCAACTCCCACA | NM_031189.2 | 59 |
| R:CAGCCGCGAGCAAATGATCTCCT | |||
| mmu-MyoD | F:AGACTTCTATGATGACCCGTGTT | NM_010866.2 | 61.4 |
| R:TCAGCGTTGGTGGTCTTGC | |||
| mmu-Myf5 | F:CTGTCTGGTCCCGAAAGAAC | XM_006513319.2 | 59 |
| R:AAGCAATCCAAGCTGGACAC | |||
| mmu-Myf6 | F:AATTCTTGAGGGTGCGGATT | XM_006513320.1 | 59 |
| R:ATGGAAGAAAGGCGCTGAAG | |||
| ACTB | F:CATCCGTAAAGACCTCTATGCCAAC | NM_007393.5 | 60 |
| R : ATGGAGCCACCGATCCACA |
Обработка клеток циклолейцином (Cyc) и бетаином (Bet). Миобласты C2C12 дифференцировались в течение 4 дней, после чего их инкубировали в течение 24 ч в присутствии Cyc в концентрации 1, 5 и 10 мМ, либо Bet (0, 0.1, 0.15 и 0.2 M). Оптимальные концентрации Cyc и Bet определяли по уровню метилирования РНК в присутствии разных концентраций этих веществ и использовали в дальнейших экспериментах.
Измерение суммарного уровня m6A-метилирования РНК. Суммарный уровень m6A в РНК мы определяли в клетках линии C2C12. Содержание метилированного аденозина определяли в 200 нг суммарной РНК при помощи коммерческого набора, основанного на колориметрическом измерении, в соответствии с рекомендациями производителя (кат. номер P-9005; “Epigentek”, США).
Выделение РНК, синтез кДНК и ПЦР в реальном времени. Суммарную РНК выделяли с использованием коммерческого набора TaKaRa MiniBEST Universal RNA Extraction Kit (“TaKaRa Biotech Co. Ltd.”, КНР) согласно [20]. Примерно 500 нг суммарной РНК использовали в реакции обратной транскрипции для синтеза кДНК при помощи набора от TaKaRa (“TaKaRa Biotech Co. Ltd.”).
Уровень мРНК определяли с использованием количественной ПЦР в реальном времени (ПЦР-РВ). Реакционная смесь объемом 10 мкл содержала 5 мкл смеси SYBR Green Real Time PCR Master Mix (“Takara Biotech Co. Ltd.”), 30 нг кДНК-матрицы и 0.4 мкл пар праймеров с концентрацией 10 мкМ. Специфичность продуктов ПЦР подтверждали анализом кривых плавления. Количество мРНК β-актина использовали для нормирования уровней мРНК исследуемых генов. Последовательности праймеров подбирали, используя программное обеспечение Primer premier software v5.0 (“Premier Biosoft International”, США), синтез праймеров заказывали в “BGI Company” (Китай). Эффективность реакции с каждой парой праймеров рассчитывали при помощи двукратных серийных разведений кДНК. Последовательности использованных праймеров приведены в табл. 1.
Статистический анализ. Уровни мРНК нормировали относительно уровня мРНК гена β-актина по формуле Ct (2−ΔΔCt) [21]. Все данные представлены в виде среднего значения ± стандартная ошибка среднего. Статистический анализ ANOVA проводили при помощи программного обеспечения SPSS 20.0 software (“SPSS Inc.”, США). р < 0.05 принимали в качестве значимого.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эндогенный уровень m6A-метилирования РНК возрастает в процессе миогенной дифференцировки миобластов C2C12
На начальном этапе изучения связи между m6A-метилированием РНК и миогенной дифференцировкой мы определили профиль эндогенного m6A-метилирования в процессе дифференцировки клеток линии C2C12, а именно, во время двух переходных стадий от миобластов к многоядерным мышечным трубочкам. Условия культивирования клеток описаны в Экспериментальной части. С момента достижения нужной плотности (день 0), миобласты C2C12 дифференцировались в удлиненные скелетные мышечные трубки (2–8 дни культивирования, рис. S1 , см. Приложение http://www.molecbio.ru/downloads/2019/3/ supp_Chen_engl.pdf).). Уровень m6A-метилирования РНК значительно возрастал в промежутке между точкой отсчета и днем 2, затем снижался и на 4-й день был ниже, чем на 2-й (рис. 1). Это означает, что данная модификация может играть значимую роль в регуляции дифференцировки миобластов.
Сверхэкспрессия METTL3 приводит к увеличению уровня m6A-метилирования РНК в миобластах мыши и стимулирует миогенную дифференцировку
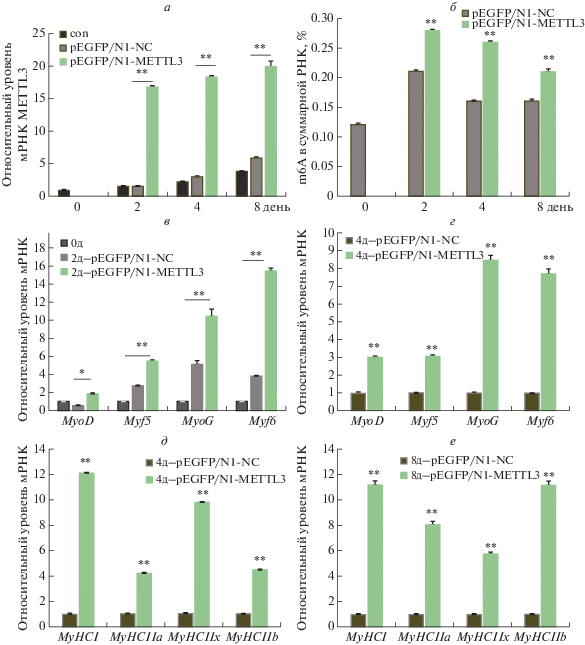
Чтобы исследовать эффект m6A-метилирования РНК на миогенную дифференцировку клеток линии C2C12, мы увеличили степень метилирования путем сверхэкспрессии METTL3. С этой целью миобласты трансфицировали плазмидой pEGFP/N1-METTL3 либо контрольным вектором pEGFP/N1-NC. Контролем успешной трансфекции служило появление флуоресцирующих клеток (рис. S1 ). Присутствие плазмиды pEGFP/N1-METTL3 привело к значительному увеличению экспрессии гена METTL3 в клетках C2C12 на 2-, 4- и 8-й день дифференцировки (p < 0.01, рис. 2а). Сверхэкспрессия METTL3 в миобластах, в свою очередь, привела к значительному увеличению уровня m6A-метилирования РНК (рис. 2б), что указывает на положительную регуляцию модификации данного типа белком METTL3. В предыдущих исследованиях установлено, что факторы MyoD и Myf5 являются маркерами ранней стадии миогенной дифференцировки, в то время как MyoG, Mrf4 (Myf6) и MyHC считаются маркерами поздней стадии [15, 22]. В данной работе нами оценена экспрессия генов, ассоциированных с миогенной дифференцировкой. Установлено, что экспрессия MyoD, Myf5, MyoG и Myf6 значимо возрастает в процессе дифференцировки миобластов на 2- и 4-й день (рис. 2в, г). Кроме того, мы проверили экспрессию генов, ассоциированных с различными типами мышечного волокна (MyHCI, MyHCIIa, MyHCIIb и MyHCIIx), на промежуточной (4-й день) и поздней (8-й день) фазах дифференцировки. Обнаружено, что уровни мРНК генов, ассоциированных с волокнами типа I и II, значимо увеличились (р < 0.05, рис. 2д, е). Эти результаты позволяют предположить, что увеличение уровня m6A-метилирования РНК путем сверхэкспрессии METTL3 стимулирует миогенную дифференцировку и формирование мышечных волокон.
Рис. 2.
Влияние сверхэкспрессии METTL3 на m6A-метилирование РНК и миогенную дифференцировку. а –Трансфекция миобластов плазмидой pEGFP/N1-METTL3 приводит к значительному увеличению экспрессии METTL3 на 2-, 4- и 8-й дни (p < 0.01). б – Сверхэкспрессия METTL3 в миобластах мыши приводит к значимому увеличению уровня m6A-метилирования РНК. в, г – Сверхэкспрессия METTL3 приводит к значимому увеличению относительных уровней мРНК генов MyoD, Myf5, MyoG и Myf6 (р < 0.05) по ходу дифференцировки миобластов на 2- и 4-й дни. д, е – Сверхэкспрессия METTL3 приводит к увеличению относительных уровней мРНК генов, ассоциированных с развитием мышечных волокон типа I и II.
Экзогенная регуляция m6A-метилирования РНК и ее влияние на миогенную дифференцировку
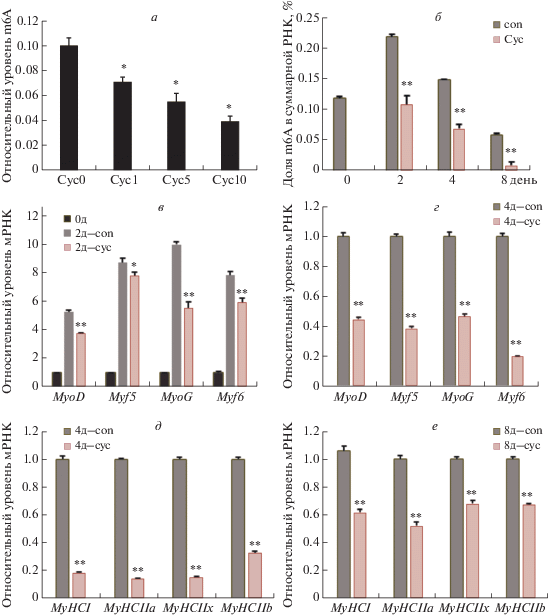
Чтобы подтвердить регуляторный эффект m6A-метилирования РНК в миобластах, мы обработали миобласты мыши ингибитором метилирования Cyc либо донором метильной группы Bet. In vitro Cyc действует как конкурентный ингибитор АТР: L-метионин-S-аденозилтрансферазы, которая участвует в синтезе S-аденозилметионина – внутриклеточного донора метильной группы [23]. В нашей работе обработка миобластов мыши Cyc в различных концентрациях приводила к значимому и дозозависимому снижению уровня m6A-метилирования РНК (p < 0.05, рис. 3а). Обработка клеток 1, 5 или 10 мМ Cyc снижала уровень метилирования на 19, 27 и 40% (p < 0.05), соответственно, по сравнению с контролем (рис. 3а). В эксперименте с дифференцирующимися клетками C2C12 мы измеряли уровень метилирования на 2-, 4- и 8-й дни в присутствии Cyc в концентрации 10 мМ (рис. 3б). Показано, что 10 мМ Сус приводит к значительному снижению уровня m6A-метилирования на всех стадиях дифференцировки (p < 0.05, рис. 3б). Эту концентрацию ингибитора (Cyc10) мы использовали в дальнейшем для определения экспрессии генов, ассоциированных с миогенной дифференцировкой. Показано, что на 2-й и 4-й день дифференцировки миобластов относительный уровень мРНК генов MyoD, MyoG и Myf6 значительно снизился по сравнению с контролем (p <0.01, рис. 3в, г), как и экспрессия гена Myf5 (p <0.05, рис. 3в, г). Кроме того, экспрессия генов MyHCI, MyHCIIa, MyHCIIb и MyHCIIx, ассоциированных с различными типами мышечных волокон, также снизилась на промежуточной (день 4) и поздней (день 8) стадии дифференцировки (p < 0.05, рис. 3д, е).
Рис. 3.
Влияние обработки миобластов экзогенным ингибитором метилирования циклолейцином (Cyc) на уровень m6A-метилирования РНК и миогенную дифференцировку. а – Обработка миобластов мыши разными концентрациями Cyc приводит к дозозависимому снижению уровня m6A-метилирования РНК (p < 0.05). б – Обработка клеток C2C12 10 мМ Cyc приводит к снижению уровня m6A-метилирования РНК на всех стадиях дифференцировки. в, г – Обработка клеток 10 мМ Cyc приводит к снижению экспрессии генов MyoD и MyoG (p < 0.05). д, е – Обработка клеток 10 мМ Cyc приводит к снижению экспрессии генов MyHCI, MyHCIIa, MyHCIIb и MyHCIIx (p < 0.05).
Уровень m6A-метилирования РНК также изменяется под действием различных концентраций Bet. Мы обрабатывали миобласты мыши 0.1, 0.15 или 0.2 M Bet и измеряли уровень метилирования после инкубации в течение 24 ч. Показано, что Bet дозозависимым образом увеличивает уровень m6A-метилирования РНК (рис. 4а). Чтобы определить оптимальную концентрацию Bet и подтвердить отсутствие негативного влияния высоких концентраций на рост клеток, миобласты обрабатывали Bet в указанных концентрациях и анализировали клетки под микроскопом. Обнаружено, что в концентрации 0.15 и 0.2 M Bet не оказывает значимого влияния на клеточный рост. В то же время, 0.2 M Bet вызывает значительное увеличение уровня m6A-метилирования РНК на всех стадиях миогенной дифференцировки (рис. 4б), и эту концентрацию мы применяли в дальнейших экспериментах. Показано, что относительный уровень мРНК гена Myf5 значительно вырос по сравнению с контролем (p < 0.05) (рис. 4в) на ранней стадии дифференцировки (день 2), а экспрессия генов MyoG и Myf6 увеличилась на промежуточной стадии (день 4) (p < 0.05) (рис. 4г). Кроме того, уровни мРНК генов MyHCI, MyHCIIa, MyHCIIx и MyHCIIb, ассоциированных с различными типами мышечных волокон, также заметно увеличились (p < 0.05) (рис. 4д, е).
Рис. 4.
Влияние обработки миобластов донором метильной группы бетаином на уровень m6A-метилирования РНК. а – Обработка бетаином приводит к дозозависимому увеличению уровня метилирования. б – Бетаин в концентрации 0.2 M значимо увеличивает уровень метилирования РНК на всех стадиях дифференцировки миобластов мыши (p < 0.01). в, г – Обработка Bet приводит к увеличению экспрессии гена Myf5 (p < 0.05) на ранней стадии дифференцировки (день 2), и увеличению экспрессии генов MyoG и Myf6 в промежуточную фазу (день 4) (p < 0.05). д, е – Обработка Bet приводит к увеличению экспрессии генов MyHCI, MyHCIIa, MyHCIIx, MyHCIIb, ассоциированных с различными типами мышечных волокон (p < 0.05).

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
m6A-метилирование, представляющее собой важную модификацию РНК у всех эукариотических организмов, начиная от дрожжей, растений и насекомых, заканчивая млекопитающими, встречается даже в вирусных РНК в ядерной фазе инфекции. Тем не менее, конкретные биологические функции этой модификации до сих пор не определены. Они могут касаться процессов транскрипции, процессинга РНК, транспорта, трансляции, деградации, клеточной дифференцировки и деления [24, 25]. Динамические изменения уровня метилирования в клетках млекопитающих могут быть связаны с изменением экспрессии генов и даже программы дифференцировки за счет регуляции клеточных сигнальных путей, в которых участвуют молекулы РНК. Показано, что в эмбриональных стволовых клетках m6A может влиять на метаболизм мРНК. m6A участвует в поддержании способности популяции клеток к восстановлению и служит маркером уровня транскрипции, необходимого для разворачивания программы дифференцировки эмбриональных клеток [26]. По этой причине мы предположили, что m6A-метилирование может играть важную роль в процессе миогенной дифференцировки. Нами показано, что m6A участвует в регуляции миогенной дифференцировки путем прямого воздействия на экспрессию соответствующих генов. Высокий уровень m6A-метилирования ускоряет дифференцировку миобластов, в то время как низкий уровень метилирования замедляет темп миогенеза.
METTL3 представляет собой субъединицу мультикомпонентного m6A-метилтрансферазного комплекса [9]. Установлено, что нокдаун гена METTL3 приводит к снижению уровня m6A-метилирования РНК в клетках линий HeLa и 293FT [8]. Кроме того, нами показано, что сверхэкспрессия METTL3 в значительной степени увеличивает уровень m6A-метилирования РНК. Таким образом N6-аденозин-метилтрансфераза METTL3 вовлечена в регуляцию m6A-метилирования РНК. Количество метилированной РНК увеличивалось после in vitro инкубации РНК с белком METTL3, очищенным из клеток линии HEK293 [27]. Показано также, что дефицит METTL3 приводит к пролиферации популяции эмбриональных стволовых клеток мыши [28], в то время как в клетках линии HeLa нокдаун гена METTL3 запускает процесс апоптоза [29]. По этим причинам мы предположили, что роль METTL3 в регуляции жизнеспособности клеток должна зависеть от типа клеток. Показано, что METTL3 локализуется в ядерных гранулах, обогащенных факторами процессинга мРНК, что позволяет предположить участие этого белка в сплайсинге [30]. Результаты нашей работы свидетельствуют о том, что сверхэкспрессия METTL3 стимулирует миогенную дифференцировку и увеличивает относительные уровни мРНК генов-маркеров мышечных волокон разного типа. Возможно, эти эффекты объясняются влиянием METTL3 на сплайсинг РНК. Тем не менее, молекулярный механизм воздействия сверхэкспрессии METTL3 на миогенную дифференцировку еще предстоит выяснить.
Кроме этого, для установления связи между m6A-метилированием и миогенной дифференцировкой миобластов мыши мы использовали вещества, влияющие на метилирование. Cyc – ингибитор метионин-аденозилтрансферазы [31] – снижал внутриклеточную концентрацию S-аденозилметионина, влияя таким образом на уровень метилирования нуклеиновых кислот. В другой работе показано, что Cyс снижает уровень m6A-метилирования РНК дозозависимым образом. Нами установлено, что обработка клеток Cyc привела к снижению уровня m6A-метилирования РНК. Bet – производное глицина, содержащее три метильных группы, играет две основные физиологические роли: (1) действует как осмопротектор, который накапливается в тканях для регуляции объема клетки и поддержания ее целостности в условиях гиперосмолярного стресса; (2) является донором метильной группы, который участвует в цикле метионин-гомоцистеин [32, 33]. Превращение гомоцистеина в метионин необходимо для поддержания постоянного внутриклеточного уровня метионина, нейтрализации токсичного гомоцистеина и синтеза универсального метильного донора S-аденозилметионина [34]. За последнее время установлено, что Bet может дозозависимо изменять уровень m6A-метилирования РНК. Например, обнаружено, что Bet снижает количество подкожного жира у свиней, и этот эффект обусловлен, по-видимому, изменением уровня m6A [35]. Кроме того, Bet стимулирует дифференцировку мышечного волокна и увеличивает размер мышечных трубок путем активации IGF-1-зависимого пути, что позволяет рассматривать это вещество как новое лекарственное средство, эффективное как в спортивной, так и в клинической практике, связанной с дисфункцией мышц [36]. Нами показано, что Bet в концентрации 0.2 M увеличивает уровень m6A-метилирования, что, в свою очередь, стимулирует миогенез и миогенную дифференцировку.
Можно заключить, что m6A-метилирование РНК – это динамическая модификация, представленность которой можно регулировать при помощи метилтрансферазы METTL3 и химических веществ.
Это исследование поддержано National Key R&D Program of China (2018YFD0501204), Key Program of National Science Foundation of China (грант № 31530073) и Chengdu Local Good Varieties of Livestock and Poultry Resources Protection and Exploitation and Utilization of Construction Projects.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Grosjean H. (2005) Modification and editing of RNA: historical overview and important facts to remember. In: Fine-Tuning of RNA Functions by Modification and Editing. Topics in Current Genetics. Berlin-Heidelberg: Springer Verlag, 12, 1–22.
Batista P.J., Molinie B., Wang J. (2014) m6A RNA modification controls cell fate transition in mammalian embryonic stem cells. Cell Stem Cell. 15, 707–719.
Zhao B.S., He C. (2015) Fate by RNA methylation: m6A steers stem cell pluripotency. Genome Biol. 16, 1–3.
Shen L., Liang Z., Gu X., Chen Y., Teo Z.W., Hou X., Cai W.M., Dedon P.C., Liu L., Yu H. (2016) N6-methyladenosine RNA modification regulates shoot stem cell fate in Arabidopsis. Developmental Cell. 38, 186–200.
Fustin J.M., Doi M., Yamaguchi Y., Hida H., Nishimura S., Yoshida M., Isagawa T., Morioka M.S., Kakeya H., Manabe I. (2013) RNA-methylation-dependent RNA processing controls the speed of the circadian clock. Cell. 155, 793–806.
Tao X., Chen J., Jiang Y. (2017) Transcriptome-wide N6-methyladenosine methylome profiling of porcine muscle and adipose tissues reveals a potential mechanism for transcriptional regulation and differential methylation pattern. BMC Genomics. 18, 336.
Bokar J.A., Rathshambaugh M.E., Ludwiczak R., Narayan P., Rottman F. (1994) Characterization and partial purification of mRNA N6-adenosine methyltransferase from HeLa cell nuclei. Internal mRNA methylation requires a multisubunit complex. J Biol. Chem. 269, 17697–17704.
Bokar J.A., Shambaugh M.E., Polayes D., Matera A.G., Rottman FM. (1997) Purification and cDNA cloning of the AdoMet-binding subunit of the human mRNA (N6-adenosine)-methyltransferase. RNA. 3, 1233–1247.
Liu J., Yue Y., Han D., Wang X., Fu Y., Zhang L. (2014) A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation. Nat. Chem. Biol. 10, 93–95.
Kuang S., Kuroda K., Grand F.L. (2007) Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell. 129, 999.
Tapscott S.J. (2005) The circuitry of a master switch: MyoD and the regulation of skeletal muscle gene transcription. Development. 132, 2685.
Haldar M., Karan G., Tvrdik P., Capecchi M.R. (2008) Two cell lineages, Myf5 and Myf5-independent, participate in mouse skeletal myogenesis. Develop. Cell. 14, 437–445.
Singh K., Dilworth F.J. (2013) Differential modulation of cell cycle progression distinguishes members of the myogenic regulatory factor family of transcription factors. FEBS J. 280, 3991–4003.
Sabourin L.A., Rudnicki M.A. (2000) The molecular regulation of myogenesis. Clin. Genet. 57, 16.
Tidyman W.E., Moore L.A., Bandman E. (1997) Expression of fast myosin heavy chain transcripts in developing and dystrophic chicken skeletal muscle. Develop. Dynamics. 208, 491.
Sant'ana Pereira J.A., Wessels A., Nijtmans L. (1995) New method for the accurate characterization of single human skeletal muscle fibres demonstrates a relation between mATPase and MyHC expression in pure and hybrid fibre types. J. Muscle Res. Cell Motility. 16, 21.
Brooke M.H., Kaiser K.K. (1970) Muscle fiber types: how many and what kind? Archives Neurol. 23, 369–379.
Edström L., Kugelberg E. (1968) Histochemical composition, distribution of fibres and fatiguability of single motor units. Anterior tibial muscle of the rat. J. Neurol. Neurosurg. Psychiatry. 31, 424–433.
Burke R.E., Levine D.N., Tsairis P. (1973) Physiological types and histochemical profiles in motor units of the cat gastrocnemius. J. Physiol. 234, 723–748.
Xu H., Tao X., Wei Y., Chen J., Xing S. (2015) Cloning of porcine GPIHBP1 gene, its tissue expression pattern and genetic effect on adipose traits. Gene. 557, 146–153.
Kenneth J., Livak T.D. (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCt method. Methods. 25, 402–408.
Sabourin L.A., Rudnicki M.A. (2010) The molecular regulation of myogenesis. Clin. Genet. 57, 16–25.
Lombardini J.B., Talalay P. (1973) Effect of inhibitors of adenosine triphosphate: L-methionine S-adenosyltransferase on levels of S-adenosyl-L-methionine and L-methionine in normal and malignant mammalian tissues. Mol. Pharmacol. 9, 542–560.
Niu Y., Zhao X., Wu Y.S., Li M.M., Wang X.J., Yang Y.G. (2012) N6-methyl-adenosine (m6 A) in RNA: an old modification with a novel epigenetic function. Genomics, Proteomics Bioinformatics. 11, 8–17.
Chen T., Hao Y.J., Zhang Y., Li M.M., Wang M., Han W. (2015) m6A RNA methylation is regulated by microRNAs and promotes reprogramming to pluripotency. Cell Stem Cell. 16, 289–301.
Batista P.J., Molinie B., Wang J., Qu K., Zhang J., Li L. (2014) m6A RNA modification controls cell fate transition in mammalian embryonic stem cells. Cell Stem Cell. 15, 707–719.
Wang Y., Li Y., Toth J.I., Petroski M.D. (2014) N6-methyladenosine modification destabilizes developmental regulators in embryonic stem cells. Nat. Cell Biol. 16, 191–198.
Batista P.J., Molinie B., Wang J., Qu K., Zhang J., Li L. (2014) m6A RNA modification controls cell fate transition in mammalian embryonic stem cells. Cell Stem Cell. 15, 707–719.
Bokar J.A. (2005) The biosynthesis and functional roles of methylated nucleosides in eukaryotic mRNA. In: Fine-Tuning of RNA Functions by Modification and Editing. Topics in Current Genetics. Berlin-Heidelberg: Springer Verlag, 12, 141–177.
Bokar J.A., Shambaugh M.E., Polayes D., Matera A.G., Rottman F.M. (1997) Purification and cDNA cloning of the AdoMet-binding subunit of the human mRNA (N6-adenosine)-methyltransferase. RNA. 3, 1233.
Lin D.W., Chung B.P., Kaiser P. (2014) S-adenosylmethionine limitation induces p38 mitogen-activated protein kinase and triggers cell cycle arrest in G1. J. Cell Sci. 127, 50–59.
Zhang F., Warskulat U., Wettstein M., Häussinger D. (1996) Identification of betaine as an osmolyte in rat liver macrophages (Kupffer cells). Gastroenterology. 110, 1543–1552.
Natalello A., Liu J., Ami D., Doglia S.M., De M.A. (2009) The osmolyte betaine promotes protein misfolding and disruption of protein aggregates. Proteins Structure Function Bioinformatics. 75, 509–517.
Allison S.P. (1987) Annual review of nutrition. Postgraduate Med. J. 63, 513.
Wang X., Zhu L., Chen J., Wang Y. (2015) mRNA m6A-methylation downregulates adipogenesis in porcine adipocytes. Biochem. Biophys. Res. Commun. 459, 201–207.
Senesi P., Luzi L., Montesano A., Mazzocchi N., Terruzzi I. (2013) Betaine supplement enhances skeletal muscle differentiation in murine myoblasts via IGF-1 signaling activation. J. Translat. Med. 11, 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология



