Молекулярная биология, 2019, T. 53, № 3, стр. 467-475
Применение импедансной спектроскопии и транскриптомного анализа для мониторинга роста клеток хориокарциномы человека BeWo b30
С. В. Никулин a, b, *, Е. Н. Князев a, Т. Н. Герасименко a, С. А. Шилин a, И. Н. Газизов a, Г. С. Захарова a, А. А. Полозников c, Д. А. Сахаров a
a ООО НТЦ “БиоКлиникум”
115088 Москва, Россия
b Московский физико-технический институт (Государственный университет)
141701 Московская обл., Долгопрудный, Россия
c Национальный медицинский исследовательский центр радиологии
Министерства здравоохранения Российской Федерации
249036 Калужская обл, Обнинск, Россия
* E-mail: s.nikulin@bioclinicum.com
Поступила в редакцию 29.08.2018
После доработки 11.12.2018
Принята к публикации 11.12.2018
Аннотация
Плацента – высокоспециализированный орган, играющий ключевую роль во время беременности. На сегодняшний день существует несколько различных моделей плацентарного барьера, используемых для изучения транспорта ксенобиотиков и других механизмов функционирования плаценты. Клетки хориокарциномы человека BeWo широко используются для создания in vitro моделей плацентарного барьера человека. Однако эти клетки не подвержены действию контактного ингибирования и способны образовывать многослойные структуры, которые в норме не встречаются в человеческой плаценте. Цель данной работы – поиск различных маркеров, позволяющих следить за ростом клеток BeWo b30 на мембранной подложке, для чего впервые применена импедансная спектроскопия. Проведенные теоретические расчеты и полученные экспериментальные данные свидетельствуют в пользу того, что электрические параметры клеток, измеренные методом импедансной спектроскопии, позволяют оценивать число клеточных слоев. По результатам транскриптомного анализа обнаружено значимое повышение экспрессии генов металлотионеинов (особенно MT1B, MT1F и MT2A) и синцитинов (ERVW-1 и ERVFRD-1) в зрелых клетках BeWo b30.
ВВЕДЕНИЕ
Плацента – высокоспециализированный орган, играющий ключевую роль при беременности. Основные функции плаценты заключаются в обмене различными соединениями между плодом и матерью (включая кислород, питательные вещества и продукты метаболизма) и в защите плода от токсинов и инфекционных агентов любой природы [1]. На сегодняшний день известно несколько различных модельных систем для изучения функционирования плаценты в норме и при патологии [2]. К наиболее популярным относятся эксперименты in vivo на животных. К плюсам этой модели можно отнести широкую доступность и наличие полноценного клеточного микроокружения. Однако результаты, полученные на животных, часто не могут быть перенесены на человека из-за существенных различий в строении плаценты [3]. Еще одна модель – эксперименты ex vivo по перфузии человеческой плаценты. Несмотря на высокую релевантность результатов, полученных на этих моделях, существует ряд недостатков, связанных с их использованием. В частности, это низкая доступность материала, невозможность детально изучить некоторые аспекты функционирования на целом органе и низкая воспроизводимость результатов [2].
Альтернативой упомянутым выше методам служат модели in vitro на основе клеточных линий, полученных от человека. Использование этой модели позволяет детально изучать влияние различных факторов микроокружения на функционирование плацентарного барьера, а при работе со стандартизированными клеточными линиями воспроизводимость результатов существенно повышается. На сегодняшний день уже разработан ряд in vitro моделей плаценты, в основе которых лежат как классические системы культивирования, так и микрофлюидные устройства [2, 4–6].
Клетки хориокарциномы человека BeWo широко используют для создания in vitro моделей человеческого плацентарного барьера [6]. Известно, что эти клетки не подвержены действию контактного ингибирования (то есть сохраняют подвижность и способность к делению при контакте с другими клетками [7]) и могут образовывать многослойные структуры в процессе роста [6, 8]; при этом клетки верхних слоев также образуют плотные контакты (но в меньшем количестве) с соседними клетками [6]. Известно, что плацента человека только на ранних этапах развития состоит из нескольких слоев клеток трофобласта, а, начиная с третьего триместра, в ней присутствует только один слой трофобластов [9]. Число слоев клеток трофобласта существенно влияет на свойства плацентарного барьера [8–10], поэтому в экспериментах по изучению транспорта различных соединений через плацентарный барьер необходимо контролировать число слоев клеток.
Целью данной работы был поиск маркеров различной природы, позволяющих следить за ходом роста клеток BeWo b30 и контролировать число клеточных слоев. Наличие генов, экспрессия которых существенно меняется при образовании многослойной структуры, позволит в перспективе создать репортерные конструкции для мониторинга состояния клеток оптическими методами [11, 12]. Для поиска генов-кандидатов, которые могут быть использованы при создании таких репортерных систем, использован высокопроизводительный транскриптомный анализ на микрочипах. Также изучена возможность применения импедансной спектроскопии для измерения различных электрических параметров клеток BeWo, растущих на пористой подложке. Импедансная спектроскопия позволяет измерять не только трансэпителиальное/трансэндотелиальное сопротивление (TEER), но и ряд дополнительных электрических параметров, таких как электрическая емкость и добавочное сопротивление (включает как сопротивление измерительных электродов, культуральной среды, мембранной подложки, так и сопротивление базальной мембраны) [13–15]. Импедансная спектроскопия – метод, не требующий использования меток и позволяющий проводить прижизненные измерения в режиме реального времени с высоким временным разрешением [13]. В результате проведенного исследования выявлена связь некоторых электрических параметров клеток с числом клеточных слоев и обосновано применение импедансной спектроскопии для контроля качества in vitro моделей плацентарного барьера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование клеток BeWo b30. После разморозки клетки линии BeWo b30 рассеивали в культуральные флаконы с площадью поверхности 25 см2 в 5 мл полной питательной среды. Полная питательная среда состояла из базовой среды DMEM без пирувата натрия, содержащей 4.5 г/л глюкозы, 2 мМ L-глутамина и 10% фетальной сыворотки крупного рогатого скота, 1% раствора заменимых аминокислот (“Gibco”, США), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина (все препараты фирмы “Gibco”). Флаконы помещали в клеточный инкубатор (5% СО2, 37°С). Пересев производили каждые 2–3 суток. Подробная процедура культивирования описана ранее [5].
Для проведения экспериментов клетки BeWo b30 рассевали в 96-луночный планшет, содержащий мембранные вставки Transwell с диаметром пор 1 мкм (“Corning”), все лунки которого предварительно были заполнены полной питательной средой (50 мкл в верхнюю камеру, 235 мкл в нижнюю камеру). Планшет помещали в клеточный инкубатор (5% СО2, 37°С) на 1 ч. Клетки BeWo b30 открепляли от подложки, используя 0.25%-ный раствор трипсина–EDTA с солями Хенкса (“ПанЭко”, Россия), ресуспендировали в питательной среде и подсчитывали при помощи автоматического счетчика клеток Countess (“Invitrogen”, США). В каждую мембранную вставку добавляли по 50 мкл клеточной суспензии с концентрацией клеток 600 000 клеток/мл (30 000 клеток в лунку, около 210 000 клеток/см2). Далее в течение всего эксперимента инкубировали мембранные вставки в клеточном инкубаторе (5% СО2, 37°С). Смену среды производили каждые 24 ч.
Измерение импедансных спектров и обработка полученных результатов. Измерение импедансных спектров проводили в диапазоне частот от 20 Гц до 20 кГц при помощи системы импедансной спектрометрии (НТЦ “БиоКлиникум”, Россия) и электрода STX100C96 (“World Precision Instruments”, США) при комнатной температуре. Для получения средних значений электрических параметров использовали, по крайней мере, 4 независимые мембранные вставки с клетками. Обработку полученных данных проводили при помощи языка программирования Python 2.7 (http:// www.python.org).
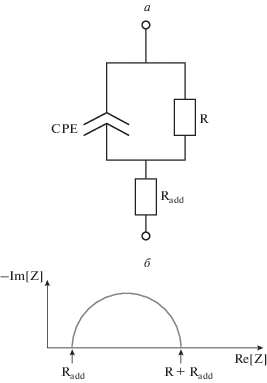
Для расчета основных электрических параметров клеточного монослоя (сопротивления R, электрической емкости C, добавочного сопротивления Radd) использовали упрощенную эквивалентную схему (рис. 1) [14, 16]. Значения R, Radd и C были рассчитаны при помощи нелинейной аппроксимации зависимости импеданса от частоты. Статистическую значимость отличий проверяли при помощи t-критерия Стьюдента с пороговым уровнем значимости 0.05. Планки погрешностей на графиках показывают стандартное отклонение.
Рис. 1.
Расчет основных электрических параметров клеточного монослоя. а – Упрощенная эквивалентная электрическая схема, использованная для вычисления основных электрических параметров (CPE – элемент постоянной фазы, отражает наличие электрической емкости у клеток; R – активное сопротивление возникающее за счет наличия клеточного сопротивления и сопротивления межклеточных контактов; вносит основной вклад в TEER; Radd – добавочное сопротивление, возникающее за счет наличия сопротивления мембраной подложки, сопротивления питательной среды, сопротивления слоя внеклеточного матрикса между мембраной и первым слоем клеток, а также за счет наличия сопротивления между слоями клеток). б – Годограф импеданса (Im[Z]), соответствующий упрощенной эквивалентной схеме.
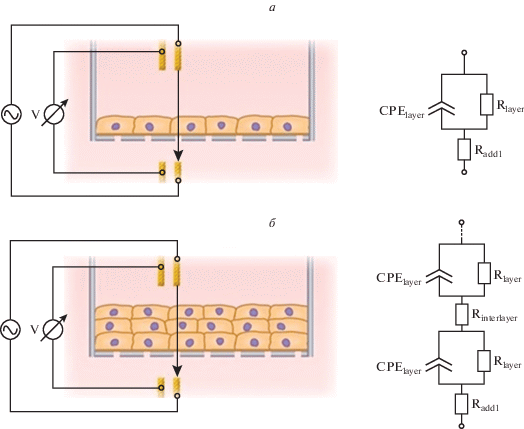
Оценка влияния роста клеток в несколько слоев на импеданс. На рис. 2 представлены эквивалентные электрические схемы для монослоя клеток и клеток, растущих в несколько слоев (в предположении, что все слои одинаковы). На основании представленных эквивалентных схем можно вычислить результирующий импеданс клеток:
(1)
${\text{Z}} = {{{\text{R}}}_{{{\text{add1}}}}} + (N - 1){{{\text{R}}}_{{{\text{interlayer}}}}} + N\frac{{{\text{R}}{{{\text{Z}}}_{{{\text{CPE}}}}}}}{{{\text{R}} + {{{\text{Z}}}_{{{\text{CPE}}}}}}},$(2)
${{{\text{Z}}}_{{{\text{CPE}}}}} = \frac{1}{{{\text{A}}{{\omega }^{\alpha }}}}\left( {\cos \frac{{\pi \alpha }}{2} - j \cdot \sin \frac{{\pi \alpha }}{2}} \right),$(3)
${\text{C}} = {{{\text{R}}}^{{\frac{{1 - \alpha }}{\alpha }}}}{{{\text{A}}}^{{\frac{1}{\alpha }}}}.$Рис. 2.
Эквивалентные схемы. а – Полная эквивалентная электрическая схема для монослоя клеток. б – Полная эквивалентная электрическая схема для случая многослойной структуры (в предположении, что все слои одинаковые); (CPElayer – элемент постоянной фазы для одного слоя клеток; Rlayer – активное сопротивление одного слоя клеток; Radd1 – добавочное сопротивление для монослоя клеток, Rinterlayer – сопротивление межклеточной прослойки).
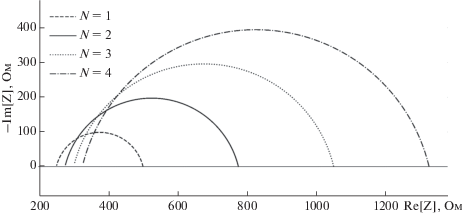
На основании анализа полученного выражения для полного импеданса можно сделать вывод, что в данном случае годограф (рис. 1б) будет представлять собой полуокружность с центром в точке:
(4)
$\begin{gathered} \operatorname{Re} {{[{\text{Z}}]}_{0}} = {{{\text{R}}}_{{{\text{add1}}}}} + (N - 1){{{\text{R}}}_{{{\text{interlayer}}}}} + \frac{N}{2}{{{\text{R}}}_{{{\text{layer}}}}}, \\ \operatorname{Im} {{[{\text{Z}}]}_{0}} = \frac{N}{2}{{{\text{R}}}_{{{\text{layer}}}}}{\text{ctg}}\frac{{\pi \alpha }}{2}. \\ \end{gathered} $то есть, при росте числа слоев клеток N центр полуокружности годографа импеданса будет на графике смещаться вправо и вниз (рис. 1б), при этом эффективная измеряемая величина добавочного сопротивления Radd будет линейно расти с ростом N. Учитывая, что на практике α всегда меньше 1, центр полуокружности лежит ниже оси абсцисс. Радиус полуокружности ρ (а, следовательно, и величина измеряемого сопротивления R) будет прямо пропорционально увеличиваться с ростом числа N:
(5)
$\rho = \frac{N}{2}{{{\text{R}}}_{{{\text{layer}}}}}\sqrt {{{{\left( {{\text{ctg}}\frac{{\pi \alpha }}{2}} \right)}}^{2}} + 1} .$Принимая во внимание все вышесказанное, можно сделать вывод, что при образовании многослойной структуры одновременно происходят 3 события (рис. 3): 1) заметный рост измеряемого сопротивления R, 2) рост измеряемого сопротивления Radd и 3) снижение ординаты центра полуокружности годографа импеданса.
Транскриптомный анализ. Для транскриптомного анализа отобрали клетки, растущие монослоем до посадки на мембранные вставки (0 ч), и клетки, растущие на мембранных вставках в течение 3 суток (72 ч) и образовавшие многослойную структуру. Эксперимент проводили в 3 биологических повторах. Клетки лизировали при помощи Qiazol lysis buffer (“Qiagen”) с добавлением 50 нг/мкл GlycoBlue Coprecipitant (“Thermo Fisher Scienti-fic”, США). Выделение тотальной РНК проводили, используя набор miRNeasy Micro Kit (“Qiagen”) по протоколу производителя. Концентрацию РНК определяли на спектрофотометре NanoDrop ND-1000 ((“Thermo Fisher Scientific”). Качество выделенной РНК оценивали на приборе 2100 Bioanalyzer с набором реагентов RNA 6000 Nano Kit (“Agilent”, США). Для дальнейшего анализа использовали образцы с показателем качества RIN более 9.5.
Транскриптомный анализ проводили на микрочипах Human Transcriptome Array 2.0 (“Affymet-rix”, США). Результаты обрабатывали с помощью алгоритма RMA в программном обеспечении Transcriptome Analysis Console version 4.0 (“Thermo Fisher Scientific”). Для оценки статистической значимости различий в экспрессии генов использовали скорректированные значения p-value (поправка FDR) с пороговым уровнем 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
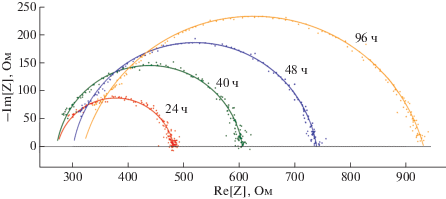
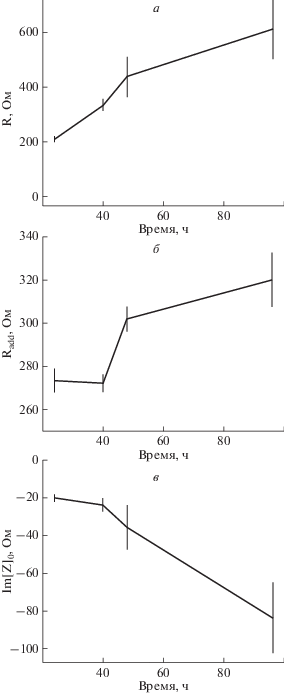
Измерения импеданса. При измерении импеданса клеток BeWo b30 в различные моменты времени от начала культивирования показано, что через 40 ч после начала эксперимента значения добавочного сопротивления Radd (рис. 4б) и ординаты центра полуокружности импеданса Im[Z]0 (рис. 4в) статистически значимо не изменяются по сравнению со значениями, измеренными через 24 ч после посева клеток на мембранные вставки (p = 0.72 и p = 0.13 соответственно); при этом наблюдается рост сопротивления клеточного слоя R (рис. 4а), примерно на 124 Ом, в этом временном интервале (p = 0.0003). Однако уже через 8 ч начинается значительный рост добавочного сопротивления Radd (рис. 4б) по сравнению со значениями, измеренными через 24 ч после начала эксперимента (на 28 Ом через 48 ч, p = 0.0004; на 47 Ом через 96 ч, p = 0.002); при этом ордината центра полуокружности годографа импеданса начинает опускаться (на 16 Ом через 48 ч, p = 0.08; на 64 Ом через 96 ч, p = 0.006), а сопротивление клеточного слоя продолжает расти (на 227 Ом через 48 ч, p = 0.008; на 401 Ом через 96 ч, p = 0.005). Таким образом, по мере роста клеток радиус полуокружности годографа импеданса постоянно увеличивается, при этом после 40 ч культивирования начинается смещение центра полуокружности вправо и вниз (рис. 5).
Рис. 4.
Зависимость сопротивления клеток R (а), добавочного сопротивления Radd (б) и ординаты центра полуокружности годографа импеданса (в) от времени культивирования.
Транскриптомный анализ. В результате проведенного транскриптомного анализа обнаружено значительное изменение экспрессии 1130 генов в клетках BeWo b30 через 72 ч после начала культивирования по сравнению с начальным моментом времени (изменение абсолютного значения экспрессии, по крайней мере, в 2 раза, FDR p-value < 0.05); при этом экспрессия 953 генов увеличилась, а 177 генов уменьшилась. Таблица 100 генов с наиболее сильным изменением экспрессии приведена в Дополнительных материалах (См. Приложение на сайте http://www.molecbio.ru/downloads/2019/3/supp_ Nikulin_rus.pdf).
Среди наиболее значимых результатов транскриптомного анализа можно выделить повышенную экспрессию генов металлотионеинов групп I и II в клетках BeWo b30 через 72 ч после начала культивирования (таблица) – без изменения экспрессии генов металлотионеинов групп III и IV. В процессе роста клеток BeWo b30 наиболее сильное спонтанное усиление экспрессии наблюдалось для генов MT2A, MT1F и MT1B (в 156, 111 и 99 раз соответственно).
Таблица.
Относительный уровень экспрессии генов металлотионеинов в клеточной линии BeWo b30 через 72 ч после начала культивирования по сравнению с начальным моментом времени
| Affymetrix ID | Степень изменения | FDR p-value |
Ген | Описание |
|---|---|---|---|---|
| TC16002035.hg.1 | 2.88 | 2.0 × 10–4 | MT1A | Mеталлотионеин 1A |
| TC16000472.hg.1 | 98.80 | 3.5 × 10–7 | MT1B | Mеталлотионеин 1B |
| TC16000470.hg.1 | 2.27 | 1.1 × 10–3 | MT1DP | Mеталлотионеин 1D, псевдоген (функциональный) |
| TC16000468.hg.1 | 5.11 | 8.7 × 10–5 | MT1E | Mеталлотионеин 1E |
| TC16000473.hg.1 | 111.36 | 3.5 × 10–7 | MT1F | Mеталлотионеин 1F |
| TC16001135.hg.1 | 9.44 | 7.7 × 10–6 | MT1G | Mеталлотионеин 1G |
| TC16000474.hg.1 | 36.6 | 8.3 × 10–6 | MT1H | Mеталлотионеин 1H |
| TC01006221.hg.1 | 22.63 | 1.0 × 10–4 | MT1HL1 | Mеталлотионеин 1H-подобный 1 |
| TC01004008.hg.1 | 1.65 | 2.0 × 10–2 | MT1HL1 | Mеталлотионеин 1H-подобный 1 |
| TC16000475.hg.1 | 1.45 | 3.7 × 10–3 | MT1IP | Mеталлотионеин 1I, псевдоген |
| TC16001578.hg.1 | 1.44 | 3.6 × 10–3 | MT1IP | Mеталлотионеин 1I, псевдоген |
| TC16000469.hg.1 | 21.61 | 3.1 × 10–5 | MT1JP | Mеталлотионеин 1J, псевдоген |
| TC16001576.hg.1 | 5.69 | 1.0 × 10–4 | MT1JP | Mеталлотионеин 1J, псевдоген |
| TC16001575.hg.1 | 3.93 | 3.0 × 10–4 | MT1L | Mеталлотионеин 1L (ген/псевдоген) |
| TC16002075.hg.1 | 3.48 | 4.0 × 10–4 | MT1L | Mеталлотионеин 1L (ген/псевдоген) |
| TC16002074.hg.1 | 1.82 | 2.8 × 10–3 | MT1M | Mеталлотионеин 1M |
| TC16000476.hg.1 | 11.80 | 1.2 × 10–5 | MT1X | Mеталлотионеин 1X |
| TC16002034.hg.1 | 156.28 | 3.5 × 10–7 | MT2A | Mеталлотионеин 2A |
| TC16000465.hg.1 | 1.04 | 7.9 × 10–1 | MT3 | Mеталлотионеин 3 |
| TC16000464.hg.1 | 1.29 | 3.0 × 10–2 | MT4 | Mеталлотионеин 4 |
Обнаружено, что в ходе роста клеток BeWo b30 спонтанно увеличивалась экспрессия генов ERVW-1 (в 1.9 раза) и ERVFRD-1 (в 8.1 раза) – кодируют белки синцитин-1 и синцитин-2 соответственно, участвующие в синцитизации клеток трофобласта.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как показали Heaton и др. [6], клетки BeWo, посаженные на мембранную подложку при плотности 80 000 клеток/см2, через 72 ч продолжают расти монослоем, а через 168 ч образуют четырехслойную структуру [6]. Позже Müller и соавт. [8] обнаружили, что при плотности посадки 150 000 клеток/см2 уже на 5 сутки формируется трехслойная структура, а при плотности посадки 610 000 клеток/см2 через такой же промежуток времени образуется шестислойная структура. Таким образом, учитывая высокую плотность посадки клеток BeWo b30, использованную нами в работе (около 210 000 клеток/см2), можно ожидать образования дополнительного слоя клеток уже на вторые или третьи сутки.
На основе полученных данных можно предположить, что формирование полноценного монослоя клеток BeWo занимает до 40 ч; при этом сопротивление клеток заметно растет, а значения добавочного сопротивления и ордината центра полуокружности годографа импеданса практически не меняются. Однако после 40 ч культивирования поведение всех электрических параметров клеток полностью совпадает с описанной выше моделью многослойного роста клеток. Ранее нами показано [15], что в процессе роста клеток эпителия кишечника Caco-2, которые подвержены действию контактного ингибирования и не образуют многослойных структур, импеданс ведет себя иначе. Слабое увеличение добавочного сопротивления в процессе роста клеток Caco-2, обусловленное, по-видимому, ремоделированием внеклеточного матрикса, не сопровождалось значимым ростом сопротивления клеток R.
Нами обнаружено значительное повышение экспрессии генов металлотионеинов в клетках BeWo b30. Металлотионеины представляют собой семейство богатых цистеином белков (Cys составляет до 30% последовательности) с относительно низкой молекулярной массой (~ 6 кДа) [18]. Эти белки принято делить на 4 группы: MT-I, MT-II, MT-III и MT-IV. Известно несколько изоформ металлотионеинов группы I, причем они кодируются разные генами. Основной функцией металлотионеинов считается связывание двухвалентных катионов, таких как Zn2+, Cu2+, Cd2+, Hg2+ и др [18, 19]. За счет высокой аффинности к ионам металлов металлотионеины принимают участие в регуляции обмена физиологически важных катионов, таких как цинк, содержание которого влияет на активность многих ферментов и транскрипционных факторов, а также участвуют в детоксикации при отравлении тяжелыми металлами. Благодаря наличию большого числа сульфгидрильных групп металлотионеины являются сильными антиоксидантами.
На сегодняшний день роль металлотионеинов в развитии и функционировании плаценты, как в норме, так и при отравлении тяжелыми металлами достаточно хорошо изучена. В экспериментах на животных показано, что в период вынашивания эмбриона экспрессия металлотионеинов постепенно возрастает и смещается от материнской части плаценты к плодной части [20]. Также в ходе беременности возрастает экспрессия металлотионеинов в печени плода. Судя по имеющимся данным, металлотионеины принимают участие в транспорте физиологически важных ионов металлов через плацентарный барьер, а также защищают плод от воздействия тяжелых металлов [21–24]. Известно, что экспрессия металлотионеинов в клетках трофобласта повышается под воздействием ионов цинка и кадмия [25]; при этом концентрация Zn2+ в крови плода выше, чем в крови матери, а для Cd2+ наблюдается обратное соотношение [26].
Нами впервые показано, что экспрессия металлотионеинов спонтанно увеличивается в процессе роста клеток хориокарциномы человека BeWo b30. Содержание металлотионеинов может существенно влиять на транспорт металлосодержащих соединений через плацентарный барьер, что следует учитывать при постановке экспериментов на моделях in vitro. Также некоторые металлотионеины с наиболее ярко выраженными изменениями экспрессии (в частности, гены MT1B, MT1F и MT2A) могут быть использованы для создания репортерных генетических конструкций, позволяющих контролировать рост клеток BeWo b30.
Стоит также отметить, что в результате транскриптомного анализа обнаружено спонтанное увеличение экспрессии белков синцитин-1 и синцитин-2, играющих ключевую роль при синцитизации клеток трофобласта [27]. Известно, что синцитизация клеток BeWo b30 может быть индуцирована при помощи форсколина, при этом также возрастает экспрессия синцитина [28, 29]. Повышение экспрессии синцитинов может быть обусловлено тем, что в процессе роста клеток BeWo b30 происходит не только образование многослойной структуры, но и слияние клеток в синцитий, при этом гены ERVW-1 и ERVFRD-1 могут служить маркерами этого процесса.
Таким образом, в данной работе впервые описано применение импедансной спектроскопии для мониторинга роста клеток хориокарциномы человека BeWo b30, используемой для создания in vitro моделей плацентарного барьера. Получены экспериментальные доказательства возможности применения импедансной спектроскопии для дифференциации монослоя клеток от многослойной структуры. Импеданстная спектроскопия относится к методам неинвазивным, не требующим использования молекулярных меток и работающим в режиме реального времени. Следовательно, импедансная спектроскопия может быть использована в моделях in vitro плацентарного барьера не только для контроля его целостности (как и классический метод измерения TEER), но и для оценки числа слоев клеток. В процессе роста клеток BeWo b30 выявлена повышенная экспрессия генов металлотионеинов и синцитинов, которые могут быть использованы в качестве молекулярных маркеров роста. Кроме того, повышенную экспрессию генов синцитинов, возможно, стоит рассматривать и как маркер спонтанного слияния клеток BeWo b30 в синцитий.
Работа выполнена при поддержке Российского научного фонда (грант № 16-19-10597).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Gude N.M., Roberts C.T., Kalionis B., King R.G. (2004) Growth and function of the normal human placenta. Thromb. Res. 114, 397–407.
Lee J.S., Romero R., Han Y.M., Kim H.C., Kim C.J., Hong J.-S., Huh D. (2016) Placenta-on-a-chip: a novel platform to study the biology of the human placenta. J. Matern. Neonatal Med. 29, 1046–1054.
Schmidt A., Morales-Prieto D.M., Pastuschek J., Fröhlich K., Markert U.R. (2015) Only humans have human placentas: molecular differences between mice and humans. J. Reprod. Immunol. 108, 65–71.
Blundell C., Tess E.R., Schanzer A.S.R., Coutifaris C., Su E.J., Parry S., Huh D. (2016) A microphysiological model of the human placental barrier. Lab Chip. 16, 3065–3073.
Bode C.J., Jin H., Rytting E., Silverstein P.S., Young A.M., Audus K.L. (2006) In vitro models for studying trophoblast transcellular transport. Methods Mol. Med. 122, 225–39.
Heaton S.J., Eady J.J., Parker M.L., Gotts K.L., Dainty J.R., Fairweather-Tait S.J., McArdle H.J., Srai K.S., Elliott R.M. (2008) The use of BeWo cells as an in vitro model for placental iron transport. Am. J. Physiol. Physiol. 295, C1445–C1453.
Ribatti D. (2017) A revisited concept: Contact inhibition of growth. From cell biology to malignancy. Exp. Cell Res. 359, 17–19.
Müller E., Gräfe C., Wiekhorst F., Bergemann C., Weidner A., Dutz S., Clement J. (2018) Magnetic nanoparticles interact and pass an in vitro co-culture blood-placenta barrier model. Nanomaterials. 8, 108.
Correia Carreira S., Walker L., Paul K., Saunders M. (2015) In vitro models of the human placental barrier – in regione caecorum rex est luscus. Nanotoxicology. 9, 135–136.
Sood A., Salih S., Roh D., Lacharme-Lora L., Parry M., Hardiman B., Keehan R., Grummer R., Winterhager E., Gokhale P.J., Andrews P.W., Abbott C., Forbes K., Westwood M., Aplin J.D., Ingham E., Papageorgiou I., Berry M., Liu J., Dick A.D., Garland R.J., Williams N., Singh R., Simon A.K., Lewis M., Ham J., Roger L., Baird D.M., Crompton L.A., Caldwell M.A., Swalwell H., Birch-Machin M., Lopez-Castejon G., Randall A., Lin H., Suleiman M.-S., Evans W.H., Newson R., Case C.P. (2011) Signalling of DNA damage and cytokines across cell barriers exposed to nanoparticles depends on barrier thickness. Nat. Nanotechnol. 6, 824–833.
Poloznikov A., Gazaryan I., Shkurnikov M., Nikulin S., Drapkina O., Baranova A., Tonevitsky A. (2018) In vitro and in silico liver models: current trends, challenges and opportunities. ALTEX. 35, 397–412.
Poloznikov A.A., Zakhariants A.A., Nikulin S.V., Smirnova N.A., Hushpulian D.M., Gaisina I.N., Tonevitsky A.G., Tishkov V.I., Gazaryan I.G. (2017) Structure-activity relationship for branched oxyquinoline HIF activators: effect of modifications to phenylacetamide “tail”. Biochimie. 133, 74–79.
Srinivasan B., Kolli A.R., Esch M.B., Abaci H.E., Shuler M.L., Hickman J.J. (2015) TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20, 107–126.
Henry O.Y.F., Villenave R., Cronce M.J., Leineweber W.D., Benz M.A., Ingber D.E. (2017) Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab Chip. 17, 2264–2271.
Никулин С.В., Князев Е.Н., Герасименко Т.Н., Шилин С.А., Газизов И.Н., Захарова Г.С., Полозников А.А., Шкурников М.Ю. (2018) Неинвазивная оценка развития внеклеточного матрикса эпителия кишечника. Бюллетень экспериментальной биологии и медицины. 166, 41–45.
Никулин С.В., Князев Е.Н., Полозников А.А., Шилин С.А., Газизов И.Н., Захарова Г.С., Герасименко Т.Н. (2018) Экспрессия мРНК транспортеров SLC30A10 и SLC23A3 коррелирует с увеличением площади апикальной мембраны клеток Caco-2. Молекуляр. биология. 52, 667–674.
Shoar Abouzari M.R., Berkemeier F., Schmitz G., Wilmer D. (2009) On the physical interpretation of constant phase elements. Solid State Ionics. 180, 922–927.
Thirumoorthy N. (2007) Metallothionein: an overview. World J. Gastroenterol. 13, 993.
Ruttkay-Nedecky B., Nejdl L., Gumulec J., Zitka O., Masarik M., Eckschlager T., Stiborova M., Adam V., Kizek R. (2013) The role of metallothionein in oxidative stress. Int. J. Mol. Sci. 14, 6044–6066.
Furukawa S., Usuda K., Abe M., Hayashi S., Ogawa I. (2008) Histological expression of metallothionein in the developing rat placenta. J. Toxicol. Pathol. 21, 223–227.
Lau J.C., Joseph M.G., Cherian M.G. (1998) Role of placental metallothionein in maternal to fetal transfer of cadmium in genetically altered mice. Toxicology. 127, 167–178.
Andrews G.K., Geiser J. (1999) Expression of the mouse metallothionein-I and -II genes provides a reproductive advantage during maternal dietary zinc deficiency. J. Nutr. 129, 1643–1648.
Ronco A.M., Arguello G., Suazo M., Llanos M.N. (2005) Increased levels of metallothionein in placenta of smokers. Toxicology. 208, 133–139.
Benitez M.A., Mendez-Armenta M., Montes S., Rembao D., Sanin L.H., Rios C. (2009) Mother-fetus transference of lead and cadmium in rats: involvement of metallothionein. Histol. Histopathol. 24, 1523–1530.
Waalkes M.P., Poisner A.M., Wood G.W., Klaassen C.D. (1984) Metallothionein-like proteins in human placenta and fetal membranes. Toxicol. Appl. Pharmacol. 74, 179–184.
Goyer R.A., Haust M.D., Cherian M.G. (1992) Cellular localization of metallothionein in human term placenta. Placenta. 13, 349–355.
Vargas A., Thiery M., Lafond J., Barbeau B. (2012) Transcriptional and functional studies of human endogenous retrovirus envelope EnvP(b) and EnvV genes in human trophoblasts. Virology. 425, 1–10.
Azar C., Valentine M., Trausch-Azar J., Druley T., Nelson D.M., Schwartz A.L. (2018) RNA-Seq identifies genes whose proteins are transformative in the differentiation of cytotrophoblast to syncytiotrophoblast, in human primary villous and BeWo trophoblasts. Sci. Rep. 8, 5142.
Borges M., Bose P., Frank H.-G., Kaufmann P., Pötgens A.J.G. (2003) A two-colour fluorescence assay for the measurement of syncytial fusion between trophoblast-derived cell lines. Placenta. 24, 959–964.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология