Молекулярная биология, 2019, T. 53, № 5, стр. 860-870
Иммуноглобулины человека как иммуномодулирующие препараты
Ч. Л. Василев a, *, О. В. Старкина a
a Институт биологии и биомедицины Национального исследовательского Нижегородского
государственного университета им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
* E-mail: tchavdarv@gmail.com
Поступила в редакцию 11.04.2019
После доработки 13.05.2019
Принята к публикации 15.05.2019
Аннотация
Настало время отпраздновать 125-летие создания первой специфической антитоксической сыворотки с высоким титром антител для лечения смертельно опасного инфекционного заболевания ‒ дифтерии. Следующие крупные события в области пассивной иммунотерапии произошли 75 лет назад (производство препаратов IgG человека для подкожных инъекций) и 50 лет назад (распространение технологии производства препаратов иммуноглобулинов для внутривенного введения). Ежегодно производство IgG человека для внутривенного введения увеличивается во всем мире. Препарат используется главным образом для замещения IgG у пациентов с первичными и вторичными иммунодефицитами, а также для иммуномодулирующего лечения растущего перечня аутоиммунных и воспалительных заболеваний. Эти препараты содержат объединенный репертуар антител IgG от большой популяции здоровых доноров плазмы. Этот репертуар включает антитела, нейтрализующие патогены и факторы их вирулентности, антиидиотипические антитела, антитела к другим чужеродным и собственным белкам, а также к углеводным антигенам. Полиспецифичные природные антитела, присутствующие у всех здоровых людей, играют важную роль в качестве защиты первой линии против бактерий и вирусов. Некоторые молекулы IgG после воздействия модификаторов белков могут приобретать способность связывать новые антигены, структурно не родственные исходным. Это явление называется “индуцированная полиспецифичность”. Нами и другими исследователями показано, что список этих молекулярных агентов, модифицирующих белки, включает буферы с низким pH, свободный гем, прооксидантные ионы железа, активные формы кислорода и другие. Такие препараты модифицированных антител могут иметь терапевтический потенциал, так как их введение животным с экспериментальными синдромами сепсиса или асептического системного воспаления приводили к значительному улучшению выживаемости, в то время как инъекции тех же доз немодифицированных препаратов не давали эффекта. Нами выдвинута гипотеза, что агрессивные белокмодифицирующие молекулы, высвобождаемые в участках воспаления и повреждения тканей, могут также модифицировать антигенсвязывающие характеристики поверхностных иммуноглобулинов, служащих рецепторами В-клеток. Это “редактирование специфичности” иммуноглобулиновых рецепторов может играть важную роль в механизмах защиты организма.
125 ЛЕТ ПАССИВНОЙ ИММУНИЗАЦИИ
Первые несколько микроорганизмов, вызывающих инфекционные заболевания, были описаны в конце XIX века, тогда же были предприняты и первые попытки разработать специфические методы лечения этих заболеваний. Эмиль фон Беринг, Пауль Эрлих и их сотрудники вводили лошадям, козам и морским свинкам увеличивающиеся дозы дифтерийного и столбнячного токсинов и обнаружили, что через некоторое время сыворотка этих животных приобретала способность предотвращать и лечить эти заболевания при введении другим неиммунным животным. Первая статья, описывающая действие “антитоксинов” против дифтерии и столбняка, датируется 1890 годом. Попытки лечения этих заболеваний у пациентов с помощью введения тех же сывороток животных вначале были безуспешными. Однако вопросы стандартизации и производства антитоксинов были быстро решены, и сыворотка животных против дифтерии стала успешно использоваться во всем мире после 1894 года для лечения детей с этим смертельным инфекционным заболеванием. В первые десятилетия XX века были разработаны специфические иммуноглобулины животных с высоким титром, которые использовались для лечения пациентов со многими другими инфекционными заболеваниями. Нежелательные побочные эффекты этого лечения были очевидны и неизбежны. Все пациенты были сенсибилизированы к животным белкам, и повторная инъекция того же препарата была опасной.
Необычно то, что в XXI веке такие специфические иммуноглобулины животного происхождения с высоким титром все еще производят и вводят пациентам. Причина проста: очень немногие пациенты в настоящее время нуждаются в специфических препаратах антител для пассивной иммунотерапии дифтерии, столбняка, газовой гангрены, отравления змеиным ядом, интоксикации ботулином и т.д. Биотехнологические компании не заинтересованы в производстве специфических иммуноглобулинов человека или гуманизованных моноклональных антител той же специфичности из-за очень низкого спроса на них и поэтому все еще приходится использовать препараты из плазмы иммунизированных животных.
Следующее важное событие в истории пассивной иммунотерапии инфекционных заболеваний произошло 80 лет назад. Технологии крупномасштабного фракционирования белков плазмы человека разработаны во время Второй мировой войны Эдвином Коном (Edwin Cohn) и его сотрудниками [1] в США с целью крупномасштабного производства сывороточного альбумина человека для лечения солдат с боевыми ранениями. Тогда показали, что компонент плазмы, известный как “фракция II”, содержит довольно чистый человеческий IgG, с тех пор эта фракция используется для производства IgG для подкожного введения с целью пассивной иммунопрофилактики и иммунотерапии ряда инфекционных заболеваний.
Первые попытки внутривенного введения человеческого сывороточного альбумина или человеческого IgG привели к неожиданным катастрофическим последствиям. У всех пациентов, которым вводили сывороточный альбумин человека, развилась “желтуха”, позже описанная как вирусный гепатит. Эта проблема была решена довольно быстро, когда препарат альбумина стали использовать только после нагревания в течение 10 ч при 60°С. Внутривенная инфузия суммарного IgG из коновской фракции II вызывала у всех пациентов сильное падение кровяного давления, озноб и гиперпирексию. Потребовалось еще 20 лет, чтобы выяснить механизмы этих неожиданных побочных эффектов и найти способы, как их избежать. Оказалось, что основной причиной было присутствие в препарате для внутривенного введения агрегированных молекул IgG. Эти агрегаты вызывают активацию комплемента, а образующиеся в результате фрагменты комплемента, анафилатоксины C3a и C5a, вызывают быстрое падение кровяного давления. В 1960-х годах были разработаны различные технологии, направленные на ограничение доли присутствующих агрегатов IgG и подавление образования новых в течение срока годности препаратов.
Каждая произведенная партия терапевтического IgG для внутривенного введения (intravenous immunoglobulin, IVIg) должна соответствовать требованиям, подробно описанным в действующей Национальной или Европейской Фармакопее (National or European Pharmacopoeia). Эти требования можно обобщить следующим образом:
– для фракционирования следует использовать плазму только здоровых доноров;
– препарат должен содержать более 90% мономеров IgG плюс димеров и лишь небольшую долю агрегированных молекул IgG, причем молекулы IgG не могут быть модифицированы ‒ они должны находиться в нативном состоянии и иметь нормальные F(ab)2- и Fc-фрагментзависимые биологические функции;
– распределение подклассов IgG должно быть таким же, как в плазме здоровых взрослых, а содержание IgA должно быть низким;
– активность активатора прекалликреина (PKA), способность активировать систему комплемента, содержание плазмина, изогемагглютинина и аллоантител (анти-D и др.) должны быть ниже предварительно определенного порогового уровня;
– не допустимо присутствие никаких консервантов (например, мертиолята);
– титры некоторых специфических (противовирусных и антибактериальных) антител дожны быть не ниже определенных гарантированных значений.
РЕПЕРТУАР СУММАРНЫХ АНТИТЕЛ IgG ДЛЯ ТЕРАПИИ
Каждая партия иммуноглобулинов человека фракционируется из объединенной плазмы более чем 1000 здоровых доноров (в англоязычной литературе используется термин “pooled IgG”, в то время как русскоязычный термин “Иммуноглобулин человека нормальный для внутривенного введения” не отражает происхождение из суммарных препаратов сыворотки многих доноров). Эту плазму получают из донорской крови, из которой удаляют эритроциты и остальные клетки крови. Есть и второй метод ‒ плазмаферез. В этой процедуре забора крови полученая плазма используется, а клетки крови возвращаются обратно в кровоток донора. Таким образом, полученный из обычной плазмы препарат содержит репертуар антител большой, свободной от болезней человеческой популяции. Новые технологии: фаговые библиотеки, микрочипы и т.д. ‒ позволяют детально проанализировать репертуар антибелковых и часто игнорируемых антигликановых антител.
Все молекулы антител IgM обладают полиреактивностью, но только часть IgG, IgA и IgE проявляет способность связывать несколько структурно различных антигенов. Формальное доказательство того, что такие антитела существуют, пришло из ранних попыток производства моноклональных антител. К разочарованию исследователей, ожидавших увидеть, что сконструированная гибридома продуцирует только высокоспецифичные антитела к антигену, введенному мышам, гибридома часто секретировала полиспецифичные антитела. Доказательство связывания с двумя или более чужеродными антигенами либо аутоантигенами, не сходными по структуре, считается достаточным, чтобы классифицировать антитело как полиспецифичное. Тем не менее, нельзя исключить, что удастся показать взаимодействие любого антитела с двумя или более антигенами, если тестируемые панели антигенов будут достаточно большими [2].
Полиспецифичные антитела часто рассматривают как “фоновые”, “молчащие”, “липкие”. Мало кто из иммунологов интересуется их биологической ролью. Однако имеются убедительные данные, подтверждающие их важную роль в качестве первой линии защиты от вторжения патогенных микроорганизмов [3]. Этот тип полиспецифичности называют “природным”, или “врожденным” [4]. Антитела могут также приобретать антигенсвязывающую полиспецифичность после контакта in vitro или in vivo с белокмодифицирующими молекулами в сайтах воспаления (см. ниже).
Идиотипические взаимодействия отдельных молекул антител с антиидиотипами ответствены за образование димеров IgG в препаратах IVIg. В связи с тем, что аффинность этих взаимодействий низкая, димеры образуются только после хранения препарата в течение нескольких месяцев при 4°С. Согласно “сетевой” гипотезе N.K. Jerne, взаимодействия идиотип/антиидиотип играют главную роль в самоконтроле иммунной системы [5]. Позже показали, что такие механизмы контроля не зависят строго от идиотипа, и интерес к “сетевым” идеям постепенно затихал, хотя о такой возможности не следует забывать. Так, однократная доза IVIg для пациентов с аутоиммунной гемофилией приводила к очень быстрому исчезновению 95% связанных с заболеванием IgG антител против человеческого фактора VIII. Доказано, что этот эффект вызван связыванием антиидиотипических антител IgG из введенного препарата с идиотипами патологических антител IgG с активностью против фактора VIII у пациентов [6].
В репертуаре специфичностей IVIg обнаружены многочисленные аутоспецифичности. Это присутствие не имеет ничего общего с патологическим аутоиммунитетом. В методах детекции: иммуноферментном анализе, иммуноблотинге, микрочипах и т.д. ‒ используют иммобилизованные собственные белки. В этих условиях могут связываться низкоаффинные аутоантитела, которые не имеют патологической значимости. В редких случаях наличие в плазме антител, не относящихся к органспецифическим, может быть предиктором аутоиммунного заболевания в будущем. Например, присуствие у здоровых людей антител класса IgG к двухцепочной ДНК ‒ это сигнал развития ревматоидного артрита с развернутой клинической картиной [7].
ПРЕПАРАТЫ IgG ЧЕЛОВЕКА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ ПРИ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ИММУНОГЛОБУЛИНОВОЙ НЕДОСТАТОЧНОСТИ И ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ
Мировое производство терапевтических препаратов IgG человека для внутривенной инфузии ежегодно увеличивается. Большинство из них используется для лечения пациентов с тремя группами заболеваний: а) первичные иммунодефициты, б) вторичные иммунодефициты и в) аутоиммунные и воспалительные заболевания.
Регулярное подкожное или внутривенное введение такого препарата иммуноглобулинов считается основным и часто единственным спасительным средством для лечения большинства первичных иммунодефицитов. Более 300 из них хорошо известны, и это число постоянно увеличивается. Первым из таких заболеваний описана связанная с Х-хромосомой агаммаглобулинемия Брутона. Это аутосомно-рецессивное заболевание, характеризующееся низким уровнем иммуноглобулина в плазме и очень низким числом В-клеток. Заболевание возникает в результате мутаций тирозинкиназы Брутона. Регулярная IgG-заместительная терапия может обеспечить близкие к нормальным показатели продолжительности и качества жизни пациентов.
Наиболее распространенный тип первичного иммунодефицита ‒ общий вариабельный иммунодефицит (CVID). Примерно у 10–20% пациентов наблюдаются моногенные расстройства; некоторые имеют аутосомно-рецессивное наследование, а некоторые аутосомно-доминантное. Помимо частых инфекций, клинические проявления CVID включают хроническую болезнь легких, развитие бронхоэктаза, диарею и высокую частоту аутоиммунных заболеваний. В дополнение к IgG-заместительной терапии лечение может включать антибиотики, парентеральное питание, трансплантацию стволовых клеток и т.д.
Число пациентов с первичными иммунодефицитами значительно ниже, чем со вторичными иммунодефицитами. К последним относятся (но не ограничиваются ими) следующие патологические состояния: множественная миелома, хронический лимфолейкоз, другие сóлидные злокачественные опухоли, злокачественные заболевания крови, низкий уровень B-клеток вследствие лечения ритуксимабом, отсутствие ответа на антибиотикотерапию, недоношенность, гериатрическая иммунонедостаточность и др.
Во многих странах ощущается нехватка препаратов иммуноглобулинов для внутривенного введения. Основная причина кроется в быстро растущем числе пациентов с аутоиммунными заболеваниями, которых лечат большими дозами IVIg. Более подробно эта проблема рассмотрена в одном из последних обзоров [8].
СПЕЦИФИЧЕСКИЕ ПОЛИКЛОНАЛЬНЫЕ ИММУНОГЛОБУЛИНЫ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ
Некоторые компании, занимающиеся фракционированием плазмы человека, производят небольшие партии специфических иммуноглобулинов с высоким титром для пассивной иммунизации или лечения некоторых инфекционных заболеваний. В этот список входят: бешенство, гепатит В, столбняк, ветряная оспа, цитомегаловирусная инфекция, клещевой энцефалит и т.д.
Тридцать лет назад в Институте инфекционных и паразитарных болезней (National Center of Infectious and Parasitic Diseases, София, Болгария) был разработан иммуноглобулиновый препарат для внутривенного лечения геморрагической лихорадки Крым–Конго (CCHF-Venin), и в Болгарии были проведены его клинические испытания. Иммуноглобулин получали из плазмы добровольцев, иммунизированных вакциной CCHF. Ранее такую же гипериммунную плазму использовали для создания высокотитражного специфического анти-CCHF-иммуноглобулина для подкожной пассивной иммунизации. Однако при введении пациентам с тяжелой формой заболевания эта манипуляция сама по себе вызывала сильное и опасное для жизни кровотечение в области инъекции. Срочная необходимость в препарате с той же специфичностью, который можно вводить внутривенно, стала очевидной. Летом 1989 года 7 пациентов с тяжелой формой CCHF получили однократную внутривенную дозу CCHF-Venin. В этом исследовании отсутствовала группа контроля, так как другого доступного препарата для лечения этого заболевания тогда не было. У всех испытуемых пациентов прогноз был плохим, но в результате проведенного лечения они быстро выздоровели и покинули больницу [9]. К сожалению, компания, которая произвела первую партию CCHT-Venin, оказалась не заинтересована в его производстве на регулярной основе ввиду нерентабельности. В результате препарат CCHT-Venin пополнил печальный список жизненно важных “орфанных” препаратов, которые ни одна фармацевтическая или биотехнологическая компания производить не берется.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПОЛИКЛОНАЛЬНЫЕ ПРЕПАРАТЫ IgM И IgA
Известно, что антитела изотипа IgM по своей природе полиспецифичны. Мощная иммуномодулирующая активность суммарного IgM человека хорошо документирована, и ее терапевтический потенциал очевиден [10, 11]. Однако ни одна компания, занимающаяся фракционированием плазмы, до сих пор не преуспела в производстве препарата иммуноглобулина с высоким содержанием IgM для внутривенного введения. Компания “Biotest” (Германия) производит продукт, обогащенный IgM/IgA, под названием BT086. Он содержит 23% IgM, остальные иммуноглобулины ‒ это IgG и IgA. Препарат теперь имеет торговое название Тримодулин, а его клинические испытания начались с пациентов с тяжелой внебольничной пневмонией, требующей инвазивной процедуры ‒ искусственной вентиляции легких [12]. Отсутствие терапевтического эффекта Тримодулина в этом клиническом исследовании, вероятно, связано с низким содержанием IgM в препарате.
Кроме того, предпринимались попытки использовать сывороточный IgA человека. Некоторые из этих иммуноглобулинов представлены димерами и при добавлении к ним секреторного компонента получают секреторные антитела, подобные природным [13, 14]. Однако данных о клинических испытаниях таких антител пока нет.
Можно ожидать, что в ближайшем будущем технологии димеризации мономерного человеческого сывороточного IgA будут разработаны. Добавление секреторного компонента к этим молекулам позволит сделать их идентичными природным секреторным IgA. Как минимум, по двум важным причинам этим стоит заниматься. Во-первых, многих новорожденных детей кормят “гуманизированным” (на самом деле коровьим) молоком. Польза будет бесспорная, если пищеварительную систему младенцев защитить добавкой в питание секреторного IgA человека. Во-вторых, бенефициарами станут компании, занимающиеся фракционированием плазмы человека. Человеческая плазма ‒ ценнейшее сырье, поэтому использование фракции, которая идет на выброс, принесет немалую выгоду.
ИНДУЦИРОВАННАЯ СПЕЦИФИЧНОСТЬ АНТИТЕЛ: ВОЗДЕЙСТВИЕ ЗАКИСЛЕННОГО БУФЕРА ИЗМЕНЯЕТ АНТИГЕНСВЯЗЫВАЮЩИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА АНТИТЕЛ IgG
Два десятилетия прошло с тех пор, как описан феномен индуцированной специфичности антител [3, 4]. Некоторые моноклональные IgG и IgE, как и все проанализированные препараты суммарных (поликлональных) антител, подвергшиеся воздействию различных белокмодифицирующих агентов, приобретают способность связываться с расширенной панелью антигенов. Эти белокмодифицирующие обработки включают воздействие кислых pH, свободного гема, а также соединений двухвалентного железа или активных форм кислорода (АФК) как активаторов окисления.
Впервые о воздействии буферов с кислым рН на препараты иммуноглобулинов сообщили Bouvet и др. [15]. Это явление не может быть напрямую связано с событиями в условиях in vivo. Однако некоторые из лицензированных терапевтических внутривенных препаратов иммуноглобулина получают с использованием стадии фракционирования белка при кислом значении pH. Это приводит к дополнительно усиленной антигенсвязывающей полиспецифичности и измененным биологическим свойствам. При сравнительном исследовании эффектов пассивной иммунотерапии сепсиса (мышиная модель) различными препаратами IVIg показано, что ведение нативного IVIg (то есть не прошедшего обработки кислым буфером) не влияло на выживаемость, в то время как однократная доза того же препарата, подвергнутого воздействию буфера с рН 4.0, значительно снижала смертность при септическом шоке, индуцированном липополисахаридами (LPS). Это важное наблюдение, поскольку становится понятным, что различные коммерчески доступные препараты иммуноглобулина могут иметь разные антигенсвязывающие, а также различные терапевтические свойства. Есть все основания полагать, что препараты с дополнительно повышенной полиспецифичностью могут обладать терапевтическим потенциалом у пациентов с различными вариантами синдрома системного воспалительного ответа (SIRS, systemic inflammation response syndrome).
Молекулярные изменения в иммуноглобулинах, подвергнутых воздействию рН 4.0, частично установлены [16, 17]. Предпочтительный одностадийный метод быстрой очистки IgG человеческого и животного происхождения основан на специфическом связывании молекул этого изотипа иммуноглобулина с иммобилизованным белком А или белком G. Элюирование осуществляют путем промывания соответствующих иммуноаффинных колонок буфером с pH 2.8. Нами показано, что эта обработка драматически изменяет структуру молекул IgG и вызывает резкое усиление антигенсвязывающей полиспецифичности, которая становится похожей на неспецифическую адгезивность. Этой методики очистки IgG следует избегать и лучше заменять его более мягкими методами (например, использовать Gentle Ag/Ab Elution Buffer фирмы “ThermoFischer Scientific”, см. https://www.thermofisher.com/order/ catalog/product/21004).
ПОЛИСПЕЦИФИЧНОСТЬ АНТИТЕЛ, ИНДУЦИРОВАННЫХ ГЕМОМ
Гем ‒ макроциклическое железосодержащее соединение, которое служит простетической группой многих белков, участвующих в транспорте газа, окислительном метаболизме и клеточной передаче сигналов. Также известно, что гем играет важную роль в клеточных процессах, таких как транскрипция, трансляция и клеточная дифференцировка. Однако присущая гему сильная окислительно-восстановительная активность несет определенную опасность, особенно при его высвобождении из белоксвязанного состояния. При многочисленных патологических состояниях, таких как гемолиз, ишемия‒реперфузионное повреждение, кровоизлияния, рабдомиолиз и т.д., большое количество гемсодержащих белков может попасть в кровоток. Вне клетки такие белки легко теряют свою простетическую группу. В плазме имеется несколько белков, таких как гемопексин и альбумин, которые участвуют в связывании свободного гема и тем самым предотвращают его токсичность. Однако при интенсивном высвобождении гемопротеинов гемпоглощающие белки могут достичь состояния насыщения, в результате чего концентрация свободного гема в плазме иногда превышает 20 мМ. В связи с тем, что иммуноглобулины относятся к одним из самых распространенных белков плазмы, они могут встретиться со свободным гемом в кровотоке. McIntyre и др. [18] показали, что воздействие гема на иммуноглобулины, полученные от здоровых людей, приводит к появлению новых активностей у антител: против фосфолипидов и многих других аутоантигенов. Авторы заметили, что выделенные от здоровых людей гемэкпонированные антитела связывались с фосфолипидами так же, как аутоантитела, выделенные от пациентов с антифосфолипидным синдромом. В дополнение к аутоантигенной активности, появляющейся у иммуноглобулинов после воздействия гема, у них обнаружили антибактериальную активность: против определенных бактериальных антигенов, а также против интактных бактерий [19]. Эффективное связывание с бактериальными антигенами гемэкспонированного IgG объясняет его способность инициировать опосредованное комплементом уничтожение бактерий. Опсонизация патогенов антителами с постсинтетически генерируемой реактивностью может индуцировать отложение фрагментов комплемента и приводить к их повышенной иммуногенности, как предлагалось ранее для “природных” полиреактивных антител. Следует заметить, что некоторые патогенные бактерии вызывают гемолиз, чтобы получить гем как жизненно важный железосодержащий фактор роста. Индукция новой, антибактериальной, специфичности у гемчувствительной фракции антител может представлять собой механизм задержки диссеминации гемолитических бактерий до тех пор, пока не включится адаптивный иммунный ответ.
Мы предполагаем, что при определенных патологиях гемопосредованная генерация новых антигенсвязывающих специфичностей может иметь пагубные последствия. Так, реперфузионный синдром представляет собой тяжелую воспалительную реакцию, приводящую к повреждению тканeй, опосредованную, главным образом, неправильной активацией системы комплемента. Недавно показано, что природные антитела ответственны за начальную активацию комплемента при ишемии–реперфузии. Начальная гипоксия и высвобождение АФК, гема и/или переходных окислительно-восстановительных металлов могут привести к повреждению клеток и появлению новых, скрытых ранее эпитопов (так называемых “криптантигенов”) на их поверхности. Их эпитопы затем распознаются циркулирующими природными антителами. Кластеризация антител на клеточной поверхности приводит к активации комплемента и последующему повреждению ткани. Нельзя исключить, что гем и АФК влияют не только на белки клеточной поверхности, но и на иммуноглобулины, присутствующие в кровяном русле. Таким образом, воздействие редокс-активных соединений, высвобождаемых во время ишемии, может привести к появлению новых антигенсвязывающих свойств у фракции локально циркулирующих антител. В результате эти антитела могут связаться с аутоантигенами клеточной поверхности с последующей активацией системы комплемента и повреждением тканей.
НЕОТЛОЖНАЯ ПОТРЕБНОСТЬ В НОВЫХ ТЕРАПЕВТИЧЕСКИХ ПОДХОДАХ ПРИ СЕПСИСЕ И ТЕРАПЕВТИЧЕСКИЙ ПОТЕНЦИАЛ ПРЕПАРАТОВ ИММУНОГЛОБУЛИНОВ С ДОПОЛНИТЕЛЬНО РАСШИРЕННОЙ ПОЛИСПЕЦИФИЧНОСТЬЮ
Сепсис развивается при тяжелом, генерализованном и неконтролируемом системном воспалении в ответ на вторжение патогенных микроорганизмов. Сепсис – основная причина смертности во всем мире. Только в США регистрируется более 750 000 случаев тяжелого сепсиса в год, причем более 210 000 заканчивается летальным исходом. Менее известно, что большая доля выживших пациентов теряет трудоспособность из-за иммунологических нарушений, когнитивных дисфункций различной тяжести, анемии и т.д. Более половины из них умирает в течение пяти лет [20‒22].
Недавно показано, что механизмы тяжелого травматического асептического воспалительного синдрома близки к таковым при сепсисе. Тяжелая травма приводит к высвобождению в кровоток ассоциированных с повреждением молекул (DAMP, ‘damage’-associated molecular patterns), таких как формилпептиды и митохондриальная ДНК, которые активируют врожденный иммунный ответ. Оба соединения активируют полиядерные нейтрофилы через формилпептидный рецертор-1 и Toll-подобный рецептор-9 (TLR9) [23]. При травме большое количество свободного гема часто попадает в кровоток, где связывается с рецепторами TLR4 и вызывает сильный провоспалительный ответ, сходный с эффектом бактериального LPS [24].
В настоящее время нет лекарственных препаратов для специфической терапии пациентов с сепсисом и синдромом асептического системного воспалительного ответа (SIRS). Даже введение моноклональных антител против отдельных провоспалительных молекул не влияет на выживаемость. Недавно у пациентов с SIRS обнаружена существенная модификацию паттернов экспрессии более 80% генов ‒ явление, которое авторы назвали “геномным штормом” [25]. Этот “геномный шторм” вполне может объяснить неудачу попыток улучшить исход заболевания путем нейтрализации отдельных провоспалительных медиаторов. Очевидно, на фоне множества одновременно действующих факторов, выборочная элиминация одного из них не имеет большого значения. Необходим терапевтический агент с широким нейтрализующим потенциалом, и IVIg ‒ неплохой кандидат на эту роль. Это полиспецифичные лекарственные средства, которые, как известно, нейтрализуют широкий спектр патогенов, а также их факторы вирулентности. Кроме того, препараты IVIg проявляют противовоспалительные и иммуномодулирующие свойства ‒ это давно задокументированный, хотя до сих пор недостаточно понятный, эффект. Тем не менее, эти препараты в их нынешнем виде пока не привели к существенным успехам в предотвращении смерти, связанной с сепсисом [26].
Список инфекционных заболеваний, при которых тяжелая генерализованная воспалительная реакция становится основным фактором повышенной смертности, неуклонно растет. Недавнее дополнение к нему ‒ грипп, вызываемый высокопатогенными штаммами вируса гриппа А (H1N1 в 1918 году и H5N1 на рубеже XX‒XXI вв.), а также некоторые геморагические лихорадки [27‒30].
ТЕРАПЕВТИЧЕСКИЕ ИММУНОГЛОБУЛИНЫ, МОДИФИЦИРОВАННЫЕ ПОД ДЕЙСТВИЕМ АКТИВАТОРОВ САМООКИСЛЕНИЯ, ЗАЩИЩАЮТ ОТ ЭКСПЕРИМЕНТАЛЬНОГО СЕПСИСА
Ранее показано, что антигенная полиспецифичность некоторых антител IgG расширяется под действием ионов двухвалентного железа или АФК, при этом они начинают связываться по крайней мере с одним провоспалительным цитокином [31]. Рециркуляция IgG in vivo через воспаленную ткань имеет тот же эффект [32]. IVIg, предварительно обработанные in vitro этим прооксидантом, использовали для пассивной иммунотерапии экспериментального сепсиса у мышей. Сепсис индуцировали инъекцией бактериального LPS, живых бактерий Escherichia coli, зимозана или пункцией и перевязкой слепой кишки. Однократная доза модифицированных препаратов, но не нативного, коммерчески доступного, IVIg, значительно повышала выживаемость животных во всех экспериментальных моделях сепсиса [33].
Механизмы наблюдаемой защитной активности IVIg, модифицированного воздействием ионов железа, подробно исследовали при системном воспалении, вызванном LPS. Его терапевтический эффект не был обусловлен более эффективной, чем у немодифицированного IVIg, нейтрализацией LPS и проявлялся даже при введении через 1 ч после LPS. Сывороточные уровни нескольких медиаторов воспаления снижались, IL-10 повышались, истощение по компоненту С3 комплемента снижалось и аномалии коагуляции были преодолены [33]. Обработка ионами двухвалентного железа индуцировала структурные изменения в антигенсвязывающем сайте молекул IgG, о чем свидетельствуют данные флуоресцентной спектроскопии, кинетического и термодинамического анализов. Эти изменения, по-видимому, не включали денатурацию, так как модифицированные препараты все еще соответствовали строгим требованиям фармакопеи для IVIg (Djoumerska-Aleksieva I. и соавт., рукопись в процессе подготовки). Мы предполагаем, что такой “улучшенный” IVIg будет эффективен при лечении сепсиса и других вариантов синдрома SIRS (например, посттравматического, птичьего гриппа и т.д.).
До настоящего времени точный механизм протективного действия IVIg с индуцированной полиспецифичностью был предметом различных гипотез. В связи с тем, что IVIg влияет на несколько систем, причем по-разному (например, на связывание FcR, на катаболизм эндогенного IgG, на идиотипические взаимодействия как с сывороточными иммуноглобулинами, так и с B-клеточными рецепторами, на связывание с многочисленными аутоантигенами с особым сродством к ряду цитокинов и мембранных рецепторов и т.д.), выбрать одну в качестве предпочтительной трудно. Тем не менее, мы обобщили известные факты и отдали предпочтение двум гипотезам. Одна из них такая же простая, механистическая и редукционистская, как любая гипотеза современной иммунологии, другая ‒ с оттенком философии, в лучших традициях европейской школы. Следует сразу сказать, что обе гипотезы (как, впрочем, и многие другие) не взаимоисключают друг друга.
Первая гипотеза основана на недавнем открытии Rauch и др. [34], что небольшая субпопуляция клеток B1, названная B1-активаторами врожденного ответа (innate response activator, IRA B1), у мышей мигрирует в селезенку, секретирует GM-CSF и контролирует цитокиновый шторм при сепсисе. Клетки B1 представляют собой не только природные поли/аутореактивные B-клетки, но также и основной источник идиотипически сопряженных антител. Интригующе звучит предположение о связи между полиспецифичностью и идиотипической “связностью” IVIg, ролью иммуноглобулинов как предпочтительных сывороточных аутоантигенов, являющихся мишенями для полиреактивных IVIg, и соответствующими свойствами клеток B1. Логично далее предположить, что клетки B1 могут быть предпочтительной клеточной мишенью идиотипических взаимодействий. Вот почему Rauch и соавт. указывают на возможный механизм контроля сепсиса препаратами IVIg с индуцированной полиспецифичностью. По нашим предварительным данным, действительно, клетки IRA B1, которые сами по себе хорошо связывают IVIg, гораздо эффективнее взаимодействуют с IVIg, у которых полиспецифичность, индукцирована ионами двухвалентного железа. Таким образом, возможно, что после контакта с Fe(II) IVIg оказываются нацелены на эту популяцию клеток, в том числе посредством идиотипических взаимодействий с В-клеточным рецептором, а в присуствии эндотоксина активируют и усиливают их функцию. Не исключено, что таким образом IVIg контролируют цитокиновый шторм при сепсисе. Эта гипотеза в настоящее время проверяется.
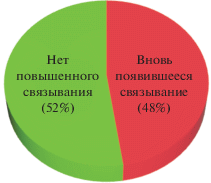
В то же время по результатам других экспериментов, проведенных в нашей лаборатории, следует, что, несмотря на снижение уровней воспалительных цитокинов при терапии Fe(II)-экспонированным IVIg, по сравнению с обработкой нативным IVIg, уровень IL-10 временно повышался. Оба эти эффекта имеют непосредственное отношение к течению сепсиса. Хотя увеличение IL-10 может быть напрямую связано с наблюдаемым взаимодействием IVIg с B1-клетками (не только IRA), а также с B-клетками маргинальной зоны в селезенке, снижение уровней IL-6 и TNF может быть обусловлено различными механизмами. Нам нравится тот, который 30 лет назад предложили Coutinho & Avrameas [35]. Они отводят важную роль полиспецифическому связыванию цитокинов в иммунорегуляторном действии природных антител. Эта блестящая и одновременно поразительно спекулятивная гипотеза не пользовалась большой популярностью, но хорошо объясняет наблюдаемые нами эффекты. Именно на этой гипотезе, с одной важной поправкой, строится наша основная концепция. Если естественная полиреактивность антител направлена на ограничение активности цитокинов, почему это не нарушает их сигнальную функцию? Возможно, в отличие от Fe(II)-экспонированного IVIg, “естественный буфер” цитокинового шторма содержит естественные полиспецифические антитела IgM, которые циркулируют только в плазме и ограничивают системное повышение уровней цитокинов, но не влияют на их локальную функцию в тканях. Природные антитела в основном относятся к изотипу IgM. Они продуцируются B1-клетками, и их репертуар прошел позитивный отбор по аутоантигенам в ходе внутриутробного развития. С другой стороны, антитела IgG в основном происходят из В2-клеток и их репертуар определяется на стадии строгого негативного отбора. Возможно, что буферная функция IgM ‒ это эволюционная адаптация, специфичная для репертуара, происходящего из B1-клеток, и служащая ограничению действия цитокинов в сосудистом русле, где воспалительные цитокины скорее вызывают проблемы, чем оказывают помощь. Неконтролируемое увеличение их содержания в сыворотке крови в значительной степени и представляет собой упомянутый “цитокиновый шторм”. Искусственно индуцируемая полиреактивность антител IgG, производимых В2-клетками, отчасти придает этому изотипу, предназначенному для проникновения в ткани, свойства, характерные для IgM (рис. 1). В физиологических условиях это было бы нежелательно, и эволюция помогла избежать такого развития событий. Однако во время сепсиса это представляется очень полезным.
Рис. 1.
IVIg, подвергшийся воздействию Fe(II), приобретает способность связываться почти с половиной всех протестированных случайно выбранных молекул, связанных с воспалением (см. [33]).
ИНДУЦИРОВАННАЯ ПОЛИСПЕЦИФИЧНОСТЬ АНТИТЕЛ, ИММУННАЯ РЕГУЛЯЦИЯ, ВРОЖДЕННЫЙ ИММУНИТЕТ И АУТОИММУНИТЕТ
Биологическая роль полиреактивных антител может не ограничиваться их вкладом в первую линию защиты от патогенов в преиммунном хозяине [36, 37]. Данные экспериментов как in vitro, так и in vivo, которые рассмотрены выше, показывают, что воспаление может увеличивать полиспецифичность некоторых циркулирующих антител IgG. Логично пойти дальше и предположить, что агрессивные молекулы, высвобождаемые в местах воспаления, могут также модифицировать структуру и, как следствие, антигенсвязывающие свойства поверхностных иммуноглобулиновых В-клеточнх рецепторов. Если эта модификация не сопровождается ухудшением жизнеспособности и долгосрочных шансов на выживание самих B-лимфоцитов, последствия могут быть далекоидущими. Появление новых, ранее “замаскированных”, специфичностей на мембранных В‑клеточных рецепторах приведет к активации В-лимфоцитов, которые в противном случае остаются неактивированными. Последующая пролиферация, клональный отбор, соматические гипермутации и созревание аффинности активированных В-клеток ‒ все это может привести к изменению репертуара локально доступных В-клеточных рецепторов, а также и циркулирующих антител, которые могут оказаться лучше адаптированы к контролю данной инфекции. Этот предполагаемый механизм, названный нами “редактированием специфичности”, может привести к быстрому и резкому увеличению спектра антигенов вторгающихся патогенов, которые распознаются циркулирующими антителами и локально присутствующими иммунными клетками. “Редактирование специфичности” некоторых В-клеточных рецепторов, в сочетании с одновременно происходящими событиями редактирования кодирующих их генов, приведет к быстрой генерации новых антигенсвязывающих специфичностей, которые сами по себе повысят эффективность защиты от ранее незнакомого дла иммуной системы микроорганизма. Специфичность распознавания вновь приобретенных антигенов непредсказуема. Она может быть направлена как против чужеродных, так и против аутоантигенов. Как мы предположили ранее, такое “редактирование специфичности”, вызванное воспалением, должно происходить вне первичных лимфоидных органов, то есть там, где процессы отрицательного отбора потенциально вредных аутореактивных клонов B-клеток не работают. Это может заложить основу для развития патологических аутоиммунных процессов и, таким образом, внести вклад в патогенетические механизмы, связывающие инфекции и аутоиммунитет [31, 38].
Ионы железа, АФК, гем и, возможно, другие агрессивные активаторы самоокисления, выделяющиеся в местах воспаления, травм и кровотечений, вполне могут оказывать влияние, которое выходит за рамки циркулирующих иммуноглобулинов и антигенсвязывающих клеточных рецепторов. Эти активаторы могут воздействовать на молекулярную структуру и специфичность связывания компонентов комплемента коагуляционных и фибринолитических каскадов, гормонов, факторов роста, цитокинов и их рецепторов, что приведет и к изменению их биологических свойств. Если это так, воспаление может оказывать сильное, ранее не предполагаемое, воздействие на поддержание антигенного гомеостаза и защитные механизмы организма.
Написание настоящего обзора не потребовало специального финансирования.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Cohn E.J., Oncley J.L., Strong L.E., Hughes W.L., Armstrong S.H. (1944) Chemical, clinical and immunological studies on the products of human plasma fractionation. I. The characterization of the protein fractions of human plasma. J. Clin. Invest. 23, 417–432.
Van Regenmortel M.H.V. (2014) Specificity, polyspecificity, and heterospecificity of antibody-antigen recognition. J. Mol. Recognit. 27, 627–639.
Dimitrov J. D., Planchais C., Roumenina L.T., Vassilev T.L., Kaveri S.V., Lacroix-Desmazes S. (2013) Antibody polyreactivity in health and disease: statu variabilis. J. Immunol. 191, 993–999.
Kanyavuz A., Marey-Jarossay A., Lacroix-Desmazes S., Dimitrov J.D. (2019) Breaking the law: unconventional strategies for antibody diversification. Nat. Rev. Immunol. doi 10.1038/s41577-019-0126-7
Jerne N.K. (1974) Clonal selection in a lymphocyte network. Soc. Gen. Physiol. Ser. 29, 39–48.
Rossi F., Dietrich G., Kazatchkine M.D. (1989) Antiidiotypic suppression of autoantibodies with normal polyspecific immunoglobulins. Res. Immunol. 140, 19–31.
Elnady B.M., Kamal N.M., Shaker R.H., Soliman A.F., Hasan W.A., Alghamdi H.A., Algethami M.M., Jajah M.B. (2016) Prevalence and clinical significance of nonorgan specific antibodies in patients with autoimmune thyroiditis as predictor markers for rheumatic diseases. Medicine (Baltimore). 95, e4336.
Perez E.E. Orange J.S., Bonilla F., Chinen J., Chinn I.K., Dorsey M., El-Gamal Y., Harville T.O., Hossny E., Mazer B., Nelson R., Secord E., Jordan S.C., Stiehm E.R., Vo A.A., Ballow M. (2017) Update on the use of immunoglobulin in human disease: a review of evidence. J. Allergy Clin. Immunol. 139, S1–S46.
Vassilenko S.M., Vassilev T.L., Bozadjiev L.G., Bineva I.L., Kazarov G.Z. (1990) Specific intravenous immunoglobulin for Crimean-Congo haemorrhagic fever. Lancet. 335, 791–792.
Hurez V., Kazatchkine M.D., Vassilev T., Ramanathan S., Pashov A., Basuyaux B., de Kozak Y., Bellon B., Kaveri S.V. (1997) Pooled normal human polyspecific IgM contains neutralizing anti-idiotypes to IgG autoantibodies of autoimmune patients and protects from experimental autoimmune disease. Blood. 90, 4004–4013.
Vassilev T., Mihaylova N., Voynova E., Nikolova M., Kazatchkine M., Kaveri S. (2006) IgM-enriched human intravenous immunoglobulin suppresses T lymphocyte functions in vitro and delays the activation of T lymphocytes in hu-SCID mice. Clin. Exp. Immunol. 145, 108–115.
Welte T., Dellinger R.P., Ebelt H., et al. (2018) Efficacy and safety of trimodulin, a novel polyclonal antibody preparation, in patients with severe community-acquired pneumonia: a randomized, placebo-controlled, double-blind, multicenter, phase II trial (CIGMA study). Intensive Care Med. 44, 438–448.
Longet S., Miled S., Lötscher M., Miescher S.M., Zuercher A.W., Corthésy B. (2013) Human plasma-derived polymeric IgA and IgM antibodies associate with secretory component to yield biologically active secretory-like antibodies. J. Biol. Chem. 288, 4085–4094.
Longet S., Vonarburg C., Lötscher M., Miescher S., Zuercher A., Corthésy B. (2014) Reconstituted human polyclonal plasma-derived secretory-like IgM and IgA maintain the barrier function of epithelial cells infected with an enteropathogen. J. Biol. Chem. 289, 21617–21626.
Bouvet J.P., Stahl D., Rose S., Quan C.P., Kazatchkine M.D., Kaveri S.V. (2001) Induction of natural autoantibody activity following treatment of human immunoglobulin with dissociating agents. J. Autoimmun. 16, 163–172.
Djoumerska-Alexieva I.K., Dimitrov J.D., Voynova E.N., Lacroix-Desmazes S., Kaveri S.V., Vassilev T.L. (2010) Exposure of IgG to an acidic environment results in molecular modifications and in enhanced protective activity in sepsis. FEBS J. 277, 3039–3050.
Djoumerska I., Tchorbanov A., Pashov A., Vassilev T. (2005) The autoreactivity of therapeutic intravenous immunoglobulin (IVIG) preparations depends on the fractionation methods used. Scand. J. Immunol. 61, 357–363.
McIntyre J.A., Faulk W.P. (2009) Redox-reactive autoantibodies: biochemistry, characterization, and specificities. Clin. Rev. Allergy Immunol. 37, 49–54.
Dimitrov J.D., Roumenina L.T., Doltchinkova V.R., Mihaylova N.M., Lacroix-Desmazes S., Kaveri S.V., Vassilev T.L. (2007) Antibodies use heme as a cofactor to extend their pathogen elimination activity and to acquire new effector functions. J. Biol. Chem. 282, 26696–26706.
Iwashyna T.J., Ely E.W., Smith D.M., Langa K.M. (2010) Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 304, 1787–1794.
Perl T.M., Dvorak L., Hwang T., Wenzel R.P. (1995) Long-term survival and function after suspected gram-negative sepsis. JAMA 274, 338–345.
Quartin A.A., Schein R.M., Kett D.H., Peduzzi P.N. (1997) Magnitude and duration of the effect of sepsis on survival. Department of veterans affairs systemic sepsis cooperative studies group. JAMA. 277, 1058–1063.
Zhang Q., Raoof M., Chen Y., Sumi Y., Sursal T., Junger W., Brohi K., Itagaki K., Hauser C.J. (2010) Circulating mitochondrial DAMPs cause inflammatory responses to injury. Nature. 464, 104–107.
Figueiredo R.T., Fernandez P.L., Mourao-Sa D.S., Porto B.N., Dutra F.F., Alves L.S., Oliveira M.F., Oliveira P.L., Graça-Souza A.V., Bozza M.T. (2007) Characterization of heme as activator of Toll-like receptor 4. J. Biol. Chem. 282, 20221–20229.
Xiao W., Mindrinos M.N., Seok J., et al.; Inflammation and Host Response to Injury Large-Scale Collaborative Research Program (2011) A genomic storm in critically injured humans. J. Exp. Med. 208, 2581–2590.
Soares M.O., Welton N.J., Harrison D.A., Peura P., Shankar- Hari M., Harvey S.E., Madan J.J., Ades A.E., Palmer S.J., Rowan K.M. (2012) An evaluation of the feasibility, cost and value of information of a multicentre randomised controlled trial of intravenous immunoglobulin for sepsis (severe sepsis and septic shock): incorporating a systematic review, meta-analysis and value of information analysis. Health Technol. Assess. 16, 1–186.
Rimmelzwaan G.F., van Riel D., Baars M., Bestebroer T.M., van Amerongen G., Fouchier R.A., Osterhaus A.D., Kuiken T. (2006) Influenza A virus (H5N1) infection in cats causes systemic disease with potential novel routes of virus spread within and between hosts. Am. J. Pathol. 168, 176–183; quiz 364.
Ignatyev G., Steinkasserer A., Streltsova M., Atrasheuskaya A., Agafonov A., Lubitz W. (2000) Expe-rimental study on the possibility of treatment of some hemorrhagic fevers. J. Biotechnol. 83, 67–76.
Atrasheuskaya A., Petzelbauer P., Fredeking T.M., Ignatyev G. (2003) Anti-TNF antibody treatment reduces mortality in experimental dengue virus infection. FEMS Immunol. Med. Microbiol. 35, 33–42.
Cheung C.Y., Poon L.L., Lau A.S., Luk W., Lau Y.L., Shortridge K.F., Gordon S., Guan Y., Peiris J.S. (2002) Induction of proinflammatory cytokines in human macrophages by influenza A (H5N1) viruses: a mechanism for the unusual severity of human disease? Lancet. 360, 1831–1837.
Dimitrov J.D., Ivanovska N.D., Lacroix-Desmazes S., Doltchinkova V.R., Kaveri S.V., Vassilev T.L. (2006) Ferrous ions and reactive oxygen species increase antigen-binding and anti-inflammatory activities of immunoglobulin G. J. Biol. Chem. 281, 439–446.
Mihaylova N.M., Dimitrov J.D., Djoumerska-Ale-xieva I.K., Vassilev T.L. (2008) Inflammation-induced enhancement of IgG immunoreactivity. Inflamm. Res. 57, 1–3.
Djoumerska-Alexieva I., Roumenina L., Pashov A., Dimitrov J., Hadzhieva M., Lindig S., Voynova E., Dimitrova P., Ivanovska N., Bockmeyer C., Stefanova Z., Fitting C., Bläss M., Claus R., von Gunten S., Kaveri S., Cavaillon J.M., Bauer M., Vassilev T. (2015) Intravenous immunoglobulin with enhanced polyspecificity improves survival in experimental sepsis and aseptic systemic inflammatory response syndromes. Mol. Med. 21(1), 1002‒1010.
Rauch P.J., Chudnovskiy A., Robbins C.S., Weber G.F., Etzrodt M., Hilgendorf I., Tiglao E., Figueiredo J.L., Iwamoto Y., Theurl I., Gorbatov R., Waring M.T., Chicoine A.T., Mouded M., Pittet M.J., Nahrendorf M., Weissleder R., Swirski F.K. (2012) Innate response activator B cells protect against microbial sepsis. Science. 335, 597‒601.
Coutinho A., Avrameas S. (1992) Speculations on immunosomatics: potential diagnostic and therapeutic value of immune homeostasis concepts. Scand. J. Immunol. 36, 527–532.
Ochsenbein A.F., Fehr T., Lutz C., Suter M., Brombacher F., Hengartner H., Zinkernagel R.M. (1999) Control of early viral and bacterial distribution and disease by natural antibodies. Science. 286, 2156–2159.
Gunti S., Notkins A.L. (2015) Polyreactive antibodies: function and quantification. J. Infect. Dis. 212(Suppl 1), S42‒46.
Sfriso P., Ghirardello A., Botsios C., Tonon M., Zen M., Bassi N., Bassetto F., Doria A. (2010) Infections and autoimmunity: the multifaceted relationship. J. Leukoc. Biol. 87, 385–395.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


