Молекулярная биология, 2019, T. 53, № 6, стр. 1049-1056
Влияние мутаций H6R и D7H на модулирование цинк-индуцированной агрегации амилоида-β гепарином
С. П. Радько a, b, *, С. А. Хмелёва b, Я. Ю. Киселёва c, С. А. Козин a, В. А. Митькевич a, А. А. Макаров a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
119121 Москва, Россия
c Российский научный центр рентгенорадиологии
117485 Москва, Россия
* E-mail: radkos@yandex.ru
Поступила в редакцию 14.01.2019
После доработки 30.01.2019
Принята к публикации 19.02.2019
Аннотация
Ионы цинка и гликозаминогликаны входят в состав амилоидных отложений и могут модулировать агрегацию β-амилоидного пептида (Аβ), которая рассматривается как ключевое событие в патогенезе болезни Альцгеймера. C помощью метода корреляционной спектроскопии исследовано влияние мутаций H6R и D7H в металлсвязывающем домене Аβ42 на модулирование цинк-индуцированной агрегации пептида таким гликозаминогликаном, как гепарин. Показано, что мутация H6R снижает, а D7H повышает способность Аβ42 к агрегации в присутствии ионов цинка. Также установлено, что мутация H6R снижает, а D7H усиливает модулирующий эффект гепарина. Различия во влиянии мутаций на модулирующий эффект гепарина связаны с координацией ионов цинка в металлсвязывающем домене мутантных пептидов. Это предполагает определяющую роль анион-связывающих сайтов, формируемых комплексами ионов цинка с металлсвязывающим доменом Аβ, во взаимодействии гепарина с цинк-индуцированными агрегатами пептида.
ВВЕДЕНИЕ
Болезнь Альцгеймера (БА) – прогрессирующее нейродегенеративное заболевание, затрагивающее десятки миллионов человек. Возникновение и развитие БА связывают, как правило, с переходом β-амилоидного пептида (Аβ) из мономерного состояния в агрегированное, что запускает цепь патогенных молекулярных событий [1]. Однако причины и молекулярные механизмы этого перехода остаются неясными. Предполагается, что агрегация Аβ может опосредоваться ионами цинка (Zn2+) [2, 3]. Действительно, in vivo процесс агрегации Аβ приводит к формированию в паренхиме головного мозга отложений Аβ, содержащих в значительном количестве цинк [4, 5]. Известно также, что Zn2+ вызывает быструю агрегацию Аβ in vitro [2, 3], которая включает две стадии – формирование высокомолекулярных олигомеров Аβ как первый шаг, и последующую ассоциацию этих олигомеров в крупные агрегаты микронного размера [6].
Наряду с Zn2+, в состав амилоидных отложений входят протеогликаны, содержащие такой полианионный компонент, как гликозаминогликаны (ГАГ) [7, 8]. In vivo агрегация Аβ происходит в окружении разнообразных природных полианионов, включая ГАГ. Способность ГАГ стимулировать самоагрегацию Аβ in vitro хорошо известна и подробно изучена (см., например, обзоры [9, 10]). Однако вопрос о том, каким образом ГАГ модулируют цинк-индуцированную агрегацию Аβ, изучен слабо, несмотря на особое место, которое Zn2+ может занимать в патогенезе БА [3, 11]. Известно, что такой ГАГ, как гепарин, способен дестабилизировать цинк-индуцированные агрегаты Аβ40 (Аβ длиной 40 а.о.) [12]. Недавно мы показали, что гепарин замедляет кинетику цинк-индуцированной агрегации изоформы Аβ длиной 42 а.о. (Аβ42,) in vitro, что проявляется в уменьшении скорости роста среднего размера агрегатов пептида [13]. Предполагается, что взаимодействие полимерных молекул гепарина с поверхностью растущих агрегатов, создающее стерическое препятствие для присоединения олигомеров Аβ42, является одним из факторов, определяющих замедление кинетики цинк-индуцированной агрегации пептида. Наиболее вероятно, что связывание происходит за счет многовалентного взаимодействия отрицательно заряженных сульфогрупп полимерной молекулы гепарина с анионсвязывающими сайтами на поверхности агрегатов Аβ42, которые формируются при образовании комплексов Zn2+ с металлсвязывающим доменом пептида (МСД, N-концевой участок Аβ, состоящий из а.о. 1–16) [13]. Интересно, что ранее, используя пептид Аβ16 как модель МСД Аβ, мы обнаружили противоположный эффект замен H6R и D7H (замены остатка гистидина в положении 6 полипептидной цепи на остаток аргинина и аспарагиновой кислоты в положении 7 на остаток гистидина, известные соответственно как “английская” [14] и “тайваньская” [15] мутации) на взаимодействие комплексов Zn2+-Аβ16 с рядом природных полианионов (оцДНК и такие ГАГ, как хондроитинсульфат) – первая замена подавляла, а вторая усиливала это взаимодействие [16, 17].
В представленной работе мы исследовали влияние аминокислотных замен H6R и D7H на цинк-индуцированную агрегацию полноразмерных пептидов в отсутствие и в присутствии такого распространенного ГАГ, как гепарин. Изучена роль взаимодействия гепарина с комплексами Zn2+-МСД Аβ в модуляции гепарином цинк-индуцированной агрегации Аβ42. Поскольку цинк-индуцированная агрегация Аβ не приводит к формированию хорошо выраженной β-структурной организации пептидов в составе агрегатов [2], в качестве меры агрегации использовали средний характеристический размер агрегатов, который оценивали методом корреляционной спектроскопии. Этот метод широко используется для мониторинга агрегации Аβ, в том числе для изучения цинк-индуцированной агрегации [18]. Нами впервые показано, что мутации H6R и D7H по-разному влияют на способность гепарина модулировать цинк-индуцированную агрегацию Аβ42. Полученные результаты указывают на определяющую роль взаимодействия гепарина с анионсвязывающими сайтами, которые формируются при образовании комплексов Zn2+-МСД, в модулирующем эффекте гепарина. Также показано, что мутация H6R снижает, а D7H повышает способность Аβ42 агрегировать под воздействием Zn2+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использованы синтетические пептиды Аβ42 (NH2-DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA-COOH), D7H-Аβ42 (NH2-DAEFRHHSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA-COOH), H6R-Аβ42 (NH2-DAEFRRDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA-COOH), Аβ16, D7H-Аβ16 и H6R-Аβ16 чистотой >95%, синтезированные компанией “Biopeptide” (США). Точечные мутации выделены жирным шрифтом. Пептиды Аβ16, D7H-Аβ16 и H6R-Аβ16 были ацетилированы и амидированы по N- и С-концам соответственно. Аминокислотные последовательности коротких пептидов соответствуют последовательностям МСД Аβ и его мутантных изоформ (подчеркнуты). Лиофилизированные пептиды хранили при –20°C. Гепарин из слизистой оболочки кишок свиней приобретен в компании “Sigma-Aldrich” (США). Остальные реактивы, приобретенные в компаниях “Acros Organics” (Бельгия) и “Sigma-Aldrich”, имели чистоту, соответствующую квалификации х.ч. или выше. Для приготовления растворов использовали деионизованную воду (diH2O), полученную на установке Milli-Q (“Millipore”, США). diH2O и буферные растворы перед использованием пропускали через фильтр с размером пор 0.22 мкм (“Millipore”).
Приготовление растворов гепарина и пептидов. Растворы гепарина требуемой концентрации в буфере А (10 мМ HEPES, 50 мM NaCl, pH 6.8) готовили, смешивая концентраты буфера А и стоковый раствор гепарина в diH2O. Стоковый раствор гепарина концентрацией 10 мг/мл готовили гравиметрическим способом.
Лиофилизаты полноразмерных пептидов для приготовления их растворов растворяли в гексафторизопропаноле в концентрации 3 мг/мл в течение 30 мин при 37°С. Аликвоты раствора высушивали в вакуумном испарителе Vacufuge 5301 (“Eppendorf”, Германия) и хранили при –20°C до использования. Для получения водных растворов пептиды Аβ42, D7H-Аβ42 и H6R-Аβ42, обработанные гексафторизопропанолом, растворяли в диметилсульфоксиде в концентрации 3 мМ. Раствор разводили diH2O до конечной концентрации пептидов 100 мкМ и хранили во льду. Раствор использовали в течение 3 ч.
Для получения цинк-индуцированных агрегатов пептидов растворы разводили концентратом буфера A, после чего концентрацию пептида доводили до 50 мкМ, добавляя буфер A или раствор гепарина. Инкубировали при комнатной температуре в течение 15 мин и добавляли равный объем буфера А, содержащего/не содержащего хлорид цинка. Размер агрегатов пептидов определяли через 10 мин после добавления Zn2+. Конечная концентрация пептида в пробе составляла 25 мкМ, весовое отношение пептид : гепарин = = 1 : 1 (110 мкг/мл гепарина), а концентрация Zn2+ варьировала в диапазоне от 1.6 до 150 мкМ.
Пептиды Аβ16, D7H-Аβ16 и H6R-Аβ42 растворяли в diH2O. Концентрацию пептидов определяли спектрофотометрическим методом, основываясь на значении коэффициента молярной экстинкции тирозина ԑ276 = 1450 М–1 см–1. Растворы пептидов разводили концентратом буфера А, содержащего/ не содержащего хлорид цинка, и смешивали с раствором гепарина в буфере А, содержащем Zn2+ в такой же концентрации. Конечная концентрация пептидов составляла 150 мкМ.
Корреляционная спектроскопия и турбидиметрия. Размер цинк-индуцированных агрегатов пептидов Аβ42, D7H-Аβ42 и H6R-Аβ42 определяли методом корреляционной спектроскопии, используя анализатор размера частиц Zetasizer Nano ZS (“Malvern Instruments”, Великобритания), позволяющий измерять диаметр частиц в диапазоне от 0.6 нм до 10 мкм. Измерения проводили при температуре 25°С согласно [19]. Метод корреляционной спектроскопии основан на определении коэффициента диффузии дисперсных частиц в жидкости путем анализа корреляционной функции флуктуаций интенсивности рассеянного света. Форма частицы аппроксимируется сферой, и ее гидродинамический радиус (диаметр) определяется по формуле Стокса–Эйнштейна. Программное обеспечение анализатора Zetasizer Nano ZS позволяет получить распределение частиц в полидисперсной популяции по размеру и определить значение среднего диаметра частиц в популяции.
Мутность растворов Аβ16, D7H-Аβ16 и H6R-Аβ42 в присутствии различных концентраций цинка и гепарина измеряли на спектрофотометре HP-8453 (“Agilent”, США), определяя их оптическую плотность на длине волны 405 нм через 10 мин после добавления раствора, содержащего гепарин.
Определение концентрации цинкона и комплексов цинкон-цинк. В 1 мл diH2O растворяли 1 мг цинкона (2-карбокси-2-окси-5-сульфоформазилбензол). Концентрацию цинкона в растворе контролировали спектрофотометрически, используя значение коэффициента молярной экстинкции ε488 = 26900 М–1 см–1 [20]. Концентрацию комплексов цинкон-цинк ([Zi-Zn]) в присутствии и в отсутствие пептидов в буфере А определяли по величине оптического поглощения растворов на 620 нм, основываясь на значении коэффициента молярной экстинкции ε620 = = 25 050 М–1 см–1 [20].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Зависимости среднего диаметра цинк-индуцированных агрегатов пептидов Аβ42, D7H-Аβ42 и H6R-Аβ42 от концентрации Zn2+ представлены на рис. 1. Очевидно, что в случае Аβ42 и H6R-Аβ42 зависимости имеют сигмоидный характер. При проведении сравнительных исследований все три экспериментальные зависимости были аппроксимированы методом наименьших квадратов с использованием сигмоидной кривой, описываемой уравнением:
(1)
$D = {{{{D}_{{{\text{max}}}}}} \mathord{\left/ {\vphantom {{{{D}_{{{\text{max}}}}}} {(1 + {{e}^{{{{ - (C - \,{{C}_{{1{\text{/}}2}}})} \mathord{\left/ {\vphantom {{ - (C - \,{{C}_{{1{\text{/}}2}}})} k}} \right. \kern-0em} k}}}})}}} \right. \kern-0em} {(1 + {{e}^{{{{ - (C - \,{{C}_{{1{\text{/}}2}}})} \mathord{\left/ {\vphantom {{ - (C - \,{{C}_{{1{\text{/}}2}}})} k}} \right. \kern-0em} k}}}})}},$Рис. 1.
Зависимость среднего диаметра цинк-индуцированных агрегатов Аβ42 и его изоформ от концентрации Zn2+ в растворе. Кривые 1, 2 и 3 – Аβ42, H6R-Аβ42 и D7H-Аβ42 соответственно. Буфер А; концентрация пептидов – 25 мкМ. Показаны средние арифметические значения и стандартные отклонения для трех измерений.
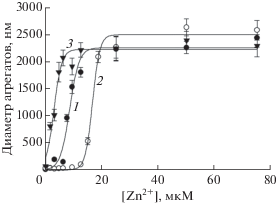
Таблица 1.
Значения максимального диаметра (Dmax) и концентраций ионов цинка (С1/2), при которых средний диаметр цинк-индуцированных агрегатов Аβ42, D7H-Аβ42 и H6R-Аβ42 достигает половины значения Dmax в отсутствие и в присутствии гепарина (110 мкг/мл)
| Гепарин | Пептид | С1/2, мкМ | Dmax, нм |
|---|---|---|---|
| В отсутствие гепарина |
Аβ42 | 8.5 ± 0.4 | 2255 ± 70 |
| H6R-Аβ42 | 16.6 ± 0.2 | 2495 ± 43 | |
| D7H-Аβ42 | 3.0 ± 0.3 | 2225 ± 57 | |
| В присутствии гепарина |
Аβ42 | 52 ± 15 | 1639 ± 286 |
| H6R-Аβ42 | 42 ± 3 | 2253 ± 155 | |
| D7H-Аβ42 | 1.2 ± 0.5 | 950 ± 37 |
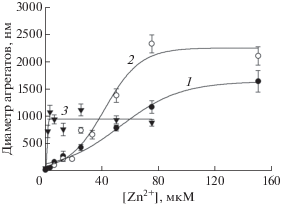
На рис. 2 представлены зависимости среднего диаметра цинк-индуцированных агрегатов пептидов Аβ42, D7H-Аβ42 и H6R-Аβ42 от концентрации Zn2+ в присутствии гепарина (весовое соотношение пептид : гепарин = 1 : 1). При проведении сравнительных исследований экспериментальные зависимости, полученные в присутствии гепарина, также аппроксимировали сигмоидной кривой (уравнение 1), как описано выше. Видно, что присутствие гепарина в равном весовом соотношении с пептидом Аβ42 (рис. 2) приводит к сдвигу зависимости размера агрегатов в область более высоких концентраций Zn2+ (величина С1/2 возрастала более чем в 6 раз, табл. 1), при этом значение Dmax также меняется, хотя и не столь значительно (Dmax уменьшался менее чем в 1.5 раза, табл. 1). Мутация H6R приводила к меньшему сдвигу зависимости диаметра агрегатов от концентрации Zn2+ под влиянием гепарина: С1/2 увеличивалась в 2.5 раза, при этом конечный диаметр агрегатов практически совпадал (табл. 1 и рис. 2). Мутация D7H более чем в 2 раза меняет значение Dmax в присутствии гепарина (950 vs. 2225 нм, табл. 1), а также приблизительно в 2 раза уменьшает значение С1/2 (табл. 1).
Рис. 2.
Влияние гепарина на зависимость среднего диаметра цинк-индуцированных агрегатов Аβ42 и его изоформ от концентрации Zn2+ в растворе. Кривые 1, 2 и 3 – Аβ42, H6R-Аβ42 и D7H-Аβ42 соответственно. Буфер А; концентрации гепарина и пептидов – 110 мкг/мл и 25 мкМ соответственно (весовое соотношение гепарин/пептид = 1 : 1). Показаны средние арифметические значения и стандартные отклонения для трех измерений.
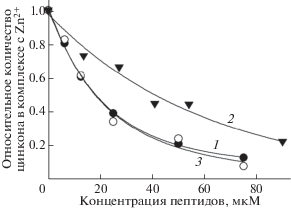
На рис. 3 представлено относительное количество комплексов Zi-Zn в растворе, содержащем 60 мкМ цинкона и 30 мкМ Zn2+, при разных концентрациях Аβ42 и его мутантных форм. Видно, что для связывания одинакового количества Zn2+ в присутствии цинкона концентрация H6R-Аβ42 должна быть практически в 2 раза выше, чем в случае Аβ42, тогда как у Аβ42 и D7H-Аβ42 зависимости практически одинаковы.
Рис. 3.
Зависимость относительного количества цинкона в комплексе с Zn2+ от концентрации пептида. Буфер А; концентрации цинкона и Zn2+ – 60 и 30 мкМ соответственно. Кривые 1, 2 и 3 – Аβ42, H6R-Аβ42 и D7H-Аβ42 соответственно.
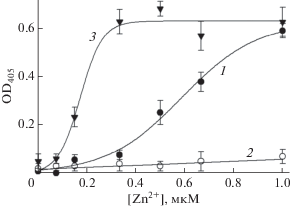
Ранее мы показали [13], что в присутствии Zn2+ (1 мМ) гепарин вызывает агрегацию пептида Аβ16, что проявлялось в помутнении смесей пептид-цинк-гепарин. Мутность смесей резко возрастала и выходила на плато при концентрации гепарина ≈10 мкг/мл [13]. Добавление Zn2+ в растворы пептидов Аβ16 и D7H-Аβ16, содержащих гепарин в концентрации 10 мкг/мл, также приводило к увеличению их оптической плотности, причем мутность раствора пептида D7H-Аβ16 возрастала гораздо быстрее, выходя на насыщение при концентрации цинка ≈350 мкМ (рис. 4). Ни цинк, ни гепарин, взятые отдельно в использованных концентрациях, не вызывали помутнения раствора пептидов. Агрегация комплексов Zn2+ с Аβ16 и D7H-Аβ16 однозначно указывает на их взаимодействие с молекулами гепарина, причем в случае D7H-Аβ16 это взаимодействие проявляется при более низких концентрациях Zn2+. В отличие от пептидов Аβ16 и D7H-Аβ16 растворы H6R-Аβ16 практически не мутнели при добавлении Zn2+ в присутствии гепарина (рис. 4).
Рис. 4.
Зависимость мутности (оптическая плотность на длине волны 405 нм) растворов Аβ16, H6R-Аβ16 и D7H-Аβ16 от концентрации Zn2+ в присутствии гепарина (10 мкг/мл). Кривые 1, 2 и 3 – Аβ16, H6R-Аβ16 и D7H-Аβ16 соответственно. Буфер А; концентрация пептидов – 150 мкМ. Показаны средние арифметические значения и стандартные отклонения для трех измерений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На сегодняшний день предложено два механизма цинк-индуцированной олигомеризации Аβ, в рамках которых олигомеризация может инициироваться либо межмолекулярным, либо внутримолекулярным связыванием Zn2+ с Аβ [21–23]. Предполагается, что в первом случае олигомеризация Аβ происходит через образование “цинковых мостиков”, где каждый ион цинка в комплексе с пептидами координирован парами аминокислотных остатков Н6/Н13 или Н14/Е11 двух пептидов [21], а во втором – через структурную реорганизацию С-концевого участка пептида (вызванную структурированием МСД при координации Zn2+), которая усиливает склонность пептида к агрегации [22, 23]. Возможно, что эти два механизма не исключают, а дополняют друг друга. Цинк-индуцированная олигомеризация Аβ, по-видимому, определяет первую (быструю, менее 1 мин в условиях in vitro) фазу агрегации, после которой наступает вторая фаза, в которой происходит относительно медленная ассоциация сформированных высокомолекулярных олигомеров в большие (диаметром 1–2 мкм) агрегаты Аβ [6]. Следует отметить, что МСД Аβ не имеет упорядоченной пространственной структуры в водных растворах при рН ~ 7, но приобретает ее при координации Zn2+ [24]. Это приводит к неравномерному распределению плотности положительного заряда и формированию анионсвязывающего сайта [16, 24]. Структура сайта может различаться у разных изоформ Аβ, что проявляется в различной эффективности взаимодействия природных полианионов с соответствующими изоформами пептида Аβ16 в комплексе с Zn2+ [16].
Изучение формирования мономерных комплексов Zn2+-Аβ16 показало, что Zn2+ координирован в МСД Аβ остатками гистидина (Н6, Н13 и Н14) и глутаминовой кислоты (Е11) [25]. В отсутствие Н6, как в случае мутации H6R, координационная сфера не может быть завершена, что должно приводить к формированию менее стабильного комплекса. Известно также, что замена H6R вызывает образование димеров Zn2+-(H6R-Аβ16)2, неспособных к последующей олигомеризации через “цинковые мостики” из-за дефектности пары Н6/Н13 [21]. Следует отметить, что отсутствие Н6 может быть компенсировано другими аминокислотными остатками (такими, как D1, E3, D7), которые потенциально могут участвовать в координации Zn2+, хотя и с меньшей эффективностью [26]. Таким образом, наблюдаемое нами двукратное увеличение концентрации Zn2+, требуемой для формирования цинк-индуцированных агрегатов H6R-Аβ42, сопоставимых по размеру с агрегатами Аβ42 на момент измерения (рис. 1 и табл. 1), по-видимому, связано с меньшей стабильностью комплексов H6R-Аβ42 с Zn2+ в сравнении с Аβ42. Это предположение поддерживается тем, что для связывания одинакового количества Zn2+ в присутствии цинкона концентрация H6R-Аβ42 должна быть практически в 2 раза выше, чем в случае Аβ42 (рис. 3).
Мутация H6R “смягчает” влияние гепарина на цинк-индуцированную агрегацию: относительный сдвиг зависимости размера агрегатов H6R-Аβ42 от концентрации Zn2+ меньше, чем у Аβ42, и они успевают достигнуть максимальных размеров при высоких концентрациях цинка (кривые 1 и 2, рис. 1 vs. рис. 2 и табл. 1). В рамках предложенного нами ранее механизма ингибирования гепарином цинк-индуцированной агрегации Аβ [13] через мультивалентное взаимодействие отрицательно заряженных полимеров гепарина с анионсвязывающими сайтами на поверхности агрегатов – “смягчение” модулирующего эффекта гепарина указывает на то, что он связывается с цинк-индуцированными агрегатами H6R-Аβ42 менее эффективно, чем с агрегатами Аβ42. Действительно, эффективность мультивалентного взаимодействия определяется эффективностью взаимодействия сульфогрупп гепарина с отдельными анионсвязывающими сайтами на поверхности агрегата. Как видно из рис. 4, гепарин не взаимодействует с H6R-Аβ16 в присутствии Zn2+ в использованных условиях, вероятно, в силу недостаточной стабильности комплекса Zn2+-(H6R-Аβ16) в сравнении с интактным Аβ16, Значение Kd такого комплекса в 7 раз выше [25, 27]. Очевидно, комплексы Zn2+ с H6R-Аβ42, экспонированные на поверхности цинк-индуцированного агрегата (а, следовательно, и анионсвязывающие сайты, формируемые координацией цинка в МСД пептида), будут также характеризоваться низкой стабильностью (при этом сами пептиды могут удерживаться в составе агрегата в силу дополнительных взаимодействий между их С-концевыми доменами). Снижение стабильности анионсвязывающих сайтов в цинк-индуцированных агрегатах H6R-Аβ42 в сравнении с агрегатами Аβ42 должно уменьшить эффективность связывания гепарина, что может объяснить различия во влиянии гепарина на характер цинк-индуцированной агрегации пептидов H6R-Аβ42 и Аβ42.
В отличие от H6R, замена D7H не приводила к видимому изменению сродства Zn2+ к Аβ (рис. 3), но, тем не менее, существенно сказывалась на цинк-индуцированной агрегации пептида (кривая 1 vs. кривой 3, рис. 2). Известно, что такая замена может значительно изменить характер связывания Zn2+ с пептидом. Действительно, как мы недавно показали [28], фрагменты 1–7 или 1–10 МСД Аβ с аминокислотной заменой D7H формируют стабильные димеры в присутствии Zn2+, в которых не один, а два иона цинка координированы остатками D1, E3, H6 и H7 двух пептидов. Можно предположить, что такая координация Zn2+ в МСД с мутацией D7H стимулирует более эффективную олигомеризацию D7H-Аβ42 и/или ассоциацию олигомеров пептида в агрегаты микронного размера, сдвигая таким образом зависимость размера агрегатов в область более низких значений концентраций цинка (рис. 1 и табл. 1).
Формальный анализ влияния замены D7H на модуляцию цинк-индуцированной агрегации Аβ гепарином показывает, что эта замена имеет двоякий эффект. С одной стороны, величина Dmax для D7H-Аβ42 существенно ниже в присутствии гепарина, чем в его отсутствие. С другой стороны, зависимость сдвигается в область более низких значений концентрации Zn2+ под воздействием гепарина, если судить по значениям С1/2, в противоположность влиянию гепарина на цинк-индуцированную агрегацию Аβ42 (табл. 1). Однако снижение С1/2 может быть артефактом, связанным с выбранным способом обработки экспериментальных данных. Действительно, в присутствии гепарина размер агрегатов D7H-Аβ42 фактически перестает меняться как функция концентрации Zn2+, начиная с 3 мкМ (рис. 2), что формально проявляется как сдвиг С1/2 в сторону меньшего значения при аппроксимации экспериментальной зависимости сигмоидной кривой. Тем не менее, существенная разница в размерах агрегатов D7H-Аβ42 (достигнутых ко времени измерения) в присутствии и в отсутствие гепарина, наблюдаемая в интервале концентраций Zn2+ от ≈6 до 75 мкМ, не вызывает сомнений (кривая 3, рис. 1 vs. рис. 2). Очевидно, она отражает более эффективное связывание отрицательно заряженных полимеров гепарина с поверхностью цинк-индуцированных агрегатов D7H-Аβ42 в сравнении с Аβ42. Наиболее вероятная причина этого – другая структурная организация комплекса Zn2+ с МСД в случае D7H-Аβ42. Действительно, координация двух ионов цинка вместо одного должна привести к более высокой локальной плотности положительного заряда, тем самым усиливая взаимодействие каждого отдельного анионсвязывающего сайта на поверхности агрегатов D7H-Аβ42 с сульфогруппами гепарина. Это предположение находится в согласии с наблюдаемым нами более выраженным взаимодействием гепарина с D7H-Аβ16 в присутствии Zn2+ (рис. 4).
Таким образом, в представленной работе впервые показано, что аминокислотные замены H6R и D7H, известные как “английская” и “тайваньская” мутации, по-разному влияют на модулирующий эффект гепарина на цинк-индуцированную агрегацию Аβ. Эти различия могут быть объяснены различиями в координации Zn2+ при его связывании с МСД исследованных изоформ Аβ42, что подчеркивает определяющую роль анионсвязывающих сайтов, формируемых комплексами Zn2+-МСД Аβ, во взаимодействии гепарина с цинк-индуцированными агрегатами пептида.
В работе использовано оборудование ЦКП “Протеом человека” (ИБМХ).
Работа выполнена при финансовой поддержке программы Президиума Российской академии наук “Фундаментальные исследования для биомедицинских технологий”.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Haass C., Selkoe D.J. (2007) Soluble protein oligomers in neurodegeneration: Lessons from the Alzheimer’s amyloid β-peptide. Nat. Rev. Mol. Cell. Biol. 8, 101–112.
Faller P., Hureau C., Berthoumieu O. (2013) Role of metal ions in the self-assembly of the Alzheimer’s amyloid-β peptide. Inorg. Chem. 52, 12193–12206.
Куликова А.А., Макаров А.А., Козин С.А. (2015) Роль ионов цинка и структурного полиморфизма β-амилоида в инициации болезни Альцгеймера. Молекуляр. биология. 49, 249–263.
Lovell M.A., Robertson J.D., Teesdale W.J., Campbell J.L., Markesbery W.R. (1998) Copper, iron and zinc in Alzheimer’s disease senile plaques. J. Neurol. Sci. 158, 47–52.
Miller L.M., Wang Q., Telivala T.P., Smith R.J., Lanzirotti A., Miklossy J. (2006) Synchrotron-based infrared and x-ray imaging shows focalized accumulation of Cu and Zn co-localized with β-amyloid deposits in Alzheimer’s disease. J. Struct. Biol. 155, 30–37.
Suprun E.V., Radko S.P., Kozin S.A., Mitkevich V.A., Makarov A.A. (2018) Electrochemical detection of Zn(II)-induced amyloid-β aggregation: insights into aggregation mechanisms. J. Electroanal. Chem. 830–831, 34–42.
O’Callaghan P., Sandwall E., Li J.P., Yu H., Ravid R., Guan Z.Z., van Kuppevelt T.H., Nilsson L.N., Ingelsson M., Hyman B.T., Kalimo H., Lindahl U., Lannfelt L., Zhang X. (2008) Heparan sulfate accumulation with Aβ deposits in Alzheimer’s disease and Tg2576 mice is contributed by glial cells. Brain Pathol. 18, 548–561.
Bruinsma I.B., te Riet L., Gevers T., ten Dam G.B., van Kuppevelt T.H., David G., Kusters B., de Waal R.M., Verbeek M.M. (2010) Sulfation of heparan sulfate associated with amyloid-β plaques in patients with Alzheimer’s disease. Acta Neuropathol. 119, 211–220.
Ariga T., Miyatake T., Yu R.K. (2010) Role of proteoglycans and glycosaminoglycans in the pathogenesis of Alzheimer’s disease and related disorders: amyloidogenesis and therapeutic strategies – a review. J. Neurosci. Res. 88, 2303–2315.
Bergamaschini L., Rossi E., Vergani C., De Simoni M.G. (2009) Alzheimer’s disease: another target for heparin therapy. Sci. World J. 9, 891–908.
Bush A.I., Tanzi R.E. (2008) Therapeutics for Alzheimer’s disease based on the metal hypothesis. Neurotherapeutics. 5, 421–432.
Yoshiike Y., Tanemura K., Murayama O., Akagi T., Murayama M., Sato S., Sun X., Tanaka N., Takashima A. (2001) New insights on how metals disrupt amyloid β-aggregation and their effects on amyloid-β cytotoxicity. J. Biol. Chem. 276, 32293–32299.
Radko S.P., Khmeleva S.A., Mantsyzov A.B., Kiseleva Y.Y., Mitkevich V.A., Kozin S.A., Makarov A.A. (2018) Heparin modulates the kinetics of zinc-induced aggregation of amyloid-β peptides. J. Alzheimers Dis. 63, 539–550.
Janssen J.C., Beck J.A., Campbell T.A., Dickinson A., Fox N.C., Harvey R.J., Houlden H., Rossor M.N., Collinge J. (2003) Early onset familial Alzheimer’s disease: mutation frequency in 31 families. Neurology. 60, 235–239.
Chen W.T., Hong C.J., Lin Y.T., Chang W.H., Huang H.T., Liao J.Y., Chang Y.J., Hsieh Y.F., Cheng C.Y., Liu H.C., Chen Y.R., Cheng I.H. (2012) Amyloid-β (Aβ) D7H mutation increases oligomeric Aβ42 and alters properties of Aβ-zinc/copper assemblies. PLoS One. 7, e35807.
Хмелёва С.А., Мезенцев Ю.В., Козин С.А., Митькевич В.А., Медведев А.Е., Иванов А.С., Бодоев Н.В., Макаров А.А., Радько С.П. (2015) Влияние мутаций и модификаций аминокислотных остатков на цинкиндуцированное взаимодействие металлсвязывающего домена β-амилоида с ДНК. Молекуляр. биология. 49, 507–514.
Хмелёва С.А., Козин С.А., Киселёва Я.Ю., Митькевич В.А., Макаров А.А., Радько С.П. (2016) Цинк-индуцированное взаимодействие металл-связывающего домена β-амилоида с нуклеиновыми кислотами и гликозаминогликанами. Молекуляр. биология. 50, 1049–1052.
Радько С.П., Хмелёва С.А., Супрун Е.В., Козин С.А., Бодоев Н.В., Макаров А.А., Арчаков А.И., Шумянцева В.В. (2015) Физико-химические методы исследования агрегации β-амилоида. Биомед. химия. 61, 203–218.
Suprun E.V., Khmeleva S.A., Kiseleva Y.Y., Radko S.P., Archakov A.I., Shumyantseva V.V. (2016) Quantitative aspects of electrochemical detection of amyloid-β aggregation. Electroanalysis. 28, 1977–1983.
Sabel C.E., Neureuther J.M., Siemann S. (2010) A spectrophotometric method for the determination of zinc, copper, and cobalt ions in metalloproteins using zincon. Anal. Biochem. 397, 218–226.
Istrate A.N., Kozin S.A., Zhokhov S.S., Mantsyzov A.B., Kechko O.I., Pastore A., Makarov A.A., Polshakov V.I. (2016) Interplay of histidine residues of the Alzheimer’s disease Aβ peptide governs its Zn-induced oligomerization. Sci. Rep. 6, 21734.
Olofsson A., Lindhagen-Persson M., Vestling M., Sauer-Eriksson A.E., Ohman A. (2009) Quenched hydrogen/deuterium exchange NMR characterization of amyloid-β peptide aggregates formed in the presence of Cu2+ or Zn2+. FEBS J. 276, 4051–4060.
Lim K.H., Kim Y.K., Chang Y.T. (2007) Investigations of the molecular mechanism of metal-induced Aβ (1–40) amyloidogenesis. Biochemistry. 46, 13523–13532.
Zirah S., Kozin S.A., Mazur A.K., Blond A., Cheminant M., Segalas-Milazzo I., Debey P., Rebuffat S. (2006) Structural changes of region 1–16 of the Alzheimer disease amyloid β-peptide upon zinc binding and in vitro aging. J. Biol. Chem. 281, 2151–2161.
Tsvetkov P.O., Kulikova A.A., Golovin A.V., Tkachev Y.V., Archakov A.I., Kozin S.A., Makarov A.A. (2010) Minimal Zn2+ binding site of amyloid-β. Biophys. J. 99, L84–L86.
Miller Y., Ma B., Nussinov R. (2012) Metal binding sites in amyloid oligomers: complexes and mechanisms. Coord. Chem. Rev. 256, 2245–2252.
Kozin S.A., Kulikova A.A., Istrate A.N., Tsvetkov P.O., Zhokhov S.S., Mezentsev Y.V., Kechko O.I., Ivanov A.S., Polshakov V.I., Makarov A.A. (2015) The English (H6R) familial Alzheimer’s disease mutation facilitates zinc-induced dimerization of the amyloid-β metal-binding domain. Metallomics. 7, 422–425.
Polshakov V.I., Mantsyzov A.B., Kozin S.A., Adzhubei A.A., Zhokhov S.S., van Beek W., Kulikova A.A., Indeykina M.I., Mitkevich V.A., Makarov A.A. (2017) A binuclear zinc interaction fold discovered in the homodimer of Alzheimer’s amyloid-β fragment with Taiwanese mutation D7H. Angew. Chem. Int. Ed. Engl. 56, 11734–11739.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


