Молекулярная биология, 2020, T. 54, № 1, стр. 137-145
Биотехнологический потенциал штамма Bacillus subtilis 20
Д. С. Карпов a, *, А. И. Домашин b, М. И. Котлов a, П. Д. Осипова a, С. В. Киселева a, Т. А. Серегина a, А. В. Гончаренко c, А. С. Миронов a, В. Л. Карпов a, С. В. Поддубко b
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Институт медико-биологических проблем Российской академии наук
123007 Москва, Россия
c Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
* E-mail: aleom@yandex.ru
Поступила в редакцию 14.06.2019
После доработки 22.06.2019
Принята к публикации 25.06.2019
Аннотация
Бактерии Bacillus subtilis имеют большое значение в ветеринарии, медицине и биотехнологии, а постоянно растущая потребность в продуктах биотехнологии заставляет совершенствовать свойства биотехнологических штаммов. Штаммы B. subtilis с улучшенными характеристиками могут быть получены с помощью рационального дизайна, технологий направленной эволюции, а также найдены среди новых штаммов. В ходе многолетних исследований состава микробиома российского сегмента международной космической станции выделен штамм B. subtilis 20, обладающий способностью к быстрому росту, накоплению большой биомассы и повышенной устойчивостью к закислению среды по сравнению с “земным” штаммом B. subtilis 168. Более того, B. subtilis 20 сверхустойчив к действию факторов, повреждающих белки и ДНК, что ассоциировано со сверхэкспрессией генов, отвечающих за репарацию ДНК, продукцию сероводорода и нейтрализацию активных форм кислорода. Выявленные характеристики B. subtilis 20 указывают на его значительный потенциал как перспективного штамма-продуцента биологически активных соединений.
ВВЕДЕНИЕ
Грамположительная бактерия Bacillus subtilis считается практически безопасной для человека. B. subtilis обладает мощной системой внеклеточной секреции белков и не выделяет каких-либо токсичных побочных продуктов метаболизма. Благодаря этим особенностям штаммы B. subtilis используются в ветеринарии, медицине и различных отраслях промышленности как пробиотики, сверхпродуценты иммуноактивных факторов, ферментов, аминокислот и витаминов [1, 2]. Учитывая большую значимость B. subtilis в биотехнологии, значительные усилия направлены как на изучение, так и на разработку способов контроля и изменений метаболизма, экспрессии генов и активности белков этой бактерии [2‒4].
Другим потенциальным источником биотехнологически значимых штаммов B. subtilis могут быть штаммы, обитающие в экстремальных условиях [5, 6]. Примером такой среды могут служить космические летательные аппараты. На орбите международной космической станции (МКС) ослаблено действие факторов, защищающих земные организмы от космического и солнечного излучения, что приводит к повышению уровня факторов, повреждающих наследственный материал всех обитателей станции [7]. Кроме того, наблюдается недостаток питательных веществ [8], а поверхности периодически подвергаются обработке антимикробными и спороцидными реагентами [9]. Однако микробы заселяют космические станции несмотря на действие этих факторов, а также на меры предосторожности и повышенные требования к санитарной чистоте [10, 11]. Видовой состав микробиома станции изучают в рамках мероприятий по оценке санитарно-гигиенических условий внутренних объемов МКС [11‒14]. Во время 20-й экспедиции на МКС в ее российском сегменте был выделен штамм B. subtilis 20 [15], биотехнологический потенциал которого, учитывая экстремальность условий его обитания, представляет существенный интерес.
В настоящей работе изучены физиологические и молекулярно-биологические свойства B. subtilis 20, позволяющие рассматривать его как платформу для получения биотехнологически ценных штаммов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Штаммы. B. subtilis 168 получен из Всероссийской коллекции промышленных микроорганизмов (В-1727). B. subtilis 20 выделен из внутренних объемов МКС в ходе 20-й экспедиции. Штаммы растили на жидкой или агаризованной среде LB при 37°С. В жидкой среде бактерии культивировали при встряхивании (200 об/мин).
MALDI-TOF-анализ бактериальных штаммов. Биологические образцы анализировали в соответствии с протоколами, разработанными компанией “Brucker” (Германия) (https://www.bruker.com/ products/mass-spectrometry-and-separations/literature/ literature-room-mass-spec/instruction-for-use.html) с небольшими изменениями. Клетки, достигшие логарифмической фазы роста, собирали центрифугированием, промывали водой и инактивировали ресуспендированием в 75%-ном этаноле. Клетки осаждали, подсушивали и лизировали, последовательно ресуспендируя их в 70%-ной муравьиной кислоте и ацетонитриле. Лизаты клеток осветляли центрифугированием. Супернатант смешивали с матрицей (α-циано-4-гидроксикоричная кислота (6 мг/мл) в растворе ацетонитрил/вода/трифторуксусная кислота (50 : 47.5 : 2.5 v/v/v)), подсушивали и кристаллизовали на подложке из нержавеющей стали. Подготовленные образцы анализировали на Microflex LT MALDI-TOF-масс-спектрометре (“Bruker Daltonik GmbH”, Германия). Сырые спектры снимали в линейном положительном режиме при частоте лазера 20 Гц в диапазоне масс от 2 до 20 кДа. Сглаживание, нормализацию, вычет базовой линии и выбор пиков выполняли автоматически с помощью программного обеспечения, поставляемого с прибором. В результате получили список наиболее значимых спектральных пиков (описываемых отношением m/z и интенсивностью). Обработанные спектры образцов сравнивали с референсной базой характеристических спектральных профилей, поставляемой в составе программного обеспечения MALDI Biotyper 3.0. Результаты поиска характеристического профиля выражали как логарифм значений. Значения ниже 1.69 соответствовали ненадежному определению рода, 1.70–1.99 ‒ надежному определению рода и, возможно, вида, значения 2.00–2.29 указывали на надежное определение рода и с высокой вероятностью вида.
Выделение геномной ДНК. Клетки, выращенные до стационарной фазы в 5 мл среды LB, осаждали центрифугированием при 3000 g в течение 5 мин при комнатной температуре. Осадок клеток промывали в Tрис-HCl-буфере (pH 8.0) и ресуспендировали в 300 мкл лизирующего буфера (2% Tритон X-100, 1% SDS, 100 мM NaCI, 10 мM Tрис-HCI pH 8.0). Добавляли равный объем смеси фенол : хлороформ : изоамиловый спирт (25 : : 24 : 1) pH 8.0 и ~100 мкл стеклянных шариков (средний диаметр ~0.5 мм, “Sigma”, США). Клетки разрушали, встряхивая смесь 3 раза по 30 с с паузами по 30 с на приборе Precellys 2400 (“Bertin Technologies”, Франция) при 6800 об/мин. Фазы разделяли центрифугированием на максимальной скорости в течение 5 мин при комнатной температуре, нуклеиновые кислоты осаждали из водной фазы, добавляя 1/10 объема 3 М ацетата натрия и 3 объема 96%-ного этилового спирта, при –20°С в течение 1 ч. Нуклеиновые кислоты осаждали центрифугированием при 20 000 g в течение 10 мин при 4°С на центрифуге 5804R (“Eppendorf”, Германия). Осадок ресуспендировали в буфере TE (10 мM Tрис-HCl pH 8.0, 1 мM EDTA ) и обрабатывали РНКазой А (“Thermo Scientific”, США) в соответствии с рекомендациями производителя. ДНК осаждали на максимальной скорости при 4°С и ресуспендировали в 10 мM буфере Tрис-HCl (pH 8.0).
Секвенирование рибосомной ДНК. ДНК выделяли из клеток, выращенных до стационарной фазы, как описано выше, и использовали в качестве матрицы для амплификации внутреннего транскрибируемого спейсера 16S‒23S. В реакции использовали праймеры L516SF и L523SR (табл. 1) и условия, описанные в [16]. ПЦР-продукт очищали с использованием набора PCR Clean Up (“Thermo Scientific”). Реакцию секвенирования ПЦР-фрагментов проводили с праймером L516SF и набором реагентов ABI PRISM® BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом анализаторе ДНК Applied Biosystems 3730.
Таблица 1.
Олигонуклеотиды, использованные в работе
| Олигонуклеотид, название | Нуклеотидная последовательность 5' → 3' | Назначение | Источник |
|---|---|---|---|
| L516SF | TCGCTAGTAATCGCGGATCAGC | Идентификация штаммов Bacillus | [16] |
| L523SR | GCATATCGGTGTTAGTCCCGTCC | ||
| rpsJ-ex-RT-F | GAAACGGCAAAACGTTCTGG | Референсный ген в ОТ-ПЦР | Данная работа |
| rpsJ-ex-RT-R | GTGTTGGGTTCACAATGTCG | ||
| ykoV-ex-RT-F | GATCGGTATCGCCAATATG | Определение относительного уровня мРНК гена ykoV | » |
| ykoV-ex-RT-R | CTGACCTCATCGGGATAAT | ||
| ligD-ex-RT-F | CTAACAACGGGTTTCTGAC | Определение относительного уровня мРНК гена ligD | » |
| ligD-ex-RT-R | GTTCCATAATCTCGCGTATAG | ||
| sigG-ex-RT-F | AGCCGACTGCAGAAGACATCGC | Определение относительного уровня мРНК гена sigG | » |
| sigG-ex-RT-R | ATCGGGTCTCCGCCGTCGTTA | ||
| spoVT-ex-RT-F | ACGCGCTTTACGACAGCCTCG | Определение относительного уровня мРНК гена spoVT | » |
| spoVT-ex-RT-R | ACGGAGCTGCGCTGATCCATTG | ||
| katA-ex-RT-F | CAACCGCGCACGCAACAAAGT | Определение относительного уровня мРНК гена katA | » |
| katA-ex-RT-R | CCGCCGAAGCTGTTAGGCTCG | ||
| sodA-ex-RT-F | CTGGCGCGCTTGCTGAAGAGA | Определение относительного уровня мРНК гена sodA | » |
| sodA-ex-RT-R | ATGCCCAGCCAGAACCGAAGC |
Определение оптической плотности культур бактерий и кинетики роста в среде LB с различными значениями pH. Оптическую плотность культур определяли на приборе NanoDrop1000 (“Thermo Scientific”). Среды со щелочными значениями pH готовили из среды LB, добавляя 1 М NaOH; среды с кислыми значениями pH готовили, добавляя в среду LB 1 M HCl. Кинетику роста бактериальных культур определяли с использованием прибора Bioscreen C (“Oy Growth Curves Ab Ltd”, Финляндия). Начальная плотность культур бактерий составляла OD600 = 0.01. В приборе Bioscreen C культуры растили в 96-луночном планшете в 150 мкл среды LB в течение 16 ч при встряхивании при 200 об/мин. Оптическую плотность культуры в каждой лунке измеряли каждый час.
Тест на устойчивость клеток к стрессу. Культуры клеток, достигшие стационарной фазы роста, разводили до OD600 = 1, готовили серии десятикратных разведений в питательной среде LB. По 4 мкл каждого из разведений наносили на поверхность твердой питательной среды, давали высохнуть и инкубировали в течение ночи при 37°C. В опыте в агар добавляли стрессовый агент, в контроле стрессовых агентов не добавляли. И в контроле, и в опыте подсчитывали количество колоний в самых высоких разведениях. Выживаемость штамма рассчитывали как соотношение количества колоний в опыте и контроле.
Тест на устойчивость к антибиотикам. На фильтровальную бумагу диаметром 4 мм наносили 5 мкл раствора антибиотика в концентрации 10 мг/мл. На чашку Петри высевали газон клеток штамма, на поверхность которого помещали смоченный антибиотиком диск фильтровальной бумаги и инкубировали при 37°C в течение 16 ч.
Определение продукции сероводорода. Штаммы выращивали на полноценной среде LB в течение 16 ч в пробирках, под крышками которых прикрепляли полоску фильтровальной бумаги, смоченной 2%-ным раствором ацетата свинца. Уровень продукции H2S штаммами оценивали по интенсивности почернения фильтровальной бумаги в результате образования PbS.
Выделение суммарной РНК. Клетки, выращенные до средней логарифмической фазы (OD600 = = 0.5), осаждали центрифугированием при 3000 g в течение 5 мин при комнатной температуре и ресуспендировали в 10 мМ Tрис-HCl-буфере pH 8.0, содержащем 100 мМ NaCl и 1 мМ EDTA. Клетки лизировали в 50 мМ Tрис-HCl-буфере pH 8.0, содержащем 8% сахарозы, 0.5% Тритона X-100, 10 мМ EDTA, 4 мг/мл лизоцима, в течение 5 мин на льду. Лизат смешивали с равным объемом кислого фенола (pH 4.5) и инкубировали при 65°С в течение 15 мин. Фазы разделяли центрифугированием в течение 5 мин на максимальной скорости при комнатной температуре. Водную фазу смешивали с равным объемом смеси фенол : хлороформ : : изоамиловый спирт (25 : 24 : 1) pH 4.5. Фазы разделяли центрифугированием в течение 5 мин на максимальной скорости при комнатной температуре. РНК из водной фазы осаждали, добавляя 1/10 объема 3 М ацетата натрия и три объема 96%-ного этилового спирта при –20°С в течение 20 мин. РНК осаждали центрифугированием при 20 000 g в течение 10 мин при 4°С на центрифуге 5804R (“Eppendorf”). Осадок промывали 70%-ным спиртом, подсушивали и ресуспендировали в деионизированной воде. Примеси геномной ДНК из препарата РНК удаляли обработкой ДНКазой I (“Thermo Scientific”) по протоколу, рекомендованному производителем. РНК осаждали на максимальной скорости при 4°С и ресуспендировали в mQ, обработанной DEPC.
Определение уровня экспрессии генов. кДНК синтезировали с использованием обратной транскриптазы RevertAid H-minus (“Thermo Scientific”) по протоколу, рекомендованному производителем, с использованием рассеянной затравки. Относительное количество мРНК исследуемых генов определяли методом ПЦР в реальном времени с флуоресцентным красителем Eva Green (“Синтол”, Россия) на приборе LightCycler-480-II (“Roshe Life Science”, США) в соответствии с рекомендациями производителя. Референсным геном служил rpsJ, ранее использованный при сравнении уровня экспрессии генов в различных штаммах Bacillus [17]. Чтобы исключить влияние случайных мутаций, возможную вариацию в копийности исследуемых генов и повреждение ДНК в ходе стресса, относительный сигнал, полученный при анализе кДНК, нормировали на относительный сигнал, полученный при амплификации соответствующих фрагментов с геномной ДНК. Таким образом, итоговый относительный сигнал рассчитывали по формуле:
где:
C(t)реф(кДНК, норм) ‒ средний пороговый цикл сигнала референсного гена с образцов кДНК, полученных из клеток, выращенных при нормальных условиях;
C(t)реф(кДНК, стресс) ‒ средний пороговый цикл сигнала референсного гена с образцов кДНК, полученных из клеток, выращенных при стрессовых условиях;
C(t)опыт(кДНК, норм) ‒ средний пороговый цикл сигнала опытного гена с образцов кДНК, полученных из клеток, выращенных при нормальных условиях;
C(t)опыт(кДНК, стресс) ‒ средний пороговый цикл сигнала опытного гена с образцов кДНК, полученных из клеток, выращенных при стрессовых условиях;
C(t)реф(ДНК, норм) ‒ средний пороговый цикл сигнала референсного гена с образцов геномной ДНК, полученных из клеток, выращенных при нормальных условиях;
C(t)реф(ДНК, стресс) ‒ средний пороговый цикл сигнала референсного гена с образцов геномной ДНК, полученных из клеток, выращенных при стрессовых условиях;
C(t)опыт(ДНК, норм) ‒ средний пороговый цикл сигнала опытного гена с образцов геномной ДНК, полученных из клеток, выращенных при нормальных условиях;
C(t)оп(ДНК, стресс) ‒ средний пороговый цикл сигнала опытного гена с образцов геномной ДНК, полученных из клеток, выращенных при стрессовых условиях.
Первичную обработку данных проводили с помощью программного обеспечения, поставляемого с прибором. Дальнейшую обработку проводили с помощью Microsoft Excel. Олигонуклеотиды, последовательности которых представлены в табл. 1, подбирали с помощью сервера mFold [18].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Повторная идентификация B. subtilis 20
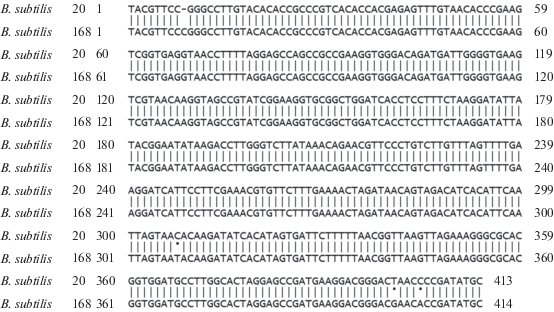
Первичная идентификация штамма B. subtilis 20 проведена с помощью системы автоматизированной идентификации микробных штаммов Vitek-60 (“Bio Merieux”, Франция) [15]. Повторная идентификация штамма проведена в настоящей работе путем секвенирования участка внутреннего транскрибируемого спейсера рДНК и MALDI-TOF-анализа. Согласно результатам секвенирования рДНК штамма на 99% идентична соответствующему участку штамма B. subtilis ssp. subtilis 168 (рис. 1). По данным MALDI-TOF исследуемый штамм также ближе всего к штамму B. subtilis ssp. subtilis (табл. 2).
Рис. 1.
Выравнивание участков рДНК штаммов B. subtilis. Глобальное выравнивание аминокислотных последовательностей белков выполнено при помощи программы EMBOSS-Stretcher (http://www.ebi.ac.uk/Tools/psa/emboss_stretcher/) [19]) с параметрами по умолчанию. Точками указаны несовпадающие нуклеотиды.
Штамм B. subtilis 20 характеризуется более высокой плотностью культуры по сравнению с B. subtilis 168
В ходе выращивания серии разведений бактериальных культур штамм B. subtilis 20 формирует колонии гораздо большего размера, нежели B. subtilis 168, которые к тому же сливаются с соседними колониями, образуя сплошной газон (рис. 2а). Подобное поведение бактерий может быть связано с повышенной подвижностью и/или скоростью деления клеток. Далее оценивали скорость роста бактериальных культур. Согласно результатам измерения кинетики роста бактериальных культур (рис. 2б) B. subtilis 20 значительно опережает B. subtilis 168 по скорости накопления биомассы. Повышенная плотность культуры B. subtilis 20 наблюдается и после 16, и особенно после 36 ч инкубации (рис. 2в). Полученные данные свидетельствуют о том, что штамм B. subtilis 20 накапливает бóльшую клеточную массу, чем B. subtilis 168.
Рис. 2.
Скорость роста культур B. subtilis на твердой и жидкой питательной среде. а ‒ Колонии штаммов B. subtilis на агаризованной среде LB после инкубации при 37°C в течение 16 ч. б ‒ Кинетика роста бактериальных культур при инкубации в микроцентрифужных пробирках. Разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах. в ‒ Плотность бактериальных культур в стационарной фазе роста. Разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах. г ‒ Кинетика роста бактериальных культур в среде LB при различных значениях pH в приборе Bioscreen C (“Oy Growth Curves Ab Ltd”).
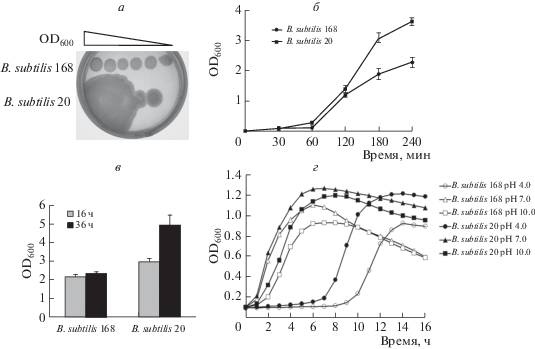
B. subtilis 20 быстро адаптируется к росту в средах с кислыми значениями pH
В ходе определения кинетики роста исследуемого штамма в среде LB с различными значениями pH обнаружено, что плотность культуры B. subtilis 20 начинает увеличиваться после 7 ч, а B. subtilis 168 ‒ после 9 ч инкубации в среде с pH 4.0 (рис. 2г). Следует также отметить, что плотность культуры B. subtilis 168 начинает значительно снижаться через 6‒10 ч культивирования. Возможно, это связано с лизисом клеток и их переходу к стадии споруляции. При этом плотность культур B. subtilis 20 снижается не так резко. Полученные данные указывают на более быструю адаптацию штамма B. subtilis 20 к росту в закисленной среде и более длительное сохранение жизнеспособности в стационарной фазе.
B. subtilis 20 более устойчив к действию ДНК-повреждающих соединений, чем B. subtilis 168
Поскольку штамм B. subtilis 20 обнаружен в среде с повышенным радиационным фоном, можно предположить, что он обладает повышенной устойчивостью к действию ДНК-повреждающих факторов. Действительно, согласно полученным данным (рис. 3а, б), B. subtilis 20 сверхустойчив к действию ДНК-окисляющего соединения 4-нитрохинолин-1-оксида, ДНК-метилирующего соединения метилметансульфоната, антибиотика зеоцина, вызывающего двухцепочечные разрывы ДНК, и ультрафиолетового излучения.
Рис. 3.
Устойчивость штаммов B. subtilis к действию стрессовых факторов. а ‒ Тест на устойчивость к действию стрессовых факторов путем выращивания серии разведений бактериальных культур на чашках Петри. б ‒ Количественный анализ выживаемости штамма B. subtilis 20. Разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах. в ‒ Относительные уровни экспрессии генов NHEJ-оперона и их регуляторов в стационарной фазе роста бактерий. Разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах. 4-NGO ‒ 4-нитрохинолин-1-оксид, MMS ‒ метилметансульфонат.
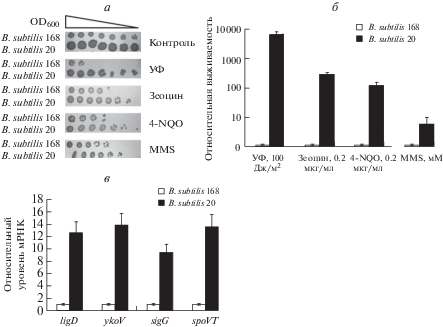
Сверхэкспрессия оперона ku-ligD у B. subtilis 20
Повышенная устойчивость к ДНК-повреждающим факторам может быть связана с повышенной активностью систем репарации ДНК. Поскольку двухцепочечные разрывы относятся к самым опасным повреждениям, мы обратили внимание на одну из систем репарации двухцепочечных разрывов ДНК по механизму соединения негомологичных концов (NHEJ). Чтобы оценить активность системы NHEJ, определяли уровни экспрессии генов ykoV и ligD, кодирующих компоненты этой системы, в культуре, находящейся в стационарной фазе роста. Согласно полученным данным, уровни экспрессии обоих генов у B. subtilis 20 более чем в 10 раз выше, чем у B. subtilis 168 (рис. 3в). Эти данные согласуются также с резким увеличением экспрессии генов sigG и spoVT, регуляторов NHEJ-оперона (рис. 3в).
B. subtilis 20 обнаруживает устойчивость к ампициллину
Поскольку штамм B. subtilis 20 сверхустойчив к действию антибиотика зеоцина, представляло интерес оценить его устойчивость к другим группам антибиотиков. Согласно полученным данным (рис. 4), B. subtilis 20 практически не чувствителен к ампициллину, в то время как проявляет чувствительность к другим антибиотикам.
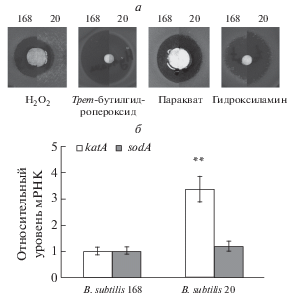
Устойчивость B. subtilis 20 к пероксиду водорода коррелирует с повышенной экспрессией гена katA
Поскольку B. subtilis 20 проявляет повышенную устойчивость к действию 4-NQO, который способен вызывать окислительный стресс [20], то можно предположить, что штамм может обладать повышенной устойчивостью и к действию окислительных агентов. Действительно, согласно полученным данным, B. subtilis 20 более устойчив к действию пероксида водорода и трет-бутилгидропероксиду, одинаково устойчив к параквату и менее устойчив к гидроксиламину (рис. 5а). Интересно, что повышенная устойчивость к пероксиду водорода коррелирует с повышенной экспрессией гена вегетативной каталазы А, необходимой для устойчивости бактерий к пероксиду водорода [21] (рис. 5б) в то время как экспрессия супероксиддисмутазы А, одного из белков, отвечающих за устойчивость к параквату [22], одинакова в обоих штаммах.
Рис. 5.
Устойчивость штаммов B. subtilis к окислительному стрессу. а ‒ Тест на устойчивость к действию окислительных агентов. На диск наносили 5 мкл 40 мМ раствора параквата, 5 мкл 35%-ного водного раствора пероксида водорода, 5 мкл 70%-ного водного раствора трет-бутилгидропероксида и 5 мкл 50%-ного водного раствора гидроксиламина. Представлены характерные совмещенные фотографии зон ингибирования роста штаммов. б ‒ Относительные уровни экспрессии ферментов антиоксидантных систем. Разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах. ** ‒ статистически значимое отличие при p < 0.01.
B. subtilis 20 продуцирует больше сероводорода, чем B. subtilis 168
Помимо ферментов, нейтрализующих активные формы кислорода, еще одним компонентом защиты от активных форм кислорода является сероводород [23]. Согласно полученным нами данным, B. subtilis 20 продуцирует больше сероводорода, нежели B. subtilis 168 (рис. 6).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Повышенный в условиях МКС уровень ионизирующего излучения повреждает наследственный материал микробных клеток. Для большинства видов прокариот эти факторы губительны, что, по-видимому, служит причиной сниженного биоразнообразия микроорганизмов, идентифицируемых на космических станциях [13]. С другой стороны, такая радиационная обстановка стимулирует эволюцию микроорганизмов, устойчивых к действию повышенных уровней радиации, что позволяет получать новые штаммы с полезными свойствами. Так, получены, например, штаммы Arthrobacter sp. МИП-89 [24] и МИА-74 [25], способные разлагать углеводороды нефти.
Ранее было показано, что в условиях космического полета скорость роста и плотность популяции как у E. coli, так и у B. subtilis возрастают по сравнению с наземным контролем [26, 27]. Следует отметить, что это были кратковременные эксперименты, по-видимому, исключающие действие генетического компонента и позволяющие говорить лишь о временной адаптации микроорганизмов к росту в условиях космического полета. Использованный в нашей работе штамм B. subtilis 20 прошел множество пассажей, поэтому его способность к ускоренному росту, по-видимому, генетически закреплена. Повышенная способность этого штамма к накоплению биомассы является важной характеристикой любых штаммов-сверхпродуцентов. Кроме того, выявленная нами способность штамма B. subtilis 20 расти при кислых значениях pH, позволяет выдерживать закисление среды продуктами естественного метаболизма, также является существенным преимуществом этого штамма в качестве штамма-продуцента.
В кратковременных экспериментах на космических станциях зафиксирована повышенная устойчивость бактерий к антибиотикам [28]. Однако более длительное пребывание на космической станции (более 4 мес.) приводило к появлению чувствительности к некоторым антибиотикам [29]. Штамм B. subtilis 20 сверхустойчив к действию зеоцина, вызывающего двухцепочечные повреждения ДНК, что может быть связано с повышенной активностью систем репарации, в частности NHEJ. Это свойство может быть полезным при дальнейшем применении штамма в химической промышленности как продуцента токсичных соединений, способных повреждать наследственный материал бактерий.
Повышенная устойчивость B. subtilis 20 к окислительным агентам, возможно, связанная со сверхактивностью ферментативных (каталаза) и неферментативных (сероводород) антиоксидантных систем, также может быть характеристикой, полезной для использования этого штамма в производстве химических соединений, способных вызывать окислительный стресс.
Таким образом, на основании полученных данных можно заключить, что благодаря своим ростовым характеристикам, pH-устойчивости и устойчивости к ДНК-повреждающим и окислительным агентам, штамм B. subtilis 20 может служить платформой для получения ценных биотехнологических штаммов.
Работа выполнена при финансовой поддержке Российского научного фонда (№ 17-74-30030) (Таблица 1, рис. 2, 3, 5 и 6), Программы фундаментальных исследований государственных академий наук на 2019–2021 годы АААА-А19-119010590015-8 (рис. 4), Программы Российской академии наук № 01201367566 (рис. 1) и № 01201373016 (таблица 2).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
van Dijl J.M., Hecker M. (2013) Bacillus subtilis: From soil bacterium to super-secreting cell factory. Microbial Cell Factories. 12, 3.
Liu Y., Li J., Du G., Chen J., Liu L. (2017) Metabolic engineering of Bacillus subtilis fueled by systems biology: Recent advances and future directions. Biotechnol. Adv. 35, 20‒30.
Cui W., Han L., Suo F., Liu Z., Zhou L., Zhou Z. (2018) Exploitation of Bacillus subtilis as a robust workhorse for production of heterologous proteins and beyond. W. J. Microbiol. Biotechnol. 34, 145.
Gu Y., Xu X., Wu Y., Niu T., Liu Y., Li J., Du G., Liu L. (2018) Advances and prospects of Bacillus subtilis cellular factories: From rational design to industrial applications. Metabolic Engin. 50, 109‒121.
Verma J.P., Jaiswal D.K., Krishna R., Prakash S., Yadav J., Singh V. (2018) Characterization and screening of thermophilic Bacillus strains for developing plant growth promoting consortium from hot spring of Leh and Ladakh region of India. Front. Microbiol. 9, 1293.
Malhotra R., Noorwez S.M., Satyanarayana T. (2000) Production and partial characterization of thermostable and calcium-independent alpha-amylase of an extreme thermophile Bacillus thermooleovorans NP54. Lett. Appl. Microbiol. 31, 378‒384.
Horneck G., Klaus D.M., Mancinelli R.L. (2010) Space microbiology. Microbiol. Mol. Biol. Rev.: MMBR. 74, 121‒156.
Novikova N.D., Polikarpov N.A., Poddubko S.V., Deshevaya E.A. (2001) Proc. 31st Internat. Conf. Environ. Systems, Orlando, FL, USA, (2001), #2001-2001-2310.
Rettberg P., Antunes A., Brucato J., Cabezas P., Collins G., Haddaji A., Kminek G., Leuko S., McKenna-Lawlor S., Moissl-Eichinger C., Fellous J.L., Olsson-Francis K., Pearce D., Rabbow E., Royle S., Saunders M., Sephton M., Spry A., Walter N., Wimmer Schweingruber R., Treuet J.C. (2019) Biological contamination prevention for outer solar system moons of astrobiological interest: what do we need to know? Astrobiology. 19, 951‒974.
Venkateswaran K., Satomi M., Chung S., Kern R., Koukol R., Basic C., White D. (2001) Molecular microbial diversity of a spacecraft assembly facility. System. Appl. Microbiol. 24, 311‒320.
Пирсон Д.Л., Мак Джиннис М.Р., Викторов А.Н. (1994) Микробиологическая обсемененность. Космическая биология и медицина: Обитаемость космических летательных аппаратов (Т2). Москва: Наука.
Новикова Н.Д., Пирсон Д.Л., Поддубко С.В., Дешевая Е.А., Отт С.М., Кастро В.А., Брюс Р.Д. (2009) Микробиологическая характеристика среды обитания. Космическая биология и медицина: российско-американское сотрудничество в области космической биологии и медицины (Т5). Москва: Наука.
Lang J.M., Coil D.A., Neches R.Y., Brown W.E., Cavalier D., Severance M., Hampton-Marcell J.T., Gilbert J.A., Eisen J.A. (2017) A microbial survey of the International Space Station (ISS). Peer J. 5, e4029.
Ichijo T., Yamaguchi N., Tanigaki F., Shirakawa M., Nasu M. (2016) Four-year bacterial monitoring in the International space station-Japanese experiment module “Kibo” with culture-independent approach. NPJ. Microgravity. 2, 16007.
Баранов В.М., Новикова Н.Д., Поликарпов Н.А., Сычев В.Н., Левинских М.А., Алексеев В.Р., Окуда Т., Сугимото М., Гусев О.А., Григорьев А.И. (2009) Эксперимент “Биориск”: 13-месячная экспозиция покоящихся форм организмов на внешней стороне Российского сегмента Международной космической станции (предварительные результаты). Докл. Акад. Наук. 426, 1‒4.
Xu D., Cote J.-C. (2003) Phylogenetic relationships between Bacillus species and related genera inferred from comparison of 39 end 16S rDNA and 5' end 16S–23S ITS nucleotide sequences. Int. J. Syst. Evol. Microbiol. 53, 695–704.
Velho R.V., Caldas D.G., Medina L.F., Tsai S.M., Brandelli A. (2011) Real-time PCR investigation on the expression of sboA and ituD genes in Bacillus spp. Lett. Appl. Microbiol. 52, 660‒666.
Zuker M. (2003) Mfold web server for nucleic acid folding and hybridization prediction. Nucl. Acids Res. 31, 3406‒3415.
McWilliam H., Li W., Uludag M., Squizzato S., Park Y.M., Buso N., Cowley A.P., Lopez R. (2013) Analysis Tool Web Services from the EMBL-EBI. Nucl. Acids Res. 41, W597‒600.
Arima Y., Nishigori C., Takeuchi T., Oka S., Morimoto K., Utani A., Miyachi Y. (2006) 4-Nitroquinoline 1-oxide forms 8-hydroxydeoxyguanosine in human fibroblasts through reactive oxygen species. Toxicol. Sci. 91, 382‒392.
Engelmann S., Hecker M. (1996) Impaired oxidative stress resistance of Bacillus subtilis sigB mutants and the role of katA and katE. FEMS Microbiol. Lett. 145, 63‒69.
Inaoka T., Matsumura Y., Tsuchido T. (1999) SodA and manganese are essential for resistance to oxidative stress in growing and sporulating cells of Bacillus subtilis. J. Bacteriol. 181, 1939‒1943.
Nagy P., Winterbourn C.C. (2010) Rapid reaction of hydrogen sulfide with the neutrophil oxidant hypochlorous acid to generate polysulfides. Chem. Res. Toxicol. 23, 1541‒1543.
Власов С.А., Краснопевцева Н.В., Крашенинникова Т.И., Лукашина Т.И. (1999) Штамм Arthrobacter sp. для разложения сырой нефти и нефтепродуктов. RU 2142997 C1. Научно-техническое объединение “ИТИН” Инженерной академии РФ, Россия.
Власов С.А., Краснопевцева Н.В., Крашенинникова Т.И., Лукашина Т.И., Украинцев А.Д. (1999) Штамм Arthrobacter sp. для разложения сырой нефти и нефтепродуктов. RU 2142996 C1. Научно-техническое объединение “ИТИН” Инженерной академии РФ, Россия.
Klaus D., Simske S., Todd P., Stodieck L. (1997) Investigation of space flight effects on Escherichia coli and a proposed model of underlying physical mechanisms. Microbiology. 143 (Pt 2), 449‒455.
Kacena M.A., Merrell G.A., Manfredi B., Smith E.E., Klaus D.M., Todd P. (1999) Bacterial growth in space flight: logistic growth curve parameters for Escherichia coli and Bacillus subtilis. Appl. Microbiol. Biotechnol. 51, 229‒234.
Lapchine L., Moatti N., Gasset G., Richoilley G., Templier J., Tixador R. (1986) Antibiotic activity in space. Drugs Exp. Clin. Res. 12, 933‒938.
Juergensmeyer M.A., Juergensmeyer E.A., Guikema J.A. (1999) Long-term exposure to spaceflight conditions affects bacterial response to antibiotics. Microgravity Sci. Technol. 12, 41‒47.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология




