Молекулярная биология, 2020, T. 54, № 1, стр. 146-152
Рибонуклеаза Bacillus pumilus ингибирует миграцию клеток аденокарциномы двенадцатиперстной кишки человека HuTu 80
П. В. Зеленихин a, И. С. Еад Мохамед b, c, А. И. Надырова a, А. А. Сироткина a, В. В. Ульянова a, Н. Л. Миронова b, В. А. Митькевич d, *, А. А. Макаров d, М. А. Зенкова b, О. Н. Ильинская a
a Институт фундаментальной медицины и биологии Казанского (Приволжского) федерального университета
420008 Казань, Россия
b Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
c Новосибирский государственный университет
630090 Новосибирск, Россия
d Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: mitkevich@gmail.com
Поступила в редакцию 23.04.2019
После доработки 26.08.2019
Принята к публикации 27.08.2019
Аннотация
Миграция опухолевых клеток из первичного очага в близлежащие ткани является первым этапом метастатического процесса. Способность к инвазии особенно важна для карцином, клеткам которых необходимо преодолеть базальную мембрану и выйти за ее пределы в подлежащие ткани. Вещества, снижающие способность злокачественных клеток к инвазии, представляют интерес в качестве антиметастатических агентов. В настоящей работе в тесте на зарастание царапины (scratch-wound assay) проанализирована возможность подавления способности к миграции ряда линий злокачественных клеток разного происхождения под действием рибонуклеазы (РНКазы) Bacillus pumilus (биназы). Установлено, что биназа в нетоксичной концентрации 10 мкг/мл значимо подавляет миграционную способность клеток аденокарциномы двенадцатиперстной кишки HuTu 80 при инкубировании в течение 48‒72 ч. Антиметастатический потенциал биназы подтверждается данными молекулярного моделирования, показывающими возможность ингибирования биназой клеточных металлопротеиназ, определяющих миграцию опухолевых клеток.
ВВЕДЕНИЕ
По данным Всемирной организации здравоохранения в 2018 г. от онкологических заболеваний умерли 9.6 млн человек. Метастазирование опухоли обычно сопряжено со смертельным исходом. Универсальными процессами, обеспечивающими прогрессию любых опухолей и образование метастазов в отдаленных органах и тканях, являются инвазия и миграция опухолевых клеток. Снижение уровня межклеточной адгезии и приобретение клетками аномальной подвижности приводят к отделению агрессивных клеток от первичного опухолевого очага. Поиск ингибиторов этих процессов активно ведется во всем мире, причем все больше внимания уделяется агентам природного происхождения. Соединения, выделенные из природных источников, сыграли важную роль в разработке новых противоопухолевых препаратов. С 1940 по 2010 год из 206 соединений естественного происхождения, проявляющих противоопухолевую активность, 112 получили разрешение на клиническое применение [1]. Нафтохиноны, обнаруженные у высших растений 22 семейств, способны ингибировать инвазию, воздействуя на эпителиально-мезенхимальный переход, опухолевые стволовые клетки и белок STAT3. Природный нафтохинон BBI608 проходит II фазу клинических испытаний [2]. Представители рода Streptomyces продуцируют антибиотики тетрациклинового ряда, среди которых есть и ингибиторы металлопротеиназ, участвующих в преодолении базальной мембраны и продвижении по внеклеточному матриксу [3]. Обнадеживающие результаты показали такие ингибиторы миграции и инвазии, как люминацин, экстракт из морских видов Streptomyces [4], и миграцин, также полученный из Streptomyces sp. и ингибирующий миграцию и инвазию клеток рака яичников, опосредованную инсулиноподобным фактором роста-1 [5].
В настоящее время пристальное внимание привлекают такие биологические эффекты рибонуклеаз (РНКаз), как контроль роста кровеносных сосудов, токсичность в отношении клеток опухолей, противовирусная активность. Современные представления о роли и функциях РНКаз позволяют рассматривать эти ферменты как возможную альтернативу традиционным химиотерапевтическим средствам в щадящей терапии злокачественных новообразований. Биназа из Bacillus pumilus ‒ представитель РНКаз, филогенетически далеких от своих аналогов у млекопитающих и вследствие этого не подверженных действию тканевого ингибитора РНКаз в организме человека, зарекомендовала себя как перспективный агент, индуцирующий апоптоз ряда опухолевых клеток, экспрессирующих онкогены ras, KIT, AML/ETO [6–8], а также подавляющий метастазирование опухолей у животных [9]. Однако необходимо отметить, что ряд неопухолевых клеток (фибробласты NIH3T3 [10], клетки эндотелия пуповинной вены человека HUVEC [11], эпителиальные клетки легких эмбриона крупного рогатого скота, ЛЭК [12]) нечувствителен к биназе в диапазоне концентраций до 300 мкг/мл, что подтверждает селективность действия фермента.
Метастазированию клеток человека препятствуют тканевые ингибиторы металлопротеиназ (TIMP) – ферментов, вызывающих протеолиз внеклеточного матрикса [13]. Цель настоящей работы состояла в анализе способности биназы ингибировать миграцию опухолевых клеток с учетом возможной селективности ее действия в отношении клеток эпителиального и неэпителиального происхождения, экспрессирующих онкоген RAS как мутантный, так и дикого типа, а также в подтверждении антиметастатического потенциала биназы как потенциального агента, блокирующего активность клеточных металлопротеиназ, участвующих в миграции опухолевых клеток.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фермент. В работе использована биназа, гуанилспецифичная РНКаза B. pumilus 7Р дикого типа ([EC 3.1.27.3], молекулярная масса 12.2 кДа, 109 аминокислотных остатков, pI = 9.5), а также коммерческий препарат лиофилизированной панкреатической РНКазы А (“Sigma-Aldrich”, США). Биназа была выделена и очищена из культуральной жидкости нативного продуцента, как описано нами ранее [14]. Каталитическая активность биназы в отношении дрожжевой РНК, измеренная модифицированным методом Анфинсена [15], составила 14 × 106 ед./мг при pH 8.5.
Условия культивирования и оценка миграции клеток. Линии клеток рака легкого человека А549, печени HepG2, молочной железы MCF-7 и двенадцатиперстной кишки HuTu 80, а также меланомы В16 мыши (коллекция АТСС, США) культивировали при 37°С в среде DMEM (“Invitrogen”, США) с добавлением пенициллина/стрептомицина (по 100 ед./мл) и 10% эмбриональной сыворотки крупного рогатого скота в атмосфере 5% СО2. Клетки высевали в 12-луночные культуральные планшеты (20 × 103 клеток на лунку) и выращивали до образования полного монослоя. Перед началом эксперимента по поверхности монослоя при помощи наконечника для автоматической пипетки (200 мкл) проводили максимально идентичные для всех культур прямые линии, очищая от клеток полосу шириной ~1.0‒1.25 мм, и заменяли среду на аналогичную, содержащую биназу (2.5‒300 мкг/мл). Изображения образцов (не менее 20 в каждом варианте) в репрезентативных участках незанятых клетками областей фиксировали в нулевой временной точке, а затем после культивирования в течение 24, 48 и 72 ч с использованием камеры Olympus SC35 (Япония). Площадь не занятой клетками ростовой поверхности измеряли с использованием сервисной опции “Free hand selection” компьютерной программы ImageJ [16].
Тест на жизнеспособность клеток. Цитотоксичность биназы определяли с использованием теста, основанного на ингибировании пролиферации клеток, измеренной по активности митохондриальных дегидрогеназ, восстанавливающих производные тетразолия (МТТ-тест). Для этого интактные клетки высаживали в 96-луночные планшеты (по 3 × 104 клеток на лунку) и инкубировали в присутствии биназы в диапазоне концентраций 10–1000 мкг/мл в течение 48 ч при 37°С в атмосфере 5%-ного СО2. По окончании инкубации к клеткам добавляли раствор МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид, “Sigma-Aldrich”) до концентрации 0.5 мг/мл и инкубировали в течение 3‒4 ч в тех же условиях. Среду удаляли, образовавшиеся в клетках кристаллы формазана растворяли в 100 мкл диметилсульфоксида (“Татхимфармпрепарат”, Россия) и измеряли оптическую плотность по разности поглощения на длинах волн Δ (А570–А630) нм на многоканальном спектрофотометре хMark (“BIO-RAD”, США). Данные представляли в виде процента живых клеток относительно контроля.
Молекулярное моделирование. Моделирование проводили на сервере ClusPro с использованием трехмерных структур металлопротеиназы (PDB 3V96B) и биназы (PDB 1GOUA) в качестве рецептора и лиганда соответственно [17]. Комплекс каталитического домена матриксной металлопротеиназы-10 (ММР-10cd) с тканевым ингибитором металлопротеиназ-1 (TIMP-1, PDB 3V96) и модель взаимодействия каталитического домена матриксной металлопротеиназы-10 (ММР-10cd, PDB 3V96B) с биназой (PDB 1GOUA) были проанализированы и представлены в шаростержневом формате (balls and sticks).
Статистика. Статистическую обработку результатов проводили в программном пакете GraphPad Prism. При множественном сравнении групп данных использовали тест ANOVA. При этом р ≤ 0.05 считали достаточным уровнем значимости различий.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Метод зарастания царапины, или раневой поверхности ‒ один из наиболее распространенных методов классического анализа миграции клеток в монослойной культуре. Для оценки способности РНКаз препятствовать миграционной активности опухолевых клеток эпителиального происхождения были выбраны четыре линии опухолевых клеток человека: легких А549, печени HepG2, молочной железы MCF-7 и двенадцатиперстной кишки HuTu 80. В качестве альтернативной линии сравнения использовали неэпителиальные клетки меланомы В16 мыши, развивающейся из меланоцитов и метастазирующей лимфогенным и гематогенным путем почти во все органы.
Установлено, что инкубация в течение 72 ч с биназой в концентрации до 10 мкг/мл не влияла на миграцию клеток HepG2, MCF-7 и А549 (рис. 1а, в, г), тогда как клетки HuTu 80 оказались чувствительными к низким концентрациям биназы и РНКазы А (рис. 2а). Торможение миграции биназой (10 мкг/мл) через 24 ч было недостоверным по сравнению с процессом зарастания царапины в контрольном монослое необработанных клеток, после 48 ч миграционная активность клеток понизилась на 66% (рис. 2б). В отличие от биназы РНКаза А уже через 24 ч снижала миграционную активность клеток, однако, к 48 ч ее ингибирующий эффект составил лишь 29% (рис. 2а). Антимиграционное действие биназы на клетки А549 проявилось только в высокой концентрации (100 мкг/мл) (рис. 1а). Таким образом, антимиграционному действию РНКаз оказались подвержены две из четырех использованных опухолевых линий. Не обнаружено антимиграционного действия биназы на линию опухолевых клеток меланомы В16, имеющих неэпителиальное происхождение (рис. 1д).
Рис. 1.
Влияние биназы на миграцию и жизнеспособность клеток А549 (а, е), HuTu 80 (б, ж), HepG2 (в, з), MCF-7 (г, и) и В16 (д, к). Жизнеспособность клеток оценивали после 48 ч инкубации с биназой. За 100% принята площадь царапины сразу после нанесения (а‒д), либо жизнеспособность клеток без обработки РНКазой (е‒к). * ‒ р ≤ 0.05.
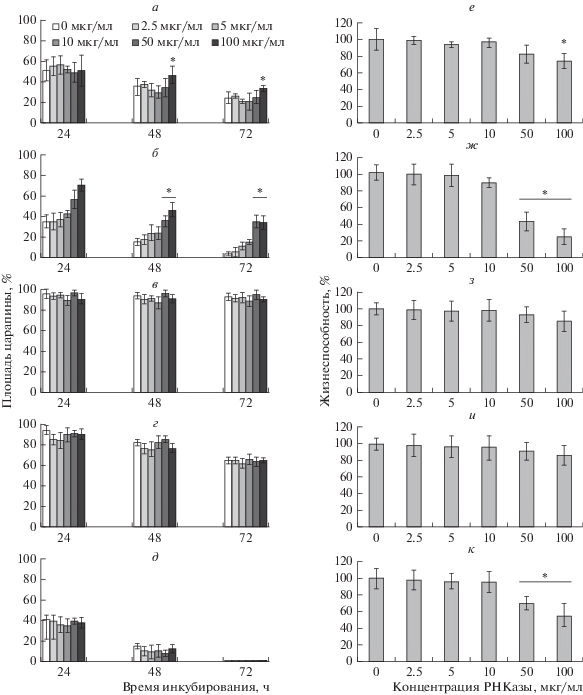
Рис. 2.
Зарастание царапины в монослое клеток аденокарциномы HuTu 80 человека (а) и меланомы мыши В16 (б), культивируемых в присутствии РНКазы (10 мкг/мл) в течение 48 ч. Точками обозначены границы изначального повреждения монослоя; пунктирные линии – границы монослоя после инкубации с РНКазами. Увеличение ×400.

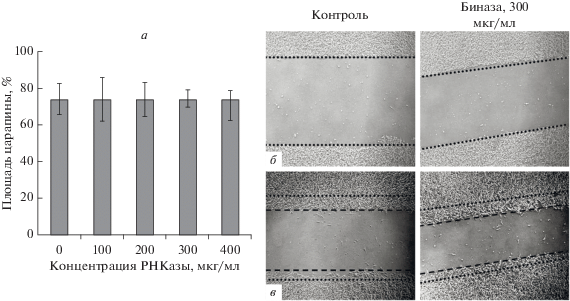
Отметим цитотоксический эффект биназы на линии клеток А549 (рис. 1е), HuTu 80 (рис. 1ж) и В16 (рис. 1к), жизнеспособность которых в присутствии 100 мкг/мл биназы снижается через 48 ч на 25.9 ± 8.7, 74.8 ± 8.8 и 44.3 ± 13.4% соответственно, по сравнению с контролем. Очевидно, что токсичность биназы вносит вклад в ее антимиграционное действие на клетки А549, но не HuTu 80, уровень миграции которых снижается и в присутствии биназы в нетоксичных концентрациях (рис. 1б). Меланома В16, несмотря на значительное снижение жизнеспособности при обработке биназой в концентрации 50‒100 мкг/мл (рис. 1к), не теряет своей высокой миграционной активности ‒ к 72 ч царапины практически полностью зарастают (рис. 1д). Миграционная активность этих клеток не изменяется и при действии биназы в концентрации 300 мкг/мл в течение 12 ч (рис. 3). Учитывая данные по антиметастатической активности биназы в модели меланомы В16 мыши [9], можно предположить, что этот эффект вызван, главным образом, гибелью опухолевых клеток.
Рис. 3.
Влияние биназы в высоких концентрациях на миграционную активность клеток меланомы В16 после 12 ч роста (а), и зарастание царапины с одинаковой скоростью в присутствии биназы и без нее в течение эксперимента: 0 ч (б) и 12 ч (в). За 100% принята площадь царапины сразу после нанесения. Увеличение ×400.
Ранее мы показали, что биназа взаимодействует непосредственно с мутантным белком K-RASG12D, блокируя таким образом сигнальный путь MAPK/ERK и индуцируя апоптоз [18]. Анализ экспрессии активированных онкогенов в опухолях эпителиального происхождения показывает, что подавление инвазии клеток биназой не всегда связано с экспрессией мутантных вариантов белка RAS. Клетки HuTu 80 и MCF-7 содержат онкогены группы RAS дикого типа, как и меланома В16. Клетки А549 экспрессируют мутантный K-RASG12S, а клетки HepG2 – мутантный N-RASQ61L. Вероятно, ингибирование биназой функций мутантного K-RAS в клетках А549 важно как для подавления их пролиферации (рис. 1е), так и миграции (рис. 1а). Однако в клетках HuTu 80 биназа индуцирует иные механизмы ингибирования миграции, поскольку антимиграционное действие наблюдается и в присутствии нетоксичных концентраций РНКазы. Эти клетки характеризуются необычайно высоким уровнем экспрессии металлопротеиназ семейства ADAM [база данных GDSC Cell Line Gene Expression Profiles]. Функциональная роль протеаз ADAM заключается в отщеплении внеклеточных фрагментов мембранных белков (так называемый шеддинг). Снижение этой активности ADAM в отношении белков клеточной адгезии может уменьшить риск метастазирования опухолевых клеток [19]. Матриксные металлопротеиназы относятся к семейству внеклеточных протеаз, выполняющих важную роль в физиологических и патологических процессах, в частности, в опухолевой трансформации и метастазировании [20]. В случае карцином − это процесс, включающий проникновение опухолевых клеток через базальную мембрану в результате ее разрушения. Как правило, инвазия является первым этапом сложного инвазивно-метастатического каскада, приводящего в дальнейшем к метастазированию. Тканевые ингибиторы металлопротеиназ (TIMP) ограничивают миграционную способность опухолевых клеток, поэтому аналогичные ингибиторы этих ферментов рассматриваются как перспективные противоопухолевые средства [21].
Каталитический центр металлопротеиназы MMP-10cd представлен консервативным цинк-связывающим мотивом HEXXHXXGXXH, в котором боковые цепи H217, H221 и H227 координируют ион цинка, а Е218 выступает в качестве общего элемента кислотно-основного катализа [22]. Ингибитор TIMP-1 взаимодействует с металлопротеиназой в области консервативного мотива, а также субстратсвязывающего участка, представленного аминокислотными остатками H178, L180, A181, A183, E218, H227, P237, Y239 (PDB 3V96, рис. 4а). Это взаимодействие в основном стабилизировано водородными связями, а также солевыми мостиками. Биназа и ингибитор TIMP-1 не похожи ни по первичной, ни по третичной структуре. Однако при моделировании взаимодействия между собственно MMP-10cd и биназой установлено, что путем электростатических взаимодействий биназа потенциально может связываться с протеиназой так же, как и ее ингибитор. И в этом взаимодействии принимают участие одни и те же области белка MMP-10cd (рис. 4). Так, с консервативным мотивом протеиназы взаимодействуют аминокислотные остатки Y12, R15, Y16 биназы, а с субстратсвязывающим участком – остатки R18 и R71.
Рис. 4.
Молекулярное моделирование: комплекс каталитического домена матриксной металлопротеиназы-10 (ММР-10cd) с тканевым ингибитором металлопротеиназы-1 (TIMP-1) (PDB 3V96) (а), и модель взаимодействия каталитического домена матриксной металлопротеиназы-10 (ММР-10cd, PDB 3V96B) с биназой (PDB 1GOUA) (б). Зеленым цветом (часть а, верх) показана металлопротеиназа, оранжевым (нижняя часть) ‒ ее ингибитор (а), красным цветом (часть б, верх) представлена металлопротеиназа, синим (нижняя часть) – биназа (б).

Таким образом, проведенный нами анализ подтверждает перспективность дальнейшего исследования биназы как селективного ингибитора инвазии опухолевых клеток, имеющих высокий уровень экспрессии мутантного онкогена K-RAS и металлопротеиназ ADAM.
Работа выполнена в рамках программы повышения конкурентоспособности Казанского федерального университета (КФУ) и поддержана грантами Российского фонда фундаментальных исследований (17-00-00059, 17-00-00060 и 17-00-00061 (КОМФИ)).
В исследовании не использованы биологические материалы, полученные от людей и животных.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Newman D.J., Cragg G.M. (2012) Natural products as sources of new drugs over the 30 years from 1981 to 2010. J. Nat. Prod. 75, 311–335.
Tsang N.Y., Chik W.I., Sze L.P., Wang M.Z., Tsang S.W., Zhang H.J. (2018) The use of naphthoquinones and furano-naphthoquinones as antiinvasive agents. Curr. Med. Chem. 25, 5007‒5056.
Onoda T., Ono T., Dhar D.K., Yamanoi A., Fujii T., Nagasue N. (2004) Doxycycline inhibits cell proliferation and invasive potential: combination therapy with cyclooxygenase-2 inhibitor in human colorectal cancer cells. J. Lab. Clin. Med. 143, 207‒216.
Shin Y.S., Cha H.Y., Lee B.-S., Kang S.U., Hwang H.S., Kwon H.C., Kim C.-H., Choi E.C. (2016) Anti-cancer effect of luminacin, a marine microbial extract, in head and neck squamous cell carcinoma progression via autophagic cell death. Cancer Res. Treat. 48, 738–752.
Тамами У., Наоки К., Йинжи Л., Банно К., Ганцев Ш., Кадзуо У. (2017) Молекулярный дизайн не содержащего углеводного компонента аналога миграцина, препятствующего миграции и инвазии клеток рака яичников. Креативная хирургия и онкология. 7, 16‒20.
Ilinskaya O., Decker K., Koschinski A., Dreyer F., Repp H. (2001) Bacillus intermedius ribonuclease as inhibitor of cell proliferation and membrane current. Toxicology. 156, 101–107.
Mitkevich V.A., Petrushanko I.Y., Spirin P.V., Fedorova T.V., Kretova O.V., Tchurikov N.A., Prassolov V.S., Ilinskaya O.N., Makarov A.A. (2011) Sensitivity of acute myeloid leukemia Kasumi-1 cells to binase toxic action depends on the expression of KIT and AML1-ETO oncogenes. Cell Cycle. 10, 4090‒4097.
Митькевич В.А., Макаров А.А., Ильинская О.Н. (2014) Клеточные мишени противоопухолевых рибонуклеаз. Молекуляр. биология. 48, 214‒219.
Mironova N.L., Petrushanko I.Y., Patutina O.A., Sen’kova A.V., Simonenko O.V., Mitkevich V.A., Markov O.V., Zenkova M.A., Makarov A.A. (2013) Ribonuclease binase inhibits primary tumor growth and metastases via apoptosis induction in tumor cells. Cell Cycle. 12, 2120‒2131.
Ильинская О.Н., Зеленихин П.В., Колпаков А.И., Макаров А.А., Митькевич В.А., Прасолов В.С., Сафиуллина Д.Р. (2008) Избирательная цитотоксичность биназы в отношении фибробластов, экспрессирующих онкогены ras и AML/ETO. Учен. Зап. Казанского ун-та. Сер. Естеств. науки. 150, 268‒273.
Кабрера Фуентес Э.А., Зеленихин П.В., Колпаков А.И., Прайсснер К., Ильинская О.Н. (2010) Сравнительная цитотоксичность биназы по отношению к опухолевым и нормальным клеткам. Учен. Зап. Казанского ун-та. Сер. Естеств. науки. 152, 143‒148.
Зеленихин П.В., Мамедзаде К.Р., Ильинская О.Н. (2012) Цитофлуориметрическая характеристика влияния РНКаз на клетки про- и эукариот. Клеточная трансплантология и тканевая инженерия. 7, 62‒65.
Arpino V., Brock M., Gill S.E. (2015) The role of TIMPs in regulation of extracellular matrix proteolysis. Matrix Biol. 44–46, 247‒254.
Dudkina E., Ulyanova V., Shah Mahmud R., Khodzhaeva V., Dao L., Vershinina V., Kolpakov A., Ilinskaya O. (2016) Three-step procedure for preparation of pure Bacillus altitudinis ribonuclease. FEBS Open Biol. 19, 24‒32.
Колпаков А.И., Ильинская О.Н. (1999) Оптимизация метода определения рибонуклеазной активности с использованием высокополимерной РНК. Клиническая и лабораторная диагностика. 5, 14‒16.
Schindelin J., Rueden C.T., Hiner M.C., Eliceiri K.W. (2015) The ImageJ ecosystem: An open platform for biomedical image analysis. Mol. Reprod. Dev. 82, 518‒529.
Kozakov D., Hall D.R., Xia B., Porter K.A., Padhorny D., Yueh C., Beglov D., Vajda S. (2017) The ClusPro web server for protein-protein docking. Nat. Protoc. 12, 255‒278.
Ilinskaya O.N., Singh I., Dudkina E., Ulyanova V., Kayumov A., Barreto G. (2016) Direct inhibition of oncogenic KRAS by Bacillus pumilus ribonuclease (binase). Biochim. Biophys. Acta–Mol. Cell Res. 1863, 1559‒1567.
Edwards D.R., Handsley M.M., Pennington C.J. (2008) The ADAM metalloproteinases. Mol. Aspects Med. 29, 258‒289.
Isaacson K.J., Martin Jensen M., Subrahmanyam N.B., Ghandehari H. (2017) Matrix-metalloproteinases as targets for controlled delivery in cancer: an analysis of upregulation and expression. J. Control Release. 259, 62‒75.
Zhong Y., Lu Y.T., Sun Y., Shi Z.H., Li N.G., Tang Y.P., Duan J.A. (2018) Recent opportunities in matrix metalloproteinase inhibitor drug design for cancer. Expert. Opin. Drug Discov. 13, 75‒87.
Batra J., Robinson J., Soares A.S., Fields A.P., Radisky D.C., Radisky E.S. (2012) Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2: binding studies and crystal structure. J. Biol. Chem. 287, 15935‒15946.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


