Молекулярная биология, 2020, T. 54, № 3, стр. 412-425
Исследование фертильности линии Drosophila melanogaster MS с нарушением контроля транспозиции мобильного элемента gypsy
И. В. Кукушкина a, П. А. Махновский b, Л. Н. Нефедова a, Е. А. Балакирева b, Н. И. Романова a, И. В. Кузьмин a, А. Р. Лавренов a, А. И. Ким a, *
a Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
b Институт медико-биологических проблем Российской академии наук
123007 Москва, Россия
* E-mail: aikim57@mail.ru
Поступила в редакцию 17.12.2019
После доработки 09.01.2020
Принята к публикации 13.01.2020
Аннотация
Локус flamenco – один из основных компонентов piРНК-пути регуляции транспозиции мобильных генетических элементов (МГЭ) у Drosophila melanogaster. Мутации в этом локусе приводят к повышению транспозиционной активности МГЭ и, как следствие, к генетической нестабильности. В работе оценена фертильность особей генетически нестабильной линии MS, полученной более 25 лет назад, которая содержит мутацию в локусе flamenco и функционально активную копию gypsy. У самок линии MS выявлены комплексные нарушения морфологии яичников: дефекты фолликулярного слоя, кольцевых каналов, деградация трофоцитов, что, в свою очередь, приводит к снижению репродуктивных способностей. Анализ транскриптома линии MS показал снижение уровня экспрессии 40 генов, кодирующих белки хориона и специфически экспрессирующихся на разных стадиях развития фолликула. У гибридных самок F1 и F2, полученных от скрещивания самок линии MS c самцами линии дикого типа, наблюдается восстановление репродуктивных способностей несмотря на то, что половина самок F2 имеет генотип flamenco и сохраняет генетическую нестабильность, вызванную транспозицией gypsy (согласно ovoD-тесту). Более того, у гибридных самок F2 с генотипом flamenco частота транспозиции gypsy возрастает в 2 раза по сравнению с линией MS. Таким образом, за 25 лет культивирования линия MS приобрела частичную супрессию фенотипа flamenco и накопила несколько рецессивных мутаций в генах, контролирующих оогенез.
ВВЕДЕНИЕ
Один из основных механизмов подавления активности мобильных генетических элементов (МГЭ) – piwi-зависимый путь PHК-интерференции – зависит от работы белков piwi и Yb, вовлеченных в дифференцировку и поддержание ниши герминальных стволовых клеток (ГСК) [1–4]. Piwi является материнским компонентом полярной гранулы – органеллы, специфичной для зародышевой плазмы, регулирующим экспрессию генов oskar и vasa, участвующих в детерминации клеток зародышевой линии у дрозофилы [5]. Поэтому нарушение контроля транспозиционной активности МГЭ в тканях яичников может коррелировать с нарушением оогенеза и репродуктивной функции у самок. У мутантов по генам, вовлеченным в биогенез piРНК (РНК, взаимодействующих с белком piwi), – piwi, Aub, armi и Cuff, описаны схожие фенотипические проявления, связанные с нарушением дифференцировки ГСК [6, 7].
Локус flamenco, мутации в котором приводят к дерепрессии транспозиции gypsy, является одним из основных компонентов piРНК-пути. Flamenco локализован на X-хромосоме и представляет собой мастер-локус для считывания предшественников piPHК. Таким образом, этот локус вовлечен в piPHК-интерференцию и участвует в контроле транспозиции ретротранспозона gypsy и некоторых других ретротранспозонов группы gypsy [8]. Показано, что flamenco необходим для морфогенеза фолликулярного эпителия; определенные (но не любые) мутации в локусе flamenco приводят к стерильности самок [9]. Предполагается, что существуют разные мутантные аллели локуса flamenco, вовлеченные в регуляцию транспозиции МГЭ и/или участвующие в оогенезе. Различные мутантные аллели flamenco могут взаимодействовать с генетическим фоном линии. В частности, описан механизм косупрессии (совместно с локусом flamenco) транскрипции gypsy, запускаемый новыми эухроматиновыми инсерциями gypsy в линиях, мутантных по локусу flamenco. Этот механизм косупрессии, по-видимому, зависит от посттранскрипционной регуляции, которая включает пути как еsiРНК (эндогенных малых интерферирующих РНК), так и piРНК, и связан с возникновением дефектов развития [10].
В нашей работе изучен феномен сниженной плодовитости линии Drosophila melanogaster MS, характеризующейся нарушением контроля транспозиции МГЭ и наличием функциональной и активно перемещающейся копии ретротранспозона gypsy [11]. Проведен также сравнительный анализ транскриптомов линии MS и контрольных линий (изогенной линии SS, отличающейся отсутствием функционального gypsy, линии дикого типа Д-32), направленный на поиск генетических маркеров, коррелирующих с репродуктивными особенностями линии MS.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Линии Drosophila melanogaster. В работе использовали изогенные линии с фенотипом flamenco SS (w1) и MS (w1, forked, содержит активный gypsy) [11], линии Д-32, w1 и линию ovoD (самцы ovoD1/+, самки ovo+/+ несут сцепленные X-хромосомы) из коллекции кафедры генетики МГУ [12]. Линии мух культивировали в стандартных условиях: на пищевом субстрате (агар, манная крупа, сахар, изюм, дрожжи) в стеклянных пробирках при температуре 25°С и влажности около 65%. Мух пересаживали на свежий корм в новую пробирку каждые 18 дней.
Оценка фертильности. Для оценки фертильности виргинную самку и самца помещали в индивидуальную пробирку объемом 25 мл. Родительские особи удаляли через 7 дней после начала эксперимента. Вылет взрослых имаго начинался через 12–14 дней. В течение 8 дней производили подсчет вылетевшего потомства. Для оценки динамики откладки яиц родительские особи каждые сутки пересаживали на новую среду. Далее оценивали количество отложенных яиц. Гибель особей на эмбриональной стадии определяли как отношение числа яиц, из которых вылупились личинки, к общему числу отложенных яиц.
Анализ полового поведения. Самцов и самок отбирали в течение 4 ч после вылупления. Имаго объединяли в однополые группы по 10 особей. Самок и самцов (возраст 72 ч) объединяли по 10 особей каждого пола в одну пробирку объемом 25 мл и в течение 1 ч наблюдали за половой активностью самцов и самок, а также за количеством копулирующих пар.
ovoD-тест. Тест на перемещение gypsy в клетках полового пути D. melanogaster (ovoD-тест) проводили в соответствии с методикой, предложенной в работе N. Prud’homme и соавт. [13].
Выделение РНК и высокопроизводительное секвенирование. РНК для секвенирования транскриптома выделяли с помощью комплекта реактивов ExtractРНК (“Евроген”, Россия) из взрослых 7-дневных самок. Концентрацию РНК измеряли с помощью флуориметра Qubit (“Thermo Scientific”, США), целостность РНК оценивали с помощью капиллярного электрофореза на приборе Bioanalyzer 2100 (“Agilent”, США). Подготовка библиотеки была выполнена с использованием набора TruSeq РНК sample v2 (“Illumina”, США). Перед секвенированием концентрацию библиотеки определяли с помощью флуориметра Qubit и ПЦР в реальном времени (праймеры: I-qPCR-1.1 AATGATACGGCGACCACCGAGAT и I-qPCR-2.1 CAAGCAGAAGACGGCATACGA). Библиотеки РНК разводили до концентрации 11 пМ и секвенировали на приборе Illumina HiSeq 2000 (длина прочтения – 50 н.). Глубина секвенирования составила для линии MS 5 млн прочтений и для линий Д-32, SS – 12 млн прочтений на образец. Качество контролировали с помощью программы FastQC, для тримминга использовали Trimmomatic v0.32. Доля прочтений с качеством не менее 20 (по системе оценки качества PHRED) составила 98.9‒99.5%. Короткие прочтения были картированы на геном D. melanogaster сборки BDGP6 с помощью программы Tophat v.2.1.0 с использованием аннотации референсного генома BDGP6.94. Доля картированных прочтений составила 94–98%. Подсчет прочтений проводили с помощью программы HTSeq v.0.6.1 с использованием референсной аннотации генома D. melanogaster BDGP6 (сборка Ensembl 94). Для оценки экспрессии конкретного гена использовали суммарное количество уникальных прочтений, локализованных на экзонах каждого гена. Дополнительные данные, используемые в качестве контрольных (транскриптомы 4-дневных самок линий Oregon-R и w1118, глубина секвенирования – 11–17 млн прочтений на образец), получены из серии эксперимента GSE99574 базы данных GEO (https:// www.ncbi.nlm.nih.gov/geo) и процессированы согласно описанному выше протоколу.
Оценка дифференциальной экспрессии генов и поиск мутаций в секвенированных геномах in silico. Дифференциальную экспрессию генов оценивали методом DESeq. Транскриптом линии SS сравнивали попарно с транскриптомами каждой из контрольных линий (Д-32, Oregon-R, w1118) и получали набор генов, которые имели значимые различия в каждом из трех случаев. Дифференциальную экспрессию отдельных генов подтверждали с помощью количественной ПЦР.
Выделение ДНК и РНК. ДНК выделяли согласно стандартной методике [14]. РНК выделяли с помощью реактива ExtractRNA (“Евроген”) по протоколу, рекомендованному фирмой-производителем. Концентрацию РНК измеряли спектрофотометрически на приборе NanoDrop (Peqlab).
Обратная транскрипция (ОТ). Перед постановкой реакции ОТ образцы РНК обрабатывали ДНКазой I (“Fermentas”, США) согласно протоколу фирмы. ОТ проводили с использованием набора MMLV-RT Kit (“Евроген”).
Полимеразная цепная реакция (ПЦР) в режиме реального времени. Амплификацию проводили в амплификаторе Mini-OpticonReal-Time-PCR System (“Bio-Rad Lab.”, CША) с использованием реакционной смеси qPCRmix-HS SYBR (“Евроген”), содержащей флуоресцентный краситель SYBR Green I. Параметры цикла: денатурация – 95°С, 15 с, отжиг праймеров – 55°С, 45 с, элонгация – 72°С, 60 с (40 циклов). Эффективность ПЦР оценивали с помощью серии кратных разведений ДНК или кДНК. Анализ результатов ПЦР проводили с помощью пакета программ Bio-Rad CFX Manager (версия 1.6.541.1028). Уровень экспрессии вычисляли методом ∆∆С(t). Оценивали относительный уровень экспрессии генов Vm26Aa, Ср16, psd, Fcp3C, CG14309, phu, tobi. Экспрессию нормировали по уровню референсных генов αTub84D, RpL40, EloB, eIF-1A. Последовательности праймеров приведены в табл. 1.
Таблица 1.
Нуклеотидные последовательности праймеров, использованных в работе
| Ген | Прямой праймер (5' → 3') | Обратный праймер (5' → 3') |
|---|---|---|
| Vm26Aa | GTGTGCATCGCTCTGGTC | GTCACTCCCTCCAGCTCTC |
| Ср16 | CCACCCTACGTCTTCTCTGC | TCGGTCTTCAGGTACGCATT |
| Psd | TGCACTCCAGAAACAGATCG | CAGTGGAGCTGTCGGATACA |
| Fcp3C | GCAAGTAGCAGCACAACAGC | TGGTGCTAACCAGACTGCTG |
| CG14309 | GGTAGTGTGCTTTGCGGATAC | ATCCAGGGCATCGTACAG |
| Phu | GATCACTCGCACACCATGTC | ATTCCAAGGGAACTGTGCTG |
| Tobi | AGTTCCTTTTGGGCGAAGAC | TCCGCTCTACTCCAGTGTGA |
| αTub84D | GTGCATGTTGTCCAACACCAC | AGAACTCTCCCTCCTCCATA |
| RpL40 | CTGCGTGGTGGTATCATTG | CAGGTTGTTGGTGTGTCC |
| EloB | GCACAAACATACACACTCACG | TTTCCTACTTCGCTTGCACC |
| eIF-1A | TCGTCTGGAGGCAATGTG | GAGTCCTGGTAGTCACGC |
Иммунохимическое окрашивание яичников дрозофилы. Для окрашивания яйцевых камер яичники 7-дневных самок изолировали в растворе фосфатно-солевого буфера (PBS), фиксировали в 4%-ном растворе параформальдегида и 0.2% Тритона Х-100. Далее яичники трижды отмывали в растворе PBS и 0.2% Тритона Х-100. Для окрашивания актина яичники инкубировали в течение 1 ч в фаллоидине (Phalloidin-CF594, “Biotium” CША, разведение 1 : 40) и затем трижды отмывали в PBS. Для окрашивания ДНК в клетках яичники на протяжении 15 мин обрабатывали РНКазой А (100 мг/мл), после чего трижды отмывали в PBS и инкубировали в течение 15 мин в красителе SytoxGreen (“Thermo Fisher Scientific”, разведение 1 : 500).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка фертильности линии MS
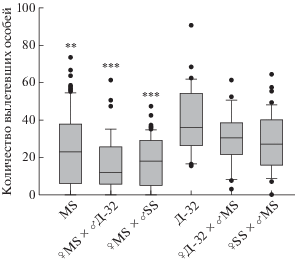
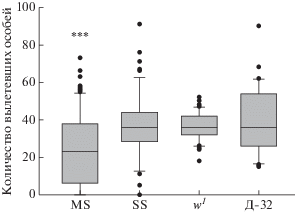
Фертильность линии MS оценивали относительно контрольных линий: SS, w1 и дикого типа Д-32. В эксперименте подсчитывали количество потомства, произведенное одной самкой в течение первых 7 дней стадии имаго. Показано, что фертильность линии MS статистически значимо ниже фертильности контрольных линий SS, w1, Д-32 (рис. 1). При этом особи линии MS оказались гетерогенными по исследуемому признаку, так как выборка включала пары с пониженной фертильностью, а также пары с нормальной фертильностью или бесплодные пары (около 20%). Всего около 30–35% пар мух линии MS за 7 дней эксперимента не дали потомства или дали в 5–8 раз меньше, чем в среднем у контрольных линий.
Рис. 1.
Потомство, полученное от одной самки линий MS, SS, w1 и Д-32 за 7 дней. *** Тест Манна–Уитни, р < 0.001 при сравнении выборки линии MS с другими выборками.
Ежедневно от момента подсадки самца к виргинной самке одна самка линии MS откладывала от 0 до 12 яиц. При этом динамика откладывания яиц у некоторых самок линии MS отличалась от динамики контрольных линий. У самок контрольных линий наблюдалось увеличение количества откладываемых яиц с возрастом с постепенным выходом на плато. У самок линии MS корреляция между количеством отложенных яиц и возрастом самки не наблюдалась. При этом смертность мух линии MS на эмбриональных и личиночных стадиях составила 3%, что соответствует смертности мух дикого типа.
Чтобы оценить репродуктивные способности особей линии MS в зависимости от пола, мы проводили реципрокные скрещивания мух линии MS с мухами линий SS и Д-32 и оценивали количество потомства, произведенного одной самкой в течение первых 7 дней стадии имаго. Выявлено, что низкая плодовитость самок линии MS не зависит от партнера по спариванию (рис. 2). Скрещивание самцов MS с самками других линий не приводит к значимому снижению плодовитости пар. Таким образом, низкая плодовитость линии MS определяется, прежде всего, самками. Вместе с тем, нельзя исключать нарушения полового поведения самцов. Поэтому далее проводили сравнительный анализ полового поведения самцов исследуемых линий.
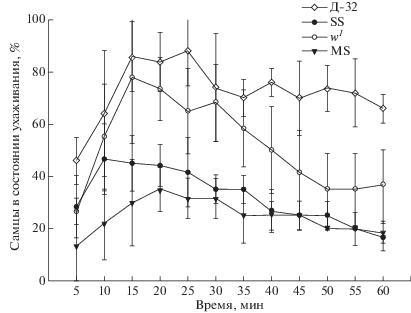
Оценка полового поведения самцов линии MS
Оценивали также половое поведение и активность самцов линии MS. Чтобы исключить влияние нарушения зрения на половое поведение самцов, в качестве дополнительного контроля использовали линию w1, поскольку линии с генотипом flamenco (линии SS и MS) являются мутантами по гену white. Отсутствие экранирующих пигментов глаз у мутантов по гену white вызывает нарушения зрения, особенно при высокой интенсивности света [15].
Анализ полового поведения чистых линий MS, SS, w1 и Д-32 выявил различия в активности самцов (рис. 3, табл. 2). У самцов всех линий, мутантных по гену white, половая активность снижена по сравнению с особями дикого типа, что связано с нарушением визуального восприятия самки. У самцов линий SS и MS наблюдается сходная половая активность, что можно объяснить изогенным происхождением этих линий. При этом нарушенное половое поведение самцов линии MS не влияет на плодовитость пары при скрещивании с самками других линий. Таким образом, можно заключить, что снижение плодовитости линии MS определяется самками.
Исследование морфологии яичников самок линии MS
Проведено сравнительное изучение морфологии яичников у самок линии MS и контрольных линий SS и Д-32, а также у гибридных самок первого поколения, полученных при скрещивании линии MS с контрольными линиями (рис. 4).
Рис. 4.
Яичники самок в возрасте 7 дней. Линии SS (а) и Д-32 (б), имеющие нормальную плодовитость, не содержат морфологических нарушений, как и яичники гибридов F1 от скрещивания ♀MS × ♂SS (в) и гибридов F1 от скрещивания ♀SS × ♂MS (г). д–ж – Яичники самок линии MS могут содержать меньше сформированных яиц или не содержать морфологических изменений, как и яичники мух контрольных линий.
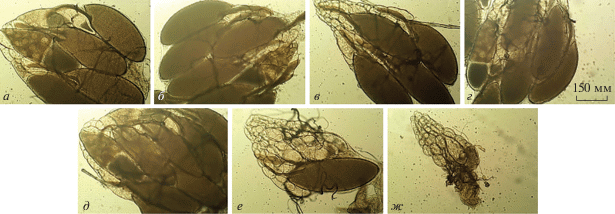
Самок линии MS в возрасте 7 дней можно разделить на три группы. Самки первой группы имели нормальную пару яичников: оба крупных яичника содержат от четырех до восьми сформированных яиц, видны стадии оогенеза. Самки второй группы обладали полностью сформированными яичниками, но с ограниченным числом зрелых яиц – до трех. Самки третьей группы имели сформированные яичники без яиц, внешне похожие на яичники самок старше 1-го дня. Иммунохимическое окрашивание яичников самок линии MS выявило комплексные нарушения морфологии яичников относительно контрольных линий: дефекты фолликулярного слоя, кольцевых каналов, деградацию трофоцитов (рис. 5).
Рис. 5.
Иммунохимическое окрашивание яичников самок D. melanogaster линии MS. ДНК и ядра клеток показаны зеленым, актин и клеточные оболочки – красным. а – Яичники самок контрольной линии без морфологических нарушений; б – яичники мух линии MS содержат большое число яйцевых камер с деградированными ядрами трофоцитов (стрелка); в – нарушение фолликулярного слоя клеток (стрелка) в яичниках мух линии MS; г – отсутствие четких клеточных границ и кольцевых каналов (стрелки) в яичниках мух линии MS.
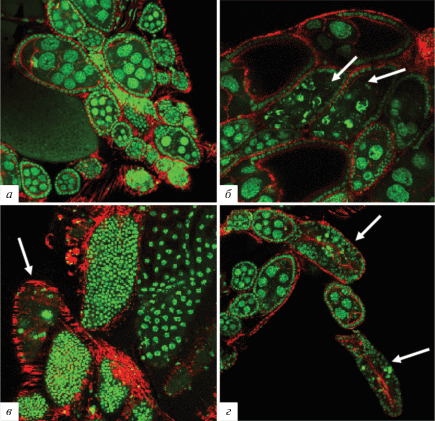
Контрольные линии SS и Д-32 и гибриды первого поколения от линии MS имели крупные яичники с 4–10 сформированными зрелыми яйцами. Самки F1 от скрещивания ♀MS × ♂SS и ♀MS × ♂Д-32 имели крупные яичники с 2–6 зрелыми яйцами.
Исследование репродуктивных способностей у гибридных потомков линии MS
Ранее было показано, что в линии MS, мутантной по локусу flamenco, инсерция gypsy локализована в гене forked, расположенном на Х-хромосоме, расстояние между flamenco и forked составляет около 8 сМ [15]. Линия гомозиготна по инсерции gypsy и, следовательно, по мутации forked. Чтобы выяснить, влияет ли мутация в гене forked на плодовитость самок, мы скрестили самок линии MS с самцами линий Д-32 и SS. Все проанализированные гибридные самки F1 были плодовитыми. В F2 наблюдали расщепление самок 1 : 1 по фенотипу forked. В случае нарушения плодовитости у самок с генотипом forked в F2 можно было предположить, что сниженная плодовитость определяется мутацией в гене forked. Всего проанализировано 156 самок F2 с генотипом forked (1/4 потомства). Для анализа количества потомства самок F2 скрещивали с самцами дикого типа. Мы не обнаружили нарушения репродуктивных способностей ни у одной из самок F2 c генотипом forked относительно контрольных линий. Все исследованные самки имели нормальную плодовитость несмотря на то, что у половины самок F2 был генотип flamenco, причем в большинстве случаев в сочетании с forked, как в линии MS.
Это указывает на то, что признак сниженной фертильности в линии MS не зависит ни от генотипа flamenco, ни от генотипа forked, и либо контролируется несколькими, не менее чем тремя, рецессивными аллелями независимо наследующихся генов, взаимодействующих по типу полимерии, либо не подчиняется закономерностям Менделя.
Анализ транспозиционной активности у самок линий MS и гибридных потомков линии MS
Транспозиционную активность МГЭ gypsy у самок линии MS и у гибридных самок F2 с генотипом flamenco, полученных от скрещивания самок MS с самцами дикого типа, подтверждали с помощью ovoD-теста. Этот тест представляет собой систему скрещиваний, направленных на выявление событий транспозиции МГЭ в линиях дрозофилы. Он основан на использовании доминантной мутации женской стерильности ovoD1 [14], локализованной в Х-хромосоме и вызывающей атрофию обоих яичников у самок. Локус ovo – это “горячая точка” инсерции gypsy [16, 17]. Инсерция gypsy в локус ovo приводит к реверсии мутации стерильности и восстановлению фертильности у самок, гетерозиготных по мутации.
Самцов линии ovoD скрещивали с виргинными самками линий дикого типа, MS и самками второго поколения c генотипом flamenco, анализировали яичники самок из полученного потомства. При анализе мы учитывали, что причиной появления фертильных самок в потомстве ovoD может быть и митотический кроссинговер (частота не превышает 0.5%), в результате которого половые клетки лишаются аллеля ovoD1. Следовательно, если число фертильных самок в потомстве превышает 0.5%, то исследуемую линию можно считать генетически нестабильной.
В тесте с использованием линии дикого типа восстановление фертильности произошло только у одной самки из 547, что составляет менее 0.5% реверсий локуса ovo. У линии MS данный показатель составил 1% (шесть самок с яичником из 584 проанализированных). У самок F2 с генотипом flamenco, полученных от скрещивания самок MS с самцами дикого типа, показатель реверсии локуса ovo составил 2.1% (12 самок с яичником из 571 проанализированной). Полученные данные подтверждают, что линия MS сохраняет генетическую нестабильность, что обеспечивается присутствием мутантного аллеля flamenco и транспозиционно активной копии gypsy. При этом сниженную плодовитость линии только в 3% случаев можно объяснить инсерциями gypsy в локус ovo.
Сравнительное исследование транскриптомов линий SS и MS
С целью поиска генетических маркеров, обусловливающих нарушение репродуктивности линии MS, проведено секвенирование транскриптомов мух линий SS, MS и Д-32. Мы провели поиск мутаций в экзомах секвенированных нами линий flamenco, способных повлиять на функционирование системы РНК-интерференции. В предыдущих исследованиях было показано, что в линиях SS и MS с фенотипом flamenco транскрипция основных генов-участников системы РНК-интерференции не изменена, однако это не исключало возможности нарушения экспрессии генов на уровне белка. В анализ взяли 89 генов, участвующих в РНК-интерференции, ни в одном из которых не обнаружили замен, которые могли бы иметь функциональное значение [19].
Анализ транскриптомов самок изогенных линий SS и MS выявил совпадение 96% аминокислотных замен относительно референсного генома BDGP6. При этом в линии MS относительно линии SS не обнаружено делеций, вставок, нонсенс-кодонов и миссенс-замен в белоккодирующих последовательностях. С помощью сравнительного анализа транскриптомов линий MS и SS выявлены различия в экспрессии 93 генов, из которых экспрессия 51 гена снижена в линии MS в сравнении с линией SS. В результате функционального анализа идентифицированы категории генов, вовлеченных в формирование хориона и вителлиновой мембраны (табл. 3). При этом уровень экспрессии генов, аннотированных этими категориями, был снижен у особей линии MS.
Таблица 3.
Функциональный анализ 51 гена с пониженной экспрессией в линии MS
| Категория генов | Термин | р-Значение | FDR, вероятность фальшивого открытия, тест Фишера |
|---|---|---|---|
| GOTERM_CC_DIRECT | GO:0042600~chorion | 4.740293288829082E-26 | 3.660151581174896E-23 |
| GOTERM_BP_DIRECT | GO:0007305~vitelline membrane formation involved in chorion-containing eggshell formation | 9.609740779501189E-10 | 9.630556796480505E-7 |
| GOTERM_BP_DIRECT | GO:0007304~chorion-containing eggshell formation | 4.277846940668945E-7 | 4.287105098366162E-4 |
| GOTERM_CC_DIRECT | GO:0060388~vitelline envelope | 4.603695541876441E-7 | 3.5546740293490586E-4 |
Является ли снижение экспрессии общей тенденцией для всех генов, кодирующих белки оболочки яйца у самок линии MS? Чтобы оценить это, использовали набор из 40 генов [20], кодирующих белки хориона и специфически экспрессирующихся на разных стадиях развития фолликул. Согласно результатам секвенирования транскриптома (табл. 4), экспрессия всех 40 генов в линии MS ниже, чем в SS (у большинства генов значимо).
Таблица 4.
Экспрессия генов, кодирующих белки, вовлеченные в формирование оболочки яйца, и результаты теста на дифференциальную экспрессию у особей линий SS и MS (метод DESeq)
| Ген | MS относительно SS | Ген | MS относительно SS | ||
|---|---|---|---|---|---|
| LogFoldChange | Padj | LogFoldChange | Padj | ||
| Vm34Ca | –4.11 | 4.03E-18 | CG31928 | –1.95 | 4.03E-02 |
| Vm32E | –4.93 | 3.54E-16 | Cp7Fc | –1.71 | 4.43E-02 |
| dec-1 | –3.54 | 2.25E-14 | Muc12Ea | –1.94 | 4.43E-02 |
| Vml | –4.06 | 1.15E-11 | Femcoat | –1.69 | 6.49E-02 |
| Vm26Aa | –2.80 | 9.88E-10 | Cp7Fb | –1.52 | 6.86E-02 |
| Cp19 | –2.49 | 6.88E-08 | Cp36 | –1.24 | 7.75E-02 |
| Cp18 | –2.48 | 1.36E-07 | Yp3 | –1.21 | 8.25E-02 |
| Vm26Ac | –6.08 | 1.88E-07 | Cp15 | –1.20 | 1.13E-01 |
| Cp16 | –2.55 | 2.02E-07 | CG4009 | –1.49 | 1.25E-01 |
| Vm26Ab | –2.54 | 3.41E-07 | Cp38 | –1.10 | 2.20E-01 |
| yellow-g2 | –2.98 | 9.87E-07 | CG11381 | –1.44 | 2.96E-01 |
| yellow-g | –2.23 | 5.91E-04 | CG31926 | –1.51 | 4.72E-01 |
| Mur2B | –2.00 | 1.65E-03 | Muc4B | –1.75 | 9.14E-01 |
| Psd | –2.59 | 2.08E-03 | CG12398 | –0.21 | 1 |
| CG13114 | –2.05 | 2.78E-03 | CG13992 | –0.90 | 1 |
| Fcp3C | –2.90 | 4.11E-03 | CG15570 | –0.91 | 1 |
| CG13083 | –1.88 | 4.29E-03 | Cp7Fa | –0.27 | 1 |
| Mur11Da | –2.84 | 8.58E-03 | Yp1 | –0.66 | 1 |
| CG32642 | –2.19 | 8.78E-03 | Yp2 | –0.74 | 1 |
| CG13084 | –1.66 | 1.82E-02 | CG31661 | –0.72 | 1 |
Результаты РНК-секвенирования отдельных генов подтверждены с помощью количественной ПЦР (рис. 6). В первую очередь, мы исследовали транскрипцию генов, специфичных для фолликулярных клеток яичников, у индивидуальных самок линий SS и MS. Это гены Vm26Aa, psd, Fcp3C, CG14309, которые экспрессируются на стадиях S9–S10 в фолликулярных клетках [20, 21] и Cp16 со специфической экспрессией на стадии S14 [20]. Анализ 20 самок каждой линии выявил значимые различия между линиями в уровне транскрипции всех исследуемых генов за исключением Fcp3C. Оказалось, что уровень мРНК этих генов у самок линии MS, как правило, намного ниже, при этом уровень экспрессии значительно варьировал среди особей исследуемых линий (рис. 6а).
Рис. 6.
Относительный уровень транскриптов дифференциально экспрессирующихся генов у особей линий SS и MS. а – Гены Vm26Aa, Ср16, psd, Fcp3C, CG14309, специфически экспрессирующиеся в поздних фолликулах. б – Гены phu, tobi, Ggt-1 и CG3397 у самок и самцов. * Тест Манна–Уитни, N = 20, p < 0.01. Линии разброса отражают минимальное и максимальное значение в выборке.
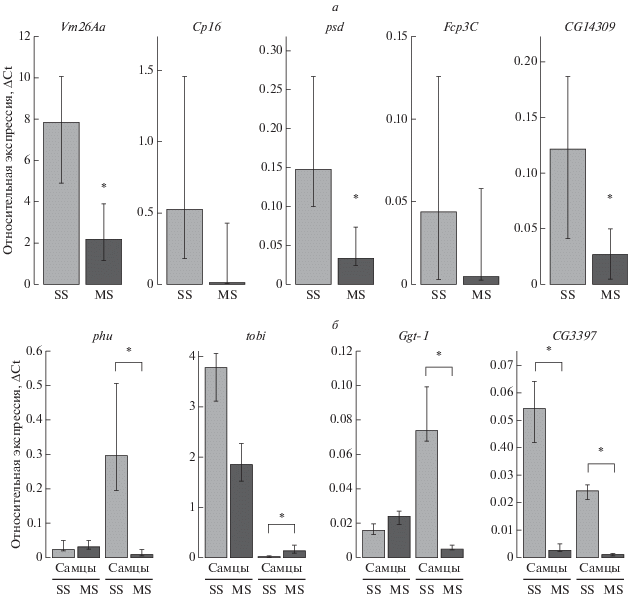
Среди других генов с высокой вариабельностью экспрессии у самок, оказались phu и tobi, которые экспрессируются и у самцов, и у самок в различных тканях. Ген phu кодирует фосфатазу, а его экспрессия подавляется в условиях голодания [22] и при воздействии различных видов стресса: окислительных агентов, гипероксии, рентгеновского излучения [23]. В свою очередь, tobi вовлечен в регуляцию углеводного обмена [24] и индуцируется при голодании [25]. У самок линии MS мы наблюдали снижение экспрессии гена phu и повышение экспрессии гена tobi, тогда как у самцов этого не наблюдалось (рис. 6б).
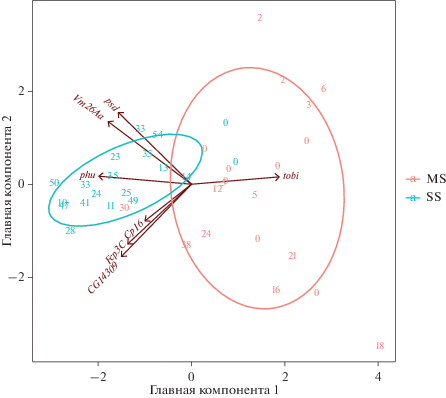
Среди других генов, экспрессия которых у самок MS (но не у самцов) ниже, чем у самок линии SS, обнаружен ген γ-глутамилтрансферазы Ggt-1 (рис. 6б), который участвует в метаболизме глутатиона и глутамата [26] и выполняет различные функции в соматических тканях [27], но также экспрессируется на высоком уровне и в генеративных тканях, и на ранней эмбриональной стадии (по данным базы FlyBase – flybase.org) и, вероятно, участвует в процессе оплодотворения [26]. Стоит отметить, что у всех самок линии MS независимо от их продуктивности уровень мРНК Ggt-1 значительно снижен в сравнении с самками родительской линии. Среди генов, экспрессия которых снижена у самок и самцов линии MS, обнаружен ген CG3397, индуцируемый гипероксией и вовлеченный в этот процесс [28, 29]. У 40 самок линий SS и MS (по 20 особей каждой линии), используемых в анализе экспрессии генов, мы также оценивали количество потомства, произведенного одной особью за 7 дней. Оказалось, что этот показатель не связан строго с уровнем транскрипции какого-либо из исследуемых генов. Однако, как правило, фертильные самки линии SS имели схожие показатели уровня транскрипции исследуемых генов, а у фертильных самок MS наблюдалась разнообразная картина. Вариабельность экспрессии этих генов и показатель количества потомства за 7 дней отражены на графике пространства главных компонент (рис. 7).
Рис. 7.
График факторных нагрузок (главных компонент 1 и 2), отображающий взаимные корреляции относительного уровня мРНК генов с вариабельной экспрессией у отдельных самок линий SS и MS. Чем ближе векторы на графике друг к другу, тем больше положительная корреляция экспрессии генов. Цифрами отмечено количество потомства, произведенное соответствующей самкой за 7 дней. Видно, что при увеличении экспрессии гена tobi уменьшается экспрессия всех остальных исследуемых генов, особенно гена phu.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее в нашей лаборатории была получена система из двух изогенных линий D. melanogaster – SS и MS, мутантных по локусу flamenco [30]. Линия MS получена путем введения в линию SS активной копии ретротранспозона gypsy [11] и характеризуется нестабильностью генома, вызванной транспозицией МГЭ gypsy. Нами показано, что генетическая нестабильность у мух этой линии сопровождается сниженной фертильностью самок и аномальным поведением самцов. Низкая фертильность самок обусловлена нарушениями процесса оогенеза. Выявленные дефекты трофоцитов предполагают нарушение нормального развития ооцита на поздних стадиях оогенеза, поскольку трофоциты необходимы в качестве источника органелл (митохондрий и рибосом) и биологических макромолекул (белков, полисахаридов, липидов) [31, 32]. Кроме деградации отдельных трофоцитов, выявленные нарушения границ между клетками могут отражать дефекты цитоскелета (микротрубочек и актиновых филаментов), важного для транспорта из трофоцитов в ооцит [33, 34]. Отсутствие кольцевых каналов (не наблюдается выраженных структур на фотографии рис. 5) также отражает общие нарушения в формировании фусомы (цистоцитов, связанных кольцевыми каналами), которая формируется на раннем этапе оогенеза. Эта структура важна для нормального оогенеза как у беспозвоночных, так и у позвоночных [35]. Полученные данные отражают нарушения, происходящие на ранних стадиях (до вителлогенеза), вероятно, на стадии дифференцировки трофобластов или деления цистоцитов. Также не исключено, что выявленные дефекты могут быть вызваны нарушениями оогенеза на более ранних стадиях (например, при асимметричном делении герминальной стволовой клетки). Отсутствие нормального фолликулярного слоя оказывает влияние на формирование яйцевых оболочек и соответственно на фертильность линии [36, 37]. Таким образом, нарушение фертильности у линии MS вызвано совокупностью выявленных дефектов. В свою очередь, эти дефекты могут быть связаны как с конкретным генетическим нарушением, так и с системным эффектом, обусловленным активностью ретротранспозона gypsy.
Линия MS характеризуется инсерцией gypsy в ген forked. Ген forked является “горячей точкой” инсерции gypsy, описано несколько мутантов по гену forked, полученных в результате инсерции gypsy [38]. При этом в научной литературе нет информации о том, что ген forked может участвовать в оогенезе. Следует отметить, что эухроматиновые инсерции gypsy (подобные нашей) могут влиять на работу системы РНК-интерференции и модифицировать активность локуса flamenco [39], что приводит к усилению фенотипа flamenco. Однако мы показали, что мутация в гене forked, вызванная инсерцией gypsy, не связана с процессами оогенеза самок линии MS.
Далее мы провели сравнительный анализ транскриптомов линий MS и SS. В линии MS не обнаружено мутаций (стоп-кодонов, делеций, инсерций) в белоккодирующих генах, которые бы отличали эту линию от линии SS. Конечно, следует учитывать, что мы проанализировали только часть транскриптома, поскольку в анализ не попали гены, не экспрессирующиеся на стадии имаго. Кроме того, мы не анализировали некодирующие РНК. Поэтому не исключено, что в линии MS есть мутации, приводящие к нарушению фертильности, но мы их не обнаружили.
Анализ транскриптома выявил различия в экспрессии 93 генов, экспрессия 51 из которых в линии MS снижена в сравнении с линией SS. В основном, это гены, вовлеченные в формирование хориона и вителлиновой мембраны.
Таким образом, транскриптомные данные отражают комплексное нарушение стадий позднего оогенеза — вителлогенеза и формирования хориона. Причинами этого нарушения могут быть как дефекты предшествующих стадий оогенеза, так и некорректная работа механизмов, обеспечивающих созревание ооцита.
Дифференцировка фолликулярных клеток, продукция белков оболочек, содержание белка и липидов в ооцитах зависят от многих сигнальных механизмов и гормональных стимулов, таких как ювенильный гормон [40] и экдизон [41, 42]. Статус питания [43], углеводный обмен и инсулиновый сигналинг также определяют репродуктивную функцию на разных стадиях оогенеза [44]. Активность митохондрий является одним из важных факторов в позднем оогенезе, влияющих на репродуктивность [45]. Анализ уровня мРНК генов, участвующих в вителлогенезе (Cp16, Fcp3C, psd, Vm26Aa, CG14309), у индивидуальных особей выявил вариабельный профиль экспрессии у самок линии MS. Таким образом, нарушения поздних стадий оогенеза, вероятно, не имеют систематического характера. В число генов с повышенным, но вариабельным уровнем экспрессии у самок MS входят гены tobi и phu. Ген гликозидазы tobi является регулятором углеводного обмена, его сверхэкспрессия приводит к увеличению запасов гликогена и подавлению роста у личинок, также его экспрессия регулируется в зависимости от статуса питания (подавляется при избытке сахаров или недостатке белка) [46]. В свою очередь, экспрессия гена phu значительно зависит от потребления сахаров [47]. Предположительно, изменение экспрессии tobi и углеводного обмена у самок линии MS относительно контрольной линии может влиять на репродуктивность, либо служить компенсаторным механизмом для поддержания необходимого уровня гликогена в ооцитах [45]. Роль генов Ggt-1 и CG3397, значительно пониженный уровень экспрессии которых обнаружен нами у всех самок MS, в оогенезе и репродуктивности требует изучения.
Результаты, полученные с помощью ovoD-теста, подтверждают, что линию MS можно считать генетически нестабильной (частота реверсий – 1%). На момент получения линии MS реверсии локуса ovoD составляли 50% [48]. Спустя 25 лет культивирования произошло уменьшение транспозиционной активности gypsy в 50 раз. Таким образом, за время культивирования мутантная линия MS приобрела не только сниженную плодовитость, но и механизмы супрессии сверхвысокой частоты транспозиции gypsy. Последнее может объясняться накоплением в геноме этой линии последовательностей gypsy, которые могли бы использоваться как матрицы piРНК в механизме подавления транспозиции путем РНК-интерференции (по нашим неопубликованным данным в линии MS насчитывается семь–восемь копий gypsy). У гибридов F2 c генотипом flamenco, полученных от скрещивания самок MS с самцами дикого типа, плодовитость восстанавливается, но частота транспозиции возрастает в 2 раза по сравнению с линией MS, что может быть связано с “разбавлением” их аутосом и потерей части копий gypsy, присутствовавших в геноме родительской линии MS.
Таким образом, снижение фертильности самок линии MS может быть либо следствием повышенной транспозиционной активности МГЭ gypsy, способствующей генетической нестабильности в линии MS, либо следствием случайных процессов, например дрейфа генов, способствующих накоплению сразу нескольких (не менее трех) рецессивных мутаций в генах, контролирующих оогенез.
Отметим, что снижение фертильности характерно для мутантов по генам системы РНК-интерференции, контролирующих транспозиции МГЭ [3, 6, 7, 9, 49]. Полная стерильность характерна для гибридных самок, полученных при скрещивании самцов, несущих транспозиционно активный МГЭ, с самками, не имеющими ни активных копий этого МГЭ, ни, как следствие, защитных механизмов, препятствующих транспозиции. В результате такого скрещивания происходит активация транспозиции МГЭ (транспозиционный взрыв) у потомков, что коррелирует со стерильностью гибридных самок. Это явление носит название гибридного (гонадального) дисгенеза [50]. Молекулярные механизмы гибридного дисгенеза, приводящие к стерильности самок, неизвестны; обнаружено, что высокий уровень транспозиции МГЭ коррелирует с низким уровнем piРНК в герминальных тканях самки [51]. Системы гибридного дисгенеза в основном обусловлены транспозициями и эксцизиями мобильных элементов в развивающихся зародышевых клетках. Высокая частота хромосомных перестроек и рекомбинаций у самцов происходят преимущественно в сайтах инсерции МГЭ [52, 53]. Предполагается, что гибридный дисгенез – это адаптивная реакция организма, препятствующая распространению активных копий МГЭ в популяции [54].
Можно предположить, что снижение фертильности в линии MS – плата за выживание линии в условиях сильной генетической нестабильности и защита от распространения МГЭ gypsy в популяции. Молекулярные механизмы, запускающие процесс подавления оогенеза в линии MS, могут быть аналогичны механизмам, действующим при гибридном дисгенезе, однако они не приводят к полной стерильности самок. Эти механизмы могут быть как генетическими, так и эпигенетическими. В условиях генетической нестабильности они, по-видимому, действуют направленно, в результате чего популяция через ряд поколений приобретает снижение плодовитости и супрессию транспозиционной активности gypsy. Дальнейшая наша работа будет направлена на поиск факторов, направляющих такой отбор.
Авторы выражают благодарность Ю.Е. Воронцовой (Институт биологии развития имени Н.А. Кольцова РАН) за помощь в проведении экспериментов по иммуногистохимическому окрашиванию.
Работа поддержана Российским фондом фундаментальных исследований (проект № 17-04-01250 А).
Статья не содержит каких-либо исследований с использованием животных в качестве объектов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cox D.N., Chao A., Baker J., Chang L., Qiao D., Lin H. (1998) A novel class of evolutionarily conserved genes defined by piwi are essential for stem cell self-renewal. Genes Dev. 12(23), 3715–3727.
King F.J., Lin H. (1999) Somatic signaling mediated by fs(1)Yb is essential for germline stem cell maintenance during Drosophila oogenesis. Development. 126(9), 1833–1844.
Ma X., Wang S., Do T., Song X., Inaba M., Nishimoto Y., Liu L.P., Gao Y., Mao Y., Li H., McDowell W., Park J., Malanowski K., Peak A., Perera A., Li H., Gaudenz K., Haug J., Yamashita Y., Lin H., Ni J.Q., Xie T. (2014) Piwi is required in multiple cell types to control germline stem cell lineage development in the Drosophila ovary. PLoS One. 9(3), e90267.
Якушев Е.Ю., Михалева Е.А., Абрамов Ю.А., Соколова О.А., Зырянова И.М., Гвоздев В.А., Кленов М.С. (2016) Роль ядерной локализации piwi в дифференцировке и пролиферации герминальных стволовых клеток. Молекуляр. биология. 50(4), 713–720.
Megosh H.B., Cox D.N., Campbell C., Lin H. (2006) The role of PIWI and the miRNA machinery in Drosophila germline determination. Curr. Biol. 16(19), 1884–1894.
Chen J.M., Willers C., Xu J., Wang A., Zheng M.H. (2007) Autologous tenocyte therapy using porcine-derived bioscaffolds for massive rotator cuff defect in rabbits. Tissue Eng. 13(7), 1479–1491.
Atikukke G., Albosta P., Zhang H., Finley R.L. Jr. (2014) A role for Drosophila cyclin J in oogenesis revealed by genetic interactions with the piRNA pathway. Mech. Dev. 133, 64–76.
Pelisson A., Song S.U., Prud’homme N., Smith P.A., Bucheton A., Corces V.G. (1994) Gypsy transposition correlates with the production of a retroviral envelope-like protein under the tissue-specific control of the Drosophila flamenco gene. EMBO J. 13(18), 4401–4411.
Mevel-Ninio M., Pelisson A., Kinder J., Campos A.R., Bucheton A. (2007) The flamenco locus controls the gypsy and ZAM retroviruses and is required for Drosophila oogenesis. Genetics. 175(4), 1615–1624.
Guida V., Cernilogar F.M., Filograna A., De Gregorio R., Ishizu H., Siomi M.C., Schotta G., Bellenchi G.C., Andrenacci D. (2016) Production of small noncoding RNAs from the flamenco locus is regulated by the gypsy retrotransposon of Drosophila melanogaster. Genetics. 204(2), 631–644.
Kim A.I., Lyubomirskaya N.V., Belyaeva E.S, Shos-tack N.G., Ilyin Y.V. (1994) The introduction of a transpositionally active copy of retrotransposon gypsy into the stable strain of Drosophila melanogaster causes genetic instability. Mol. Gen. Genet. 242(4), 472–477.
Razorenova O.V., Karpova N.N., Smirnova Iu.B., Kusulidu L.K., Reneva N.K., Subocheva E.A., Kim A.I., Liubomirskaia N.V., Il’in Iu.V. (2001) Interlineage distribution and characteristics of the structure of two subfamilies of Drosophila melanogaster MDG4 (gypsy) retrotransposon. Russ. J. Genetics. 37(2), 175–182.
Prud’homme N., Gans M., Masson M., Terzian C., Bucheton A. (1995) Flamenco, a gene controlling the gypsy retrovirus of Drosophila melanogaster. Genetics. 139(2), 697–711.
Нефедова Л.Н., Романова Н.И., Ким А.И. (2007) Особенности структурной организации гена DIP1 в линиях Drosophila melanogaster, мутантных по гену flamenco. Генетика. 43(1), 71‒78.
Кузин А.Б., Любомирская Н.В., Ильин Ю.В., Худайбергенова Б.М., Ким А.И. (1994) Горячая точка встраивания ретротранспозона МДГ4 в локус forked и его точное вырезание. Докл. РАН. 335(5), 656‒658.
Mével-Ninio M., Mariol M.C., Gans M. (1989) Mobilization of the gypsy and copia retrotransposons in Drosophila melanogaster induces reversion of the ovo dominant female-sterile mutations: molecular analysis of revertant alleles. EMBO J. 8(5), 1549–1558.
Dej K.J., Gerasimova T., Corces V.G., Boeke J.D. (1998) A hotspot for the Drosophila gypsy retroelement in the ovo locus. Nucl. Acids Res. 26(17), 4019–4025.
Krstic D., Boll W., Noll M. (2013) Influence of the White locus on the courtship behavior of Drosophila males. PLoS One. 8(10), e77904.
Czech B., Preall J.B., McGinn J., Hannon G.J. (2013) A transcriptome-wide RNA screen in the Drosophila ovary reveals factors of the germline piRNA pathway. Mol. Cell. 50(5), 749–761.
Tootle T.L., Williams D., Hubb A., Frederick R., Spradling A. (2011) Drosophila eggshell production: identification of new genes and coordination by Pxt. PLoS One. 6(5), e19943.
Fakhouri M., Elalayli M., Sherling D., Hall J.D., Miller E., Sun X., Wells L., LeMosy E.K. (2006) Minor proteins and enzymes of the Drosophila eggshell matrix. Dev. Biol. 293(1), 127–141.
Fujikawa K., Takahashi A., Nishimura A., Itoh M., Takano-Shimizu T., Ozaki M. (2009) Characteristics of genes up-regulated and down-regulated after 24 h starvation in the head of Drosophila. Gene. 446(1), 11–17.
Landis G., Shen J., Tower J. (2012) Gene expression changes in response to aging compared to heat stress, oxidative stress and ionizing radiation in Drosophila melanogaster. Aging (Albany NY). 4(11), 768–789.
Buch S., Melcher C., Bauer M., Katzenberger J., Pankratz M.J. (2008) Opposing effects of dietary protein and sugar regulate a transcriptional target of Drosophila insulin-like peptide signaling. Cell Metab. 7(4), 321–332.
Grönke S., Mildner A., Fellert S., Tennagels N., Petry S., Müller G., Jäckle H., Kühnlein R.P. (2005) Brummer lipase is an evolutionary conserved fat storage regulator in Drosophila. Cell Metab. 1(5), 323–330.
Walker M.J., Rylett C.M., Keen J.N., Audsley N., Sajid M., Shirras A.D., Isaac R.E. (2006) Proteomic identification of Drosophila melanogaster male accessory gland proteins, including a pro-cathepsin and a soluble gamma-glutamyl transpeptidase. Proteome Sci. 4, 9.
Liu J., Gong Z., Liu L. (2014) γ-glutamyl transpeptidase 1 specifically suppresses green-light avoidance via GABAA receptors in Drosophila. J. Neurochem. 130(3), 408–418.
Gruenewald C., Botella J.A., Bayersdorfer F., Navarro J.A., Schneuwly S. (2009) Hyperoxia-induced neurodegeneration as a tool to identify neuroprotective genes in Drosophila melanogaster. Free Radic. Biol. Med. 46(12), 1668–1676.
Icreverzi A., de la Cruz A.F., Walker D.W., Edgar B.A. (2015) Changes in neuronal CycD/Cdk4 activity affect aging, neurodegeneration, and oxidative stress. Aging Cell. 14(5), 896–906.
Ким А.И., Беляева Е.С. (1986) Транспозиции МДГ4 на фоне неизменной локализации других мобильных элементов в мутаторной линии Drosophila melanogaster, характеризующейся генетической нестабильностью. Докл. АН СССР. 289(5), 1248–1252.
Koch E.A., Smiht P.A., King R.S. (1967) The division and dif-ferentiation of Drosophila cystocytes. J. Morphol. 121, 55–70.
Ogienko A.A., Fedorova S.A., Baricheva E.M. (2007) Basic aspects of ovarian development in Drosophila melanogaster. Genetika. 43(10), 1341–1357.
Gutzeit H.O. (1986) The role of microfilaments in cytoplasmic streaming in Drosophila follicles. J. Cell Sci. 80, 159–169.
Lopez de Heredia M., Jansen R.P. (2004) mRNA localization and the cytoskeleton. Curr. Opin. Cell Biol. 16(1), 80–85.
Kloc M., Bilinski S., Dougherty M.T., Brey E.M., Etkin L.D. (2004) Formation, architecture and polarity of female germline cystin Xenopus. Develop. Biol. 266(1), 43–61.
Claycomb J.M., Orr-Weaver T.L. (2005) Developmental gene amplification: insights into DNA replication and gene expression. Trends Genet. 21(3), 149–162.
Klusza S., Deng W.M. (2011) At the crossroads of differentiation and proliferation: precise control of cell-cycle changes by multiple signaling pathways in Drosophila follicle cells. Bioessays. 33(2), 124–134.
Hoover K.K., Chien A.J., Corces V.G. (1993) Effects of transposable elements on the expression of the forked gene of Drosophila melanogaster. Genetics. 135(2), 507–526.
Guida V., Cernilogar F.M., Filograna A., De Gregorio R., Ishizu H., Siomi M.C., Schotta G., Bellenchi G.C., Andrenacci D. (2016) Production of small noncoding RNAs from the flamenco locus is regulated by the gypsy retrotransposon of Drosophila melanogaster. Genetics. 204(2), 631–644.
Santos C.G., Humann F.C., Hartfelder K. (2019) Juvenile hormone signaling in insect oogenesis. Curr. Opin. Insect. Sci. 31, 43–48.
Carney G.E., Bender M. (2000) The Drosophila ecdysone receptor (EcR) gene is required maternally for normal oogenesis. Genetics. 154(3), 1203–1211.
Gaziova I., Bonnette P.C., Henrich V.C., Jindra M. (2004) Cell-autonomous roles of the ecdysoneless gene in Drosophila development and oogenesis. Development. 131(11), 2715–2725.
Armstrong A.R. (2019) Drosophila melanogaster as a model for nutrient regulation of ovarian function. Reproduction. pii: REP-18-0593.R3.
Das D., Arur S. (2017) Conserved insulin signaling in the regulation of oocyte growth, development, and maturation. Mol. Reprod. Dev. 84(6), 444–459.
Sieber M.H., Thomsen M.B., Spradling A.C. (2016) Electron transport chain remodeling by GSK3 during oogenesis connects nutrient state to reproduction. Cell. 164(3), 420–432.
Buch S., Melcher C., Bauer M., Katzenberger J., Pankratz M.J. (2008) Opposing effects of dietary protein and sugar regulate a transcriptional target of Drosophila insulin-like peptide signaling. Cell Metab. 7(4), 321–332.
Sun J., Liu C., Bai X., Li X., Li J., Zhang Z., Zhang Y., Guo J., Li Y. (2017) Drosophila FIT is a protein-specific satiety hormone essential for feeding control. Nat. Commun. 8, 14161.
Kim A., Terzian C., Santamaria P., Pélisson A., Purd’homme N., Bucheton A. (1994) Retroviruses in invertebrates: the gypsy retrotransposon is apparently an infectious retrovirus of Drosophila melanogaster. Proc. Natl. Acad. Sci. USA. 91(4), 1285–1289.
Sarot E., Payen-Groschкne G., Bucheton A., Pélisson A. (2004) Evidence for a piwi-dependent RNA silencing of the gypsy endogenous retrovirus by the Drosophila melanogaster flamenco gene. Genetics. 166(3), 1313–1321.
Kidwell M.G. (1985) Hybrid dysgenesis in Drosophila melanogaster: nature and inheritance of P element regulation. Genetics. 111, 337–350.
Duc C., Yoth M., Jensen S., Mouniée N., Bergman C.M., Vaury C., Brasset E. (2019) Trapping a somatic endogenous retrovirus into a germline piRNA cluster immunizes the germline against further invasion. Genome Biol. 20(1), 127.
Engels W.R., Preston C.R. (1984) Formation of chromosome rearrangements by P factors in Drosophila. Genetics. 107(4), 657–678.
Sved J.A., Eggleston W.B., Engels W.R. (1990) Germ-line and somatic recombination induced by in vitro modified P elements in Drosophila melanogaster. Genetics. 124(2), 331–337.
Srivastav S.P., Kelleher E.S. (2017) Paternal induction of hybrid dysgenesis in Drosophila melanogaster is weakly correlated with both P-element and hobo element dosage. G3 (Bethesda). 7(5), 1487–1497.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология