Молекулярная биология, 2020, T. 54, № 3, стр. 522-528
Высокая экспрессия SP1, CSF1R и PAK1 коррелирует с повышенной чувствительностью лейкозных клеток к антибиотику митрамицину
Э. Р. Вагапова a, Т. Д. Лебедев a, А. Д. Тихонова a, Б. В. Гойхман a, К. А. Иваненко a, П. В. Спирин a, В. С. Прасолов a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: prassolov45@mail.ru
Поступила в редакцию 17.01.2020
После доработки 17.01.2020
Принята к публикации 27.01.2020
Аннотация
Острые миелоидные лейкозы (ОМЛ) представляют собой генетически гетерогенную группу онкологических заболеваний гемопоэтической системы, которые крайне плохо поддаются лечению. Разработка новых таргетных препаратов (Гилтеритиниб, Венетоклакс) значительно улучшила выживаемость больных, однако к ним, как и к цитотоксическим противолейкозным препаратам, нередко возникает резистентность. Задача поиска новых молекулярных мишеней для разработки эффективных подходов к лечению ОМЛ в настоящее время весьма актуальна. В бластных клетках пациентов с ОМЛ обнаруживают мутации, хромосомные перестройки и повышенную экспрессию ряда немутантных генов, в том числе генов факторов транскрипции. Транскрипционный фактор Sp1 связывается с GC-богатыми областями регуляторных участков различных генов и контролирует таким образом их экспрессию. Мишени Sp1 включают гены, ответственные за пролиферацию, регуляцию клеточного цикла и дифференцировку. При многих злокачественных заболеваниях высокий уровень экспрессии гена Sp1 связан с неблагоприятным прогнозом, поэтому Sp1 рассматривают в качестве перспективной терапевтической мишени при онкологических заболеваниях. В настоящей работе мы оценили уровни экспрессии Sp1 в различных озлокачествленных тканях. Повышенный уровень экспрессии Sp1 выявлен в образцах, полученных от пациентов с ОМЛ, острым лимфобластным лейкозом, саркомой Юинга, раком яичников и почки. Показано также, что экспрессия Sp1 коррелирует с экспрессией генов, кодирующих рецепторы цитокинов и факторов роста – CSF1R и IL6R, внутриклеточные киназы – CSK, SYK, PAK1, ILK, JAK2, и транскрипционный фактор LMO2. Корреляция между уровнями экспрессии Sp1 и CSF1R, SYK, JAK2 и LMO2 характерна также и для перевиваемых клеток лейкоза человека. Мы измерили уровни экспрессии Sp1, CSF1R, ILK, PAK1 в клетках трех перевиваемых линий лейкоза человека и обнаружили повышенные уровни экспрессии данных генов в клетках Kasumi-1. Кроме того, мы показали, что клетки Kasumi-1 наиболее чувствительны к Митрамицину – препарату, вытесняющему Sp1 с его мишеней на ДНК. Полученные нами данные свидетельствуют о необходимости выявления клеток ОМЛ, наиболее чувствительных к ингибированию Sp1, для оценки возможности подавления его активности in vivo.
ВВЕДЕНИЕ
Лейкоз – одно из наиболее распространенных заболеваний кроветворной системы. Ключевой причиной развития лейкозов, в том числе и острого миелоидного лейкоза (ОМЛ), считается накопление мутаций в кроветворных клетках-предшественниках, которые претерпевают злокачественное перерождение, в результате чего теряют способность к нормальной дифференцировке и приобретают способность к усиленной пролиферации [1].
Для подавляющей части лейкозов характерно наличие хромосомных перестроек и мутаций, затрагивающих важные для гемопоэтической дифференцировки гены. Также в бластных клетках пациентов с ОМЛ обнаруживают сверхэкспрессию немутантных генов, в том числе транскрипционных факторов [2]. Средний возраст больных ОМЛ составляет 68 лет. Прогноз у пожилых пациентов неблагоприятный: 5-летняя выживаемость у них составляет ~5% по сравнению с 70% у детей. На данный момент обнаружено несколько перспективных мишеней (FLT3, Bcl-2, IDH1/IDH26, KIT) для лечения ОМЛ, однако к существующим противолейкозным препаратам нередко развивается устойчивость in vitro и in vivo [3–5]. Механизмы развития устойчивости к терапевтическим агентам требуют дальнейшего изучения.
В злокачественных клетках разного типа (аденокарциномы, колоректальный рак, рак молочной железы и др.) обнаружена сверхэкспрессия гена Sp1, который кодирует одноименный фактор транскрипции Sp1 (specificity protein 1), входящий в семейство Sp/Krüppel-like (KLF). Sp1 связывается с GC-богатыми участками регуляторных областей генов и участвует в регуляции экспрессии генов, кодирующих белки, ответственные за пролиферацию (PDGF, PDGFR, EGFR), регуляцию клеточного цикла (Cyclin D1, Cyclin B1, Cdc25) и апоптоза (Bcl-2, survivin), а также дифференцировку (c-jun, c-fos) [6–8].
Больных аденокарциномой с повышенной экспрессией Sp1 отличает более агрессивное течение заболевания – низкая общая выживаемость и наличие метастазов в лимфатических узлах [9]. Высокий уровень экспрессии Sp1 при раке легкого также связан с неблагоприятным прогнозом [10]. Показано, что в клетках рака желудка, молочной железы, панкреатического рака уровни экспрессии Sp1 выше, чем в нормальных клетках [11, 12].
Известно, что антибиотик Митрамицин (Mithramycin, Plicamycin) конкурентно связывает GC-богатые участки ДНК, тем самым вытесняя Sp1 с его мишеней на ДНК. Митрамицин рассматривают в качестве препарата, применяемого при ряде злокачественных заболеваний как в качестве монотерапии, так и в комбинации с противоопухолевыми препаратами [13, 14]. Митрамицин в настоящее время проходит клинические испытания при солидных опухолях. Остается неизвестным, насколько существенен вклад сверхэкспрессии Sp1 в возникновение и прогрессию лейкозов, так как роль Sp1 в лейкозных клетках до сих пор не установлена. Существенный интерес представляет возможность использования ингибиторов активности Sp1 (в частности Митрамицина) в комбинации с существующими противолейкозными химиотерапевтическими препаратами.
В данной работе мы исследовали экспрессию Sp1 в клетках лейкоза человека и выявили гены, экспрессия которых коррелирует с уровнем Sp1. Полученные результаты подтвердили на перевиваемых клетках лейкоза человека, а также оценили их чувствительность к Митрамицину ‒ препарату, конкурентно связывающему мишени Sp1 на ДНК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культуры клеток. Перевиваемые клетки лейкоза человека U937, HL-60 и Kasumi-1 культивировали с использованием культуральной среды RPMI 1640 (“Gibco”, США) с добавлением 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 1 мМ пирувата натрия, 2 мМ L-глутамина при 37°C и 5% CO2. К клеткам U937 и HL-60 дополнительно добавляли 10% эмбриональной сыворотки крупного рогатого скота (FBS), а к Kasumi-1 – 20% FBS. Все линии клеток получены из института Heinrich-Pette Institute-Leibniz Institute for Experimental Virology (ФРГ) и протестированы на отсутствие контаминации микоплазмой.
Количественная ПЦР в реальном времени. РНК выделяли из 500 000 клеток с использованием Trizol (“Invitrogen”, США) в соответствии с протоколом производителя. Качественный и количественный анализ РНК проводили с использованием спектрофотометра (“NanoDrop”, США). Выделенную из клеток РНК хранили при температуре 4°С не более 2 сут, 5000 нг РНК использовали для синтеза кДНК с использованием набора для обратной транскрипции “ThermoFisher” (рандомные праймеры). ПЦР в реальном времени проводили с флуоресцентным красителем Maxima SYBR Green Supermix (“Thermo Scientific”, США) на амплификаторе CFX96 Real-Time System (“Bio-Rad”, США). Экспрессию целевых генов нормировали по экспрессии гена домашнего хозяйства GAPDH в каждой пробе. Подсчет Ct и относительного уровня экспрессии проводили в программном обеспечении CFX Manager 3.1. Каждый эксперимент проводили не менее чем в трех повторностях.
Дизайн праймеров. Праймеры подбирали с использованием Primer Blast (NCBI, США) по следующим параметрам: размер продукта 50–200 п.н., температура отжига 57°С (табл. 1). Энергетические характеристики пар праймеров проверяли с использованием Oligo Analyzer (idtdna) для исключения образования высокоэнергетических шпилечных конструкций и димеров (более 10 кДж).
Таблица 1.
Праймеры, использованные для оценки экспрессии генов, контролируемых Sp1, методом количественной ПЦР в реальном времени
| Таргетная мРНК | Праймер |
|---|---|
| GAPDH | Sen 5'-GAGCCCGCAGCCTCCCGCT-3' Asen 5'-GCGCCCAATACGACCAAATC-3' |
| Sp1 | Sen 5'-GAAACGCTTCACACGTTCGG-' Asen 5'-GTGCCCACACTCAGAGCTAC-3' |
| CSF1R | Sen 5'-GGTGGCAGGAAGGTGATGTC-3' Asen 5'-ATTGCGAGCTTGGTGTTGTTG-3' |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Мы проанализировали уровень экспрессии Sp1 в клетках различных злокачественных тканей, в том числе ОМЛ и острого лимфобластного лейкоза (ОЛЛ). С этой целью использовали находящиеся в общем доступе данные РНК-секвенирования (GEO ID: GSE9891, GEO ID: gse6891, GEO ID: gse10846, GEO ID gse14333 + gse17538, GEO ID: gse16011, GEO ID: GSE16476, GEO ID: gse34620, GEO ID: GSE43580, GEO ID: GSE63074, GEO ID: GSE2109, GEO ID: gse68790, GEO ID: GSE2109, GEO ID: GSE2109).
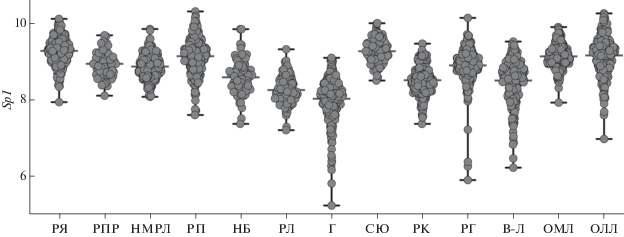
Уровень экспрессии Sp1 в образцах, полученных от пациентов с саркомой Юинга, ОЛЛ, ОМЛ, раком яичников и раком почки значительно выше, чем при других злокачественных заболеваниях (рис. 1). Это может свидетельствовать о тканеспецифичности функции белка Sp1 при злокачественном перерождении клеток гемопоэтической и лимфатичесской системы, а также при саркоме Юинга и раке яичников.
Рис. 1.
Относительная экспрессия гена Sp1 в образцах, полученных от пациентов со злокачественными заболеваниями. РЯ – рак яичников, РПР – рак предстательной железы, НМРЛ – немелкоклеточный рак легкого, РП – рак почки, НБ – нейробластома, РЛ – рак легкого, Г – глиома, СЮ – саркома Юинга, РК – рак кишечника, РГ – рак молочной железы, B-Л – B-клеточная лимфома, ОМЛ – острый миелоидный лейкоз, ОЛЛ – острый лимфобластный лейкоз.
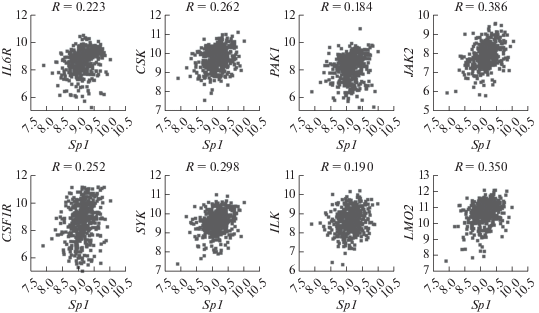
Мы подсчитали коэффициент корреляции Пирсона для уровня экспрессии Sp1 и нескольких генов, высокая экспрессия которых характерна для злокачественных клеток крови. Проведенный нами анализ данных секвенирования РНК образцов ОМЛ (GEO ID: gse6891) показал, что экспрессия гена Sp1 статистически значимо коррелирует с экспрессией генов, кодирующих рецепторы фактора роста макрофагов и IL-6 – CSF1R и IL6R; внутриклеточные киназы (CSK, SYK, PAK1, ILK, JAK2) и фактор транскрипции LMO2 [15] (рис. 2).
Рис. 2.
Экспрессия генов Sp1 (по оси X, lg2) и генов IL6R, CSK, PAK1, JAK2, CSF1R, SYK, ILK, LMO2 (по оси Y, lg2) в образцах ОМЛ, указан коэффициент корреляции Пирсона (R).
Далее мы оценили коэффициент корреляции Спирмена для генов Sp1, JAK2, PAK1, CSK, SYK, CSF1R, IL6R, ILK и JAK2, используя данные секвенирования РНК перевиваемых клеток ОМЛ человека CESS, MV4;11, ML2, Kg1, GDM-1, NCIH1408, THP-1 и HL-60, находящиеся в общем доступе (CAARRAY ID: GSK950). Экспрессия Sp1 коррелирует с экспрессией JAK2, PAK1, CSF1R, SYK и LMO2 (рис. 3).
Рис. 3.
Корреляция между экспрессией SP1 и JAK2, PAK1, CSK, SYK, CSF1R, IL6R в перевиваемых клеточных линиях ОМЛ CESS, MV4;11, ML2, Kg1, GDM-1, NCIH1408, THP-1 и HL-60, величина коэффициента корреляции обозначена цветом. Экспрессия Sp1 (по оси X) и CSK, SYK (по оси Y) в перевиваемых клеточных линиях, треугольником отмечены перевиваемые линии клеток ОМЛ, остальные – клетки другой природы, указан коэффициент корреляции Спирмена (R).
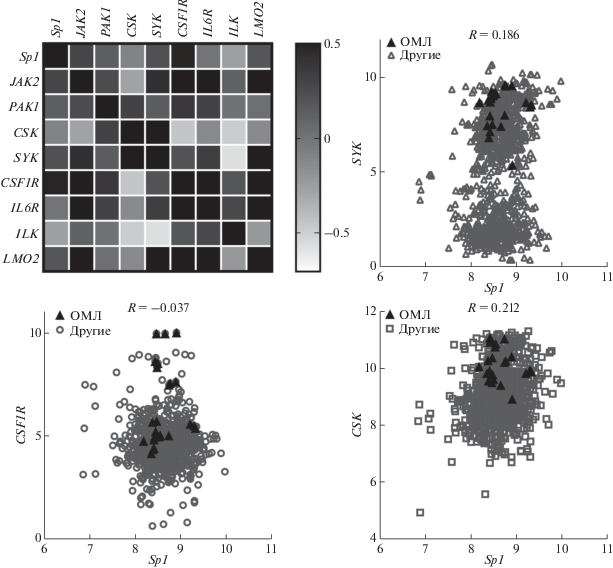
Следует отметить, что корреляция между Sp1 и SYK, а также CSK характерна для всех проанализированных линий перевиваемых злокачественных клеток.
Методом количественной ПЦР в реальном времени мы оценили экспрессию гена Sp1, а также генов PAK1, ILK и СSF1R в клетках трех перевиваемых линий лейкоза человека U937, Kasumi-1 и HL-60 (рис. 4). Наиболее высокий уровень экспрессии Sp1, измеренный по уровню мРНК, характерен для линии Kasumi-1. Кроме того, в этой линии мы обнаружили высокую экспрессию генов PAK1 и CSF1R. В исследованных нами линиях уровни экспрессии генов PAK1, CSF1R и ILK ассоциированы с уровнем экспрессии Sp1, что соответствует данным, полученными при анализе образцов пациентов с ОМЛ.
Рис. 4.
Нормированный уровень экспрессии генов Sp1, CSF1R, CSK, PAK1 в линиях ОМЛ – U937, Kasumi-1 и HL-60. Количество (%) живых клеток U937 (круги), Kasumi-1 (треугольники) и HL-60 (квадраты) на 3-й день после добавления к ним препарата Митрамицина в концентрации 1, 5, 10, 20 и 50 нМ. Указаны значения IC50 Митрамицина для каждой линии клеток (нм).
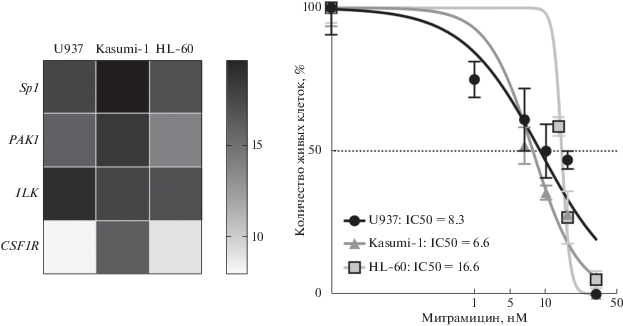
Мы обработали клетки U937, Kasumi-1 и HL-60 Митрамицином в концентрации от 0 до 50 нм (контрольные клетки обрабатывали диметилсульфоксидом), провели подсчет живых клеток на 3 день после добавления к ним препарата и оценили концентрацию Митрамицина, ингибирующую рост клеток на 50% (IC50). Митрамицин ингибирует рост всех исследуемых клеток. Клетки Kasumi-1 наиболее чувствительны к действию Митрамицина. Для клеток Kasumi-1 и U937 концентрация IC50 оказалась меньше 10 нМ, в то время как для клеток HL-60 IC50 превышает 15 нм. Кроме того, низкие концентрации Митрамицина (1 и 5 нМ) активируют рост клеток HL-60.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Возможность использования Sp1 в качестве мишени для терапии злокачественных заболеваний рассматривается довольно давно. Показано, что Митрамицин – антибиотик, конкурентно вытесняющий Sp1 с GC-богатых участков генов, проявляет противоопухолевую активность. Важно отметить, что генетические особенности злокачественных заболеваний, наиболее чувствительных к ингибированию активности Sp1, недостаточно изучены. Поэтому не разработан и эффективный подход к терапии таких заболеваний с использованием Митрамицина.
Наше исследование направлено на изучение роли Sp1 в ОМЛ. Мы выявили высокий уровень экспрессии Sp1 в образцах ОМЛ и ОЛЛ, а также в образцах саркомы Юинга и рака яичников. Вероятно, что Sp1 играет специфичную роль в патогенезе данных заболеваний. Кроме того, мы обнаружили корреляцию между экспрессией Sp1 и таких генов, ассоциированных с лейкозом, как CSF1R и IL6R, CSK, SYK, JAK2, PAK1, ILK и LMO2. На данный момент рецептор фактора роста макрофагов CSF1R, обладающий тирозинкиназной активностью, рассматривают в качестве перспективной мишени для терапии лейкозов [16]. Возможность применения Митрамицина в качестве компонента комбинированной терапии с использованием ингибиторов киназ (CSF1R, SYK, JAK2) требует дальнейшего изучения.
Полученные нами результаты свидетельствуют о существовании взаимосвязи между Sp1 и лейкоз-ассоциированными генами, а также об эффективности Митрамицина в отношении ингибирования роста клеток лейкоза человека, особенно клеток с повышенной экспрессией Sp1, CSF1R и PAK1 in vitro. В перспективе полученные нами данные могут использоваться для разработки эффективной комбинированной терапии ОМЛ. Дальнейшее исследование терапевтической возможности ингибирования Sp1 должно сопровождаться подробным генетическим анализом, направленным на выявление подгрупп ОМЛ, особенно зависимых от активности Sp1.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований: эксперименты по выживаемости клеток выполнены в рамках научного проекта № 19-34-80029; анализ экспрессии генов – в рамках научного проекта № 20-04-00923. Данная работа выполнена с использованием оборудования ЦКП “Геном” ИМБ РАН (http://www.eimb.ru/ru1/ckp/ ccu_genome_c.php).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Horibata S., Gui G., Lack J., DeStefano C.B., Gottesman M.M., Hourigan C.S. (2019) Heterogeneity in refractory acute myeloid leukemia. Proc. Natl. Acad. Sci. USA. 116(21) 10494–10503.
Vagapova E.R., Spirin P.V., Lebedev T.D., Prassolov V.S. (2018) The role of TAL1 in hematopoiesis and leukemogenesis. Acta Naturae. 10(1), 15–23.
Daver N., Schlenk R.F., Russell N.H., Levis M.J. (2019) Targeting FLT3 mutations in AML: review of current knowledge and evidence. Leukemia. 33(2), 299–312.
Pollyea D.A., Amaya M., Strati P., Konopleva M.Y. (2019) Venetoclax for AML: changing the treatment paradigm. Blood Adv. 3(24), 4326–4335.
Lebedev T.D., Vagapova E.R., Popenko V.I., Leonova O.G., Spirin P.V., Prassolov V.S. (2019) Two receptors, two isoforms, two cancers: comprehensive analysis of KIT and TrkA expression in neuroblastoma and acute myeloid leukemia. Front. Oncol. 9, 1046.
Wierstra I. (2008) Sp1: Emerging roles—вeyond constitutive activation of TATA-less housekeeping genes. Biochem. Biophys. Res. Commun. 372(1), 1–13.
Wierstra I., Alves J. (2007) FOXM1c and Sp1 transactivate the P1 and P2 promoters of human c-myc synergistically. Biochem. Biophys. Res. Commun. 352(1), 61–68.
Borja P.F., Collins N.K., Du P., Azizkhan-Clifford J., Mudryj M. (2001) Cyclin A-CDK phosphorylates Sp1 and enhances Sp1-mediated transcription. EMBO J. 20(20), 5737–5747.
Jiang N.Y., Woda B.A., Banner B.F., Whalen G.F., Dresser K.A., Lu D. (2008) Sp1, a new biomarker that identifies a subset of aggressive pancreatic ductal adenocarcinoma. Cancer Epidemiol. Biomarkers Prev. 17(7), 1648–1652.
Lin R.-K., Wu C.Y., Chang J.W., Juan L.J., Hsu H.S., Chen C.Y., Lu Y.Y., Tang Y.A., Yang Y.C., Yang P.C., Wang Y.C. (2010) Dysregulation of p53/Sp1 control leads to DNA methyltransferase-1 overexpression in lung cancer. Cancer Res. 70(14), 5807–5817.
Wang X., Yan Z., Fulciniti M., Li Y., Gkotzamanidou M., Amin S.B., Shah P.K., Zhang Y., Munshi N.C., Li C. (2014) Transcription factor-pathway coexpression analysis reveals cooperation between SP1 and ESR1 on dysregulating cell cycle arrest in non-hyperdiploid multiple myeloma. Leukemia. 28(4) 894–903.
Wang L., Wei D., Huang S., Peng Z., Le X., Wu T.T., Yao J., Ajani J., Xie K. (2003) Transcription factor Sp1 expression is a significant predictor of survival in human gastric cancer. Clin. Cancer Res. 9(17), 6371–6380.
Quarni W., Dutta R., Green R., Katiri S., Patel B., Mohapatra S.S., Mohapatra S. (2019) Mithramycin A inhibits colorectal cancer growth by targeting cancer stem cells. Sci. Rep. 9(1), 15202.
Saha S., Mukherjee S., Mazumdar M., Manna A., Khan P., Adhikary A., Kajal K., Jana D., Sa G., Mukherjee S., Sarkar D.K., Das T. (2015) Mithramycin A sensitizes therapy-resistant breast cancer stem cells toward genotoxic drug doxorubicin. Transl. Res. 165(5), 558–577.
Verhaak R.G., Wouters B.J., Erpelinck C.A., Abbas S., Beverloo H.B., Lugthart S., Löwenberg B., Delwel R., Valk P.J. (2009) Prediction of molecular subtypes in acute myeloid leukemia based on gene expression profiling. Haematologica. 94(1), 131–134.
Edwards D.K. 5th, Watanabe-Smith K., Rofelty A., Damnernsawad A., Laderas T., Lamble A., Lind E.F., Kaempf A., Mori M., Rosenberg M., d’Almeida A., Long N., Agarwal A., Sweeney D.T., Loriaux M., McWeeney S.K., Tyner J.W. (2019) CSF1R inhibitors exhibit antitumor activity in acute myeloid leukemia by blocking paracrine signals from support cells. Blood. 133(6), 588–599.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


